Incidencia de Rhizoctonia spp , Sclerotium rolfsii y Macrophomina phaseolina en frijol común en Villa Clara Bases para el manejo integrado
Texto completo
(2) UNIVERSIDAD CENTRAL “MARTA ABREU” DE LAS VILLAS FACULTAD DE CIENCIAS AGROPECUARIAS DEPARTAMENTO DE AGRONOMÍA. INCIDENCIA DE Rhizoctonia spp., Sclerotium rolfsii Y Macrophomina phaseolina EN FRIJOL COMÚN EN VILLA CLARA. BASES PARA EL MANEJO INTEGRADO. Tesis presentada en opción al grado científico de Doctor en Ciencias Agrícolas. Autor. Ing. Manuel Díaz Castellanos, M. Sc. Tutor. Prof. Tit., Ing. Lidcay Herrera Isla, Dr. Cs. Consultante. Ing. Reinaldo Quiñones Ramos, M. Sc.. Santa Clara 2011.
(3) Todo hombre debe decidir una vez en la vida, si se lanza a triunfar arriesgándolo todo; o se sienta en su balcón tranquilamente, a contemplar el desfile de los triunfadores.. Anónimo.
(4) Agradecimientos Hace mucho tiempo una frase llamó mi atención "La gratitud es la memoria del corazón". Quiero, por tanto, expresar mi agradecimiento a todas aquellas personas que de alguna forma influyeron en la realización y culminación de este proyecto. A mi tutor Dr. Cs. Lidcay Herrera Isla, por su contribución a mi formación profesional y personal. A la Doctora Maryluz Folgueiras, por su paciencia y contribución a la mejora del documento. Al Doctor Michel Leiva Mora, por su contribución, incondicionalmente, a la mejora del documento y de mi formación. A la Doctora Yaquelyn Nerey, la que tardía pero segura, hizo suya esta tesis. Al administrador José Paz, por su preocupación constante por el desarrollo del trabajo. A los que me ofrecieron su apoyo incondicional: Dr. C. Orlando Saucedo, Marlén Cárdenas, Gudelia Rodríguez, Dr. C. Edilberto Pozo. A Guillermo, Guinia, César, jefes de las fincas, y trabajadores donde se desarrollaron los experimentos de campo. A los especialistas René Cupull, Rafael Jiménez Carrazana y Angel Mollineda por sus contribuciones a mi formación profesional. A Marianela Sibat, del Centro de Documentación de la FCA. Al Máster Rafael Sosa, por sus lanzamientos indescifrables. Al Máster Ray Espinosa por ayudarme a descifrar esos lanzamientos. A los estudiantes y maestrantes que colaboraron con sus investigaciones a la realización de este trabajo: Clara Elena Fajardo, Inocencio Martínez, Yanet Reinaldo, Máximo Delgado, Yosbel Hernández, César Fernández, Aynel Egües, Maikel Yánder Fernández Cancio, Eduán Valdés e Idania Tirado.. Abreu,. Minelys González,.
(5) A la Licenciada Milagros Al Dr. C. Luis A. Barranco y a Carmen Mendoza, del Vicedecanato de Investigaciones y Postgrado A la Dirección de la Facultad de Ciencias Agropecuarias A mis compañeros del Departamento de Agronomia A mis amigos, que simpre estuvieron al tanto de la marcha del proceso, Raul Collado, Ojito y Yuniel. Y por último, un agradecimiento especial a mi familia, por su comprensión y apoyo..
(6) A Yía "El Dulcero" y Mariana "La Costurera" dondequiera que estén A Claudia.
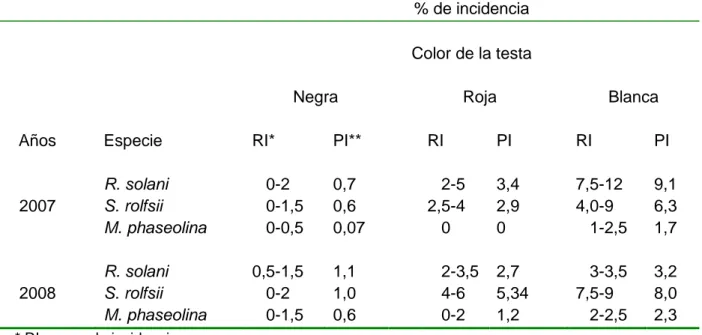
(7) SÍNTESIS. Con los objetivos de identificar los hongos patógenos del suelo involucrados en la pudrición de raíces y tallos del frijol común (Phaseolus vulgaris), así como determinar el efecto de la composición varietal, el tipo de suelo, la fertilización y el tratamiento de semillas con bacterias antagonistas y Quitosana sobre la incidencia de estos hongos, se condujeron varios experimentos en el período comprendido entre enero del año 2007 hasta mayo de 2011. Rhizoctonia spp., S. rolfsii y M. phaseolina fueron las especies que incidieron sobre el frijol y su porcentaje de incidencia estuvo relacionada con el color de las semillas. Las variedades más afectadas fueron las que tenían semillas de testa blanca, a estas le siguieron las rojas y, finalmente las menos afectadas fueron las negras. Los análisis de la composición química de la testa de la semilla mostraron diferencias significativas en cuanto al contenido de compuestos fenólicos entre las semillas blancas, rojas y negras. Estas últimas contenían la mayor cantidad de fenoles. El recubrimiento de las semillas con Rhizobium phaseoli y micorrizas, así como la aplicación de compost en el fondo del surco y el empleo de bacterias antagonistas y quitosana redujeron las afectaciones por hongos del suelo e incrementaron el rendimiento del cultivo. M. phaseolina se asoció más a los suelos Ferralíticos. El manejo de la variedad, el uso de productos orgánicos y biofertilizantes, así como el empleo de organismos antagonistas y sustancias elicitoras en el tratamiento a la semilla, son una alternativa para reducir las afectaciones por hongos del suelo en el frijol común, o en otros cultivos donde estos organismos causan afectaciones..
(8) Tabla de contenidos 1. INTRODUCCIÓN ...............................................................................................................................1 2. REVISIÓN BIBLIOGRÁFICA. .........................................................................................................5 2.1. Rhizoctonia solani Kühn ........................................................................................................7 2.2. Sclerotium rolfsii Sacc ..........................................................................................................11 2.3. Macrophomina phaseolina (Tassi.) Goid. .......................................................................13 2.4. Métodos de lucha. ..................................................................................................................15 2.4.1. Control cultural ................................................................................................................16 2.4.1.1. Enmiendas orgánicas ............................................................................................16 2.4.1.2. Rotación de cultivos. ..............................................................................................16 2.4. 1.3. Labores agrotécnicas ............................................................................................17 2.4.1. 4. Resistencia varietal ................................................................................................18 2.4.2. Control químico ....................................................................................................................18 2.4.3. Solarización .....................................................................................................................19 2.4.4. Control biológico.............................................................................................................19 2.4.5. Control con sustancias naturales .........................................................................................21 2.4.6. Control Integral ....................................................................................................................22 3. MATERIALES Y MÉTODOS .........................................................................................................25 3.1. Aislamiento, identificación y patogenicidad de hongos del suelo causantes de enfermedades en frijol común ....................................................................................................25 3.1.1. Aislamiento, identificación y agresividad de Rhizoctonia spp. ..........................25 3.1.2. Aislamiento, identificación y patogenicidad de Sclerotium rolfsii Sacc..........30 3.1.3. Aislamiento, patogenicidad y agresividad de aislados de Macrophomina phaseolina (Tassi) Goid............................................................................................................31 3.2. Incidencia de enfermedades causadas por hongos fitopatógenos del suelo sobre variedades de frijol ........................................................................................................................33.
(9) 3.2.1. Caracteres de la testa de la semilla asociados a la resistencia del frijol común a hongos fitopatógenos del suelo ...........................................................................35 3.2.1.1. Ensayos biológicos .................................................................................................36 3.2.1.2. Tamizaje fitoquímico ...............................................................................................37 3.2.1.3. Cuantificación de compuestos fenólicos en extractos acuosos obtenidos de testas de variedades de frijol común ..........................................................................37 3.3. Incidencia de enfermedades causadas por hongos fitopatógenos del suelo sobre frijol común en dos tipos de suelo. ...........................................................................................38 3.4. Efecto de la fertilización sobre la incidencia de hongos fitopatógenos del suelo en frijol común ................................................................................................................................38 3.4.1. Influencia de la fertilización sobre el rendimiento agrícola .................................40 3.5. Incidencia de hongos del suelo sobre plantas de frijol provenientes de semillas tratadas con bacterias antagonistas y Quitosana .................................................................41 3.5.1. Efecto de los tratamientos sobre el rendimiento agrícola y sus componentes. .........................................................................................................................................................42 3.5.2. Efecto in vitro de Burkholderia cepacia, Bacillus subtilis, Pseudomonas aeruginosa y Pseudomonas fluorescens sobre hongos del suelo patógenos al frijol ................................................................................................................................................42 3.5.2.1 Difusión en agar ........................................................................................................42 3.5.2.2 Determinación de la presencia de metabolitos volátiles con actividad antifúngica ...............................................................................................................................43 3.6. Efecto in vivo del tratamiento a la semilla con bacterias antagonistas y Quitosana sobre la severidad de la enfermedad causada por hongos del suelo patógenos al frijol ..........................................................................................................................44 3.7. Análisis de los suelos ...........................................................................................................45 3.7.1. Análisis químico....................................................................................................................46 3.7.2. Análisis físico ........................................................................................................................46 3.7.3. Análisis microbiológico del Suelo ........................................................................................47 3.8. Variables climatológicas ......................................................................................................47 4. RESULTADOS Y DISCUSIÓN ......................................................................................................49.
(10) 4.1. Aislamiento, identificación y patogenicidad (agresividad) de hongos del suelo causantes de enfermedades en frijol común..........................................................................49 4.1.1 Aislamiento, identificación y agresividad de Rhizoctonia spp. ...........................49 4.1.2. Aislamiento, identificación y patogenicidad de Sclerotium rolfsii Sacc..........53 4.1.3. Aislamiento, patogenicidad y agresividad de aislados de Macrophomina phaseolina (Tassi) Goid............................................................................................................55 4.2. Incidencia de enfermedades causadas por hongos fitopatógenos del suelo sobre variedades de frijol ........................................................................................................................58 4.2.1. Caracteres químicos de la testa de la semilla de frijol común asociados a la resistencia a hongos fitopatógenos del suelo. ..................................................................64 4.2.1.1. Ensayos biológicos .................................................................................................64 4.2.1.2. Tamizaje fitoquímico ...............................................................................................64 4.2.1.3. Cuantificación de compuestos fenólicos en extractos acuosos obtenidos de testas de variedades de frijol común. .........................................................................65 4.3. Incidencia de enfermedades causadas por hongos fitopatógenos del suelo sobre frijol común en dos tipos de suelos..........................................................................................67 4.4. Efecto de la fertilización sobre la incidencia de hongos fitopatógenos del suelo en frijol común ................................................................................................................................70 4.4.1. Influencia de la fertilización sobre el rendimiento agrícola .................................74 4.5. Incidencia de hongos del suelo sobre plantas de frijol provenientes de semillas tratadas con bacterias antagonistas y Quitosana .................................................................75 4.5.1. Influencia de bacterias antagonistas y Quitosana sobre el rendimiento. .......79 4.5.2. Efecto in vitro de Burkholderia cepacia, Bacillus subtilis, Pseudomonas aeruginosa y Pseudomonas fluorescens sobre hongos del suelo patógenos al frijol. ...............................................................................................................................................81 4.5.2.1. Difusión en agar ......................................................................................................81 4.5.2.2. Determinación de la producción de metabolitos volátiles con actividad antifúngica ...............................................................................................................................81 4.5.3. Efecto in vivo del tratamiento a la semilla con bacterias antagonistas y quitosana sobre la severidad de la enfermedad causada por hongos del suelo patógenos al frijol ......................................................................................................................83.
(11) 5. CONCLUSIONES ............................................................................................................................93 6. RECOMENDACIONES ...................................................................................................................95 7. REFERENCIAS BIBLIOGRÁFICAS ............................................................................................96 ANEXOS ..............................................................................................................................................136.
(12) 1. INTRODUCCIÓN El frijol común (Phaseolus vulgaris L.) está ubicado entre los cinco cultivos con mayor superficie dedicada a la agricultura en los países latinoamericanos (Peña-Cabriales, 2002) y es el tercero en importancia después del frijol de soya (Glycine max (L.) Merr.) y el cacahuate (Arachis hypogea L.) (Lin, 2008). En el mundo se siembran cerca de 25 millones de hectáreas con un rendimiento promedio de 0,7 t ha-1 y los principales productores son India, Brasil, China, EE.UU. y México, quienes contribuyen con el 57,8 % de la producción mundial (Cabral, 2006). En muchos países de América Latina el frijol es la principal fuente de proteínas para la población (Guzmán-Maldonado et al. 2000). Por otro lado, se ha demostrado que el frijol contiene además, gran cantidad de compuestos nutracéuticos tales como fibras, inhibidores de proteasa, acido fítico, polifenoles y taninos (Espinosa et al., 2006). En Cuba, se cultiva a lo largo y ancho del país y alcanza un área de 112 702 ha aproximadamente, incluyendo el sector estatal (6 353 ha) y no estatal (106 349 ha), con rendimientos de 0,57 y 0,72 t ha-1, respectivamente. Se destacan las provincias de Villa Clara, Holguín y La Habana (ONE, 2010). En la dieta del cubano, los frijoles secos representan una de las principales fuentes de proteína y calorías, con una dependencia del cultivo superior al 50 % (ONE, 2007). La producción nacional no cubre las necesidades del consumo por lo que es necesario importar alrededor de 110 000 toneladas por año (Faure, 2003), equivalentes a 48 millones de dólares (FAO, 2004). Estas cifras dan una idea de la necesidad de explotar todos los recursos posibles para incrementar los niveles de 1.
(13) producción actuales si se quiere mantener los índices de consumo establecidos, sin incrementar excesivamente las importaciones. Urge entonces aumentar los rendimientos del cultivo, cuyo potencial puede alcanzar 5 t/ha bajo condiciones de fertilidad (CIAT, 2000), dada esta diferencia por las deficiencias nutricionales y la incidencia de plagas y enfermedades. En muchos lugares donde se cultiva el frijol común, las enfermedades son el factor más importante en la reducción de los rendimientos. Entre los organismos causantes se encuentran los hongos del suelo, existiendo en nuestro país, condiciones favorables para el desarrollo de esos organismos. Se destacan entre las especies más importantes Rhizoctonia spp., Sclerotium rolfsii Sacc. y Macrophomina phaseolina Tassi (Goid.), los que pueden ocasionar pérdidas en el rendimiento del cultivo del orden del 90 % en América Latina (CIAT, 1988) y entre 25 y 50 % en Cuba (González, 1988). En Villa Clara, en el 2005 y 2006 la presencia de M. phaseolina en las semillas fue la causa de la descalificación de seis toneladas de frijol común y tres toneladas de habichuela, a utilizar como material de siembra (González, 2007). Para el control de estos microorganismos se han empleado métodos que incluyen el control cultural, resistencia varietal, control químico, solarización, control biológico, entre otros. Estos métodos tienen sus inconvenientes específicos, por lo que las tendencias actuales se inclinan por un manejo integrado de los mismos (Folch et al., 1997). Numerosos estudios se han desarrollado en nuestro país sobre la bioecología y control de especies de hongos fitopatógenos que habitan en el suelo (González, 2.
(14) 1988; Martín, 2001; Herrera, 2004). Sin embargo, en la actualidad estas enfermedades constituyen una causa importante de bajos rendimientos en los cultivos, por lo que se hace necesario ampliar los estudios y utilizar e incluir alternativas que reduzcan las pérdidas y contribuyan a las sostenibilidad de nuestras producciones agropecuarias.. Hipótesis El manejo de la variedad, el tipo de suelo y la fertilización, así como el empleo de microorganismos antagonistas y sustancias naturales para la protección de las semillas, reducirán la incidencia de enfermedades causadas por hongos del suelo patógenos al frijol común y con ello se contribuirá al aumento de los rendimientos agrícolas de este cultivo.. Objetivo general Evaluar el efecto de la composición varietal, el tipo de suelo, la fertilización y el tratamiento a las semillas con Quitosana y bacterias antagonistas y promotoras del crecimiento sobre la incidencia de enfermedades causadas por hongos del suelo patógenos al frijol común.. Objetivos específicos: 1. Identificar y determinar la incidencia de los hongos del suelo patógenos al frijol común.. 3.
(15) 2. Relacionar la incidencia de los principales agentes patógenos con las variedades (color de la testa) y el tipo de suelo. 3. Evaluar el efecto de la fertilización sobre la incidencia de hongos fitopatógenos del suelo y el rendimiento en el frijol común. 4. Evaluar el efecto del tratamiento a la semilla con Quitosana y bacterias antagonistas y promotoras del crecimiento, sobre la incidencia de hongos fitopatógenos del suelo y el rendimiento en el frijol común.. 4.
(16) 2. REVISIÓN BIBLIOGRÁFICA. El frijol común (Phaseolus vulgaris L.) es la leguminosa comestible más importante en el mundo, cultivada en muchos países, especialmente en América Latina y África; siendo una fuente importante de proteínas. Sin embargo, los rendimientos actuales son bajos, no sobrepasando en muchos casos el 20 % del rendimiento máximo del cultivo (Chailloux et al. 1996). En muchos lugares donde se cultiva el frijol, las enfermedades son el factor más importante en la reducción de los rendimientos (Opio y Senguoba, 1991), encontrándose entre los organismos causantes los hongos del suelo. En Latinoamérica, el Centro Internacional de Agricultura Tropical (CIAT) de Colombia destaca que el cultivo es atacado por numerosos organismos fitopatógenos. La incidencia y daño ocasionado varían significativamente entre estaciones, de un año a otro, y entre localidades, por lo que es imposible obtener información para clasificarlas en orden de prioridad. Entre las enfermedades fúngicas más importantes del cultivo reportan la roya, Uromyces phaseoli var. typica Arthur, la antracnosis, Colletotrichum lindemuthianum Sacc. & Magnus (Glomerella cingulata (Stoneman) Spauld. & H. Schrenk) y las pudriciones radicales: Rhizoctonia solani Kühn, Fusarium spp. Sclerotium rolfsii Sacc. (Athelia rolfsii (Curzi) C.C. Tu & Kimbr.) y Thielaviosis bassicola (Berk y Br.) Ferr. causantes de pérdidas que pueden alcanzar el ciento por ciento del cultivo (CIAT, 1988). Mayea et al. (1983) destacaron entre las principales enfermedades del frijol en Cuba al tizón común (Xanthomonas campestris pv. phaseoli (Smith)), Antracnosis 5.
(17) (Colletotrichum lindemuthianum), la Roya (Uromyces phaseoli typica.), Mancha angular (Isariopsis griseola Sacc.), Tizón ceniciento del tallo (Macrophomina phaseolina Tassi. (Goid.)), la Pudrición del tallo (Rhizoctonia solani) y la marchitez por Sclerotium (S. rolfsii) Un amplio estudio sobre las enfermedades fúngicas que afectan al frijol común en Cuba fue realizado por González (1988) quien refirió que la importancia de las enfermedades en el cultivo está determinada por las características que las mismas presentan bajo nuestras condiciones, los factores climáticos que prevalecen en cada época de siembra, así como las características de los microclimas existentes en cada región donde se cultiva el frijol común y las resumió en orden de importancia y frecuencia, en las regiones oriental, central y occidental del país, destacándose la roya, Uromyces phaseoli y las pudriciones radicales y del tallo, Rhizoctonia solani Sclerotium rolfsii. y Macrophomina phaseolina. Estudios realizados en la región central del país por Martin (2001) abordaron aspectos bioecológicos y de control de S. rolfsii, especie fitopatógena presente en numerosos cultivos de la región y en diferentes suelos. Investigaciones durante más de 25 años sobre los principales hongos fitopatógenos que viven en el suelo, fueron realizadas por Herrera (2004), las cuales trataron aspectos sobre la bioecología y control de especies de los géneros Ceratocystis Ellis & Halst, Fusarium Link 1809, Macrophomina Petr., Rhizoctonia DC, Sclerotium Tode y Thanatephorus. En la actualidad las pudriciones radicales continúan entre las enfermedades que mayores pérdidas causan en el cultivo. Entre los agentes causales se destacan 6.
(18) Rhizoctonia solani, Sclerotium rolfsii. y Macrophomina phaseolina, los cuales pueden ocasionar pérdidas en el rendimiento entre un 25 y un 50 % (González, 1988). 2.1. Rhizoctonia solani Kühn Este hongo se clasifica dentro de la Clase Deuteromycetes u hongos imperfectos, Orden Mycelia sterilia. En su etapa perfecta se corresponde con Thanatephorus cucumeris (A. B. Frank) Donk, Familia Ceratobasidiaceae, Orden Cantharellales, Subclase Incertae sedis, Clase Agaricomycetes, División Basidiomycota, Reino Fungi (Index Fungorum, 2008). Rhizoctonia solani es el agente causal de la rizoctoniosis, también conocida en muchos lugares como chancro del cuello, tallo hueco, damping off o marchitez de las posturas, pudriciones del tallo y órganos subterráneos, en numerosas plantas cultivadas y silvestres. El hongo presenta amplia distribución mundial siendo reportado en numerosos países. Este hongo afecta mucho más las plántulas jóvenes que el tejido de las plantas adultas, causando la enfermedad conocida como damping off o marchitez de las posturas. Por lo general la enfermedad se encuentra localizada y en sus últimas fases dentro de las parcelas pueden observarse fácilmente, pequeños parches en los que han muerto las plantas. Los síntomas aéreos no sirven para diferenciar la enfermedad en el campo (González, 1988). Mayea et al. (1983) señalan que en plantas pequeñas aparecen en el tallo e hipocotilo úlceras de color pardo-rojizo, de varios tamaños, delimitadas usualmente por un borde oscuro, las que luego se vuelven ásperas, se secan y destruyen la médula. El hongo ataca además las raíces, 7.
(19) causando pudriciones en la base de la planta (González, 1988). El micelio es ramificado y tabicado, uniformemente distribuido por la superficie del hospedero, aunque a veces se aglomera y forma cordones visibles macroscópicamente. En los cordones de mayor espesor se forman los esclerocios de color pardo intenso. Son de forma aplastada y redondeada, cubiertos por un fieltro espeso y aterciopelado. Aunque se ha informado sobre la aparición de los esclerocios en las lesiones, éstos no son siempre fáciles de ver, contrario a lo que ocurre con S. rolfsii, el cual es fácil de diagnosticar por la presencia de abundantes esclerocios de color crema a pardo oscuro. Los esclerocios de R. solani tienen coloración mucho más oscura, siendo ambas enfermedades fáciles de diferenciar. Las hifas jóvenes presentan una coloración pardo amarilla a pardo oscura. Sus ramificaciones aparecen en ángulo recto, con un tabique a una distancia no menor de 10 nm del punto de inserción. Según Pichardo (1990) aislados de R. solani difieren en patogenicidad y morfología, así como en características culturales y fisiológicas. No es una especie única, sino una colección de poblaciones que da origen al concepto de Grupo Anastomosis (AG) en el cual se agrupan organismos de la misma especie que pueden entrecruzar sus hifas. González (2008a) señala que R. solani es la especie más estudiada dentro del complejo Rhizoctonia. Se encuentra dividida en 14 grupos de anastomosis (AG) que se subdividen en grupos según caracteres morfológicos, bioquímicos y moleculares. Puede afectar a más de 500 especies de plantas superiores y provocar damping off en posturas, lesiones necróticas en raíces y semillas y tallos, además de lesiones foliares. Refiere además, que hasta mediados de 1980, la clasificación se basó en. 8.
(20) caracteres morfológicos, número de núcleos por célula vegetativa, patogenicidad y anastomosis hifal. Este último es el criterio más usado hasta la fecha. Los enfoques recientes para caracterizar los distintos aislamientos incorporan caracteres que se obtienen a través de técnicas moleculares como hibridización de ADN, el polimorfismo de la longitud de los fragmentos de restricción y la secuenciación directa de genes, entre otros (Carling y Kuninaga, 1990; Vilgalys y González, 1990; Cubeta et al., 1996). El hongo, según Pupo y Heredia (1998) se transmite, además, por las semillas infectadas. Según Finch y Finch (1987) la penetración del hongo en el hospedero es directa, formando agregados hifales (cojines de infección) en las raíces, que más tarde ocasionan la decoloración y muerte de las mismas, con la siguiente penetración. Cuando la hifa de Rhizoctonia se pone en contacto con la superficie externa del hospedante se produce un fenómeno de reconocimiento que origina un aumento de la ramificación micelial y formación de estructuras. de infección. (apresorios) o ramas hifales en forma de T, las cuales forman lo que se conoce como cojines de infección, que le permite al hongo penetrar al tejido vegetal intacto (cutícula y epidermis). En el transcurso del proceso infeccioso se produce un intercambio de sustancias entre la planta (exudados vegetales) y el hongo (enzimas extracelulares). Después de la formación de los cojines de infección, ocurre la penetración cuticular o estomática, esta última es muy rara, aunque se ha informado solo para el AG I. Posteriormente ocurre la colonización. de los tejidos con la. producción de enzimas hidrolíticas que degradan las paredes celulares. Se ha. 9.
(21) demostrado que miembros del AG4 producen enzimas pectinolíticas y celulolíticas. Esto ocurre preferentemente en suelos húmedos, pudiendo ser destruidas muchas plantas jóvenes. Según Llacer (1996) los propágulos de esta especie son orientados por los exudados radicales de sus hospedantes y entre las sustancias que estimulan su orientación se encuentran aldehidos y policetoles. Las plantas más viejas pueden ser atacadas, pero sobre éstas la invasión del hongo se limita al tejido externo cortical, sobre el cual el hongo produce alargadas quemaduras y lesiones rojizas. Según Mayea y Padrón (1983) una parte de su ciclo lo pasa saprofíticamente sobre las partículas orgánicas del suelo o formando micorrizas, hasta que por determinados factores se vuelve perjudicial para los semilleros provocando pudriciones y otros trastornos. Herrera (2004) señala que la actividad saprofítica de R. solani permanece inalterable durante los primeros 6 meses de establecerse en el suelo, mientras que a partir de este período la supervivencia decrece a 25 cm de profundidad hasta un 60 % y a 15 cm a 90 %, manteniéndose el 100 % en la superficie del suelo, lo que evidencia que la actividad saprofítica del patógeno disminuye a medida que aumenta la profundidad. El efecto de la temperatura ha sido estudiado por numerosos investigadores. Allison (1952) y Sherwood (1969) encontraron que el rango óptimo de temperatura es de 25 a 30 ºC En cuanto al pH se ha reportado que el género Rhizoctonia presenta un crecimiento limitado a valores que oscilan entre 2,3 y 3,8 y que el valor óptimo varía de 4,5 a 7, estando los límites máximos entre 6,7 y 9. La humedad del suelo constituye un factor determinante para la actividad biológica de Rhizoctonia solani. El. 10.
(22) hongo es capaz de sobrevivir durante muchos años tanto en períodos de humedad como de sequía. 2.2. Sclerotium rolfsii Sacc Desde que en 1892, Rolfs reportó y describió por primera vez en el sur de la Florida a Sclerotium rolfsii Sacc. causando la enfermedad conocida como Tizón del Sur, en el cultivo del tomate (Solanum esculentum Mill.), muchos estudios se han desarrollado sobre esta importante especie. A pesar de ello, el organismo continúa causando problemas en numerosos cultivos, principalmente en regiones tropicales y subtropicales.. El hongo se clasifica dentro de la Clase Deuteromycetes u hongos imperfectos, Orden Mycelia Sterilia. Presenta como telemorfo un basidiomiceto denominado primeramente Corticium rolfsii Curzi, después Pellicularia rolfsii (Curzi) West y actualmente conocida como Athelia rolfsii (Curzi) C.C. Tu y Kimbrough (Domsch et al, 1980), Familia Atheliaceae, Orden Atheliales, Subclase Agaricomycetidae, Clase Agaricomycetes, División Basidiomycota, Reino Fungi (Index fungorum, 2008). En cuanto a los hospederos Díaz y Castro (2005) plantean que el hongo afecta más de 200 géneros de plantas. Arnold (1986) reporta entre las principales especies hospedantes del organismo patógeno a Ipomoea batatas (L.) Lam., Solanum tuberosum L., Phaseolus vulgaris L. y Helianthus annus L., entre otras.. El hongo ataca las posturas en los semilleros durante la germinación de las semillas o posteriormente, causando lesiones en la base de los hipocotilos de las plántulas, caracterizada por hundimiento, ablandamiento y decoloración de la corteza, 11.
(23) justamente en la línea del suelo, donde aparece una mancha oscura en la base del tallo, que aumenta hasta que se forma un anillo a su alrededor. Cuando llega a esta fase, la planta queda tan debilitada en la base del tallo que termina por caer. Los síntomas de la parte aérea son: clorosis, lenta defoliación y marchitez permanente. En las partes subterráneas la infección también progresa y causa separación de la corteza de los tejidos de la raíz (González, 1988). Sobre los tallos afectados se forma una capa de micelio extramatrical, dentro del cual se forman los esclerocios del hongo, de tamaño pequeño, 859 µm los redondos y 852-976 µm los ovoides, inicialmente blancos y posteriormente pardo oscuros (Mayea y Padrón, 1983). Los síntomas y signos del patógeno facilitan bastante la identificación de la enfermedad en el campo. Sclerotium presenta micelio compuesto por hifas tabicadas y finas, de paredes delgadas que se integran en cordones. Las células del micelio son variables, entre 150-250 µm de largo por 2-9 µm de ancho, con uniones características en forma de hebilla, las cuales tienen gran valor en la identificación de este hongo (González, 1988). El organismo puede transmitirse por semilla (Pupo y Heredia, 1998), así como mediante esclerocios y micelio transportado por semillas agámicas de diferentes cultivos, suelo, restos de cosecha, implementos agrícolas, y por el hombre mismo (González, 1988). Según Beaute y Rodríguez-Kabana (1981) los esclerocios pueden sobrevivir en el suelo de 2 a 5 años, lo cual dificulta las prácticas de rotación de cultivo para su control, resaltando que alta humedad y temperatura mayor de 20 ºC disminuyen su supervivencia. Con relación al efecto de la temperatura Herrera (2004) destaca que para Sclerotium rolfsii coinciden las temperaturas para el 12.
(24) crecimiento del micelio con las de la infección (28-34 grados). El efecto del pH ha sido estudiado por numerosos autores, Punja (1985) reportó que S. rolfsii crece mejor en pH en el rango de 2 a 7, siendo el óptimo entre 4 a 5. Urquijo et al. (1971) encontraron que S. rolfsii crece mejor en suelos ácidos y Herrera (2004) no encontró formación de esclerocios a pH entre 7 y 8. Otro factor ambiental importante en el desarrollo y patogenicidad de S. rolfsii es la humedad del suelo. Según Herrera (2004) el micelio de S. rolfsii en condiciones de alta humedad se reduce en viabilidad a partir de los 7 días. Estos resultados coinciden con los encontrados por Beaute y Rodríguez-Kabana (1981) quienes observaron que el micelio desapareció rápidamente en presencia de alta humedad. En suelo seco la supervivencia del micelio fue de 100 % hasta los 35 días, disminuyendo a un 80 % a los 49 días. En condiciones naturales del suelo no hubo cambios hasta los 35 días, sólo a los 49 días se notó una caída de la supervivencia debido a las fuertes precipitaciones. La tendencia de germinación de los esclerocios durante los 49 días de sobresaturación del suelo estuvo entre 60-80 % hasta los 35 días, a partir de donde disminuyó a cero (Herrera, 2004). Beute y Rodríguez-Kabana (1981) señalaron que bajo un régimen de alta humedad del suelo la supervivencia de los esclerocios fue significativamente más baja cuando las temperaturas se mantuvieron por encima de los 20 ºC. 2.3. Macrophomina phaseolina (Tassi.) Goid. Este organismo es considerado, según Hall (1991), un gran problema en el sur de los Estados Unidos, el Caribe, América Central y Suramérica, provocando grandes pérdidas en diferentes cultivos, entre los que se destaca el frijol común. 13.
(25) El hongo está ubicado taxonómicamente en la Familia Botryosphaeriaceae, Orden Botryosphaeriales, Subclase Incertae sedis, Clase Dothideomycetes, División Ascomycota, Reino Fungi. (Index Fungorum, 2008). Macrophomina phaseolina presenta una fase esclerocial (Micelia Sterilia) Rhizoctonia bataticola (Taub.) Buttler, la cual consiste en micelio y microesclerocios (esclerocios negros) de forma esférica e irregular, los cuales se desarrollan con facilidad en medios de cultivo. La fase picnidial, con la formación de picnidios negros, ostiolados y globosos se desarrolla sólo en medios de cultivos especiales. En la naturaleza se forma sólo en algunos hospederos y en ciertas condiciones. Las picnidiosporas son ovaladas, hialinas, sin septas (Díaz, 1990). El hongo ataca la raíz y tallo de las especies hospedantes mediante las picnidiosporas y microesclerocios que sobreviven en el suelo y constituyen el inóculo primario. La penetración al tejido se produce directamente mediante apresorios y lo invade extra e intracelularmente, además, el organismo patógeno produce enzimas pectinolíticas y toxinas de importancia para la patogénesis. Las plantas de frijol son atacadas en todos los estados. En semilleros produce damping off pre y postemergente con una reducción del vigor de las plantas. El hongo causa clorosis, defoliación prematura, maduración temprana, achaparramiento y muerte de la planta (Olaya y Abawi, 1993). Frecuentemente afecta los hipocotilos y produce manchas oscuras hundidas tan pronto como los mismos emergen del suelo. Los cotiledones de las semillas portadoras de la enfermedad aparecen manchados de color pardo oscuro a pardo violáceo, en las hojas y tallos de las plantas adultas se puede. 14.
(26) observar necrosis acompañada de las fructificaciones del hongo (Tarakanta et al., 2005). Souza et al. (1980) plantean que M. phaseolina es el hongo más frecuente en el cultivo del frijol, con una reducción acentuada de la germinación causando la muerte de hasta el 70 % de las plántulas. Las infecciones pueden provenir de semillas infectadas (Pupo y Heredia, 1998). El hongo sobrevive en el suelo en formas de esclerocios, la primera fuente de inóculo, los que son formados en el tejido del hospedante y aportados al suelo cuando el cultivo muere. Los microesclerocios viables han mostrado persistencia en el suelo de 3 meses a 7 años. Olaya y Abawi (1996) señalan que altas temperaturas y estrés hídrico incrementan la susceptibilidad del hospedero y reducen la actividad de los antagonistas del hongo. Banerje et al. (1985) señalan que altos regímenes de humedad estimularon la acción lítica del micelio. La población decrece (85 %) a una humedad de saturación después de 180 días. Dhingra (1985) plantea que a 60 % de humedad de capacidad de campo la población se reduce de 96 – 99 %. La producción de esclerocios fue estimulada por la baja humedad de suelo. La presencia de residuos de cultivo permite la colonización y sobrevivencia del patógeno hasta 70 % de la capacidad de campo. 2.4. Métodos de lucha. Los métodos de lucha contra las enfermedades provocadas por hongos del suelo se distinguen de los empleados contra otros organismos patógenos foliares. La integración de prácticas culturales como el enmendado del suelo con materia. 15.
(27) orgánica, la rotación de cultivos, el control químico, el control biológico y el manejo del riego son entre otros, factores a tener en cuenta para el control de las mismas. 2.4.1. Control cultural 2.4.1.1. Enmiendas orgánicas Se ha demostrado que la mayor influencia de la materia orgánica sobre los patógenos radicales es a través de modificaciones de las actividades microbianas. El control de éstos se produce por inacción o lisis de los esclerocios o hifas, directamente o seguido de un corto período de estimulación del crecimiento. La adición de materia orgánica mejora el vigor de las plantas e incrementa la resistencia de la mismas al ataque de organismos patógenos (Lampkin, 1999). Aplicaciones de materia orgánica redujeron las afectaciones de M. phaseolina en maní en un 32 % comparado con las plantas no tratadas (Harinat y Subbarami, 1996). Morales et al. (2007) encontraron una reducción de la enfermedad causada por S. rolfsii con el empleo de estiércol líquido de cerdos. Los autores explican este efecto debido al incremento de la actividad microbiana, concentracion de amonio y niveles de Zinc y Cobre en el suelo, coincidiendo con Blum y Rodríguez-Kábana (2004) al emplear enmiendas con Mucuna deeringiana, Pueraria lobata, y corteza de Pinus sp. en el control de S. rolfsii en el suelo. 2.4.1.2. Rotación de cultivos. Rosado et al. (1987) plantean que la resistencia a R. solani depende del manejo dado al agrosistema y destacan la rotación de cultivos como una técnica que. 16.
(28) garantiza una menor incidencia de hongos del suelo. Estos autores encontraron que la rotación maíz-frijol redujo notablemente las pérdidas producidas por organismos patógenos del suelo, en este último. Hagan (1983) reportó como cultivos a rotar con el maní, para disminuir las afectaciones de S. rofsii, maíz, sorgo, algodón y la mayoría de las hierbas usadas para pastos. La integración de cebolla dentro de los esquemas de rotación de maní y frijol, provocó una significativa reducción del porcentaje de plantas afectadas de un 25 a un 30 % (Zeidan, 1986). En estudios realizados sobre sistemas de rotación, Hernández (1996) encontró que en rotaciones cuyo cultivo fundamental de frío fue el frijol común, se cuantificaron densidades de esclerocios por kilogramo de suelo significativamente superiores que aquellos donde se cultivó papa en frío. Bhattacharyta y Malhotra (1979) reportaron en la India, que la incidencia de M. phaseolina fue reducida cuando la papa fue precedida por Crotalaria juncea. Singh et al. (1996) señalaron que el manejo de enfermedades mediante sistemas de rotación de cultivos puede ser un método más práctico, al intercalar cultivos no compatibles con los principales organismos patógenos que atacan al próximo en la rotación; estos autores señalan que el ciclo de dichos cultivos es de vital importancia en este aspecto. 2.4. 1.3. Labores agrotécnicas Las labores agrotécnicas pueden emplearse efectivamente para el combate de hongos del suelo en varios cultivos. La aradura profunda en el cultivo de la zanahoria disminuyó en un 50 % la densidad del inóculo de S. rolfsii en el campo (Gurkins y Jenkins, 1985). Un método de cultivo que no acerque suelo y materia orgánica a la base del tallo también logró disminuir significativamente el daño de S. rolfsii en maní. 17.
(29) (Garren y Duque, 1958). Tanaka et al. (1993) señalaron como un método para controlar S. rolfsii reducir la viabilidad de los esclerocios con el anegamiento de los suelos; esto puede ser debido a la disminución de O2 en el suelo, producción de sustancias anfúngicas (ácidos orgánicos) e incremento de organismos competitivos en el suelo. Prácticamente, el mismo puede ser efectivo para controlar S. rolfsii en suelos que puedan ser fácilmente cubiertos con agua. 2.4.1. 4. Resistencia varietal Mora y Blumm (1990) plantean que debido al alto rango de hospederos, se ha complicado el trabajo de los fitomejoradores en la búsqueda de resistencia genética a hongos del suelo, lo que coincide con Singh et al. (1996) respecto a M. phaseolina. 2.4.2. Control químico Los intentos de control químico de hongos del suelo han sido infructuosos debido a la poca persistencia de los productos químicos, la existencia de un alto número de hospedantes, proliferación rápida de los organismos patógenos, así como abundante producción de esclerocios, los cuales persisten en el suelo por varios años. Sharma y Sohi (1981) redujeron completamente las afectaciones por R. solani con el uso de Benomil, Carbendazim y Tridemorfe en tratamientos a la semilla. Pozo (1988) obtuvo buenos resultados empleando Benzotiazol, Thiram, y Carboxin + Thiram en tratamientos a la semilla en la variedad de frijol Carioca en el control de enfermedades radicales. Por otra parte Acimovic et al. (1982) reportan al Benomil como el fungicida más efectivo contra M. phaseolina. En Cuba, González y Pupo (1985) destacan buenos resultados con Benomil, Captan, Captan + Benomil y Benmil + TMTD. Martín (2001) obtuvo buenos resultados con el empleo in vitro de 18.
(30) Difeconazol 25 % (Score), Tebuconazol 25 % (Folicur), Propiconazol 25 % (Tilt) y Tebuconazol + Triadimenol triademol, en el control de S. rolfsii.. Palavan (2001) utilizó el fungicida Difluoromethylornithine (DFMO) el cual inhibió el crecimiento micelial de Macrophomina phaseolina. Resultados positivos in vitro obtuvo Folgueras (2010) con el empleo del TMTD. Partridge (2007) plantea que en la actualidad no existen fungicidas eficientes para el control de M. phaseolina en condiciones de producción y que lo más apropiado es el adecuado manejo agrotécnico del cultivo. 2.4.3. Solarización Un método con un gran potencial para el control de organismos patógenos del suelo es el acolchamiento del mismo con películas de polietileno (solarización), aplicado por primera vez por los israelíes a mediados de la década de los setenta. Resultados positivos con el empleo de este método han sido reportados por Esqueda - Valle y Zenteno-Zevada (1991) en el control de R. solani y Mihail y Alcorn (1984) en el control de S. rofsii aplicando la solarización en época de verano. Según estos autores, el método es inefectivo contra M. phaseolina. En Cuba, González et al. (2002 a, b) lograron la reducción de la supervivencia de Rhizoctonia solani con el empleo de cobertor plástico. 2.4.4. Control biológico Debido a que el control químico del patógeno es costoso, el control cultural difícil de aplicar y se carece de variedades resistentes, surge la alternativa. del control. biológico como una posible solución para la reducción de las enfermedades. Entre los microorganismos más empleados en el control biológico de hongos fitopatógenos del suelo se destaca el género Trichoderma Pers, el cual ha sido 19.
(31) investigado por diferentes autores (Punja, 1985; Papavizas, 1989) y Stephanova, (2007); Folgueras (2010 y Reyes (2011) en Cuba. Otros microorganismos han sido reportados como antagonistas de hongos del suelo, entre los que se encuentran Bacillus subtilis (Ehrenberg) como antagonistas de S. rolfsii (Kimm et al. 1997); Pseudomonas fluorescens (Trevisan) Migula, como antagonista de R. solani, S. rolfsii y M. phaseolina (Thara, 1994), Pseudomonas cepacia y Bacillus cereus, como antagonistas de R. solani. (Echávez et al., 1997) y Rhizobium leguminosarum biovar. phaseoli como antagonista de R. solani (Mora, 1996). Bocourt et al. (2009) en una prospección de hongos del suelo con potencialidades para el control biológico en suelos de agroecosistema cubanos reportaron, en un suelo Ferralitico Rojo con Nicotiana tabacum, Arachis hypogea y Sorghum bicolor, nueve especies con potencialidades para el control biológico, entre las que citan a: Aspergillus candidus Link. antagonista de Sclerotium cepivorum y M. phaseolina; Clonostachys rosa (Link) Schoers, Samuel, Seyfery WW. Gams. antagonista de R. solani y Fusarium solani, y Paecilomyces lilacinus (Thorne) Samsan, biocontrolador de M. phaseolina y S. cepivorum. Por otra parte Cuervo et al. (1998) destacan que las micorrizas vesicoarbusculares (MVA) Glomus fasciculatum (Thaxt.) Gerd. & Trappe y G. mosseau, solas o en combinación, disminuyeron el ataque de R. solani y Fusarium oxysporum E.F. Sm. & Swingle.. 20.
(32) De cualquier forma muchos son los reportes sobre la utilización de microorganismos como antagonistas de los principales hongos fitopatógenos del suelo, sin embargo esta práctica debe ser más extendida pues los tratamientos de semilla de forma comercial en el mundo desarrollado, continúan haciéndose en gran medida con productos químicos. 2.4.5. Control con sustancias naturales Como una forma de explorar nuestros recursos vegetales y animales en la búsqueda de compuestos bioactivos, que representen una alternativa en el control de organismos fitopatógenos han sido estudiadas plantas aromáticas, y muchos constituyentes de aceites esenciales por su actividad biológica, entre las que se destacan propiedades antimicrobianas, antioxidantes y antimutagénicas Begum et al. (2004) reportaron actividad antifúngica de un compuesto orgánico aislado a partir del extracto de rizoma de Acorus calamus contra Macrophomina phaseolina (Tassi) Goid., Curvularia lunata (Wakker) Boedijn y Alternaria alternata (Fr.) Keissl.. Resultados positivos encontraron Pirajno et al. (2004) con aceites. esenciales de Laurus nobilis, Mentha piperita y Ruta graveolaens contra Rhizoctonia solani y Sclerotinia sclerotiorum y Vaillant et al. (2008) al evaluar el efecto inhibitorio de cinco monoterpenos sobre un aislado de Rhizoctonia solani en papa: timol, alcanfor, citronelal (Cymbopogon nardus L.) y 1,8 cineol encontrados en aceites esenciales. En México, Zamora-Natera et al. (2005) encontraron actividad antifúngica in vitro del extracto crudo de semilla de Lupinus exaltatus contra Sclerotium rolfsii, Alternaria solani (Ellis & G. Martin) L.R. Jones & Grout, Rhizoctonia solani y Fusarium 21.
(33) oxysporum. Resultados similares obtuvieron Bernal-Alcocer et al. (2005). Puente (2007) encontró efecto antifúngico in vitro de extractos acuosos de Bixa orellana L., Euphorbia lactea Haw., Petiveria aliaceae L., Phyla strigulosa Mart.& Gal. y Wedelia trilobata Hitchc. frente a R. solani y S. rolfsii. En condiciones de campo, Robaina et al. (2008) encontraron, con el empleo del extracto de Wedelia trilobata (L.) Hitchc aplicado a la semilla, efecto fungicida sobre S. rolfsii. La quitina es un polisacárido que se encuentra ampliamente distribuido en la naturaleza, constituyendo el segundo polímero más abundante después de la celulosa, forma parte del caparazón de crustáceos, moluscos, insectos y otros seres vivos, cuyo derivado principal es la quitosana, la cual tiene en la actualidad amplios usos en la medicina, así como en la agricultura, ya que aplicada al suelo protege a las plantas contra la toxicidad de los metales (Cartaya et al., 2008 y 2009) y ha sido reportada con efecto directo en la inhibición del crecimiento de hongos fitopatógenos, asi como responsable de la activación de mecanismos de defensa en las plantas (Chang et al., 1995). 2.4.6. Control Integral Como se explicó anteriormente los diferentes métodos de lucha contra las enfermedades causadas por hongos del suelo hongos tienen sus inconvenientes específicos, por lo que las tendencias actuales se inclinan por un control integrado de las mismas. Elad et al. (1980) reportaron un trabajo de control integrado de hongos fitopatógenos del suelo utilizando solarización, empleo de productos químicos, agentes biocontroladores, combinaciones de cultivo profundo y normal con 22.
(34) empleo de fertilizantes cálcicos y nitrogenados para el control de S. rolfsii en el cultivo de la zanahoria, teniendo como resultado una disminución considerable del ataque de este hongo. Jenkins y Averre (1986) estudiaron los problemas y progresos en el control integrado del tizón sureño (S. rolfsii) y concluyeron que es positivo evitar el aporque, enterrar los restos vegetales, selección negativa, incremento de la distancia de siembra, control de plantas hospedantes, rotación de cultivos, aradura profunda, solarización, resistencia varietal, control biológico, demostrando con ello la importancia de este tipo de práctica. Araya y Hernández (2006) señalan entre las medidas para reducir las afectaciones por pudriciones radicales en el frijol común, en Costa Rica: Rotación de cultivos (arroz, maíz, yuca, pastos), siembra en tierras bien drenadas o evitar encharcamientos, labranza mínima, uso de semilla de calidad, y tratamiento a la semilla con Benomil, Carboxin + Captan, Clorineb, PCNB. El Instituto Iberoamericano de Cooperación para la Agricultura (2008) destaca que no existen variedades resistentes para América Central y establece un programa de manejo integrado que comprende el uso de semilla sana y nueva (preferiblemente certificada), siembra en cantero alto, evitar suelos encharcados, rotar con yuca, maíz, pastos; trabajar con labranza mínima y usar coberturas (malezas quemadas, restos de maíz, etc.) y el tratamiento a la semilla con fungicidas (Benomil, PCNB, Carboxin, Rizolex). En Cuba el MINAGRI (2000) recomienda contra las pudriciones radicales y del tallo en el cultivo: usar semillas limpias y libres de organismos patógenos, sembrar en suelos con buen drenaje, evitar dañar las raíces, erradicar malezas susceptibles,. 23.
(35) sembrar cultivos no susceptibles en suelos infestados, y el uso de variedades resistentes cuando sea posible. De las consideraciones anteriormente expresadas se puede concluir la importancia que tienen las enfermedades provocadas por hongos del suelo en el cultivo del frijol y la necesidad de estudiar las afectaciones que se producen por este concepto en nuestro país, así como proponer medidas para su posible control utilizando elementos que conlleven cada vez más a una agricultura sostenible.. 24.
(36) 3. MATERIALES Y MÉTODOS La investigación se desarrolló en la Facultad de Ciencias Agropecuarias (FCA) de la Universidad Central “Marta Abreu” de Las Villas (UCLV), en el período comprendido entre enero de 2007 y mayo de 2011. 3.1. Aislamiento, identificación y patogenicidad de hongos del suelo causantes de enfermedades en frijol común Se colectaron plantas de frijol común con síntomas de enfermedades causadas por hongos del suelo, procedentes de zonas productoras de las provincias de Villa Clara y Sancti Spiritus. 3.1.1. Aislamiento, identificación y agresividad de Rhizoctonia spp. Aislamiento Los aislados de este hongo se obtuvieron a partir de zonas necróticas de raíces y tallos de plantas cultivadas en campos de frijol en Villa Clara, así como de muestras de suelos pertenecientes a los agrupamientos Ferralítico y Pardo Sialítico (Hernández et al., 1999), las cuales fueron colocadas en macetas. Posteriormente se sembraron semillas de frijol de la variedad Güira 89 desinfectadas con hipoclorito de sodio al 1 %. Siete días después se colectó el tejido enfermo y se procedió al aislamiento. Los tejidos afectados, provenientes tanto de las plantas obtenidas en campo como en suelo, se colocaron en cámara húmeda y las colonias con características del género Rhizoctonia se purificaron en Agar Papa Dextrosa (PDA).. 25.
(37) Identificación de aislados de Rhizoctonia spp. Con el objetivo de identificar los aislados de Rhizoctonia spp. se utilizaron técnicas tales como tinción de núcleos, zimograma péctico, RCP-PLFR (Reacción en Cadena de la Polimerasa-Polimorfismo en la Longitud de los Fragmentos de Restricción) de la región ITS (del inglés Internal Transcribed Spacer) del ADN ribosomal (ADNr) y secuenciación de la propia región, según los procedimientos descritos por Pannecoucque et al. (2008). Estos análisis se realizaron en el laboratorio de Fitopatología de la Facultad de Bioingeniería de la Universidad de Gante, Bélgica. Tinción de núcleos. Para distinguir las especies de los aislados se determinó el número de núcleos mediante la tinción con 10μg mL-1 de 4,6-diamino-2-fenil indol (DAPI; Sigma-Aldrich) de hifas jóvenes obtenidas en microcultivos sobre agar-agua. Las observaciones se realizaron a través de un microscopio Olympus BX51. Zimograma péctico Para el análisis de las enzimas pécticas se empleó el sistema vertical de gelelectroforesis descrito por Schneider et al. (1997). Los aislados crecieron en un medio que contenía 1 % de pectina cítrica (Sigma-Aldrich, lote: 013K007) durante 10 días, en la oscuridad. Posteriormente se tomaron díez micro-litros filtrados de cada muestra los cuales se colocaron en un gel de poliacrilamina nativo del inglés (native polyacrylamine gel) y se llevó a cabo la electroforesis nativa en geles de poliacrilamida con el uso de un equipo Mini Protean III (BioRad). El gel separador 26.
(38) contenía 1,5 M Tris-HCL (pH 8,8), 10 % de acrilamida (acrylamide) y 0,1 % de pectina cítrica, mientras que el gel apilador estaba compuesto de 0,5 M Tris-HCL (pH 6,8), 5 % de acrilamida y 0,03 % de pectina cítrica. El buffer de electroforesis contenía 0.025 M Tris y 0.192 M Glicina (pH 8.3). Los geles se corrieron a 20 mA durante 30 minutos a una temperatura de 4 °C y seguidamente a 30 mA durante 60 minutos a esta misma temperatura. Después de la electroforesis, los geles fueron incubados en 0.1 M DL- ácido málico por una hora a temperatura ambiente, posteriormente se tiñeron con 0, 02 % de Rutenio rojo por dos horas y la fijación se realizó durante toda la noche en 3 mM de Na 2CO3. Los zimogramas obtenidos de los aislados se compararon con los patrones de aislados cuyos grupos de anastomosis eran conocidos. Análisis del RCP-PLFR de la región ITS del ADNr La extracción de ADN se realizó a partir de aislados cultivados durante 7 y 10 días en medio líquido de papa dextrosa (Difco). El micelio de cada aislado fue filtrado del medio y secado con papel de filtro estéril. Posteriormente se maceró en nitrógeno líquido, hasta un polvo fino. Los siguientes pasos de extracción se condujeron de según las instrucciones del protocolo de extracción de ADN DNeasy® Plant Mini Kit, (Qiagen, Alemania) acorde con las especificaciones de los fabricantes. Se utilizaron los oligonucleótidos ITS4 (5´-TCC TCC GCT TAT TGA TAT GC -3´) e ITS5 (5´-GGA AGT AAA AGT CGT AAC AAG G-3´) para amplificar la región ITS del rADN, incluyendo el ADN ribosomal 5.8 S (White et al., 1990).. 27.
(39) La reacción de amplificación por reacción en cadena de la polimerasa (RCP) se condujo añadiendo 2 μL de ADN genómico (5-10 ng μL-1) a 23 μL de una mezcla de PCR, la cual contenía 2.5 μL 10 x del buffer de PCR (Qiagen), 5 μL solución-Q (Qiagen), 0.5 μL de dNTPs (10 mM, Fermentas GmbH) y 11.35 μL de agua estéril bidestilada y consistió en un paso inicial de desnaturalización a 94°C por 10 minutos, seguido por 35 ciclos de un minuto a 94°C, un minuto a 55°C y un minuto a 72°C. El ciclo terminó con un paso final de extensión a 72°C por 10 minutos. El equipo empleado fue un termociclador Mastercycler gradient, (Eppendorf, Alemania). El producto de la amplificación fue posteriormente analizado por PLFR utilizando enzimas de restricción descritas por Guillemaut et al. (2003). Para ello se tomaron alícuotas (4-6 μL) del producto de RCP las cuales fueron digeridas en un volumen final de 10 μL con 5 U de endonucleasas MunI, MseI, y una combinación de AvaII y HincII (Fermentas GmbH). Los fragmentos de restricción fueron separados por electroforesis en un gel de agarosa (4 %) en un buffer TAE a 100 V y visualizado por tinción con bromuro de etidio en un transluminador ultravioleta. Los fragmentos de restricción de los aislados fueron comparados con aquellos pertenecientes a aislados cuyos grupos de anastomosis eran conocidos. Secuenciación de la región ITS del ADNr Para la amplificación de la región ITS se utilizaron los oligonucleótidos ITS1 (5’-TCC GTA GGT GAA CCT GCG G-3’) e ITS4 (White et al., 1990). El volumen total de reacción fue de 50 μL, conteniendo 28,5 μL de agua estéril bidestilada, 10 μL (10 ng μL-1), 5 μL 10x buffer de reacción, 3 μL de MgCl2 (25 mM), 1 μL de dNTPs (10 mM), 1 28.
(40) μL de cada 10 μM de cebador y 0,5 μL de Taq ADN polimerasa (5 U μL-1; SigmaAldrich). La amplificación se inició con una desnaturalización a 94°C por. tres. minutos, seguido de 30 ciclos de 94°C por 90 segundos, 55 °C por 90 segundos, 72 °C por dos minutos, con una extensión final a 72 °C por 10 minutos. Los productos de la RCP fueron analizados por electroforesis en gel de agarosa (1 %) en un buffer TAE y se purificaron para remover exceso de cebadores y/o dNTPs. La secuenciación se hizo utilizando CEQDTCS secuenciación química (Beckman Coulter Inc.) y posteriormente fueron corridos en un secuenciador automático de ADN (automated DNA capillarity sequencer) (CEQ 2000-XL; Beckman Coulter Inc.). Las secuencias fueron alineadas utilizando el programa de alineación múltiple CLUSTALW (Thompson et al., 1994) y el alineamiento fue chequeado visualmente. El porcentaje de similitud de secuencias de la región ITS fue calculada a partir de los datos, utilizando BIOEDIT versión 7.0.4.1. Determinación de la agresividad de los aislados en frijol Los estudios de patogenicidad se realizaron en condiciones semicontroladas. El inóculo de cada aislado de Rhizoctonia spp. se produjo en Erlenmeyers de 500 mL los cuales contenían granos de arroz previamente autoclaveados durante 21 minutos por dos días consecutivos. Dichos Erlenmeyers fueron inoculados con discos de PDA conteniendo micelio del hongo, proveniente de las márgenes de colonias de cuatro días de edad, y posteriormente se incubaron por 10 días a 28 ± 2°C. Semillas de frijol de la variedad Güira 89, previamente desinfectadas con hipoclorito de sodio al 1 % y enjuagadas con abundante agua estéril, fueron germinadas en 29.
(41) bandejas. de 22 x 15 x 6 cm, las cuales contenían suelo Pardo Sialítico. autoclaveado. Una semana después cada plántula fue transferida a macetas (1 plántula/maceta y 10 macetas por aislado) que contenían 392 g de suelo estéril y 8 g de inóculo.. Diez. días después, la severidad de la enfermedad fue evaluada. separadamente en tallos y raíces utilizándose la escala propuesta por Keijer et al. (1997) con modificaciones. Para el tallo: 0= ausencia de síntomas; 1= pequeñas lesiones negras o pardas menores de 1 mm de diámetro; 2= lesiones cubriendo menos del 75 % de la superficie del tallo, 3= lesiones cubriendo más del 75 % de la superficie del tallo; 4= planta muerta. Para la raíz: 1= decoloración amarilla o parda cerca de la base del tallo; 2= decoloración amarilla o parda cerca de la base del tallo más puntas pardas, 3= superficie totalmente parda cubriendo más del 75 % de la superficie de la raíz; 4= planta muerta. Los resultados se analizaron separadamente para las raíces y tallos. Los datos fueron sujetos a la prueba de Kruskal-Wallis y cuando se encontraron diferencias significativas se utilizó la prueba de. Mann-. Whitney. Todos los análisis se hicieron a través del paquete estadístico SPSS 16.0 para Windows. 3.1.2. Aislamiento, identificación y patogenicidad de Sclerotium rolfsii Sacc. Aislamiento e identificación Plantas enfermas, provenientes de zonas productoras de Villa Clara, fueron lavadas con agua corriente. El tejido afectado se colocó en placas de Petri conteniendo Agar agua con 25 mg/L de cloranfenicol, las cuales fueron incubadas a 28±2 0C durante 7 días. Seguidamente se tomaron hifas de las colonias con aspecto de S. rolfsii y se 30.
(42) transfirieron a placas de Petri con medio PDA, las cuales fueron incubadas durante 7 días a 28±2 0C. Posteriormente la autenticidad del hongo fue comprobada teniendo en cuenta los criterios de Mayea y Padrón (1986) y Leiva-Mora et al. (2005). Las observaciones se realizaron mediante un microscopio clínico Motic con aumento 40 x. Patogenicidad El estudio de la patogenicidad se realizó siguiendo el mismo procedimiento descrito para Rhizoctonia en cuanto a la producción del inóculo e inoculación del suelo. En este caso se utilizó la variedad de frijol BAT 482 (Testa blanca). La presencia de la enfermedad se diagnosticó de acuerdo con los síntomas descritos por Schwartz y Galvez (1980) y Punja (1985) en frijol para este microorganismo. Todos los estudios se desarrollaron en el Laboratorio de Fitopatologia de la Facultad de Ciencias Agropecuarias de la UCLV. 3.1.3. Aislamiento, patogenicidad y agresividad de aislados de Macrophomina phaseolina (Tassi) Goid. Aislamiento Plantas de frijol con chancros negros sobre el tallo y en algunos casos con presencia de esclerocios y/o picnidios, procedentes de campos cultivados de Villa Clara y Sancti Spíritus, fueron colocadas en cámara húmeda. Aproximadamente 48 horas después los picnidios se dejaron descargar durante dos horas sobre un portaobjeto estéril que contenía una fina lámina de PDA con Sulfato de Gentamicina (1 %p/v). Como recipiente de descarga se emplearon frascos del cultivo de tejido de plantas de 500 31.
(43) mL de capacidad.. El micelio fue transferido a placas de 9 cm de diámetro que. contenían 10 mL de medio PDA. Las colonias individuales no contaminadas fueron transferidas a tubos de ensayos que contenían 5 mL de PDA inclinado e incubadas durante 15 días a 30 ºC. Posteriormente cada aislado fue conservado a 4 ºC e incorporado a la colección de cultivo de hongos fitopatógenos del IBP.. Caracterización cultural y morfológica La caracterización cultural de los aislados se realizó teniendo en cuenta los criterios de De la Garza y Díaz (1989). Para ello se colocaron discos de micelio de 0,5 cm de diámetro (1 disco/aislado/placa), provenientes de las márgenes de colonias previamente crecidas durante 72, en placas de Petri (diámetro 9 cm) con 10 mL de PDA. Las placas se incubaron durante 7 días a 28±2 ºC y pasado este tiempo se caracterizó cada aislado. Determinación de la agresividad de los aislados en frijol Para determinar la agresividad de cada aislado se utilizó la variedad de frijol BAT 482. La producción de inóculo se llevó a cabo en Erlenmeyers de 500 mL que contenían 200 g de harina de maíz, previamente esterilizados, inoculados con 50 mL de una suspensión esclerocial cuya concentración era de 1.25x10 4escl.ml-1 aproximadamente. Cada recipiente se colocó en oscuridad constante dentro de una cámara climatizada Gallenkamp a 30 °C durante 15 días. Posteriormente por cada 400 g de suelo autoclaveado, del tipo Pardo mullido medianamente lavado (Hernández et al., 1999), se añadieron 50 g de inóculo. Cuatrocientos cincuenta 32.
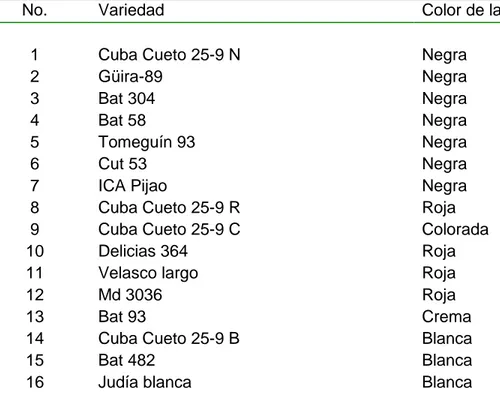
(44) gramos de la mezcla suelo-inóculo fueron vertidos en cada maceta, en las cuales se sembraron 5 semillas desinfectadas con anterioridad en hipoclorito de sodio al 2 %. Cada maceta fue regada con 50 mL de agua desionizada estéril. Catorce días después de la siembra se evaluó la agresividad, empleándose para ello la escala propuesta por Van Schoonhoven y Pastor Corrales, 1987 (Anexo 1). Se empleó un diseño completamente aleatorizado con 10 réplicas por cada aislado. Los datos se procesaron mediante la prueba de Kruskal-Wallis y cuando se encontraron diferencias significativas se utilizó la prueba de Mann-Whitney. Todos los análisis se hicieron a través del paquete estadístico SPSS 16.0 para Windows. Todos los estudios se desarrollaron en el Laboratorio de Fitopatología del Instituto de Biotecnología de las plantas de la UCLV. 3.2. Incidencia de enfermedades causadas por hongos fitopatógenos del suelo sobre variedades de frijol Con el objetivo de estudiar la incidencia de hongos fitopatógenos del suelo sobre 16 variedades de frijol (Tabla 3.1) se condujo un experimento en la estación experimental agrícola “Álvaro Barba Machado” de la UCLV. El mismo se inició el 18 de enero de 2007 y se repitió el 19 de enero de 2008. Se utilizó un diseño en bloques al azar con 3 réplicas. En cada uno de ellos la distancia de siembra fue de 0.45 m x 0.07 m y las parcelas tenían 4 surcos de 5 m lineales para un área de 6.75 m2. Los estudios se condujeron en un suelo Pardo Sialítico (Hernández., et al 1999). Las labores fitotécnicas aplicadas al cultivo únicamente fueron las relacionadas con. 33.
(45) la eliminación de plantas indeseables y un riego en siembra. No se aplicaron productos químicos ni biológicos.. Tabla 3.1. Variedades de frijol común (Phaseolus vulgaris) estudiadas. No.. Variedad. Color de la testa. 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16. Cuba Cueto 25-9 N Güira-89 Bat 304 Bat 58 Tomeguín 93 Cut 53 ICA Pijao Cuba Cueto 25-9 R Cuba Cueto 25-9 C Delicias 364 Velasco largo Md 3036 Bat 93 Cuba Cueto 25-9 B Bat 482 Judía blanca. Negra Negra Negra Negra Negra Negra Negra Roja Colorada Roja Roja Roja Crema Blanca Blanca Blanca. Para determinar el tipo de hongo fitopatógeno, siete días después de la siembra se inició la toma de muestra. La misma se mantuvo semanalmente hasta la cosecha. Las plantas con síntomas de marchitez y/o lesiones sobre el tallo se trajeron al laboratorio de Fitopatologia de la FCA y los órganos afectados se colocaron en cámara húmeda a temperatura ambiente, en un período comprendido entre 48-72 horas. Posteriormente las muestras fueron analizadas bajo un esterecospio Olympus. Las hifas, provenientes del tejido, se colocaron sobre un portaobjetos y se identificaron, teniendo en cuenta lo descrito por Bannert y Hunter (1986) para los 34.
(46) hongos del suelo patógenos al frijol, utilizando un microscopio clínico Motic con aumento 40 x. El porcentaje de incidencia de cada hongo se determinó dividiendo el número de plantas afectadas entre el número de plantas totales y multiplicando el resultado por 100 (Schoonhoven y Pastor-Corrales, 1987). Los datos del experimento se analizaron para cada año por separado empleándose la prueba de Kruskal- Wallis. En ambos casos el análisis se hizo través del paquete estadístico SPSS 16.0 para Windows. 3.2.1. Caracteres de la testa de la semilla asociados a la resistencia del frijol común a hongos fitopatógenos del suelo El experimento se realizó en el laboratorio de Microbiología de la Facultad de Ciencias Agropecuarias con los objetivos de evaluar el efecto in vitro de extractos acuosos, obtenidos de la testa de semillas de frijol común, sobre el crecimiento micelial de hongos del suelo patógenos a este cultivo así como determinar algunos de los caracteres químicos de la testa relacionados con la resistencia y/o tolerancia a las enfermedades causadas por estos organismos. Para ello se utilizaron semillas negras, rojas y blancas de las variedades Tomeguín 93, Delicias 364 y Bat 482 respectivamente, las cuales tenían 30 días de cosechadas y habían sido secadas al sol. Preparación de los extractos vegetales.. 35.
Figure



Documento similar
Cedulario se inicia a mediados del siglo XVIL, por sus propias cédulas puede advertirse que no estaba totalmente conquistada la Nueva Gali- cia, ya que a fines del siglo xvn y en
En estos últimos años, he tenido el privilegio, durante varias prolongadas visitas al extranjero, de hacer investigaciones sobre el teatro, y muchas veces he tenido la ocasión
que hasta que llegue el tiempo en que su regia planta ; | pise el hispano suelo... que hasta que el
En junio de 1980, el Departamento de Literatura Española de la Universi- dad de Sevilla, tras consultar con diversos estudiosos del poeta, decidió propo- ner al Claustro de la
Missing estimates for total domestic participant spend were estimated using a similar approach of that used to calculate missing international estimates, with average shares applied
The part I assessment is coordinated involving all MSCs and led by the RMS who prepares a draft assessment report, sends the request for information (RFI) with considerations,
Products Management Services (PMS) - Implementation of International Organization for Standardization (ISO) standards for the identification of medicinal products (IDMP) in
This section provides guidance with examples on encoding medicinal product packaging information, together with the relationship between Pack Size, Package Item (container)