Efecto del antagonismo k opioide sobre la dinámica dopaminérgica del estriado dorsolateral en ratas tratadas repetidamente con anfetamina
Texto completo
(2) Dedicatoria. A mis padres, por su esfuerzo y apoyo incondicional.. “La vida no es fácil, para ninguno de nosotros. Pero… ¡Qué importa! Hay que perseverar y, sobre todo, tener confianza en uno mismo. Hay que sentirse dotado para realizar alguna cosa y que esa cosa hay que alcanzarla, cueste lo que cueste”.. Marie Curie.
(3) Agradecimientos. Agradezco al profesor José Fuentealba por darme la oportunidad de trabajar en su laboratorio. Agradezco además su disposición y compromiso. Agradezco a mi familia y amigos por el apoyo que me brindaron durante estos años de formación universitaria. Por estar ahí en los buenos y malos momentos. A todos los integrantes del Laboratorio de Neuroquímica, gracias por su buena onda, por sus consejos y apoyo. Gracias a Consuelo Aguilera por enseñarme las técnicas necesarias para llevar a cabo este estudio. Gracias también a Víctor Azócar y Enzo Pérez, por su buena voluntad y disposición para ayudar a los alumnos de pregrado, por su apoyo y por subirme al ánimo en muchos momentos con sus tallas. A todos los que formaron parte de este proceso, profesores, compañeros, a los que me acogieron durante mis prácticas profesionales..
(4) Lista abreviaciones. AMPH. Anfetamina. cAMP. Adenosin monofosfato cíclico. Cext. Concentración extracelular. Cin Cin- Cout. Concentración perfundida Diferencia entre la concentración perfundida y el dializado. CPu. Caudado putamen. CRF. Factor liberador de corticotrofina. DA. Dopamina. DAext. Concentración extracelular de dopamina. DAT. Transportador de dopamina. DLS. Estriado Dorsolateral. DYN. Dinorfina. Ed. Fracción de extracción. GPCRs. Receptores acoplados a proteína G. GRKs. Quinasas de receptores acopladas a proteína G. HPLC. Cromatografía líquida de alta eficiencia. i.p.. Intraperitoneal. ICSS. Autoestimulación intracraneal. IPSC. Corrientes inhibitorias post-sinápticas. KOR. Receptor kappa opioide.
(5) KRF. Krebs Ringer Fosfato. MAPKs. Proteínas quinasa activadas por mitógenos. µL. Microliltro. µm. Micrometro. mm. Milímetro. mM. Milimolar. min. Minutos. MOR. Receptor Mu opioide. mPFC. Corteza prefrontal medial. MSNs. Neuronas espinosas medianas. mV. Milivolt. NAc. Núcleo Accumbens. nM. Nanomolar. NNF. Microdiálisis no-net flux. nor-BNI. Norbinaltorfimina. PCA. Ácido perclórico. PDYN. Prodinorfina. PFA. Paraformaldehído. PFC. Corteza prefrontal. PKA. Proteína quinasa A. SEM. Error estándar de la media. VTA. Área tegmental ventral.
(6) Indice General. Indice general: ........................................................................................... i Indice de Figuras ...................................................................................... iii Resumen .................................................................................................. iv Abstract………………………………………………………………………….v I.. INTRODUCCIÓN……………………………………………………………….1 a). Adicción……………………………………………………………………….1. b) Sistema dopaminérgico mesolímbico……….. ……………………………4 c). Sistema kappa opioide en la adicción……………………………………..6. d). Implicancia del estriado dorsolateral en la adicción…………………….11. II.. HIPÓTESIS…………………………………………………………………...13. III.. OBJETIVOS…………………………………………………………………..14. a) Objetivo general……………………………………………………………..14 b) Objetivos específicos……………………………………………………….14 IV.. METODOLOGÍA……………………………………………………………..15. a) Drogas………………………………………………………………………..15 b) Animales……………………………………………………………………...15 c) Cuantificación de la actividad locomotora horizontal.…………………...16 d) Microdialisis no net flux…………………………………………………….18 e) Histología…………………………………………………………………….19 f) Análisis muestras de dializado…………………………………………….21 g) Análisis de los datos y análisis estadísticos……………………………...21 V.. RESULTADOS……………………………………………………………...23. i.
(7) a) El pretratamiento con nor-BNI no afecta la actividad locomotora inducida por la administración repetida de AMPH………………………………………..23 b) El pretratamiento con nor-BNI modifica la dinámica dopaminérgica del DLS de ratas tratadas repetidamente con AMPH……………………………...26 b.1 Efecto de nor-BNI sobre la liberación basal de DA en el DLS…………27 b.2 Efecto de nor-BNI sobre la Ed en el DLS………………………………..27 b.3 Efecto de nor-BNI sobre la DAext en el DLS……………………………..28 V.. DISCUSIÓN.………………………………………………………………….30. a) El antagonismo kappa opioide y su implicancia en el proceso adictivo…30 b) El pretratamiento con nor-BNI modifica la dinámica dopaminérgica del DLS de ratas tratadas repetidamente con anfetamina...………………………32 c) El pretratamiento con nor-BNI no afecta la actividad locomotora inducida por la administración repetida de AMPH……………………………................38 VI.. CONCLUSIONES ............................................................................... 42. VII.. BIBLIOGRAFÍA ................................................................................... 43. ii.
(8) Indice de Figuras. Figura 1. Etapas del ciclo de la adicción………………………………………....2 Figura 2. Modelo por el cual el sistema DYN/KOR atenúa la liberación de DA inducida por los psicoestimulantes………………………………………………..8 Figura 3. Protocolo de sensibilización locomotora a anfetamina…………….17 Figura 4. Postura de sonda de corte coronal cerebral…………………………20 Figura 5. Representación gráfica de los datos obtenidos a partir de una microdiálisis no net flux……………………………………………………………22 Figura 6. Curso temporal de la sensibilización locomotora a anfetamina…..25 Figura 7. Dinámica dopaminérgica en el DLS de ratas tratadas repetidamente con. AMPH,. que. recibieron. pretratamiento. con. nor-BNI. o. salino………………………………………………………………………………..29. iii.
(9) Resumen. El sistema kappa opioide ha sido relacionado a la fisiopatología y tratamiento de la adicción, principalmente por su control sobre la neurotransmisión dopaminérgica en el sistema mesolímbico. La exposición a psicoestimulantes como la anfetamina (AMPH) se acompaña de un aumento en la actividad del sistema opioide kappa. La evidencia indica que la activación repetida de los receptores opioides kappa (KORs) asociada la administración crónica de una droga de abuso, induce un aumento en la liberación de dopamina (DA) y una disminución en la recaptura de dicho neurotransmisor en el Núcleo Accumbens (NAc). Sin embargo la contribución de los KORs sobre la dinámica dopaminérgica. de. la. vía. dopaminérgica. nigro-estriatal. durante. la. administración repetida de AMPH no ha sido del todo elucidada. Este trabajo tiene como objetivo estudiar el efecto del pretratamiento con el antagonista KOR, nor-binaltorfimina (nor-BNI), sobre la concentración extracelular de DA (DAext) en el estriado dorsolateral (DLS) de ratas tratadas repetidamente con AMPH. Para cumplir con los objetivos se llevó a cabo la técnica de microdiálisis no-net flux (NNF), en ratas anestesiadas, para cuantificar la liberación basal de DA y determinar la fracción de extracción (Ed) y la concentración extracelular de DA. Los resultados obtenidos muestran que la administración sistémica de nor-BNI previo al tratamiento repetido con AMPH se acompaña de una disminución en la DAext en el DLS, asociado a un incremento de la Ed y una disminución en la liberación basal de DA. Estos resultados sugieren que los KORs contribuyen al incremento en la DAext inducida por la administración repetida de AMPH, incrementando la liberación de DA y disminuyendo su recaptura mediada por el transportador de DA (DAT).. iv.
(10) Abstract. The kappa opioid system has been associated to the pathophysiology and treatment of drug addiction, due to its control on the mesolimbic dopaminergic neurotransmission. Exposure to psychostimulants such as amphetamine (AMPH) is accompanied with an up-regulated kappa opioid system activity. The repeated activation of KOR observed after chronic administration of a drug, induces an increase in the release of dopamine (DA) and a decrease in the DA uptake in the Nucleus Accumbens (NAc). However, the contribution of KOR on the nigro-striatal dopaminergic dynamics during the repeated administration of AMPH has not been fully elucidated. This work aims to study the effect of KOR antagonist pretreatment, nor-binaltorphimine (nor-BNI), on the extracellular DA concentration (DAext) in the dorsolateral striatum (DLS) of rats repeatedly treated with AMPH. The microdialysis non-net flux (NNF) was carried out to assess basal DA release, the extraction fraction (Ed) and the extracellular DA concentration in the DLS of rats treated repeatedly with AMPH. Results show that the systemic administration of nor-BNI prior to repeated treatment with AMPH is accompanied by a decrease in DAext in the DLS, associated with an increase in Ed and a decrease in basal DA release. These results suggest that KORs contribute to the increase in DAext induced by repeated administration of AMPH, increasing DA release and decreasing DA uptake mediated by dopamine transporter (DAT).. v.
(11) I.. INTRODUCCIÓN. a) Adicción. La adicción puede ser definida como un desorden crónico caracterizado por el consumo y búsqueda compulsiva de la droga, pérdida de control para limitar el consumo y la aparición de síntomas negativos característico del síndrome de abstinencia. Los patrones compulsivos de comportamiento tienen lugar a expensas de la mayoría de las otras actividades de la vida diaria y persisten a pesar de las consecuencias adversas [1]. El comportamiento adictivo se debe en gran parte al hecho que el uso repetido de la droga es capaz de inducir en individuos susceptibles y en condiciones particulares cambios adaptativos a nivel neuronal [2]. Sin embargo, no todos los individuos que consumen drogas desarrollan adicción. En este sentido, se han descrito factores predisponentes a desarrollar este desorden, como: la historia familiar, exposición temprana (la adolescencia representa un período de mayor vulnerabilidad), el ambiente en el cual se desenvuelve el individuo (pobre soporte social y familiar), la presencia de alteraciones mentales (déficit atencional, trastornos de hiperactividad y ansiedad) y por último los factores genéticos [3, 4]. Según la teoría de los Procesos Opuestos descrita por primera vez en 1974 [5], la adicción se presenta como un ciclo que puede dividirse en tres etapas como se observa en la figura 1 [3]. La primera etapa se caracteriza por el consumo recreacional de la droga que activa en forma paulatina el sistema dopaminérgico mesolímbico contribuyendo a las propiedades hedónicas y a la búsqueda de la droga. En este periodo la droga actúa como un reforzador positivo. El refuerzo positivo es aquel proceso en el que la presentación del estímulo, aumenta la probabilidad de la respuesta [6].. 1.
(12) Figura 1. Etapas del ciclo de la adicción. La adicción se divide en tres etapas; la primera se caracteriza por el consumo recreacional de la droga (en azul), la segunda involucra el desarrollo del síndrome de abstinencia (en rojo) y la tercera etapa se caracteriza por un déficit de las funciones ejecutivas (en verde). Cada etapa involucra diversos circuitos cerebrales interconectados. Imagen adaptada de Volkow et al. (2016) [3].. La segunda etapa de la adicción se genera con la discontinuación del uso de la droga e involucra procesos hedónicos negativos característicos del síndrome de abstinencia. Esta etapa involucra además un tipo de refuerzo negativo, definido como el proceso en el cual el retiro de un estímulo aversivo, aumenta la probabilidad de la respuesta [7]. En este sentido el individuo adicto busca aliviar el estado hedónico negativo generado durante el síndrome de. 2.
(13) abstinencia con el consumo de la droga, por sobre las propiedades gratificantes de ésta [6]. Algunos de los síntomas desarrollados por los individuos susceptibles cuando el acceso a la droga es restringido corresponden a la irritabilidad, disforia, incapacidad de expresar o identificar las emociones propias, estados de estrés y pérdida de motivación por recompensas naturales [3]. La tercera etapa se denomina anticipación y preocupación, el individuo desarrolla un déficit en las funciones ejecutivas, es decir alteraciones en la toma de decisiones. Se manifiesta como una imposibilidad para abandonar voluntariamente el comportamiento adictivo, adquiriendo una conducta guiada por la droga. La adicción se vuelve un trastorno crónico con recaídas recurrentes, periodo en el cual el individuo restablece el comportamiento de búsqueda compulsiva de drogas, incluso después de largos periodos sin la exposición a éstas [8]. La evidencia es considerable respecto a que todas las drogas de abuso convergen en un sistema común, conocido como el sistema dopaminérgico mesolímbico [9]. Este sistema corresponde a uno de los principales sustratos neuronales que se ve afectado durante el ciclo de la adicción y ha sido relacionado por algunos autores a aspectos como la recompensa [10] y la motivación [2].. 3.
(14) b) Sistema dopaminérgico mesolímbico. Este sistema está compuesto por neuronas dopaminérgicas del área tegmental ventral (VTA) del mesencéfalo y sus proyecciones hacia regiones rostrales del cerebro como la corteza prefrontal (PFC), la amígdala y zonas estriatales, en particular el núcleo accumbens (NAc) [9, 10, 11]. La evidencia indica que todas las drogas de abuso administradas de forma aguda son capaces de aumentar la liberación de dopamina (DA) dentro del NAc, siendo una liberación de mayor amplitud y duración que aquella alcanzada mediante mecanismos fisiológicos, contribuyendo de esta manera al efecto reforzante positivo de las drogas de abuso [12]. Luego de una activación excesiva del circuito de la motivación tras el consumo habitual de la droga, se genera un proceso denominado alostasis, en el cual el organismo tiende a mantener la estabilidad pero estableciendo nuevas condiciones basales [13, 14]. Los procesos alostáticos se producen mediante cambios neuroplásticos, involucrando modificaciones neuroquímicas. En primer lugar se generan cambios transitorios inducidos principalmente por la farmacología de la droga en sí, por ejemplo, los opiáceos son agonistas de los receptores de opioides, mientras que la cocaína bloquea transportadores de monoaminas en los terminales nerviosos [9]. Con el trascurso del proceso adictivo se desarrollan cambios estables que afectan la excitabilidad neuronal y la transcripción de genes en los circuitos neuronales [15], contribuyendo a la disminución de niveles de DA del sistema mesolímbico. Este estado hipodopaminérgico ha sido relacionado al desarrollo del síndrome de abstinencia cuando el acceso a la droga es restringido y a la perdida de placer por los reforzantes naturales [9]. Uno de los mecanismos involucrados en este cambio sobre la neurotransmisión dopaminérgica mesocorticolímbica corresponde a la activación de los sistemas de estrés cerebral. En este sentido, se propone que tras el consumo de drogas no solo se producen cambios dentro del sistema. 4.
(15) dopaminérgico mesolímbico que tienden a reducir la intensidad de los efectos gratificantes sino que también se genera el reclutamiento de los sistemas de estrés cerebral [16]. La activación del eje extrahipotalámico mediado por el factor liberador de corticotrofina (CRF) destaca entre los elementos neuroquímicos implicados en estos sistemas [6]. La activación de CRF en áreas cerebrales como la amígdala extendida ha sido relacionada a efectos de tipo ansiosos, consistente con aquello la administración de un antagonista CRF en ratas sometidas a un tratamiento repetido con cocaína es capaz de revertir los efectos anxiogénicos desarrollados durante el síndrome de abstinencia a drogas [17]. Además la evidencia posiciona la activación CRF en zonas como la corteza prefrontal medial, como un factor asociado a un déficit en las funciones ejecutivas del individuo que facilita la transición a un comportamiento de tipo compulsivo en la adicción [6]. Otro de los sistemas que controla las respuestas inducidas por agentes estresantes corresponde al sistema kappa opioide, el cual como ha sido ampliamente reportado, contribuye de manera clave en la progresión de la adicción a drogas [18].. 5.
(16) c) Sistema kappa opioide en la adicción. El receptor kappa opioide (KOR) es un miembro de la superfamilia de siete receptores transmembrana acoplados a proteína G (GPCR) y forma parte del sistema opioide endógeno junto a los receptores mu (µ) y delta (δ) [19]. La activación de los KORs gatilla diversas cascadas de señalización intracelular, incluyendo la vía acoplada a la proteína G-αi/o (cAMP) y la modulación de canales iónicos a través de G-βγ. A su vez los agonistas KOR son capaces de activar vías de quinasa intracelular, como quinasas acopladas a proteína G (GRK) y proteínas quinasas activadas por mitogenos (MAPK): ERK1/2, p38 and JNK [19]. Se ha demostrado que la activación del sistema kappa opioide ejerce efectos de tipo inhibitorio sobre la función neuronal, ya sea axonal o somatodendrítica [20] limitando la excitabilidad celular o inhibiendo la liberación de neurotransmisores desde terminales axonales que expresan KOR [21]. La dinorfina (DYN) corresponde al ligando endógeno de los KORs y se distribuye a lo largo del cerebro y la médula espinal [18]. Específicamente regiones cerebrales relacionadas a la motivación, estados emocionales, aprendizaje y toma de decisiones; como el VTA, NAc, mPFC, estriado dorsal y la amígdala extendida [22]. Se ha demostrado que la activación KOR desempeña un papel importante en la regulación de la transmisión dopaminérgica estriatal [23]. Los agonistas KOR disminuyen la transmisión dopaminérgica en el NAc [24] y en el estriado dorsal [25], lo que se asocia con la aparición de efectos aversivos en animales de experimentación y disfóricos en humanos [26]. El sistema kappa opioide se ha visto implicado además en estados emocionales negativos y específicamente en aquellos presentes durante el síndrome de abstinencia a drogas, como la ansiedad y la depresión [27]. Consistente con lo anterior se ha observado que el bloqueo de los KORs. 6.
(17) posee efectos ansiolíticos y antidepresivos en animales de experimentación [28, 29]. La exposición a psicoestimulantes como la cocaína y anfetamina (AMPH) se acompaña de un aumento en la actividad del sistema kappa opioide endógeno y en la expresión de DYN en el estriado [30, 31]. Estudios postmortem en individuos adictos a cocaína muestran un aumento de la expresión de Prodinorfina (PDYN), el péptido precursor de DYN [32]. En la misma línea ha sido demostrado que tras someter a ratas a un protocolo de administración repetida de cocaína existe un aumento en la expresión del gen de PDYN en el estriado dorsal, lo cual sugiere la participación del sistema kappa opioide en etapas más avanzadas de la adicción [30]. La inducción de la expresión de DYN tras la exposición a estimulantes puede ser explicado a través de un mecanismo dependiente de la activación de los receptores dopaminérgicos post-sinápticos D1 [33], como se observa en la figura 2. Se ha propuesto que la activación sostenida de estos receptores en la vía nigroestriatal después de la exposición a la droga promueve la activación del factor de transcripción CREB y la posterior síntesis de DYN. El aumento de la síntesis de DYN conlleva a la activación de los KORs en las terminales dopaminérgicas, ejerciendo de esta forma un feed-back negativo sobre la liberación de DA. Por ende se propone que la activación de este sistema puede conceptualizarse como una adaptación compensatoria que modula la liberación DA inducida por la droga [34]. Además se posiciona como uno de los sistemas que contribuyen a la generación de un estado hipodopaminérgico durante el transcurso de la adicción el cual ha sido correlacionado con mayores riesgos de recaída y abuso de drogas [34]. En este sentido el sistema kappa opioide representa un posible blanco terapéutico en el tratamiento de la adicción [18, 35].. 7.
(18) Figura 2. Modelo por el cual el sistema DYN/KOR atenúa la liberación de DA inducida por los psicoestimulantes. La administración de AMPH eleva los niveles de DA, la cual se une al receptor D1 expresado por las neuronas espinosas medianas de la vía nigroestriatal (vía directa). La unión de DA al receptor D1 activa la vía cAMP/PKA/CREB que promueve la síntesis de DYN que se unirá al KOR situado en los terminales dopaminérgicos. Siendo el resultado final la inhibición de la liberación de dicho neurotransmisor. Imagen adaptada de Trifilieff et al. (2013) [34].. La evidencia existente muestra que el control ejercido por los KORs sobre la neurotransmisión. dopaminérgica. es. aparentemente. contradictoria. y. dependiente del régimen de administración utilizado. Como se mencionó anteriormente, la activación aguda de los KORs se acompaña de una disminución de la señalización de DA en el NAc y en el estriado dorsal [24, 36, 37] efecto que ha sido atribuido a una inhibición de la liberación de DA [18]. Además, la evidencia también indica que los KORs son capaces de regular la 8.
(19) recaptura de DA, en este sentido la activación aguda de los KORs por agonistas sintéticos como U-69593 se acompaña de un incremento transitorio en la recaptura de DA en el NAc [38]. Los resultados sugieren por ende que la activación aguda de los KORs disminuye la neurotransmisión dopaminérgica a través de la inhibición de la liberación de DA y el aumento de su recaptura mediante el trasportador de dopamina (DAT). De acuerdo a lo demostrado por Svingos et al. (2001), los KORs se encuentran co-localizados junto con el DAT en los terminales dopaminérgicos estriatales [39] respaldando una posible interacción entre los KORs y el DAT. Por otro lado, tanto la exposición a norbinaltorfimina, (nor-BNI), antagonista de los KORs, como la deleción de dicho receptor en animales knock-out, induce un aumento en liberación basal de dopamina y subsecuentemente un aumento en la recaptura en el NAc [35]. Lo anterior es sugerente de la presencia de un tono basal kappa opioide que inhibe la neurotransmisión dopaminérgica en dicha región cerebral y cuya perdida o bloqueo gatilla adaptaciones en la actividad del DAT. Contrario a lo observado después de la administración aguda de los KORs, la activación repetida de estos receptores se acompaña de un incremento de la neurotransmisión dopaminérgica. En concordancia, un estudio demuestra que la administración repetida del agonista selectivo KOR, U-69593, aumenta los niveles extracelulares de DA estimulados por depolarización en el NAc [40]. Además la administración repetida de U-69593 se acompaña de un incremento significativo en la liberación de DA inducida por AMPH en el NAc [41]. Los resultados anteriores sugieren que la activación prolongada de los KORs resulta en una facilitación de los niveles extracelulares de DA inducidos por AMPH en el NAc. De manera similar, estudios previos reportaron que la administración sistémica repetida de U-69593 provoca un aumento en la liberación de DA inducida por la cocaína en el NAc y el estriado [42]. En cuanto al efecto producido sobre la actividad del DAT, los hallazgos indican que la. 9.
(20) activación repetida de los KORs produce una disminución de la recaptura de DA en el NAc [38]. De acuerdo a lo expuesto anteriormente es posible sugerir que la activación aguda de los KORs inducida tras el consumo inicial de un psicoestimulante o tras ser expuesto a un episodio de estrés agudo, lograría atenuar el efecto molecular y conductual inducido por la droga. No obstante se propone que, la activación repetida de los KORs como podría ocurrir después de la administración crónica de psicoestimulantes, es capaz de inducir un aumento de la liberación de DA potenciando de esta forma los efectos conductuales producidos por la droga [43]. Como quedó en manifiesto el sistema kappa opioide ejerce un control complejo sobre la neurotransmisión dopaminérgica en el NAc. Sin embargo, la evidencia es menos concluyente respecto al control ejercido por los KORs en la dinámica DA en el estriado dorsolateral (DLS), siendo objeto de estudio en esta investigación.. 10.
(21) d) Implicancia del estriado dorsolateral en la adicción. Junto a los cambios neuroquímicos que se observan en el NAc, regiones más dorsales del cuerpo estriado han sido recientemente involucradas en algunos aspectos importantes del proceso adictivo. En este sentido, se ha observado que tras el uso repetido de una droga se establece un aumento progresivo de la liberación de DA en el DLS mientras que se evidencia una atenuación en el incremento de la señalización dopaminérgica en el NAc [44]. En el estudio realizado por Willuhn et al. (2012), caracterizaron la dinámica dopaminérgica en ratas que fueron sometidas a un régimen de autoadministración de cocaína mediante un método de voltametría. Los resultados de este estudio evidenciaron una liberación fásica (estimulada) de DA en el NAc desde las primeras semanas de administración de la droga, mientras que el registro en el DLS mostró una liberación fásica de DA similar en magnitud a aquella obtenida en el NAc pero que surgió a partir de la segunda a tercera semana de administración de cocaína. Lo anterior sugiere que la señalización dopaminérgica en el DLS se desarrolla tras el uso habitual de la droga. Otro estudio indica que tras la desconexión entre el estriado ventral y el dorsal en ratas sometidas al protocolo de autoadministración de cocaína se evidencia una disminución selectiva del comportamiento de búsqueda de drogas por los animales [45]. De esta forma se refuerza la idea que la adicción involucra una transición desde zonas ventrales a zonas dorsales del estriado que se correlacionan con respuestas condicionadas que resultan en hábitos, conduciendo en última instancia al consumo compulsivo de drogas. En resumen es posible proponer que el sistema kappa opioide está implicado en la fisiopatología de la adicción, principalmente mediante el control ejercido sobre la neurotransmisión dopaminérgica en el estriado. La exposición a psicoestimulantes como la anfetamina se acompaña de un aumento en la actividad del sistema kappa opioide endógeno en dicha zona cerebral [31].. 11.
(22) Además se ha propuesto que la activación de este sistema puede conceptualizarse como una adaptación compensatoria que inhibe la liberación de DA inducida por la droga. Sin embargo la activación repetida del sistema kappa opioide, como ocurre después de la administración crónica de una droga, induce un aumento en la liberación de DA y una disminución en la recaptura de dicho neurotransmisor especialmente en el NAc. El aumento de la señalización dopaminérgica contribuye al desarrollo de la búsqueda compulsiva de la droga y pérdida de control para limitar el consumo que promueve a su vez una mayor vulnerabilidad a la recaída. Además la activación prolongada de los KORs se posiciona como un factor que contribuye a la intensificación de los estados emocionales negativos presentes durante el síndrome de abstinencia y en la dependencia [46]. En base a esos antecedentes la administración de un antagonista KOR aparece como una alternativa farmacológica prometedora para el tratamiento de la adicción. Si bien existe un consenso sobre el control ejercido por el sistema kappa opioide sobre la dinámica dopaminérgica en el NAc y su implicancia en la adicción, un posible tono endógeno de KOR sobre el DLS no ha sido completamente determinado, ni el efecto del bloqueo KOR sobre la dinámica de DA de dicha zona cerebral en un contexto de administración repetida de una droga. Este trabajo pretende determinar en consecuencia, el efecto del bloqueo de los KORs sobre la dinámica dopaminérgica del DLS de ratas tratadas repetidamente con AMPH. Para esto se llevará a cabo la administración de un antagonista de los KORs, nor-BNI, previo al protocolo de sensibilización locomotora a AMPH. La sensibilización locomotora representa un paradigma experimental que permite evaluar la respuesta locomotora inducida tras la administración repetida de la droga [47]. Los resultados obtenidos permitirán comprender los cambios neuroquímicos y conductuales que subyacen al antagonismo opioide kappa y su implicancia en el desarrollo de la adicción.. 12.
(23) II.. HIPÓTESIS. “El bloqueo de los receptores κ-opioide modifica la dinámica dopaminérgica del DLS que acompaña el tratamiento repetido con anfetamina en ratas”.. 13.
(24) III.. a). •. OBJETIVOS. Objetivo general:. Evaluar el efecto del pretratamiento con el antagonista kappa opioide, nor-BNI, en la dinámica dopaminérgica del DLS en ratas tratadas repetidamente con anfetamina.. b) Objetivos específicos:. •. Cuantificar la actividad locomotora horizontal inducida por 1mg/kg de anfetamina en ratas.. •. Cuantificar el dializado basal de dopamina mediante una microdiálisis no-net flux en animales tratados repetidamente con anfetamina.. •. Determinar Fracción de extracción (Ed) y la concentración extracelular de dopamina (DAext) en animales tratados repetidamente con anfetamina.. 14.
(25) IV.. METODOLOGÍA. a) Drogas. •. Antagonista de los receptores kappa opioide, nor-BNI (Laboratorio Abcam), dosis 10 mg/Kg disuelta en suero salino al 0,9%.. •. Anfetamina (Laboratorio Chile), dosis 1mg/kg. Se utilizó una solución de 0,9 mg/mL, la cual fue preparada a partir de una solución stock 1,8 mg/mL.. b) Animales. Se utilizaron ratas macho adultas de la cepa Sprague Dawley (300-350 g), 70 días post-natal, que fueron alojadas en grupos de 2 animales por jaula y mantenidos a temperatura (21±1°C) y humedad (45-50%) con un ciclo de 12 horas de luz y 12 horas de oscuridad (luz encendida a partir de las 7 am) y mantenidos con libre acceso al agua y comida. Los animales fueron adquiridos desde el Bioterio central de la Facultad de Ciencias Biológicas de la Pontificia Universidad Católica de Chile y trasladados hasta el Departamento de Farmacia de la Facultad de Química de la Pontificia Universidad Católica de Chile. Todos los animales recibieron un proceso de aclimatación durante una semana. El proceso comienza con el marcaje de sus colas, de manera que cada uno sea identificado numéricamente. El peso de las ratas fue registrado diariamente y fueron sometidas a un proceso denominado handling, que consiste en levantar a cada rata y luego devolverla a la superficie, sucesivamente durante 2 minutos, transcurrido el tiempo se posiciona a la rata en el antebrazo del experimentador manipulándola durante 5 minutos. Los animales fueron manejados siguiendo las normas establecidas para el cuidado. 15.
(26) de animales por el Consejo Directivo ECC 86/609 y las medidas de bioseguridad que dispone el Manual de Normas de Bioseguridad, editado por CONICYT. Se siguieron las Normas de Bioética de la Guide for the Care and Use of Laboratory Animals del Nacional Institute of Health (NIH). Los animales fueron separados en dos grupos experimentales, uno de los grupos recibió una inyección i.p de nor-BNI (10 mg/Kg) dos días antes de comenzar con el protocolo de sensibilización, involucrando una única inyección de nor-BNI debido al ciclo de tiempo prolongado (14-21 días) del bloqueo opioide kappa por este antagonista [48]. El segundo grupo que recibirá en cambio una inyección i.p equivalente de solución salino al 0.9%, correspondiendo al grupo control.. c) Cuantificación de la actividad locomotora horizontal. El protocolo de administración repetida de anfetamina se llevó a cabo de acuerdo a una adaptación del protocolo descrito por Aguilar-Rivera et al. (2015) [49]. Las ratas fueron puestas en las cajas de prueba de actividad locomotora horizontal (15 cm x 47 cm x 26 cm) equipadas con un piso de metal y 2 pares de luces infrarrojas dispuestas longitudinalmente y separadas por 25 cm y 5 cm sobre el piso. Los cruces en las cajas fueron monitoreados usando un dispositivo programado para detectar un cruce cuando ambas luces sean interrumpidas consecutivamente. Un archivo Excel con macros habilitado cuenta automáticamente 1 vuelta o cruz. Una vez en la caja, las ratas fueron habituadas por 60 min para atenuar la actividad exploratoria normal, luego éstas fueron inyectadas con 1 mg/Kg i.p de AMPH. Inmediatamente se midió la actividad locomotora durante otros 60 minutos. El protocolo se repitió durante cinco días consecutivos (días 1 a 5). Luego de transcurrido estos 5 día. 16.
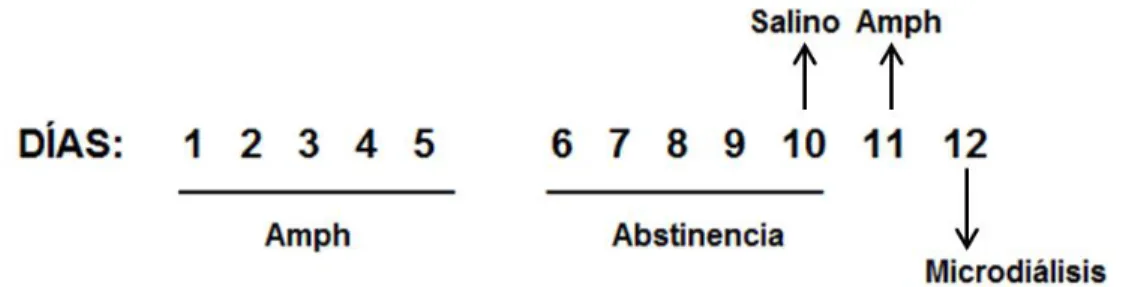
(27) de administración repetida de AMPH se contemplan 5 días sin tratamiento con AMPH (abstinencia). El día 10 se les administró una inyección de suero salino i.p a todas las ratas para descartar que el efecto en la actividad locomotora sea consecuencia del estrés inducido tras la inyección. El día 11 se llevó a cabo la expresión, día en el cual se administra nuevamente la dosis de AMPH correspondiente (challenge dose). Se considera el desarrollo de la sensibilización conductual locomotora a AMPH cuando la rata logra aumentar ≥ 20% los cruces / 60 min en el día 5 en comparación con el día 1. Aquellos animales que sobrepasan el aumento ≥ 20% de los cruces / 60 min en el día 11 en comparación con el día 1, se dice que logran la expresión de la sensibilización conductual a AMPH, de acuerdo al criterio utilizado por Ball et al. (2010) [50].. Figura 3. Protocolo de sensibilización locomotora a anfetamina. El protocolo comienza con la administración de AMPH (1 mg/Kg) durante 5 días consecutivos (Días 1-5) a ambos grupos experimentales. Posterior a ese período los animales se mantuvieron durante 5 días sin tratamiento (abstinencia). El día 10 del protocolo se les administró a ambos grupos una inyección de suero salino. El día 11 se llevó a cabo la expresión de la sensibilización locomotora, siendo administrada una challenge dose de anfetamina (1 mg/Kg) a todos los animales. Por último el día 12 se realizó la microdiálisis no-net flux (NNF).. 17.
(28) d) Microdiálisis no-net flux. La técnica de microdiálisis permite la recolección de diversas moléculas pequeñas del espacio intersticial, entre ellas neurotransmisores como la DA. La clave del proceso involucra la inserción de una sonda que posee una membrana de diálisis semipermeable que permite el intercambio de solutos desde un área de mayor concentración a una de menor concentración [51]. Esta técnica permite recolectar sustancias de la solución externa o liberarlas a ésta. La microdiálisis NNF permite determinar la cantidad ganada o perdida de la sustancia de interés a través de la sonda. Lo anterior se logra mediante la perfusión de distintas concentraciones de la sustancia dentro de la solución perfundida. Mediante la microdiálisis NNF es posible estimar la concentración extracelular (Cext) y la fracción de extracción (Ed) que describe la concentración de dializado del analito en función de las variaciones en la concentración del analito perfundido controladas por el experimentador. En el caso particular de la microdiálisis realizada en este estudio la Ed representa una medida indirecta de la actividad del DAT [35, 52].. Cirugía realizada: Las ratas fueron anestesiadas con uretano 750 mg/kg i.p y colocadas en un aparato estereotáxico (Stoelting, Wood Dale, IL). El uretano fue elegido debido a su tiempo de vida media prolongado. El cráneo de la rata fue expuesto, y se perforó un agujero para poder insertar una sonda de microdiálisis (CMA 12 MD, longitud de membrana 2 mm) en el DLS. La sonda se bajó utilizando las siguientes coordenadas; +1,2 mm antero-posterior, + 3,6 mm medio-lateral y - 4,8 mm dorso-ventral bajo la duramadre relativo a bregma [53]. El día del experimento, se perfundió continuamente por 40 minutos el buffer Krebs RingerPhosphate (KRP: NaCl 120 mM, KCl 2,4 mM, CaCl2 1,2 mM, NaH2PO4 0,9 mM y Na2HPO4 1,4 mM, Ácido ascórbico 0,2 mM (pH 7,4)) a una velocidad de 2 μl / min usando una bomba de infusión Harvard (Dover, MA, 18.
(29) modelo 22), para lograr un equilibrio. Las muestras de perfusión (dializado) se recogieron cada 5 minutos en 2 µL de ácido perclórico (0.2 N) y fueron mantenidas en hielo (4 °C) hasta la determinación de DA usando HPLC acoplado con detección electroquímica. Transcurridos los 40 minutos iniciales se recolectaron tres muestras basales cada 5 minutos. Una vez recolectadas las muestras basales se procederá a la perfusión de distintas concentraciones de DA en orden aleatorio a través de la sonda insertada (5 nM, 10 nM, 20 nM, 40 nM DA) para determinar la concentración de dopamina extracelular (DAext) y la fracción de extracción (Ed). Después de un período de equilibrio de 30 minutos, se recolectaran cada 5 minutos, tres muestras por concentración en 2 µL de ácido perclórico (0.2 N) y mantenidas en hielo hasta la determinación de DA.. e) Histología. Posterior a la realización de la microdiálisis de ratas anestesiadas, se les extrajo el cerebro y fueron almacenados en una solución de paraformaldehído (PFA) al 4%. Lo anterior se llevó a cabo para poder identificar la postura de la sonda utilizada durante la microdiálisis en el núcleo cerebral de interés, específicamente en DLS. Los cerebros fueron colocados posteriormente por lo menos durante dos días en una solución con sacarosa al 30%. Mediante un criostato se obtuvieron cortes coronales cerebrales de 50 µm. Se utilizó cresil violeta 0,05% para teñir los cortes, los cuales fueron montados sobre un portaobjeto y observados en un microscopio (4x).. 19.
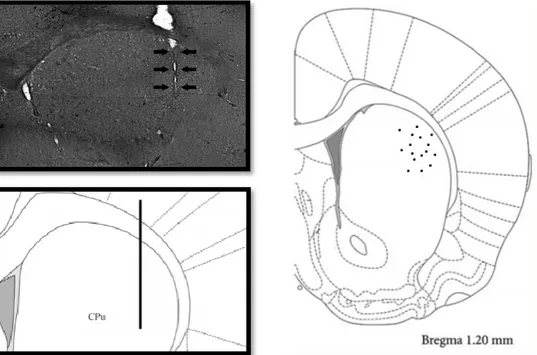
(30) Figura 4. Postura de sonda de corte coronal cerebral. La sonda de microdiálisis fue insertada en el DLS utilizando las siguientes coordenadas; +1,2 mm antero-posterior, + 3,6 mm medio-lateral y - 4,8 mm dorso-ventral bajo la duramadre relativo a bregma (Paxinos G. and Watson C, 2009). La imagen de la izquierda representa la postura de sonda real en el DLS (panel superior) y la representación esquemática de la postura de sonda (línea negra) en el panel inferior. La imagen de la derecha muestra la postura de sonda de cada rata, representadas como puntos. Los diagramas corresponden a adaptaciones de Paxinos and Watson. (2009) [53]. CPu: Caudado putamen.. 20.
(31) f) Análisis de muestras de dializado. Las muestras fueron recibidas en un tubo eppendorf conteniendo 2 uL de PCA 0.2N, doce microlitros fueron inyectados por medio de una válvula inyectora Rheodyne en un sistema de cromatografía líquida de alta eficiencia (HighPerformance-Liquid-Chromatography), HPLC, (BASi America, West Lafayette, IN, USA) configurada: una bomba (Jasco LC-Net II/ADC), una columna UNIJET TM LC (número de parte: MF-8954, BASi) y un detector amperométrico (LC4C, BASi America). La fase móvil contenía NaH2PO4 100 mM, EDTA 1.0 mM, Ácido octano-1-sulfónico sal sódica 1.0 mM y acetonitrilo al 3% (pH 3.0), y se bombeó a una velocidad de flujo de 700 µl / min. El potencial del detector amperométrico. se estableció. en 650 mV.. Bajo. estas condiciones. experimentales el tiempo de retención para DA fue de 6 minutos.. g) Análisis de los datos y análisis estadístico. Los datos obtenidos de la microdiálisis no-net flux se analizarán según lo descrito por Chefer et al. (2006) [54]. La cantidad de DA obtenida o perdida de la sonda durante la microdiálisis (Cin-Cout) se calculó para cada animal por cada concentración de perfusión de DA (Cin: 5, 10, 20,40 nM). El cambio neto en DA (Cin-Cout) se graficó contra Cin y se aplicó una regresión lineal. El punto cuando no se gana o se pierde DA (Cin-Cout = 0) representa una estimación de la DAext. La pendiente de la recta bajo regresión lineal corresponde a la Ed, que representa una medida indirecta de la actividad del DAT [52]. Los niveles de dializado basal de DA se calcularon para cada animal como el promedio de las tres muestras basales, previo a la administración de distintas. 21.
(32) concentraciones de DA (Cin = 0). La figura 5 muestra la gráfica obtenida mediante una microdiálisis no-net flux. Todos los análisis estadísticos se llevaron a cabo utilizando Prism 5.0. Software GraphPad, GraphPad Software Inc., San Diego, CA, USA. Los puntos de datos fuera del intervalo de confianza de 95% considerados como valores atípicos, podrán ser excluidos del análisis de datos. Todos los datos son expresados como media ± SEM. Los datos resultantes se analizaron mediante ANOVA de dos vías, ANOVA de una vía y prueba posterior de Bonferroni; prueba t pareada y no pareada cuando sea apropiado.. C in - C o u t [ n M ]. 40. 30. 20. 10. 0 10 -1 0. 20. 30. 40. C in [ n M ]. Figura 5. Representación gráfica de los datos obtenidos a partir de una microdiálisis no-net flux. El cambio neto en DA (Cin – Cout) se grafica contra Cin, aplicando una regresión lineal. La pendiente de la recta representa Ed, una medida indirecta de la actividad del transportador. La intersección con el eje de las abscisas (Cin – Cout = 0) indicada mediante la circunferencia roja representa una estimación de la concentración de DAext (nM). La intersección con el eje de las ordenadas (Cin = 0) representado mediante un círculo azul cuantifica la liberación basal de DA (nM).. 22.
(33) V.. RESULTADOS. a) El pretratamiento con nor-BNI no afecta la actividad locomotora inducida por la administración repetida de AMPH.. La evidencia indica que la administración de drogas como la AMPH causa una incremento exacerbado y progresivo de la actividad locomotora en animales de laboratorio [47] y su administración repetida facilita la liberación de DA en el NAc y en el estriado dorsal [55, 56]. Consistente con la capacidad de aumentar la transmisión dopaminérgica presináptica, las drogas de abuso administradas repetidamente aumentan la señalización del sistema kappa opioide endógeno y la expresión de DYN en el estriado [31]. Para determinar por ende el papel que juega la señalización DYN/KOR sobre la respuesta conductual asociada a la administración repetida de AMPH, se evaluó el efecto del pretratamiento con el antagonista KOR, nor-BNI, sobre la actividad locomotora horizontal en ratas tratadas repetidamente con AMPH. En la figura 6 se observa la actividad locomotora promedio recorrida por cada grupo experimental durante los días de duración del protocolo. Se evidencia como en ambos grupos existe un aumento de la actividad locomotora con el transcurso de los días luego de la administración repetida de AMPH. Durante el día 10 del protocolo se administró a ambos grupos una inyección de suero salino, evidenciando una declinación en la actividad locomotora en ambos grupos independiente del pretratamiento. Esta medida se lleva a cabo para descartar que el aumento de la actividad locomotora se vea afectado por el estrés post inyección o al mismo contexto ambiental en el que se desarrolla, variables que han sido documentadas como reforzantes de la conducta [57].. 23.
(34) De esta forma el aumento de la actividad locomotora a AMPH puede ser atribuido principalmente al efecto farmacológico de la droga. El análisis de datos se llevó a cabo mediante un test ANOVA de dos vías con las condiciones de tratamiento (salino vs nor-BNI) como la variable entre sujetos y los días (1-11) como la variable intra sujeto. Los resultados no revelaron efecto significativo entre grupos experimentales de acuerdo al tratamiento (F 1,14 = 2,365, p = 0,1463) e interacción (F 6,84 = 1,415, p = 0,2183). De acuerdo a los días (F. 6,84. = 15,49, p < 0,0001) se alcanzó una diferencia. significativa ya que dentro del análisis se incorporó la media ± SEM de la actividad locomotora alcanzada por cada grupo experimental monitoreada durante el día 10 del protocolo. Este día como se mencionó anteriormente, se les administró a todas las ratas, independiente del pretratamiento una dosis equivalente de suero salino, observándose una disminución considerable de la actividad locomotora en comparación a la administración de AMPH durante los otros días del protocolo (Fig.6). Estos resultados muestran que la neurotransmisión opioide kappa no contribuye al efecto hiperlocomotor inducido por la administración de AMPH.. 24.
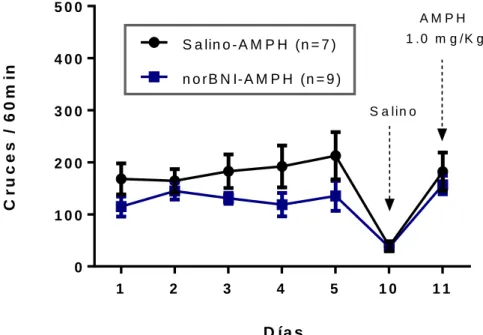
(35) 500. AMPH 1 .0 m g /K g. C r u c e s / 6 0 m in. S a lin o -A M P H (n = 7 ) 400 n o rB N I-A M P H (n = 9 ) 300. S a lin o. 200. 100. 0 1. 2. 3. 4. 5. 10. 11. D ía s. Figura 6. Curso temporal de la sensibilización locomotora a anfetamina. La figura muestra el curso temporal del número de cruces horizontales de ratas en respuesta a la administración de AMPH. Durante el protocolo se le administró a cada rata una dosis de 1 mg/Kg peso de AMPH por 5 días consecutivos (Día 1-5). Se contemplaron 5 días sin tratamiento (Días 6-10). El día 10 se le administró a cada rata una solución salina al 0,9%. Por último el día 11 cada animal recibió una challenge dose de AMPH. La actividad locomotora horizontal fue cuantificada durante 60 minutos inmediatamente después de cada inyección. Cada dato experimental representa la media ± SEM de 7-9 experimentos independientes. Los datos fueron analizados con un test ANOVA de dos vías y un test Benferroni post hoc considerando diferencias significativas cuando p˂0.05.. 25.
(36) b) El pretratamiento con nor-BNI modifica la dinámica dopaminérgica del DLS de ratas tratadas repetidamente con AMPH.. La señalización DYN/KOR se ha visto implicada en la progresión de la adicción a drogas [18, 58]. La adicción involucra una transición desde zonas ventrales (NAc) a zonas dorsales del estriado, estas últimas se correlacionan con respuestas condicionadas que resultan en hábitos, conduciendo en última instancia al consumo compulsivo de drogas [44]. La evidencia indica que la activación repetida de los KORs incrementa la liberación de DA en al NAc [40], sin embargo un posible tono endógeno de KOR sobre el DLS no ha sido completamente determinado, ni el efecto del bloqueo KOR sobre la recaptura de DA en el DLS. Con el objetivo de evaluar el efecto del bloqueo KOR sobre la dinámica dopaminérgica en el DLS de ratas tratadas repetidamente con AMPH, se llevaron a cabo experimentos de microdiálisis no-net flux en ratas anestesiadas. La técnica de microdiálisis cuantitativa o microdiálisis no-net flux, permite determinar la DAext y la Ed, una medida indirecta de la actividad del DAT. Además de cuantificar los niveles basales de DA, indicativos de la liberación basal de dicho neurotransmisor [35].. 26.
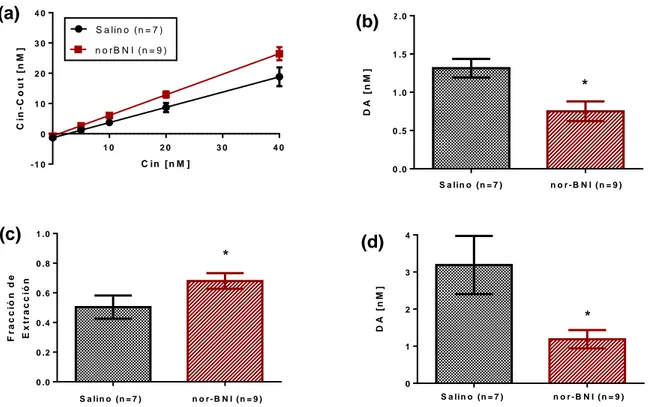
(37) b.1 Efecto de nor-BNI sobre la liberación basal de DA en el DLS. El dializado basal obtenido como el promedio de las muestras basales previo a la perfusión de las distintas concentraciones de DA, representa una medida de la liberación basal de DA. Este parámetro es obtenido mediante la figura 7a como la intersección con el eje de las ordenadas (Cin=0). De acuerdo a lo expuesto en la figura 7b, existe una diferencia significativa entre la liberación basal de DA obtenida del grupo salino-AMPH vs la obtenida del grupo nor-BNIAMPH (Grupo salino-AMPH: 1,314 ± 0,1219 nM; n=7 vs. Grupo nor-BNIAMPH: 0,7517 ± 0,1297 nM; n=9; p < 0.05 de acuerdo a un t-test no pareado de dos colas). Los resultados indican que el pretratamiento con nor-BNI disminuye la liberación basal de DA inducida por la administración repetida de AMPH.. b.2 Efecto de nor-BNI sobre la Ed en el DLS. Las pendientes de la recta bajo regresión lineal obtenidas (Fig.7a.) son interpretadas como la fracción de extracción (Ed), la cual representa una medida de la recaptura de DA por parte del DAT para cada grupo experimental. La figura 7c muestra que el pretratamiento con nor-BNI de manera sistémica se acompaña de un incremento significativo en la Ed en comparación al grupo control salino. (Grupo salino-AMPH: 0,5038 ± 0,07819; n=7 vs. Grupo nor-BNIAMPH: 0,6799 ± 0,05296; n=9; p < 0.05 de acuerdo a un t-test no pareado de una cola). Los resultados anteriores sugieren que la recaptura de DA por el DAT en el DLS se ve aumentada tras el bloqueo de los KORs en el contexto de administración repetida de AMPH.. 27.
(38) b.3 Efecto de nor-BNI sobre la DAext en el DLS. La DAext, corresponde a la cantidad de DA del espacio extracelular cuando los procesos de liberación y recaptura están en equilibrio. La intersección de la recta con el eje de las abscisas (Cin-Cout=0) de la figura 7a representa la DAext para cada grupo experimental. De acuerdo a lo expuesto en la figura 7d, el grupo experimental que recibió un pretratamiento con nor-BNI muestra una menor DAext en comparación con el grupo salino, siendo esta diferencia significativa (Grupo salino-AMPH: 3,189 ± 0,7832 nM; n=7; vs. Grupo nor-BNIAMPH: 1,188 ± 0,2478 nM; n=9; p < 0.05 de acuerdo a un t-test no pareado de dos colas). Lo anterior sugiere que el bloqueo de los KORs se acompaña de una menor DAext en el DLS tras el tratamiento repetido con AMPH.. 28.
(39) (a). 40. (b). S a lin o ( n = 7 ) n o rB N I (n = 9 ). 1 .5. D A [n M ]. C in - C o u t [ n M ]. 30. 2 .0. 20. 10. *. 1 .0. 0 .5. 0 10. 20. 30. 40. C in [ n M ]. -1 0. 0 .0 S a lin o (n = 7 ). (c). 1 .0. *. 4. D A [n M ]. 3. E x t r a c c ió n. 0 .6. 0 .4. S. a. li. n. (n. o. =. 7. ). n. o. rB. N. I. (n. =. 9. 2. ). *. 1. 0 .2. 0 .0. 0 S a lin o (n = 7 ). 7. ). S a lin o (n = 7 ). n o r-B N I (n = 9 ). =. 9. n o r-B N I (n = 9 ). ). o. n. a. li. rB. n. N. o. I. (n. (n. =. =. 7. 9. ). ). = n Figura o (7. DinámicaN I ( n dopaminérgica en el DLS de ratas tratadas il n a repetidamente conn o r BAMPH, que recibieron pretratamiento con nor-BNI o S salino. Resultados obtenidos de la microdiálisis no-net flux in vivo en animales anestesiados (Grupo salino= 7 vs Grupo nor-BNI=9). Los datos corresponden a la media ±SEM. (a) Representación de la ganancia o pérdida promedio de DA (Cin-Cout) hacia o desde las distintas concentraciones de DA perfundidas y el ajuste de regresión lineal de los datos obtenidos en la microdiálisis no net flux para cada grupo experimental. La pendiente de las recta representa la Ed. La intersección con el eje de las ordenadas (Cin=0) corresponde a la liberación basal de DA obtenida como el promedio de las concentraciones basales recolectadas al comienzo de la microdiálisis. El punto en el que no se gana ni se pierde DA de las concentraciones de DA perfundidas (Cin-Cout=0) representa una estimación de la DAext. (b) Liberación basal de DA expresada en [nM]. *p˂ 0.05 comparado con grupo salino de acuerdo a un t-test no pareado de dos colas (c) Fracción de extracción (Ed). *p˂ 0.05 comparado con grupo salino de acuerdo a un t-test no pareado de una cola. (d) Concentración extracelular de DA (DAext) expresada en [nM]. *p˂ 0.05 comparado con grupo salino de acuerdo a un t-test no pareado de dos colas.. S. F r a c c ió n d e. 0 .8. (d). n o r-B N I (n = 9 ). 29.
(40) DISCUSIÓN. En este trabajo se evaluó el efecto del pretratamiento con nor-BNI en la dinámica dopaminérgica del DLS en ratas tratadas repetidamente con AMPH. Los resultados obtenidos muestran que la administración sistémica de nor-BNI previo al tratamiento repetido con AMPH se acompaña de una disminución en la concentración extracelular de DA en el DLS. Esta disminución de la concentración extracelular de DA se explica por un incremento en Ed y una disminución en la liberación basal de DA. Los resultados sugieren que la activación endógena de los KORs estaría contribuyendo al incremento de la neurotransmisión dopaminérgica en el DLS que se observa después de la administración repetida de AMPH. Por otro lado, el pretratamiento con nor-BNI no modificó la actividad locomotora horizontal inducida por la AMPH con respecto al grupo con pretratamiento salino.. a) El antagonismo kappa opioide y su implicancia en el proceso adictivo. La señalización DYN/KOR ha sido asociada con la fisiopatología y progresión de la adicción a drogas [18, 58]. En sus inicios los agonistas KOR fueron investigados ya que de manera similar a los agonistas mu opioide (MOR), ejercen propiedades antinociceptivas, pero con menos potencial de abuso que estos últimos. La pentazocina, un fármaco antagonista MOR y agonista parcial KOR, fue producto de la investigación dirigida a desarrollar un analgésico con menor potencial adictivo [59]. Sin embargo altas dosis de este fármaco mostraron efectos psicotomiméticos y disfóricos en los pacientes. Dado los efectos negativos de los agonistas KOR sobre el estado anímico, los esfuerzos para el desarrollo de éstos en el tratamiento del dolor se detuvieron [60]. En. 30.
(41) línea con la evidencia antes mencionada se ha reportado que el aumento la actividad del sistema DYN/KOR se posiciona como un factor que contribuye a la intensificación de los estados emocionales negativos desarrollados por los individuos durante el síndrome de abstinencia a drogas [46]. En este sentido la administración de un antagonista KOR constituye una posible alternativa farmacológica en el tratamiento de la adicción. La evidencia preclínica ha mostrado que el uso previo de un antagonista KOR de corta duración, en animales expuestos a un protocolo de autoadministración crónico de cocaína, logró reducir efectos depresivos y ansiosos luego de la última dosis de la droga [30]. El bloqueo KOR también ha sido relacionado a otras conductas propias del síndrome de abstinencia, como la anhedonia, la cual puede ser evaluada a través de un método conocido como autoestimulación intracraneal (ICSS). Este método mide la sensibilidad a la recompensa a través de la administración de pulsos eléctricos breves en estructuras cerebrales del sistema dopaminérgico mesolímbico. Un animal con mayor sensibilidad a la recompensa responderá a estímulos eléctricos menos intensos, por lo que los umbrales reducidos reflejan un estado hedónico, mientras que los umbrales elevados de ICSS reflejan la anhedonia [61]. En esta línea, los resultados de Chartoff et al. (2012), mostraron que la administración de nor-BNI intracerebral antes de comenzar el régimen de administración repetida de cocaína logra atenuar la anhedonia inducida por la abstinencia en ratas, medido como una disminución del umbral de auto estimulación intracraneal. Sin embargo, la administración de nor-BNI una vez que el consumo de cocaína ya había comenzado no logró atenuar la anhedonia producida durante la abstinencia. Los autores proponen que los antagonistas KOR pudiesen ser efectivos para tratar individuos adictos de manera profiláctica que se encuentran en alto riesgo de recaída pero que no han desarrollado aún los síntomas del síndrome de abstinencia [27].. 31.
(42) Al igual que la anhedonia, el estrés también ha sido identificado como un factor que contribuye a la recaída luego de un periodo de abstinencia [62]. Se ha demostrado que JDTic, un antagonista KOR, atenúa el restablecimiento de la búsqueda de cocaína en ratas sometidas a un shock eléctrico en las patas después de un periodo de abstinencia. Los autores proponen por ende, que este antagonista logra reducir la posibilidad de recaída inducida por estrés [63]. En síntesis, considerando que la abstinencia temprana constituye una etapa del proceso adictivo en la cual la señalización kappa opioide se encuentra aumentada, las investigaciones se han dirigido al uso de antagonistas KOR para aliviar los síntomas negativos desarrollados cuando el acceso a la droga es restringido. En este trabajo indagaremos en la posible contribución de los KORs desde el inicio del proceso adictivo, determinando las consecuencias del bloqueo de estos receptores sobre la dinámica dopaminérgica en el DLS antes de comenzar la administración repetida de AMPH.. b) El pretratamiento con nor-BNI modifica la dinámica dopaminérgica del DLS de ratas tratadas repetidamente con anfetamina.. La administración repetida de drogas como la AMPH y otras drogas de abuso producen cambios profundos y muchas veces de larga duración sobre la neuroquímica cerebral, entre estos cambios neuroplásticos se puede mencionar la activación del sistema kappa opioide endógeno. El aumento de la expresión del precursor de DYN en el estriado ha sido observado luego de la exposición aguda y repetida a AMPH [31]. También se observan aumentos en la expresión de PDYN en le estriado en respuesta a otros psicoestimulantes, opiáceos, nicotina y etanol [64, 65, 66, 67]. Se ha propuesto a la activación del sistema DYN/KOR como un mecanismo que contrarresta el aumento de la liberación de DA inducida por la droga. En este sentido estudios. 32.
(43) en cultivos estriatales indican que la unión de la DA al receptor D1 presináptico promueve la síntesis de DYN, a través de la fosforilación del factor de transcripción CREB [33]. La activación de CREB, a partir de lo reportado por diversos estudios, incrementa con el uso habitual de la droga, sugiriendo la participación del sistema kappa opioide en etapas más avanzadas de la adicción [68]. La modulación del sistema kappa opioide sobre la dinámica dopaminérgica estriatal en animales naive ha sido ampliamente estudiada, aunque con resultados aparentemente contradictorios. La activación aguda de los KORs se acompaña de una disminución de la liberación de DA en el NAc y en el estriado dorsal [24, 37]. Por otro lado el bloqueo agudo de los KOR resulta en un aumento de la liberación basal de DA en el NAc [36]. Consistente con la evidencia anterior, un estudio reciente de nuestro laboratorio demostró que la administración sistémica y local de nor-BNI en el DLS se acompaña de un aumento de la liberación basal de DA en dicha zona cerebral [69]. Estos hallazgos sugieren la presencia de un sistema kappa opioide endógeno que regula la liberación basal de DA en el estriado, tanto ventral como dorsal. En cuanto al control ejercido sobre la recaptura de DA, la evidencia indica que la activación aguda de los KORs por agonistas sintéticos como U-69593 se acompaña de un incremento en la recaptura de DA en el NAc [38]. Contrario a lo observado después de la administración aguda de los KORs, la activación repetida de estos receptores se acompaña de un incremento de la neurotransmisión dopaminérgica. En este sentido la evidencia ha mostrado que la activación repetida de los KORs con el agonista U-69593, induce una aumento de la liberación de DA estimulada por depolarización en el NAc [40] como por aquella liberación inducida por la AMPH o cocaína en dicho núcleo cerebral [41, 42].. 33.
(44) Esta facilitación de la liberación de DA estimulada, ya sea por depolarización o. por. la. intervención. farmacológica,. puede. ser. explicada. por. la. desensibilización de alguno de los mecanismos inhibitorios pre-sinápticos presentes en el NAc tales como los propios KORs o los autorreceptores D2. Sin embargo, de acuerdo a lo demostrado por Fuentealba et al. (2006), es posible descartar que el aumento de los niveles extracelulares de DA tras la administración. repetida. del. agonista. KOR. se. produzca. por. una. desensibilización de los KORs, ya que los resultados indican que el pretratamiento repetido con U-69593 no modifica el efecto inhibitorio agudo del agonista administrado localmente en el NAc. Este mismo estudio mostró que el tratamiento repetido con U-69593, se acompaña de una atenuación del efecto inhibitorio de Quinpirol, un agonista D2, sobre los niveles extracelulares basales y estimulados por depolarización en el NAc [40]. De manera similar otro estudio mostró que la activación repetida de los KORs también reduce el efecto inhibidor de Quinpirol en los niveles extracelulares de DA en el estriado dorsal [70]. De acuerdo a lo anteriormente expuesto, se sugiere que una disminución del tono inhibitorio D2 presináptico subyacería a la facilitación de la liberación de DA tras la activación repetida de los KORs en el estriado. Ha sido ampliamente reportado que la administración de psicoestimulantes como la AMPH y la cocaína de manera repetida induce un aumento de la liberación basal de DA en el NAc y en el estriado dorsal [55, 56,71]. Hallazgos previos de nuestro laboratorio, muestran un incremento en la liberación de DA en el DLS en animales tratados repetidamente con AMPH en comparación con el grupo control [69]. Consistentemente, los resultados obtenidos en nuestro estudio revelan un aumento de la liberación basal de DA en el DLS (Fig.7b) en el grupo que recibió pretratamiento con solución salina., confirmando que el tratamiento repetido con AMPH facilita la liberación de DA en el DLS. Cabe entonces preguntarse si la activación repetida del sistema kappa opioide como. 34.
(45) ocurre después de la administración crónica de una droga estaría contribuyendo a este aumento en la liberación de DA en el DLS. En esta línea Azócar et al. (2019) evaluó el efecto de la administración de norBNI sobre la liberación de DA en el DLS posterior a la administración repetida de AMPH durante el periodo de abstinencia. Los resultados mostraron que la perfusión local de nor-BNI en el DLS se acompaña de una atenuación de la liberación basal de DA en dicha zona cerebral en ratas tratadas previamente con dosis repetidas de AMPH [69]. Los resultados obtenidos en nuestro estudio mostraron de forma similar una disminución de la liberación basal de DA en el DLS (Fig.7b) en aquel grupo tratado repetidamente con AMPH pero que recibió como pretratamiento sistémico nor-BNI. En conjunto los resultados son sugerentes de que el sistema kappa opioide estaría contribuyendo a la facilitación de la liberación de DA en el DLS inducida por la droga, desde las primeras exposiciones a ésta. El efecto de la activación de los KORs sobre la liberación de DA es indicativo de la acción de los KOR en la terminal de las neuronas DA, tal como lo muestra la evidencia neuroanatomica de Svingos et al. (2001) [39]. En esta misma línea además se evidenció que la activación KOR inhibe la liberación de DA desde sinaptosomas estriatales [72]. Sin embargo la activación de los KORs no solo controla la liberación axonal de DA, sino que también la liberación somatodendrítica [20]. La liberación de DA a nivel somatodendrítico promueve la unión de este neurotransmisor a los receptores dopaminérgicos D2 que son del tipo inhibitorio, generando lo que se conoce como corrientes postsinápticas inhibitorias (IPSC). La activación de los KORs induce una disminución del efecto inhibitorio D2 asociado a una diminución de la liberación de DA somatodendrítica [20]. De acuerdo a los antecedentes presentados se sugiere que, el efecto inhibitorio sobre la liberación basal de DA ejercida por la activación aguda de los KOR podría ser explicada por la actividad de los KORs ubicados en la 35.
(46) terminal de las neuronas dopaminérgicas. En el caso del efecto facilitador de la liberación de DA que subyace a la activación repetida de los KORs puede explicarse mediante la activación de estos receptores ubicados en los terminales DA mesocorticolímbicos [40] como también por aquellos presentes a nivel somatodendrítico; la activación repetida de los KORs en la sustancia nigra mantendría inhibida la liberación dendrítica de DA disminuyendo el tono inhibitorio D2. Además de ejercer un control sobre la liberación de DA, los KORs también podrían controlar la neurotransmisión dopaminérgica modificando la actividad del DAT. La evidencia neuroanatomica indica que los KORs y el DAT se encuentran co-localizados en los terminales dopaminérgicos estriatales [39], respaldando una posible interacción entre estos elementos. Se propone que el mecanismo por el cual los KORs contribuyen a la regulación de la actividad del DAT es mediado por la activación de la señal extracelular dependiente de la proteína quinasa ERK1/2. La administración de agonistas KOR, como la Salvinorina A, U-69593 y U-50488 aumentaron los niveles de ERK1/2, medidos como un aumento de la fosforilación de esta proteína en células que coexpresaban KOR y DAT, de acuerdo a lo expuesto por Kivell et al. (2014). Los resultados de este estudio además demostraron que, la administración de Salvinorina A aumenta la actividad del DAT en parte por la redistribución de este transportador a la superficie celular estriatal [73]. No obstante, existe evidencia que reporta que la activación aguda de los KOR por diversos agonistas [74, 75] no modifica la recaptura de DA por parte del DAT en el NAc. De forma opuesta de acuerdo a lo expuesto por Thompson et al. (2000), la activación aguda de KOR con el agonista U-69593, provocó un aumento de la recaptura de DA en el NAc. En este mismo estudio los resultados indicaron que la activación repetida de los KORs disminuye la recaptura de DA en el NAc, no así en el estriado dorsal [38]. Sin embargo, estudios realizados en nuestro laboratorio utilizando experimentos de. 36.
Figure

Outline
Documento similar
Al no observar una significante relación con el valor de p=0,165 (p>0,05) y correlación muy baja de r=0,071, se considera que no existe relación significativa entre
On Modeling and Parameter Es- timation of Brushless DC Servoactuators for Position Control Tasks.. Proceeding of the 17th
Cabe hacer hincapié en que nos encontramos en el orden de algo que se produce más allá de la voluntad, de ese dolor existencial que enmarca la vida de todo ser humano,
que hasta que llegue el tiempo en que su regia planta ; | pise el hispano suelo... que hasta que el
Para ello, trabajaremos con una colección de cartas redactadas desde allí, impresa en Évora en 1598 y otros documentos jesuitas: el Sumario de las cosas de Japón (1583),
En junio de 1980, el Departamento de Literatura Española de la Universi- dad de Sevilla, tras consultar con diversos estudiosos del poeta, decidió propo- ner al Claustro de la
Missing estimates for total domestic participant spend were estimated using a similar approach of that used to calculate missing international estimates, with average shares applied
The part I assessment is coordinated involving all MSCs and led by the RMS who prepares a draft assessment report, sends the request for information (RFI) with considerations,