Estudio ecológico de Mammillaria grahamii en una población del matorral Xerófilo del estado de Sonora
Texto completo
(2) Universidad de Sonora Repositorio Institucional UNISON. Excepto si se señala otra cosa, la licencia del ítem se describe como openAccess.
(3) FORMATO DE APROBACIÓN Los miembros del Comité de Tesis designado para revisar la Tesis de Jesús Arturo Bracamonte Terán la han encontrado satisfactoria y recomiendan que sea aceptada como requisito para obtener el Título de Licenciado en Biología con Opción en Recursos Naturales Terrestres.. Dra. Clara Tinoco Ojanguren Director de Tesis. Dr. Francisco E. Molina Freaner Sinodal Secretario. Dra. Maria Cistina Peñalba Garmendia Sinodal. M.C. Gilberto Solís Garza Suplente. ii.
(4) DEDICATORIA. Con mucho amor para mis padres: Por darme todo el cariño humanamente posible, por aceptar y apoyar cada una de las decisiones que he tomado, aunque no siempre fueran las mejores. Por darme las herramientas necesarias en la vida, pues sin sus regaños, ni sus correcciones, sin su amor y sin su disciplina no habría podido ser la persona de provecho que soy ahora. Gracias a su ejemplo y sus enseñanzas soy capaz de enfrentar cualquier adversidad.. A Angelita: Gracias, por todo el amor que me has dado, pues desde que apareciste en mi vida la has llenado de momentos inolvidables que de alguna u otra forma la han enriquecido. Gracias también por tu paciencia mientras me perdía en el inmenso mundo de la biología, mientras me ausentaba días y noches estudiando o viajando. Por tu amor y tu sinceridad, por escuchar y entender mi frustración, te agradezco todos los sacrificios que has hecho por mí y por hacer desaparecer mi cansancio y desesperación con tan solo tu sonrisa.. La paciencia es una planta de raíces muy amargas, pero de frutos muy dulces.. iii.
(5) AGRADECIMIENTOS A la Universidad de Sonora, especialmente al Departamento de Investigaciones Científicas y Tecnológicas, por el apoyo académico y profesional brindado durante el transcurso de mis estudios. Agradezco al CEES por permitirme realizar este trabajo dentro de sus instalaciones y área de reserva. Al Laboratorio de Ecología Molecular y Funcional del Instituto de Ecología de la Universidad Nacional Autónoma de México, pues sin el uso de sus instalaciones y equipo no hubiera sido posible la realización de este trabajo. Al Programa de Apoyo a Proyectos de Investigación e Innovación Tecnológica PAPIIT proyecto IN212914 por brindarme el apoyo económico para la realización de este trabajo, así como una beca tesis. A mi directora de tesis, la Dr. Clara Tinoco Ojanguren por confiar en mí desde un principio inclusive mucho antes de que esto fuera una tesis. Por alentarme a cada paso y ayudarme cada día a ser un mejor estudiante y profesionista. Por todo su apoyo, su tiempo y su paciencia muchas gracias. A mi comité de tesis: la Dra. María Cristina Peñalba Garmendia por brindarme su tiempo, sus valiosos consejos y observaciones cada vez que lo necesité. Al Dr. Francisco Molina y al M.C Gilberto Solís por sus enseñanzas a lo largo de mis estudios, por sus ánimos y buenos consejos durante la realización de este trabajo. A la Dra. María Esther Sánchez Coronado por brindarme su apoyo para la realización de uno de los ensayos de germinación. A José Fulgencio Martínez Rodríguez del Instituto de Ecología de la UNAM, por su valiosísimo apoyo en el trabajo de campo y laboratorio. A Anabel Margarita Díaz Martínez del Instituto de Ecología de la UNAM, por brindarme su ayuda en el manejo de las bases de datos y los análisis estadísticos. Al M.C Aldo Hiram Gutiérrez Saldaña del CIAD por sus enseñanzas y por haber sido parte de una de las etapas más bonitas de mis estudios. Al Dr. Carlos Lizárraga Celaya del Departamento de Física de la UNISON por depositar su confianza en mí y por alentarme a salir de mi zona de confort y hacer cosas nuevas. A la Biol. Ma. Cristina Meléndez Torres del CEDES Dirección General de Conservación, Vida Silvestre y CDC por apoyarme en la realización de mis Prácticas Profesionales y por encaminarme a una de las etapas más bonitas como profesionista.. iv.
(6) A la Ing. Rosa Lina León Borbón del CEDES Dirección General de Conservación, Vida Silvestre y CDC por ayudarme en la elaboración de algunos de los mapas que aparecen en este trabajo. A la M.I.E. Claudia Berenice Ramírez Yánez del Departamento de Letras y Lingüística por su gran disposición para ayudarme a culminar mis estudios. A Alina Santos, Andrea López, Adán Silva, Emiliano Mora y Sergio Terán por su gran amistad, sus valiosos consejos y asesorías. Siempre han sido un ejemplo para mí. A la Dr. Clara Tinoco Ojanguren, José Fulgencio Martínez Rodríguez, Anabel Margarita Díaz Martínez, Dulce Olivia Espinoza y Sergio Terán por estar conmigo a cada paso durante los muestreos de campo, por reírnos y cansarnos juntos. A mi mamá por su cariño y sus palabras de aliento, por enseñarme a esforzarme y dar el doble para alcanzar mis metas. A mi papá por ser siempre un ejemplo para mí de disciplina y puntualidad. Gracias a los dos por ser los mejores maestros que he tenido en mi vida. A Angelita por estar a mi lado a cada momento, por enseñarme a integrar y derivar, por aguantar mis ratos de mal humor y por esperarme siempre con una sonrisa durante los eternos viajes de campo. A los alumnos de estancias, que de alguna u otra forma me han ayudado. Gracias por cuidar y adoptar a mis hijitas. A mis amigos de Biología por hacer más amenas esas largas horas de escuela.. v.
(7) CONTENIDO FORMATO DE APROBACIÓN. ii. DEDICATORIA. iii. AGRADECIMIENTOS. iv. CONTENIDO. vi. ÍNDICE DE TABLAS. viii. ÍNDICE DE FIGURAS. ix. I. RESUMEN. 1. II. INTRODUCCIÓN. 2. III. ANTECEDENTES. 5. III.1. Las zonas áridas. 5. III.2. El Desierto de Sonora. 5. III.4. Las Cactáceas de Sonora. 6. III.5. Densidad y Estructura de poblaciones de cactáceas. 7. III.5.1. Densidad y Estructura de poblaciones de Cactáceas. 8. III.6. Asociación Nodriza. 9. III.7. Amenazas a las poblaciones. 10. III.8. El género Mammillaria. 11. III.8.1. Requerimientos para la germinación. 13. IV. JUSTIFICACIÓN. 16. V. HIPOTESIS. 17. VI. OBJETIVOS. 18. VI.1. Objetivo General. 18. VI.2. Objetivos Específicos. 18. VII. METODOLOGÍA. 19. VII.1. Sitio de Muestreo. 19. VII.2. Especie en Estudio. 20. VII.3. Abundancia y Densidad. 22. VII.4. Estructura de Tamaños. 22. VII.5. Patrón de Distribución Espacial. 22. VII.6. Cobertura vegetal. 23 vi.
(8) VII.7. Patrón de asociación. 23. VII.8. Análisis de regresión lineal. 24. VII.9. Determinación de los requerimientos abióticos de germinación. 24. VII.9.1. Requerimiento Luz. 25. VII.9.2. Requerimiento Agua. 25. VII.9.3. Requerimiento Temperatura. 25. VIII. RESULTADOS. 27. VIII.1. Abundancia y Densidad. 27. VIII.2. Estructura de Tamaños. 28. VIII.3. Patrón de Distribución Espacial. 29. VIII.4. Cobertura vegetal. 29. VIII.5. Patrón de asociación. 31. VIII.6. Análisis de regresión lineal. 33. VIII.7. Requerimientos abióticos de germinación. 34. VIII.7.1. Requerimiento de Luz. 34. VIII.7.2. Requerimiento de Agua. 36. VIII.7.3. Requerimiento de Temperatura. 39. IX. DISCUSIÓN. 42. IX.1. Abundancia y Densidad. 42. IX.2. Estructura de Tamaños. 43. IX.3. Patrón de Distribución Espacial y Patrón de Asociación. 44. IX.4. Requerimientos abióticos de germinación. 47. IX.4.1. Requerimiento de Luz. 47. IX.4.2. Requerimiento de Agua. 48. IX.4.3. Requerimiento de Temperatura. 49. X. CONCLUSIÓNES. 50. XI. LITERATURA CITADA. 51. ANEXO 1 Área del Centro Ecológico del Estado de Sonora quemada y Mammillaria grahamii quemada.. 59. ANEXO 2 Estudios ecológicos de especies pertenecientes al género 60. Mammillaria. vii.
(9) ANEXO 3 (Continuación) Estudios ecológicos de especies pertenecientes al género Mammillaria.. 61. ANEXO 4 Estudios de germinación de especies pertenecientes al género Mammillaria.. 62. viii.
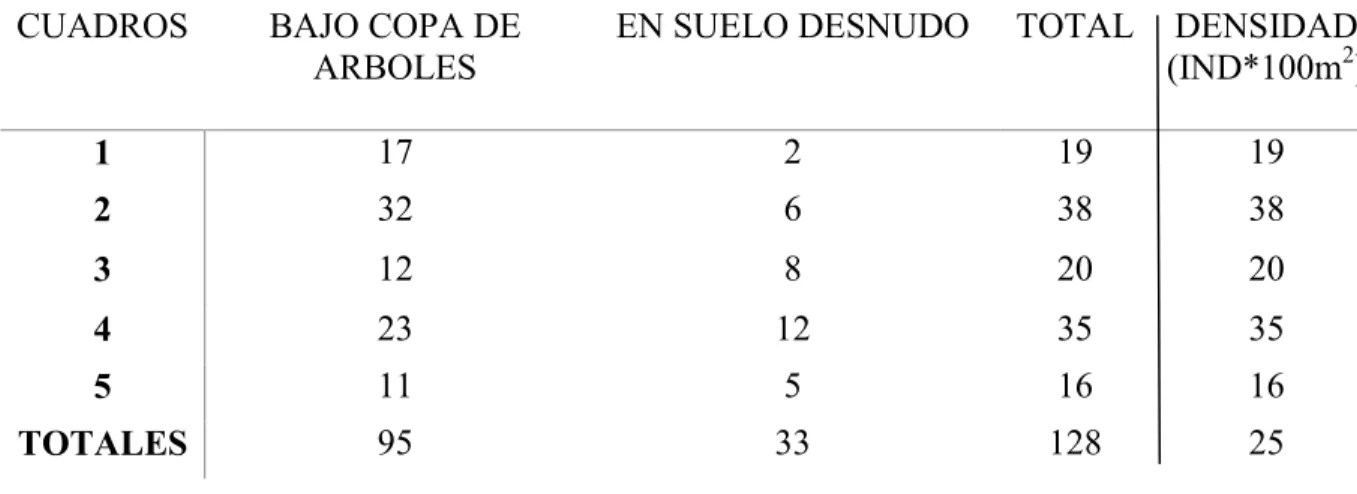
(10) ÍNDICE DE TABLAS. Tabla I. Número de individuos de Mammillaria grahamii creciendo bajo la copa de 27 algún árbol o arbusto o en suelo desnudo en cada cuadro de muestreo. Se muestra también el total de individuos por cuadro y la densidad.. Tabla II. Análisis de varianza (ANOVA). 33. Tabla III. Prueba de Wilcoxon para comparación de los parámetros de germinación 34 de los tratamientos de luz en semillas con y sin escarificar. DIG son los días para el inicio de la germinación.. Tabla IV. Prueba de Wilcoxon para comparación de los parámetros de germinación 37 en respuesta a los tratamientos de potencial osmótico. DIG son los días para el inicio de la germinación.. Tabla V. Prueba de Wilcoxon para comparación de los parámetros de germinación 39 en respuesta a los tratamientos de temperatura. DIG son los días para el inicio de la germinación.. ix.
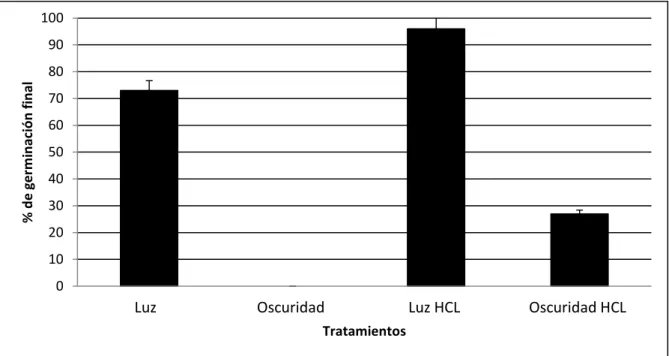
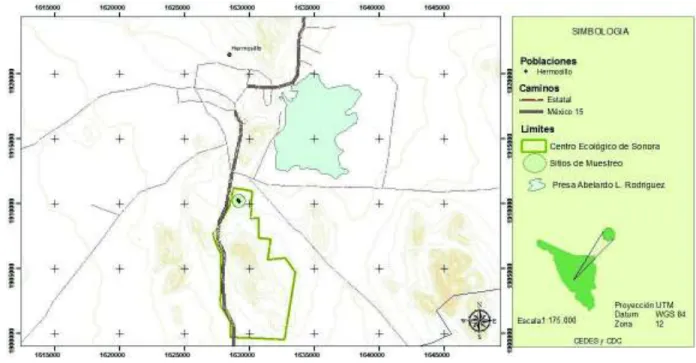
(11) ÍNDICE DE FIGURAS. Figura 1. Ubicación del Centro Ecológico Del Estado De Sonora, en Hermosillo,. 20. Sonora.. Figura 2. De izquierda a derecha, Mammillaria grahamii creciendo agrupada y. 21. solitaria. Figura 3. Espinas de Mammillaria grahamii. 22. Figura 4. Frutos de Mammillaria grahamii (A) y semillas (B). 22. Figura 5. Número de individuos de Mammillaria grahamii encontrados debajo. 30. de algún árbol o arbusto o en suelo desnudo en las diferentes categorias de tamaño: 1 a 2 tallos hasta más de diez tallos. Se presentan los datos del total del área muestreada en el sitio sin perturbación.. Figura 6. Porcentaje (%) de suelo desnudo y de cobertura total en el área no. 32. perturbada del muestreo. Se muestra también el porcentaje de cobertura correspondiente a cada especie en el área muestreada (500 m2).. Figura 7. Porcentaje (%) de suelo desnudo y de cobertura total en el área. 33. invadida del muestreo. Se muestra también el porcentaje de cobertura correspondiente a cada especie en el área muestreada (500 m2).. Figura 8. Se muestran de izquierda a derecha los individuos de Mammillaria grahamii observados y esperados creciendo bajo la copa de algún árbol o arbusto y los individuos observados y esperados creciendo en suelo desnudo.. x. 33.
(12) Figura 9. Individuos de Mammillaria grahamii observados en campo creciendo. 35. bajo la copa de las especies nodrizas y los individuos que se esperaría que estuvieran creciendo debajo de la copa de las especies nodrizas si la distribución fuera al azar.. Figura 10. Análisis de regresión entre el número de individuos de Mammillaria. 35. grahamii y el porcentaje de cobertura de las especies nodrizas.. Figura 11. Efecto de la luz y la escarificación con ácido clorhídrico (HCl) en el. 36. porcentaje de germinación final. Las barras representan la media ± D.E. N = 5.. Figura 12. Efecto de la luz y la escarificación en el tiempo (días) para el inicio de. 37. germinación. Las barras representan la media ± D.E. N = 5. Figura 13. Efecto de la luz y la escarificación en la tasa de germinación. Las. 38. barras representan la media ± D.E. N = 5.. Figura 14. Efecto de los diferentes potenciales osmóticos sobre el porcentaje de. 38. germinación final de las semillas de M. grahamii. Cada columna representa la X ± D.E. N = 5.. Figura 15. Efecto del potencial osmótico sobre el inicio de la germinación en las. 39. semillas de M. grahamii. Cada columna representa la X ± D.E. N = 5.. Figura 16. Efecto del potencial osmótico sobre la tasa de germinación en las. 40. semillas de M. grahamii. Cada columna representa la X ± D.E. N = 5.. Figura 17. Efecto de temperatura sobre el porcentaje de germinación final de Mammillaria grahamii. Cada barra representa la media ± D. E. N = 5.. xi. 41.
(13) Figura 18. Efecto de temperatura sobre el inicio de la germinación de. 41. Mammillaria grahamii. Cada barra representa la media ± D. E. N = 5.. Figura 19. Efecto de temperatura sobre la tasa de germinación de Mammillaria grahamii. Cada barra representa la media ± D.E. N = 5.. xii. 43.
(14) I. RESUMEN. Se presenta un estudio sobre la ecología y los requerimientos de germinación de una población de Mammillaria grahamii en el Matorral Xerófilo del Centro Ecológico de Hermosillo, Sonora. Los objetivos fueron: caracterizar la población en términos de abundancia, densidad, estructura de tamaños y distribución espacial, en áreas invadidas y no invadidas por buffel. Determinar los requerimientos abióticos para su germinación. Determinar si naturalmente existe una asociación de M. grahamii con especies nodrizas, y si existe alguna preferencia en esta relación, y determinar el grado de intensidad de esta asociación. Metodología: El número de individuos y su tamaño, así como su distribución espacial se determinó en 5 parcelas (réplicas) de matorral xerófilo natural de 2 x 10 m (total del área muestreada 500 m 2), y 5 parcelas del mismo tamaño, adyacentes, pero en una área invadida por zacate buffel. Para los ensayos de germinación, las semillas se sembraron en cajas de petri con agar al 1%, se sembraron 5 cajas (repeticiones) con 20 semillas por caja para cada tratamiento. Todos los tratamientos se colocaron en cámaras de germinación a 25°C, y la germinación se registró todos los días. Los resultados mostraron que la población de Mammillaria grahamii en el CEES, está conformada por individuos pequeños que se distribuyen de forma agregada en el espacio y su densidad se ve considerablemente disminuida en los sitios con presencia de zacate buffel. Las semillas son fotoblásticas positivas, su potencial osmótico óptimo para la germinación está entre -0.3 a -0.9 MPa y las temperaturas óptimas para la germinación están entre 20°C y 35°C. Se encontró una relación lineal positiva y estadísticamente significativa entre el número de individuos de M. grahamii con respecto al porcentaje de cobertura. Sin embargo se observan individuos creciendo fuera de las copas de los árboles, aunque en menor número.. 1.
(15) II. INTRODUCCIÓN. Una población se define como los individuos de una especie que cohabitan en una área determinada, que interaccionan entre sí y con otras especies, se reproducen y renuevan; estos últimos procesos mantienen las poblaciones en el tiempo (Sarmiento, 2001; Silvertown y Charlesworth, 2001). La ecología de poblaciones tiene como principal objetivo explicar y predecir las variaciones espacio-temporales en el número de individuos que conforman una población (Sarmiento, 2001; Silvertown y Charlesworth, 2001),. mediante el uso de. parámetros como la densidad y la estructura poblacional, los cuales nos ayudan comprender cómo están conformadas y el estado biológico actual en el que se encuentran.. La variación que presenta una población se expresa a través de cambios en la densidad, la distribución, el crecimiento, la reproducción y sobrevivencia; estos cambios son producto de las modificaciones que ocurren en el medio ambiente, y en la disponibilidad de los recursos. No todas las modificaciones actúan de manera negativa sobre las poblaciones, sin embargo, un factor que contribuye de manera importante al deterioro de las poblaciones es la perturbación de los hábitats (Godínez-Álvarez et al., 2003).. La perturbación o deterioro del hábitat se define como todos aquellos procesos que afectan de manera negativa el funcionamiento de la población, provocando la eliminación de especies y por tanto reducen la diversidad biológica. La pérdida de diversidad biológica es en gran parte el resultado de la fragmentación de los hábitats, pues aísla a las poblaciones reduciendo su tamaño poblacional, y poniendo en riesgo la viabilidad de las especies; la contaminación ambiental afecta la fisiología y la reproducción de las especies y la extracción y comercio ilegal de las especies ejerce una presión sobre la regeneración de las poblaciones (Sánchez et al., 2007; Aguilar, 2010; Plascencia et al., 2011.). 2.
(16) Las poblaciones de plantas en general son las que se ven más afectadas, principalmente aquellas que presentan un lento crecimiento, requerimiento de condiciones ecológicas o ambientales muy particulares o que son poco resilientes. Aquellas especies con distribución amplia son menos vulnerables a la extinción que aquéllas con distribución restringida, o que se distribuyen en pequeños parches (Rabinowitz, 1981). Actualmente en Sonora el incremento en actividades antropogenicas como el cambio de uso de suelo para la agricultura y/o ganadería, así como la introducción de especies exóticas han contribuido significativamente a la perturbación de las poblaciones, incluyendo las de cactáceas (Van Devender, 2010).. En México, la familia cactaceae es particularmente importante, pues es exclusiva del continente americano, y cerca del 37% de las especies están solo en México. Además, muchas especies han sido utilizadas en prácticas religiosas, medicinales, alimenticias y de ornamentación (Bravo Hollis, 1991; Arias 1997). El género de cactáceas con más especies en peligro de extinción es el de Mammillaria (Bravo Hollis, 1991), el cual no ha sido muy estudiado, pero cuenta con especies importantes ecológica y comercialmente. Este género se compone de aproximadamente 306 especies y presenta un alto grado de endemismo en México (Hernández y Godínez, 1994; Villaseñor, 2004); también es uno de los más llamativos por la forma de sus tallos y sus flores conspicuas. Las especies de este género se distribuyen sobre la mayor parte del territorio mexicano, principalmente al sur y centro de la república y en la zona noroeste (Flores-Martínez y Manzanero-Medina, 2010).. Para Sonora se estima un aproximado de 21 especies de Mammillaria de las cuales 12 se encuentran enlistadas en la Norma Oficial Mexicana (NOM-059-2010) (Paredes Aguilar et al., 2000; Molina-Freaner y Van Devender, 2010; Diario Oficial de la Federación, 2010). Sin embargo el estado actual de sus poblaciones en Sonora no está bien documentado, ya que no hay estudios sobre la biología de las especies, ni de la ecología y genética de sus poblaciones, ni de los efectos de las presiones antropogénicas en sus hábitats y poblaciones (Groom et al., 2006). El desarrollo de estos estudios es de suma importancia pues a partir de ellos se pueden entender los factores que afectan negativamente estas poblaciones además de contribuir al conocimiento sobre el estatus de las especies, y de esta manera poder lograr una conservación efectiva. 3.
(17) Es importante estudiar no solo las especies que están en peligro, pues en Sonora existen más especies de las que no se sabe mucho sobre los aspectos ecológicos de sus poblaciones, sin embargo, su estudio permite obtener información útil para su manejo y la conservación de aquellas especies que se encuentran amenazadas. Es por eso que el presente estudio está enfocado al análisis de las poblaciones de Mammillaria grahamii bajo condiciones naturales con y sin invasión de zacate buffel, incluyendo las interacciones que pueda tener con otras especies vegetales (tanto nodrizas como exóticas). Se estudio también la germinación, con la finalidad de conocer sus requerimientos para germinar y establecerse, con miras a su restablecimiento en áreas perturbadas.. 4.
(18) III. ANTECEDENTES. III.I. Las Zonas Áridas. Las zonas áridas pueden definirse como aquellas regiones en donde la evapotranspiración potencial es muy superior a la precipitación y donde, además, esta última es extremadamente irregular (González-Medrano, 2012). No todas las zonas áridas son iguales, por lo que se utilizan estimadores para poder determinar qué tan árida es una región. Comúnmente se utiliza el índice de aridez, que consiste en la relación de la precipitación media anual (P) entre la evapotranspiración potencial media anual (PET) de un determinado lugar. Dependiendo de este valor (P/PET), las regiones pueden clasificarse en semiáridas (0.20-0.50), áridas (0.050.20) e hiperáridas (menor 0.05). (UNEP 1997; FAO 2004).. Los lugares con valores menores a 0.5 se les denominan desiertos y se ubican en los trópicos de cáncer y capricornio (Ezcurra et al., 2006). Se distribuyen de esa manera debido al patrón de circulación de los vientos tropicales (Células de Hadley), estos movimientos son de ascenso cerca del ecuador y de descenso en latitudes medias, lo cual provoca que en esas regiones la temperatura sea elevada (González-Medrano, 2012). Los desiertos en el mundo se encuentran localizados en África, Australia, Norte América, Sudamérica y Asia Central. En Norte América se encuentran el desierto de la Gran Cuenca, el desierto de Mohave, el desierto de Sonora, y el desierto de Chihuahua (Cutler et al., 2008).. III.2. El Desierto Sonorense. El Desierto de Sonora es el segundo desierto más grande de Norte América, con una extensión 260 000 km2 cubre más de la mitad del estado. Se extiende en dos tercios de la Península de Baja California así como en todas las islas del Mar de Cortés y abarca hasta los estados de Arizona y California en Estados Unidos (Martínez-Yrízar et al., 2010). Es considerado la zona más árida de México, pues las temperaturas más altas que se registran en los meses de junio y julio son de 50°C en la sombra y más de 70°C en la superficie del suelo. Sin embargo, la lluvia anual en el desierto de Sonora es 75 a 400 mm aproximadamente, convirtiéndolo en el desierto 5.
(19) más húmedo de Norte América (Phillips & Wentworth, 2000). Aproximadamente un 80% de la precipitación cae durante los meses de julio, agosto y septiembre y se caracteriza por ser de alta intensidad (lluvias torrenciales), mientras que el 20 % ocurre durante los meses de diciembre y febrero siendo una lluvia de larga duración y poca intensidad (Brito-Castillo et al., 2010). Esta última es particularmente importante para la vegetación, ya que al ser menos intensa puede llegar a infiltrarse a mayor profundidad en el suelo, lo que la hace disponible durante los periodos de sequía hasta las próximas lluvias (Phillips y Wentworth, 2000).. Debido a la baja disponibilidad de agua y a las condiciones extremas de temperatura, la vegetación va a estar conformada por plantas resistentes y/o tolerantes a estas condiciones adversas. Por esta razón las plantas han desarrollado características morfológicas, fisiológicas y de ciclo de vida que les permite sobrevivir a condiciones ambientales extremas, como los largos periodos de sequía y la alta salinidad del suelo. Las plantas xerófilas son tolerantes a la escasez del agua, las freatofitas por el contrario, no soportan la falta de agua por lo que poseen raíces profundas las cuales les permiten absorber humedad de los mantos freáticos, las halofitas soportan los altos niveles de salinidad. Algunas plantas llamadas suculentas han desarrollado estrategias para el almacenamiento de agua que se ve a simple vista, como en el caso de cactáceas; otras plantas disminuyen la pérdida de agua reduciendo la superficie transpiratoria, ya sea que posean hojas muy pequeñas (micrófilas) o tiren las hojas como respuesta a la falta de agua (caducifolias) (González-Medrano, 2012).. III.3. Las Cactáceas de Sonora. Las cactáceas son las plantas más representativas de los ecosistemas desérticos pues presentan características conspicuas que les permiten sobrevivir en estos ambientes (González-Medrano, 2012). Una de las estructuras fácilmente identificables en los cactus son sus tallos los cuales son suculentos y poseen costillas que les permiten expandirse para almacenar agua; además cumplen con las funciones de fotosíntesis y soporte (Márquez et al., 2013).. 6.
(20) Las características morfológicas de los tallos sirven de base para la identificación de las especies, pues su forma se puede relacionar directamente con un género o la especie. Podemos encontrar tallos cilíndricos, circulares, largos, con ramificaciones o sin ramificaciones (Ferocactus cylindraceus); tallos globosos o esféricos con ramificaciones simples o densamente ramificados (cespitosos), que se pueden relacionar con géneros como el de Mammillaria y Coryphantha, también podemos encontrar tallos aplanados lateralmente o cladodios (Opuntia, Epyphyllum) (Márquez et al., 2013).. Sonora cuenta con aproximadamente 107 especies de cactus y la mayoría son nativas de la región. Los géneros que podemos encontrar son Carnegiea, Coryphantha, Cylindropuntia, Echinocactus, Ferocactus, Grusonia, Lophocereus, Mammillaria, Opuntia, Pachycereus, Peniocereus, Pereskiopsis, Selenicereus, Stenocereus. (Paredes Aguilar et al., 2000; MolinaFreaner y Van Devender, 2010).. III.4. Densidad y Estructura de Poblaciones. Una población se define como los individuos de una especie que cohabitan en un área determinada, que interaccionan entre sí y con otras especies, se reproducen y renuevan; estos últimos procesos mantienen las poblaciones en el tiempo (Sarmiento, 2001; Silvertown y Charlesworth, 2001). Los parámetros que nos permiten describir una población y evaluar las condiciones en que se encuentra son: abundancia, densidad, estructura poblacional (como patrones de distribución de edades o tamaños), y distribución espacial; además de parámetros demográficos (Barbour et al., 1987) La abundancia se define como el número de individuos de la misma especie en un sitio particular. La densidad es el número de individuos por unidad de área. Esta información por sí misma es estática y no nos permite conocer la dinámica y el estado de las poblaciones, para lo que se necesita además datos sobre la estructura poblacional (Odum, 1972). La estructura poblacional es una representación de la frecuencia de edades o tamaños que permite estimar el estado biológico actual de una especie, reflejando indirectamente las oportunidades de reclutamiento y los riesgos de mortalidad a los cuales los individuos han sido expuestos, lo cual permite hacer inferencias sobre la dinámica poblacional de dicha especie 7.
(21) (Hutchings 1986; Barbour et al., 1987). Así, por ejemplo, diferentes poblaciones de una misma especie pueden presentar densidades poblacionales similares, pero estar conformadas por proporciones distintas de categorías de tamaño. Poblaciones con una distribución de edades (o tamaños que reflejen edades) con una frecuencia alta de individuos adultos (grandes) y sin jóvenes (pequeños), indica que no se están regenerando. En comparación, poblaciones que incluyen todas las categorías de edades, incluyendo individuos reproductivos y juveniles, nos indicarían que estas poblaciones no tienen problemas para regenerarse (Arvizu-Valenzuela, 2014).. La distribución espacial hace referencia al lugar que ocupan las especies en el espacio y la forma en que lo hacen, junto con mediciones de densidad, nos informa sobre la preferencia de hábitat, dinámica de competencia y distribución en microhábitats específicos. De acuerdo con Barbour (1987), existen tres tipos de distribución espacial: la aleatoria, la uniforme y la agregada: - La distribución aleatoria es aquella en la que los individuos de una población se localizan en el espacio independientemente de la distribución de los demás individuos. Este tipo de distribución indica que no hay interacciones de atracción o repulsión entre los individuos de la población, esto puede deberse a que los recursos son abundantes en el hábitat. - La distribución uniforme establece que los organismos están ubicados en el espacio de forma regular unos con otros. Este tipo de distribución indica que existen interacciones negativas entre los individuos de las poblaciones que no les permiten estar cerca entre sí; estas interacciones se dan generalmente cuando los recursos en el hábitat escasean, provocando competencia entre los individuos de las poblaciones. - La distribución agregada ocurre cuando los individuos de las poblaciones se juntan entre sí; este tipo de distribución indica que los recursos en el hábitat se encuentran concentrados en un lugar específico.. 8.
(22) III.4.1. Densidad y Estructura de Poblaciones de Cactáceas. Las cactáceas presentan ciclos de vida largos, lento crecimiento y un bajo reclutamiento de plántulas; al sumarse a estas características factores como la baja disponibilidad de agua y nutrientes en algunos ambientes, esto ocasiona tasas de crecimiento bajas (Godínez-Álvarez et al., 2004). Una tasa de crecimiento baja afecta directamente la reproducción, pues se sabe que la capacidad reproductiva aumenta en función del tamaño de los individuos (Godínez-Álvarez, 2003). Estas y otras características biológicas como requerimientos de condiciones ambientales específicas, como características del suelo, de luz, disponibilidad de agua y temperaturas para su germinación y establecimiento, provocan que sea una de las familias de plantas que se encuentra con mayor número de especies amenazadas y/o en peligro de extinción por perturbación de su hábitat (Hernández y Godínez, 1994).. III.5. Asociación Nodriza. En las poblaciones de cactáceas la distribución de sus individuos en el espacio muchas veces tiende a ser agregada. Este tipo de distribución puede ser un indicador de las interacciones que presentan las cactáceas con las rocas y/o con árboles o arbustos, creciendo bajo sus copas (Valiente-Baunet et al., 1991; Cody, 1993; Turner et al., 1996; Drezner, 2006). Estas interacciones les permiten de alguna manera minimizar los efectos adversos del medio ambiente favoreciéndolas con un microclima o microhabitat en donde pueden desarrollarse de pequeñas sin tanto estrés. Este fenómeno se conoce como nodricismo (Méndez et al., 2006).. Las plantas nodrizas al igual que las rocas modifican el ambiente, pues bajo sus copas o en las grietas las condiciones de temperatura y humedad son mucho más favorables que las del resto del entorno. En el caso de las plantas nodriza el intercambio de energía se da en la copa, disminuyendo en gran parte la radiación solar directa, y por lo tanto la temperatura del suelo bajo la misma; así se reduce también la pérdida de agua por evaporación; también sirven de protección contra depredadores (Valiente-Banuet y Ezcurra 1991; Nobel y Franco, 1988).. 9.
(23) No todas las especies de cactus requieren de nodriza para su germinación y establecimiento (Rodríguez y Ezcurra, 2000), depende de la magnitud e intervalo de variación de factores ambientales como la temperatura, la disponibilidad del agua y la intensidad de luz solar. En gradientes de aridez en Sonora, se observa con más frecuencia el nodricismo en la zona de mayor aridez (Tewksbury et al., 2001).. III.6. Amenazas a las Poblaciones. Debido a que no todas las especies. de cactus requieren de las mismas condiciones. ambientales y fisiológicas, las especies se distribuyen en hábitats específicos que les permitan sobrevivir. La especificidad del hábitat provoca que en la familia de las cactáceas se desarrollen altos niveles de endemismo, esto quiere decir que la distribución de una especie se limita a un ambiente geográfico reducido o restringido y no se encuentra en forma natural en otra parte. En México la familia de las cactáceas cuenta con 946 especies nativas y presenta un 82.6% de especies endémicas (Llorente y Ocegeda, 2008; Durand y Neyra, 2010).. Particularmente las zonas áridas son las regiones donde se tiene mayor número de especies endémicas, específicamente el Valle de Cuicatlán-Tehuacán (50%), el desierto Chihuahuense (28%) y la península de Baja California (23%) (Santos-González, 2010). Los altos niveles de endemismo, al sumarse con la destrucción de sus hábitats, provocan que sus poblaciones se reduzcan drásticamente y eventualmente desaparezcan (Hernández-Oria et al., 2006). Sonora cuenta con más de 100 especies de plantas endémicas de las cuales el 33.3% son herbáceas, el 34.6% son plantas leñosas y el 30.8% son suculentas (cactus y magueyes) (Van Devender et al., 2010).. Las características biológicas de las cactáceas y sus altos niveles de endemismo ocasionan que las poblaciones de cactáceas sean mucho más vulnerables a la perturbación de sus hábitats (Frankham, 1998; Morgan, 1999; Keith, 2000). Actualmente la familia de las cactáceas es una de las familias con mayor número de especies amenazadas debido a la destrucción de las áreas naturales y las colectas clandestinas (Jiménez-Sierra, 2011).. 10.
(24) La destrucción de las áreas naturales en Sonora se debe principalmente al cambio de uso de suelo, el aumento de la población humana y la urbanización (Van Devender et al., 2010). El cambio de uso de suelo ya sea para la agricultura y/o ganadería, además de los incendios forestales, son uno de las principales amenazas para las poblaciones de cactáceas pues se pierde parcial o totalmente su ecosistema, por la reducción de la cubierta vegetal y por la afectación del suelo (salinidad, reducción de infiltración, etc.) (Lambin et al., 1999). La introducción de especies exóticas como el zacate buffel (Pennisetum ciliare) para establecer praderas y su reciente invasión a ecosistemas naturales, afectan la supervivencia, la germinación y el establecimiento de las plantas nativas. Estudios del cactus columnar Pachycereus pecten-aboriginum en Sonora, revelan que las plántulas fueron incapaces de establecerse en las praderas debido a los altos niveles de mortalidad. Las principales causas de mortalidad fueron alta irradiación, que conlleva a la disminución en la disponibilidad de agua y el pisoteo del ganado (Morales-Romero y Molina-Freaner, 2008). El desmonte del matorral xerófilo para la construcción de granjas camaroneras, así como el desarrollo turístico en las playas de San Carlos y Bahía de Kino, ocasionan una profunda perdida en los hábitats de las cactáceas en Sonora (Van Devender et al., 2010). Además, la explotación comercial de las especies contribuye en menor escala a la destrucción o fragmentación de sus hábitats y disminución de sus poblaciones (Jiménez-Sierra, 2011).. El estado actual de las poblaciones de plantas en Sonora, principalmente de cactáceas, no está bien documentado, ya que no hay estudios ecológicos que permitan evaluarlo claramente. Según la NOM-059-2010, Sonora cuenta con 18 especies de la familia de las cactáceas que se encuentran en alguna categoría de riesgo: Echinocereus bristolii, E. laui, E. leucanthus, E. stoloniferus, E.subinermis, Echinomastus erectocentrus var. acunensis, E. intertextus, Ferocactus cylindraceus, Glanculicactus uncinatus, Mammillaria boolii, M. johnstonii, M. hertrichiana, M. marksiana, M. miegiana, M. saboae, M. thornberi var. yaquensis, Peniocereus greggii y P. marianus. El género con más número de especies amenazadas y/o en peligro de extinción es el de Mammillaria (Paredes-Aguilar et al, 2000; Van Devender et al., 2010; Diario Oficial de la Federación, 2010).. 11.
(25) III.9. El Género Mammillaria. Mammillaria es uno de los géneros de cactáceas más diversos y más llamativos por la forma de sus tallos y sus flores; sin embargo ha sido muy poco estudiado. Las especies de Mammillaria se distribuyen sobre la mayor parte del territorio mexicano. Sin embargo el mayor número de especies se registra al sur de la república, en los estados de Oaxaca (26), y Puebla (22), al centro en los estados de Hidalgo (20), Querétaro (28), Guanajuato (28), y San Luis Potosí (31) y al norte en los estados de Sonora (22), Chihuahua (14), Sinaloa (12), Tamaulipas (22) y Baja California sur (14) (Flores-Martínez y Manzanero-Medina, 2010).. A pesar de ser abundantes en ciertas regiones del país, el género presenta un alto grado de endemismo en México (Villaseñor, 2004). Los estados que presentan mayor grado de endemismo son Baja California sur (57%), Oaxaca (34%), Sonora (27%), Tamaulipas (27%) y Puebla (22%). Así mismo, es uno de los géneros que presenta mayor número de especies enlistadas en la NOM, los estados con más especies enlistadas bajo alguna categoría son Tamaulipas (50%), Oaxaca (46%), Puebla (45%), Baja California sur (42%) y Sonora (40%) (Flores-Martínez y Manzanero-Medina, 2010).. De los escasos estudios que se tienen acerca de las poblaciones de Mammillaria, pocos son tan completos como los de Navarro-Carvajal y Castillo-Campohermoso (2007), los cuales muestran valores muy bajos de establecimientos de plántulas así como de abundancia y densidad. Los valores bajos de establecimiento, abundancia y densidad de las poblaciones, se atribuyen a que muchas especies de Mammillaria muestran preferencia hacia un tipo de suelo, y requerimientos abióticos muy específicos para germinar y establecerse (Flores-Martínez et al., 2005). La preferencia hacia un tipo de sustrato y los requerimientos ambientales en rangos particulares provocan que los individuos de las poblaciones de Mammillaria se distribuyan espacialmente en patrones específicos. Por ejemplo Mammillaria pectinifera se encuentra en espacios abiertos y bajo nodrizas como resultado de una distribución al azar, mientras que M. carnea solo se encuentra bajo nodrizas presentando una distribución agregada (RodríguezOrtega y Ezcurra, 2000).. 12.
(26) Los patrones de distribución aleatoria y distribución agregada son muy comunes en las poblaciones de Mammillaria. Estos patrones de distribución son originados por las interacciones que presentan las especies de Mammillaria con otras especies de plantas y/o rocas. Para Mammillaria fraileana, una cactácea endémica de Baja California sur, estudios recientes de las poblaciones de esta especie revelan que crece únicamente en grietas o fisuras de las rocas y que la variación en su distribución y abundancia depende de la presencia y concentración de varios elementos en el sustrato tales como K, Si, Na, Nd, La, Ce, Zr, Nb, Y, y Rb (López et al., 2009). En cuanto a Mammillaria heyderii en estudios efectuados en poblaciones de Tamaulipas mostraron que solo es posible encontrar a esta especie de cactácea creciendo bajo la copa de algún arbusto o árbol y que presentó preferencia hacia el abrojo (Opuntia tunicata) y el mezquite (Prosopis laevigata), lo que significa que su abundancia y distribución se ven considerablemente afectadas con la disminución de alguna de estas plantas nodrizas (Muro Pérez et al., 2011).. Los estudios para Sonora, que muestren que las especies de Mammillaria presentan asociación con alguna planta o arbusto, son muy escasos, sin embargo existen observaciones como la de Paredes Aguilar et al. (2000) en donde describe a Mammillaria multidigitata, la cual es abundante en las laderas empinadas y rocosas del cerro San Pedro Nolasco, y crece asociada a Agave chrysoglossa y Echinocereus websterianus. Otra especie que describe es Mammillaria thornberi la cual considera vulnerable, se localiza al noroeste de Sonora en las planicies arenosas de Caborca y presenta asociación con Ambrosia deltoidea y Atriplex polycarpa (Paredes-Aguilar et al., 2000). Sin embargo se requieren estudios ecológicos de estas especies.. A pesar de las marcadas tendencias a tener distribución agregada y asociación positiva, existen registros de especies de Mammillaria que no presentan ninguna asociación ya sea con plantas o rocas, y que posiblemente, si se da esta asociación, no sea determinante para su establecimiento. Tal es el caso de Mammillaria lasiacantha (Rodríguez y Ezcurra, 2000). La asociación de algunas especies de Mammillaria a plantas nodrizas, depende de los requerimentos de temperatura, la disponibilidad del agua e intensidad de luz solar en los procesos de germinación y establecimiento (Valiente-Banuet y Ezcurra 1991).. 13.
(27) III.8.1. Requerimientos Para La Germinación. Las fases más críticas del ciclo de vida de las cactáceas son la germinación y el establecimiento, ya que factores abióticos (como el exceso de luz, temperaturas extremas y falta de agua) y bióticos (como altas tasas de predación de frutos, semillas y plántulas) pueden limitar estas fases. La producción de una alta densidad de semillas, incrementa la probabilidad de que se establezcan al menos unos pocos individuos (Méndez et al., 2006). No todas las cactáceas necesitan de las mismas condiciones abióticas para germinar, pues los requerimientos para la germinación de las cactáceas en general reflejan mucho del ambiente en donde se encuentren; para estudiar estos requerimientos se caracteriza principalmente la respuesta de germinación a las variables de luz, temperatura y disponibilidad de agua (Flores y Jurado, 2009; Sánchez-Soto, 2010).. Debido a que las semillas requieren estar en contacto físico con el agua para iniciar el proceso de germinación, las semillas de las cactáceas aprovechan los periodos de mayor precipitación en los desiertos. Algunas especies poseen inhibidores químicos en la testa, que se van lavando con el agua de lluvia, lo que les proporciona una manera de detectar las condiciones hídricas del ambiente y así aseguran la germinación en época de crecimiento. Cuando estas condiciones no se dan, las semillas pueden entrar en un periodo de latencia, esperando las condiciones adecuadas para germinar (Rojas Aréchiga y Vásquez-Yanes, 2000; Carbajal et al., 2008).. Después del agua, la luz es uno de los factores ambientales más importantes para la germinación pues permite detectar los sitios adecuados para establecerse, de acuerdo a sus requerimientos de sol o sombra, permitiendo el buen desarrollo de la plántula. No todas las semillas requieren luz para poder germinar pues algunas son inhibidas por este factor (fotoblásticas negativas), otras no germinan sin luz (fotoblásticas positivas) y unas pocas no se ven afectadas por la ausencia o la presencia de este factor (Vázquez-Yáñez et al., 1990; Flores y Jurado, 2009; Rojas-Aréchiga, 2013).. 14.
(28) La temperatura puede inhibir el proceso de germinación. En general las semillas de cactáceas presentan temperaturas óptimas para germinación entre 20-25°C, pero algunas especies pueden germinar a temperaturas relativamente bajas entre 10°C a 15°C, mientras que otras a temperaturas considerablemente altas entre 30°C a 35°C (Baskin y Baskin, 1998; Bradbeer, 1994, Rojas Aréchiga et al., 1997).. Los estudios sobre germinación y establecimiento de Mammillaria son escasos. Sin embargo se sabe que muchas de las especies son fotoblásticas positivas y en algunas especies la escarificación revierte los requerimientos de luz. Tal es el caso de Mammillaria zephyranthoides (Carbajal et al., 2008).. Por otra parte la disponibilidad de agua es muy importante, pues en estudios de M. hamata se observó que las semillas germinan sin necesidad de escarificación, pero que en general las plántulas mueren por deshidratación en zonas sin cubierta vegetal, mientras que en zonas con vegetación la germinación y establecimiento es mayor. Estos resultados sugieren un requerimiento de sombra que les permita crecer bajo condiciones de mayor disponibilidad de agua y temperaturas menos extremas (Castillo-Campohermoso et al., 2009).. 15.
(29) IV. JUSTIFICACIÓN. Mammillaria es el género de cactáceas mexicanas con más especies en peligro de extinción. Este género ha sido poco estudiado, a pesar de incluir especies importantes ecológica y comercialmente. En Sonora, se tienen 21 especies, una de estas especies es Mammillaria grahamii, de la que tampoco se cuenta con estudios ecológicos ni de poblaciones que proporcionen datos acerca de su biología y de las interacciones con la comunidad vegetal. Es por eso que el presente estudio está enfocado al análisis de las poblaciones de Mammillaria grahamii, su germinación y las interacciones con otras especies vegetales, tanto nodrizas como invasoras (zacate buffel), lo que permite contribuir con el conocimiento de esta cactácea para futuros planes de manejo y conservación entre otros aspectos.. 16.
(30) V. HIPÓTESIS CIENTÍFICA. Mammillaria grahamii germina y se establece bajo la protección de copas de árboles y arbustos u otro elemento físico como las rocas, que le brindan protección de condiciones ambientales extremas; por lo que la perdida de la cubierta vegetal disminuirá la densidad de su población. La respuesta de germinación a la luz, temperatura y potencial osmótico reflejará los requerimientos que le permiten germinar y establecerse en condiciones naturales.. 17.
(31) VI. OBJETIVOS. VI.1. Objetivo general. Determinar algunas variables ecológicas y fisiológicas de una población de Mammillaria grahamii bajo condiciones naturales sin invasión y con invasión de zacate buffel en el matorral xerófilo del estado de Sonora.. VI.2. Objetivos específicos Caracterizar la población de M. grahamii en términos de abundancia, densidad, estructura de tamaños y distribución espacial en una población del Centro Ecológico del Estado De Sonora, en áreas sin invasión por buffel y con invasión por buffel,. Determinar la cobertura vegetal de las especies en los sitios de muestreo. Determinar si naturalmente existe una asociación de M. grahamii con especies nodrizas, y si existe alguna preferencia en esta relación, determinar el grado de intensidad de esta asociación. Determinar los requerimientos abióticos para la germinación de la especie (luz, temperatura y potencial hídrico).. 18.
(32) VI. METODOLOGÍA. VI.1. Área de estudio. El estudio se realizó en el Centro Ecológico del Estado de Sonora (CEES), el cual es un parque natural que tiene como objetivo difundir y promover la cultura y valores ecológicos a través de la exhibición de especies nativas de flora y fauna del Estado. Se encuentra ubicado al sur de la ciudad de Hermosillo a 29 ° 01 'N; 110 ° 57' W; 245 m de altitud (Figura 1).. Figura 1. Ubicación del Centro Ecológico Del Estado De Sonora. Hermosillo, Sonora.. El CEES presenta un clima muy seco, donde los principales eventos de precipitación ocurren durante el verano. Las temperaturas medias anuales máximas y mínimas son de 22°C y 18°C respectivamente. El suelo está compuesto por granito (TeGr) del mesozoico, aluvión (Qhoal) del cuaternario y calizas (P Cz-Ar) del paleozoico; además presenta tres tipos de suelo: litosol, Yermosol y xerosol (Carta topográfica H12D41, Hermosillo, Sonora, 1975; Carta uso de suelo y vegetación H12-8, 1981).. 19.
(33) La vegetación del CEES es matorral xerófilo, con árboles de Olneya tesota y Parkinsonia microphylla como dominantes del estrato arbóreo incluye también especies arbóreas como Acacia willardiana, Bursera fagaroides, B. laxiflora, Jatropha cordata, Lysiloma divaricatum, Mimosa laxiflora y Stenocereus thurberi, entre otras; como dominante del estrato arbustivo se observa Encelia farinosa (Shreve, 1951; Turner y Brown 1982; Molina-Freaner y TinocoOjanguren, 1997). Sin embargo la invasión del área por zacate buffel (Pennisetum ciliare) en 1997, así como la disminución y perturbación del área debido al aumento de la población y urbanización a los alrededores del CEES, ha transformado significativamente la vegetación, principalmente de las planicies, la cual después de repetidos incendios producidos por el mismo zacate buffel se ha convertido en una comunidad dominada por P. ciliare (De la Barrera, 2008). VI.2. Especie estudiada. Mammillaria grahamii es un cactus globular pequeño, menor de 15 cm; los tallos pueden crecer solitarios o agrupados (Figura 2 y 3). Las espinas son delgadas y flexibles, con apariencia de cerdas o pelos, además su terminación es en forma de gancho (Figura 4). Las flores son de color rosa o rosa lavanda puede tener tonalidades purpuras o rojizas y a veces blanco. Los frutos son pequeños y tubulares, y su color típico es el rojo, crecen sobre la parte superior del cactus y son comestibles; poseen una alta densidad de semillas oscuras muy pequeñas (menos de un milímetro de diámetro) (Figura 5 y 6). Se distribuye ampliamente en Sonora, y parte de Arizona. Los Seris y los Pimas utilizan el tallo para curar dolor de oído y enfermedades respiratorias.. B. Figura 2. De izquierda a derecha, Mammillaria grahamii creciendo agrupada y solitaria. 20.
(34) Figura 3. Espinas de Mammillaria grahamii. A. B. Figura 4. Frutos de Mammillaria grahamii (A) y semillas (B). 21.
(35) Caracterización de la población de M. grahamii en áreas adyacentes sin invasión y con invasión de zacate buffel.- Para llevar a cabo este objetivo se determinó la abundancia, densidad, estructura de tamaños y distribución espacial de la población. El número de individuos y su tamaño se determinó en 5 parcelas (réplicas) de matorral xerófilo natural de 2 x 10 m (total del área muestreada 500 m2), y 5 parcelas del mismo tamaño, adyacentes, pero en una área invadida por zacate buffel.. VII.3. Abundancia y Densidad.- La abundancia se define como la cantidad de individuos que conforman una población. La densidad es el número de individuos que ocupa alguna unidad de espacio. Para cada cuadrante de los dos sitios de muestreo se determinó la abundancia y densidad de M. grahamii.. VII.4. Estructura de Tamaños.- Debido a que muchas especies que pertenecen al género Mammillaria presentan un crecimiento cespitoso (crecen en colonias o conglomerados que probablemente son producidos vegetativamente) y que el número de tallos por colonia que poseen los individuos es utilizado para determinar su tamaño, se establecieron categorías de número de tallos por colonia (de 1-2, 3-4, 5-6, 7-8 9-10 y más de 10 tallos) para determinar la estructura de tamaños que presentaron los individuos de M. grahamii en el área de muestreo.. VII.5. Patrón de Distribución Espacial.- Para determinar el patrón de distribución espacial de M. grahamii en el área de estudio se utilizó el índice de Hopkins (Krebs, 1999). Este índice se calcula con base en la selección de 100 puntos al azar donde se mide la distancia de cada punto al individuo más cercano de la especie estudiada (Xi), y la distancia del individuo de la especie estudiada a su vecino más próximo (ri). El resultado del índice determina si la distribución de la especie de estudio es al azar, agregada o uniforme. En caso de una distribución al azar la distancia entre el punto al azar y la planta más cercana es igual a la distancia entre vecinos. Por otra parte, si la distribución es uniforme la distancia entre el punto al azar y la planta más cercana es menor a la distancia entre vecinos, en caso contrario si la distribución es agregada la distancia del punto al azar y la planta más cercana es menor a la distancia entre vecinos.. 22.
(36) El índice de Hopkins se calculó como:. Una vez calculado el valor de H es necesario llevar a cabo una prueba de F donde Ho (hipótesis nula) supone una distribución al azar y Ha (hipótesis alternativa) una distribución no al azar. Para aceptar Ho el valor obtenido del estadístico tendría que ser menor a los valores críticos en = 0.025 y en = 0.75 en una tabla de distribución F, de no presentar una distribución al azar los parámetros para determinar una distribución agregada y uniforme son los siguientes: si el índice es mayor en = 0.025 es consistente con una distribución uniforme o si es mayor en = 0.75 es consistente con una distribución agregada (Badii et al., 2012).. VII.6. Cobertura vegetal.- Se identificó cada especie de árbol o arbusto encontrados en los 5 cuadrantes sin invasión de buffel y los 5 cuadrantes con invasión de buffel. Se midieron los diámetros mayor y menor de la copa de cada individuo que había en cada cuadrante, y se determinó el área utilizando la fórmula del área del círculo. Esta área fue tomada como la cobertura que presentó cada individuo. Para determinar la cobertura de cada especie se sumó la cobertura de cada individuo de la misma especie. Posteriormente se sumaron las coberturas de los individuos por cuadrante para determinar el porcentaje de cobertura que se presentó en cada cuadrante. El promedio de los porcentajes de cada cuadrante determinó el porcentaje de cobertura y suelo desnudo para cada sitio de muestreo.. VII.7. Patrón de asociación.- Para determinar si los individuos M. grahamii, en el área de estudio, se distribuyen por igual bajo la copa de árboles y/o arbustos y en espacios abiertos se utilizó el estadístico Ji cuadrada ( 2) (Krebs 1998). Este estadístico contrasta los datos observados y esperados de individuos creciendo bajo la copa de árboles y/o arbustos, con los individuos observados y esperados creciendo en suelo desnudo, si la distribución fuese por igual en estas dos categorías.. 23.
(37) El estadístico ji cuadrada sigue una prueba de hipótesis en donde Ho supone una dispersión al azar y Ha una dispersión no al azar, por lo tanto para rechazar Ho el valor obtenido del estadístico tiene que ser mayor o igual que el valor critico de ji cuadrada siguiendo n-1 grados de libertad.. En la fórmula Oi son los individuos observados, Ei los esperados creciendo bajo la copa de algún árbol o arbusto y en espacios abiertos. Para calcular los individuos esperados en las dos categorías, se establece la probabilidad de cuantos individuos se esperaría que estuvieran creciendo al azar bajo algún árbol o arbusto y en espacios abiertos tomando en cuenta el porcentaje de suelo desnudo y suelo con cobertura.. VII.8. Análisis de regresión lineal: Para probar que las variables X (% de cobertura de las especies) y Y (número de individuos de M. grahamii) tienen relación lineal se aplicó un análisis de regresión y posteriormente un análisis de varianza para comprobar si el modelo lineal proporciona un buen ajuste para los datos (Daniel, 1988). El análisis de varianza nos permite mediante una prueba de hipótesis determinar la significancia de la pendiente, donde Ho: 0 es constante y no depende de X y Ha: es diferente de cero (modelo lineal significativo).. VII.9. Determinación de los requerimientos abióticos de germinación.- Se colectaron frutos de más de 5 individuos en las parcelas de muestreo, se separaron las semillas, y se realizaron pruebas de germinación en condiciones controladas, incluyendo germinación en respuesta a la luz, temperatura y potencial osmótico. En general las semillas se sembraron en cajas de petri con agar al 1%, se sembraron 5 cajas (repeticiones) con 20 semillas por caja para cada tratamiento. Todos los tratamientos se colocaron en cámaras de germinación a 25°C, y la germinación se registró todos los días, considerando la protrusión de la raíz como parámetro indicativo de germinación.. 24.
(38) VII.9.1. Requerimientos de luz: Tratamiento sin luz.- Se colocaron 20 semillas sin escarificar en cada una de 5 cajas de petri (réplicas) con una base de agar al 1% (como soporte y suministro de humedad) y se envolvieron en una doble capa de papel aluminio. Tratamiento luz.- Se utilizaron 5 réplicas de 20 semillas pero no se obstruyó el paso de la luz con papel aluminio.. Debido a la existencia de aperturas en los frutos que se recolectaron y que estas aperturas aparentemente son producidas por algún animal, se exploró la posibilidad de escarificación química como un requerimiento para la germinación (Carbajal et al. 2008). Para escarificar las semillas se expusieron a HCL concentrado por un minuto y después se enjuagaron con agua destilada (Vázquez-Yáñez et al., 1990; Flores y Jurado, 2009; Rojas-Aréchiga, 2013). Para discernir entre los requerimientos de luz y escarificación se realizaron los siguientes ensayos: 10 réplicas de 20 semillas se escarificaron y se sembraron en cajas de Petri con agar, de estas 5 se envolvieron el papel aluminio, mientras que las otras 5 no se cubrieron. Los tratamientos con luz y sin luz, con y sin escarificación se colocaron en una cámara de germinación a 25°C.. VII.9.2. Requerimientos de agua: Para determinar los requerimientos de agua para la germinación de M. grahamii, se expusieron las semillas a soluciones de diferente potencial osmótico. Las soluciones se prepararon con polietilenglicol (PEG) disuelto en agua. Los potenciales osmóticos fueron: 0, -0.3, -0.6, -0.9, 1.2 y -1.5 MPa. Para cada tratamiento se tuvieron 5 réplicas de 20 semillas en cajas de Petri con la solución de PEG correspondiente. Todos los tratamientos se colocaron en cámaras de germinación a 25°C. Se registró la germinación todos los días.. VII.9.3. Requerimientos de temperatura: Para determinar la temperatura óptima y mínima de germinación de M. grahamii se germinaron las semillas en un gradiente de temperatura de 5, 20, 25, 30 y 35°C constantes y un tratamiento de temperatura alternada de 25/35°C, para este último tratamiento se sembraron 3 cajas de petri con 30 semillas cada una (Baskin y Baskin, 1998; Bradbeer, 1994). Todos los tratamientos de germinación se llevaron a cabo en cámaras de crecimiento (Lab-line 455 25.
(39) Instrument, In Lab, Mel Rose Park, Illinois), con lámparas fluorescentes de luz fría de 20 W (Sylvania, USA) con fotoperiodo 12/12 h de luz.. Los resultados de los diferentes ensayos de germinación se analizaron en base a los siguientes parámetros: días para el inicio de germinación, porcentaje de germinación final y tasa de germinación. Este último parámetro se derivó del ajuste de la germinación acumulada a una curva sigmoide utilizando Table Curve 2D Versión 3 (AINS, Software, Chicago IL, USA). Debido a que los datos no presentan los supuestos de normalidad y homogeneidad de varianzas a pesar de ser transformados, se optó por la prueba de Wilcoxon. Este estadístico mediante una prueba de ji cuadrada nos permite determinar si existen diferencias en los efectos que producen diferentes tratamientos.. 26.
(40) VIII. RESULTADOS. VIII.1. Abundancia y densidad. Se registró un total de 128 individuos de Mammillaria grahamii distribuidos en los cinco cuadrantes del área de muestreo donde no había zacate buffel; de los 128 individuos encontrados 95 estaban creciendo bajo alguna planta perenne mientras que 33 se ubicaron creciendo fuera de las copas de árboles (Tabla I). Por otra parte, se encontró un total de 7 individuos de M. grahamii distribuidos en los cinco cuadrantes del sitio de muestreo con presencia de buffel, de los cuales los 7 se encontraban creciendo bajo alguna planta perenne. La densidad promedio para el sitio sin perturbación fue de 25.6 ± 10.1 individuos/100 m2, con un rango de variación de 16-38 y una mediana de 20. Para el sitio con invasión de zacate buffel la densidad fue de 1.4 ± 3.1 individuos/100 m2, con un rango de variación de 0-7 y una mediana de 0.. Tabla I. Número de individuos de Mammillaria grahamii creciendo bajo la copa de algún árbol o arbusto o en suelo desnudo en cada cuadro de muestreo. Se muestra también el total de individuos por cuadro y la densidad.. CUADROS. BAJO COPA DE ARBOLES. EN SUELO DESNUDO. TOTAL. DENSIDAD (IND*100m2). 1. 17. 2. 19. 19. 2. 32. 6. 38. 38. 3. 12. 8. 20. 20. 4. 23. 12. 35. 35. 5. 11. 5. 16. 16. TOTALES. 95. 33. 128. 25. 27.
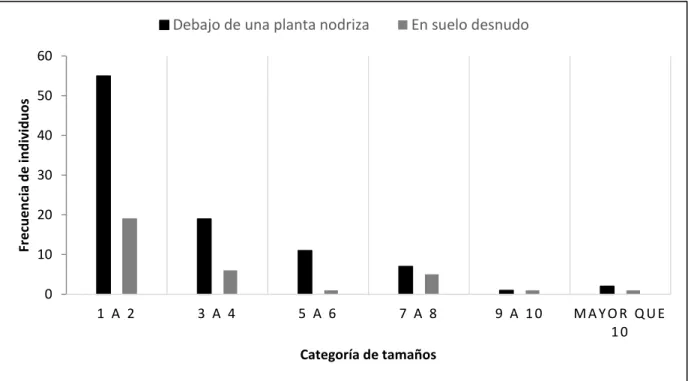
(41) VIII.2. Estructura de tamaños. Los individuos de M. grahamii se encontraron aislados o en conglomerados, esto último debido a que tienen crecimiento cespitoso, es decir que producen vegetativamente tallos a partir de su base (Figura 5). Los conglomerados fueron considerados como un individuo y su tamaño fue determinado por el número de tallos por individuo que los constituían. Los individuos solitarios fueron considerados los más pequeños y probablemente más jóvenes, y debido a que no estaban cerca de los conglomerados probablemente sean resultado de reproducción por semillas, aunque no se descarta la posibilidad de que se dispersara el tallo. La estructura de tamaños partiendo del número de tallos que presento cada individuo de M. grahamii en el área de muestreo, mostró un mayor número de individuos en la categoría de 1 a 2 tallos por individuo que en las demás categorías de tamaño.. Debajo de una planta nodriza. En suelo desnudo. Frecuencia de individuos. 60 50 40 30 20 10 0 1 A 2. 3 A 4. 5 A 6. 7 A 8. 9 A 10. MAYOR QUE 10. Categoría de tamaños. Figura 5. Número de individuos de Mammillaria grahamii encontrados debajo de algún árbol o arbusto o en suelo desnudo en las diferentes categorias de tamaño: 1 a 2 tallos hasta más de diez tallos. Se presentan los datos del total del área muestreada en el sitio sin perturbación.. 28.
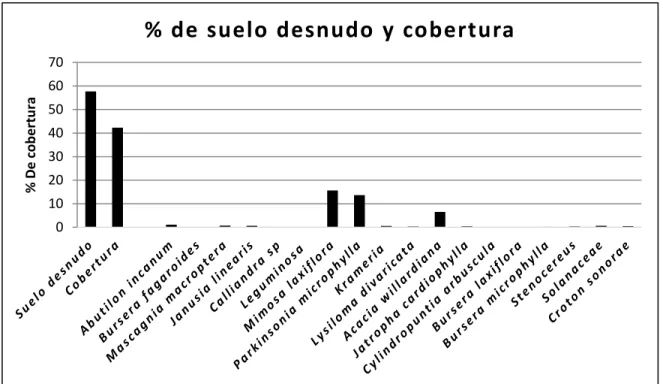
(42) VIII.3. Patrón de distribución Los resultados del índice Hopkins mostraron un patrón consistente con una distribución espacial agregada, pues la distancia entre el punto al azar y la planta más cercana es mayor a la distancia entre vecinos y por tanto el valor del índice de Hopkins fue mayor que 1 (h = 1.11). Debido a que el índice de Hopkins sigue una prueba de hipótesis de dos colas y una distribución de F, donde Ho supone una distribución al azar y Ha una distribución no al azar. Para rechazar Ho el valor obtenido del estadístico con nuestros resultados tendría que ser mayor en = 0.025 (caso de distribución uniforme). o mayor en . = 0.75 (caso de. distribución agregado). Los valores críticos en F (0.025, 200) = 1.32 y F (0.975, 200) = 0.75. Por lo tanto, dado que 1.11 no es mayor a 1.32 pero si es mayor a 0.75 Ho se rechaza, como consecuencia, el patrón de distribución espacial de los individuos de M. grahamii es agregado.. VIII.4. Cobertura vegetal. El área total de cobertura y de suelo desnudo de los sitios se representa en las primeras dos columnas en las Figuras 6 y 7. El porcentaje de suelo desnudo fue menor en el sitio invadido por buffel, ya que el buffel tiende a expandirse entre las plantas nativas y formar una capa continua; mientras que el de cobertura de plantas nativas fue menor en comparación con el sitio no invadido. Estas mismas figuras incluyen la cobertura de cada una de las especies en los dos sitios de muestreo. Las especies con mayor cobertura fueron Mimosa laxiflora (15.67 %), Parkinsonia microphylla (13.50%) y Acacia willardiana (6.50%) para el sitio sin buffel. Para el sitio invadido por buffel las especies nativas con mayor cobertura fueron M. laxiflora (17.0 %), P. microphylla (8.8%), pero buffel tuvo una cobertura mayor al 50%.. 29.
(43) % de suelo desnudo y cobertura 70 % De cobertura. 60 50 40 30 20 10 0. Figura 6. Porcentaje (%) de suelo desnudo y de cobertura total en el área no perturbada del muestreo. Se muestra también el porcentaje de cobertura correspondiente a cada especie en el área muestreada (500 m2).. % De Cobertura. % de suelo desnudo y cobertura 100 90 80 70 60 50 40 30 20 10 0. Figura 7. Porcentaje (%) de suelo desnudo y de cobertura total en el área invadida del muestreo. Se muestra también el porcentaje de cobertura correspondiente a cada especie en el área muestreada (500 m2). 30.
(44) VIII.5. Patrón de asociación. Debido a que los datos que se obtuvieron en el sitio con buffel fueron insuficientes para hacer el análisis de asociación, se presentan únicamente los datos en el sitio sin buffel. Los datos de cobertura mostraron que el 42.2 % del área muestreada está cubierta por árboles y arbustos y el 57.7% es suelo desnudo. Este dato fue utilizado para hacer el contraste entre los individuos observados creciendo bajo plantas nodrizas (95) y los individuos que se esperaría que hubiese si no hubiera asociación con plantas y la distribución fuese aleatoria (33 individuos bajo plantas y 45 en espacios abiertos) (Figura 8).. Individuos observados y esperados 100 90 80 INDIVIDUOS. 70. 60 50 40 30 20 10 0. Observados. Esperados. Figura 8. Se muestran de izquierda a derecha los individuos de Mammillaria grahamii observados y esperados creciendo bajo la copa de algún árbol o arbusto y los individuos observados y esperados creciendo en suelo desnudo.. El estadístico ji cuadrada contrasta una prueba de hipótesis donde Ho supone que la dispersión de los individuos de una población sigue una distribución normal; mientras que Ha supone que la dispersión de los organismos de una población no sigue una distribución normal. Para rechazar Ho el valor obtenido del estadístico tiene que ser mayor o igual que el valor critico de 31.
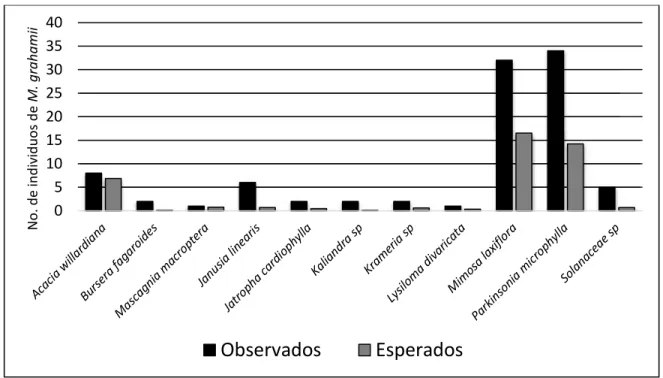
(45) ji cuadrada. El resultado del estadístico fue x2 = 31.98, g.l. = 1, p < 0.001 lo cual indica que los individuos de Mammillaria grahamii no crecen por igual bajo plantas y en espacios abiertos, más bien crecen preferentemente asociados a algunas especies de la comunidad.. Cuando se comparan los datos del número observado de individuos de Mammillaria grahamii creciendo bajo cada una de las especies más importantes con los datos esperados si no hubiera asociación (Figura 9), se puede observar que al parecer Mammillaria grahamii muestra preferencia por A. willardiana, M. laxiflora y P. microphylla. El resultado del estadístico fue. x2 = 69.90, g.l. = 10, p < 0.001 lo cual indica que existe una asociación significativa de Mammillaria grahamii con varias especies de plantas de la comunidad, donde P. microphylla. No. de individuos de M. grahamii. destaca como una de las plantas más importantes en la asociación. 40 35 30 25 20 15 10 5 0. Observados. Esperados. Figura 9. Individuos de Mammillaria grahamii observados en campo creciendo bajo la copa de las especies nodrizas y los individuos que se esperaría que estuvieran creciendo debajo de la copa de las especies nodrizas si la distribución fuera al azar.. 32.
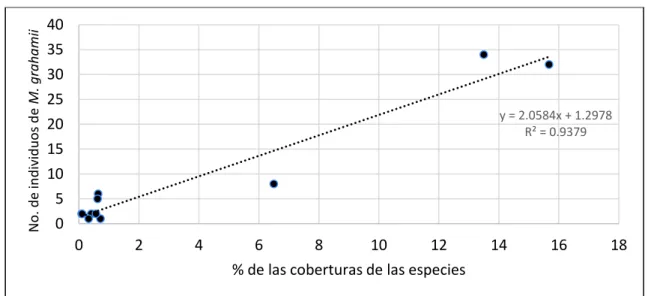
(46) VIII.6. Análisis de regresión lineal. Cuando relacionamos los datos de las coberturas de las especies nodrizas y los datos de los individuos de M. grahamii que tiene cada una de ellas bajo sus copas, se observa que hay una relación lineal entre las dos variables (Figura 10). Mediante el estadístico R de Pearson, los resultados indicaron que sí hay asociación estadísticamente significativa entre las variables. Al. No. de individuos de M. grahamii. incrementar la cobertura, incrementa el número de individuos de M. grahamii. 40 35 30 25 20 15 10 5 0. y = 2.0584x + 1.2978 R² = 0.9379. 0. 2. 4. 6 8 10 12 % de las coberturas de las especies. 14. 16. 18. Figura 10. Análisis de regresión entre el número de individuos de Mammillaria grahamii y el porcentaje de cobertura de las especies nodrizas.. Tabla II. Análisis de varianza (ANOVA). Regresión Residual Total. DF 1 9 10. SC 1409.253 93.293 1502.545. CM 1409.253 10.366 150.255. F 135.951. P <0.001. Aplicando un análisis de regresión lineal se obtuvo un coeficiente de determinación R2 = 0.938 y un error típico de estimación = 3.220. Los resultados del análisis de varianza indican que el modelo lineal proporciona un buen ajuste para los datos (F = 135.951, P < 0.001).. 33.
(47) VIII.7. Requerimientos abióticos de germinación. VIII.7.1. Requerimiento de luz. Se observó un efecto significativo de la luz y la escarificación en la germinación final, la tasa de germinación (semillas germinadas por día), y los días para el inicio de la germinación (DIG) (Tabla III). Bajo condiciones de luz hubo una germinación final del 73% mientras que el tratamiento en oscuridad total no presentó germinación en ninguna de sus réplicas (Figura 11). Por lo tanto las semillas de M. grahamii son fotoblásticas positivas. Sin embargo, la escarificación con ácido clorhídrico revirtió el requerimiento de luz en una porción de las semillas, ya que se observó incremento en la germinación final la cual fue de 27% en oscuridad y un 96% en luz. (Figura 12). El tratamiento de escarificación disminuyo los DIG en luz de 7.0 a 3.4 días. El tratamiento de escarificación incrementó la tasa de germinación en luz de 12.7 a 88.2; en la obscuridad y con escarificación la tasa fue de 28.4 ± 12.2 (Figura 13).. Tabla III. Prueba de Wilcoxon para comparación de los parámetros de germinación de los tratamientos de luz en semillas con y sin escarificar. DIG son los días para el inicio de la germinación LUZ Variables de respuesta. X2. GL.. P > X2. Tasa de germinación. 16.633. 3. 0.0008. Dig. 17.0722. 3. 0.0007. % de germinación final. 18.2412. 3. 0.0004. 34.
(48) 100 90 % de germinación final. 80 70 60 50 40 30 20 10 0. Luz. Oscuridad. Luz HCL. Oscuridad HCL. Tratamientos. Figura 11. Efecto de la luz y la escarificación con ácido clorhídrico (HCl) en el porcentaje de germinación final. Las barras representan la media ± D.E. N = 5. 8. Día de inicio de la germinación. 7 6 5 4 3 2 1 0. Luz. Oscuridad. Luz HCL. Oscuridad HCL. Tratamiento. Figura 12. Efecto de la luz y la escarificación en el tiempo (días) para el inicio de germinación. Las barras representan la media ± D.E. N = 5.. 35.
Figure


Documento similar
d) que haya «identidad de órgano» (con identidad de Sala y Sección); e) que haya alteridad, es decir, que las sentencias aportadas sean de persona distinta a la recurrente, e) que
Para ello, trabajaremos con una colección de cartas redactadas desde allí, impresa en Évora en 1598 y otros documentos jesuitas: el Sumario de las cosas de Japón (1583),
E Clamades andaua sienpre sobre el caua- 11o de madera, y en poco tienpo fue tan lexos, que el no sabia en donde estaña; pero el tomo muy gran esfuergo en si, y pensó yendo assi
Sanz (Universidad Carlos III-IUNE): "El papel de las fuentes de datos en los ranking nacionales de universidades".. Reuniones científicas 75 Los días 12 y 13 de noviembre
(Banco de España) Mancebo, Pascual (U. de Alicante) Marco, Mariluz (U. de València) Marhuenda, Francisco (U. de Alicante) Marhuenda, Joaquín (U. de Alicante) Marquerie,
Proporcione esta nota de seguridad y las copias de la versión para pacientes junto con el documento Preguntas frecuentes sobre contraindicaciones y
[r]
Contraindicaciones: El uso de la mascarilla está contraindicado para los pacientes y los miembros de sus familias, profesionales sanitarios y compañeros de