Validación del Score TEF para descartar neumonía por Mycoplasma pneumoniae: Estudio Prospectivo
Texto completo
(2) Los Integrantes del Comité aprueban la tesis de Barbara Rivera Fernández Galán, que presenta para cubrir el requisito parcial de obtención del grado de: ESPECIALISTA EN PEDIATRÍA. Comité de Tesis ______________________________ Dra. Julieta Rodríguez de Ita Director de Comité de Sinodales. ______________________________. ______________________________. Dr. Mario Alberto Vázquez González. Dr. Gabriel Martín Vargas Duarte. Sinodal. Sinodal. ______________________________ Dr. Gabriel Martín Vargas Duarte Director Académico del programa en Pediatría Validación del Score TEF para descartar neumonía por Mycoplasma pneumoniae: Estudio Prospectivo. 2.
(3) o Autor principal: Dra. Barbara Rivera Fernández Galán, matrícula A00289717. Residente de cuarto año del Departamento de Pediatría, Programas Multicéntricos de Residencias Médicas de la Escuela de Medicina y Ciencias de la Salud del Tecnológico de Monterrey y la Secretaría de Salud de Nuevo León.. o Director de tesis: Dra. Julieta Rodríguez de Ita. Médico Pediatra, Maestro en Ciencias con orientación terminal en Inmunología, Doctor en Ciencias Clínicas. Profesor de cátedra de Pediatría de la Escuela de Medicina y Ciencias de la Salud del Tecnológico de Monterrey y la Secretaría de Salud de Nuevo León.. o Codirector de tesis: Dra. Karla Lorena Chávez Caraza. Médico Pediatra, especialista en Gastroenterología y Nutrición pediátrica. Profesor de cátedra de Pediatría de la Escuela de Medicina y Ciencias de la Salud del Tecnológico de Monterrey y la Secretaría de Salud de Nuevo León.. o Coinvestigador de tesis: Dr. Jesús Santos Guzmán. Especialista en Educación y estadística aplicada. Director del Departamento de medición y evaluación académica del Tecnológico de Monterrey.. Validación del Score TEF para descartar neumonía por Mycoplasma pneumoniae: Estudio Prospectivo. 3.
(4) o Coinvestigador de tesis: Mario Antonio Torres Acosta. SNI- nivel candidato. Grupo de Enfoque Estratégico en Bioprocesos y Biología Sintética. Centro de Biotecnología-FEMSA. Tecnológico de Monterrey. o Coinvestigador de tesis: Alejandro Robles Zamora. Maestro en Ciencias. Centro de Biotecnología-FEMSA. Tecnológico de Monterrey.. Validación del Score TEF para descartar neumonía por Mycoplasma pneumoniae: Estudio Prospectivo. 4.
(5) Dedicatoria. Gracias a mis papas y a mi hermana por ser por ser mi pilar y motivarme a ser la mejor versión de mí, por apoyarme en cada paso que doy y cada proyecto que me trazo. A Ana y a Paco quienes me enseñaron (y lo siguen haciendo) que para conseguir tus sueños hay que trabajar duro y creer en ti mismo. A mi abuela Marilú y abuelo Fito por siempre alentarme a continuar. Este esfuerzo y este logro es gracias a todos ustedes.. Validación del Score TEF para descartar neumonía por Mycoplasma pneumoniae: Estudio Prospectivo. 5.
(6) Agradecimientos. A todas las personas que participaron en la elaboración de esta tesis, desde la recolección de muestras, el llenado de formatos o el simplemente alentarme a continuar. A Andrés Alejandro Martínez Valdés, por su incansable labor de recolectar muestras y llevarlas al laboratorio, así como el de estarme aguantando y escribiendo todos los días. A la química Gabriela Yamelli Martínez Velázquez, que a pesar de estar en su horario laboral se dio a la tarea de tomar muestras. A María Guadalupe Martínez Lima por su apoyo y participación, quedando un largo camino a recorrer para continuar la segunda fase del proyecto en sus manos. Al personal de laboratorio del Hospital San José, Hospital Zambrano Hellion y Hospital Regional Materno Infantil quienes presentaron disponibilidad para el almacenamiento de las muestras.. Validación del Score TEF para descartar neumonía por Mycoplasma pneumoniae: Estudio Prospectivo. 6.
(7) Glosario Las siguientes abreviaturas o términos son utilizados dentro del protocolo: Abreviatura. Explicación. M. pneumoniae. Mycoplasma pneumoniae. PCR. Reacción en cadena de polimerasa. IgM. Inmunoglobulina del tipo M. TEF. Días de tos, edad y días de fiebre. S. pneumoniae. Streptococcus pneumoniae. CARDS. Community-acquired respiratory distress syndrome. NAC. Neumonía adquirida en la comunidad. Validación del Score TEF para descartar neumonía por Mycoplasma pneumoniae: Estudio Prospectivo. 7.
(8) Índice. Dedicatoria...................................................................................................................................5 Agradecimientos .........................................................................................................................6 Glosario ........................................................................................................................................7 Índice de Tablas ..........................................................................................................................9 Índice de Figuras ........................................................................................................................9 Resumen .................................................................................................................................... 10 Capítulo 1. Planteamiento del problema ............................................................................ 11 Capítulo 2. Marco teórico ...................................................................................................... 13 Epidemiología ..................................................................................................................................... 13 Mycoplasma pneumoniae .................................................................................................................. 15 Cuadro clínico..................................................................................................................................... 16 Diagnóstico ......................................................................................................................................... 17 Tratamiento ......................................................................................................................................... 21. Capítulo 3. Metodología......................................................................................................... 23. Diseño del estudio .............................................................................................................................. 23 Materiales y métodos ......................................................................................................................... 23 Metodología ........................................................................................................................................ 24 Reclutamiento de pacientes y obtención de muestras ........................................................................ 24 Análisis de muestras y estandarización de PCR .................................................................................. 25 Variables.............................................................................................................................................. 26 Identificación por PCR ................................................................................................................................. 27 Identificación por IgM .................................................................................................................................. 27 Panel respiratorio............................................................................................................................................ 28 Score TEF ......................................................................................................................................................... 28 Análisis estadístico ............................................................................................................................. 30. Capítulo 4. Resultados ........................................................................................................... 31 Capítulo 5. Análisis y discusión ............................................................................................ 42 Capítulo 6. Conclusión ........................................................................................................... 47 Referencias................................................................................................................................ 48 Anexo 1. Hoja de recolección de datos ............................................................................... 51 Anexo 2. Formato de Registro de Investigación Estatal ................................................. 52 Anexo 3. Aceptación Comité de Ética ................................................................................. 53 Anexo 4. Aceptación Comité de Ética ................................................................................. 54 Curriculum Vitae .................................................................................................................... 55. Validación del Score TEF para descartar neumonía por Mycoplasma pneumoniae: Estudio Prospectivo. 8.
(9) Índice de Tablas 1. Tabla 1 ………………………………………………………………………………. 21 2. Tabla 2 ………………………………………………………………………………. 29 3. Tabla 3 ………………………………………………………………………………. 31 4. Tabla 4 ………………………………………………………………………………. 31 5. Tabla 5 ………………………………………………………………………………. 31 6. Tabla 6 ………………………………………………………………………………. 32 7. Tabla 7 ………………………………………………………………………………. 35 8. Tabla 8 ………………………………………………………………………………. 35 9. Tabla 9 ………………………………………………………………………………. 36 10. Tabla 10 ……………………………………………………………………………. 37 11. Tabla 11 ……………………………………………………………………………. 38. Índice de Figuras 1. Figura 1 ……………………………………………………………………………. 26 2. Figura 2 ……………………………………………………………………………. 33 3. Figura 3 ……………………………………………………………………………. 34 4. Figura 4 ……………………………………………………………………………. 38 5. Figura 5 ……………………………………………………………………………. 39 6. Figura 6 ……………………………………………………………………………. 40 7. Figura 7 ……………………………………………………………………………. 41. Validación del Score TEF para descartar neumonía por Mycoplasma pneumoniae: Estudio Prospectivo. 9.
(10) Resumen Introducción y objetivos: La neumonía adquirida en la comunidad continúa siendo una de las principales causas de morbimortalidad a nivel mundial considerándose Mycoplasma pneumoniae como el segundo agente etiológico que la causa aunque determinar esta etiología mediante la clínica es un reto por lo que se busca validar un score publicado en 2014 por Rodríguez et al (1) comparándolo con un estándar de oro seleccionado que fue PCR en exudado nasofaríngeo y nasal. Material y métodos: Se trata de un estudio multicéntrico, replicativo, observacional, de prueba diagnóstica, transversal, analítico y prospectivo en el que se busca obtener el rendimiento del score TEF contra el estándar de oro diagnóstico que se ha elegido por conveniencia: PCR para M. pneumoniae en exudado faríngeo o aspirado nasal así como en saliva las cuales fueron estandarizadas por el grupo de Biotecnología del Instituto de Monterrey. Resultados: Se contó con un total de 110 pacientes, de los cuales 60 tuvieron un score TEF positivo y 50 un score negativo. Todos las PCR para M. pneumoniae de muestras de exudados nasofaríngeo y salival fueron negativas, encontrándose una prevalencia de 0% de neumonía por M. pneumoniae en nuestra población de estudio. Conclusiones: No es posible validar el score TEF como herramienta de diagnóstico clínica ya que no se cuenta con ninguna prueba de PCR positiva. Se apoya el score en el hecho que los pacientes con score positivo tuvieron síntomas inespecíficos leves y menor días de estancia intrahospitalaria que los que tuvieron un score negativo. Se necesita un número de muestra mas grande para poder ampliar los resultados..
(11) Capítulo 1. Planteamiento del problema Los signos y síntomas manifestados en las infecciones de vías aéreas bajas son muy inespecíficos y las diferentes etiologías de la misma, ya sea bacteriana, viral o por organismos atípicos, comparten estas manifestaciones siendo muy difícil su diferenciación diagnóstica mediante la clínica. Así pues, la diferenciación de las neumonías por Mycoplasma pneumoniae se lleva a cabo mediante estudios de laboratorio como IgM y PCR los cuales también tienen inconvenientes en su uso como el alto costo para la PCR o la necesidad de esperar 2 semanas o incluso 4 para observar la cuadruplicación de los niveles de inmunoglobulinas, por lo que se han realizado varios esfuerzos por crear scores predictivos de etiología de las neumonías llegando a ser no aplicables o validados en la población pediátrica debido a que los resultados no son significativos además de la aplicación en nuestro medio de una prueba de PCR para Mycoplasma pneumoniae en muestra de saliva. Recientemente se ha creado un score que busca descartar la posibilidad de presentar neumonía por Mycoplasma pneumoniae mediante tres variables clínicas que incluyen edad, duración de la tos y duración de la fiebre previos a buscar atención médica, el cual fue formulado en base a la presentación clínica que tenían los pacientes a su ingreso en un estudio retrospectivo teniendo como inconveniente el uso de una muestra única de IgM para realizar un diagnóstico presuntivo de neumonía atípica. Este score no ha sido validado para asegurar su valor predictivo negativo ni su especificidad, pero si se logrará evidenciar que tiene una similitud diagnóstica con los estándares de oro actuales que son la cuadruplicación de títulos de IgM e IgG y la PCR para Mycoplasma.
(12) se tendría una herramienta para un diagnóstico clínico oportuno en aquellos centros donde no es posible realizar una prueba confirmatoria por laboratorio o el resultado de dichas pruebas es tardío. Por lo que se busca validar el score descrito con pruebas diagnósticas para la identificación de M. pneumoniae por PCR en exudado faríngeo o aspirado nasal, además de determinar si pruebas menos invasivas como la de saliva es útil para la detección de este patógeno, estimando además la prevalencia de neumonías por Mycoplasma pneumoniae en nuestra comunidad. Por lo tanto la pregunta de investigación que se plantea es: ¿El score TEF tiene mejor sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo que la PCR para M. pneumoniae en exudado faríngeo o aspirado nasal para detectar neumonías por este patógeno?. Validación del Score TEF para descartar neumonía por Mycoplasma pneumoniae: Estudio Prospectivo. 12.
(13) Capítulo 2. Marco teórico Definimos una neumonía atípica como una neumonía que se presenta de manera no habitual, con fiebre subaguda, síntomas respiratorios leves y manifestaciones extra pulmonares así como una imposibilidad para su identificación mediante la tinción de Gram y su falta de crecimiento en cultivos estándares (3). La principal etiología de la neumonía atípica se debe a Mycoplasma pneumoniae y se manifiesta con fiebre, dolor torácico y sibilancias leves además de síntomas no respiratorios como cefalea y artralgias en la mayoría de los casos. (4) Epidemiología De acuerdo a la Organización Mundial de la Salud, la neumonía adquirida en la comunidad continúa siendo una de las principales causas de morbimortalidad a nivel mundial, con una incidencia de 156 millones de casos nuevos al año en niños menores de cinco años quienes, de estos, la mitad requieren manejo intrahospitalario. La mortalidad a nivel mundial se estima en 1.4 millones al año, con un 70% de las muertes ocurriendo en menores de 5 años y un 90-95% de estas muertes sucediendo en países en vías de desarrollo (5, 6). Por su parte, México aunado a otros 14 países de África subsahariana y el sureste asiático son los países que aportan un 75% de todos los casos de neumonía a nivel mundial. (7) Dentro de todas las neumonías, las causadas por M. pneumoniae ocupan el segundo lugar, detrás de las causadas por Streptococcus pneumoniae, con una prevalencia que oscila del 14.5% al 40% (7-10) variando de acuerdo a la edad de presentación, la temporada del año, factores ambientales como la contaminación o el clima frío o si existe.
(14) una epidemia de M. Pneumoniae, las cuales se presenta en ciclos cada 3 a 7 años (11). De estos, 3 a 4% desarrollan complicaciones que pueden llegar a ser fulminantes, de ahí la importancia de su detección temprana. De acuerdo a un estudio realizado por Korppi et al. que involucró a 201 menores de 15 años, en un periodo de 1 año en Helsinki, Finlandia, se detectó la causalidad de M. pneumoniae como agente etiológico en un 50% de las neumonías en mayores de 5 años mediante el uso de IgM por inmunoensayo así como que la incidencia de la misma iba aumentando con la edad (8), y de acuerdo a M. Ieven et al en un estudio que incluyó 341 menores de 3 años, se identifica solamente como agente causal de neumonía mediante técnica de PCR en un 5.9% de ellos (12). En nuestro país no contamos con registros que nos indiquen la prevalencia de este organismo como agente causal de neumonía. Aun cuando se sabe que su incidencia aumenta en la población mayor a 5 años, recientemente se ha observado que en niños menores también ocupa un lugar importante como factor etiológico de neumonía llegando a causar hasta un 25% de las mismas, según un estudio realizado por Medjo et al en una población italiana que incluyó un total de 166 pacientes con diagnóstico de neumonía de entre 1 y 14 años. (13). Determinar la etiología de la neumonía adquirida en la comunidad es un proceso difícil lográndose solo documentar en un 27 al 67%, ya que en solo alrededor del 10% de los pacientes hospitalizados se logra aislar el germen en sangre, aumentando este porcentaje si existe un empiema y se cultiva una muestra de este. En la población pediátrica, los gérmenes aislados del tracto respiratorio superior pueden corresponder a colonización de la nasofaringe y el obtener una muestra del tracto respiratorio inferior. Validación del Score TEF para descartar neumonía por Mycoplasma pneumoniae: Estudio Prospectivo. 14.
(15) requiere procedimientos invasivos y poco accesibles en la mayoría de los hospitales como lo son la punción pulmonar o broncoscopía con cepillado y lavado bronco-alveolar (14). Mycoplasma pneumoniae También conocido como agente de Eaton fue aislado por primera vez en 1944, se trasmite a través de gotas de personas a personas y es exclusivamente un patógeno humano. Se trata de un parásito obligado puesto que depende de un huésped para vivir, microscópico por lo cual no se puede observar con microscopía de luz, además no cuenta con pared celular por lo que puede alterar su tamaño y forma para adaptarse al medio en el que se encuentre. Su virulencia depende de la adherencia a las células huéspedes, así como a su motilidad, ya que se ha observado que mutaciones que ocasionen pérdidas de la misma la convierte en una cepa avirulenta (15, 16). Su asociación tan cercana con las células huéspedes previene que sea removida del sistema mucociliar, dañando el epitelio respiratorio celular en la base de los cilios activando la respuesta inmune innata y produciendo efectos citotóxicos locales. Así mismo se ha descubierto la exotoxina CARDS (community-acquired respiratory distress syndrome) como factor determinante de la enfermedad causada por este microorganismo que desencadena la cascada de inflamación y causa una disrupción del epitelio respiratorio en modelos animales. (11, 17) Otro de los factores que afectan la virulencia son la respuesta inmune y la inmunocompetencia del huésped para determinar las complicaciones respiratorias que se pudieran presentar así como las manifestaciones extra pulmonares que se tendrán (18).. Validación del Score TEF para descartar neumonía por Mycoplasma pneumoniae: Estudio Prospectivo. 15.
(16) Cuadro clínico Las manifestaciones por infección debida a M. pneumoniae son variadas e incluyen traqueo bronquitis o datos clínicos sugestivos de infecciones de vías aéreas superiores e inferiores como el interés del presente protocolo. (17) Sus manifestaciones se dividen primariamente en dos: las respiratorias entre las que se encuentran tos no productiva, neumonía, disnea, faringitis, rinorrea, otalgia o sinusitis y las extra pulmonares como anemia hemolítica, exantema eritematoso maculopapular, poliartritis, pancreatitis o hepatitis, enfermedad cardiaca o del sistema nervioso central. (19) La neumonía causada por este patógeno se denomina “neumonía silente” o “neumonía atípica” ya que presenta una infinidad de síntomas y signos clínicos generalmente de menor intensidad que una neumonía bacteriana. Se presenta con fiebre, malestar general, mialgias, cefalea, fotofobia, faringitis y tos no productiva prolongada (19) pero puede incluso ser asintomática o tener una exploración física con signos menores. En la más reciente revisión de Cochrane del 2012 (9), donde se incluyen tras un descarte inicial, un total de siete estudios con 1491 niños en un ambiente hospitalario, se llegó a la conclusión que no se puede establecer un diagnóstico de infección por M. pneumoniae basados únicamente en el cuadro clínico de la enfermedad. Se observó que la ausencia de sibilancias es un indicador estadísticamente significativo mientras que la presencia de estertores no lo es, se demostró además que la presencia de dolor torácico aumenta la posibilidad de que se trate de una infección por M. pneumoniae pero aún sin. Validación del Score TEF para descartar neumonía por Mycoplasma pneumoniae: Estudio Prospectivo. 16.
(17) poder establecer escalas de predicción de la enfermedad. La ausencia de sibilancias es 12% más probable en los casos de infecciones por M. pneumoniae, por lo que se si da tratamiento empírico a estos pacientes de un 61 a un 89% de los niños recibiendo antibióticos serían negativos para M. pneumoniae basados en una prevalencia del 10-36% y un 25% de los niños que si estuvieran infectados por M. pneumoniae no estarían recibiendo el tratamiento. El valor diagnóstico de cada signo y/o síntoma dependen y varían de la edad del niño. Defilippi en el 2008 (20) y Othman en el 2005 (21) encontraron que datos como taquipnea, coriza, diarrea y vómito eran más comunes en niños preescolares. Por otra parte, también se ha observado que las manifestaciones dependen de si existe o no una epidemia de la enfermedad, con signos y síntomas más variados, destacando rinorrea, cefalea y dolor torácico si nos encontramos durante estos periodos. También se encontró un aumento en la severidad de los síntomas y signos clínicos en los pacientes hospitalizados que aquellos que se presentan a una consulta ambulatoria. Diagnóstico En un estudio llevado a cabo por Chang et al (22) se demostró que solo una pequeña proporción de las neumonías cuyo agente etiológico sospechado fue M. pneumoniae y que recibían tratamiento antibiótico eran confirmadas mediante una prueba de laboratorio siendo común su sobre diagnóstico y sobre tratamiento. Uno de los motivos por los cuales no se solicitan estudios de laboratorio es que el estándar de oro para el diagnóstico de la infección por M. pneumoniae continúa siendo la cuadruplicación de títulos de IgM en un periodo de 2 a 4 semanas (22, 23), llegando a ser Validación del Score TEF para descartar neumonía por Mycoplasma pneumoniae: Estudio Prospectivo. 17.
(18) un reto su uso, ya que el clínico debería esperar mínimo estas semanas para observar este aumento en la titulación de los mismos para iniciar tratamiento antibiótico. Por esto mismo, el uso de PCR en tiempo real como método alternativo ha surgido para normar la conducta ante la sospecha de una infección por M. pneumoniae ya que también brinda la posibilidad de establecer un diagnóstico en las manifestaciones extra pulmonares del patógeno. (19) Cada una de estas pruebas tiene sus desventajas. Al solicitar anticuerpos de IgM para M. pneumoniae puede haber falsos negativos si son tomados en la primera semana de la enfermedad ya que los títulos pueden no haber aumentado lo suficiente para tener un resultado positivo, mientras que la sensibilidad de la PCR disminuye al aumentar el tiempo entre inicio de los síntomas y toma de la muestra debido a que la carga del microorganismo va disminuyendo (23). Por otra parte, para establecer el diagnóstico por PCR de infección por M. pneumoniae, se emplea más frecuentemente la muestra de secreción faríngea ya que tiene un efecto menor inhibitorio sobre la reacción de amplificación de ADN que otras muestras (21), pudiéndonos dar resultados falsos positivos ya que M. pneumoniae se puede encontrar como flora de la faringe, y es que hasta la fecha se desconoce si existe un parámetro de corte en las pruebas cuantitativas que sea capaz de distinguir entre infección activa o estado de portador (24) además de que estos resultados se pueden negativizar tras haber iniciado el tratamiento antibiótico (25). De acuerdo a una revisión por Waites et at (26) que compara los resultados de IgM versus los de PCR en niños de nacionalidad china hospitalizados con diagnóstico de. Validación del Score TEF para descartar neumonía por Mycoplasma pneumoniae: Estudio Prospectivo. 18.
(19) neumonía por M. pneumoniae, se observó una concordancia del 90% entre los dos métodos, pero aún así se evidenció que un 7% de los pacientes con una PCR positiva tenían una IgM negativa y un 3% de los niños con IgM positiva tenían PCR negativa. Estas diferencias son más evidentes en niños menores de 1 año, debido a que los infantes pueden no tener la capacidad de montar una respuesta inmune humoral por lo que los niveles de IgM pudieran no ser lo suficientemente elevados para ser detectados, sucediendo esto mismo entre la población con inmunocompromiso o de edad avanzada. Dicho esto, se llega a la conclusión que no hay un test único que pueda detectar con precisión todas las infecciones causadas por este patógeno y que la medida diagnóstica más sensata para una detección temprana sería una combinación de serología de IgM y PCR en tiempo real (12). Durante la última década se ha venido desarrollando la aplicación de pruebas diagnósticas como la PCR en saliva para llevar a cabo el diagnostico etiológico de ciertas enfermedades causadas por patógenos específicos. Komatsu et al, llegaron a la conclusión que Mycoplasma pneumoniae es uno de estos patógenos que puede ser detectado, pudiendo así simplificar el método de obtención de las muestras pero teniendo como desventaja que necesita una carga elevada de ADN (+10 log copias de ADN). (27) En el 2014 Rodríguez y colaboradores (1), desarrollaron una herramienta clínica para el diagnóstico de neumonía por Mycoplasma pneumoniae, mediante un estudio transversal, observacional y analítico en un período de dos años y medio que incluyó un total de 302 expedientes de pacientes con edades de 2 a 18 años con diagnóstico de NAC, definiendo una neumonía por M. pneumoniae aquella que hubiera tenido una prueba única de IgM positiva, y posterior a la obtención de dicho score se aplicó de manera Validación del Score TEF para descartar neumonía por Mycoplasma pneumoniae: Estudio Prospectivo. 19.
(20) retrospectiva a la muestra obtenida previamente obteniendo la sensibilidad, especificidad, valor predictivo positivo y negativo de la misma. Se revisaron variables como antecedentes personales patológicos, síntomas y tratamientos previos, signos vitales al ingreso, exploración física, radiografía de tórax, recuento de neutrófilos, nivel de proteína C reactiva, esquema de tratamiento, respuesta al tratamiento, días de estancia hospitalaria, ingreso y días en unidad de cuidados intensivos pediátricos y si estos requirieron ventilación mecánica. Se establecieron los factores como predictores encontrando que los que presentaron odds ratio mas elevados fueron la edad, días de fiebre y de tos. De estos se eligieron las características clínicas asignándole una puntuación a cada una de ellas y siendo una prueba positiva para neumonía por M. pneumoniae si se suman mas de 5 puntos (Tabla 1). TABLA 1. Score TEF (tos, edad y fiebre). Edad (años). Puntos. Días de fiebre. Puntos. Días de tos. Puntos. < 0,5 0 <1 0 <1 0 0,5 - 2 1 1-3 1 1-3 1 >2–4 2 >3–5 2 >3–5 2 >4–7 3 >5–7 3 >5–7 3 > 7 – 10 4 > 7 – 14 4 > 7 – 14 4 > 10 5 > 14 5 > 14 5 Score para descartar neumonías por Mycoplasma pneumoniae. Asignación de puntos para cada parámetro. Una vez aplicada esta prueba se obtuvo una sensibilidad del 85%, especificidad del 49%, un valor predictivo positivo del 17% y un valor predictivo negativo del 96% con lo que se llega a la conclusión de que este score se podría usar como una herramienta de diagnóstico para descartar neumonías por M. pneumoniae dado su alto valor predictivo negativo y sensibilidad. La prueba tiene sus limitaciones, puesto que se considero una. Validación del Score TEF para descartar neumonía por Mycoplasma pneumoniae: Estudio Prospectivo. 20.
(21) neumonía por Mycoplasma pneumoniae al contar con una prueba única cualitativa de IgM positiva, sin repetir una cuantificación de IgM en dos semanas. Este score podría descartar esta patología sin el uso de estudios de laboratorio y de una manera temprana comparada con el estándar de oro diagnóstico que continúa siendo la toma seriada de anticuerpos IgM para M. pneumoniae en 2 a 4 semanas, disminuyendo así la incidencia de resistencia a antibióticos que se ha venido presentando por el uso indiscriminado de macrólidos ante la sospecha de esta infección, mas hace falta un análisis prospectivo del mismo score. Tratamiento Debido a las manifestaciones extremas causadas por M. pneumoniae se ha llegado a considerar la infección por este patógeno auto-limitada y sin evidencia suficiente de que el tratamiento a base de antibióticos sea efectivo contra una neumonía por M. pneumoniae (16, 28). Los macrólidos son los antibióticos más recetados para infecciones de vías aéreas en niños, especialmente en los casos que existe duda acerca de infecciones de vías aéreas inferiores y su etiología (29). En una revisión sistemática del 2014 (30) se llegó a la conclusión que el tratamiento antibiótico a base de los mismos, disminuían la duración de la fiebre de manera estadística pero sin traducción clínica, sin embargo se incluían infecciones de vías aéreas superiores, no solamente las neumonías. No se encontró ninguna otra mejoría en parámetros clínicos o de laboratorio. Se llega entonces a la conclusión que se necesitan más estudios en especial de carácter prospectivo para establecer el beneficio del uso de macrólidos en las neumonías. Validación del Score TEF para descartar neumonía por Mycoplasma pneumoniae: Estudio Prospectivo. 21.
(22) por Mycoplasma pneumoniae en niños, ya que de acuerdo con Biondi et al, se necesitan al menos 8.56 niños tratados para ver en uno una mejoría clínica significativa, siendo así ésta un área de oportunidad para disminuir el uso indiscriminado de antibióticos.. Validación del Score TEF para descartar neumonía por Mycoplasma pneumoniae: Estudio Prospectivo. 22.
(23) Capítulo 3. Metodología. Diseño del estudio Se propuso el protocolo de estudio y se obtuvo la autorización del Comité de Ética y el Comité de Investigación de la Escuela de Medicina y Ciencias de la Salud del Tecnológico de Monterrey, con el número de registro 19- CEI -011-20161017 y 13CI 19039138 ante la Comisión Nacional de Bioética además del comité correspondiente del Hospital Regional Materno Infantil de Alta Especialidad obteniendo el registro DEISC190119010 ante la Dirección de Enseñanza, Investigación en Salud y Calidad. Se trata de un estudio multicéntrico, replicativo, observacional, de prueba diagnóstica, transversal, analítico y prospectivo en el que se busca obtener el rendimiento (sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo) del score TEF contra el estándar de oro diagnóstico que se ha elegido por conveniencia: PCR para M. pneumoniae en exudado faríngeo o aspirado nasal así como en saliva.. Materiales y métodos Se realizó en una población de entre 0 y 15 años 11 meses de edad, debido a la alta incidencia de neumonías en esta etapa, en tres hospitales de la zona conurbada de Nuevo León (Hospital Zambrano Hellion, Hospital San José y Hospital Regional Materno Infantil) ya que aquí se presenta la mayor parte de la población pediátrica tanto de los sistemas de salud pública como privada que tenemos a nuestro alcance durante el periodo comprendido entre los meses de Diciembre 2018 y Junio 2019..
(24) Se incluyeron a los pacientes que se presentaron con sospecha clínica de neumonía definida como la presencia de tos y fiebre que se acompañe con signos clínicos como crepitantes o áreas torácicas hipoventiladas, leucocitosis o radiografía de tórax con infiltrados o consolidación y que no hubieran estado hospitalizados en un periodo de 2 semanas previas al ingreso. Se excluyeron únicamente a los pacientes con antecedentes personales patológicos de inmunocompromiso. Considerando la prevalencia documentada de neumonías por M. pneumoniae de 14.6% se requiere de una muestra de 191 pacientes con un nivel de significancia Z de 95% y un valor d 0.05. Se obtuvieron al final 110 pacientes con diagnóstico al ingreso de neumonía. Todos los padres de los pacientes que ingresaron al protocolo de estudio firmaron un consentimiento informado y aquellos pacientes mayores de 5 años firmaron un asentimiento informado; no existieron conflictos éticos de acuerdo a la declaración de Helsinki.. Metodología Reclutamiento de pacientes y obtención de muestras En el área de urgencias del Hospital Regional Materno Infantil y en el área de hospitalización en las primeras 24 horas en el Hospital San José y Zambrano Hellion, se contó con sobres que incluían los siguientes documentos: rúbrica del Score TEF, un consentimiento informado y dos medios de transporte universal. Ante la sospecha diagnóstica de neumonía en un paciente de nuevo ingreso, se realizó el Score TEF si se. Validación del Score TEF para descartar neumonía por Mycoplasma pneumoniae: Estudio Prospectivo. 24.
(25) cumplían los criterios de inclusión y hubieran decidido participar en el protocolo y firmado el consentimiento y asentimiento informado. Se procedía a tomar la muestra de exudado nasofaríngeo mediante un hisopo de algodón seco y estéril el cual posterior a la recolección de la muestra se colocaba en un medio de transporte universal que contenía un buffer de fosfato salino cuya función era mantener en condiciones fisiológicas a la muestra hasta la extracción del ADN; así mismo la muestra de saliva en los pacientes menores de 5 años se obtenía mediante una pipeta Pasteur de transferencia de 3ml salival, considerándola adecuada con al menos 1ml de muestra y colocándola en un tubo “Salivette”, mientras que a los pacientes mayores de 5 años se les solicitaba arrojar la saliva en el tubo “Salivette” de manera directa. Las muestras se colocaron en cada sobre con el Score TEF debidamente requisitado manteniéndose en refrigeración a 4º centígrados por un periodo máximo de 7 días en un área específica de un refrigerador establecido por el departamento de laboratorio de cada hospital participante (San José, Zambrano Hellion y Regional Materno Infantil). Se transportaron a las instalaciones del laboratorio en el Tecnológico de Monterrey donde fueron procesadas.. Análisis de muestras y estandarización de PCR La primera muestra de PCR de exudado faríngeo y salival que se utiliza fue la basada en el primer obtenido a partir de una región conservada del fragmente 16S del rRNA del gen 11 (270pb) que es común a 17 bacterias diferentes entre las que se encuentran Acholeplasma laidlawii, Mycoplasma argimini, Mycoplasma fermentans, Mycoplasma hyorhinis, Mycoplasma orale, Mycoplasma pneumoniae, Mycoplasma. Validación del Score TEF para descartar neumonía por Mycoplasma pneumoniae: Estudio Prospectivo. 25.
(26) gallisepticum, Mycoplasma sinovyae, Spiroplasma citri, Mycoplasma arthritidis, Mycoplasma genitalium, Mycoplasma hominis, Mycoplasma penetrans, Mycoplasma salivarium, Ureaplasma urealyticum, Mycoplasma bovis, Mycoplasma hyopneumoniae, Mycoplasma pirum. (Figura 1) (31). FIGURA 1. PCR para Mycoplasma pneumoniae. Electroforesis en gel de agarosa para muestras del protocolo que se mostraron positivas para el primer primer pero negativas para el segundo primer específico de Mycoplasma pneumoniae. Si alguna de las muestras es positiva se procede a realizar una segunda PCR con un plásmido específico para Mycoplasma pneumoniae que amplifican el fragmente 89pb del segmente 23S del rRNA de M. pneumoniae. (27, 32). Variables La variable independiente fue el resultado de PCR para Mycoplasma en exudado faríngeo y saliva que se tomaron como patrón de oro para diagnosticar la presencia o no. Validación del Score TEF para descartar neumonía por Mycoplasma pneumoniae: Estudio Prospectivo. 26.
(27) de infección por Mycoplasma pneumoniae. Se trató de una variable cualitativa y dicotómica la cual se reportó en forma de positivas o negativas.. Identificación por PCR Recordemos que la PCR tiene mejor sensibilidad y especificidad que la IgM para Mycoplasma pero aún continua su estudio y validación para homologar un kit único que pueda utilizarse cumpliendo criterios de aceptación internacional y criterios de calidad (22, 26). El grupo de Biotecnología del Instituto Tecnológico de Monterrey, estandarizó la prueba de PCR para M. pneumoniae tanto en exudado nasofaríngeo como de saliva después de una revisión en la literatura donde se encontró en un estudio que múltiples especies son identificadas como contaminación si se amplifica mediante PCR el gen ribosomal 16s (31) mientras que un segundo identifica específicamente a Mycoplasma pneumoniae si se amplifica el gen ribosomal 23s (27) posterior a lo cual se utilizó la base de datos de NCBI y GenBank para identificar la secuencia de estos genes y específicamente estas regiones que amplifican los primers en cada uno y se mandaron sintetizar con GenScript quien entregó un plásmido (pJET1.2) que incluye esta región. Ya contando con el plásmido se le hizo reacción en cadena de polimerasa con los dos pares de primers corroborando que los primers si identifican las regiones adecuadas.. Identificación por IgM La IgM para Mycoplasma se realizó con 3ml de una prueba sanguínea mediante técnica de inmunoensayo enzimático basado en el principio del sándwich, es decir, los pocillos están recubiertos con un antígeno y los anticuerpos específicos que se unen a Validación del Score TEF para descartar neumonía por Mycoplasma pneumoniae: Estudio Prospectivo. 27.
(28) ellos son detectados por un conjugado enzimático del segundo anticuerpo específico para el antígeno humano. La intensidad del color desarrollado por la reacción del sustrato es proporcional a la cantidad de anticuerpos detectados. Esta prueba seriada se ha considerado el estándar de oro para diagnóstico de Mycoplasma pneumoniae (14, 18, 22),. Panel respiratorio El panel respiratorio FilmArray es un equipo comercial automatizado de PCR múltiples que detecta 17 virus respiratorios (virus sincicial respiratorio, influenza A, influenza A/H1, influenza A/H1 2009, influenza A/H3, influenza B, parainfluenza 1-4, adenovirus, metapneumovirus, enterovirus, bocavirus, coronavirus OC43, 229E, NL63 y HKU1. además. de. 3. bacterias. (Bordetella. pertussis,. Mycoplasma. pneumoniae y Chlamydophila pneumoniae), en un sistema cerrado que requiere de 5 minutos de procesamiento y una hora de instrumentación utilizando como muestra aspirado nasofaríngeo o exudado nasofaríngeo. Tiene una sensibilidad clínica del 90% y una especificidad del 100% específicamente para M. pneumoniae, considerando que se realizaron estimaciones basándose en menos de 10 muestras positivas debido a la baja incidencia de este patógeno.. Score TEF Mientras tanto, la variable dependiente se trata del resultado del Score TEF, el cual se realizó por el médico externo o el residente de guardia cuando el paciente acudió a urgencias por primera vez con sospecha clínica de neumonía. El score TEF consta de. Validación del Score TEF para descartar neumonía por Mycoplasma pneumoniae: Estudio Prospectivo. 28.
(29) tres preguntas: ¿días de fiebre previos a su ingreso?, ¿días de tos previos a su ingreso? y edad del paciente. En base a estas preguntas, se otorgan puntos (Tabla 2):. TABLA 2 Edad (años). Score TEF. Puntos. Días de fiebre. Puntos. Días de tos. Puntos. < 0,5 0 <1 0 <1 0,5 - 2 1 1-3 1 1-3 >2–4 2 >3–5 2 >3–5 >4–7 3 >5–7 3 >5–7 > 7 – 10 4 > 7 – 14 4 > 7 – 14 > 10 5 > 14 5 > 14 Score TEF. Un puntaje de 5 o más en esta escala equivale a una prueba positiva.. 0 1 2 3 4 5. Así mismo otras de las variables a estudiar incluyeron los datos demográficos de los pacientes como la edad y el sexo, la época del año en que se presentaron, así como sus antecedentes patológicos de importancia y el uso de antibióticos previo a su ingreso, buscando relacionar las características con un score positivo o negativo. De la misma manera se analizaron los días de estancia intrahospitalaria que requirieron, el tratamiento antibiótico utilizado y si requirieron de manejo en el área de cuidados intensivos pediátricos. Las variables incluidas que hablan de la patología actual como los síntomas característicos de dificultad respiratoria, rinorrea, congestión nasal, tos, síntomas generales como cefalea, mialgias, artralgias, hiporexia, ataque al estado general astenia, adinamia, vómito, dolor abdominal, crisis convulsivas, cianosis, irritabilidad o hiporreactividad, apneas y disnea también se analizaron para buscar su correlación con un score positivo o negativo, de la misma manera que los estudios de laboratorio que incluyen una biometría hemática, una proteína C reactiva y en caso de pacientes que. Validación del Score TEF para descartar neumonía por Mycoplasma pneumoniae: Estudio Prospectivo. 29.
(30) fueron tratados en hospital privado pruebas como el panel respiratorio o la IgM para M. pneumoniae. Los resultados obtenidos así como la información de los pacientes se anotaron en un archivo de Excel ®, conservando el anonimato del paciente no registrando información que los pudiera identificar de alguna manera.. Análisis estadístico Primero se analizaron las variable demográficas y se reportaron en gráficas de barras y cuadros de contingencia, obteniendo medidas de tendencia central. Al tratarse de un estudio de prueba diagnóstica, se utilizó estadística descriptiva para obtener sensibilidad, especificidad, valor predictivo positivo y negativo del score TEF. Se aplicó el paquete estadístico SPSS versión 18 así como Stata v15 College station, Texas, realizando un análisis factorial de las variables, identificando si existe relación entre la temporada del año que se diagnostica la neumonía y el riesgo de ser identificada como una neumonía atípica mediante el score TEF, así como el uso de antibióticos previo a su diagnóstico e ingreso. Así mismo, se analizó la relación de severidad de la escala con la presentación de ciertos signos y síntomas y con los días de estancia intrahospitalaria. Se aplicó la prueba de Chi Cuadrada de Pearson aceptándose una p de 0.05 o menor.. Validación del Score TEF para descartar neumonía por Mycoplasma pneumoniae: Estudio Prospectivo. 30.
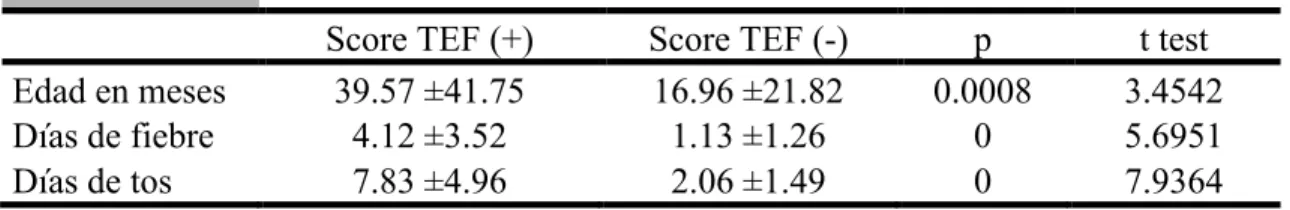
(31) Capítulo 4. Resultados Se incluyeron un total de 117 pacientes en un periodo comprendido entre Diciembre 2018 a Junio 2019, realizándose el seguimiento completo de 110 pacientes (94.01%) perdiéndose 7 pacientes debido a falta de información en el expediente clínico. Se analizó la información y intentó obtener la sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo para el score TEF comparándolo con el estándar oro elegido que fue PCR para Mycoplasma pneumoniae tanto en exudado faríngeo y saliva, no pudiendo obtener estos valores debido a que no se encontraron pruebas positivas. Se analiza la información en las siguientes tablas (Tabla 3, 4 y 5). TABLA 3. Tabla de contingencia al aplicar el score TEF PCR (+) PCR (-) Score (+) 0 60 Score (-) 0 50 Se identifica a los pacientes con un score TEF positivo o negativo comparándolo con el resultado de PCR para Mycoplasma pneumoniae que fue negativa en muestra salival y de exudado nasofaríngeo en todos los pacientes. TABLA 4. Estudio de prueba diagnóstica Sensibilidad Especificidad 0 45.45. V.P.P. Valor predictivo positivo. V.P.P. 0 V.P.N.. V.P.N. 100 Valor predictivo negativo. Sensibilidad, especificidad, valor predictivo positivo y negativo obtenidos para el score TEF comparándolos con la PCR en exudado nasofaríngeo y salival. TABLA 5. Evaluación de características del score TEF Score TEF (+) Score TEF (-) p t test Edad en meses 39.57 ±41.75 16.96 ±21.82 0.0008 3.4542 Días de fiebre 4.12 ±3.52 1.13 ±1.26 0 5.6951 Días de tos 7.83 ±4.96 2.06 ±1.49 0 7.9364 Comparación de la edad promedio de presentación, los días de tos y días de fiebre que tuvieron los pacientes en el grupo con score positivo vs los pacientes con score negativo..
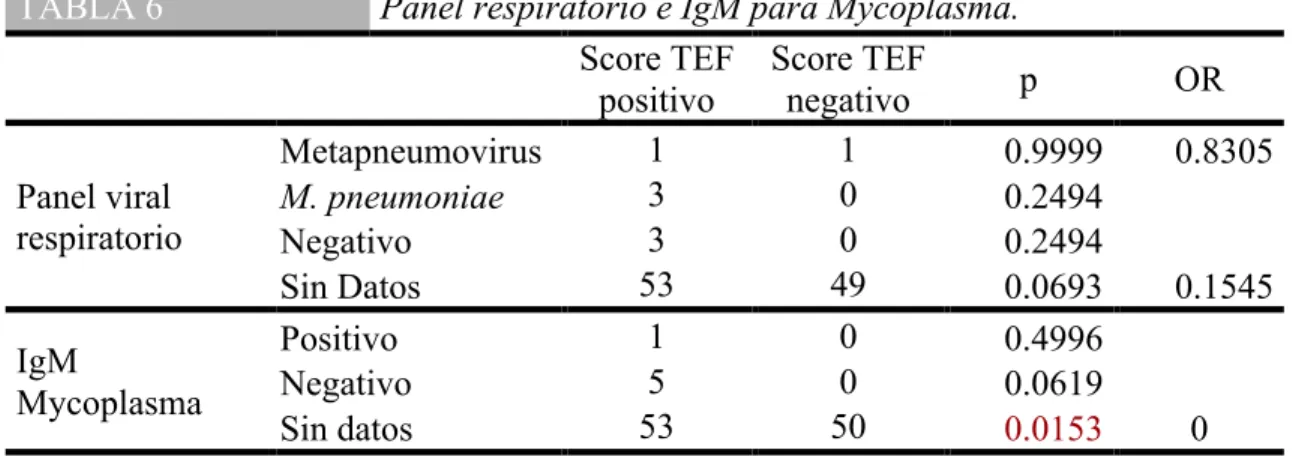
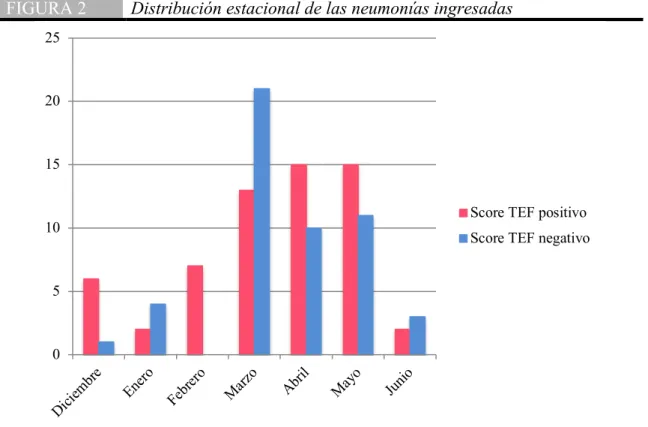
(32) Se realizó únicamente en 8 pacientes del Hospital San José y Hospital Zambrano Hellion el panel respiratorio encontrando tres pacientes con M. pneumoniae positivo, 2 con metapneumovirus y tres mas con panel respiratorio negativo (Tabla 6). TABLA 6. Panel respiratorio e IgM para Mycoplasma. Score TEF Score TEF p OR positivo negativo 1 1 Metapneumovirus 0.9999 0.8305 3 0 Panel viral M. pneumoniae 0.2494 respiratorio 3 0 Negativo 0.2494 53 49 Sin Datos 0.0693 0.1545 1 0 Positivo 0.4996 IgM 5 0 Negativo 0.0619 Mycoplasma 53 50 Sin datos 0.0153 0 Se muestra el número de pacientes a los cuales se les realizó un panel respiratorio y una cuantificación de IgM para Mycoplasma a su ingreso.. Con la información obtenida y las variables establecidas, se llevaron a cabo otros análisis estadísticos que se presentaran en el siguiente apartado de acuerdo a si el score TEF fue positivo o negativo.. Distribución estacional en el periodo del estudio Del total de 110 pacientes, 7 corresponden al año 2018 y 103 al 2019, representando el 6.36 y 93.63% de los pacientes diagnosticados de neumonía en el servicio de pediatría. La distribución por meses viene representada en el siguiente gráfico (Fig. 2), destacando un aumento de incidencia en Marzo Abril y Mayo, meses en los que se recogieron el 77.2% de los episodios, sin observarse alguna diferencia entre los pacientes con score TEF positivo y score TEF negativo.. Validación del Score TEF para descartar neumonía por Mycoplasma pneumoniae: Estudio Prospectivo. 32.
(33) FIGURA 2. Distribución estacional de las neumonías ingresadas. 25. 20. 15 Score TEF positivo. 10. Score TEF negativo. 5. io Ju n. M ay o. il A br. M ar zo. o re r Fe b. ro En e. D ic ie m. br e. 0. Se observa un aumento en el diagnóstico de neumonías durante los meses de Marzo a Mayo en ambos grupos estudiados.. Descripción por edad y sexo La edad de estos pacientes, de los cuales 63 fueron masculinos, osciló entre los 3 meses y 13 años, siendo la mediana de 1 año; y 47 femeninos, con edades comprendidas entre el mes de edad y los 9 años, siendo la mediana nuevamente de 1 año. En la siguiente gráfica, se puede ver un predominio de pacientes en el rango de menores de 1 año con leve preferencia no significativa por el sexo masculino. (Fig. 3). Validación del Score TEF para descartar neumonía por Mycoplasma pneumoniae: Estudio Prospectivo. 33.
(34) FIGURA 3 60. 50. 40. 30. 20. 10. 0 <1. 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. Población femenina positiva. Población masculina positiva. Población femenina negativa. Población masculina negativa. 12. 13. Representación de la población en cuanto al sexo y de acuerdo al resultado del score TEF. Antecedentes patológicos en la población estudiada Se recogieron los datos referentes a antecedentes de ingresos hospitalarios en el último mes así como patologías las cuales se agruparon de acuerdo al órgano o sistema que involucraban. Se apreció un 30% de antecedentes de patología pulmonar entre los que se incluían las sibilancias del lactante, asma y broncodisplasia pulmonar siendo esta prevalencia mayor entre los pacientes con score TEF positivo, pero sin ser estadísticamente significativo, un 7% de antecedentes de cardiopatía y solamente un 31% de pacientes sin patologías de base. Así mismo un 11.8% de pacientes contaban con un ingreso hospitalario previo en el último mes. Estos datos se aprecian en la siguiente tabla (Tabla 7): Validación del Score TEF para descartar neumonía por Mycoplasma pneumoniae: Estudio Prospectivo. 34.
(35) TABLA 7. Antecedentes patológicos en la población estudiada Score TEF negativo Score TEF positivo N % N % Cardiopatías 4 4 8.00 6.67 Neumopatías 13 20 26.00 33.33 Prematurez 5 4 10.00 6.67 Enfermedades neurológicas 6 7 12.00 11.67 Enfermedades genéticas 2 9 4.00 15.00 Enfermedades renales 0 2 0.00 3.33 Sanos 30 29 60.00 48.33 Ingresos previos 7 6.4 6 5.5 Tanto en el grupo del score positivo como el del negativo se encontraron en su mayoría pacientes con antecedentes de neumopatía. Se observa el número de pacientes con y su porcentaje respecto al grupo en el que se encuentran. Presentación clínica En la siguiente tabla (Tabla 8 ) podemos ver la incidencia de los diferentes signos y síntomas que se presentaron en ambos grupo, encontrando que los pacientes con score TEF positivo tuvieron una menor probabilidad de tener cianosis (p 0.0216) y mayor probabilidad de tener tos (p 0.0245). Signos y síntomas presentes durante evolución clínica Score TEF positivo Score TEF negativo N % N % Fiebre 9 15.00 7 14.00 Congestión nasal 14 23.33 18 36.00 Rinorrea 25 41.67 30 60.00 Dolor abdominal 3 5.00 0 0.00 Hiporexia 20 33.33 11 22.00 Cianosis al toser 7 11.67 2 4.00 Astenia 11 18.33 5 10.00 Adinamia 10 16.67 5 10.00 Vómito 10 16.67 9 18.00 Cefalea 3 5.00 1 2.00 Diarrea 3 5.00 0 0.00 Crisis convulsivas 1 1.67 2 4.00 Irritabilidad 2 3.33 3 6.00 Apneas 0 0.00 1 2.00 TABLA 8. p 0.9999 0.101 0.1799 0.2494 0.2084 0.1782 0.4332 0.5917 0.8046 0.6244 0.2494 0.5899 0.6575 0.4545. Validación del Score TEF para descartar neumonía por Mycoplasma pneumoniae: Estudio Prospectivo. 35.
(36) Score TEF positivo Score TEF negativo p N % N % Disnea 1 1.67 0 0.00 0.9999 Otorrea 1 1.67 0 0.00 0.9999 Hiporreactividad 0 0.00 2 4.00 0.2043 Tos emetizante 4 6.67 0 0.00 0.1244 Cianosis 2 3.33 9 18.00 0.0216 Taquipnea 34 56.67 28 56.00 0.9999 Tos 47 78.33 28 56.00 0.0245 Aleteo nasal 7 11.67 13 26.00 0.0808 Tirajes 38 63.33 40 80.00 0.0927 Estertores 38 63.33 27 54.00 0.1792 Hipoventilación 11 18.33 11 22.00 0.6414 Sibilancias 26 43.33 19 38.00 0.8463 Se muestran los síntomas evaluados así como los signos clínicos evidentes al ingreso de los pacientes al hospital, con el porcentaje que representan en la totalidad del grupo al que pertenecen.. Se analizaron los signos vitales iniciales de todos los pacientes encontrando significancia tanto en la frecuencia cardiaca y la frecuencia respiratoria con una p de 0.0122 y 0.0121 respectivamente, esto secundario a que existe una pequeña diferencia de porcentaje de pacientes en distintos grupos etarios (Tabla 9). Signos vitales al ingreso Score TEF Score TEF p t. test positivo negativo Frecuencia cardiaca 146.05 ±24.91 158.36 ±25.56 0.0122 -2.5503 Frecuencia respiratoria 40.63 ±13.67 46.84 ±11.42 0.0121 -2.5517 Saturación de oxígeno 93.18 ±4.46 91.74 ±5.1 0.1162 1.5836 Variabilidad en cuanto a los signos vitales al ingreso, mostrando la frecuencia cardiacos como latidos por minutos, la frecuencia respiratoria como respiraciones por minuto y la saturación de oxígeno como porcentaje. TABLA 9. Validación del Score TEF para descartar neumonía por Mycoplasma pneumoniae: Estudio Prospectivo. 36.
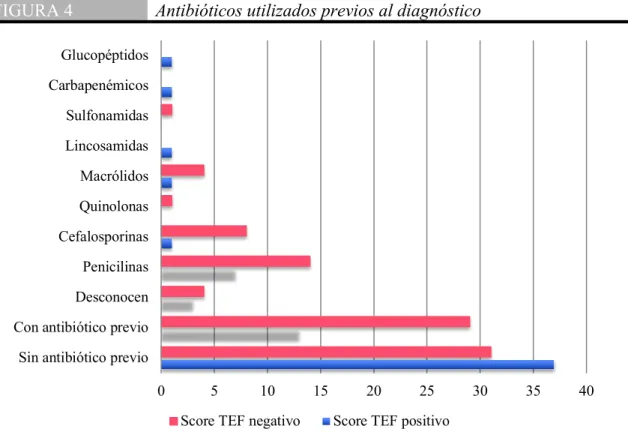
(37) Evaluación diagnóstica Se cuenta con los resultados de la biometría hemática y proteína C reactiva realizados a su ingreso, donde no se encuentra una relación entre los valores de los mismos y la escala de severidad del score TEF como se podría suponer. Se exponen los resultados en la siguiente tabla (Tabla 10). TABLA 10. Evaluación de la biometría hemática y proteína C reactiva Score TEF (+) Score TEF (-) p t test Hemoglobina 11.25 ±1.61 11.34 ±1.95 0.7848 -0.2737 Hematocrito 33.63 ±4.9 34.21 ±5.15 0.5461 -0.6055 Leucocitos 13.2 ±7.61 14.07 ±7.08 0.5374 -0.6188 Neutrófilos 7.64 ±5.86 8.05 ±5.54 0.709 -0.3742 Linfocitos 4.01 ±3.01 4.59 ±3.89 0.3762 -0.8885 Plaquetas 363.85 ±151.2 359.34 ±156.78 0.8785 0.1532 Bandas 2.62 ±6.91 2.86 ±6.71 0.8833 -0.1474 Proteína C reactiva 1.73 ±3.97 1.87 ±2.75 0.8454 -0.1955 Se muestran los valores absolutos de los recuentos obtenidos en la biometría hemática y valor de la proteína C reactiva sin encontrar una significancia estadística de los mismos. Tratamiento antibiótico Previo al diagnóstico Cuarenta y cuatro pacientes (40%) habían recibido antibióticos previo a su ingreso hospitalario, habiendo utilizado un 17% penicilinas, 7% cefalosporinas, 4% macrólidos y un 6% desconocen que tipo de antibiótico les fue indicado. En las siguiente gráfica y tabla (Fig. 4) (Tabla 11) vemos su representación de acuerdo a su clasificación en el grupo de score TEF positivo y negativo, encontrando que una gran parte de los pacientes con score TEF negativo habían recibido antibiótico en las dos semanas previas, siendo las penicilinas las mas utilizadas; mientras que la mayoría de los pacientes con score TEF positivo no habían recibido ningún tipo de antibiótico. Cabe mencionar que 5 pacientes utilizaron una combinación de antibióticos. Validación del Score TEF para descartar neumonía por Mycoplasma pneumoniae: Estudio Prospectivo. 37.
(38) FIGURA 4. Antibióticos utilizados previos al diagnóstico. Glucopéptidos Carbapenémicos Sulfonamidas Lincosamidas Macrólidos Quinolonas Cefalosporinas Penicilinas Desconocen Con antibiótico previo Sin antibiótico previo 0. 5. 10. Score TEF negativo. 15. 20. 25. 30. 35. 40. Score TEF positivo. Se observa una similitud entre los pacientes que usaron y no usaron antibióticos en los pacientes con score TEF negativo. Se agruparon los diferentes antibióticos de acuerdo a su clasificación por mecanismo de acción observándose un uso importante de cefalosporinas y mayormente penicilinas en ambos grupos. Antibiótico utilizado previo al ingreso Score TEF positivo Score TEF negativo p N % N % 31 28.18 37 33.64 Sin antibiótico previo 29 26.36 13 11.82 Con antibiótico previo 4 3.64 3 2.73 Desconocen 14 12.73 7 6.36 Penicilinas 0.0382 8 7.27 1 0.91 Cefalosporinas 0.2347 1 0.91 0 0.00 Quinolonas 0.9999 4 3.64 1 0.91 Macrólidos 0.374 0 0.00 1 0.91 Lincosamidas 0.4545 1 0.91 0 0.00 Sulfonamidas 0.9999 0 0.00 1 0.91 Carbapenémicos 0.4545 0 0.00 1 0.91 Glucopéptidos 0.4545 Se representa el porcentaje de acuerdo al número total de pacientes en el estudio. TABLA 11. Validación del Score TEF para descartar neumonía por Mycoplasma pneumoniae: Estudio Prospectivo. 38.
(39) Tratamiento empleado tras diagnóstico En 88 pacientes (80%) el tratamiento fue por vía endovenosa (IV) , siendo la mediana de los días de tratamiento de 7 días, para los pacientes con score TEF positivo de 6.88±3.03 y los que tienen un score TEF negativo de 7.13±2.24. Dentro de estos, el 46.27% de los pacientes recibieron tratamiento con una cefalosporina, 8.2% con una penicilina y 40.1% con un macrólido considerando que el 28% de los pacientes recibió tratamiento combinado. En el siguiente gráfico (Fig. 5) podemos ver los distintos antibióticos utilizados en el tratamiento, sin encontrar un patrón de uso : FIGURA 5. Antibióticos utilizados como tratamiento médico. 60 50 40 30 20. 0. Sin uso de antibióticos Uso de antibióticos Ceftriaxona Vancomicina TMP/SMX Claritromicina Amoxicilina-ácido clavulánico Cefepime Ampicilina Cefotaxima Eritromicina Cefixima Clindamicina Meropenem Metronidazol Azitromicina Cefotaxima + Eritromicina Ceftriaxona + Clindamicina Claritromicina + Cefotaxima Vancomicina + TMP/SMX Claritromicina + Amoxicilina-ácido clavulánico TMP/SMX + Clindamicina Cefotaxima + Clindamicina Ceftriaxona + Claritromicina Claritromicina + Eritromicina Vancomicina + Claritromicina + Clindamicina Claritromicina + Metronidazol Ceftriaxona + Vancomicina Ceftriaxona + Amoxicilina ácido-clavulánico Claritromicina + Clindamicina Claritromicina + Ampicilina Ceftriaxona + Azitromicina Ceftriaxona + Vancomicina + Cefepime. 10. Score TEF positivo. Score TEF negativo. Tanto en los pacientes con un score TEF positivo y negativos, se observa un gran uso de antibióticos entre los que destacan la ceftriaxona o claritromicina en monoterapia y combinados. Validación del Score TEF para descartar neumonía por Mycoplasma pneumoniae: Estudio Prospectivo. 39.
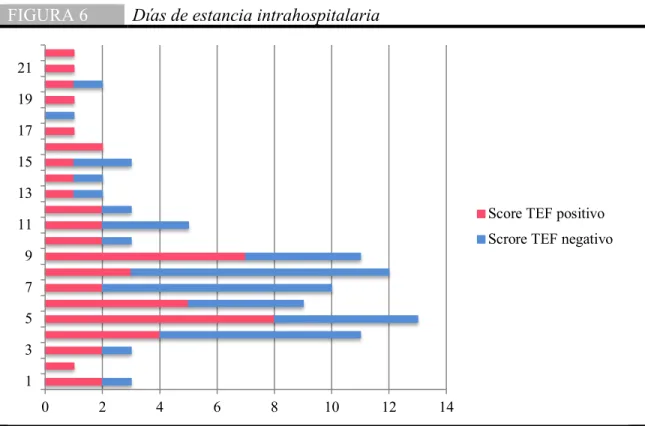
(40) Estancia en el hospital En cuanto a los días de estancia intrahospitalaria, no hubo una diferencia significativa entre los dos grupos pero si se observa un ligero predominio de mayor días de estancia en los pacientes con un score TEF positivo observándose una mediana de 2 días (8.23 ±7.37) mientras que los pacientes con un score negativo tuvieron una mediana de 1 día (7.36 ±4.34) (Fig. 6). FIGURA 6. Días de estancia intrahospitalaria. 21 19 17 15 13 Score TEF positivo. 11. Scrore TEF negativo. 9 7 5 3 1 0. 2. 4. 6. 8. 10. 12. 14. En esta gráfica de barras se puede apreciar que no hay ninguna diferencia en los días de estancias hospitalaria entre ambos grupos. De la misma manera, en la siguiente figura, se observa que el hecho de tener un score TEF positivo no aumenta el riesgo de estancia en el área de cuidados intensivos pediátricos (Fig. 7).. Validación del Score TEF para descartar neumonía por Mycoplasma pneumoniae: Estudio Prospectivo. 40.
(41) FIGURA 7. Ingresos a la Unidad de Cuidados Intensivos Pediátricos. 60 50 40 Score TEF positivo. 30. Score TEF negativo 20 10 0 Si. No. Tanto en los pacientes con un score TEF positivo y negativos hay un índice muy bajo de ingreso al área de cuidados intensivos pediátricos.. Validación del Score TEF para descartar neumonía por Mycoplasma pneumoniae: Estudio Prospectivo. 41.
(42) Capítulo 5. Análisis y discusión A pesar del desarrollo de procedimientos diagnósticos y estrategias terapéuticas, la neumonía por Mycoplasma pneumoniae sigue siendo un problema clínico grave en los niños que incluye un gasto elevado en su manejo, tanto a nivel hospitalario como ambulatorio. En este estudio se pretendió validar el score TEF como una herramienta diagnóstica para neumonía por Mycoplasma pneumoniae. Se seleccionó la PCR como estándar de oro, aunque se ha visto que tomar una muestra para IgM y PCR de manera combinada en la etapa aguda aumenta la sensibilidad y especificidad de realizar el diagnóstico de neumonía por Mycoplasma pneumoniae (22, 33), pero el hacer esto aumentaría el costo de nuestro estudio además de tener una mayor probabilidad de pérdida de pacientes, debido a que se tendrían que presentar dos semanas posteriores al día de su ingreso para realizase otra prueba sanguínea para documentar la cuadruplicación de títulos de IgM. Se decidió tomar dos pruebas de PCR, una de exudado faríngeo y una de saliva. La literatura apoya la muestra de exudado faríngeo o aspirado nasal existiendo una correlación de estos resultados con la infección activa por la bacteria y existe muy poca información acerca de un resultado de PCR en saliva positivo para Mycoplasma y su implicación como causa de enfermedad infecciosa del parénquima pulmonar (25). Se busca correlacionar estos resultados para apoyar el uso de la muestra salival como nuevo método diagnóstico tomando en cuenta que ambas pruebas de PCR fueron estandarizadas.
(43) por el grupo de biotecnología del Instituto Tecnológico de Monterrey, siguiendo los lineamientos de Komatsu et al (27). De manera muy interesante la prevalencia de M. pneumoniae en nuestra población de estudio fue nula, sin haber una incidencia o prevalencia registrada en nuestro país para comparar, tanto en PCR de exudado nasofaríngeo y de muestra salival con una concordancia del 100% entre pruebas, coincidiendo estos resultados con los publicados recientemente por Marcone et al., quienes detectaron una incidencia tan baja como del 0.2-0.4% para neumonías causadas por Mycoplasma pneumoniae, mediante el uso de PCR con duplicación de DNA en pruebas de aspirado nasofaríngeo (34). Llama la atención que tres de los ocho pacientes a los cuales se les realizó un panel respiratorio obtuvieron una prueba positiva para M. pneumoniae con una PCR puntual negativa de nuestro grupo de Biotecnología. El panel respiratorio que se realiza es marca Biofire ® (35), el cual consiste en un filmarray que mediante la técnica de PCR amplifica y duplica la cantidad de copias de ADN de los virus y bacterias que identifica entre las que se encuentra Mycoplasma pneumoniae tomando como base una proteína diferente a la 23S rRNA, por lo que se pueden hacer dos inferencias; las copias de ADN de M. pneumoniae en las muestras obtenidas era insuficiente para ser identificadas por una PCR puntual y que el plásmido utilizado en el panel respiratorio no es especifico para M. pneumoniae. Así, ante la presencia de cero pacientes con nuestra PCR para M. pneumoniae positiva y el número tan bajo de pacientes con la prueba de panel respiratorio positiva para Mycoplasma pneumoniae no es posible extender el análisis y por lo tanto no es posible validar el score TEF como una herramienta de diagnóstico clínica de descarte; es. Validación del Score TEF para descartar neumonía por Mycoplasma pneumoniae: Estudio Prospectivo. 43.
(44) decir, al tener un score TEF positivo se debe de realizar una prueba diagnóstica aceptada como la PCR en exudado nasofaríngeo u obtener una cuatriplicación de títulos de IgM en dos semanas para corroborar al sospecha, pero al tener un score TEF negativo se puede o debe desestimar la sospecha de neumonía por Mycoplasma pneumoniae. Se consideró la presencia de un índice de fallo, no tanto en la realización de la prueba de PCR, sino mas bien, en la posibilidad de tener falsos negativos debido a que la carga de copias de ADN de Mycoplasma era menor a 0.6 log copias/ml en las muestras (27). Por otro lado, se analizo la diferencia entre las variables en los dos grupos de pacientes, los que contaban con un score TEF positivo y los de score negativo. Se puede inferir, de acuerdo a las tablas 8, y 11 además de la figura 6, que las neumonías que obtuvieron un score TEF negativo fueron menos severas ya que presentan síntomas generales mas leves, un menor número de días de estancia intrahospitalaria y un menor uso de antibióticos. Así mismo, si tomamos el score TEF como una escala de severidad, observamos que no hay diferencia en los parámetros de laboratorio pero si en los clínicos, con una frecuencia respiratoria elevada en los pacientes con score negativo así como tendencia a la taquicardia y a pesar de que no fue estadísticamente significativo, la oximetría de pulso levemente disminuida en este grupo, que en caso de validar el score, correlacionaría con lo descrito con la clínica acerca de la sintomatología leve en pacientes con neumonías atípicas, teniendo en cuenta que para que estos resultados tengan validez habría que compararlos con la escala siendo utilizada como escala de severidad, equiparando de manera paradójica un mayor puntaje en el score con una clínica mas leve (9). De igual. Validación del Score TEF para descartar neumonía por Mycoplasma pneumoniae: Estudio Prospectivo. 44.
Figure

Documento similar
Para ello, trabajaremos con una colección de cartas redactadas desde allí, impresa en Évora en 1598 y otros documentos jesuitas: el Sumario de las cosas de Japón (1583),
La utilización de la ecografía Doppler en estas áreas de consolidaciones subpleurales permite evidenciar la ausencia de flujo sanguíneo, probablemente debido a la fisiopatología
De las muestras realizadas en saliva y en exudado nasofaríngeo en el laboratorio de biotecnología del Tecnológico de Monterrey, ninguna resultó positiva para Mycoplasma pneumoniae,
IV.3.3 Ruido de los multiplicadores de frecuencia 90 IV.3.4 Ruido de los amplificadores 91
«Según el artículo 21 de la vigente Ley de Expropiación de 16 de diciembre de 1954, el acuerdo de necesidad de ocupación inicia el ex- pediente expropiatorio, y a tenor del artículo
En el periodo de estudio, se aisló Kp-BLEE en muestras clínicas y/o epidemiológicas en 87 pacientes: 15 pacientes (17%) presentaron infección y colonización rectal, 3
Para suelos impermeables arenosos (o con grava) con un 40 a 85% en peso (de la fracción más fina que el tamiz nº 4) de partículas más finas que el tamiz 200, el filtro de
Para cumplir con el primer objetivo especifico se analizaron las características clínicas de los pacientes que cursan una neumonía atípica causada por Chlamydophila