La Química no es un pestiño
Texto completo
Figure

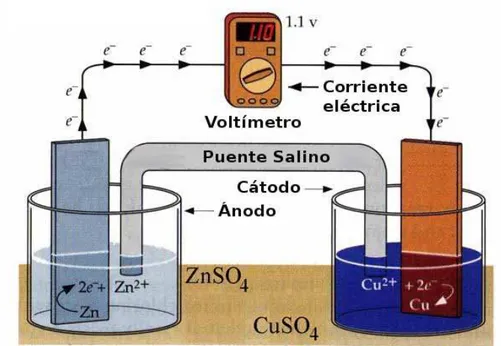
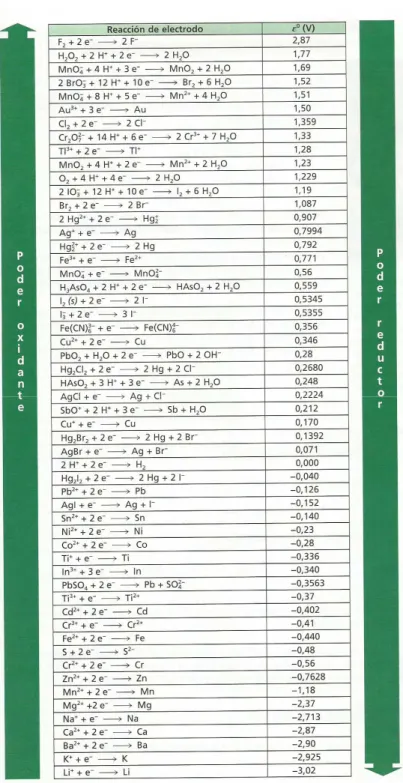
Documento similar
diabetes, chronic respiratory disease and cancer) targeted in the Global Action Plan on NCDs as well as other noncommunicable conditions of particular concern in the European
d) que haya «identidad de órgano» (con identidad de Sala y Sección); e) que haya alteridad, es decir, que las sentencias aportadas sean de persona distinta a la recurrente, e) que
Las manifestaciones musicales y su organización institucional a lo largo de los siglos XVI al XVIII son aspectos poco conocidos de la cultura alicantina. Analizar el alcance y
Proporcione esta nota de seguridad y las copias de la versión para pacientes junto con el documento Preguntas frecuentes sobre contraindicaciones y
[r]
Contraindicaciones: El uso de la mascarilla está contraindicado para los pacientes y los miembros de sus familias, profesionales sanitarios y compañeros de
Para recibir todos los números de referencia en un solo correo electrónico, es necesario que las solicitudes estén cumplimentadas y sean todos los datos válidos, incluido el
Sólo que aquí, de una manera bien drástica, aunque a la vez coherente con lo más tuétano de sí mismo, la conversión de la poesía en objeto -reconocida ya sin telarañas