Efectos de la defoliación causada por insectos mordedores (Trichoplusia ni) y de forma mecánica sobre parámetros cuantitativos y cualitativos del grano de quínoa (Chenopodium quinoa)
Texto completo
(2) Agradecimientos. Quisiera agradecer a todas las personas que me apoyaron y ayudaron a lo largo de este magister, a mi profesor guía Rodrigo Chorbadjian por su paciencia, confianza y constante apoyo en el desarrollo de esta investigación y en el trabajo en el laboratorio. A mi profesor informante, Samuel Contreras por siempre estar dispuesto a resolver dudas. A Nathe McCartney por realizar las mediciones de las saponinas. A Tamara, Karo y Fabián por ayudarme a contar, pesar, separar infinitas semillas de quínoa. A mis grandes amigas del departamento de Ciencias Vegetales, Marce, Eli y Glori por su amistad, risas, cariño y por sus inmensas ayudas varias durante todo este tiempo. A mi familia y especialmente a mi Benja por su paciencia, preocupación, por sus críticas constructivas y por su infinito apoyo incondicional todos estos años. A mi Tango por tantos horas de compañía durante el estudio del magister y la escritura de esta tesis..
(3) A Soledad Ahumada Becker.
(4) Índice. Abstract ......................................................................................................................................... 2 Introducción .................................................................................................................................. 4 La quínoa como modelo de estudio de tolerancia al daño ............................................... 8 Materiales y Métodos ................................................................................................................ 11 Material Vegetal, Insectos y diseño experimental ............................................................ 11 Parámetros cuantitativos ...................................................................................................... 12 Parámetros cualitativos ........................................................................................................ 13 Análisis estadístico ................................................................................................................ 15 Resultados.................................................................................................................................. 16 Parámetros cuantitativos ...................................................................................................... 16 Parámetros Cualitativos ....................................................................................................... 21 Discusión .................................................................................................................................... 28 Conclusiones .............................................................................................................................. 34 Resumen..................................................................................................................................... 35 Referencias ................................................................................................................................ 37. 1.
(5) Efectos de la defoliación causada por insectos mordedores (Trichoplusia ni) y de forma mecánica sobre parámetros cuantitativos y cualitativos del grano en quínoa (Chenopodium quinoa). María Isabel Ahumada Becker. Departamento de Ciencias Vegetales, Facultad de Agronomía e Ingeniería Forestal. Pontificia Universidad Católica de Chile. Santiago, Chile. Abstract Ahumada M.I. 2019. Effects of defoliation caused by chewing insect (Trichoplusia ni) and mechanical damage over quantitative and qualitative parameters of quinoa grains (Chenopodium quinoa). Tesis, Magister en Fisiología y Producción Vegetal Facultad de Agronomía e Ingeniería Forestal. Pontificia Universidad Católica de Chile. Santiago, Chile. 45 pp. Insect attack can cause significant damage to plants decreasing its growth rate and yield. Despite this, plants have the ability to recover compensating the losses, a concept known as tolerance. Regarding this, the response to defoliation on the quantity and quality of the quinoa grain (Chenopodium quinoa Willd.) has not been studied. This research studied the response of quinoa plant at different intensities of defoliation induced by insect and by artificial damage, measuring quantitative and qualitative parameters of the grain. Plants were treated with different intensities of defoliation (20%, 40% and 60%) induced by cabbage looper (Trichoplusia ni Hübner) and by artificial damage. It was observed that quinoa plant is capable of tolerating up to 60% of defoliation, maintaining the same yield, biomass, harvest index and growth rate as the control plants. Moreover, the plant tends to overcompensate some parameters at 20% of defoliation. Artificial defoliated plants produced less number of ramifications and less foliar area compared to insect induced defoliated plants and control plants. Grain quality parameters did not showed differences between treatments measured in number of grains, weight of grains and weight of 1000 grains arranged by its size. Grain chemical composition was assessed, and no differences were found in phenols content and antioxidant capability. In the case of sapogenins, defoliation affected their concentration, but only with mechanical damage defoliation. This is the first research of tolerance to different levels of defoliation caused by insects and by an artificial method on quinoa plant.. 2.
(6) Key words: tolerance, compensation response, herbivory, artificial defoliation, sapogenins. 3.
(7) Introducción. Un gran número de plagas consumen hojas y otros tejidos de las plantas reduciendo su crecimiento y la producción de granos, lo que genera una disminución en el rendimiento. Sin embargo, los insectos no siempre producen un daño en las plantas, ya que éstas pueden responder compensando lo perdido por la herbivoría. Esta facultad que tienen las plantas de recuperarse del daño producido por herbívoros en términos de crecimiento y rendimiento se denomina tolerancia. Las plantas al estar sometidas a los daños producidos por los insectos, pueden presentar tres tipos de respuestas. La respuesta de las plantas donde producen un mayor rendimiento después de un ataque de herbívoros que plantas no dañadas, se denomina sobrecompensación (Strauss y Agrawal 1999, Stowe et al., 2000). Por otra parte, plantas que disminuyen sus rendimientos son susceptibles, y plantas que alcanzan rendimientos similares a las no dañadas, es decir, no se ven afectadas, presentan respuestas compensatorias (Strauss y Agrawal 1999, Stowe et al., 2000). A pesar de que se conocen respuestas de tolerancia en muchas plantas (García y Eubanks 2018), hay algunas especies vegetales que han sido poco estudiadas, particularmente aquellas destinadas para alimentación humana. La capacidad de las plantas de compensar el daño causado por herbívoros puede ser medida a través de parámetros cuantitativos asociados al rendimiento de las plantas como peso de los granos, cantidad de materia seca, parámetros con los cuales se puede determinar un índice de cosecha. Este parámetro representa la fracción o proporción entre el peso del producto cosechado y el peso total de la parte aérea de la planta. Es un factor importante para determinar la productividad de los cultivos ya que refleja la inversión de la planta en la asignación de carbono para producir componentes reproductivos (Sinclair 1998, Unkovich et al., 2010) Este valor puede disminuir debido al ataque de insectos en las plantas ya que éstos afectan en algunos casos el desarrollo de flores y granos (Unkovich et al., 2010). Además se pueden determinar otros parámetros cuantitativos como altura, área foliar, entre otros. La tolerancia también puede ser medida mediante parámetros cualitativos, ya que es importante evaluar los cambios que se puedan producir en el producto cosechado (Mitchell et al., 2016). Estos parámetros son en general menos estudiados por ejemplo, la composición química de los granos como compuestos o metabolitos secundarios que 4.
(8) producen las plantas y que pueden ser inducidos por insectos. Otro aspecto de calidad es el tamaño de los granos, lo cual es importante en el proceso de comercialización de éstos. Las plantas al estar sometidas a la herbivoría pueden presentar diferentes mecanismos de tolerancia que les ayuden a compensar el daño producido. Existen factores intrínsecos o cambios fisiológicos (Strauss y Agrawal 1999, Iqbal et al., 2012) propios de las plantas que les permiten compensar el daño producido por los insectos. Estos cambios fisiológicos y de desarrollo de las plantas pueden expresarse de diferentes maneras como por ejemplo, aumento en las tasas fotosintéticas, aumento en la tasa relativa de crecimiento, la activación de meristemas, incremento de ramificaciones o número de macollos, niveles prexistentes y traslocación de reservas de carbono y nitrógeno y adicionalmente cambios en la fenología y arquitectura de las plantas (Strauss y Agrawal 1999, Stowe 2000, Tiffin 2000, Smith 2005, Schwachtje y Baldwin 2008, Mitchel et al., 2016, Peterson et al., 2017). Existen por otra parte varios factores extrínsecos que inciden en la respuesta de la planta para lograr tolerar el daño producido por herbivoría. Algunos de estos factores son el tipo de daño, las partes de la planta que son dañadas y la intensidad del daño, entre otros. El tipo de daño y las partes de las plantas dañadas son factores relevantes en la forma en que la planta compensa el daño producido y pueden desencadenar mecanismos de tolerancia diferentes (Strauss y Agrawal 1999). El mecanismo por el cual la planta tolera puede variar según el hábito alimenticio del insecto (Zhou et al., 2015). Insectos mordedores pueden causar daño en los tejidos aéreos de la planta y defoliarla disminuyendo su capacidad fotosintética (Zhou et al., 2015), sin embargo, los insectos que defolian la parte vegetativa de la plantas pueden hacer también que aumente la capacidad fotosintética de las hojas que se mantienen en la planta luego del ataque (Schwachtje y Baldwin, 2008, otros). Insectos defoliadores además, pueden remover yemas apicales eliminando la dominancia apical y fomentando el crecimiento de yemas laterales, que sin embargo, pueden perjudicar el manejo de los cultivos produciendo retrasos en la floración y en la producción de semillas (Paige 1999). La intensidad del daño es relevante porque se asocia al concepto de umbral de daño económico, es decir, el nivel de daño o población de insectos donde se debe tomar una decisión de manejo para no ocasionar pérdidas económicas (Ramsden et al., 2017). La 5.
(9) tolerancia puede ser medida como un umbral de daño (Stieha y Poveda 2014) y en consecuencia puede determinar la aplicación o no de medidas de control (Ramsden et al., 2017). Si la planta es más tolerante (soporta un número mayor de insectos o un porcentaje mayor de daño) significa que su umbral puede ser mayor sin causar un daño económico. Se ha estudiado la respuesta de algunas especies al daño causado por insectos en distintas intensidades midiendo diferentes parámetros cuantitativos. Por ejemplo, en plantas de mostaza negra, Brassica nigra, infestadas con polilla blanca de la col (Pieris brassicae) con distintas densidades y en diferentes momentos fenológicos, se vio que las plantas infestadas produjeron mayor cantidad de semillas independiente del momento de infestación (Blatt et al., 2008). En papa (Solanum tuberosum) se observó que plantas atacadas por un bajo número de larvas de polilla de la papa de Guatemala (Tecia solanivora) produce un aumento de la masa de los tubérculos, aumentando el rendimiento (Poveda et al., 2010). En la maleza Lythrum salicaria se estudió el efecto del. coleóptero. controlador. biológico. Galerucella. calmariensis. con. diferentes. intensidades de defoliación produciendo plantas de menor altura, cambios en la arquitectura de la planta con mayor cantidad de ramificaciones y por tanto mayor número de inflorescencias (Schat y Bloosey 2005). Otra maleza, Alliaria petiolata fue capaz de compensar el número de semillas con un nivel bajo de densidad de insectos (Gerber et al., 2008). En menor medida se han investigado parámetros cualitativos despues del ataque de insectos. Por ejemplo, se ha reportado una disminución de la calidad de la semilla y por consiguiente de la fibra de plantas de algodón luego del ataque de insectos, entre ellos lepidópteros (Sadras y Felton 2010). Los insectos pueden interferir con ciertas rutas metabólicas relacionadas al metabolismo secundario de las plantas (Karban y Agrawal 2002, Shoonhoven et al., 2005), potencialmente modificando el fenotipo (o la calidad) de las plantas atacadas. Su alimentación puede inducir cambios físico-químicos y químicos (Shoonhoven et al., 2005), haciendo que los compuestos dañinos producidos por la planta disminuyan o aumenten. Por ejemplo, la enzima glucosa oxidasa producida por la saliva del gusano cortador Helicoverpa zea suprime la producción de nicotina en plantas de tabaco (Musser et al., 2002, Gog et al., 2014).. 6.
(10) Se han realizado esfuerzos por simular artificialmente el daño causado por insectos para estudiar las respuestas de crecimiento compensatorio, por ejemplo defoliando mecánicamente para simular la remoción de hojas por parte de insectos mordedores. Sin embargo se ha visto que la capacidad de la planta de responder al daño causado por insectos puede ser distinta que con un método artificial de defoliación (Lehtilä y Boalt 2008). Por ejemplo, existe la particularidad de que el daño producido por insectos mordedores no es uniforme dentro de la planta (Marquis 1996). También se ha determinado que los insectos pueden activar genes de respuesta defensiva específicos, distintos a los producidos de forma mecánica (Brichi et al., 2010, Castrillón-Árbeláez et al., 2012). Se ha visto por ejemplo que la imitación del daño de larvas mordedoras con heridas mecánicas en plantas de poroto Pallar (Phaseolus lunatus) provoca la emisión de volátiles similares a los producidos por los herbívoros, pero no producen exactamente la misma respuesta (Mithöfer et al., 2005). Así, el daño mecánico puede diferir con el del herbívoro en la cantidad, el tipo de tejido, lugar de la planta, el tipo de ruptura de las células y en la señalización de la respuesta al daño (Strauss and Agrawal 1999, Baldwin y Preston 1999). Existen varios estudios sobre tolerancia de las plantas a métodos de defoliación mecánica. Mo y colaboradores (2018), estudiaron la respuesta de defoliación mecánica en algodón y concluyeron que con un 75% de defoliación no hubo pérdidas de rendimiento. Vargas-Ortiz et al., 2013 estudiaron la respuesta de una especie de amaranto (Amaranthus cruentus) a la defoliación artificial en condiciones de campo y bajo invernadero con niveles de defoliación de hasta 100%, concluyendo que el amaranto es una especie que tolera la defoliación bajo ciertas condiciones. Los mismos autores, Vargas-Ortiz et al., 2015 realizaron ensayos de defoliación en amaranto con 100% de defoliación de forma gradual en varios momentos fenológicos de la planta y en distintas estaciones del año, encontrando diferentes respuestas de tolerancia de las plantas. También se han estudiado parámetros de calidad mediante métodos artificiales de daño a las plantas. Por ejemplo, Pilson y Decker (2002) observaron que el número de semillas y peso de las semillas de Helianthus annus (girasol silvestre) dañadas artificialmente simulando un insecto no varió con respecto al control sin daño. Proulx y Naeve (2009) determinaron que la defoliación artificial en plantas de soya reduce el tamaño de la semilla en 7,7% comparado con el control y éstas tuvieron menor cantidad de proteinas, pero alta concentración de aceite 7.
(11) comparado con otros tratamientos realizados. En girasol, Erbas y Baydar (2007) observaron que una disminución parcial de 30 a 72% de hojas reduce el porcentaje de aceite respecto al control, mientras que en la defoliación completa de 90 a 100% el contenido de aceite en la semilla no varía respecto al control sin defoliar. Si bien las respuestas de la planta al daño mediante métodos artificiales y por insectos pueden ser similares en algunos aspectos, es de gran interés evaluar si los insectos producen una respuesta de tolerancia diferente a los métodos artificiales de daño especialmente en los parámetros cualitativos de las plantas que han sido menos estudiados. La quínoa como modelo de estudio de tolerancia al daño. La quínoa (Chenopodium quinoa Willd.) es una planta anual de la familia Amaranthaceae originaria de la zona andina de Sudamérica. En este estudio se utilizó la variedad de quínoa Regalona, única variedad comercial registrada en Chile. El producto cosechado de esta especie son los granos, que tienen una alta calidad nutricional (FAO y CIRAD 2015). Referido a esto último, la quínoa es un alimento que presenta algunas ventajas de calidad nutricional en términos de proteínas y minerales una vez que es procesada, en comparación con otros granos como son el trigo, el arroz y el maíz (FAO y CIRAD 2015). Además, dentro del aspecto nutricional se encuentran los llamados antioxidantes, compuestos importantes por sus propiedades nutracéuticas. Se ha estudiado en la quínoa variados compuestos fenólicos y antioxidantes (James 2016). Además, la quínoa produce un compuesto químico denominado saponina que está presente en un gran número de plantas (GüçlüÜstündağ y Mazza 2007, Vincken et al., 2017). Las saponinas están en el pericarpio del grano y le proporcionan un sabor amargo (Fuentes y Paredes-González 2015) que debe ser removido antes del consumo humano. Las saponinas son glucósidos triterpenos policíclicos con hasta siete estructuras de agliconas llamada sapogeninas (Kuljanabhagavad et al., 2008). Estas estructuras han sido reportadas identificándose los siguientes compuestos: ácido fitolacagénico, hederagenina, ácido serjánico, ácido oleanólico, ácido 3b-hidroxi-23-oxo-olean-12-en-28 oico, ácido 3b-hidroxi-27-oxo-olean12-en-28 oico y ácido 3b-23, 30- trihidroxi olean-12-en-28 oico (Kuljanabhagavad et al., 2008), siendo los cuatro primeros los principales (Medina-Meza et al., 2016).. 8.
(12) La quínoa es un cultivo que presenta alta tolerancia a factores abióticos como estrés salino y sequia (Jacobsen et al., 2003) pero su relación respecto a la tolerancia a estrés biótico como por ejemplo insectos no ha sido estudiada. Dentro de los agentes bióticos de estrés, muchas especies de insectos atacan la quínoa. Se han señalado especies de Hemiptera, Coleoptera, Thysanoptera y Lepidoptera (Artigas 1994, Lamborot et al., 1999, Klein y Waterhouse 2000, Rasmussen et al., 2003, Dughetti 2015 y Cruces et al., 2016), siendo los lepidópteros los que usualmente causan más daño (Lamborot et al., 1999, Rasmussen et al., 2013, Saravia et al., 2014, Cruces et al., 2016) Los daños causados por los lepidópteros incluyen defoliación, consumo de meristemas, primordios foliares, tallos, panojas, granos etc. Una especie poco estudiada en su capacidad de daño a la quínoa es el gusano medidor del repollo, Trichoplusia ni (Hübner; Lepidoptera: Noctuidae), una plaga generalista que ataca varias especies de plantas entre ellas quínoa (Cranshaw et al., 1990). La hembra adulta puede depositar entre 250 a 350 huevos en su ciclo de vida y tener tres a cuatro generaciones en la temporada siendo considerada una plaga importante por la velocidad con que realiza el daño y por la cantidad de población que genera (Artigas 1994). En quínoa se desconoce si los insectos mordedores pueden inducir la producción de saponinas u otros compuestos luego de un ataque de herbivoría pero si existe evidencia de que las saponinas de otras especies de plantas tienen efectos anti herbívoros interfiriendo en el comportamiento de alimentación, regulación del crecimiento y sobrevivencia de insectos (Chaieb 2010, Singh y Kaur 2018). Además, los compuestos químicos del tipo fenólico también pueden ser inducidos por insectos. La quínoa es una buena fuente de compuestos fenólicos y antioxidantes, elementos que tienen beneficios para la nutrición humana (Miranda et al., 2012), por lo que sería relevante estudiar si los insectos inducen estos compuestos modificando la calidad nutricional del grano. En estudios preliminares se observó que la quínoa es capaz de tolerar la defoliación artificial, sin disminuir su rendimiento con diferentes niveles de defoliación y en diferentes momentos fenológicos vegetativos de la planta. Dado los resultados anteriores surge la hipótesis si la quínoa tiene la capacidad de producir respuestas de. 9.
(13) tolerancia a distintas intensidades de daño causada por insectos mordedores y si éstos producen modificaciones en la cantidad y calidad del grano de quínoa. Para probar esta hipótesis, se planteó el objetivo general de evaluar el efecto del daño foliar sobre parámetros cuantitativos y cualitativos del cultivo de quínoa, enfocándose específicamente en determinar los efectos del tipo de daño, ya sea mecánico o por larvas de lepidópteros, y de tres niveles de intensidad de defoliación (20, 40 y 60%) sobre la productividad de los granos y su calidad física y química.. 10.
(14) Materiales y Métodos. Material Vegetal, Insectos y diseño experimental. Se utilizaron plantas de quínoa de la variedad comercial Regalona que fueron sometidas a tratamientos con tres niveles de defoliación de 20%, 40% y 60% más el control sin defoliación (0%). Para cada nivel de defoliación, se usaron larvas del gusano medidor del repollo (Trichoplusia ni) o defoliación mecánica (con tijeras). El ensayo se realizó en el campus San Joaquín de la Pontificia Universidad Católica de Chile bajo una estructura con malla antiáfido. Se utilizó un diseño experimental en bloques completos al azar con 10 repeticiones por cada uno de los tratamientos, totalizando 70 plantas. Cada planta se cultivó en un contenedor de 3 litros con un sustrato de turba y perlita en proporción 2:1 respectivamente. Las plantas fueron regadas según necesidad y fertilizadas. La fertilización consistió en 560 gramos totales de N:P:K (1:2:4) (80 g de N; 160 g de P2O5 y 320 g de K2O) aplicada en cuatro parcializaciones y micronutrientes (Fertrilon). Los tratamientos de defoliación se aplicaron cuando las plantas estaban en el estado de 22 hojas expandidas, estado fenológico correspondiente al estado de crecimiento 59 (Sosa-Zuñiga et al., 2017), 38 días después de la siembra. Para la defoliación con insectos, se usaron larvas de T. ni obtenidas a partir de una crianza en plantas de quínoa en condiciones de invernadero. Cada planta fue infestada con larvas de segundo y tercer subestado. Se usó un número de 6, 11 y 22 larvas por cada planta a defoliar, según el nivel de defoliación de 20, 40 y 60% respectivamente. Las larvas se mantuvieron en las plantas por aproximadamente 4 días quitando y depositando larvas de las plantas hasta lograr visualmente los distintos porcentajes de defoliación deseados. Los insectos se mantuvieron en las plantas mediante el uso de mallas de tul que cubrían la planta. Todas las plantas, incluyendo testigos sin defoliación y plantas defoliadas mecánicamente, se mantuvieron con mallas durante el mismo tiempo que las plantas que fueron defoliadas con insectos desde el estado de crecimiento 0 hasta estado de crecimiento 6 (Sosa-Zuñiga et al., 2017). Los tratamientos de defoliación mecánica consistieron en remover hojas de las plantas usando tijeras. Previo a la defoliación se contó las hojas de cada planta, para luego 11.
(15) remover a nivel de peciolo el número de hojas correspondiente al porcentaje de defoliación de cada tratamiento. La distribución de las hojas defoliadas fue uniforme a lo largo de la planta. Al finalizar los tratamientos de defoliación con insectos, las mallas que cubrían las plantas fueron removidas y todas las plantas se asperjaron con insecticida y fungicida para evitar la presencia de otros agentes bióticos de daño que actuaran como factores adicionales de variación en el experimento. Se utilizó el insecticida lambdacihalotrina (Karate Zeon 050CS, Syngenta) en concentración de 0,5 (ml p.f./L) y los fungicidas Mefenoxam y Mancozeb (Ridomil Gold MZ 68 WG, Syngenta) en concentración de 2,5 (g p.f/L) para eliminar todas las larvas y prevenir mildiú. En 2 oportunidades se aplicaron los fungicidas Ridomil e Iprodiona respectivamente (Iprodion 50WP, Agrospec) para controlar el mildiú de la quínoa y alternaria. Parámetros cuantitativos. Se determinaron el rendimiento, la biomasa, el índice de cosecha, el número de ramificaciones laterales, el área foliar y la altura de las plantas. El rendimiento, la biomasa y el índice de cosecha fueron evaluados una vez realizada la cosecha en estado de crecimiento 93 (Sosa-Zuñiga et al., 2017) aproximadamente 65 días después de iniciados los tratamientos. Los granos fueron secados en una estufa a 28°C por 48 horas mientras que la parte vegetativa de las plantas (hojas y tallos) fueron secadas en una estufa a 60°C por 72 horas. Se evaluó el rendimiento de las plantas en peso en gramos de los granos producidos por planta y la biomasa total producida por cada planta (peso de tallos, hojas y granos). Con la razón entre el peso de semillas y la biomasa se determinó el índice de cosecha para cada planta. El número de ramificaciones laterales se cuantificó a los doce días después de iniciados los tratamientos (estado de crecimiento 6) contando la cantidad de brotes completamente diferenciados en ramas laterales. El área foliar fue medida a los diez días después de iniciados los tratamientos y se determinó contando el número total de hojas de cada planta con plantillas de los diferentes tamaños de hojas que se presentan en las plantas de quínoa. El área foliar de las hojas de las plantillas fue analizado en el programa WCIF Image J v1.37 (Wright Cell Imaging Facility, University 12.
(16) Health Network Research, Canadá). El área foliar de las plantas defoliadas por insectos se midió con una escala modificada de medición de severidad del hongo mildiú en foliolos de hojas de tomate (Sepúlveda-Chavera et al., 2013), la cual se asemeja a las mordeduras de la larva utilizada y a la hoja de quínoa. La altura de las plantas se midió un día antes de los tratamientos, a los 12 días después de iniciado los tratamientos y al momento de la cosecha. Parámetros cualitativos. Los parámetros cualitativos o calidad de granos consideraron el calibre, fenoles totales y la capacidad antioxidante en los granos de cada tratamiento, así como también las sapogeninas totales e individuales como ácido oleanólico (AO), hederagenina (Hed), ácido fitolacagénico (AF), y ácido serjánico (AS). El calibre de los. granos se determinó mediante 3 tamices de diferentes calibres. separando los granos de cada planta en tres grupos diferentes: granos con diámetros menores a 1,35 mm, granos con diámetro entre 1,35 y 1,56 mm y granos con diámetro superior a 1,56 mm. Luego, los granos de cada rango de calibre fueron pesados y contados. Para realizar la cuantificación de los granos se pesó y cuantificó el 10% de los granos en cada rango de tamizaje para luego determinar el total de granos de cada muestra. Además se estimó el peso en gramos de 1000 granos para cada uno de los rangos de tamizaje. Para analizar la cantidad de fenoles totales y la capacidad antioxidante de los granos de quínoa se molió los granos de cada tratamiento y se obtuvo un polvo. Se pesó una submuestra de 40 mg. para cada tratamiento de las cuales se realizó una doble. extracción con 0,5 mL de metanol por 24 horas cada una (1 mL total de solvente). El contenido de fenoles totales fue medido con el reactivo Folin-Ciocalteu según el método Tang et al., 2015 con algunas modificaciones (Pasko et al., 2009, RepoCarrasco-Valencia y Serna 2011, Magalhães et al., 2010). El método fue llevado a cabo en un lector de placas de 96 pocillos PowerWave HT, Biotek. El extracto diluido de granos de quínoa o de ácido tánico (ocupado como compuesto fenólico estándar) fue depositado en cada pocillo de la microplaca, a eso se le agregó el reactivo F-C (diluido 1:10 con agua destilada). Luego se le agregó carbonato de sodio (Na2CO3) 7% 13.
(17) p/v. La mezcla fue homogenizada en un agitador de microplacas y dejado en oscuridad por 90 minutos a temperatura ambiente. Fue utilizada una muestra blanco con agua destilada en vez del extracto o el compuesto fenólico. Luego la absorbancia fue medida en el lector de placas a una longitud de onda de 725 nm. Los resultados fueron expresados en miligramo de ácido tánico (AT) por gramo de peso seco de extracto de grano de quínoa (mg AT/100g de PS extracto de grano) usando la curva de calibración obtenida con ácido tánico (r2= 0,9999). Para determinar la capacidad antioxidante de granos de quínoa se utilizó el método con el reactivo DPPH con algunas modificaciones (Tang et al., 2015, Miranda et al., 2012). El método fue realizado en un lector de placas de 96 pocillos PowerWave HT, Biotek. En este caso el extracto diluido de los granos de quínoa o del compuesto Trolox (utilizado como compuesto estándar) fue depositado en cada pocillo de la microplaca, a eso se le agregó el reactivo DPPH a una concentración de 0,06 mMolar. La mezcla fue homogenizada y dejada en oscuridad por 30 minutos a temperatura ambiente. Como muestra blanco se utilizó metanol. La absorbancia fue medida a una longitud de onda de 517 nm. La capacidad antioxidante de cada extracto se expresó como µmoles de equivalente de Trolox (ET) por gramo de peso seco de extracto (µmoles ET/100g PS) usando la curva de calibración determinada con Trolox (r2 = 0,998). El contenido de sapogeninas fue determinado mediante cromatografía liquida de alta resolución (HPLC, utilizando el modelo Dionex UltiMate 3000) según métodos descritos previamente (Mastebroek et al., 2000). Los granos fueron molidos y se pesó una fracción de 75 mg de polvo de granos. Mediante hexano se extrajo las grasas y luego se realizó tres extracciones de compuestos mediante metanol el cual fue evaporado completamente. Los extractos fueron resuspendidos en agua y luego se efectuó una reacción de hidrólisis con ácido clorhídrico (HCl) en la cual, la cadena de azúcar es separada de la molécula quedando solo la sapogenina. El producto de la hidrolisis fue particionado con cloroformo y la fase orgánica fue lavada con agua y secada. El remanente fue redisuelto en metanol y almacenado a -20°C. Antes de realizar la cromatografía, se centrifugó las muestras y se transfirieron a viales de HPLC en donde fueron secadas. Se redisolvieron con una mezcla de acetonitrilo y agua usando un baño de agua y sonicador. Luego se analizó las muestras en el HPLC inmediatamente. Para cuantificar las sapogeninas se utilizaron estándares comerciales y aislados. Se 14.
(18) midieron sapogeninas totales y cuatro sapogeninas individuales, hederagenina, ácido oleanólico, ácido fitolacagénico y ácido serjánico. Los resultados fueron expresados en mg sapogenina por gramo de peso seco de extracto de grano (mg/g de PS extracto de grano). Análisis estadístico. Para el análisis estadístico se utilizó el Software estadístico InfoStat 2018 (Rienzo et al., 2018). Se realizó 7 tratamientos con 10 repeticiones para cada uno. Dos plantas fueron comidas por ratones al momento de la cosecha. Diferencias mínimas significativas entre tratamientos aplicados a plantas en macetas se detectaron mediante ANDEVA usando el modelo lineal general. Debido a la cantidad de variables respuestas del estudio se consideró una prueba de comparación de medias ajustada por Bonferroni (DMS, = 0,05). Contrastes ortogonales fueron utilizados para comparar los promedios entre el método de defoliación por insectos y el método mecánico.. 15.
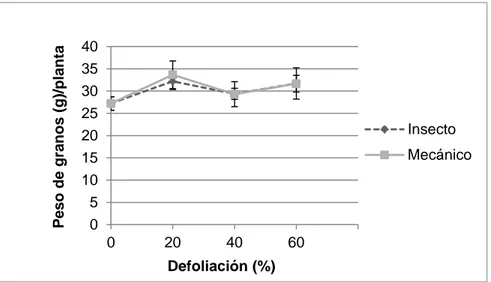
(19) Resultados. Parámetros cuantitativos. Los resultados de rendimiento en peso de granos demostraron que las plantas toleran la defoliación, ya que no hubo diferencias estadísticamente significativas en el peso total de granos (gramos /planta) entre plantas no defoliadas y plantas defoliadas mecánicamente o con larvas de insectos, independiente del nivel de defoliación (F6,52 = 0,80; p = 0,576) (Figura 1). En términos de los efectos individuales, mediante análisis de contrastes ortogonales no se detectó un efecto del método de defoliación sobre el peso de granos independiente del nivel de defoliación (F1,52 = 0,05; p = 0,824). Las plantas en promedio para todos los tratamientos produjeron 30,67 gramos de granos por planta. El peso promedio de granos por planta en el método de defoliación por insecto en los 3 niveles de defoliación es de 31,08 gramos y en el mecánico es de 31,5 gramos mientras que en el testigo sin defoliar es de 27,2 gramos por planta. Es notable destacar que el rendimiento en las plantas defoliadas nunca fue menor que en las no defoliadas (Figura 1). Similarmente, se determinó que las plantas toleraron los tratamientos de defoliación en términos de la producción de biomasa total (hojas, tallos y granos) (F6,52 = 0,87; p = 0,522). Se determinó que en promedio para todos los tratamientos la biomasa total fue de 98,9 gramos de peso seco por planta. Tampoco hubo diferencias al comparar ambos métodos de defoliación (F1,52 = 0,34; p = 0,563). Interesantemente, se observó una tendencia a producir más biomasa en el nivel de defoliación de 20% en ambos métodos de defoliación, lo que sugiere una tendencia de las plantas para sobrecompensar un bajo nivel de daño (Figura 2). Los tratamientos de defoliación tampoco afectaron el índice de cosecha, calculado mediante la razón entre el peso de granos y el peso total de la planta o biomasa total (tallos, hojas y granos). El índice de cosecha promedio para todos los tratamientos fue de 0,31 el cual no difirió entre plantas sometidas a los diferentes tratamientos (F6,52 = 1,56; p = 0,177) (Figura 3), ni tampoco entre plantas defoliadas por insectos o mecánicamente (F1,52 = 1,03; p = 0,315). Se observó una leve tendencia de incremento. 16.
(20) del índice de cosecha a 0,32 y 0,33 en los tratamientos de defoliación de 40 y 60% respectivamente causados por insectos.. Peso de granos (g)/planta. 40 35 30 25 20 15 10 5 0. Insecto Mecánico. 0. 20. 40. 60. Defoliación (%). Figura 1. Rendimiento de granos de quínoa (gramos/planta) en plantas sometidas a niveles de defoliación de 20, 40, y 60%, ya sea con larvas del lepidóptero Trichoplusia ni o en forma mecánica (p = 0,576). En la figura se muestran promedios ± 1 error. Biomasa Total (g MS/planta). estándar.. 140 120 100 80. Insecto. 60. Mecánico. 40 20 0. 0. 20 40 60 Defoliación (%). Figura 2. Biomasa total de plantas de quínoa (gramos de peso seco/ planta) en plantas sometidas a niveles de defoliación de 20, 40 y 60% ya sea con larvas de Trichoplusia ni o en forma mecánica (p = 0,522). En la figura se muestran los promedios ± 1 error estándar.. 17.
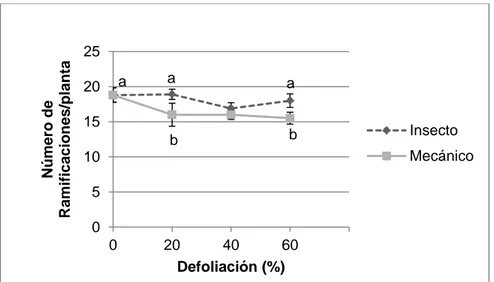
(21) Indice de Cosecha. 0,60 0,50. 0,40 Insecto. 0,30. Mecánico. 0,20 0,10 0,00 0. 20. 40 60 Defoliación (%). Figura 3. Índice de cosecha de las plantas de quínoa en plantas sometidas a niveles de defoliación de 20, 40 y 60% ya sea con larvas de Trichoplusia ni o en forma mecánica (p = 0,177). En la figura se muestran los promedios ± 1 error estándar.. A los doce días después de iniciados los tratamientos de defoliación, se detectaron diferencias en el número de ramificaciones laterales producido por las plantas entre los métodos de defoliación (F1,54 = 8,66; p = 0,048) (Figura 4). Se detectaron diferencias además en el método de defoliación mecánica con el control sin defoliar (F1,54 = 7,53; p = 0,017). En cambio, los diferentes niveles de defoliación causados por insectos no difirieron del tratamiento sin defoliar. Las plantas defoliadas con insectos en los niveles de defoliación de 20 y 60% produjeron significativamente un mayor número de ramificaciones (18,9 y 18 respectivamente) en comparación con 20 y 60% de defoliación mecánica (16 y 15,5 respectivamente) (F1,54 = 5,51; p = 0,023 y F1,54 = 4,09; p = 0,048 para 20 y 60% respectivamente). Sin embargo, en el 40% de defoliación no hubo diferencias significativas entre ambos métodos de defoliación (F1,54 = 0,53; p = 0,467). Todas las plantas tenían igual área foliar un día antes de los tratamientos de defoliación (F6,54 = 1,39 p= 0,234) (Figura 5). Sin embargo, 10 días después de los tratamientos ya se evidenciaban diferencias significativas. Se encontraron diferencias entre los dos métodos utilizados (F1,54 = 14,00; p = 0,0004) específicamente entre los tratamientos de defoliación por insecto en niveles de 20 y 60% de defoliación, los cuales tienen significativamente mayor área foliar (536,3 y 456,7 cm2 respectivamente) 18.
(22) que los mismos porcentajes de defoliación mecánica (420,2 y 327,7 cm2 respectivamente) (F1,54 = 5,73; p = 0,020; F1,54 = 7,07; p = 0,010 respectivamente). Además, se detectaron diferencias en el método de defoliación mecánica con el control sin defoliar (F1,54 = 32,08; p < 0,0001). Las plantas de quínoa tenían igual altura (promedio de 24,63 cm) un día antes de realizar los tratamientos (F6,54 = 0,82; p = 0,256) (Figura 6). Doce días después de iniciados los tratamientos no se observaron diferencias significativas entre los diferentes tratamientos (F6,54 = 1,34; p = 0,256) encontrando una altura promedio de 62,78 cm. Al momento de la cosecha, 65 días después de iniciados los tratamientos, no se encontraron diferencias significativas entre éstos (F6,54 = 0,85; p = 0,538) con una altura promedio de 111,6 cm. Tampoco se encontraron diferencias entre el método utilizado (F1,54 = 2,74; p = 0,104).. Número de Ramificaciones/planta. 25 a. 20. a. a. b. b. 15. Insecto Mecánico. 10 5 0 0. 20 40 60 Defoliación (%). Figura 4. Número de ramificaciones producidas por las plantas de quínoa medidas 12 días después en plantas sometidas a niveles de defoliación de 20, 40 y 60% ya sea con larvas de Trichoplusia ni o en forma mecánica observando diferencias significativas en el método de defoliación (p = 0,048). En la figura se muestran los promedios ± 1 error estándar. Promedios que no comparten letras son significativamente distintos p<0,05.. 19.
(23) Área Foliar (cm2)/planta. 700 600 500 400 300. a. a a. a. 200. b. Pretratamientos. b b. Postratamientos. 100 0. Figura 5. Área foliar por planta (cm2) medida 1 día antes y 10 días después de realizados los tratamientos en plantas sometidas a niveles de defoliación de 20, 40 y 60% ya sea con larvas de Trichoplusia ni o en forma mecánica observando diferencias significativas entre los métodos de defoliación postratamientos (p = 0,0004). En la figura se muestran los promedios ± 1 error estándar. Promedios que no comparten letras son significativamente distintos p<0,05. 140. Altura (cm)/planta. 120 100 80 60 40. Pretratamiento Postratamiento Cosecha. 20 0. 20.
(24) Figura 6. Crecimiento de las plantas (cm/planta) de quínoa medida un día antes (p = 0,562), 12 días después de iniciados los tratamientos (p = 0,256) y en el momento de la cosecha (p = 0,538) en plantas sometidas a niveles de defoliación de 20, 40 y 60% ya sea con larvas de Trichoplusia ni o en forma mecánica. En la figura se muestran los promedios ± 1 error estándar. Parámetros Cualitativos. Cada planta produjo en promedio 9977 granos para todos los tratamientos, los que se separaron en 3 calibres (<1,35; 1,35-1,56; >1,56 mm de diámetro). Los tratamientos de defoliación no tuvieron efecto sobre el número de granos por planta ni sobre el peso de granos separados en diferentes calibres según diámetro (Cuadro 1). La mayor proporción de número de granos (73% del total) y de peso de granos se encuentra en el rango de tamizaje mayor a 1,56 mm en todos los tratamientos con un promedio de 7281 granos por planta y 25,15 gramos/planta sin diferencias significativas entre los tratamientos (F6,52 = 1,03; p = 0,414; F6,52 = 0,87; p = 0,525 para número y peso respectivamente). En el rango de tamizaje de granos entre 1,35 y 1,56 mm hubo un promedio de 1416 granos por planta (14% del total) y un peso promedio de 3,48 gramos/planta sin diferencias significativas entre los diferentes tratamientos (F6,52 = 0,76; p = 0,603; F6,52 = 0,58; p = 0,744 para número y peso respectivamente). Similarmente, en el tamiz inferior a 1,35 mm el promedio de granos fue de 1279 granos/planta (13% del total) y el peso promedio es de 2,03 g/planta sin diferencias significativas entre los diferentes tratamientos (F6,52 = 1,91; p = 0,097; F6,52 = 1,98; p = 0,085). No hubo diferencias en el método de defoliación ni para el número de granos ni para el peso de éstos. En el del rango de calibre mayor a 1,56 mm se observó de acuerdo a lo esperado, una tendencia de las plantas a sobrecompensar debido a que en todos los tratamientos de defoliación con ambos métodos hubo un mayor número de granos y mayor peso de granos que en el testigo sin defoliar. Lo mismo ocurre para el número y peso total de los granos. Además, se observó una tendencia en las plantas defoliadas con un nivel del 60% de producir mayor cantidad de granos de calibre pequeño (menor a 1,35 mm). En el peso de 1000 granos para cada tratamiento separados en los tres calibres anteriormente descritos, no se encontró diferencias significativas en ninguno de los tres 21.
(25) calibres estudiados (calibre menor a 1,35 mm F6,52 = 1,99; p = 0,083, calibre entre 0,35 y 0,56 mm F6,52 = 0,81; p = 0,567, y calibre superior a 1,56 mm F6,52 = 1,10; p = 0,372). Tampoco se encontraron diferencias en el método de defoliación para ninguno de los calibres.. 22.
(26) Cuadro 1. Número y peso de granos por planta separados en los diferentes calibres en plantas de quínoa sometidas a niveles de defoliación de 20, 40 y 60% ya sea con larvas de Trichoplusia ni o en forma mecánica. Los rangos según calibre se dividen en granos menores a 1,35 mm; entre 1,35 y 1,56 mm y mayores a 1,56 mm de diámetro. Se muestran también el número total y peso total (rendimiento) de granos por planta. No se detectaron diferencias significativas para los diferentes tratamientos. En el cuadro se muestran los promedios ± 1 error estándar. Tratamiento Tipo de defoliación. Intensidad (%). Número granos según calibre (n°/planta) < 1,35. Peso de granos (g/planta). 1,35-1,56. > 1,56. Total. < 1,35. 1,35-1,56. > 1,56. Total. Control (sin defoliar). 1106 ± 162. 1262 ± 152. 6428 ± 418. 8797 ± 402. 1,66 ± 0,22. 3,18 ± 0,42 22,38 ± 1,54 27,22 ± 1,52. Insecto. 20. 1092 ± 144. 1261 ± 162. 7819 ± 498 10172 ± 498. 1,81 ± 0,27. 3,09 ± 0,40 27,28 ± 1,74 32,18 ± 1,83. Insecto. 40. 1319 ± 224. 1548 ± 228. 6798 ± 297. 9665 ± 296. 2,18 ± 0,44. 3,84 ± 0,63 23,35 ± 1,26 29,37 ± 1,27. Insecto. 60. 1707 ± 193. 1645 ± 207. 7459 ± 982 10811 ± 982. 2,73 ± 0,30. 4,01 ± 0,50 24,97 ± 3,22 31,71 ± 3,50. Mecánico. 20. 1220 ± 209. 1543 ± 211. 8188 ± 821 10951 ± 820. 1,74 ± 0,28. 3,68 ± 0,58 28,23 ± 2,83 33,65 ± 3,12. Mecánico. 40. 1028 ± 204. 1383 ± 234. 6704 ± 652. 9115 ± 651. 1,71 ± 0,34. 3,38 ± 0,59 24,20 ± 2,54 29,30 ± 2,82. Mecánico. 60. 1501 ± 308. 1268 ± 108. 7704 ± 513 10473 ± 512. 2,43 ± 0,52. 3,15 ± 0,21 26,07 ± 1,48 31,66 ± 1,89. 23.
(27) Cuadro 2. Peso de 1000 granos según calibre en plantas de quínoa sometidas a niveles de defoliación de 20, 40 y 60% ya sea con larvas de Trichoplusia ni o en forma mecánica. Los rangos según calibre se dividen en granos menores a 1,35 mm; entre 1,35 y 1,56 mm y mayores a 1,56 mm de diámetro. No se detectaron diferencias significativas para los diferentes tratamientos. En el cuadro se muestran los promedios ± 1 error estándar. Tratamiento. Peso de 1000 granos. Tipo de Intensidad defoliación (%). < 1,35. 1,35-1,56. > 1,56. Control (sin defoliar) Insecto 20 Insecto 40 Insecto 60 Mecánico 20 Mecánico 40 Mecánico 60. 1,53 ± 0,034 1,63 ± 0,062 1,60 ± 0,083 1,61 ± 0,033 1,43 ± 0,039 1,67 ± 0,051 1,59 ± 0,048. 2,49 ± 0,033 2,46 ± 0,038 2,43 ± 0,056 2,45 ± 0,045 2,34 ± 0,066 2,42 ± 0,037 2,55 ± 0,146. 3,48 ± 0,038 3,49 ± 0,051 3,42 ± 0,047 3,37 ± 0,053 3,46 ± 0,064 3,60 ± 0,165 3,40 ± 0,066. En los resultados de la determinación de la cantidad de fenoles totales y la capacidad antioxidante no se encontraron diferencias significativas para la cantidad de fenoles totales (F6,52 = 0,57; p = 0,753) ni tampoco para la capacidad antioxidante (F6,52 = 2,09; p = 0,070) (Figura 7). En promedio en los distintos tratamientos los granos tienen un contenido de fenoles totales de 295,8 mg de ácido tánico por cada 100 gramos de peso seco de extracto de granos. Para la capacidad antioxidante, se encontró que los granos tienen en promedio 51,92 µmoles de equivalentes Trolox por cada 100 gramos de peso seco de extracto de granos. Tampoco se encontró diferencias al comparar ambos métodos de defoliación ni para el total de fenoles (F1,52 = 0,10; p = 0,748) ni para la capacidad antioxidante (F1,52 = 2,99; p = 0,089). Capacidad Antioxidante. Insecto Mecánico. 0. 20. 40. 60. Defoliación (%). µmoles de ET/100 g PS extracto. mg AT/100 g PS extracto. Polifenoles Totales 350 300 250 200 150 100 50 0. 60 50 40. Insecto. 30. Mecánico. 20 10 0 0. 20. 40. 60. Defoliación (%). 24.
(28) Figura 7. Contenido de fenoles totales y capacidad antioxidante en los granos de plantas de quínoa sometidas a niveles de defoliación de 20, 40 y 60% ya sea con larvas de Trichoplusia ni o en forma mecánica. No se detectaron diferencias significativas para los diferentes tratamientos en fenoles totales (p = 0,753) ni en la capacidad antioxidante (p = 0,070). En la figura se muestran los promedios ± 1 error estándar. Se encontraron diferencias significativas entre los métodos de defoliación mecánico o por larvas de insecto para el total de sapogeninas (F1,50 = 10,28; p = 0,002) (Figura 8). Además, se encontraron diferencias significativas en los niveles de defoliación de 20 y 40% entre ambos métodos (F1,50 = 4,77; p = 0,034 y F1,50 = 6,43; p = 0,014 respectivamente). No hubo diferencias en la concentración de sapogeninas totales en el nivel de defoliación de 60% para ambos métodos (F1,50 = 0,68; p = 0,415). En general se observó que los granos de las plantas defoliadas mediante insectos mordedores en los niveles de defoliación de 20 y 40% tienen un menor contenido de sapogeninas totales (12,13 y 14,45 mg/g peso seco de extracto respectivamente) que granos de plantas defoliadas. mecánicamente. (15,55. y. 18,32. mg/g. de. peso. seco. de. extracto. respectivamente). Esta misma tendencia se dio en las sapogeninas individuales ácido oleanólico (AO), Hederagenina (Hed) y ácido fitolacagénico (AF) donde se encontraron diferencias significativas entre los dos métodos de defoliación (F1,50 = 9,30; p = 0,004; F1,50 = 11,62; p = 0,001 y F1,50 = 9,15; p = 0,004, respectivamente) y también para los niveles de defoliación de 20 y 40%. En el nivel de defoliación de 60% no hay diferencias significativas entre métodos. La concentración promedio para AO, Hed y AF en los tratamientos de defoliación por larvas de insectos fue de 5,02; 4,69 y 2,75 mg/g de peso seco de extracto respectivamente. Mientras que para los tratamientos realizados de forma mecánica los promedios para AO, Hed y PA son de 6,26; 6,22 y 3,74 mg/g respectivamente. En el caso del ácido serjánico se encontraron diferencias significativas en el método de defoliación (F1,50 = 4,29; p = 0,044) pero solo en el nivel de defoliación del 20% (F = 4,19; p = 0,046). Individualmente, la sapogenina hederagenina en el método de defoliación mecánico el nivel de defoliación de 40% difiere del control y del nivel de defoliación de 60%.. 25.
(29) Ácido Oleanólico. 25. *. 20. * 15. Insecto Mecánico. 10 5 0 0. 20. 40. 60. Defoliación (%). A. Oleanólico (mg/g PS extracto). Sapogeninas (mg/g PS extracto). Total Sapogeninas 8. *. 7. *. 6 5. Insecto. 4. Mecánico. 3 2 1 0 0. Insecto Mecánico. 2 1 0 0. 20. 40. A. Fitolacagénico (mg/g PS extracto). Hederagenina (mg/g PS extracto). *. 60. Ácido Fitolacagénico. *. 6 5 4 3. 40 Defoliación (%). Hederagenina 9 8 7. 20. 5 4,5 4 3,5 3 2,5 2 1,5 1 0,5 0. *. Insecto Mecánico. 0. 60. *. 20. 40. 60. Defoliación (%). Defoliacón (%). A. Serjánico (mg/g PS extracto). Ácido Serjánico 0,9 0,8 0,7 0,6 0,5 0,4 0,3 0,2 0,1 0. * Insecto. Mecánico. 0. 20. 40. 60. Defoliación (%). 26.
(30) Figura 8. Contenido de Sapogeninas totales y sapogeninas individuales en los granos de quínoa (mg/g de peso seco de extracto de grano) de plantas sometidas a niveles de defoliación de 20, 40 y 60% ya sea con larvas de Trichoplusia ni o en forma mecánica. Se encontraron diferencias significativas (*) entre métodos para ciertos niveles de defoliación. En la figura se muestran los promedios ± 1 error estándar.. 27.
(31) Discusión. En este estudio se reporta por primera vez la capacidad de la especie C. quinoa para tolerar la defoliación causada mecánicamente o con larvas de insectos mordedores. La planta de quínoa es capaz de compensar en términos de rendimiento (peso de granos) en todos los porcentajes de defoliación. La capacidad de las plantas de tolerar la defoliación también se ha reportado en otras especies vegetales. Por ejemplo, 20, 50 y 100% de defoliación de plantas de amaranto (Amaranthus cruentus) no disminuyó el peso de las panículas ni el peso de los granos, observándose también una tendencia a sobrecompensar respecto al control sin defoliación (Vargas-Ortiz et al., 2013). Similarmente, el rendimiento de algodón no disminuyó en plantas defoliadas mecánicamente a un nivel de 75%, aunque un 100% de defoliación si causó una disminución del rendimiento en una de las temporadas de estudio sumado a retrasos en los tiempos de maduración del cultivo de hasta 18 días (Mo et al., 2018). La planta de quínoa con 20% de defoliación incluso tiende a sobrecompensar el daño, lo que puede incluso aumentar el rendimiento. Poveda et al., 2010 demostraron que con bajas cantidades de insecto (larvas de Tecia solanivora) aumentó el rendimiento de papa en comparación con el testigo sin daño. En la biomasa total de la planta ocurre algo parecido, en donde la planta tiende a sobrecompensar especialmente en el nivel más bajo de defoliación. Un mecanismo descrito por el cual la planta tolera la defoliación es la traslocación de recursos dentro de la planta. En este sentido se esperaría que la biomasa de la parte aérea disminuya, pero no se observó esta situación. Con un nivel de defoliación de 20%, la biomasa incluso tiende a aumentar con insectos mordedores y de forma mecánica en comparación con el testigo sin defoliar. Contrario a lo que ocurre en quínoa, Blue y colaboradores (2015) observaron que en plantas de poroto pallar (Phaseolus lunatus) la biomasa disminuye con respecto al control, pero no hay diferencias entre el tipo ni los diferentes niveles de defoliación. Otras especies son capaces de compensar con menores porcentajes de daño o no compensan. Por ejemplo, en plantas de algodón silvestre (Gossypium hirsutum) defoliadas artificialmente en diferentes niveles combinado con secreciones orales de larvas de Spodoptera exigua, las plantas compensan en crecimiento, biomasa de nuevas hojas y biomasa de ramificaciones con. 28.
(32) menos del 10% de defoliación, en el caso de la biomasa de raíces la planta compensa con hasta un 50% de defoliación (Quijano-Medina et al., 2019). En la quínoa la biomasa tiende a disminuir en los tratamientos con defoliación de 60% con insectos, pero el rendimiento no se vio afectado. Esto se ve reflejado en el índice de cosecha (IC), ya que defoliaciones de 40 y 60% con insectos mordedores tienen mayor IC debido a que con menor cantidad de biomasa, de todas formas la planta fue capaz de compensar el rendimiento y producir lo mismo que el control sin defoliar. Los valores de índice de cosecha encontrados en este estudio son menores a Miranda y colaboradores (2012) para la variedad Regalona el cual fue de 0,36 y a lo encontrado por Bertero y Ruiz 2008, en donde el promedio de IC para genotipos de la costa fue de 0,42. La capacidad de la planta de quínoa de compensar el daño produciendo la misma cantidad de rendimiento (peso granos en gramos/planta) y biomasa a diferentes niveles de defoliación llegando incluso a un 60% menos de hojas, las cuales en el caso de la defoliación mediante insectos fue con 22 larvas, es muy relevante. La planta puede tolerar un número mayor de insectos sin que eso genere daños en el rendimiento final y con eso retrasar o evitar el uso de medidas de control. Esto es muy importante para el manejo integrado y sustentable de plagas. Además, es favorable para el medio ambiente, la salud humana y la comercialización del grano. En este estudio se observó que la defoliación causada por métodos artificiales afecta la capacidad de la planta de producir ramificaciones laterales, en la cual la planta produjo una menor cantidad de brotes en comparación con el testigo sin defoliar y con la defoliación causada por las larvas de insecto. Esto difiere de otros estudios en donde por ejemplo plantas de Lythrum salicaria afectada con diferentes niveles de defoliación causados por el coleóptero Galerucella calmariensis, producen una mayor cantidad de brotes modificando la arquitectura de la planta luego del ataque (Schat y Bloossey, 2005). Otros estudios observaron una respuesta similar en plantas que fueron defoliadas artificialmente. Por ejemplo plantas de amaranto, las cuales fueron defoliadas en estados vegetativos y pre emergencia de panícula produjeron ramificaciones laterales, lo que no ocurrió en las plantas control sin defoliar (VargasOrtiz et al., 2015).. 29.
(33) La producción de ramificaciones laterales es un posible mecanismo de la planta de quínoa para tolerar la defoliación debido a que 65 días después de iniciados los tratamientos la plantas se recuperaron del daño En este contexto podría presentarse una diferencia en el mecanismo utilizado para compensar el daño entre la defoliación artificial y la defoliación mediante larvas. En lo que se refiere al parámetro área foliar, se observó que las plantas defoliadas de forma artificial tienen menor área foliar que las plantas defoliadas por insectos 10 días después de realizados los tratamientos. Esto puede significar que las plantas defoliadas por insectos pueden ser capaces de recuperar de manera más rápida el área foliar perdida que las defoliadas de manera mecánica. Esto se observó especialmente en el nivel de defoliación del 20%. Cely y colaboradores (2010) evaluaron el área foliar en plantas de tomate atacadas por larvas de Tuta absoluta en distintas densidades del insecto, encontrando que por ejemplo con 26 larvas, plantas de 12 semanas presentan un 27% de su área foliar afectada. El área foliar de las plantas disminuye a medida que aumenta la densidad de las larvas y esto finalmente se ve reflejado un menor número de frutos a cosecha (Cely et al., 2010). Camargo y colaboradores (2015) observaron que en dos ecotipos de Datura stramonium a los cuales se les removió el 35% de su área foliar compensaron el área foliar al final del ciclo de vida de la planta con respecto al control sin defoliar. Sin embargo, la recuperación de área foliar fue más lenta. Además se observó que un ecotipo defoliado de Datura fue capaz de producir la misma cantidad de semillas que el control sin defoliar. Respecto al crecimiento de las plantas medido en altura/planta, no se observaron diferencias en las mediciones realizadas. No hubo efecto sobre la altura ni después de realizados los tratamientos, ni 65 días después cuando las plantas se cosecharon. En otros estudios se observó algo similar. Por ejemplo, en plantas de amaranto luego de 100 días de realizados los tratamientos no se observaron diferencias en la altura (Vargas-Ortiz et al., 2013). Coincidentemente Mo y colaboradores (2018) observaron que la altura de plantas de algodón defoliadas de forma artificial después de los 100 hasta los 180 días después de emergencia no se encontró diferencias en algunas temporadas. Sin embargo, a diferencia de la quínoa en otras especies se observó que tienen menores alturas después de ser defoliadas o que compensan este parámetro 30.
(34) con un nivel bajo de daño. En algodón silvestre se observó que las plantas no disminuyen su crecimiento con 10% de defoliación, pero con porcentajes de 25, 50 y 75% la altura disminuye no encontrando diferencias entre los tres niveles (QuijanoMedina et al., 2019). Otra investigación concluye que a medida que aumenta el nivel de defoliación causado por insectos disminuye la altura de las plantas (Shat y Bloossey 2005). Respecto a los parametros cualitativos en términos de calidad física, no hubo diferencias significativas en el número y peso de granos separados en diferentes calibres en los distintos tratamientos. En este estudio el mayor porcentaje de granos en todos los tratamientos se encuentra en el calibre más grande con diametros superiores a 1,56 mm, siendo similar a lo reportado por Miranda y colaboradores (2012) donde el diametro promedio de semillas de Regalona es de 1,79 mm. La planta de quinoa produjo un número total de semillas mayor en todos los niveles de defoliación y en ambos métodos comparado con el testigo sin defoliar, por lo que tiende a sobrecompensar el daño producido por la defoliación. Algunos estudios observaron resultados similares. Por ejemplo, plantas de Brassica nigra defoliadas con 3 y 6 larvas de Pieris brassicae produjeron mayor cantidad de semillas que el control sin insectos en la infestación temprana y con 3 larvas en la infestación tardía (Blatt et al., 2008). De la misma manera, plantas de B. nigra afectadas por la defoliación de las larvas de P. brassicae produjeron mayor cantidad de semillas además de un adelantamiento en la producción de éstas en comparación con el control (Lucas-Barbosa et al., 2013). Por otro lado, al contrario de lo ocurrido en esta investigación, hubo estudios en los cuales las plantas no compensaron el daño producido por la defoliación, por ejemplo la planta de poroto pallar produjo un menor número de semillas con hasta un 66% de defoliación en comparación con el control sin defoliar (Blue et al., 2014). Muro et al., 2012 estudió la defoliación artificial de un nivel de 100% en plantas de girasol y observó una reducción en el peso de 1000 semillas de girasol y en el número de semillas por cabeza en el estado de prefloración. Por lo tanto, la planta de quinoa sometida a niveles de defoliación de hasta un 60% compensó y no comprometió el número de semillas producidas ni en tamaño ni en peso. Esto es importante ya que si la planta es atacada por insectos no se verá comprometida su capacidad productiva ni su calidad física. En el nivel de 60% de defoliación se observó que la planta tiende a producir mayor cantidad de granos del calibre pequeño que en las defoliaciones de 20 y 40%. 31.
(35) Es posible que si la planta fuese expuesta a un nivel de daño mayor a 60% aumenten los granos de calibre pequeño. Con respecto a los parámetros cualitativos en términos de la composición química de los granos, la producción de compuestos fenólicos y de la capacidad antioxidante no presentó diferencias en ninguno de los tratamientos, por lo que en este caso no hubo una inducción de compuestos de este tipo en las plantas defoliadas con diferentes métodos. En el caso de las sapogeninas la defoliación tuvo un efecto en la concentración de éstas pero solo cuando las plantas fueron defoliadas artificialmente. La defoliación mediante insectos no causa un efecto en la cantidad de sapogeninas estudiadas, sin embargo en el nivel de defoliación del 20% la concentración de sapogeninas totales e individuales tiende a ser menor que en el resto de los niveles de daño. Además se observó que en los niveles de defoliación de 20 y 40% hubo diferencias en los métodos de defoliación lo que no ocurre para el 60% de defoliación. En general, este mismo patrón se repite para todas las sapogeninas individuales estudiadas excepto el ácido serjánico que sólo difiere en el 20% de defoliación. Las sapogeninas totales presentes en el grano de quínoa variedad regalona tienen un promedio de 14,63 mg por gramo, encontrando que las sapogeninas ácido oleanólico y hederagenina componen en conjunto el 73% del total de sapogeninas en los granos (37,2 y 35,8% respectivamente). El ácido fitolacagénico representa el 22,4% y el ácido serjánico el 4,6%. Mastebroek et al., 2000 analizó el contenido de sapogeninas en variedades dulces y amargas y para estas últimas determinó un rango en el contenido total de sapogeninas entre 4,7 y 11,3 mg/g, mientras que Medina-Meza et al., 2016 determinaron un rango de sapogeninas entre 3,81 y 27,1 mg/g para distintas variedades, siendo la mayor proporción del total el ácido fitolacagénico con 16,72 mg/g promedio y luego la hederagenina con 4,22 mg/g. Este estudio el ácido fitolacagénico tiene un promedio 3,27 mg/g lo que es bastante inferior al promedio reportado por Medina-Meza. Los resultados obtenidos en el efecto de la defoliación sobre la concentración de sapogeninas podrían ser de utilidad al realizar estudios sobre la composición química de plantas inducidas por insectos. Esto debido a las diferencias encontradas en la cantidad de compuestos utilizando insectos y un método artificial para defoliar las 32.
(36) plantas. Además bajos niveles de daño en plantas de quínoa podrían provocar una disminución en la concentración de sapogeninas en las plantas. Para el consumo humano las saponinas son un compuesto indeseable ya que el grano se vuelve más amargo y debe pasar por un proceso de lavado, lo que hace más complejo el proceso de poscosecha y previa comercialización de la quínoa. Los insectos mordedores podrían disminuir la cantidad de sapogeninas en los granos lo que beneficiaría la producción y comercialización de este grano.. 33.
(37) Conclusiones. Existen varios estudios sobre tolerancia de plantas al daño causado por la defoliación mediante insectos y de forma artificial. Sin embargo, este es el primer estudio que reporta la tolerancia de la planta de quínoa a la defoliación causada tanto por insectos mordedores (T. ni) como por métodos mecánicos. La defoliación de la planta de quínoa por insectos y mecánicamente no afectó los parámetros cuantitativos como el rendimientos expresado en g/planta ni la biomasa (g de hojas, tallos y granos/planta) ni el índice de cosecha independiente de los niveles de defoliación usados. La planta tolera la defoliación de hasta un 60%. Tampoco se observó diferencias en la altura de las plantas doce días después de iniciados los tratamientos ni en la cosecha. Se observó diferencias en el área foliar entre el método mecánico y por insecto, donde éste último doce días después de iniciados los tratamientos presentó mayor cantidad de área foliar que plantas defoliadas artificialmente. El número de ramificaciones laterales producidas por las plantas fueron menores en la defoliación mecánica comparado con la defoliación por insecto y el control sin defoliar. Respecto a los parámetros cualitativos, no hubo diferencias en el número de granos separados en diferentes calibres por lo que la defoliación no tuvo un efecto en la producción de granos con niveles de hasta 60% de defoliación con ambos métodos. En términos de la composición química, no se observó efectos en la producción de compuestos fenólicos ni en la capacidad antioxidante medidos en los granos de quínoa. Sin embargo la defoliación afectó la calidad del grano en términos de modificar la concentración de las sapogeninas, pero solo cuando la defoliación se realizó mediante el método artificial. La defoliación por insectos no incidió mayormente en el contenido de sapogeninas.. 34.
(38) Resumen. Efectos de la defoliación causada por insectos mordedores (Trichoplusia ni) y de forma mecánica sobre parámetros cuantitativos y cualitativos del grano de quínoa (Chenopodium quinoa). María Isabel Ahumada Becker. Laboratorio de Entomología de Cultivos. Departamento de Ciencias Vegetales, Facultad de Agronomía e Ingeniería Forestal. Pontificia Universidad Católica de Chile. Santiago, Chile. Ahumada, M.I. 2019. Efectos de la defoliación causada por insectos mordedores (Trichoplusia ni) y de forma mecánica sobre parámetros cuantitativos y cualitativos del grano de quínoa (Chenopodium quinoa). Tesis, Magister en Fisiología y Producción Vegetal Facultad de Agronomía e Ingeniería Forestal. Pontificia Universidad Católica de Chile. Santiago, Chile. 45 pp. Los insectos pueden provocar daño en las plantas disminuyendo su crecimiento y producción afectando el rendimiento. Sin embargo, las plantas pueden compensar el daño, concepto denominado tolerancia. Referente a esto, no ha sido estudiada la respuesta a la defoliación sobre la cantidad y calidad del grano de la quínoa (Chenopodium quinoa Willd.) El objetivo de este trabajo fue evaluar el efecto del daño foliar, causado por insectos y de forma artificial en tres intensidades de daño sobre parámetros cuantitativos y cualitativos de los granos de quínoa. Las plantas fueron sometidas a diferentes intensidades de defoliación (20, 40 y 60%) producidas por larvas de gusano medidor del repollo (Trichoplusia ni Hübner) y de forma artificial. Se observó que la quínoa es capaz de tolerar hasta un 60% de defoliación produciendo el mismo rendimiento, biomasa, índice de cosecha y altura que plantas sin defoliar. Incluso con un nivel de defoliación de 20% tiende a sobrecompensar. Plantas defoliadas artificialmente presentaron menor cantidad de ramificaciones y menor cantidad de área foliar que las defoliadas por insecto y que las sin defoliar. Respecto a los aspectos cualitativos, no hubo diferencias entre el número, peso y peso de 1000 granos separados en diferentes calibres. En la composición química de los granos no hubo efecto sobre el contenido de fenoles ni la capacidad antioxidante. En el caso de las sapogeninas, la defoliación afectó su concentración, pero solo con la defoliación 35.
(39) mecánica. Este es el primer estudio de tolerancia a la defoliación con distintos niveles mediante insectos mordedores y mecánicamente en plantas de quínoa. Palabras Clave: tolerancia, respuesta compensatoria, rendimiento, herbívoros, defoliación artificial, sapogeninas. 36.
(40) Referencias. Artigas J.N. 1994. Entomología Económica. Ediciones Universidad de Concepción, Concepción, Chile, Vol. II: 943 p. 631-633. Baldwin, I. T., and Preston, C. A. (1999). The eco-physiological complexity of plant responses to insect herbivores. Planta, 208(2), 137-145. Bertero, H. D., and Ruiz, R. A. (2008). Determination of seed number in sea level quinoa (Chenopodium quinoa Willd.) cultivars. European journal of agronomy, 28(3), 186-194. Blatt, S. E., Smallegange, R. C., Hess, L., Harvey, J. A., Dicke, M., and Van Loon, J. J. A. (2008). Tolerance of Brassica nigra to Pieris brassicae herbivory. Botany, 86(6), 641-648. Blue, E., Kay, J., Younginger, B. S., and Ballhorn, D. J. (2015). Differential effects of type and quantity of leaf damage on growth, reproduction and defence of lima bean (Phaseolus lunatus L.). Plant Biology, 17(3), 712-719. Bricchi, I., Leitner, M., Foti, M., Mithöfer, A., Boland, W., and Maffei, M. E. (2010). Robotic mechanical wounding (MecWorm) versus herbivore-induced responses: early. signaling. and. volatile. emission. in. Lima. bean. (Phaseolus. lunatus. L.). Planta, 232(3), 719-729. Camargo, I. D., Tapia-López, R., and Núñez-Farfán, J. (2015). Ecotypic variation in growth responses to simulated herbivory: trade-off between maximum relative growth rate and tolerance to defoliation in an annual plant. AoB plants, 7. Castrillón-Arbeláez, P. A., Martínez-Gallardo, N., Arnaut, H. A., Tiessen, A., and Délano-Frier, J. P. (2012). Metabolic and enzymatic changes associated with carbon mobilization, utilization and replenishment triggered in grain amaranth (Amaranthus cruentus) in response to partial defoliation by mechanical injury or insect herbivory. BMC plant biology, 12(1), 163. Chaieb, I. (2010). Saponins as insecticides: a review. Tunisian Journal of Plant Protection, 5(1), 39-50. 37.
Figure
Documento similar
Consejería de Agricultura, Medio Ambiente y Desarrollo Rural
La campaña ha consistido en la revisión del etiquetado e instrucciones de uso de todos los ter- mómetros digitales comunicados, así como de la documentación técnica adicional de
Debido al riesgo de producir malformaciones congénitas graves, en la Unión Europea se han establecido una serie de requisitos para su prescripción y dispensación con un Plan
Como medida de precaución, puesto que talidomida se encuentra en el semen, todos los pacientes varones deben usar preservativos durante el tratamiento, durante la interrupción
que hasta que llegue el tiempo en que su regia planta ; | pise el hispano suelo... que hasta que el
Abstract: This paper reviews the dialogue and controversies between the paratexts of a corpus of collections of short novels –and romances– publi- shed from 1624 to 1637:
Luis Miguel Utrera Navarrete ha presentado la relación de Bienes y Actividades siguientes para la legislatura de 2015-2019, según constan inscritos en el
Fuente de emisión secundaria que afecta a la estación: Combustión en sector residencial y comercial Distancia a la primera vía de tráfico: 3 metros (15 m de ancho)..