Diseño de un proceso para la obtención de pectina de la corteza del limón de la variedad Tahití (Citrus latifolia Tan )
Texto completo
(2) © Escuela Politécnica Nacional (2015) Reservados todos los derechos de reproducción.
(3) DECLARACIÓN. Yo, Luisiana Augusta Galeas Lema, declaro que el trabajo aquí escrito es de mi autoría; que no ha sido previamente presentado para ningún grado o certificación profesional; y, que he consultado las referencias bibliográficas que se incluye en este documento.. La. Escuela. Politécnica. Nacional. puede. hacer. uso. de. los. derechos. correspondientes a este trabajo, según lo establecido por la Ley de Propiedad intelectual, por su Reglamento y por la normativa institucional vigente.. _________________________ Luisiana Augusta Galeas Lema.
(4) CERTIFICACIÓN. Certifico que el presente trabajo fue desarrollado por Luisiana Augusta Galeas Lema bajo mi supervisión.. ________________________ Ing. Marcelo Albuja DIRECTOR DEL PROYECTO. ________________________ Ing. Marcelo Salvador CODIRECTOR DEL PROYECTO.
(5) AGRADECIMIENTOS. A Dios por permitirme culminar este objetivo con sabiduría y fortaleza, por impulsar mis pensamientos y guiar mis acciones.. A mis padres, Norma y Luis, que con sus sacrificios fomentaron en mí el espíritu de superación y trabajo; gracias por soportar mi mal genio y por depositar su total confianza en mí.. A mi hermano y hermanas Danilo, Pao y Liz de quienes recibí su apoyo durante este largo trajinar; y en especial a mis sobrinos Ximenita, Danna y José que con sus locuras alegraron mis días.. A mi enamorado Alejandro por su cariño, apoyo y motivación por culminar este proyecto en momentos de desánimo.. A mi ñaña Euge, ñaño Pato y Dani por su amor y preocupación, que aunque no estemos cerca siempre están pendientes de mí.. Al Ing. Marcelo Albuja por su dirección y predisposición de ayuda para alcanzar el término de este proyecto.. Al Ing. Marcelo Salvador por sus conocimientos y amistad, quien estuvo presto a solucionar las inquietudes generadas en el desarrollo del proyecto.. A Don Ca, Ing. Mario Aldás, Carlitos y Lore por su colaboración y consejos, por su ejemplo de seres humanos y profesionales; en sí a todos quienes conforman el Laboratorio de Operaciones Unitarias gracias por su amabilidad y apoyo.. A mis amigas y amigos Letty, Tania, Andre, Gaby, Mafer y Cris quienes compartieron conmigo las diferentes etapas de la carrera y de quienes recibí una valiosa amistad..
(6) DEDICATORIA. A lo más valioso que Dios me dio, mis padres, Luis y Norma, quienes consagraron sus días para guiarme y educarme..
(7) i. ÍNDICE DE CONTENIDO PÁGINA RESUMEN. xiv. INTRODUCCIÓN. xv. 1.. REVISIÓN BIBLIOGRÁFICA. 1. 1.1. El limón Tahití (Citrus latifolia Tanaka) 1.1.1. Generalidades 1.1.2. Clasificación botánica 1.1.3. Nombres comunes 1.1.4. Descripción botánica 1.1.4.1. Planta 1.1.4.2. Hojas 1.1.4.3. Flor 1.1.4.4. Fruto 1.1.5. Condiciones climáticas y edáficas de cultivo 1.1.5.1. Condiciones Climáticas 1.1.5.2. Condiciones Edáficas 1.1.6. Siembra y fertilización 1.1.7. Cosecha 1.1.8. Composición nutricional 1.1.9. Aplicaciones industriales y propiedades 1.1.10. Producción en el Ecuador 1.1.10.1. Producción en el cantón Patate. 1 1 1 2 2 2 2 3 3 5 5 6 7 7 8 9 11 12. 1.2. Pectina 1.2.1. Ubicación 1.2.2. Estructura 1.2.2.1. Protopectina 1.2.2.2. Pectina 1.2.3. Esterificación de las pectinas y su categorización 1.2.3.1. Contenido de metóxilos 1.2.3.2. Grado de esterificación 1.2.3.3. Pectinas muy esterificadas 1.2.3.4. Pectinas poco esterificadas 1.2.4. Propiedades de modificación 1.2.4.1. Formación de geles y resistencia 1.2.5. Métodos de extracción. 14 14 15 16 16 19 19 19 20 21 22 22 24.
(8) ii. 1.2.6. 1.2.7. 1.2.8. 2.. 1.2.5.1. Extracción con soluciones ácidas 1.2.5.2. Extracción con previa aplicación de ondas microondas. 26. 1.2.5.3. Extracción enzimática Usos y aplicaciones Normalización de la pectina Demanda de pectina en el ecuador. 27 28 30 30. METODOLOGÍA. 2.1. Caracterización del limón de la variedad Tahití (Citrus latifolia Tan.) 2.1.1. Selección de la materia prima 2.1.2. Caracterización de las muestras 2.1.2.1. Caracterización física 2.1.2.2. Caracterización química 2.1.3. Análisis estadístico 2.2. Determinación de la cinética de reacción para la obtención de la pectina 2.2.1. Número de repeticiones 2.2.2. Tratamiento previo 2.2.3. Proceso para la extracción de pectina del limón de la variedad Tahití (Citrus latifolia Tan.) 2.2.3.1. Procedimiento 2.2.4. Determinación de los parámetros cinéticos de la obtención de la pectina 2.3. Determinación de la cinética de secado de la pectina gel 2.3.1. Obtención del la mejores condiciones del proceso de deshidratación de la pectina 2.3.2. Análisis del perfil de deshidratación, modelización y cinética 2.4. Caracterización de la pectina obtenida de la corteza del limón 2.5. Diseño del reactor para la hidrólisis y del secador de la pectina a escala piloto. 2.5.1. Diseño del reactor para la hidrólisis a escala piloto 2.5.2. Diseño del secador de la pectina a escala piloto 2.5.3. Costos de materia prima, insumos y de producción de pectina. 25. 33. 34 34 35 36 36 36. 37 37 37 38 38 41 42 42 43. 43. 44 45 46 47.
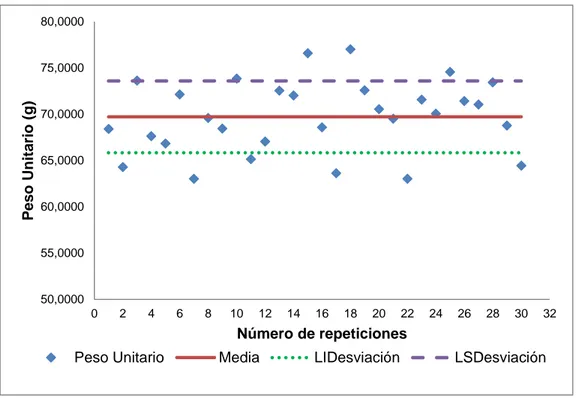
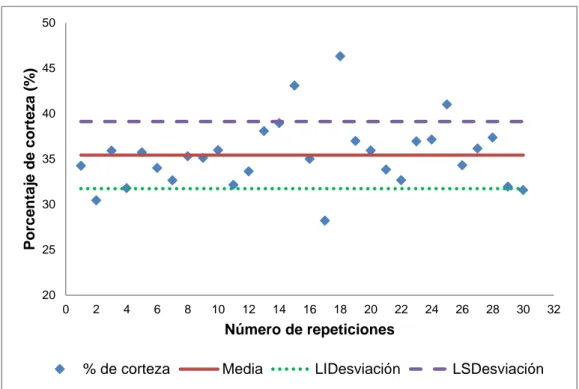
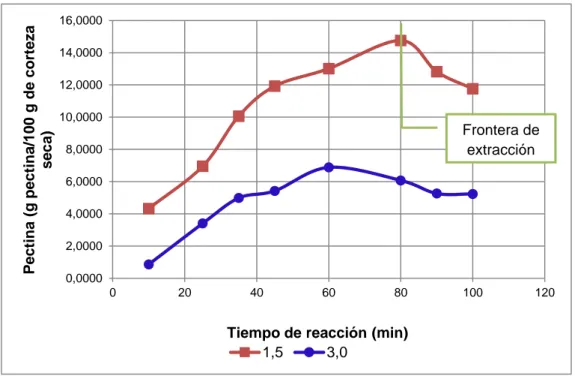
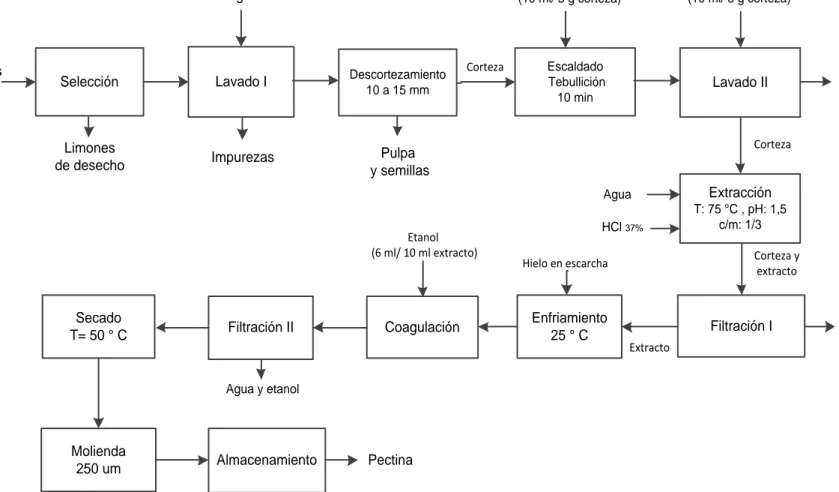
(9) iii. 3.. RESULTADOS Y DISCUSIÓN. 3.1. Resultados de la caracterización del limón de la variedad Tahití (Citrus latifolia tan.) 3.1.1. Resultados de la selección de la materia prima 3.1.2. Resultados de la caracterización del limón tahití 3.2. Resultados de la determinación de la cinética de reacción para la obtención de la pectina 3.2.1. Resultado del número de repeticiones 3.2.2. Resultados del tratamiento previo 3.2.3. Resultados del proceso de la extracción de pectina el limón de la variedad tahití (Citrus latifolia Tan.) 3.2.4. Resultados de la determinación de los parámetros cinéticos de la obtención de la pectina 3.3. Resultados de la determinación de la cinética de secado de la pectina gel 3.3.1. Resultados de la obtención del la mejores condiciones del proceso de deshidratación de la pectina 3.3.2. Resultados del análisis del perfil de deshidratación, modelización y cinética 3.4. Resultados de la caracterización de la pectina obtenida de la corteza del limón. 48. 48 48 49. 53 53 53 57 62 67 67 71. 79. 3.5. Resultados del diseño del reactor para la hidrólisis y del secador de la pectina a escala piloto. 3.5.1. Resultados del diseño del reactor para la hidrólisis a escala piloto 3.5.1.1. Cuerpo, tapa y fondo 3.5.1.2. Sistema de agitación y calentamiento 3.5.2. Resultados del diseño del secador a escala piloto 3.5.2.1. Armario, bandejas y cámara de secado 3.5.2.2. Sistema de ventilación 3.5.2.3. Sistema de calentameinto 3.5.3. Resultados de costos de materia prima, insumos y de producción de pectina. 102. 4.. 107. CONCLUSIONES Y RECOMENDACIONES. 82 83 83 86 90 90 96 99. 4.1. Conclusiones. 107. 4.2. Recomendaciones. 109.
(10) iv. REFERENCIAS BIBLIOGRÁFICAS. 111. ANEXOS. 126.
(11) v. ÍNDICE DE TABLAS PÁGINA Tabla 1. 1.. Clasificación Botánica del limón Tahití. 1. Tabla 1. 2.. Contenido nutricional del limón Tahití. 8. Tabla 1. 3.. Total de exportaciones del limón Tahití del Ecuador. 12. Tabla 1. 4.. Exportaciones del limón Tahití en los últimos cuatro años. 12. Tabla 1. 5.. Área planta. 13. Tabla 1. 6.. Producción y rendimiento del área cosechada del limón Tahití.. 13. Tabla 1. 7.. Porcentaje de pectina en ciertos vegetales y frutos. 15. Tabla 1. 8.. Tiempo de gelificación de pectinas. 23. Tabla 1. 9.. Países proveedores de pectina al Ecuador. 31. Tabla 1. 10.. Industrias importadoras de materias pécticas en el Ecuador. 31. Tabla 2. 1.. Equipos. 33. Tabla 2. 2.. Materiales. 33. Tabla 2. 3.. Reactivos. 34. Tabla 3. 1.. Resumen de las características físicas del fruto de la variedad Tahití. 51. Resumen de las características químicas del fruto de la variedad Tahití. 52. Tabla 3. 3.. Resultado visual de la pectina obtenida a 75 °C y 91 °C. 54. Tabla 3. 4.. Condiciones de extracción definidas en el tratamiento previo para el limón Tahití. 57. Tabla 3. 5.. Grados Brix reportados durante el proceso de Lavado II. 59. Tabla 3. 6.. Rendimiento en base seca y húmeda de pectina de diferentes limoneros. 60. Rendimiento en base seca y húmeda de pectina de diferentes especies. 61. Tabla 3. 2.. Tabla 3. 7..
(12) vi. Tabla 3. 8.. Resultados de la cuantificación de pectina a diferentes tiempos de extracción (pH 1,5; relación 1/3). 62. Tabla 3. 9.. Expresiones de la velocidad de reacción. 64. Tabla 3. 10.. Factor de correlación según el orden de reacción. 66. Tabla 3. 11.. Ecuaciones de linealización como Reacción de Primer orden. 67. Tabla 3. 12.. Condiciones de deshidratación de la pectina gel. 68. Tabla 3. 13.. Contenido de metóxilos a las condiciones de 1,4 y 1,8 m/s de aire. 70. Tabla 3. 14.. Datos de humedad de pectina a diferentes intervalos de tiempo, durante el proceso de deshidratación a 50,0 °C y 1,8 m/s de aire. 71. Datos de la rapidez de deshidratación respecto al tiempo, durante el proceso de deshidratación a 50,0 °C y 1,8 m/s de aire. 76. Parámetros del proceso de deshidratación de la pectina a 50,0 °C y 1,8 m/s de aire. 78. Características del producto final del limón Tahití (Citrus latifolia Tan.). 80. Tabla 3. 18.. Importaciones anuales, mensuales y diarias de pectina. 82. Tabla 3. 19.. Componentes de la carga de cada reactor batch. 84. Tabla 3. 20.. Dimensiones del reactor batch para la extracción de pectina. 85. Tabla 3. 21.. Espesor calculado, por corrosión y nominal del reactor. 86. Tabla 3. 22.. Dimensiones de la tapa y fondo del reactor. 86. Tabla 3. 23.. Características y dimensiones del agitador. 87. Tabla 3. 24.. Dimensiones de la chaqueta de calentamiento. 88. Tabla 3. 25.. Alimentación del gel, agua a eliminar y tiempo de secado de la pectina. 90. Tabla 3. 26.. Área de diseño del secador. 91. Tabla 3. 27.. Características y dimensiones de las bandejas. 92. Tabla 3. 28.. Dimensiones de las carro y cámara de secado. 93. Tabla 3. 15.. Tabla 3. 16.. Tabla 3. 17..
(13) vii. Tabla 3. 29.. Condiciones térmicas de entrada y salida del aire. 96. Tabla 3. 30.. Parámetros del ventilador para el secado de pectina gel.. 98. Tabla 3. 31.. Dimensiones del ventilador para el secado de pectina gel.. 98. Tabla 3. 32.. Características de las resistencias con aletas. 100. Tabla 3. 33.. Áreas del diagrama PFD.. 102. Tabla 3. 34.. Detalle de los costos de los cítricos e insumos. 102. Tabla 3. 35.. Detalle de los costos de servicios industriales. 104. Tabla 3. 36.. Detalle de los costos de mano de obra. 105. Tabla 3. 37.. Recopilación de los elementos de producción de 2400 kg de pectina al año. 105. Valores de los parámetros estadísticos para la determinación del número de repeticiones. 133. Tabla AXI. 1.. Registro de los datos de humedad. 147. Tabla AXI. 2.. Registro de los datos de cenizas. 147. Tabla AXI. 3.. Peso de las muestras libre de humedad y cenizas. 148. Tabla AXI. 4.. Consumo de NaOH para la determinación de las propiedades estructurales. 148. Reporte de peso equivalente, metóxilos, ácido galacturónico y ET. 148. Tabla AXII. 1.. Clases de cabezas para tanques cilíndricos. 153. Tabla AXII. 2.. Dimensiones de la cabeza estándar para un diámetro de 34 in. 159. Tabla AXIII. 1.. Condiciones térmicas de entrada y salida del aire. 174. Tabla AXIII. 2.. Condiciones de humedad del aire para la deshidratación de pectina. 175. Detalle del consumo de energía de los equipos requeridos para generación de 2400 kg/año de pectina. 187. Tabla AVI. 1.. Tabla AXI. 5.. Tabla AXIV. 1..
(14) viii. ÍNDICE DE FIGURAS PÁGINA Figura 1. 1.. Flor y fruto de la variedad Tahití. 4. Figura 1. 2.. Corte transversal del limón. 4. Figura 1. 3.. Propiedades del limón. 14. Figura 1. 4.. Pared celular. 14. Figura 1. 5.. Estructura de un fragmento de cadena de ácido galacturónico. 16. Figura 1. 6.. Estructura de la región rugosa. 18. Figura 1. 7.. Representación del modelo estructural de la pectina. 19. Figura 1. 8.. Pectina muy esterificada. 21. Figura 1. 9.. Pectina poco esterificada. 22. Figura 1. 10.. Método de enlace entre pectinas para la generación del hidrogel. 24. Figura 1. 11.. Acción de la endo-poligalacturonasa (endo-PG) y pectinesterasa (PE). 28. Figura 2. 1.. Tabla colorimétrica del Limón Persa o Tahití. 35. Figura 2. 2.. Esquema del sistema de extracción utilizado en el laboratorio de Operaciones Unitarias. 40. Figura 2. 3.. Parámetros de caracterización del producto. 44. Figura 2. 4.. Parámetros del costo de producción de pectina. 47. Figura 3. 1.. Frutos del limón Persa o Tahití seleccionados para el estudio. 48. Figura 3. 2.. Valores del diámetro ecuatorial del Limón Persa o Tahití. 49. Figura 3. 3.. Valores del peso por unidad del limón Persa o Tahití.. 50. Figura 3. 4.. Porcentaje de corteza por unidad del limón Persa o Tahití.. 51. Figura 3. 5.. Variables del tratamiento preliminar de extracción.. 53. Figura 3. 6.. Generación de pectina (pH 1,5 y 3,0), en el tratamiento preliminar de extracción. 55.
(15) ix. Figura 3. 7.. Prueba de precipitación de pectina, (izquierda) relación 1/3, (derecha) relación (1/6) en el tratamiento preliminar de extracción. 57. Esquema de la secuencia de operaciones unitarias para la obtención de pectina del limón Tahití o Persa a escala de laboratorio. 58. Valor medio y rango de desviación del rendimiento en base seca de pectina del Limón Persa o Tahití, de acuerdo a las seis repeticiones. 59. Representación de la masa de pectina en función del tiempo de tratamiento, repetición 1, 2 y 3. 63. Representación de la masa de pectina en función del tiempo de tratamiento, repetición 4, 5 y 6. 63. Método integral de linealización de los datos de extracción R2, reacción de primer orden. 65. Método integral de linealización de los datos de extracción R2, reacción de segundo orden. 65. Perfil de deshidratación de pectina a 50,0 °C, para las condiciones de velocidad de aire de 1,4 y 1,8 m/s. 69. Perfil de deshidratación del periodo de velocidad constante, para las condiciones de velocidad de aire de 1,4 y 1,8 m/s. 69. Perfil de deshidratación de pectina, generado por los datos en base húmeda. 73. Etapas de la deshidratación de la pectina del limón Tahití a 50,0 °C y 1,8 m/s de aire. 74. Modelización de las etapas de la deshidratación de la pectina del limón Tahití a 50,0 °C y 1,8 m/s de aire. 75. Velocidad de deshidratación de la pectina del limón Tahití a 50,0 °C y 1,8 m/s. 77. Figura 3. 20.. Aspecto físico del producto del limón de la variedad Tahití. 79. Figura 3. 21.. Valores medios de las propiedades estructurales de la pectina del limón Tahití (Citrus latifolia Tan.). 81. Diseño del reactor y agitador para la hidrólisis de la protopectina. 89. Figura 3. 8.. Figura 3. 9.. Figura 3. 10.. Figura 3. 11.. Figura 3. 12.. Figura 3. 13.. Figura 3. 14.. Figura 3. 15.. Figura 3. 16.. Figura 3. 17.. Figura 3. 18.. Figura 3. 19.. Figura 3. 22..
(16) x. Figura 3. 23.. Parámetros para la estimación del espesor de lana de vidrio en el secador requeridos por el programa ECOWIN GREEN. 94. Figura 3. 24.. Resultados del programa ECOWIN GREEN. 94. Figura 3. 25.. Diseño del armario portador de bandejas para la pectina gel. 95. Figura 3. 26.. Diseño del secador de la pectina gel a escala piloto. 101. Figura 3. 27.. Diagrama de flujo del proceso de obtención de pectina del limón Tahití (Citrus latifolia Tan.) a escala piloto. 103. Porcentaje de intervención de los elementos de producción para la generación de 2400 kg/año de pectina.. 105. Figura AI. 1.. Tamaño de muestra para análisis de frutos medianos. 127. Figura AII. 1.. Clasificación del limón Tahití de acuerdo a sus propiedades físicas. 128. Linealización de los datos de extracción R1, reacción de primer orden. 137. Linealización de los datos de extracción R1, reacción de segundo orden. 137. Linealización de los datos de extracción R3, reacción de primer orden. 138. Linealización de los datos de extracción R3, reacción de segundo orden. 138. Linealización de los datos de extracción R4, reacción de primer orden. 139. Linealización de los datos de extracción R4, reacción de segundo orden. 139. Linealización de los datos de extracción R5, reacción de primer orden. 140. Linealización de los datos de extracción R5, reacción de segundo orden. 140. Linealización de los datos de extracción R6, reacción de primer orden. 141. Linealización de los datos de extracción R6, reacción de segundo orden. 141. Figura 3. 28.. Figura AVII. 1.. Figura AVII. 2.. Figura AVII. 3.. Figura AVII. 4.. Figura AVII. 5.. Figura AVII. 6.. Figura AVII. 7.. Figura AVII. 8.. Figura AVII. 9.. Figura AVII. 10..
(17) xi. Figura AVIII. 1.. Modelización de las etapas de la velocidad deshidratación de la pectina del limón Tahití a 50 ̊C y 1,8 m/s de aire. 142. Metodología de caracterización de la pectina del limón de la variedad Tahití. 150. Figura AXII. 1.. Volumen de cabezas torriesféricas. 155. Figura AXII. 2.. Velocidad de pérdida por corrosión. 159. Figura AXII. 3.. Relaciones entre las dimensiones del reactor y agitador. 160. Figura AXII. 4.. Relaciones de las dimensiones del agitador. 161. Figura AXII. 5.. Comportamiento del número de potencia.. 162. Figura AXIII. 1.. Especificaciones de los perfiles de acero inoxidable. 168. Figura AXIII. 2.. Especificaciones de los ángulos de acero inoxidable. 168. Figura AXIII. 3.. Especificaciones de ruedas giratorias. 171. Figura AXIII. 6.. Rangos de diseño para la presión estática. 176. Figura AXIII. 7.. Característica de la boca de captación de aire para el secado. 176. Figura AXIII. 8.. Parámetros del ventilador axial. 179. Figura AXIII. 9.. Dimensiones del ventilador axial. 180. Figura AX. 1.. Figura AXIII. 10. Especificaciones de resistencias con aletas. 182.
(18) xii. ÍNDICE DE ANEXOS PÁGINA. ANEXO I Extracto de la norma NTE INEN 1750 (1994): Hortalizas y frutas frescas. Muestreo. 127. ANEXO II Extracto de la norma NTE INEN 1757 (2008): Frutas frescas. Limón. Requisitos. 128. ANEXO III Extracto de la norma INEN 0389 (1986): Conservas vegetales. Determinación de la concentración del ión hidrógeno (pH). 129. ANEXO IV Extracto de la norma NTE INEN 0381 (1986): Conservas vegetales. Determinación de la concentración del ión hidrógeno (pH). 130. ANEXO V Extracto de la norma NTE INEN 0381(1986): Determinación de sólidos solubles. Método refractométrico. 132. ANEXO VI Determinación del número de repeticiones para el análisis de la cinética de extracción. 133. ANEXO VII Metodología del análisis cinético de la extracción de pectina del limón Tahití. 135. ANEXO VIII Determinación de la humedad crítica y velocidad constante a las condiciones de 50 °C y 1,8 m/s de aire. 142. ANEXO IX Normas AOAC: Humedad y cenizas. 144. ANEXO X Método de valoración ácido - base para análisis de las pectinas. 146.
(19) xiii. ANEXO XI Registro de las características y propiedades estructurales de la pectina del limón Tahití. 147. ANEXO XII Determinación de la producción a escala piloto y síntesis de cálculos para el diseño del reactor para la hidrólisis. 149. ANEXO XIII Síntesis de cálculos para el diseño secador de pectina a escala piloto. 164. ANEXO XIV Demanda energética de los principales equipos descritos en el PFD del proceso de extracción a escala piloto. 183.
(20) xiv. RESUMEN El presente estudio tiene como objetivo el diseño de un proceso para la obtención de pectina a partir de la corteza del limón de la variedad Tahití (Citrus latifolia Tan.), para lo cual se emplearon frutos provenientes de la Asociación de productores Quinlata del cantón Patate, provincia de Tungurahua, los mismos que fueron seleccionados bajo el parámetro colorimétrico verde oscuro. Se determinaron las propiedades físicoquímicas de los limones, con lo que se obtuvieron valores promedios de 6,04 cm de diámetro longitudinal con un peso unitario de 69,7225 g y un porcentaje de corteza del 35,43 % con un nivel de madurez 2.. El proceso de extracción fue evaluado a escala de laboratorio, donde las variables de operación fueron la temperatura, pH, tiempo y la relación masa de corteza/volumen de medio. Se definieron como las mejores condiciones del tratamiento 75 °C; 1,5; 80 min y 1/3; cuyo efecto representó el incremento de pectina por cantidad de materia prima empleada. Se obtuvo el perfil de extracción a los tiempos de 15, 25, 35, 45, 60 y 80 min; donde se determinó que la reacción de obtención de pectina corresponde a una de primer orden con un factor de velocidad de 0,0286 min-1.. Se obtuvo el perfil de deshidratación de la pectina coloidal a 50 °C y una velocidad de aire 1,8 m/s, del cual se determinó una humedad crítica de 11,8731 kg de agua/kg de pectina seca, una de equilibrio de 0,0556 kg de agua/kg de pectina seca y un tiempo de secado de 11,41 h bajo una velocidad constante de 1,3527 kg agua/m2h. La pectina se caracterizó como un producto con 5,86 % de humedad en base húmeda y 1,21 % de cenizas; con propiedades estructurales de 2 456,4505 peso equivalente; 3,55 % metóxilos; 27,47 % ácido galacturónico y 72,85 % grado de esterificación. Se diseñó un reactor tipo batch a escala piloto con una capacidad de 0,87 m3 y un secador con un área de 31,78 m2, que permitan producir 10 kg de pectina con un costo de fabricación de 199,30 $/kg..
(21) xv. INTRODUCCIÓN En la actualidad el aditivo denominado pectina, es requerido por la industria ecuatoriana en alrededor de 48,55 t por año (Banco Central del Ecuador, 2014) con tendencia a incrementar, cuya demanda no es abastecida nacionalmente; por lo que el país se ve obligado a importar. La nula existencia de industrias enfocadas a su producción, hace de sus consumidores un mercado potencial.. La pectina se comercializa sólida, de apariencia blancuzca-amarillenta (FAO, 2009, p. 1); siendo las modas o cortezas de cítricos sus principales reservas. Según los datos estadísticos del INEC en el 2013, los cultivos nacionales generaron 10 915 t de limones y limas, definiéndole al Ecuador como un país altamente citrícola, cuya producción se ve favorecida por la continua cosecha que obedece a las características tropicales que posee (Corpei, 2009, p.3).. Pese a ello la industrialización de dichos frutos no ha evolucionado; pues estos se destinan en su mayoría como frutos de consumo inmediato; siendo esta la causa de una gran contradicción latinoamericana como lo es exportar la materia prima e importar sus productos (Corpei, 2009, p.3).. La importancia de las pectinas se basa principalmente en su propiedad para transformar la viscosidad de los alimentos, tornándoles más espesos; es por ello de su uso en productos que requieren dicha textura como lo son: mermeladas y conservas (Chasquibol, Arroyo y Morales, 2008, p. 180). En otras aplicaciones se la utiliza como excipiente envolvente y desintegrador en la formulación de cápsulas de fármacos; por su clasificación como fibra soluble se la utiliza en procedimientos para disminuir el peso corporal y control de niveles de colesterol (Mamani, Ruiz y Veiga, 2011, p. 85).. Los limones con una madurez menor presentan en sus tejidos una cantidad superior de pectina, debido a la baja actividad de las enzimas degradadoras de esta; por lo que es necesario evaluar su obtención a partir de frutos ecuatorianos como el Tahití para fomentar su tecnificación..
(22) 1. 1. REVISIÓN BIBLIOGRÁFICA 1.1.. EL LIMÓN TAHITÍ (Citrus latifolia Tanaka). 1.1.1. GENERALIDADES. El limón Tahití o Persa (Citrus latifolia Tanaka) es calificado como una lima ácida y es resultado de la combinación de dos especies de cítricos: la lima mexicana (Citrus aurantifolia) y la cidra (Citrus medica linn) (Malo, Campbell, Balerdi y Crane, 2012, p. 1).. Dicho fruto es originario de la isla Tahití, en Oceanía y se ha distribuido en regiones tropicales y subtropicales, siendo los principales países productores: México, Brasil, España y Argentina. En el Ecuador se localiza en el Litoral, Imbabura, Pichincha, Tungurahua, Bolívar y Napo (UTEPI, 2006, pp. 17-18).. 1.1.2. CLASIFICACIÓN BOTÁNICA. La clasificación botánica del limón Tahití se detalla en la Tabla 1.1.. Tabla 1. 1. Clasificación Botánica del limón Tahití Nombre Científico. Citrus latifolia Tan.. Género. Citrus. Especie. Latifolia. Clase. Dicotiledóneas. Subclase. Arquiclamídeas. Orden. Geraniales. Suborden. Geraniineas. Familia. Rutaceae. Subfamilia. Aurantioideas. (Cañizares, Sanabría y Rojas, 2005, p. 68).
(23) 2. 1.1.3. NOMBRES COMUNES. Limón Thaití o limón de Persia en Estados Unidos y Sudamérica, en México se lo conoce como limón sin semilla; y en otros idiomas: Seedles Lime, Persian Lime, Bears Lime y Limettier-Limonellenbaum (Malo et al., 2012, p. 1).. 1.1.4. DESCRIPCIÓN BOTÁNICA. 1.1.4.1.. Planta. El árbol presenta una altura máxima de 5 m, un tronco corto y varias ramificaciones que se extienden en distintas direcciones, varias de ellas tienden a la base del árbol. Sus ramas están dotadas de pequeñas espinas y forman una copa frondosa y redondeada (Malo et al., 2012, p. 1; Orduz, León y Arango, 2009, p. 8). Este limonero se caracteriza por no presentar periodos de inactividad vegetativa, únicamente a temperaturas bajas reduce su crecimiento, favoreciendo así su productividad (Jasso et al., 2011, pp. 203-204).. Dicho árbol frutal se diferencia de los demás limoneros por alcanzar mayores alturas, mantener su follaje y producir frutos de mayor diámetro (Orduz et al., 2009, p. 6).. 1.1.4.2.. Hojas. Las hojas son de color verde, de forma elíptica y lanceolada, alargadas de 2,5 a 9,0 cm, su borde es levemente dentado y su peciolo cilíndrico (Cañizares et al., 2005, p. 68). Se encuentran de forma alternada en las ramas y se mantienen en ellas por tiempo aproximado de 3 años (Malo et al., 2012, p. 1)..
(24) 3. 1.1.4.3.. Flor. De forma continua en el año se tiene la presencia de la yema floral, la cual es pequeña, ovalada y de color blanco con tintes violeta; a partir de ella se desarrolla la flor alcanzando un tamaño de 2,5 cm. Las flores se ubican de manera solitaria o en conjunto y su corola está formada por 5 pétalos libres que despiden un aroma característico intenso (Malo et al., 2012, p. 1).. 1.1.4.4.. Fruto. El tamaño del fruto oscila de 5 a 7 cm de diámetro, de 76 g de masa media, su forma es ovoide y uno de sus extremos se reduce ligeramente hasta terminar en un pequeño abultamiento (Malo et al., 2012, p. 1; Orduz et al., 2009, p. 8).. El fruto no tiene semillas en su interior, por la esterilidad de su polen y su crecimiento se da naturalmente en la planta, por acción de hormonas internas (Orduz et al., 2009, p. 8).. La morfología del fruto es particular de los cítricos, presenta un flavedo liso y de color verde oscuro, de 2 mm de espesor; a medida que avanza al estado de madurez su tonalidad cambia a amarilla y su espesor se reduce. El área del albedo es blanca, blanda y gruesa; y la región interna está dividida en pequeñas secciones donde se almacena el jugo (Malo et al., 2012, p. 1).. En la Figura 1.1 y Figura 1.2 se observa la flor y la estructura del fruto de la variedad Tahití..
(25) 4. Figura 1. 1. Flor y fruto de la variedad Tahití (Orduz et al., 2009, p. 8). Figura 1. 2. Corte transversal del limón (Fréderique, 2014, p.2).
(26) 5. 1.1.5. CONDICIONES CLIMÁTICAS Y EDÁFICAS DE CULTIVO. 1.1.5.1.. 1.1.5.1.1.. Condiciones Climáticas. Temperatura. Esta variedad de limón presenta buena resistencia a diversos climas, sin embargo el clima cálido, tropical o subtropical es el que favorece su crecimiento. El brote floral se da de manera continua en climas que mantengan su temperatura entre 22 y 28 °C; y de forma temporal al reducir a los 12 °C (Piña, Laborem, Monteverde, Magaña, Espinoza y Rangel, 2006, p. 435).. Generalmente el periodo desde que la flor nace hasta que se obtiene el fruto adecuado para cosecha dura 2 meses, lo cual se ve ralentizado por las bajas temperaturas incrementando el tiempo hasta 4 meses (Malo et al., 2012, p. 2).. 1.1.5.1.2.. Precipitación y humedad relativa. Estos árboles demandan anualmente entre 1 000 a 2 000 mm de agua para su desarrollo, por lo que en épocas de bajas precipitaciones se utiliza acoplamientos de riego, a fin de no afectar la producción (Piña et al., 2006, p. 435).. La humedad relativa de la región no debe ser elevada para un óptimo cultivo, ya que un valor alto puede mejorar la textura del fruto pero lo vuelve vulnerable a enfermedades (Escobar, 2008, p. 27).. 1.1.5.1.3.. Nivel. Se localiza en regiones de 500 a 1200 msnm, por su requerimiento de climas calientes, lo cual está directamente relacionado (Piña et al., 2006, p. 435)..
(27) 6. 1.1.5.1.4.. Vientos. La frecuencia máxima del viento en las zonas de cultivo debe ser de 20 km/h, debido a las consistencia y frondosidad de su copa (Escobar, 2008, p. 27).. 1.1.5.2.. Condiciones Edáficas. 1.1.5.2.1.. Suelo. Se adaptan en territorios francos arenosos, permeables, sin exceso salino y con una profundidad mayor a 2 m. No se desarrollan en suelos calcáreos (Malo et al., 2012, p. 2).. 1.1.5.2.2.. pH. El suelo óptimo para el cultivo presenta un pH de 5,5 a 7,0; siendo su límite básico 8,5. El pH está en función de los minerales a absorber, por tal razón es necesario considerar las características de solubilidad de los mismos (Pinto, 2008, p. 51).. 1.1.5.2.3.. Pendiente. Un factor determinante en la localización de las plantaciones es la pendiente, la cual no debe sobrepasar los 28 °, a fin de evitar el desgaste del terreno (Escobar, 2008, p. 32).. 1.1.5.2.4.. Humus. Un contenido de 3 a 4 % es adecuado para el cultivo (Barrera, 2008, p. 1)..
(28) 7. 1.1.6. SIEMBRA Y FERTILIZACIÓN . El Limón Persa se obtiene mediante injerto de tipo escudete en patrones de las variedades: Limón Macrofila, Mandarino Cleopatra, Volkameriana y Citrumelo Swingle. La inserción de la yema se realiza a 30 cm de altura de planta patrón y dura 5 días hasta acoplarse y brotar en él (Malo et al., 2012, p. 1; Piña et al., 2006, p. 435).. . La siembra se realiza mediante el método de ahoyado, en una profundidad de 40 cm y con la adición de materia orgánica e insecticida. La distancia entre sitios es de 3 a 6 m (Orduz y Mateus, 2012, p. 72).. . La poda debe ser moderada asegurándose mantener las ramas productivas, se la realiza de forma manual conservando un dimensión horizontal de 2 a 3 m (Malo et al., 2012, p. 3).. . Riego por gravedad, goteo o aspersión con una frecuencia promedio de 2 días por semana y en épocas secas hasta 4 días por semana (Orduz y Mateus, 2012, p. 84).. . El desarrollo y la producción están relacionados con la fertilización, sus necesidades de nitrógeno, fósforo y potasio son 5,00 kg, 2,00 kg y 1,88 kg por tonelada de fruta respectivamente (Orduz y Mateus, 2012, pp. 72-73).. 1.1.7. COSECHA. La recolección de los frutos se realiza continuamente en el año y cuando su corteza haya adquirido un color verde brillante y una acidez entre 4 – 7 %.. Esta operación se efectúa manualmente mediante la flexión de su rabillo o utilizando tijeras adecuadas, los frutos más altos se los obtiene mediante ganchos, evitando que sufran daños al desprenderse..
(29) 8. Se debe evitar la recolección de los frutos cuando presenten agua en su superficie ya que esta incrementa la posibilidad de sufrir alteraciones en su corteza, adherencia de hongos y fracturación de las vesículas internas caracterizada por el manchamiento de la piel (Pinto, 2008, p. 54).. 1.1.8. COMPOSICIÓN NUTRICIONAL La riqueza nutricional que posee el limón se expone en la Tabla 1.2.. Tabla 1. 2. Contenido nutricional del limón Tahití Componente. Cantidad /100g de fruto. Potasio. 135,0 mg. Vitamina C o ácido ascórbico. 52,0 mg. Calcio. 16,0 mg. Fósforo. 13,0 mg. Sodio. 10,0 mg. Glúcidos. 9,6 g. Proteínas. 0,8 g. Lípidos. 0,6 g. Ácido cítrico. 4,7 g. Agua. 90 %. Calorías. 19 kcal. (Fréderique, 2014, p. 17). Dentro de su género, el limón es el fruto que mayor cantidad de ácido ascórbico posee, el cual se ve fortalecido por la presencia de Riboflavina que inhibe su pérdida por oxidación. Además presenta un elevado contenido de minerales y bajo porcentaje de calorías que le convierte en una importante fuente nutricional.. De forma particular su corteza presenta abundante pectina y aceite esencial, en el cual se ha registrado: . Citral (5%).
(30) 9. . Limoneno (90 %). . Canfeno. . Pineno (alfa y beta). . Cumarina. . Iso-pulegol. . Terpineno (alfa y gamma). . Felantreno. . Beta-bergamoteno (Mejías y Aflallo, 2007, p. 59).. Sus hojas poseen cafeína y entre otros compuestos el limón presenta: . Bioflavonoides: Quercetina, limotricina, hesperidina, vitamina B1, B2 y B6. . Hierro, Magnesio. . Ácido málico, caféico (Jordá, 2011, p. 666).. 1.1.9. APLICACIONES INDUSTRIALES Y PROPIEDADES. La demanda artesanal e industrial de esta variedad es extensa, aprovechándose todos los componentes de su fruto, así como también las flores de su árbol.. El zumo se emplea en la preparación de bebidas, el cual se comercializa como concentrado o jugo. Se elabora aderezos y aliños para alimentos, para dotar de un sabor agrio o evitar la oxidación de ciertos vegetales; y por su alto contenido de ácido cítrico, se lo emplea en su proceso de obtención con carbonato de barita y ácido sulfúrico hasta formar cristales blancos de múltiples aplicaciones en el campo alimentico y farmacéutico (Malo et al., 2012, p. 3).. La principal aplicación del pericarpio es la producción de pectina como modificador de la reología de alimentos, el pericarpio puede provenir directamente de cosechas designadas a este fin o de residuos industriales (de bebidas, licores)..
(31) 10. La corteza húmeda o seca se emplea en formulaciones alimenticias para ganado porcino y vacuno por su alto porcentaje de fibra, que conjuntamente con suplementos propone un alimento adecuado para animales (Albarracín, Prieto, Barnes, Paz y Genta, 2011, p. 1).. El aceite aromático se extrae de la corteza oleosa y se lo utiliza como material desinfectante o fragancia; se lo obtiene mediante la técnica de arrastre de vapor o raspadura con un rendimiento de 10 mL/kg de limón. También se comercializa refinado mediante su desterpenación para evitar el enranciamiento y mejorar sus propiedades, el cual se lo utiliza en bebidas (Fréderique, 2014, p. 14; Ortuño, 2006, p. 11).. La aplicación en perfumería es amplia, también de la flor blanca del limonero se extrae el Neroli petalae, muy apetecido por su aroma dulce y por sus beneficios en tratamientos de la piel.. Por su contenido de antioxidantes (flavonoides) se consume el fruto como tal, al cual se le atribuyen beneficios medicinales contra el envejecimiento de la piel y propiedades anticancerígenas. Por su riqueza en limoneno es calificado como desintoxicante del organismo; y por el elevado índice de ácido ascórbico y minerales. es. un. regenerador. de. las. células. sanguíneas. previniendo. enfermedades como la anemia (Mejías y Aflallo, 2007, p. 241).. En la Figura 1.3 se sintetizan las propiedades del limón, con las cuales se fundamenta la acción positiva de este cítrico al ser consumido por el ser humano, es así que Morales (2011), lo califica como una fuente de más de mil beneficios químico-medicinales (p. 104)..
(32) 11. Figura 1. 3. Propiedades del limón (Fréderique, 2014, p. 18). 1.1.10. PRODUCCIÓN EN EL ECUADOR. La variedad Tahití llegó al Ecuador en la década de los cincuenta, su proporción de árboles asciende a 269 683 (INEC, 2013), ubicados en las regiones Costa, Sierra y Amazónica, donde se destacan las provincias de Manabí, Guayas, El Oro, Pichincha, Imbabura, Tungurahua, Bolívar, Loja y Napo (UTEPI, 2006, pp. 22-23).. En el Ecuador la producción del limón Tahití o Persa está mayoritariamente encaminada a la exportación a países como: Estados Unidos, Canadá, Puerto Rico, Francia y a las Antillas Holandesas y de Guadalupe, cuyos mercados se ven abastecidos por la continua producción del país, que al poseer regiones de características tropicales propicia el desarrollo de los cultivos durante todo el año. Según el Banco Central del Ecuador en los últimos cuatro años se ha exportado un total de 680,31 t, como se indica en la Tabla 1.3..
(33) 12. Tabla 1. 3. Total de exportaciones del limón Tahití del Ecuador País. Cantidad (t). Estados Unidos. 555,25. Canadá. 48,26. Guadalupe. 26,09. Puesto Rico. 25,46. Francia. 25,27. Antillas Holandesas. 0,01. Total de exportaciones. 630,31. (Banco Central del Ecuador, 2014). Estados Unidos interfiere con mayor relevancia en las importaciones del limón Tahití ecuatoriano registrando 555,25 t en el periodo del 2010 al 2013, pues a pesar de también producirlo, su cosecha es estacional por lo que tiende a las importaciones para cubrir sus necesidades.. Las exportaciones se han incrementado notablemente a medida de los años, por las mejoras en las condiciones de comercialización del país con el exterior, que han categorizado al producto ecuatoriano como un fruto competitivo y de calidad logrando posesionarse en mercados altamente estrictos, como se indica en la Tabla 1.4. Tabla 1. 4. Exportaciones del limón Tahití en los últimos cuatro años Año. Cantidad (t). 2010. 17,46. 2011. 22,86. 2012. 150,85. 2013. 439,14. (Banco Central del Ecuador, 2014). 1.1.10.1. Producción en el cantón Patate. En el área agrícola del cantón Patate el cultivo asociado presenta mayor superficie, esto corresponde a cultivos combinados de diversas clases de cítricos,.
(34) 13. que comúnmente lo realizan agricultores empíricos que satisfacen el mercado interno de la provincia y del país, sin cumplimiento de parámetros estrictos de cosecha. Sin embargo un porcentaje más bajo reserva zonas determinadas para el cultivo del limón, las cuales reciben asistencia técnica adecuada, a fin de intervenir en mercados más exigentes. En la Tabla 1.5 se observa el área plantada, productiva y cosechada de limón en el cantón Patate. Tabla 1. 5. Área plantada, productiva y cosechada de limón en el Cantón Patate Modo de cultivo. Área plantada (hm2). Área productiva (hm2). Área cosechada (hm2). Asociado. 48,14. 23,42. 23,39. Solo. 5,91. 5,49. 5,49. (INEC, 2010). Los monocultivos presentan mayor eficiencia, por las ventajas de esta condición, al tratar regularmente con maquinaria y fertilizantes que permiten normalizar las características del fruto. La producción total del limón corresponde a 100,21 t, con una generación promedio de 137 kg por árbol en cada cosecha.. La producción y el rendimiento del área cosechada se observa en la Tabla 1.6.. Tabla 1. 6. Producción y rendimiento del área cosechada del limón Tahití. Modo de cultivo Producción (t) Rendimiento (t/hm2) Asociado. 64,45. 2,76. Sólo. 35,76. 6,51. Total. 100,21. -. (INEC, 2010).
(35) 14. 1.2.. PECTINA. 1.2.1. UBICACIÓN. El término pectina se utiliza de forma general para nombrar a las sustancia pécticas y se definen como polisacáridos complejos de elevado peso molecular, se localizan en los tejidos de reserva de varios vegetales y cítricos. Constituyen la mayor parte de las laminillas intermedias del fruto verde y se encuentran en las membranas celulares y, en pequeña proporción, en todos los tejidos de la planta (Mohmen, 2008, p. 266).. La pectina se encuentra en la pared celular entrecruzada por otros polisacáridos como la hemicelulosa, celulosa y lignina, los cuales se enlazan a través de puentes de hidrógeno. La pectina acopla y adhiere internamente las células, proporcionando rigidez y firmeza a la pared (Lodish et al., 2005, p. 232; Velasco, Romero, Salamanca y López, 2009, p. 106). La estructura de la pared celular se presenta en la Figura 1.4.. Figura 1. 4. Pared celular (Velasco et al., 2009, p. 107)..
(36) 15. El albedo, capa blanca y esponjosa de los cítricos, es una fuente importante de pectina, que representa hasta el 50% del material seco, específicamente la pectina extraída de la corteza del limón verde presenta excelentes propiedades de homogeneidad, viscosidad y gelificación. Así también los residuos del plátano y la pulpa de remolacha son fuentes ricas en pectina (Srivastava y Malviya, 2011, p. 12).. En la Tabla 1.7, se presenta el porcentaje de pectinas sobre materia fresca y seca de ciertos vegetales y frutos.. Tabla 1. 7. Porcentaje de pectina en ciertos vegetales y frutos Producto. Porcentaje de pectina sobre: Materia Fresca. Materia Seca. Cáscaras de plátano. -. 20. Corteza de naranja. 4. 35. Corteza de limón. 3. 32. Corteza de limón verde. -. 50. Pulpa de remolacha. 1. 28. (Srivastava y Malviya, 2011, pp. 12-13; Vasquez, Ruesga, D’addosio, Páez y Marín, 2008, p. 318). El porcentaje de pectina varía según la especie del fruto y su estado de maduración. La actividad de la enzima pectinesterasa se incrementa a medida que evoluciona el estado de maduración del fruto, por lo que el porcentaje de pectina insoluble (protopectina) disminuye de las cáscaras, perdiendo su firmeza y quedando más susceptible al ataque de hongos y microorganismos (Guidi y Arandina, 2010, p. 68; Monsalves, Loyola y Muñoz, 2009, p. 10).. 1.2.2. ESTRUCTURA. En la década del 80 la pectina fue descubierta por Braconnot, químico experto en la extracción de componentes activos de las plantas, quién al observar las.
(37) 16. características de gelificación de ciertos frutos identificó por primera vez este tipo de polisacárido, denominándole pectina (Leclere, Van y Michiels, 2013, p. 1). La palabra pectina se usa de modo universal para designar “sustancias pécticas” y engloba los siguientes nombres: protopectina y pectina.. 1.2.2.1.. Protopectina. La protopectina es la sustancia péctica madre presente de forma abundante en las laminillas medias de las paredes celulares de plantas verdes, la cual al someterla al calentamiento en una solución de ácido o por acción de enzimas es hidrolizada a pectina soluble (pectina). Se la califica como pectina insoluble al agua (Monsalves et al., 2009, p. 10).. 1.2.2.2.. Pectina. Bioquímicamente la pectina está definida como un grupo de polisacáridos ricos en ácido galacturónico, con unidades de arabinosa y galactosa en intervalos raros; pueden presentar además ramnosa, fructosa y xilosa (Sandoval, 2005, p. 119). Los fragmentos de ácido galacturónico se observan en la Figura 1.5, los cuales presentan una forma piranosa.. Figura 1. 5. Estructura de un fragmento de cadena de ácido galacturónico (Wang, Liao, Feng, Zhang, Li y Wang, 2012, p. 257).
(38) 17. Los grupos de ácido galacturónico que forman la unidad de la pectina, se unen por medio de enlaces glucosídicos α (1-4) para dar origen a moléculas fibrilares constituidas por muchas unidades. Las macromoléculas poseen una variabilidad de pesos hasta 200 000 daltons (Cerón y Cardona, 2011, pp. 67-68).. 1.2.2.2.1.. Modelo estructural de la pectina. La estructura de la pectina es compleja y todavía se encuentra en debate, siendo el modelo estructural más aceptado aquel que está compuesto por dos regiones importantes: lisa y rugosa; que forman su columna vertebral e involucran tres dominios. de. polisacáridos. presentes. en. todas. los. tipos. de. pectina:. homogalacturonano y ramnogalacturonano I y II. Estos tres dominios se unen covalentemente formando la red péctica en toda la pared celular primaria y laminillas intermedias (Schols, Coenen y Voragen, 2009, p. 20; Willats, Knox y Mikkelsen, 2006, p. 98).. El homogalacturonano (HGA) es un homopolímero lineal en el que las fracciones de ácido D-galacturónico están unidas por enlaces α(1-4), esta estructura contiene alrededor de 100 a 200 fracciones de ácido D-galacturónico. El HGA es un dominio muy extenso y abundante de pectina que es sintetizado en el aparato de Golgi y depositado en la pared celular; los residuos de ácido D-galacturónico se encuentran en un 70 a 80% metilados en el C-6 y a la vez pueden presentar acetilación en los carbonos C-3 y C-2. Los residuos de ácido galacturónico también pueden ser sustituidos en el C-3 con residuos de xilosa, formándose el xilogaluctoronato (Mohmen, 2008, p. 267). El dominio ramogalacturonano se divide en dos tipos: ramnogalacturonano I y ramnogalacturonano II. El ramnogalacturonano I (RG I) es un polímero heterogéneo y se adhiere al homogalacturonato mediante enlaces glicosídicos; su estructura está formada por más de 100 repeticiones del disacárido α (1-2) - Lramnosa - α(1-4) - D-galacturónico, como se distingue en la Figura 1.6 (Leclere et al., 2013, p. 2)..
(39) 18. Figura 1. 6. Estructura de la región rugosa (Chasquibol et al., 2008, p. 179). En dicho dominio del 20 al 80% de los residuos de ramnosa están ramificados en el carbono C-4 con cadenas laterales de residuos neutros, los cuales pueden variar en tamaño desde 1 a 50 residuos, generando una familia extensa de polisacáridos. Las cadenas laterales presentan generalmente L-ramnosa, Dgalacturónico, L-arabinosa y D-galactosa (Leclere et al., 2013, p. 2; Willats et al., 2006, p. 98).. El ramnogalacturonano II presenta una estructura muy distinta al RG I, contiene azúcares inusuales como: metilfucosa, metilxilosa, ácido acérico, apiosa, 3desoxi D -manno ácido -2-octulosónico, etc.; representado en la Figura 1.7 (Leclere et al., 2013, p. 2).. El modelo estructural de las regiones: homogalacturonano y ramnogalacturonano se observan en la Figura 1.7..
(40) 19. Figura 1. 7. Representación del modelo estructural de la pectina (Leclere et al., 2013, p. 2). 1.2.3. ESTERIFICACIÓN DE LAS PECTINAS Y SU CATEGORIZACIÓN. 1.2.3.1.. Contenido de metóxilos. El contenido de metóxilos se define al total de grupos carboxilos presentes en forma de éster metílicos (-COOCH3) en la molécula de pectina; su contenido se relaciona directamente con su esterificación.. 1.2.3.2.. Grado de esterificación. El grado de esterificación es una característica importante de las pectinas, se expresa como porcentaje y está definido como la relación entre la cantidad de.
(41) 20. esterificaciones de los grupos carboxilos con metanol y el contenido de ácido ácido galacturónico.. Para determinar el grado de esterificación se presenta la siguiente ecuación [1.1] (Kanmani, Dhivya, Aravind y Kumaresan, 2014, p. 305):. 𝐸𝑇 (%) =. 176 𝑥 𝑀𝑋% 𝑥 100 31 𝑥 𝐺%. [1.1]. Donde:. ET: Grado de esterificación MX: Contenido de metóxilos G: Contenido de ácido galacturónico anhidro. Los valores de 176 y 31 corresponden al peso equivalente del ácido galacturónico y el peso molecular del metóxilo respectivamente.. Según los dos parámetros antes mencionados las pectinas se categorizan en dos grupos:. 1.2.3.3.. Pectinas muy esterificadas. Se califica como pectinas muy esterificadas o ricas en grupos metoxi aquellas que presentan un elevado número de ésteres metílicos, por tal razón su porcentaje de esterificación es igual o mayor al 50% (Cerón y Cardona, 2011, p. 67).. Las pectinas ricas en grupos metoxi al disolverse generan geles estables en medios cuyo pH es menor a 3,4 y un porcentaje de azúcar elevado, superior al 60%; y son irreversibles al exponerse en el calor. Para la elaboración de confituras y jaleas se requiere un mínimo de 60% de azúcar, por tal razón dichas.
(42) 21. pectinas son muy utilizadas en su elaboración; además se las aplica como estabilizadores de bebidas lácteas ácidas y como agentes de viscosidad en zumos de frutas sin la alteración del sabor, proporcionando un sabor de zumo muy limpio (Cerón y Cardona, 2011, p. 67; Monsalves et al., 2009, p. 10).. 1.2.3.4.. Pectinas poco esterificadas. Cuando el porcentaje de grupos carboxilos metilados presentes en la cadena de lineal de ácido galacturónico es bajo, se denominan pectinas poco esterificadas. Este tipo de pectinas presentan un porcentaje de esterificación menor al 50% (Cerón y Cardona, 2011, p. 67).. Estas pectinas forman geles en presencia de pequeñas cantidades de iones divalentes, en concentraciones de azúcar muy inferiores a las que normalmente se suele utilizar en las mermeladas y jaleas, o bien sin que exista azúcar alguno. Sus geles presentan estabilidad cuando el pH y el azúcar se encuentran en los rangos de 2,5 - 6,5 y 10 - 25% respectivamente (Cerón y Cardona, 2011, p. 67).. Al no requerir cantidades elevadas de azúcar las pectinas poco esterificadas se las utiliza en productos dietéticos, yogures naturales y conservas con bajo nivel de azúcar (Chasquibol et al., 2008, p. 192).. En las Figuras 1.8 y 1.9 se esquematiza las estructuras de las pectinas.. Figura 1. 8. Pectina muy esterificada (Imeson, 2010, p. 245).
(43) 22. Figura 1. 9. Pectina poco esterificada (Imeson, 2010, p. 245). 1.2.4. PROPIEDADES DE MODIFICACIÓN. 1.2.4.1.. Formación de geles y resistencia. La gelificación es la capacidad de las pectinas en formar soluciones coloidales, por lo que se precisa otros agentes como: ácido, agua y azúcar, los cuales deben estar en proporciones adecuadas.. La molécula de pectina presenta una alta afinidad por la molécula de agua, ya que posee grupos oxhidrilos (-OH) que le otorgan polaridad; dando lugar a la formación de puentes de hidrógeno con el agua. Al disolverse la pectina, sus moléculas se esparcen en el medio y se genera fácilmente la heterólisis de sus radicales carboxi (-COO-); por tal razón se añade sacarosa, que al ser una sustancia también polar interacciona con el agua interfiriendo en la relación aguapectina y a la vez incrementando la unión pectina-pectina (grupos ésteres) que favorece la formación de una estructura tridimensional (Kastner, Einhorn-Stoll y Senge, 2012, p. 43; O’Brien, Philp y Morris, 2009, p. 1818).. Otro agente que se adiciona para favorecer la interacción pectina-pectina es el ácido, el cual permite mantener estables los grupos carboxilos de la pectina, evitando su ionización; que provoca que se separen (Kastner et al., 2012, p. 43)..
(44) 23. Las moléculas de pectinas no se unen completamente, poseen secciones definidas de interacción, donde las moléculas se entrecruzan y dan lugar a una red tridimensional en cuyo interior se almacena agua, a la que se denominada hidrogel (Imeson, 2010, p. 250).. El grado de esterificación es directamente proporcional a la velocidad de gelificación, es por ello que, para pectinas de elevado grado de esterificación el tiempo de formación del gel es menor, como se presenta en la Tabla 1.8. Además se debe considerar la temperatura, manteniéndola en un rango de 55-85 °C, con el fin de alcanzar una gelificación normal (Edwards, 2007, p. 126).. Tabla 1. 8. Tiempo de gelificación de pectinas Tipo de pectina. Grado de esterificación (%). Tiempo de gelificación (s). De gelificación rápida. > 72. 20-70. De gelificación normal. 64 - 72. 100-135. De gelificación lenta. < 64. 180-250. (Edwards, 2007, p. 126; Imeson, 2010, p. 250). La diferencia de tiempos se fundamenta en la complejidad de la vía de gelificación de las pectinas con ET bajo, menor al 64 %; al necesitar calcio para enlazar las moléculas de pectina y acoplarse adecuadamente como gel. Para este tipo de pectinas las fuerzas de cohesión del gel dependen de la cantidad de calcio añadida y este del número de radicales carboxi (Shukla, Jain, Verma, K. y Verma, S., 2011, p. 85).. Los factores ligados directamente con la resistencia del gel son el ET y el peso molecular, es por ello que la extensión de las cadenas de pectina define la transformación de la textura de la solución y la dificultad a fluir del hidrogel (Kanmani et al., 2014, p. 304).. En la Figura 1.10 se esquematizan los enlaces entre cadenas de pectina según la categoría a la que pertenecen..
(45) 24. Figura 1. 10. Método de enlace entre pectinas para la generación del hidrogel (Shukla et al., 2011, p. 84). 1.2.5. MÉTODOS DE EXTRACCIÓN. Existen métodos físicoquímicos y enzimáticos, a través de los cuales se obtiene pectina de distinta calidad; pues dicho producto depende directamente del tratamiento que haya sido utilizado. Los métodos de extracción de pectina incluyen: extracción en medio ácido, asistida por microondas y extracción con enzimas.. La extracción en medio ácido constituye el método convencional, el cual requiere aproximadamente 30 min a 1 hora para obtener un buen rendimiento de pectina, y si el periodo de calentamiento directo se extiende la pectina sufre degradación térmica. La extracción por calentamiento en microondas utiliza la energía discipada por el campo electromagnético para incrementar la porosidad de la corteza,. y. la. extracción. enzimática. requiere. enzimas. generadas. por. microorganismos que despolimericen la estructura de la protopectina (Srivastava y Malviya, 2011, p. 13)..
(46) 25. 1.2.5.1.. Extracción con soluciones ácidas. La extracción de la pectina es un proceso complejo en el que la hidrólisis, extracción y solubilidad de las moléculas de pectina de los tejidos de la fruta se efectúan bajo la influencia de varios factores, siendo los principales: la temperatura, el pH y el tiempo de tratamiento (Chakraborty y Ray, 2011, p. 391).. A escala industrial el método más utilizado es la extracción de pectina en medio acuoso acidificado, el cual se realiza a temperaturas entre 60 ̊ C - 95 C ̊ y en un rango de pH de 1,5 – 3,0. Los ácidos inorgánicos más comúnmente utilizados son: ácido clorhídrico, sulfúrico y fosfórico; y entre ácidos orgánicos y sus sales: ácido cítrico, ácido oxálico, oxalato de amonio, ácido tartárico, entre otros (Sánchez, Aguilar, Contreras y Nevárez, 2011, p. 79; Srivastava y Malviya, 2011, p. 13).. Dentro de los ácidos citados, el clorhídrico, es aquel que permitó la recuperación máxima de pectina para la especie Citrus pseudolimon Tan.; es por ello, de su preferencia para el ensayo con cítricos (Flores, Mariños, Rodríguez, N. y Rodríguez, D., 2014, p. 79).. La presencia del ácido en medio acuoso a temperaturas elevadas ayuda a un rápido y brusco rompimiento de las paredes celulares de la corteza del fruto, dando lugar a la hidrólisis de la protopectina. Generalmente la extracción con ácidos produce pectinas con alto grado de esterificación, mientras que las sales pectinas con bajo grado (Sánchez et al., 2011, p. 79).. El tiempo de extracción puede variar de 30 minutos a horas y constituye un factor relevante en dicho proceso; ya que, si el periodo de tiempo es muy pequeño la cantidad extraída va a ser baja, mientras que si se extiende demasiado la pectina tiende a degradarse (Monsalves et al., 2009, p. 10).. Después de dicho tratamiento se precipita la pectina del extracto obtenido, para este fin se utiliza sales de aluminio, sales de cobre, pectato de calcio y alcoholes,.
(47) 26. entre ellos: etanol, metanol y 2-propanol; debido a la capacidad de coagular o gelificar la pectina en presencia de dichas sustancias. El etanol es el agente precipitante más utilizado, ya que la aplicación de las demás sustancias involucra procesos de lavado y purificación (con agua o etanol ácido para eliminar iones metálicos) y por ende mayor costo (Cerón y Cardona, 2011, p. 69).. De forma específica, al analizar la influencia del pH y el tiempo de calentamiento durante la extracción de pectina de la corteza seca de limones Citrus genuina, se encontró un máximo rendimiento al trabajar a un pH 2,5 y 90 min. La pectina obtenida se caracterizó como una de bajo índice de metóxilo (Chakraborty y Ray, 2011, p. 392).. 1.2.5.2.. Extracción con previa aplicación de ondas microondas. La extracción asistida por microondas, consiste en el calentamiento delimitado de la matriz (modas de fruta) mediante ondas microondas, lo que provoca el aumento de la temperatura y presión en el pericarpio (Srivastava y Malviya, 2011, p. 13). El fenómeno de transformación de la energía electromagnética en energía térmica ocurre por la rotación y alineación de los dipolos, ocasionando que las moléculas roten y se friccionen, emitiendo energía en forma de calor (Fernández et al., 2010, p. 2).. En dicho proceso la presión se acumula en el interior del material, incrementándose rápidamente; lo que da lugar al fraccionamiento de la estructura celular, los tejidos y la liberación las sustancias intracelulares; mientras que el aumento de temperatura inactiva las enzimas que degradan la pectina (Sánchez et al., 2011, p. 79; Srivastava y Malviya, 2011, p. 13).. Particularmente para la extracción de pectina del albedo de la naranja Valencia de la región tropical de Colombia, se han estudiado tratamientos a una frecuencia de 2450 MHz y una potencia de 600 W, donde el mayor rendimiento correspondió a 9,50 % (base seca). Así también se trató a pieles de manzana con una potencia.
(48) 27. de 499,99 W y un tiempo de 20 min, donde se obtuvo un rendimiento de 0,315 g por 2 g de piel seca (Barón y Villa, 2014, p. 153).. Dicho método reduce el tiempo, se requiere un periodo de 15 a 20 minutos para la extracción, sin embargo el costo operativo es alto (Srivastava y Malviya, 2011, p. 13). El pretratamiento con microondas incrementa la solubilidad de la pectina, a la vez que dicho gel presenta mayor resistencia (Barón y Villa, 2014, p. 148-149).. 1.2.5.3.. Este. Extracción enzimática. método. se. microorganismos:. basa. en. la. utilización. endo-poligalacturonasa. de. enzimas. (Aspergillus. generadas. niger,. por. Aspergillus. kawachii), endo-celulasa (Trichoderma sp.) y endo-arabinasa (A. niger ), de las cuales la primera permite una mayor solubilización de la pectina. Las endopoligalacturonasas actúan sobre el homogalacturonano, que constituye la estructura principal de las sustancias pépticas, rompiendo mediante hidrólisis sus enlaces glucosídicos; mientras que las otras enzimas señaladas atacan las cadenas laterales. Las enzimas pectinesterasa y pectinmetilesterasa también se las utiliza, para disminuir el porcentaje de metóxilos de las pectinas como se observa en la Figura 1.11 (Sánchez et al., 2011, p. 80). Dicho método se ha aplicado en la obtención de pectina de la cáscara deshidratada de mango y se obtuvo un rendimiento del 32,50 %; utilizando la endo-poligalacturonasa como enzima. Así también se utilizó dicha enzima en la extracción de pectina del limón y se la comparó con el rendimiento obtenido con el tratamiento general, donde se alcanzó un rendimiento del 17,60 % y 20,20 %, respectivamente; observándose la disminución del rendimiento con el método enzimático (Contreras, Voget, Vita y Espinoza, 2006, p. 163).. La ventaja de este método lo constituye las condiciones no severas de la reacción y el bajo consumo de energía; calificándolo como un método amigable con el medio ambiente (Contreras et al., 2006, p. 163; Flores et al., 2014, p. 81)..
(49) 28. Figura 1. 11. Acción de la endo-poligalacturonasa (endo-PG) y pectinmetilesterasa (PME) (Menezes y Choudhari, 2011, p. 228). 1.2.6. USOS Y APLICACIONES. La principal aplicación de las pectinas se debe a su capacidad de gelificar y estabilizar ciertos alimentos, su acción favorece las propiedades reológicas de mermeladas, jaleas, lácteos, jugos, etc. Según Pons, García, Contreras y Acevedo (2009), el aditamento de pectina en una concentración de 0,15 % favorece la firmeza y viscosidad del yogurt, pues genera un producto de mejor calidad respecto al estándar (p. 447).. En la industria alimenticia, se la utiliza en gran porcentaje para combatir la sinéresis de mermeladas y conservas; pues una de las causas de este fenómeno es la deficiencia de pectina; que ocasiona la compresión del gel y por ende la expulsión del líquido presente, lo que constituye un grave problema en la elaboración de dichos productos (Monsalves et al., 2009, p. 10; Colquichagua y Ortega, 2005, p. 17).. Es considerada fibra dietética, al formar geles de alta viscosidad que inhiben la asimilación de compuestos en el estómago e intestino; y al combinarse con el agua generan una capa hidrofílica que evita que el colesterol y las sales biliares.
(50) 29. atraviesen el intestino. Es por ello que se le añade a varios alimentos, al igual que a la hemicelulosa y a la celulosa (Srivastava y Malviya, 2011, pp. 10-11).. Así se justifica su aplicación en tratamientos de reducción de peso y control de niveles de colesterol en la sangre, donde el consumo de al menos 6 g/día de pectina es necesario para establecer un efecto significativo en la reducción del colesterol (Kadajji y Betageri, 2011, p.1972). Además, actúa como desintoxicante por su capacidad de adherencia a cationes que permite eliminarlos del tracto gastrointestinal, con gran eficiencia en la remoción específica de plomo y mercurio (Shukla et al., 2011, p. 85).. La elaboración de recubrimientos comestibles es un nuevo campo de aplicación de la pectina, produce películas con propiedades mecánicas y de permeabilidad adecuada destinadas como barreras de preservación de alimentos; durante su fabricación es necesaria la adición de sales de calcio para mejorar la resistencia al agua. Además, se ha comprobado que la aplicación de radiación gama e inmersión en cloruro cálcico (CaCl2) mejora la resistencia a la tracción, elongación a la rotura y permeabilidad al vapor de agua de la película biodegradable (Sánchez et al., 2011, p. 78).. En el ámbito farmacéutico, la pectina se la utiliza en las formulaciones como gelificante instantáneo del paracetamol y ambrosol, para que su liberación en el interior del estómago se realice lentamente y se controle su velocidad de disipación; así también la adición de iones divalentes permite mejorar dicho control, siempre y cuando se encuentren en dosis adecuadas, las cuales oscilan entre 15 a 30 mg/g pectina (Mamani et al., 2011, pp. 84-85).. Las pectinas obtenidas de cítricos se han aplicado en la medicina para combatir el cáncer, por su capacidad de bloquear su propagación y disminuir la dimensión del tumor; con mayor relevancia en el cáncer de colon. La inclusión de pectina en el consumo humano permite incrementar los ácidos grasos, los cuales intervienen en el cuidado de las células de colon evitando su degeneración; además que mejora el tránsito intestinal (Mamani et al., 2011, p. 91)..
(51) 30. 1.2.7. NORMALIZACIÓN DE LA PECTINA. Según el Codex Alimentarius, la pectina está calificada como aditivo alimentario autorizado y seguro; que no presenta peligro alguno al ser consumida por los seres humanos.. Los aditivos alimentarios son sustancias no consumidas de forma regular ni directa por las personas, no constituyen un componente esencial en la elaboración de alimentos y pueden o no presentar características nutricionales; su adición en productos alimenticios se realiza para mejorar sus propiedades organolépticas (Codex Alimentarius Codex Stan 192, 1995, p.3).. De acuerdo al Código Europeo, se califica a la pectina como Agente Gelificante, Espesante y Estabilizante, al igual que el alginato, carragenano, agar, ácido algínico, monoestearato, etc.; cuya función es transformar la textura de los alimentos. Su característica más importante es la formación de geles estables a diferentes condiciones; además de ser sustancias con baja o nula asimilación en el organismo (García, 2010, p. 2).. En el Ecuador la norma INEN 192:2013 se fundamenta en la norma del Codex Alimentarius y se especifica a la pectina 440 como coadyuvante, definiendo las categorías de los alimentos en los que se usa: . Zumos de frutos. . Concentrados para zumos de frutos. . Néctares de frutos. . Concentrados para néctares de frutos. 1.2.8. DEMANDA DE PECTINA EN EL ECUADOR. El Ecuador y varios países de Sudamérica importan pectina, mientras la fuente principal de este aditivo, los cítricos, se cultivan en gran porcentaje en sus.
(52) 31. campos sin contar con un adecuado enfoque industrial. Según los registros del Banco Central en el periodo: enero 2010 a diciembre 2013, el principal proveedor de pectina del Ecuador es México, como se observa en la Tabla 1.9.. Tabla 1. 9. Países proveedores de pectina al Ecuador País. Cantidad (t). México. 60,28. Colombia. 46,00. Alemania. 21,25. Estados Unidos. 21,81. Brasil. 22,00. Francia. 13,90. Bélgica. 4,00. España. 3,03. Dinamarca. 0,85. China. 0,90. Perú. 0,15. Chile. 0,03. (Banco Central, 2014). El país ha importado un total de 194,18 t de materias pécticas en los últimos cuatro años, de proveedores como Estados Unidos y Francia, que son los países que mayor proporción de limón Tahití ecuatoriano consumen. Dicha cantidad es requerida por 19 industrias presentes en el país, cuyos nombres se especifican en la Tabla 1.10.. Tabla 1. 10. Industrias importadoras de materias pécticas en el Ecuador ADITMAQ CIA. LTDA ALITECNICO COMERCIO E INSUMOS PARA IND. ALIMENTOS ALPINA PRODUCTOS ALIMENTICIOS ALPIECUADOR COMERCIAL DANESA CIA. LTDA ECUAJUGOS S.A. ECUAVEGETAL S.A. ESPECTROCROM CIA.LTDA..
(53) 32. Tabla 1.10. Industrias importadoras de materias pécticas en el Ecuador (continuación …) INDUSTRIA DE PRODUCTOS ALIMENTICIOS INPROLAC INDUSTRIAS LÁCTEAS TONI S.A. INDUSTRIAS REUNIDAS CIA. LTDA. JAMES BROWN PHARMA C.A. NEW YORKER S.A. PLASTIQUIM S.A. PRODUCTOS DE SEGURIDAD INDUSTRIAL PROSEIN CIA.LTDA PROVEQUIM C.A. QUÍMICA SUIZA INDUSTRIAL DEL ECUADOR QSI S.A. RESIQUIM S.A. SUMESA S.A. SUPERQUÍMICOS C.A. (Banco Central del Ecuador, 2014). Las industrias nombradas anteriormente se dedican a la producción de alimentos como bebidas, jugos, lácteos, pastas, mermeladas, etc. que solicitan la pectina en sus procesos como ingrediente para adquirir la textura que demanda el consumidor; mientras que otras se dedican a la comercialización local de materias primas, agregados y químicos..
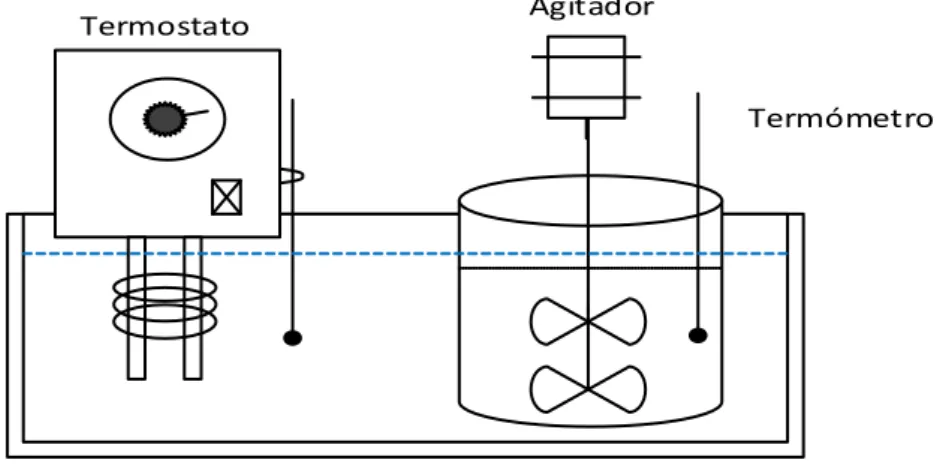
(54) 33. 2. METODOLOGÍA Para la ejecución experimental del presente estudio se utilizaron los siguientes equipos, materiales y reactivos, como se indican en las Tablas 2.1, 2.2 y 2.3:. Tabla 2. 1. Equipos Equipo. Marca. Modelo. Capacidad. Sensibilidad. Agitador de vidrio con motor. Talboys. Engineering Corp.. 104. 5000 rpm. 2%. Agitador magnético. Stuart. SM27. 1W. -. Anemómetro. Amprobe. TMA40-A. 0,4-32,0 m/s. 0,1 m/s. Balanza analítica. Ohaus Champ II. CD-11. 5,0000 kg. 0,0001 kg. Balanza analítica. Ae Adam. PW 124. 120,0000 g. 0,0001g. Baño termostático. Julabo. 20B. 30 L. -. Calibrador. Mitutoyo. -. 150,00 mm. 0,02 mm. Hielera. Scotsman. ECF75AE-1A. 53 kg. -. Estufa. Memmert. SFE-A00. 200,0 °C. 0,1 °C. pH-metro. Hanna. H198127. 14,0. 0,1. Plancha eléctrica. Scientific Support. PC-100. 50 Watts. -. Refractómetro. Llinsham & Stanless Epic Inc.. 33. 0-50 °Bx 0,00-25,00 °Bx. 1 °Bx 0,25 °Bx. 80203. 150 °C. 1 °C. 73A0G11B. 100 °C. 2 °C. Termómetro Termostato. Thomas Scinetific. Tabla 2. 2. Materiales Material. Capacidad (mL). Vaso de precipitación. 50, 250,1000 y 4000. Bureta. 25. Matraz Erlenmeyer. 250.
(55) 34. Tabla 2.2. Materiales (continuación …) Pipeta. 10. Balones. 500 y 1000. Filtro de tela. -. Bandeja. 0,0456 m2. Mortero. -. Cuchillo. -. Imán de agitación Bolsas herméticas. -. Tabla 2. 3. Reactivos. 2.1.. Material. Casa Comercial. Pureza. Hidróxido de sodio. Laquin S.A.. Reactivo. Ácido clorhídrico. Merck. 37 %. Etanol. Laquin S.A.. 96 %. Fenolftaleína. Laquin S.A.. 2%. Rojo fenol. Laquin S.A.. 2%. Cloruro de Sodio. Laquin S.A.. Reactivo. CARACTERIZACIÓN DEL LIMÓN DE LA VARIEDAD TAHITÍ (Citrus latifolia Tan.). 2.1.1. SELECCIÓN DE LA MATERIA PRIMA. La recolección de las muestras de los frutos del limonero de la variedad Tahití se realizó directamente en la Granja de la Asociación de Productores Agropecuarios Quinlata del cantón Patate, en la provincia de Tungurahua.. Esta etapa se efectuó manualmente mediante la torcedura del rabillo de fruto y bajo la utilización de la tabla colorimetría específica del limón Persa o Tahití, elaborada por Bosquez, Domínguez, Perez, Bautista, Díaz de León y Rivera.
Figure



Documento similar
If certification of devices under the MDR has not been finalised before expiry of the Directive’s certificate, and where the device does not present an unacceptable risk to health
In addition to the requirements set out in Chapter VII MDR, also other MDR requirements should apply to ‘legacy devices’, provided that those requirements
The notified body that issued the AIMDD or MDD certificate may confirm in writing (after having reviewed manufacturer’s description of the (proposed) change) that the
Para ello, trabajaremos con una colección de cartas redactadas desde allí, impresa en Évora en 1598 y otros documentos jesuitas: el Sumario de las cosas de Japón (1583),
Entre nosotros anda un escritor de cosas de filología, paisano de Costa, que no deja de tener ingenio y garbo; pero cuyas obras tienen de todo menos de ciencia, y aun
E Clamades andaua sienpre sobre el caua- 11o de madera, y en poco tienpo fue tan lexos, que el no sabia en donde estaña; pero el tomo muy gran esfuergo en si, y pensó yendo assi
Products Management Services (PMS) - Implementation of International Organization for Standardization (ISO) standards for the identification of medicinal products (IDMP) in
This section provides guidance with examples on encoding medicinal product packaging information, together with the relationship between Pack Size, Package Item (container)