QUANTIFICAÇÃO DE GALACTO OLIGOSSACARÍDEOS PRODUZIDOS PELA ENZIMA LACTOZYME 2600
Texto completo
(2) 48$17,),&$d-2 '( *$/$&72-2/,*266$&$5Ë'(26 352'8=,'26 3(/$ ENZIMA LACTOZYME 2600 ,1752'8d-2 $ ODFWRVH SULQFLSDO FDUERLGUDWR GR OHLWH H RXWURV SURGXWRV OiFWHRV HVWi SUHVHQWH DSHQDV QR OHLWH GH PDPtIHURV $Wp RQGH VH VDEH D ODFWRVH QmR WHP HVSHFLDO LPSRUWkQFLD QXWULFLRQDO SDUD DGXOWRV QR HQWDQWR p D PDLV LPSRUWDQWH IRQWH GH HQHUJLD GXUDQWH R SULPHLUR DQR GH YLGD GH XP VHU KXPDQR IRUQHFHQGR TXDVH PHWDGH GD QHFHVVLGDGH HQHUJpWLFD WRWDO HP FULDQoDV 3RUpP, para ser absorvida, a lactose precisa ser hidrolisada no intestino pela enzima JDODFWRVLGDVH FKDPDGD WDPEpP GH ODFWDVH $ ODFWDVH p HQFRQWUDGD PDLV DEXQGDQWHPHQWH QR LQWHVWLQR GHOJDGR VXD IXQomR p HVSHFLILFDPHQWH KLGUROLVDU D ODFWRVH $ ODFWDVH KLGUROLVD D lactose nos Do~FDUes glicose e galactose (,QWROHUkQFLD . A partir da UHDomR HQ]LPiWLFD GD KLGUyOLVH GD ODFWRVH YDULDQGR GLYHUVRV IDWRUHV FRPR D IRQWH GD HQ]LPD D FRQFHQWUDomR GD HQ]LPD D WHPSHUDWXUD R S+ H D FRQFHQWUDomR GR VXEVWUDWR p SRVVtYHO REWHU-se galacto-oOLJRVVDFDUtGHRV *OS) (LISBOA et al., 2012) conhecidos como alimentos funcionais, VHQGR HVWHV ROLJRVVDFDUtGHRV FRPSRVWRV GH XPD FDGHLD FRQWHQWR GH D unidades de galactose e uma unidade terminal de glicose (MARTINS, BURKERT, 2012). Os ROLJRVVDFDUtGHRV SDUWLFLSDP GD FRQVWLWXLomR GD ILEUD DOLPHQWDU H VmR SULQFLSDOPHQWH XWLOL]DGRV FRPR SUHELyWLFRV 2V ROLJRVVDFDUtGHRV YrP VHQGR XWLOL]DGRV FRPHUFLDOPHQWH QD LQG~VWULD DOLPHQWtFLD *,(6( HW DO $ DGLomR RX D VtQWHVH dos GOS em alimentos possibilita algumas vantagens como a REWHQomR GH SURGXWRV FRP EDL[R WHRU GH ODFWRVH SRVVLELOLWDQGR R FRQVXPR SRU JUXSRV SRSXODFLRQDLV TXH VmR LQWROHUDQWHV D ODFWRVH UHJXODomR GR WUDWR LQWHVWLQDO REWHQomR GH PHOKRUHV FDUDFWHUtVWLFDV WHFQROyJLFDV HP GHULYDGRV OiFWHRV WDLV FRPR PHOKRU VROubilidade e UHGXomR GH ULVFRV GH FULVWDOL]DomR HP VRUYHWHV GRFH GH OHLWH H OHLWH FRQGHQVDGR 0$57,16 2009). Com isso eVWH WUDEDOKR WHYH FRPR REMHWLYR HVWXGDU D VtQWHVH Ge galactoROLJRVVDFDUtGHRV D SDUWLU GD KLGUyOLVH GD ODFWRVH SHOD HQ]LPD Lactozyme 2600 (SigmaŠ) YDULDQGR GLIHUHQWHV FRQGLo}HV 2 METODOLOGIA 2 HVWXGR H[SHULPHQWDO GH KLGUyOLVH GD ODFWRVH H SURGXomR GRV *26 IRL UHDOL]DGR utilizado a enzima Lactozyme 2600 e HPSUHJDQGR GLIHUHQWHV FRQGLo}HV D SDUWLU GH XP SODQHMDPHQWR IDWRULDO IUDFLRQiULR 4-1 RQGH DV YDULiYHLV HVWXGDGDV IRUDP D FRQFHQWUDomR GD HQ]LPD D 8 P/ FRQFHQWUDomR GD ODFWRVH D J / S+ D H WHPSHUDWXUD D ƒ& FRQIRUPH LQGLFDGR na Tabela 1. 2V HQVDLRV IRUDP UHDOL]DGRV HP EDQKR GH DJLWDomR 0HWDEyOLFR 'XEQRIf SL 157 DOWHUDQGR DV YDULiYHLV GH DFRUGR FRP R SODQHMDPHQWR UHWLUDQGR-se a cada 2 horas uma amostra DWp FRPSOHWDU KRUDV GH UHDomR $V DPRVWUDV REWLGDV D SDUWLU GRV HQVDLRV IRUDP GLOXtGDV H TXDQWLILFDGDV DWUDYpV GD FURPDWRJUDILD OtTXLGD GH DOWD HILFLrQcia (Agilent, Infinitely better 1200 infinity series). As amostras foram injetadas no HPLC empregando H2SO4 0,005 M como eluente e os carboidratos presentes foram detectados pelo detector de tQGLFH GH UHIUDomR H LGHQWLILFDGRV SRU FRPSDUDomR FRP R WHPSR GH UHWHQomR GRV SDGU}HV GH ODFWRVH JOLFRVH H JDODFWRVH.. Anais do 10ž 6$/-2 ,17(51$&,21$/ '( (16,12 3(648,6$ ( (;7(16-2 - SIEPE Universidade Federal do Pampa œ Santana do Livramento, 6 a 8 de novembro de 2018.
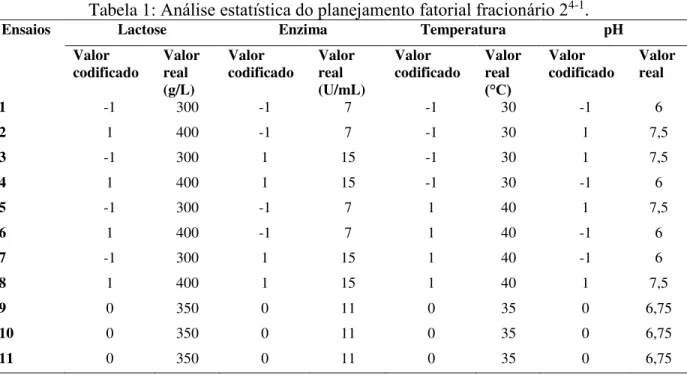
(3) Tabela Ensaios. $QiOLVH HVWDWtVWLFD GR SODQHMDPHQWR IDWRULDO IUDFLRQiULR. Lactose Valor codificado. Enzima Valor codificado. 4-1. .. Temperatura. 1. -1. Valor real (g/L) 300. 2. 1. 400. -1. 7. -1. 30. 1. 7,5. 3. -1. 300. 1. 15. -1. 30. 1. 7,5. 4. 1. 400. 1. 15. -1. 30. -1. 6. 5. -1. 300. -1. 7. 1. 40. 1. 7,5. 6. 1. 400. -1. 7. 1. 40. -1. 6. 7. -1. 300. 1. 15. 1. 40. -1. 6. 8. 1. 400. 1. 15. 1. 40. 1. 7,5. 9. 0. 350. 0. 11. 0. 35. 0. 6,75. 10. 0. 350. 0. 11. 0. 35. 0. 6,75. 11. 0. 350. 0. 11. 0. 35. 0. 6,75. -1. Valor real (U/mL) 7. Valor codificado -1. Valor real ƒ& 30. pH Valor codificado. Valor real. -1. 6. Fonte: Autor, 2018.. 5(68/7$'26 H ',6&866-2 $V PDLRUHV FRQFHQWUDo}HV GH *26 SUHVHQWHV QHVWH SODQHMDPHQWR RFRUUHUDP QDV VtQWHVHV 6, 7 e 8 $ VtQWHVH do ensaio 6 WHYH SURGXomR de 71,6 g/L de GOS QR SHUtRGR GH K VHJXLGD SHOD KLGUyOLVH GRV *26 IRUPDGRV QHVWH HQVDLR DV FRQGLo}HV HPSUHJDGDV IRUDP 400 g/L de lactose, 7 U/mL de enzima, 40 ƒ& H S+ 3DUD R HQVDLR 7 KRXYH SURGXomR de 74,0 g/L no tempo de 6 h, ocorrendo, em seguida, a KLGUyOLVH GRV *26 IRUPDGRV e as seguintes FRQGLo}HV foram empregadas neste ensaio: 300 g/L de lactose, 15 U/mL de enzima, 4 ƒ& H pH 6. Para o ensaio 8 D VtQWHVH GRV *26 RFRUUHX DWp as 6 K GH UHDomR DOFDQoDQGR R PDLRU YDORU GH FRQFHQWUDomR GH *26 GH Wodo o planejamento, 186,5 g/L, VHJXLGD SRU KLGUyOLVH GRV *26 QR UHVWDQWH GR WHPSR GH UHDomR SDUD HVWH HQVDLR HPSUHJRX-se 400 g/L de lactose, 15 U/mL de enzima, 4 ƒ& H S+ 3DUD RV GHPDLV HQVDLRV RFRUUHX PHQRU SURGXomR GH *26 (variando de 45,2 g/L a 68,9 g/L). 2V UHVXOWDGRV GD Pi[LPD FRQFHQWUDomR GH *26 de cada ensaio foram analisados estatisticamente e a Figura 1 apresenta os efeitos das quatro YDULiYHLV estudadas. Observa-se que D FRQFHQWUDomR GD lactose apresenta efeito estatisticamente significativo a 90% de FRQILDQoD QD VtQWHVH dos GOS, sendo este efeito positivo RX VHMD DR PXGDU GRV QtYHO -1 para R QtYHO KRXYH DXPHQWR QD FRQFHQWUDomR GH *26 $V GHPDLV YDULiYHLV QmR DSUHVHQWDUDP efeito estatisticamente significativo. Para obter uma maior SURGXomR GH *26 pode-se manter a FRQFHQWUDomR GH enzima, a temperatura e o pH QR QtYHO GR SRQWR FHQWUDO H aumentar a FRQFHQWUDomR da lactose.. Anais do 10ž 6$/-2 ,17(51$&,21$/ '( (16,12 3(648,6$ ( (;7(16-2 - SIEPE Universidade Federal do Pampa œ Santana do Livramento, 6 a 8 de novembro de 2018.
(4) Figura 1: Estimativa dos efeitos para a SURGXomR GH *26 SHOD HQ]LPD /DFWR]\PH. 1,97. Lactose. 1,88. Enzima. Temperatura. pH. .. 1,64. 1,10. p=0,1 Estimativa dos Efeitos. Fonte: Autor, 2018.. &216,'(5$d®(6 ),1$,6 A partir destes resultados percebe-se que a enzima utilizada apresentou um rendimento VDWLVIDWyULR GH KLGUyOLVH GD ODFWRVH QDV FRQGLo}HV XWLOL]DGDV QHVWH WUDEDOKR 2 PHOKRU UHVXOWDGR foi obtido ao empregar 400 J / GH FRQFHQWUDomR GH ODFWRVH 5 8 P/ GH FRQFHQWUDomR GH enzima, temperatura a 40ƒ& H S+ ,5, H SHOD DQiOLVH HVWDWtVWLFD DSHQDV D FRQFHQWUDomR GH ODFWRVH D DSUHVHQWRX HIHLWR HVWDWLVWLFDPHQWH VLJQLILFDWLYR QD FRQFHQWUDomR GRV *26 indicando assim, que D IRUPDomR GRV *26 H PDQXWHQomR GHVWHV *26 DR ORQJR GR WHPSR GH UHDomR SHOD enzima Lactozyme 2600 VmR PDLV LQIOXHQFLDGRV SHOD FRQFHQWUDomR GR VXEVWUDWR ODFWRVH.. Agradecimentos Ao &13T H j )$3(5*6 SHOR DSRLR financeiro e incentivo a pesquisa e ao LDERUDWyULR GH 0LFURELRORJLD H 7R[LFRORJLD GH Alimentos UNIPAMPA ± &DPSXV %DJp SHOR HVSDoR ItVLFR 5()(5Ç1&,$6 $GLWLYRV H ,QJUHGLHQWHV ,QWROHUkQFLD j ODFWRVH H SURGXWRV OiFWHRV FRP EDL[R WHRU GH ODFWRVH 'LVSRQtYHO HP KWWS LQVXPRV FRP EU DGLWLYRVBHBingredientes/materias/143.pdf>. Acesso em: Agosto, 2018. *,(6( ( & +,526, 7 6,/9$ 0 / & 6,/9$ 5 %$5%26$ $ 0 3URGXomR SURSULHGDGHV H DSOLFDo}HV GH ROLJRVVDFDUtGHRV 6HPLQD &LrQFLDV $JUiULDV. Londrina - PR. 2011. Anais do 10ž 6$/-2 ,17(51$&,21$/ '( (16,12 3(648,6$ ( (;7(16-2 - SIEPE Universidade Federal do Pampa œ Santana do Livramento, 6 a 8 de novembro de 2018.
(5) LISBOA, C. R.; COSTA, F $ $ %85.(57 - ) 0 %85.(57 & $ 9 6tQWHVH GH galacto-ROLJRVVDFDUtGHRV D SDUWLU GH ODFWRVH XVDQGR -galactosidase comercial de Kluyveromyces lactis. Brazilian Journal Food Technology. Campinas ± SP. 2012. MARTINS, A. R &RQYHUVmR GD ODFWRVH H VtQWHVH GH JDODFWR-ROLJRVVDFDUtGHRV SRU DomR GH -JDODFWRVLGDVH H GH PLFURUJDQLVPRV SURELyWLFRV HP ELRSURFHVVRV VLPXOWkQHRV FRP FDWiOLVH H IHUPHQWDomR OiFWLFD UFRGR - (VFROD GH 4XtPLFD H $OLPHQWRV 3URJUDPD GH 3yV*UDGXDomR HP (QJHQKDULD H &LrQFLD GH $OLPHntos. 2009. 0$57,16 $ 5 %85.(57 & $ 9 5HYLVmR *DODFWR-ROLJRVVDFDUtGHRV *26 H VHXV HIHLWRV SUHELyWLFRV H ELILGRJrQLFRV Brazilian Journal Food Technology. 2012.. Anais do 10ž 6$/-2 ,17(51$&,21$/ '( (16,12 3(648,6$ ( (;7(16-2 - SIEPE Universidade Federal do Pampa œ Santana do Livramento, 6 a 8 de novembro de 2018.
(6)
Figure
![Figura 1: Estimativa dos efeitos para a SURGXomR GH *26 SHOD HQ]LPD /DFWR]\PH . 1,10 1,64 1,88 1,97 p=0,1 Estimativa dos Efeitos](https://thumb-us.123doks.com/thumbv2/123dok_es/3264504.589704/4.894.194.750.142.547/figura-estimativa-efeitos-surgxomr-shod-dfwr-estimativa-efeitos.webp)
Documento similar
Dado un espazo topol´ oxico, denominado base, e dado un espazo vec- torial para cada punto de dito espazo base, chamaremos fibrado vectorial ´ a uni´ on de todos estes
Este estimador é asintoticamente insesgado para a densidade espectral, pero non é consistente dado que a súa varianza é proporcional ao valor da densidade espectral en cada frecuencia
La solución que se ha planteado, es que el paso o bien se hiciese exclusivamente por el adarve de la muralla, o que una escalera diese acceso por la RM evitando la estancia (De
Este acoplamiento se debe a las fuentes que aporta la fase discreta a las ecuaciones de conservación de masa y energía del modelo para la fase gaseosa, y a que la fase gaseosa
Nijkamp has placed special emphasis on spatial-economic competition and ascribes to it a central function. While we recognise the centrality of spatial- economic
If you are covered by a reciprocal agreement for health and social security (citizens of Denmark, Finland, France, Luxembourg, Norway, Portugal and Sweden), you may be eligible
DECORA SOLO LAS IMÁGENES QUE NECESITES PARA LLEGAR AL NÚMERO CORRESPONDIENTE... CEIP Sansueña/CEIP Juan XXIII Infantil
Las personas solicitantes deberán incluir en la solicitud a un investigador tutor, que deberá formar parte de un grupo de investigación. Se entiende por investigador tutor la