Efecto de aditivos químicos (urea, benzoato de sodio y sulfato de amonio) sobre la composición química bromatológica de la Avena (avena sativa l ) ensilada
Texto completo
(2) UNIVERSIDAD NACIONAL DE HUANCAVELICA FACULTAD DE CIENCIAS DE INGENIERÍA ACTA DE SUSTENTACIÓN DE TESIS el Auditórium de la Facultad de Ciencias de Ingeniería, a los 01 días del mes de junio del año 2016, a 3S. 3:00 p.m, se reunieron los miembros del Jurado Calificador conformado por los siguientes: Dr. Manuel ·. iTEJON VALDEZ (PRESJDEN!E), M.Sc. Héctor Marcelo GUILLEN DOMINGUEZ (SECRETARIO), lng.. ) Victoria RAMOS ESPJNOZA (VOCAL), designados con Resolución de Consejo de Facultad W 2043-FCI-UNH, de fecha 14 de junio del2013 y ratificados con Resolución de Decano W 041-2016-FCI-UNH fecha 10 de mayo del 2016, a fin de prqceder con la evaluación y calificación de la sustentación del rme final de tesis titulado: "EFECTO DE ADITIVOS QUIMICOS (Urea, Benzoato de Sodio y Sulfato de Jnio) SOBRE LA COMPOSICIÓN QUIMICA BROMATOLÓGICA DE LA AVENA (Avena saliva L.) )!LADA", presentado por lo_s Bachilleres Liz Mabel PAYTAN ESPINOZA y Miguel SAEZ AMAN, para optar el Título Profesional de Ingeniero Zootecnista; en presencia del Dr. Alfonso !gorio C_ ordero Fernandez, Asesor y al lng. José Luis CONTRERAS PACO, como Ca-Asesor del 3ente trabajo de tesis. Finalizado la evaluación a horas .;(-. ~ ~~. !!"•.; se invitó al público presente y a los tentantes abandonar el recinto. Luego de una amplia deliberación por parte de los Jurados, se llegó al Jiente resultado: : Mabel PAYTAN ESPINOZA. ROBADO. IS]. SAPROBADO. c:J. POR.J.~~.~ . ; .Y.':!. ~dQ.~.. ouol SAEZ HUAMAN. ROBADO. ~. :SAPROBADO. 0. señal de conformidad, firmamos a continuación:.
(3) A mis padres y tía por su. apoyo incondicional para cumplir mis objetivos, a mi querida hija. quien es la ra~ón de mi vida y a. m; at>ue~ QUe s>empre Y~Y~rá en mi recuerdo.. Mfguef.. A mis padres por el. apoyo incondicional que me brindaron dla a dJa para culminar. satisfactoriamente mi carrera profesional y a mi querida hija quien es la razón de mi vida. Llz Mabel..
(4) AGRADECIMIENTO. •. Expresamos nuestro agradecimiento a los docentes de la Universidad Nacional de Huancavelica, que integran la Escuela Profesional de Zootecnia, quienes impartieron sus conocimientos y experiencias durante nuestra permanencia en las aulas universitarias en beneficio de nuestra formación profesional.. •. Al Dr. Alfonso Gregario Cordero Fernández, investigador y docente universitario, quién en su calidad de asesor del presente trabajo nos brindó su orientación e invalorable contribución para la ejecución del presente trabajo.. •. Allng. José Luis Contreras Paco, docente universitario e investigador quién en su condición de co asesor del trabajo nos facilitó su constante apoyo y orientación en la conducción del experimento.. •. Expresamos de manera especial nuestro agradecimiento sincero a nuestros familiares, quienes supieron darnos su constante apoyo para la culminación de esta primera parte de nuestra vida profesional.. ii.
(5) ÍNDICE CAPÍTULO 1 PROBLEMA. Pág. 1.1 . Planteamiento del problema. 3. 1.2. Formulación del problema. 4. 1.3. Objetivos. 4. 1.4. Justificación. 5. CAPÍTULO 11 MARCO TEÓRICO. 2.1 . Antecedentes. 7. 2.2. Bases teóricas. 12. 2.3. Hipótesis. 26. 2.4. Definición de términos. 27. 2.5. Identificación de variables. 28. 2.6. Definición operativa de variables e indicadores. 30. CAPITULO 111 METODOLOGÍA DE LA INVESTIGACIÓN. 3.1. Ámbito de estudio. 31. 3.2. Tipo de investigación. 31. 3.3. Nivel de investigación. 31. 3.4. Método de investigación. 31. 3.5. Diseño de investigación. 32. 3.6. Población, muestra, muestreo. 32. ¡¡¡.
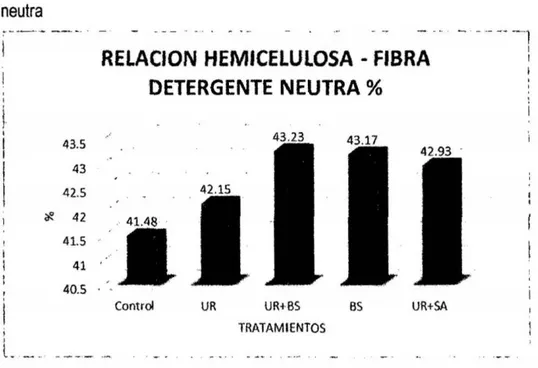
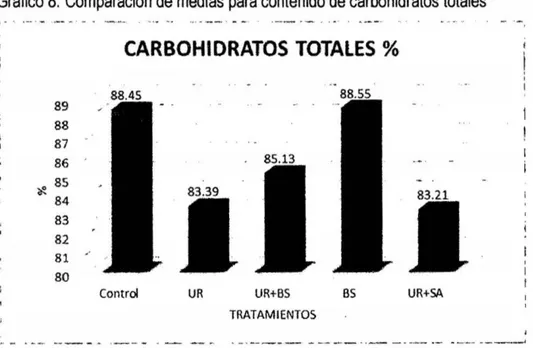
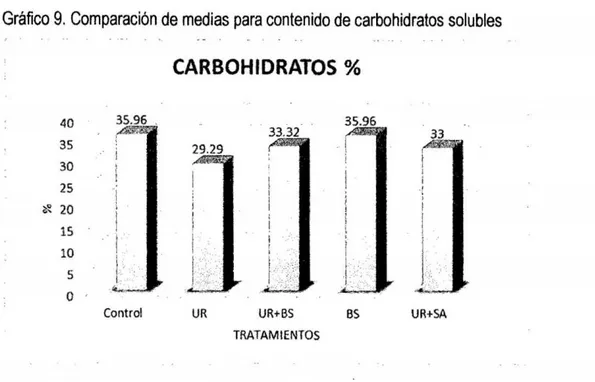
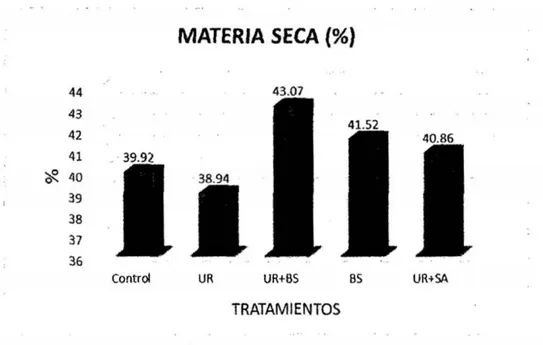
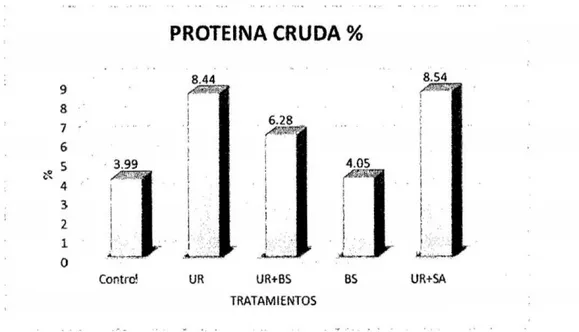
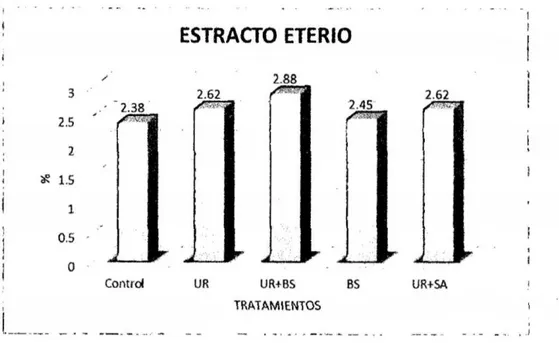
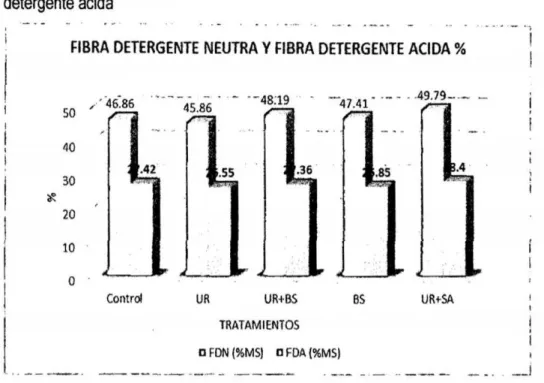
(6) 3.7. Técnicas e instrumentos de recolección de datos. 33. 3.8. Técnicas de procesamiento y análisis de datos. 42. CAPiTULO IV RESULTADOS Y DISCUSIÓN. 4.1 Presentación de resultados y discusiones 4.1.1 Efecto de aditivos químicos sobre la composición química. 43 43. a. materia seca. 43. b. Proteína Cruda. 45. c. Extracto etéreo. 47. d. Materia mineral. 49. 4.1 .2 Efecto de aditivos qulmicos sobre la composición bromatológica. 50. a. Fibra en detergente neutro y fibra en detergente ácido. 50. b. Hemicelulosa. 53. c. Relación hemicelulosa en fibra detergente neutro. 54. d. Carbohidratos totales. 56. e. Carbohidratos solubles. 57. RECOMENDACIONES. 60 61. REFERENCIAS BIBLIOGRÁFICAS. 62. ANEXOS. 68. CONCLUSIONES.
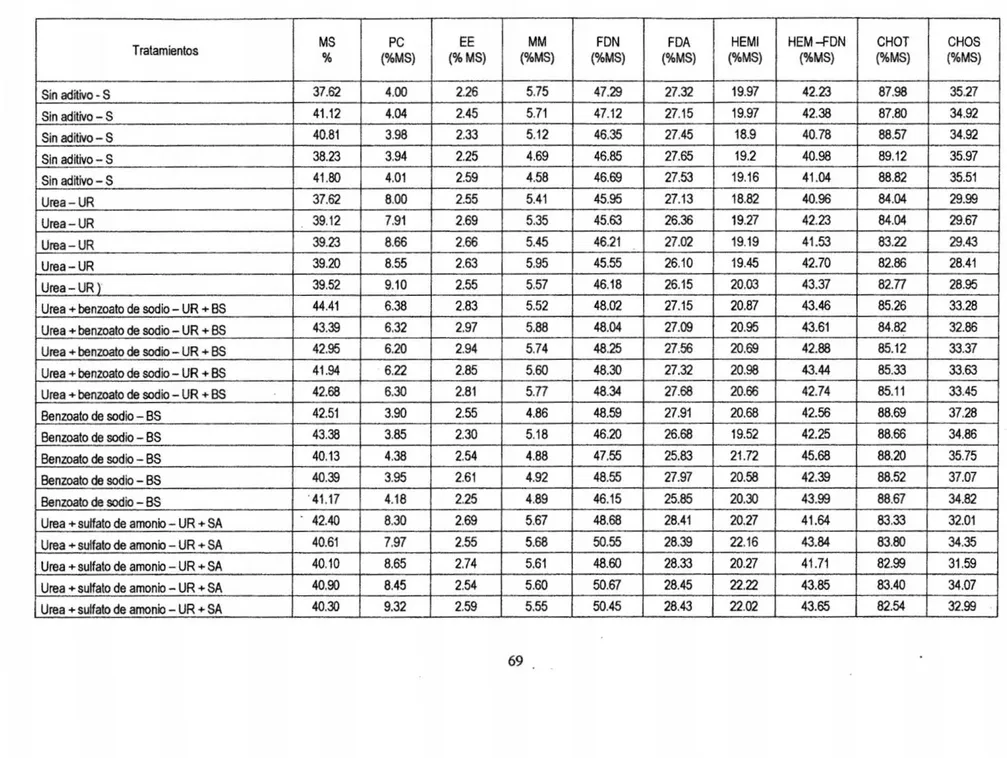
(7) ÍNDICE DE TABLAS Pág. Tabla 1. Prueba del rango estudentizado de Tukey de la composición química bromatológica del ensilado de avena del contenido de materia seca (%):. Sin. aditivo- control; urea (10g/kg)- UR; UR (5glkg) + benzoato de sodio (0,5g/kg)UR + BS; benzoato de sodio {1g/kg) - BS y UR +sulfato de amonio en la proporción 9:1 (10g/kg)- UR +SA... ......... ......... ... ... ............... ... ... ...... ......... 43. Tabla 2. Prueba del rango estudentizado de Tukey de la composición química bromatológica del ensilado de avena del contenido de proteína cruda (%): Sin aditivo- control; urea {10g/kg)- UR; UR (5glkg) + benzoato de sodio (0,5g/kg)UR + BS; benzoato de sodio (1g/kg) - BS y UR +sulfato de amonio en la proporción 9:1 {10g/kg)- UR + SA... ... ... .. .... ... .. . ... ... .. .... ... ... ... .. .... ... .. .... ... ... 45. Tabla 3. Prueba del rango estudentizado de Tukey de la composición química bromatológica del ensilado de avena del contenido de extracto eterio: Sin aditivo -control; urea (10glkg)- UR; UR (5glkg) + benzoato de sodio (0,5g/kg)- UR + BS; benzoato de sodio (1g/kg)- BS y UR +sulfato de amonio en la proporción 9:1 (10g/kg)- UR + SA.. .... ... ... ... ... ... ... ... ... ... ... ... ... ... ... ... ...... ... ... ... ... ... .. . ... ..... 47. Tabla 4. Prueba del rango estudentizado de Tukey de la composición química bromatológica del ensilado de avena del contenido de materia mineral (%): Sin aditivo- control; urea (10glkg)- UR; UR (Sg/kg) + benzoato de sodio (O,Sg/kg)UR + BS; benzoato de sodio {1g/kg) - BS y UR +sulfato de amonio en la proporción 9:1 (10g/kg)- UR +SA......... ........................... ...... ............ ......... 49 Tabla 5. Prueba del rango estudentizado de Tukey de la composición química bromatológica del ensilado de avena de fibra detergente neutra y fibra detergente acida (%): Sin aditivo- control; urea (10g/kg)- UR; UR (Sg/kg) + benzoato de sodio {O,Sg/kg) - UR + BS; benzoato de sodio (1glkg) - BS y UR +sulfato de amonio en la proporción 9:1 (10glkg)- UR + SA ............................................ 50 Tabla 6. Prueba del rango estudentizado de Tukey de la composición química bromatológica del ensilado de avena del contenido de hemicelulosa: Sin aditivo -control; urea (10g/kg)- UR; UR (Sg/kg) + benzoato de sodio {O,Sglkg)- UR +. V.
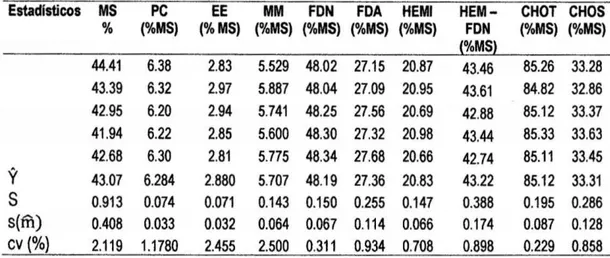
(8) BS; benzoato de sodio (1g/kg}- BS y UR +sulfato de amonio en la proporción 9:1 (10glkg} - UR +SAo.. .. o.. o.. o.. o.. o.. o.. oo.. .. o.. o.. o.. o.. o.. o.. o.. o.. o.. o.. o.. o.. o.. o... .. . .. .... .. 53 Tabla 70 Prueba del rango estudentizado de Tukey de la composición química bromatológica del ensilado de avena del contenido hemicelulosa en fibra detergente neutra:. Sin aditivo - control; urea (10glkg} - UR; UR (5glkg) +. benzoato de sodio (0,5glkg}- UR + BS; benzoato de sodio (1g/kg)- BS y UR + sulfato de amonio en la proporción 9:1 (10g/kg)- UR + SA.. o.. o.. o.. o.. o.. o.. o.. o..... oo 54 Tabla 8. Prueba del rango estudentizado de Tukey de la composición química bromatológica del ensilado de avena del contenido de carbohídratos totales: Sin aditivo- control; urea (10glkg}- UR; UR (5glkg) + benzoato de sodio (0,5glkg)UR + BS; benzoato de sodio (1glkg) - BS y UR +sulfato de amonio en la proporción 9:1 (10glkg)- UR +SA......... ... ..... o........ o......... .. o.. o..... o..... o...... ... . 56 Tabla 90 Prueba del rango estudentizado de Tukey de la composición química bromatológica del ensilado de avena del contenido de carbohidratos solubles: Sin aditivo- control; urea (10g/kg)- UR; UR (5g/kg) + benzoato de sodio (0,5g/kg)UR + BS; benzoato de sodio (1glkg) - BS y UR +sulfato de amonio en la proporción 9:1 (10g/kg)- UR + SA... ... ..... o......... ..................... ...... ... ... ... ...... 57 Tabla 1A. Análisis químico y bromatológico de ensilados de avena tratados con aditivos químicos ......... ... ................. o........... o...... .. ............... o........ o...... ..... 69. Tabla 2A. Tenores de materia seca (MS %), proteína cruda (PC %), extracto etéreo (EE), materia mineral (MM %), fibra en detergente neutro (FDN %), fibra en detergente ácido (FDA %), hemicelulosa (HEM % ) ), relación HEM - FDN (%} , carbohidratos totales (CHOT}% y carbohidratos solubles (CHOS %) del ensilado de avena libre de aditivos (control), y los estadísticos: media (y), desviación estándar (s), error estándar de la media (s(m)) y el coeficiente de variación (cv)... 70 Tabla 3A. Tenores de materia seca (MS), proteína cruda (PC}, grasa % (EE), materia mineral (MM), fibra detergente neutro% (FDN), fibra detergente acido % (FDA}, hemicelulosa (HEMI}, relación HEMI- FDN, carbohidratos totales (CBT) y carbohidratos solubles (CBS) del ensilado de avena + urea y los estadísticos:. vi.
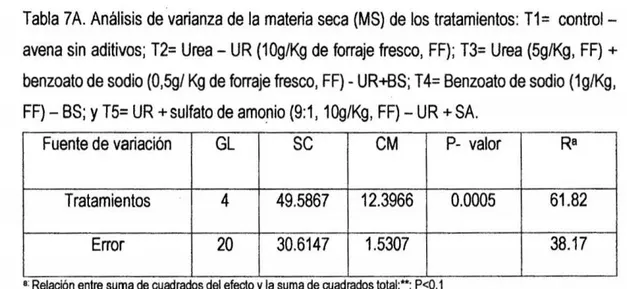
(9) media (y), desviación estándar (s), error estándar de la media (s(m)). y el. coeficiente de variación (cv) .................. ... ... ........·.... ...... ... ... ... ... ... ... ... ... ... ... 70. Tabla 4A. Tenores de materia seca.(MS %), proteína cruda (PC %), extracto etéreo (EE %), materia mineral (MM %), fibra en detergente neutro (FDN %), fibra en detergente ácido. (FDA %), hemicelulosa (HEM) , relación HEM - FDN ,. carbohidratos totales (CHOT) y carbohidratos solubles (CHOS) del ensilado de avena + urea + benzoato de sodio - UR + SB y los estadísticos media (y), desviación estándar (s), error estándar de la media (s(m)) y el coeficiente de vanac1on(cv) ............ ...................................... ..................................... .... 71. Tabla 5A. Tenores de materia seca (MS), proteína cruda (PC), grasa % (EE), materia mineral (MM), fibra detergente neutro % (FDN), fibra detergente acido% (FDA), hemicelulosa (HEMI), relación HEMI- FDN, carbohidratos totales (CBT) y carbohidratos solubles (CBS) del ensilado de avena + benzoato de sodio (BS) y los estadísticos: media (y), desviación estándar (s), error estándar de la media (s(m)) y el coeficiente de variación (cv)... ... ... ... .. . ... ... ... ... ... ... ... ... ... ... ... ... .. .. 71. Tabla 6A. Tenores de materia seca (MS), proteína cruda (PC), grasa % (EE), materia mineral (MM), fibra detergente neutro% (FDN), fibra detergente acido % (FDA), hemicelulosa (HEMI), relación HEMI - FDN, carbohidratos totales (CBT) y carbohidratos solubles (CBS) del ensilado de avena + urea + sulfato de amonio (UR + SA) y los estadísticos: media (y), desviación estándar (s), error estándar de la media (s(m)) y el coeficiente de variación (cv)... ... ...... ...... ...... ... ...... .... .. ... .. 72 Tabla 7A. Análisis de varianza de la materia seca (MS) de los tratamientos: T1 = control- avena sin aditivos; T2= Urea- UR (10g/Kg de forraje fresco, FF); T3= Urea (5g/Kg, FF) + benzoato de sodio (0,5g/ Kg de forraje fresco, FF) - UR;.BS; T4= Benzoato de sodio (1g/Kg, FF)- BS; y T5= UR +sulfato de amonio (9:1, 10g/Kg, FF)- UR + SA... ... ... ... ... ... ... ... ...... ............ ... ... ... ... ... ...... ...... ... ... . Tabla BA. Análisis de varianza de la proteína cruda (PC) de los tratamientos: T1= control- avena sin aditivos; T2= Urea- UR (10g/Kg de forraje fresco, FF); T3= Urea (5g/Kg, FF) + benzoato de sodio (0,5g/ Kg de forraje fresco, FF) - UR;.BS;. vii. 73.
(10) T4= Benzoato de sodio (1g/Kg, FF) - BS; y T5= UR +sulfato de amonio (9:1, 10g/Kg, FF)- UR + SA... .... ........................... ................. ................................. 73. Tabla 9A. Análisis de varianza de la grasa (EE) de los tratamientos: T1 = control avena sin aditivos; T2= Urea- UR (10g/Kg de forraje fresco, FF); T3= Urea (5g/Kg, FF) + benzoato de sodio (0,5g/ Kg de forraje fresco, FF)- UR+BS; T4= Benzoato de sodio (1g/Kg, FF)- BS; y T5= UR +sulfato de amonio (9:1, 10g/Kg, FF)- UR + SA... ... ... ... ...... ... ... ... ...... ... ... ... ... ... ... ... ... ...... ... ...... ... ...... ... ... ... ... ... ... .... 73. Tabla 10A. Análisis de varianza de la materia mineral (MM) de los tratamientos: T1= control- avena sin aditivos; T2= Urea- UR (10g/Kg de forraje fresco, FF); T3= Urea (5g/Kg, FF) + benzoato de sodio (0,5g/ Kg de forraje fresco, FF) UR+BS; T4= Benzoato de sodio (1g/Kg, FF)- BS; y T5= UR +sulfato de amonio (9:1 , 10g/Kg, FF)- UR + SA... ... ... ... ... ... ... ... ...... ... ... ... ... ... ... ... .. . ... ... ... ... ... ... 74. Tabla 11A. Análisis de varianza de la fibra detergente neutro (FDN) de los tratamientos: T1= control- avena sin aditivos; T2= Urea- UR (10g/Kg de forraje fresco, FF); T3= Urea (5g/Kg, FF) + benzoato de sodio (0,5g/ Kg de forraje fresco, FF) - UR+BS; T4= Benzoato de sodio (1g/Kg, FF) - BS; y T5= UR +sulfato de amonio (9:1 , 10g/Kg, FF)- UR +SA.................................... ... ...... ... ... .. ........ 74. Tabla 12A. Análisis de varianza de la fibra detergente ácido FDA de los tratamientos: T1= control- avena sin aditivos; T2= Urea - UR (10g/Kg de forraje fresco, FF}; T3= Urea (5g/Kg, FF} + benzoato de sodio (0,5g/ Kg de forraje fresco, FF} - UR+BS; T4= Benzoato de sodio (1g/Kg, FF} - BS; y T5= UR +sulfato de amonio (9:1, 10g/Kg, FF}- UR + SA................................................ ... .... ,.... 74. Tabla 13A. Análisis de varianza de la hemicelulosa (HEMI) de los tratamiento: T1= control- avena sin aditivos; T2= Urea- UR (10g/Kg de forraje fresco, FF); T3= Urea (5g/Kg, FF) + benzoato de sodio (0,5g/ Kg de forraje fresco, FF)- UR+BS; T4= Benzoato de sodio (1g/Kg, FF)- BS; y T5= UR +sulfato de amonio (9:1 , 10g/Kg, FF}- UR + SA... ... ... ... .. .... ... ... ... ... ... ... ... ... .. .... ... .. .... .. .... ... ... ... ... . Tabla 14A. Análisis de varianza de la relación de fibra detergente neutro hemicelulosa (Relacion FDN-HEMI) de los tratamientos: T1 = control - avena sin. viii. 75.
(11) aditivos; T2= Urea - UR (10g/Kg de forraje fresco, FF); T3= Urea (Sg/Kg, FF} + benzoato de sodio (O,Sg/ Kg de forraje fresco, FF} • UR+BS; T4= Benzoato de sodio (1g/Kg, FF)- BS; y TS= UR +sulfato de amonio (9:1, 10g/Kg, FF)- UR + SA.. .... ... ... .. . ... ...... ... ... ... ... ... ... ... ... ... ... .. .... .. . ... ... ... .. ... . ... ... ... ... ... ... ... ... ... 75. Tabla 15A. Análisis de varianza de los carbohidratos totales (CHOT) de los tratamientos: T1= control- avena sin aditivos; T2= Urea- UR (10g/Kg de forraje fresco, FF}; T3= Urea (Sg/Kg, FF) + benzoato de sodio (O,Sg/ Kg de forraje fresco, FF} · UR+BS; T4= Benzoato de sodio (1g/Kg, FF} - BS; y TS= UR +sulfato de amonio (9:1, 10g/Kg, FF) - UR + SA... ... ... ... ... ... ... ... ... ... ... ... ... ... ... ... ... ... ... .... 75. Tabla 16A. Análisis de varianza de los carbohídratos solubles (CHOS) de los tratamiento: T1= control- avena sin aditivos; T2= Urea- UR (10gr/Kg de forraje fresco, FF); T3= Urea (Sgr/Kg, FF) + benzoato de sodio (O,Sgr/ Kg de forraje fresco, FF) · UR+BS; T4= Benzoato de sodio (1gr/Kg, FF)- BS; y TS= UR +sulfato de amonio(9:1, 10gr/Kg, FF)-UR+SA ..................... ......... .. ... .... ... .. ............. ... 76. Tabla 17A. Resumen del análisis de variancia de la composición química bromatológica de. los ensilados. de avena adicionados. de aditivos. químicos......... ...... ............... ...... .................. ........................ ... ................ 76. Tabla 18A. Prueba del rango estudentizado de Tukey de la composición química bromatológica del ensilado de avena: Sin aditivo- control; urea (10glkg)- UR; UR (5g/kg) + benzoato de sodio (0,5g/kg)- UR + BS; benzoato de sodio (1glkg)BS y UR +sulfato de amonio en la proporción 9:1 (10g/kg)- UR + SA...... .. .... .... 78. ix.
(12) ÍNDICE DE GRÁFICOS Pág.. Gráfico 1. Comparación de medias para contenido de materia seca... ...... ... ... Gráfico 2. Comparación de medias para contenido de proteína cruda............. Gráfico 3. Comparación de medias para contenido de extracto eterio... ... ... ... . Gráfico 4. Comparación de medias para contenido de materia mineral. ........ ... 44 45 48. 49. Gráfico 5. Comparación de medias para contenido de fibra detergente neutra y fibra detergente acida.................. .................. ........................... ......... .. Gráfico 6. Comparación de medias para contenido de hemicelulosa... ... ......... Gráfico 7. Comparación de medias para contenido de hemicelulosa... ... ... ... ... Gráfico 8. Comparación de medias para contenido de carbohidratos totales..... Gráfico 9. Comparación de medias para contenido de carbohidratos solubles.... X. 51 53 55 56 58.
(13) ÍNDICE DE FOTOGRAFÍAS Pég.. Foto 1. Muestras de aditivos utilizados en el experimento............ .............. .............. 79. Foto 2. Pesaje de muestras de aditivos utilizados una balanza de precisión .... ........ .. 79. Foto 3. Confección de micro-silos de tubos de PVC... ............. ............... .. .......... ... 80. Foto 4. Control de peso de confección de prototipos de tubos de PVC ... ..... ............ .. 80. Foto 5. Pesaje de muestra biológica con balanza mecánica de reloj .... .................. .. Foto 6. Adición de aditivos de urea en muestra de avena forrajera picada .................. .. 81 81. Foto 7. Llenado y toconeado del ensilado de avena a las micro-silos de tubo de PVC .. .................... .... ... ..... ...... ......... ............... .......... .................... . 82 Foto 8. Cierre y sellado de micro-silo de tubo de PVC ...... ....... .............. ................ ... 82. Foto 9. Cierre hermético de micro silos para ser llevados a laboratorio de Nutrición animal y evaluación de alimentos-UNH ..... ... ..... ...... ........ ...................... ........... 83 Foto 10. Apertura de micro-silos en Laboratorio.... .................................... ...... ..... ... 83. Foto 11. Distribución de ensilaje en mesas del Laboratorio .. ...... ........... .. .... .............. .. 84. Foto 12. Llenado del ensilado de avena tratado con aditivos en sobres de papel para deshidratar en el homo... ... ..... ..................................... ......................... 84 Foto 13. Ensilado de avena tratado con aditivos en sobre de papel en el horno para ser deshidratado........ ...... .......... ....... ... ... .. .. ................. ... ........ ... 85. Foto 14. Ensilado de avena tratado con aditivos en sobres de papel en el homo para ser · deshidratado ...... ..... ...................... ..... .......... ....... ............ ... ·.. ··............. 8 5 Foto 15. Molido de las muestras deshidratadas en el homo.................... ..... ........... .... 86. Foto 16. Llenado de las muestras molidas de los ensilados de avena tratado con aditivos deshidratadas en el hamo.................. ... .......................... ....... ............... 86 Foto 17. Pesado de las muestras molidas del ensilado de avena tratado con aditivos químicos. ...... .... ... ..... ....... .... ........ .. ..... .. ...... .... ...... .... ....... .................. 87 Foto 18. Apuntes de los pesos de fas muestras molidas de los ensilados tratados con aditivos químicos deshidratados........ .......... ..... ............................ ......... 87. xi.
(14) Foto 19. Pesado de las muestras molidas del ensilado de avena tratado con aditivos químicos........................... ..... ... ..... .... .. ................................ .. ........... 88 Foto 20. Detenninación de la materia mineral de las muestras de los ensilados tratados con aditivos químicos en el horno.. ....... ...... ...... ...... ............ .. .... .............. 88 Foto 21. Cernido de las muestras molidas de los ensilados tratados con aditivos químicos para la realización de sus análisis bromatológicos........... ...... .. .. .. .. .. .. ... ....... ... 89 Foto 22. Cernido de las muestras molidas de los ensilados tratados con aditivos químicos para la realización de sus análisis bromatológicos............................ .... .. .. .. ... 89 Foto 23. Almacenamiento de las muestras cernidas de los ensilados tratados con aditivos químicos para la realización de los análisis bromatológicos ........................ .. 90 Foto 24. Almacenamiento en potes de platico de las muestras cernidas de los ensilados tratados con aditivos químicos para la realización de los análisis 90 bromatológicos.................... ........ ......... ............. .............. ...... ........... ... xii.
(15) RESUMEN El propósito del experimento fue evaluar la eficiencia del uso de aditivos químicos (dosis en base a forraje fresco): sin aditivo- control; urea (10g/kg}- UR; UR (5g/kg) + benzoato de sodio (0,5g/kg) - UR + BS; benzoato de sodio (1g/kg) - BS; UR +sulfato de amonio en la proporción 9:1 (10g/kg)- UR + SA en ensilados de avena. Estos fueron elaborados en la Escuela Profesional de Zootecnia de la Universidad Nacional de Huancavelica, en microsilos experimentales de PVC de 10 x 40 cm de ancho y altura, provistos de tapas herméticas. El diseño experimental fue el completamente al azar, con 5 tratamientos y 5 repeticiones. Los datos fueron sometidos aun análisis de varianza mediante el MLG del SAS (SAS, 2008). Diferencias entre medias fueron comparadas por la prueba de Tukey a 5% de significación. Los silos fueron abiertos a los 120 días después del ensilaje. Ninguno de los aditivos fue eficaz en la reducción de FDN, FDA, hemicelulosa y la relación HEM- FDN de los ensilados. Los tratamientos con UR, UR + BS, UR + SA propiciaron menores valores de carbohidratos solubles, en relación al ensilado libre de aditivos. El ensilado de avena sin aditivos, es una estrategia que puede ser mejorada con aditivos en forma satisfactoria en el contenido de proteína cruda, solo o asociado, excepto con el BS. Palabras claves: urea, benzoato de sodio, sulfato de amonio, ensilado.. xiii.
(16) ABSTRACT The purpose of the experiment was to evaluate the efficiency of the use of chemical additives (dose based on fresh forage): without additive- control, urea (10g/ kg) - UR; UR {Sg/ kg) + Sodium benzoate (O,Sg/ kg) - UR + BS; sodium benzoate (1g/ kg)- BS; UR + ammonium sulphate in the ratio 9: 1 {10g/ kg)- UR + SA in silage oats. These were developed in the Professional School of Animal Science, National University of Huancavelica, in experimental microsilos PVC 10 x 40 cm in width and height, provided with tight lids. The experimental design was completely randomized with 5 treatments and 5 repetitions. Data were subjected to analysis of variance using the GLM of SAS (SAS, 2008). Differences between means were comparad by the Tukey t,est at 5% significance. Silos were opened 120 days after ensiling. None of the additives was effective in reducing NDF, ADF, hemicellulose and relationship HEM- NOF silage. Treatments UR, UR + BS, UR + SA led lower values of soluble carbohydrates, in relation outdoor silage additives. Oat. silage without additives, is a strategy that can be improved with additives satisfactorily in the content of cruda protein, alone or in combination, except for the BS. Keywords: urea, sodium benzoate, ammonium sulfate, silage.. xiv.
(17) INTRODUCCION. La sierra central del Perú, está afectado de forma recurrente por un período de sequía que dificulta la disponibilidad de forrajes para alimentar el ganado; por lo que se debe recurrir a la conservación de forrajes ya sea como ensilado y/o heno de los recursos forrajeros, de tal manera de disponer de alimento en las cantidades necesarias en la época seca, que se toma critica. La utilización de la avena forrajera en la época seca es bastante difundida entre los productores, como heno preferentemente.. El ensilado es un proceso de conservación de forrajes en estado húmedo mediante fermentación que conduce a la acidificación, en unos reservorios especiales denominados silos, al abrigo del aire, la luz y la humedad exterior (Argamenteria, et a/, 1997; Cañete y Sancha, 1998). El ensilado representa uno de los recursos forrajeros; sin embargo, el proceso de producción y sumil'}istro de ensilados de avena a los animales incluye pérdidas considerables y muchas veces puede inviabilizaresta opción. De acuerdo a Schmidt (2004), citado por Siqueira et al. (2010), la principal orientación de los estudios con ensilajes es la búsqueda de aditivos que, asociados al ensilaje, además de incrementar los contenidos de compuestos nitrogenados, inhiben la fermentación alcohólica, con la intención de evitar las pérdidas. Entre ellos, destacan la urea Siqueira et al. (2010), benzoato de sodio Pedroso et al. (2011 ). La urea es frecuentemente mezclada con el sulfato de amonio (9:1) para alcanzar el equilibrio adecuado de nitrógeno-azufre en dietas para animales (Ferreiro. et. a/.1977).. Algunos experimentos fueron realizados a fin de evaluar la combinación de aditivos en el ensilaje de caña de azúcar (Pedroso. et a/., 2007; Siqueira et a/., 2010). La eventual. ocurrencia de un efecto sinérgico crea la posibilidad del uso de aditivos en niveles más bajos, permitiendo la posible reducción de costos de aplicación.. 1.
(18) Las consideraciones anteriores, conducen a la búsqueda y adición de las estrategias y tecnologías actuales de conservación de forrajes, en especial aquellas que tengan efectos directos sobre el proceso del ensilado, de manera que permitan mejorar la calidad del producto que se está conservando.. 2.
(19) CAPÍTULO 1 PROBLEMA 1.1. Planteamiento del problema En la Sierra del Perú, se presentan características climáticas de crecimiento estacional de plantas forrajeras, alto costo de la tierra y explotación pecuaria poco desarrollada. Ante esta realidad los procesos de conservación de forrajes cumplen importante papel para reducir el problema de escasez de alimento permitiendo así, una producción de leche y carne equilibrada durante el año. Entre las gramíneas anuales, la avena tradicionalmente utilizada para corte, ha sido destacada como forrajera para ensilaje por su fácil manejo. Entretanto, en el momento ideal para el corte (120 días, con un tamaño promedio de 150 cm), la avena y las gramíneas . en general presentan altos valores de humedad, bajas concentraciones de carbohidratos solubles y elevado poder tampón, características que influencian negativamente en el proceso de fermentación, impidiendo el rápido decrecimiento del pH y permitiendo la ocurrencia de fermentaciones secundarias indeseables, lo que pe~udica la cualidad del producto preservado (Me Oonald, 1981). Las fermentaciones indeseables dan lugar a la mayor producción de ácidos acético y butírico, de nitrógeno amoniacal, amidas y aminas (Ferrari Junior et a/., 2009). Siendo así, la composición química bromatológica y el valor nutritivo de los ensilados pueden ser modificados por la adición de aditivos en el momento del ensilaje, los cuales pueden ser ácidos, sales, carbohidratos fermentados, microbiológicos o subproductos microbianos con alguna actividad enzimática (amilasa, celulosa, hemicelulosa). 3.
(20) Ante estas consideraciones se presenta la interrogante, en el Perú, particularmente en la sierra ¿habrá efecto de aditivos sobre la composición química bromatológica de la avena (avena sativa /.)ensilada?. 1.2. Formulación del problema: Ante la pregunta anterior, se tiene el interés de responder la interrogante del problema de investigación: ¿Cuál es el efecto de aditivos químicos (urea, benzoato de sodio y sulfato de amonio) sobre la composición química bromatológica de la avena (Avena saliva L.) ensilada?. 1.3. Objetivos: 1.3.1. General: Determinar el efecto de aditivos químicos (urea, benzoato de sodio y sulfato de amonio) sobre la composición química bromatológica de la avena (Avena. saliva L.) ensilada. 1.3.2. Específicos: •. Determinar el efecto de los aditivos químicos (urea, benzoato de sodio y sulfato de amonio) sobre la composición química de la avena ensilada de materia seca (MS}, proteína cruda (PC}, extracto etéreo (EE} y materia mineral (MM}.. •. Determinar el efecto de los aditivos químicos (urea, benzoato de sodio y sulfato de amonio) sobre la composición bromatológíca de la avena ensilada de fibra detergente neutro (FDN), fibra detergente ácido (FDA), hemicelulosa (HEM), la relación HEM - FDN, carbohidratos totales (CHOT) y carbohidratos solubles (CHOS).. 4.
(21) 1.4. Justificación En el Perú, especialmente en la ecoregión andina entre las especies forrajeras la avena ha destacado por ser la más utilizada en diversas investigaciones, principalmente por presentar elevada producción y rendimiento. Al ser abundante la avena los productores por el desconocimiento de conservación de forrajes tienen perdidas de este recurso forrajero. La adición de aditivos químicos de aditivos químicos (urea, benzoato de sodio y sulfato de amonio) en la elaboración de ensilados de avena tiene con como objetivo mejorar de la calidad del forraje ensilado el cual con los resultados obtenidos se espera aportar información para mejorar la alimentación y nutrición adecuada de las diferentes especies animales que cohabitan en los andes peruanos en épocas de sequía, ya que su elaboración no es costosa y es de fácil manejo. El presente trabajo de investigación beneficiara a los productores alto andinos de la sierra del peru ya que los productores siembran diferentes especies de pastos forrajeros para la alimentación de sus animales, siendo la elaboración de ensilado con la adición de aditivos químicos una técnica de conservación de forrajes muy sencilla para épocas de sequía por la abundancia de producción obtenida al ser cosechada los forrajes, garantizando de esta manera la demanda de los nutrientes para la alimentación de los animales. La utilización de forrajeras anuales con la adición de aditivos químicos en la producción de ensilado es un recurso que puede ser utilizado como alternativa de manejo, para el aprovechamiento del forraje producido en periodos de mayor crecimiento por el efecto de las lluvias, garantizando de esta manera la demanda de nutrientes de los animales en el periodo critico del año. Los forrajes se conservan con un mínimo de pérdidas de materia seca y de nutrientes, manteniendo una buena palatabilidad por el ganado (Vieira da Cunha, 2009).. 5.
(22) Con la presente investigación aportamos información sobre el contenido químico bromatológico de la avena ensilada con la adición de aditivos químicos haciendo uso de una avena madura de 180 días y con los resultados obtenidos recomendar si recomendar si el uso de aditivos químicos hace efecto sobre la avena madura ensilada en la composición química bromatológico. En ese contexto, diversos autores han buscado alternativas para aumentar la concentración de carbohidratos solubles en la masa ensilada de gramíneas y mejorar su valor nutritivo, como la técnica de marchitamiento de la forrajera (Carvalho et al. 2007).. 6.
(23) CAPÍTULO 11 ·MARCO TEÓRICO 2.1. Antecedentes Mena et al. (2014) en el trabajo de investigación titulado influencia de diferentes niveles de urea (0,25; 0,50 y 0,75%) sobre la calidad bromatológica del ensilado del pasto elefante (Pennisetum purpureum S.) con el objetivo de evaluar la influencia de diferentes niveles de urea (0,25; 0,50 y 0,75%) sobre la calidad bromatológica del ensilado del pasto elefante (Pennisetum purpureum S.) no observaron efectos significativos de las dosis aplicadas de urea sobre el contenido de MS, cuyo valor promedio fue de 19,02%. En cuanto al contenido de PB, existió efectos significativos en las dosis de 0,50 y 0,75%; cuyos valores fueron de 7,20 y 7,40%, respectivamente, en relación al ensilado libre de urea (6,40%). Se concluye que no influyen las dosis de urea aplicada sobre los tenores de materia seca (MS) y fibra detergente neutra (FDN) de la masa de forraje ensilada, pero si influyen sobre el tenor de proteína cruda y pH aumentándolos linealmente conforme al incremento de la dosis utilizada. Cordero et al. (2013), en el trabajo de investigación titulado efecto de aditivos en el ensilaje de avena, con el objetivo de estudiar el ensilado de avena sin y con la adición de aditivos químicos y fermentativos en el momento del ensilaje sobre la composición química y pH, al utilizar 1) avena libre de aditivos (A), 2) A+ 1% de urea, 3) A -r 1% de óxido de calcio, 4) A+ 10% de maíz amarillo duro triturado, 5) A+ 10% de salvado de trigo y 6) A + 1% de sulfato de calcio encontraron que la adición de 10% de salvado de trigo se mostró más eficiente de aumentar la materia seca en relación a los demás tratamientos.. 7.
(24) La incorporación de calcio en la forma de óxido o sulfato promovió respectivamente, la disminución de los contenidos de materia orgánica en comparación al ensilado libre de aditivos (85,38; 87,24 vs 89,51%), consecuentemente los valores de materia mineral fueron más elevados.. Los mayores valores de proteína cruda fueron observados en los ensilados adicionados de 1% de urea y de 10% de salvado de trigo, mostrando respectivamente, una superioridad de 2,5 y 1,1 puntos porcentuales (11,14; 10,01 %) en relación al ensilado libre de aditivos (8,66 %). los ensilados adicionados de urea, calcio en la forma de óxido o sulfato y de malz amarillo duro triturado en relación al tratamiento libre de aditivo promovieron decrecimiento en los valores de carbohidratos totales (74,88; 73,92; 75,59; 75,59 vs 77,85 %). El uso de maíz amarillo duro triturado mejora el proceso fermentativo, además de promover mejoras en la cualidad de la materia seca, proteína cruda y extracto etéreo del ensilado de avena.. Llegando a la conclusión que el aditivo urea proporcionó un padrón fermentativo diferente a lo observado en los ensilados convencionales. Sin embargo, la amonificación para el nivel utilizado permitió incremento en el contenido de PC mayor . que el ensilado adicionado de maíz amarillo duro triturado. Cordero et al. (2013),. en el trabajo de investigación titulado efecto del. premarchitamiento y de la adición de urea (0,1 y 1,5%, en base fresca) sobre la composición bromatológica del ensilado de avena con el objetivo de evaluar el efecto del premarchitamiento y de la adición de urea (0,1 y 1,5%, en base fresca) sobre la composición bromatológica del ensilado de avena observaron que la PC de los ensilados a partir de forraje sin marchitar aumentó con dosis crecientes de urea y se redujo el contenido en FDN; los valores variaron de 8,95 a 17,74% de PB, y de 49,23. a 44,44% de FDN.. 8.
(25) La disminución de la FDN y hemicelulosa ocurrió para el ensilado marchitado con el 1% de urea. Los valores de la proporción FDN - HEM en la pared celular en todos los ensilados fueron semejantes, a excepción de los ensilados con forraje marchitado que mostraron tendencia de aumento al ser tratado con 1,5% de urea. No se verificó consistencia cuanto a los valores de pH en el ensilado sin marchitar con niveles crecientes de urea. Los autores del estudio recomiendan la adición de 1,5% de urea a la avena sin marchitar al momento del ensilaje, y 1% de urea en la avena marchitada por promover reducción significativa en los contenidos de FDN, FDA y hemicelulosa. Llegando a la conclusión, el estado de la avena (marchitada o sin marchitar) al momento del ensilaje no influenciaron en las variables analizadas, a excepción de la PB y del pH. Los constituyentes de la pared celular vegetal del ensilado sin marchitar fueron alterados por el uso de la urea, vía amonificación con la reducción lineal de FND, principalmente. Arredondo (2011) en el trabajo de tesis titulado evalúación del efecto de tres diferentes aditivos sobre parámetros de valor nutrícíonal del ensilaje de caña de azúcar (saccharum officinarum) en condiciones tropicales cuyo objetivo fue evaluar el efecto de tres diferentes aditivos sobre parámetros de valor nutricional del ensilaje de caña de azúcar (Saccharum officinarum) en condiciones tropicales (dosis en base a forraje fresco): 2kg de caña ensilada; 2kg de caña+ 50g de urea; 2kg caña+ 50g de sulfato de amonio; 2kg de caña + 30g de cloruro de sodio; 2kg de caña + 50g de urea + 30g de cloruro de sodio; 2kg de caña + 50g de sulfato de amonio + 30g de cloruro de sodio. El uso de la urea como aditivo, incrementó en 28,49% el contenido final de PC en comparación al testigo (33,53% vs 5,04%), disminuyó el valor de FDN (59,8% vs 56,55%) y FDA (35,69% vs 34,19%) en relación al testigo. El contenido de MS del tratamiento control se mostró semejante (P > 0,05) al ensilado adicionado de urea (22,57% vs 22,55%). La adición de sulfato de amonio aumentó el contenido final de PC, FDN y FDA, en comparación al ensilado libre de aditivos (17,5; 61 ,72; 36,92% vs 5,04; 59,8; 35,69%),. 9.
(26) mientras el contenido de MS del tratamiento control se mostró semejante (P > 0,05) del ensilado de caña de azúcar adicionado de urea (22,02% vs 22,55%). Los resultados obtenidos con la adición de cloruro de sodio muestran que este aditivo no tuvo efectos positivos en los valores de PC y MS en comparación al ensilado libre de aditivos (5,75; 20,98% vs 5,04; 22,55%). Concluyendo que se mejoró el valor nutricional del ensilaje con los aditivos urea y sulfato de amonio, debido al incremento en la concentración de PC y manteniendo los niveles de FAD y FND dentro de lo aceptable. El cloruro de sodio no presenta un efecto positivo en el valor nutricional del ensilaje. Además, en todos los tratamientos se obtuvo un ensilaje de buenas características organolépticas. Asimismo, se obtuvo consumo por parte de los animales en todos los tratamientos. Pedroso et al. (2011) en el trabajo de investigación titulado Características y estabilidad aeróbica de ensilajes de caña de azúcar, tratada con urea, NaOH y maíz. Cuyo objetivo fue determinar el efecto de diferentes aditivos en la estabilidad aeróbica de la caña de azúcar, conservada como ensilaje en silos de laboratorio. Se determinó la materia seca (MS), el extracto etéreo (EE), la materia mineral (MM), la proteína bruta (PB), el pH y la estabilidad aeróbica del ensilaje tratado con urea, NaOH y maíz molido. Se utilizó un diseño ·completamente aleatorizado, con cuatro repeticiones, para evaluar los siguientes tratamientos: caña de azúcar sin aditivos, caña de azúcar + 4 % de maíz molido, caña de azúcar + 1 % de urea, caña de azúcar + 1 % de urea + 4 % de maíz molido, caí'\a de azúcar+ 1 %de NaOH, y cana de azúcar+ 1 %de NaOH + 4 %de maíz molido. Los ensilajes tratados con urea tuvieron un mayor porcentaje de EE. En presencia de urea y NaOH, la adición de maíz molido aumentó significativamente la PB. El NaOH incrementó el porcentaje de MM. Las pérdidas de MS causadas por gases fueron significativamente mayores en los ensilajes que no recibieron aditivos químicos. Hubo diferencias significativas en la producción de C02 en diferentes tiempos de exposición al aire. Llegando a la conclusión que los aditivos mejoraron las características químicas, excepto el contenido de MS, y redujeron la pérdida por gases en la fermentación. 10.
(27) anaeróbica. En conclusión, los aditivos utilizados mejoraron las características químicas de los ensilajes y redujeron las pérdidas de MS causadas por gases en la fermentación anaeróbica, aunque el tratamiento con urea al1 %aumentó la producción de C02 después de abrir el silo. Lara y Lara (1997) al evaluar diferentes niveles de melaza (0, 1, 2, 4 y 6%) y urea (O;. 0,25; 0,50; 0,75; 1, 2 y 3%) en el ensilaje de caña de azúcar (Saccharum officinarum L.), observaron que la inclusión de urea en el ensilado de caña de azúcar propició el aumento del pH final del ensilado, mientras que la melaza tuvo un efecto acidificante. La adición de urea favoreció la fermentación láctica y butírica, hasta un punto crítico, a partir del cual las fermentaciones disminuyeron drásticamente. La melaza redujo la cantidad de ácido láctico y butírico. El contenido de ácido acético en el ensilado de caña de azúcar disminuyo gradualmente a medida que se incrementó el nivel de urea en el silo, tendiendo a valores asintóticos a nivel superiores al 3 % de urea; no habiéndose encontrado efecto de la melaza. La inclusión de urea evito la fermentación alcohólica en el ensilado de caña de azúcar mientras que la melaza tendió a favorecerla. El contenido de nitrógeno aumento linealmente en todos los ensilados a medida que se incrementó el nivel de urea, no habiéndose encontrado efecto de la melaza. En el presente estudio debido a la adición de urea en cantidades crecientes, se obtuvo una respuesta lineal en el contenido de nitrógeno amoniacal {N-NHJ) del ensilado. La inclusión de urea y melaza a la caña de azúcar en el momento del ensilaje, produjo un aumento del contenido de materia seca del ensilado. La composición de la pared celular, contenido celular, proteína de la pared, ceniza total y ceniza de la pared en el ensilado no se afectaron por las adiciones de urea y melaza. El nivel óptimo de urea que permitió la mayor disponibilidad de nitrógeno para el consumo de animales, fue de 1%. La melaza favoreció las pérdidas de nitrógeno. La disponibilidad de azucares totales invertidos disminuyo cuando se agregó más del1% de urea y melaza. De acuerdo a los parámetros estudiados, la adición de 1% de urea. 11.
(28) al ensilado de caña de azúcar aseguró a la obtención de un buen ensilado, siendo la melaza un aditivo del cual se puede prescindir.. 2.2. Bases te6ricas La utilización de aditivos en el proceso de ensilaje tiene por objetivos alterar positivamente características fermentativas y/o bromatológicas del producto final (Schnmidt et al., 2010; Ferrari et al.,2009) favoreciendo la conservación y mejoramiento del valor nutritivo. Así, como la disminución de pérdidas superficiales, aumento de la vida útil, aumento del valor energético, mejora de la digestibilidad de la ñbra y de la materia seca y mejoramiento del rendimiento animal. El ingrediente usado como aditivos en los ensilajes de gramíneas debe presentar alta concentración de materia seca, alta capacidad de retención de agua, buena palatabilidad, además de suministrar carbohidratos para fermentación. Como también ser de fácil manipulación, bajo costo y fácil adquisición (Bergamaschine et al.,2006). Por otro lado, aditivos químicos como urea, benzoato de sodio y sulfato de amonio pueden ser utilizados como agentes hidrolíticos (Carvalho et al., 2006; Baliero Neto et. al., 2007).. 2.2.1 Aditivos El empleo de aditivos en el proceso de ensilados persigue mejorar la conservación. y el valor nutritivo del alimento Argamentería et al. (1997). En ocasiones se puede obtener un ensilado de satisfactoria calidad fermentativa sin usar aditivos, especialmente si los forrajes han sido pre marchitados por un corto período, picados adecuadamente, bien compactados y sellados. Sin embargo, al usar un aditivo se obtiene, en ocasiones, una serie de beneficios siempre y cuando se apliquen a forraje tierno, pues su acción es casi nula o nula en forraje de alto contenido en materia seca o sobre maduro.. 12.
(29) En general, los aditivos para ensilajes controlan y/o mejoran la fermentación en el silo, reducen las pérdidas y mejoran la calidad nutritiva de los ensilajes para uso animal. A pesar de ello, los aditivos aun siendo muy eficientes no solucionan fallas del ensilaje como corte tardío o un pobre sellado (Castle, 1982). Tipos de aditivos. Existen varias clasificaciones de aditivos, según Argamentería et al. (1997), los aditivos pueden ser químicos o biológicos y se pueden clasificar en: 1. Nutrientes o activadores: Amonio, urea, carbonato cálcico, sulfato de amonio. Urea. Los aditivos de nitrógeno no proteico, especialmente la urea agregada a forrajes con alto contenido de MS y bajo poder tampón (granos de maíz o sorgo) aumentan el contenido de proteína bruta y pueden mejorar la estabilidad aeróbica del ensilado al momento de la apertura del silo (Argamentería et al., 1997). La urea CO(NH2)2está autorizada en rumiantes y es la fuente de NNP más . utilizada en condiciones prácticas. El exceso (más de 200 g/d en vacas de 500 kg ó más del1% de la MS ingerida 6 más del25% del Ntotal de la dieta) puede provocar toxicidad. Además, niveles altos de urea reducen la palatabilidad de la ración (Argamentería et al., 1997).. •. Usos Fertilizante: El 91 % de la urea producida se emplea como fertilizante.. Se aplica al suelo y provee nitrógeno a la planta. Se disuelve en agua y se aplica a las hojas de las plantas, sobre todo frutales, cítricos. •. Industria química y de los plásticos: Se encuentra presente en. adhesivos, plásticos, resinas, tintas, productos farmacéuticos y acabados para productos textiles, papel, metales y tabaco.. 13.
(30) •. Suplemento alimenticio para el ganado: Se mezcla en el alimento del ganado y aporta nitrógeno, que es vital en la formación de las proteínas.. •. Producción de drogas: Se usa como adulterante para la fabricación de drogas como la metanfetamina.. Sulfato de amonio El sulfato de amonio (NH4)2S04 es una sal de color gris claro. Se utiliza como floculante y, además, como un reactivo en purificación de proteínas para precipitar proteínas solubles. El Sulfato de Amonio es excelente componente para la llamada precipitación fraccionada, porque, entre otras cosas, hace que el agua compita entre la disolución de esta sal o de la proteína (formada por muchos grupos carboxilo y amonio (Bedford y Clarke, 1972).. 2. Conservantes: Acido fórmico, acético, láctico, propiónico, benzoato de sodio, benzoico, capróico. Inhiben las fermentaciones indeseables actuando de diversas maneras, unos comunican a la masa del forraje una acidez inicial que favorece la actividad de las bacterias lácticas. ·. Benzoato de sodio El benzoato de sodio CsHsCOONa, también conocido como benzoato de sosa, es una sal del ácido benzoico, blanca, cristalina y gelatinosa o granulada. Es soluble en agua y ligeramente soluble en alcohol. La sal es antiséptica y se usa generalmente para conservar los alimentos (Bedford y Clarke, 1972). Como aditivo alimentario es usado como conservante, dando muerte eficientemente a la mayoría de levaduras, bacterias y hongos. El benzoato sódico sólo es efectivo en condiciones ácidas (pH<3,6), lo que hace que su uso más frecuente sea en conservas, en aliño de ensaladas (vinagre), en. 14.
(31) bebidas carbonatadas (ácido carbónico), en mermeladas (ácido cítrico), en zumo de frutas (ácido cítrico) y en salsas de comida china (soja, mostaza y pato) (Bedford y Clarke, 1972). 3. lnoculantes: Bacterias del ácido láctico: Lactobacíllus, pediococcus,. streptococcus, tienen como papel principal elevar rápidamente el nivel de acidez del forraje a ensilar. 4. Enzimas: Ami lasas, celulasas, hemicelulasas, pectinasas. Se encargan de la ruptura de las paredes celulares, aumentan el contenido de azúcares solubles, fermentados por bacterias lácticas, produciéndose la disminución del pH. 5. Sustratos: Melazas, glucosa, sacarosa, granos de cereales, pulpa de remolacha, pulpa de cítricos. 2.2.2 Composición quimica. En el ámbito de la química, se conoce como composición química a aquellas sustancias que se encuentran presentes en una determinada muestra y en las cantidades en las cuales se encuentran dispuestas (Bedford y Clarke, 1972). 2.2.3 Composición bromatológica. La Bromatología es la ciencia que se ocupa del estudio de los alimentos, cuál es la preparación más adecuada para darle a los mismos, cómo conservarlos y distribuirlos, es decir, esta disciplina permite conocer la composición cualitativa y cuantitativa de aquellos alimentos que comemos, orienta sobre la higiene que habría que darles y que presentan los mismos y nos indica además las alteraciones y contaminantes que podrían llegar a ostentar; al respecto nos dirá no solamente cómo y porque ocurrieron sino también cómo prevenirlas (Bedford y Clarke, 1972).. 15.
(32) 2.2.4 Avena forrajera La avena forrajera es una gramínea de comportamiento anual. Es importante entre las pasturas cultivadas para la sierra, por ser un cultivo de adaptabilidad a distintas condiciones ambientales, altitudes y de manejo; siendo su uso en forraje verde, heno y en ensilaje para la alimentación del ganado en la época seca. En promedio alcanza una altura de 1,53 my se adapta a pisos altitudinales desde 2500 a 4000 msnm (Filya, 2003, citado por Ruiz et al., 2009). Los cereales de grano pequeño como la avena y cebada constituyen una alternativa de forraje conservado debido a su gran rendimiento de MS y de energía por unidad de superficie (Ruiz et al., 2009). Para obtener ensilados de buena calidad, las especies forrajeras, se deben cortar después de fa aparición de las espigas, pero antes de la floración. En particular, la avena puede cortarse desde la prefloración hasta que el grano esté lechoso o pastoso.. 2.2.5 El ensilaje Es un método de conservación de forrajes en el que se inhibe el crecimiento de microorganismos degradadores de la materia orgánica, preservados con ácidos, sean estos agregados o producidos en un proceso de fermentación natural en un depósito de dimensiones y forma variable denominado silo, en el que se dispone en capas uniformes eliminando el aire mediante compresión y cubriéndolo finalmente (Cañete y Sancha, 1998).. 2.2.6 Características del ensilaje a). Color: Debe aproximarse al verde o verde que ha sufrido una decoloración algo amarilla, pero no café, café oscuro o negruzco, porque estos últimos indican exceso de calentamiento y fermentación aeróbica. A veces por mucha agua puede verse verde, pero descubre su mala calidad en el olor. El color castaño amarillento indica una fermentación típicamente táctica, de olor no muy fuerte ni desagradable (Cañete y Sancha, 1998). El color verde oliva, indica que el proceso se ha. 16.
(33) desarrollado a temperaturas muy bajas, presumiblemente · ha ocurrido fermentación butírica de malas características organolépticas y grandes pérdidas de principios nutritivos, siendo peligroso para el ganado que lo consume. El color castaño atabacado es típico de fermentaciones a altas temperaturas, con predominio de la fermentación acética (Cañete y Sancha, 1998). b) Olor: No debe ser demasiado penetrante. En exceso de ácido butírico, el olor. desagradable limita el consumo y pueden incorporarse a la leche. El olor a proteína en putrefacción o amónico ocurre con ensilajes con mucha agua y valores altos en proteína. Esto indica también grandes pérdidas en el valor nutritivo y puede deberse a una mala compresión de la masa ensilada. Ensilajes con predominio de fermentación acética deben usarse con precaución para evitar que transmita un olor desagradable a la leche (Cañete y Sancha, 1998).. e) Acidez: Los buenos ensilados generalmente poseen un pH menor de 4,5. El ácido láctico es deseable y es característico de buenos ensilajes en porcentajes de 2,5 a 8 %. El ácido butírico es indeseable y no debe aparecer en más del 0,5%, los ensilados de calidad deficiente, tienen un pH de 5,2 a más, por lo que es necesario provocar lo más rápido la fermentación láctica en el ensilado, para alcanzar. una concentración de ácido láctico que corresponde al pH óptimo (Cañete y Sancha, 1998}. d) Humedad: El buen ensilaje se caracteriza por un contenido de 60 a 75% de agua.. Las bacterias capaces de producir ácido láctico son siempre suficientes en material verde, no es necesario hacer ninguna inoculación. Así mismo, los clostridios necesitan un alto contenido de humedad para desarrollarse, por ello es conveniente dejar marchitar el cultivo a ensilar hasta que tenga 30 a 50 % de materia seca (Gallardo, 2003). e) Textura: La presencia de tallos gruesos, material leñoso, inflorescencias que. indiquen madurez excesiva del material ensilado se pueden descubrir al tacto. Un. 17.
(34) ensilado bueno, debe presentarse casi como pasto puesto en el silo, conservar intacta las hojas y tallos de las plantas originales. Cuando el forraje sale del silo untuoso viscoso sucio y enmohecido, indica que ha sufrido una fermentación pútrida amoniacal y carece de valor como alimento. Si el ensilado se presenta como una papilla y desecho, no puede ser usado en la alimentación (Gallardo. 2003).. 2.2. 7 Procesos químicos-biológicos de ensilado El forraje que se ensila experimenta una serie de transformaciones como consecuencia de la acción de las enzimas de la planta y de los microorganismos presentes en la superficie foliar, lo que puedan incorporarse voluntariamente (aditivos) o accidentalmente (contaminación con suelo o similar). Las enzimas actúan sobre procesos respiratorios y sobre la descomposición de glúcidos y proteínas (Cañete y Sancha, 1998).. a) Respiración celular Al principio el forraje en el silo continúa respirando, absorbiendo oxígeno y liberando anhídrido carbónico, con desprendimiento de calor. Esta respiración ocasiona una pérdida de materia seca muy digestible y sobre todo reduce el contenido de azúcares de la planta,. pe~udicando. la actuación. posterior de la flora fáctica que no podría encontrar suficiente cantidad de hidratos de ·Carbono para garantizar una suficiente acumulación de ácido láctico. Por ello, es conveniente llenar y cerrar lo más rápidamente el silo. El aire aprisionado en el interior de un silo es desprovisto de oxígeno en menos de 12 horas, produciéndose un ligero aumento de la temperatura de la masa ensilada de 3 a 5 °C. (Cañete y Sancha, 1998).. b) Acción de los microorganismos Hay gran diversidad de microorganismos que se desarrollan más o menos intensamente en función de las circunstancias predominantes en el ensilaje.. 18.
(35) Algunos de estos microrganismos son beneficiosos, al acidificar la masa del forraje (disminuye el pH) y desarrollarse en ausencia de aire (anaerobiosis). Otros son pe~udiciales, creciendo y multiplicándose en presencia de aire con lo que compiten con la microbiología láctica por los azúcares y otros, más propios de condiciones anaerobias, pueden destruir parte de la proteína, incluso ácidos aromados previamente, originando olor desagradable (Argamentería et al. , 1997). En una primera fase se registra el desarrollo de bacterias aerobias (Klebsiella. y Acetobacter) que son, por tanto, más activas cuanto mayor sea la cantidad de aire aprisionado en el forraje. Estas bacterias emplean como sustrato o alimento, los hidratos de carbono que pueden transformarse en anhídrido carbónico o ácido acético, ácido cuya eficacia conservadora no es muy notable debido a su escasa capacidad acidificante. Tras un período de tiempo que varía entre las 24 y 48 horas aparecen bacterias (Leuconostoc y Strectococus) que transforman los azúcares en ácido láctico que ayuda a bajar el pH más rápidamente. A medida que las concentraciones de este ácido son más abundantes, estas bacterias van disminuyendo al t_iempo que aparecen otras (Lactobacilus y Pediococus) que forman ácido láctico en grandes cantidades; esto sucede entre el 3er y Sto día. Desde este momento hasta el día 17 y 21 de la conservación, el ácido se va acumulando en cantidades crecientes al tiempo que el forraje se hace cada vez más inhabitable para otras bacterias. De modo que si durante este período se ha producido suficiente cantidad de ácidos como para llevar el pH a valores de 4,2 o inferiores, existe la garantía de que el forraje se conservará perfectamente por un período indefinido de tiempo, con un valor nutritivo semejante al que poseía al ser puesto en el silo. Por el contrario, si el forraje era pobre en azúcares (leguminosas, plantas jóvenes) o por el contrario se ha empobrecido antes de ensilarfo (respiración. 19.
(36) celular, fertilización nitrogenada, etc.) o simplemente las bacterias aerobias de la primera fase los han agotado, entonces las bacterias lácticas, formadoras del ácido láctico conservador, no tendrán suficiente cantidad de azúcares a su disposición como para conseguir bajar el pH a 4,2 y ello permitirá el desarrollo de otros microbios que van a destruir el forraje poco a. poco. En este caso, en primer lugar actúan unas bacterias (Ciostrídíum sacarolíticos) que atacan a los hidratos de carbono formando ácido butírico. de olor desagradable y escaso poder acidificante, dificultando as) la actividad de las bacterias lácticas y por si fuera poco, también destruyen el ácido láctico ya formado, con lo que la acidez de la masa disminuye y permite la proliferación de otros grupos bacterianos (Ciostrídíum proteolítícos) que van acontinuar el proceso de putrefacción que afecta a las proteínas, originando amoníaco como producto final, el cual termina por neutralizar la acidez residual. La masa, ya de por sí sin mucho valor alimenticio y posiblemente con sustancias de carácter tóxico, queda reducida a un producto podrido que ha perdido su aspecto original, con un desagradable y característico olor. A todo ello debe sumarse el efecto destructor de los hongos que se reproducen intensamente, en especial donde por defecto de compresión han quedado bolsas de aire, completando la destrucción del producto que queda prácticamente inservible (Argamentería et al. , 1997). Al tiempo, que actúan las enzimas de la planta, se produce un desarrollo de los microorganismos presentes en la superficie del forraje en el momento de recolección. Finalmente es necesario considerar las fermentaciones debidas a mohos y levaduras, que tienen lugar por la presencia de oxígeno en el interior del ensilado bien sea por la falta de hermetismo del silo, o porque hayan quedado bolsas de aire a causa de una deficiente compactación o por la apertura descuiqada del mismo (Cañete y Sancha, 1998).. 20.
(37) 2.2.8 Proceso de ensilaje Los cambios en el forraje verde se inician a partir del momento que se corta (fase enzimática), continuará en el silo en dos etapas, primero durante la fase aeróbica. y finalmente, con la fase anaeróbica. a) Fase enzimática Desde el momento que el forraje es cortado comienzan a actuar enzimas propias del vegetal, hidrolizando parte de las proteínas verdaderas, del almidón, de los CHOS y de la hemicelulosa, causando pérdidas de distintos órdenes y generando azúcares que serán usados durante la fermentación láctica {Muck, 1988). Generalmente, la reducción de la hemicelulosa es baja, mientras que las proteínas pueden sufrir cambios muy importantes por la acción de las enzimas proteolíticas. Estas enzimas pueden convertir parte de las proteínas verdaderas de la planta verde en nitrógeno proteico-péptido y aminoácidos libres y nitrógeno no proteico (NNP). En cambio, por la actividad de los microorganismos estas sustancias proteicas son reducidas a amonio y aminas {Muck, 1988). Todas estas alteraciones se magnifican en cultivos forrajeros como la alfalfa o las gramíneas, especialmente en otoño-invierno, donde cerca del 85% del total de nitrógeno puede estar como NNP (Muck, 1988). Además, estas enzimas producen pérdidas en la materia seca y en el valor energético del ensilado, al reducir la disponibilidad de CHOS. Afortunadamente, las enzimas de las que mencionamos, son muy sensibles al descenso brusco del pH cuando se acidifica el material (Muck, 1988).. 21.
(38) b) Fase aeróbica. Luego del picado y del proceso del ensilaje, las células del vegetal continúan respirando hasta que consumen todo el oxígeno del aire presente en la masa ensilada. Durante esta etapa, gran parte de los carbohidratos no estructurales, en especial el almidón, son transfonnados en azúcares simples (glucosa y fructosa).. Posterionnente, estas sustancias son. utilizadas por los microorganismos que se encuentran en la superficie del vegetal (bacterias, mohos, levaduras), generando ácidos grasos volátiles (AGV) y gases (Bertoia, 2007). Simultáneamente, durante este proceso respiratorio se produce calor, agua y dióxido de carbono, el cual desplaza al oxigeno atrapado en el forraje ensilado. Cuanto más rápido se elimine el oxigeno, generalmente en 4 a 6 horas de finalizado el ensilado, menor es la reducción de los CHOS y la producción de calor; y menor es el tiempo que transcurre hasta que se generen las condiciones favorables para el desarrollo de los microorganismos anaeróbicos. Sin embargo, cuando las condiciones de trabajo son inadecuadas, picado del cultivo demasiado seco, pobre compactación, picado largo, llenado lento, no culminación del ensilado, etc, la fase aeróbica puede durar varios días. Esto ocasiona pérdidas significativas de azúcares junto con el deterioro en la calidad final del ensilado. Según Muck, (1988) se produce una temperatura inicial mayor de 37°C (ensilado atabacado de color marrón) que afecta la fennentación y aumenta la cantidad de nitrógeno que queda insoluble junto a la fracción de fibra de detergente ácido (FDA}, y obviamente, menor será el valor nutritivo del mismo. Sin embargo, cuando el llenado del silo se realiza en fonna rápida y se compacta bien el material, las pérdidas de azúcares, producto de la. hidrólisis del almidón, nonnalmente no son importantes.. 22.
(39) Además, cuando ingresa aire al silo (cobertura no hermética, excesiva exposición del material a la intemperie) se favorece el crecimiento de mohos y levaduras (color blanquecino).. Esto ocasiona una menor. palatabilidad del material, incluso se pueden producir trastornos en la salud de los animales (aflatoxina producido por el Aspergillius flavus). En la fase anaeróbica, los CHOS representan el mejor sustrato para el desarrollo de los microorganismos, en especial las bacterias lácticas, que a través del ácido láctico, permiten la estabilización final del material ensilado. En estas condiciones de estabilización la presencia de CHOS es nula.. e) Fase anaeróbica Una vez que el oxígeno ha sido desplazado, comienza la fase anaeróbica, que se caracteriza por la intervención de un complejo de microrganismos. A continuación, se describen las características más importantes de las bacterias predominantes en el proceso del ensilaje:. Bacterias - coliformes • productoras de ácido acético: • Pueden desarrollarse con o sin aire. • Degradan a los azúcares en ácido acético, alcohol y dióxido de carbono. • Tienen mayor actividad con alta humedad en la masa ensilada. • Se inhiben cuando el pH desciende de 4,5.. Bacterias productoras de ácido láctico: • Según Spoelstra et al. (1988) se dividen en homofermentativas y heterofermentativas. Las primeras, fermentan a los azúcares en ácido láctico (exclusivamente), mientras que las segundas, generan ácido láctico, ácido acético y alcohol.. • La temperatura adecuada para el crecimiento de los microorganismos, productores de ácido láctico, varia entre 200 y 37°C.. 23.
(40) • Cuando el pH es elevado aumenta la producción de acético y en la medida que éste desciende, el láctico se convierte en el producto dominante, siempre y cuando sea adecuado el nivel de azúcares en el forraje (maíz y sorgo). En cambio, en los ensilados de pasturas (gramíneas y leguminosas) pueden desarrollar otras fermentaciones secundarias que alteran la calidad final, como las que generan ácido butírico {olor rancio) y aminas {olor putrefacto}. Durante la fase de anaerobiosis se desarrolla un complejo microbiano que consume los jugos celulares liberados por la planta, especialmente los azúcares. En una primera etapa predominan las bacterias coliformes o enterobacterias, productoras de ácido acético {olor a vinagre), alcoholes y gas carbónico. Estas bacterias habitualmente abundan en el suelo, por lo que se recomienda la no utilización de la tierra en el proceso del ensilaje (Bragachini et al., 1997). Posteriormente a estas bacterias colifonnes se desarrollan las bacterias lácticas. En todos los casos, estos complejos de microrganismos consumen diferentes cantidades de azúcares solubles del medio. La fermentación láctíca utiliza del 3,8 al 4 % de los azúcares del material puesto a fermentar, mientras que la butírica consume el 24 %y la acética el38% {Bragachini et al., 1997). 2.2.9 Factores que afectan el proceso del ensilado Contenido de materia seca El contenido correcto de MS (3~35%) de la planta antes del ensilado es un factor. importante para el éxito de la fermentación (Ashbell y Weinberg, 2001), así la degradación del ácido láctico y la producción de amoníaco por bacterias butíricas se ven considerablemente atenuados (Cañete y Sancha, 1998). Forrajes con contenidos de más del70% de humedad son indeseables dado que 24.
(41) el crecimiento de los Clostridium no se inhibe aun cuando el pH baje a 4, obteniéndose ensilados de bajo valor nutricional por pérdidas de efluentes, y poco apreciado por los animales (Aianiz, 2008).. Grado de madurez óptimo. El proceso del ensilado no mejora en ningún caso la calidad inicial del forraje o del alimento, limitándose a conservarla cuando se realiza de forma adecuada. En forrajes el momento óptimo de cosecha será cuando el valor nutritivo y las características físico químicas estén relacionadas, es decir los forrajes, aunque siendo jóvenes presentan un valor nutritivo elevado, su gran contenido en agua y en materia nitrogenada se recomienda no ensilar, dando lugar a una baja producción por hectárea, aunque el consumo sea elevado. Por otra parte, cuando son recolectados tardíamente, aunque aumente su producción por hectárea, presentan un alto contenido en glúcidos estructurales en sus paredes (celulosa, hemicelulosa y lignina) y un bajo contenido en materias nitrogenadas, lo que determina un bajo valor nutritivo y un menor consumo, recomendando no ensilar (Cañete y Sancha, 1998). 2.2.10 Ligados a la realización del ensilado Tamaño de la partícula. Al momento de picar un cultivo para ensilar se presentan dos aspectos, que en cierto modo parecen contrastantes: 1) lograr un tamaño de partículas lo suficientemente pequeño como para no dificultar el correcto compactado del ensilaje y 2) lograr un tamaño de partícula lo suficientemente grande como para proveer al animal de FDN, asegurándole una normal masticación y una adecuada rumia cuando el animal ingiere ese forraje (Gallardo, 2003).. 25.
(42) El tratamiento físico del forraje antes de ser ensilado es muy importante para conseguir una buena conservación, el tamaño de partícula es una de las principales precauciones para ensilar forrajes . Si el forraje tiene gruesos y grandes tallos, sino se pica, pueden quedarse bolsas de aire con más facilidad ya que la compactación del material es más difícil y consecuentemente, pueden producirse fermentaciones de tipo aeróbico principalmente, aumentando la temperatura y elevándose el pH, que deteriora el ensilaje (Gallardo, 2003).. Características del material ensilado El valor nutritivo de los ensilajes está determinado principalmente por la composición del forraje al momento de la cosecha y por las modificaciones químicas que toman lugar durante el proceso del ensilaje. El valor nutritivo del ensilado es siempre menor en relación al material de origen, siendo la magnitud de estos cambios dependiente de las medidas que se adopten para conducir el proceso de conservación técnicamente en la forma más adecuada. Considerando el valor nutritivo como una función del consumo voluntario, digestibilidad y eficiencia de utilización de los nutrientes digeridos (Cañete y Sancha, 1998).. 2.3. Hipótesis: Ho: No existe efecto de los aditivos químicos (urea, benzoato de sodio y sulfato de amonio) sobre la composición química bromatológica de la avena (Avena sativa L.) ensilada Ha: Existe efecto de los aditivos químicos (urea, benzoato de sodio y sulfato de amonio) sobre la composición química bromatológica de la avena (Avena sativa L.) ensilada. 26.
Figure
Documento similar
La campaña ha consistido en la revisión del etiquetado e instrucciones de uso de todos los ter- mómetros digitales comunicados, así como de la documentación técnica adicional de
You may wish to take a note of your Organisation ID, which, in addition to the organisation name, can be used to search for an organisation you will need to affiliate with when you
Where possible, the EU IG and more specifically the data fields and associated business rules present in Chapter 2 –Data elements for the electronic submission of information
The 'On-boarding of users to Substance, Product, Organisation and Referentials (SPOR) data services' document must be considered the reference guidance, as this document includes the
In medicinal products containing more than one manufactured item (e.g., contraceptive having different strengths and fixed dose combination as part of the same medicinal
Products Management Services (PMS) - Implementation of International Organization for Standardization (ISO) standards for the identification of medicinal products (IDMP) in
Products Management Services (PMS) - Implementation of International Organization for Standardization (ISO) standards for the identification of medicinal products (IDMP) in
This section provides guidance with examples on encoding medicinal product packaging information, together with the relationship between Pack Size, Package Item (container)