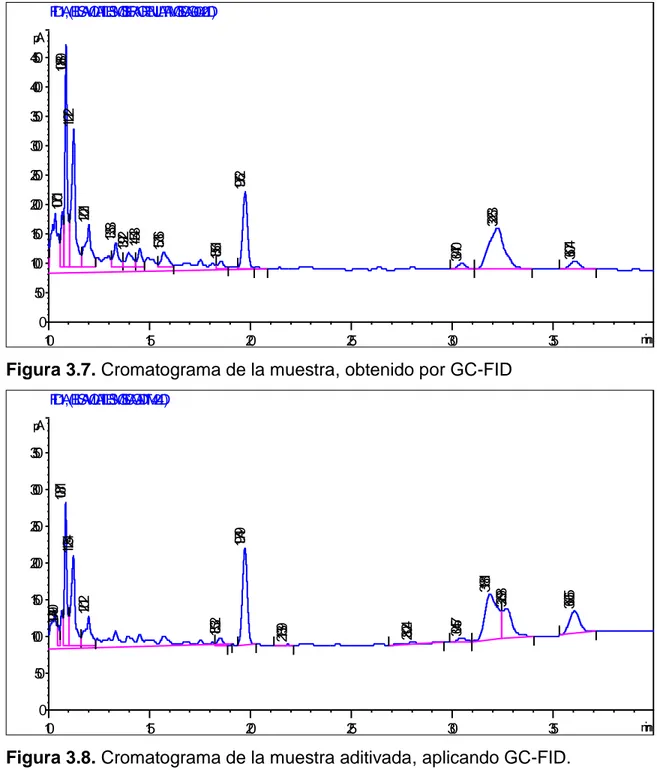
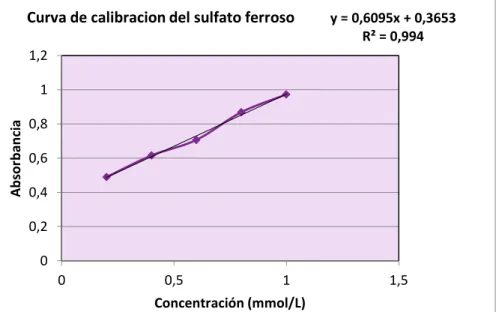
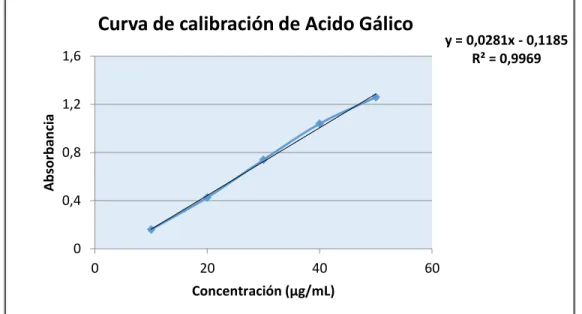
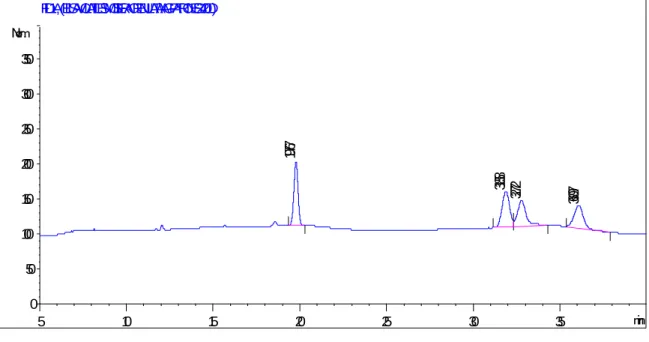
Composición fenólica y actividad antioxidante de las hojas de Mosiera crenulata
Texto completo
(2) Exergo.
(3) « Nadie está a salvo de las derrotas. Pero es mejor perder algunos combates en la lucha por nuestros sueños, que ser derrotado sin saber siquiera por qué se está luchando » Paulo Coelho.
(4) Dedicatoria.
(5) A mi Madre.
(6) Agradecimientos.
(7) AGRADECIMIENTOS Realizar este trabajo ha supuesto un gran reto que no hubiese sido posible sin la compañía de personas maravillosas que me han apoyado, me han animado durante todos estos años de esfuerzos y dedicación: A Dios quién me da fuerza para enfrentar los retos que surgen en cada paso de mi vida. A mi mamita querida por darme la vida, quien ha sido ese motor impulsor, que ha estado siempre que la he necesitado dispuesta, cariñosa y paciente ante mis necesidades. A Kindo por darme ese amor y cariño de un padre. A mi hermana Melissa que es la mejor, tatica te quiero mucho. A Yohan por darme su amor y estar siempre presente en los momentos buenos y malos que la vida nos ha dado. A mi familia, por todo el apoyo que me dieron en esta etapa y durante toda mi vida, por estar pendiente siempre de mí y ayudarme sin pedir nada a cambio, en especial a : Desdy, Juan Carlos, Susana, Driagna, Yonnie. A mis profesores y especialmente a mi tutora Elisa por tenerme paciencia, transmitirme sus conocimientos de manera amorosa y cariñosa, por estar siempre que la he necesitado. A Janet Melissa que aunque esté lejos siempre me ha brindado su amor y confianza. A Osmary mi amiga ante todo, por haber compartido todos estos años de alegrías y tristezas juntas. A todos aquellos que de una forma u otra me han ayudado y estado presente en este largo camino. A todos Muchas Gracias!!!.
(8) Resumen.
(9) RESUMEN Las plantas medicinales son una fuente importante de antioxidantes y éstos permiten retrasar, prevenir o eliminar el daño oxidativo generado por las especies reactivas de oxígeno que se asocian al desarrollo de enfermedades. Se realizó un estudio experimental para evaluar desde el punto de vista farmacológico in vitro la actividad antioxidante de extractos obtenidos de las hojas de Mosiera crenulata. Se analizó cualitativamente la composición química del extracto metanólico, en acetato de etilo y de hexano, se determinó el contenido de fenoles, flavonoides y taninos. Se evaluó in vitro la actividad antioxidante mediante los ensayos: secuestro del radical. DPPH,. capacidad. antioxidante. total,. actividad. quelante,. poder. reductor/antioxidante férrico. Los fenoles, flavonoides y taninos fueron los principales metabolitos identificados. El extracto metanólico posee mayor contenido de compuestos fenólicos (658,21 mgEAG/gES) y el de acetato de etilo mayor contenido de flavonoides (286,7 mgER/gES). El contenido de taninos fue de 1,67%. Los extractos mostraron actividad antioxidante in vitro, siendo el metanólico el de mejores resultados en los ensayos que evaluaron la actividad antiradicalica (Secuestro del radical 2,2-difenil-1-picril-hidracilo y Actividad antioxidante total) y el de acetato de etilo el que mostró mejor actividad en los ensayos que midieron la actividad quelante (ensayo del poder reductor/antioxidante férrico (FRAP) y ensayo para medir la actividad quelante). Los tres extractos de Mosiera crenulata muestran actividad antioxidante in vitro, tributando a ello los compuestos fenólicos que lo componen..
(10) Índice.
(11) ÍNDICE ÍNDICE INTRODUCCIÓN .................................................................................................. 1 CAPÍTULO I: REVISIÓN BIBLIOGRÁFICA ......................................................... 5 1.1. Consideraciones generales sobre el uso de las plantas medicinales. 5 1.2. Estudios publicados de la planta incluida en el trabajo Mosiera crenulata......................................................................................................... 7 1.2.1. Breve descripción de la especie. ......................................................... 7 1.3. Metabolitos de plantas medicinales determinados en el presente trabajo. Su relación con la actividad antioxidante evaluada en la investigación.................................................................................................. 8 1.3.1. Determinación cualitativa de los metabolitos ....................................... 9 1.3.2. Determinación cuantitativa del contenido de metabolitos de interés en la planta. ...................................................................................................... 10 1.4. Actividad Antioxidante ......................................................................... 18 1.4.1. Generalidades de Radicales Libres ................................................... 18 1.4.2. Daños producidos por los Radicales Libres ....................................... 19 1.4.3. Agentes Antioxidantes. Definición. Métodos para su evaluación. ...... 20 1.4.3.1. Métodos para evaluar la actividad antioxidante. ............................. 22 CAPÍTULO II: MATERIALES Y MÉTODOS ....................................................... 26 2.1. Tipo de estudio ..................................................................................... 26 2.2. Extractos, equipos y reactivos. ........................................................... 26 Equipos, instrumentos de medición. ............................................................ 26 Reactivos más utilizados: ............................................................................ 26 2.3. Obtención y determinación del rendimiento de extractos secos obtenidos a partir de las hojas de Mosiera crenulata. ............................. 28 2.3.1. Metodología de obtención y almacenamiento de los extractos .......... 28 2.3.2. Determinación del rendimiento de extractos secos............................ 29 2.4. Determinación de la composición fenólica en los extractos obtenidos. .................................................................................................... 29 2.4.1. Determinación cualitativa. Tamizaje fitoquímico. ............................... 29 2.4.2. Determinación cuantitativa de los compuestos fenólicos en los extractos evaluados. .................................................................................... 29 2.5. Evaluación in vitro de la actividad antioxidante ................................ 34 2.5.1. Secuestro del radical 2,2-difenil-1-picril-hidracilo (Ensayo DPPH) .... 34 2.5.2. Determinación del poder reductor/antioxidante férrico (FRAP). ......... 35 2.5.3. Determinación de la Actividad Quelante. ........................................... 36.
(12) ÍNDICE 2.5.4. Determinación de la capacidad antioxidante total (TAOC). ............... 37 2.6. Relación de la composición fenólica con la actividad antioxidante en los extractos. .......................................................................................... 37 CAPÍTULO III: RESULTADOS Y DISCUSIÓN................................................... 39 3.1. Determinación del rendimiento de extractos secos obtenidos a partir de las hojas de Mosiera crenulata. .................................................. 39 3.2. Resultados de la composición química de los extractos obtenidos de las hojas de Mosiera crenulata. ............................................................ 40 3.2.2. Determinación cuantitativa de los compuestos fenólicos presentes en los extractos obtenidos de las hojas de Mosiera crenulata .......................... 42 3.3. Evaluación in vitro de la actividad antioxidante ................................ 49 3.3.1. Secuestro del radical 2,2-difenil-1-picril-hidracilo (Ensayo DPPH) .... 50 3.3.2. Capacidad antioxidante total .............................................................. 54 3.3.4. Determinación de la Actividad quelante de Fe2+ ................................ 58 3.4. Relación entre el contenido fenólico con la actividad quelante y la capacidad secuestradora del radical DPPH. ............................................. 59 BIBLIOGRAFÍA .................................................................................................. 64.
(13) Introducción.
(14) INTRODUCCIÓN. INTRODUCCIÓN Las plantas medicinales han sido usadas desde hace muchos siglos para aliviar síntomas y tratar enfermedades. La medicina tradicional ha ganado un gran interés tanto para el uso preventivo, para el tratamiento de enfermedades como para la búsqueda de nuevos compuestos terapéuticos. En el año 2002 la Organización mundial de la salud (OMS) señalo la falta de metodologías de investigaciones científicas y estandarizadas para obtener y evaluar productos los productos obtenidos de hierbas garantizando su calidad y eficacia, lo que ha mantenido ocupado a muchos investigadores de todo el mundo (1). Muchas investigaciones científicas de interés en las últimas décadas, dirigidas a la obtención de compuestos naturales a partir de plantas medicinales, han estado vinculadas con las Especies Radicales de Oxigeno (EROs) y su probable vínculo en la fisiopatología humana con problemas de salud. El estrés oxidativo, causado por un desbalance entre el sistema antioxidante y la producción de oxidantes, incluyendo los EROs, parece estar asociado con muchas enfermedades multifactoriales(2), especialmente cáncer, enfermedades cardiovasculares y desordenes. antiinflamatorio(3).. La. inflamación. crónica. es. profundamente. reconocida como una causa mayor de varias enfermedades degenerativas. Efectos acumulativos de destrucción de tejidos causados por EROs junto con daños inducidos por metaloproteinasas conducen a condiciones patológicas (4). Ha sido reportado que extractos de hierbas bioactivos con altos niveles de compuestos fenólicos y flavonoides exhiben fuertes actividades antioxidantes y antiinflamatoria(5). Por tanto frutas y vegetales que contienen grandes cantidades de antioxidantes tienen altos beneficios para la salud por contrarrestar el estrés oxidativo y de este modo reduce el riesgo de enfermedades crónicas (5,. 6). . Estos antioxidantes. principalmente se obtienen de plantas en forma de fenoles tales como flavonoides, ácidos. fenólicos,. tocoferoles,. ácido. ascórbico. y. carotenoides,. etc.... Recientemente, los compuestos fenólicos han recibido mucha atención sobre sus efectivas propiedades antioxidantes, y sus efectos beneficiosos son atribuidos a su posibilidad de donar electrones, secuestrar radicales libres y su fuerza reducida 1.
(15) INTRODUCCIÓN (7, 8). . Además, los de origen natural tienen la capacidad de mejorar la estabilidad y. calidad de los alimentos y pueden también actuar como nutracéuticos para terminar las reacciones en cadena de radicales libres en sistemas biológicos, y asi poder propiciar efectos beneficiosos a los consumidores(9). Los antioxidantes más comúnmente utilizados en la actualidad son el hidroxianisol butilado (BHA), el hidroxitolueno butilado (BHT), el propil gallato (PG) y el tert-butilhidroquinona (TBHQ)(10). Sin embargo, en los últimos años estos han sido cuestionados por su toxicidad, al ser causantes de daños hepáticos y carcinogénesis en animales de laboratorio(11). Por tanto, el desarrollo y la utilización de antioxidantes más efectivos de origen natural constituye una tarea que enfrenta la comunidad científica internacional en estos momentos (12). Múltiples trabajos se presentan en la literatura reciente informando sobre las características antioxidantes de extractos obtenidos de plantas, por solo citar algunos ejemplos, aparecen los de Topobea cf discolor, Alchornea grandis, Tovomita, Guianensis, Clusia multiflora ect.(5), Hibiscus sabdariffa,(13) Ilex brfaseliensis (14). Nuestro país presenta una riqueza y mega diversidad de plantas nativas, siendo uno de los pilares de la etnofarmacología y la medicina tradicional desde la época del Incario hasta la actualidad. Las plantas medicinales han sido utilizadas en forma empírica por sus bondades terapéuticas en el cuidado y restauración de la salud, de forma similar a lo que ocurre en la mayoría de los países, encontrándose incluidas en la categoría de medicamentos. Asimismo, el Ministerio de Salud tiene establecido un Programa de Medicina Tradicional, que fue aprobado en 1991, para estudiar los productos naturales más utilizadas por la población y evaluar con métodos científicos actuales sus efectos farmacológicos y tóxicos, lo que permite incorporar la llamada medicina moderna a los medios medicinales tradicionales con verdadera efectividad, ganando prestigio en la práctica médica actual(15). Las plantas aromáticas insertadas en este programa son muchas pero cada día se realizan estudios a nuevas especies de plantas para determinar si pueden incluirse en este programa pues constan con investigaciones anteriormente realizadas donde se reportan posibles propiedades terapéuticas que podrían ser de. muy. buena. utilización. en. el. país,. tales. como. antiparasitarias, 2.
(16) INTRODUCCIÓN antiespasmódicas,. antirreumáticos etc. Teniendo en cuenta. esto en el. Departamento de Farmacia de la Universidad Central de Las Villas existe un grupo de investigación que tiene como objetivo fundamental el estudio de las plantas medicinales, particularmente los aceites esenciales y extractos presentes en las plantas aromáticas. El presente trabajo se desarrolló en este grupo de investigación que para la selección de la planta tuvo en consideración el interés mostrado por el grupo de botánicos del centro de Casilda de Santi Spiritus, por la Mosiera crenulata, planta endémica de la región central que se encuentra en real peligro de extinción y posee muy poca información en la literatura. Además, se propone extender su cultivo por su endemismo y se requiere justificar su uso en la medicina tradicional cubana, lo que complementaría las razones para su estudio. Constituye, por tanto, el problema científico del presente trabajo que la Mosiera crenulata posee escasos estudios reportados que describan la composición y la actividad farmacológica de sus hojas, lo que limita justificar el uso de extractos en el campo farmacéutico y alimentario. Atendiendo a ello, con el objetivo de buscar nuevas fuentes de antioxidantes naturales y resolver el problema planteado, este trabajo científico parte de la siguiente hipótesis: Si se realizan estudios que permitan conocer los metabolitos de mayor interés que podrían estar relacionados con la posible actividad antioxidante de la Mosiera crenulata se contribuirá a disponer de la información necesaria para proponer su uso como antioxidante en el campo farmacéutico y alimentario. Para fundamentar dicha hipótesis se trazaron los siguientes objetivos. Objetivo general: Evaluar la composición de extractos obtenidos de las hojas de Mosiera crenulata y su posible relación con la actividad antioxidante en el mismo. Objetivos específicos: 1. Obtener extractos a partir de las hojas de Mosiera crenulata, aplicando la técnica de extracción sólido-líquido. 2. Determinar el contenido fenólico, de flavonoides y de taninos en los extractos obtenidos a partir de las hojas de Mosiera crenulata, empleando técnicas espectrofotométricas. 3.
(17) INTRODUCCIÓN 3. Identificar la presencia de ácidos grasos en el extracto de hexano, empleando la Cromatografía Gaseosa. 4. Evaluar la actividad antioxidante de los extractos, aplicando diferentes ensayos in vitro. 5. Relacionar el contenido fenólico de la planta con la actividad antioxidante evaluada, aplicando la regresión lineal.. 4.
(18) CAPITULO I Revisión Bibliográfica.
(19) CAPÍTULO I: REVISIÓN BIBLIOGRÁFICA CAPÍTULO I: REVISIÓN BIBLIOGRÁFICA 1.1. Consideraciones generales sobre el uso de las plantas medicinales. El uso de las plantas medicinales tiene una historia honorable. El testimonio más antiguo del uso de las plantas por razones no alimentarías se encontró en una excavación en Shanidar, Irak; que data alrededor de 60.000 años; pues aunque no existe documentación escrita que permita determinar exactamente desde cuando el hombre las utiliza con funciones medicinales, resulta evidente que esto ocurrió desde etapas muy tempranas de la evolución e incluso mucho antes de que apareciera la escritura y el lenguaje. Los conocimientos relacionados con las plantas medicinales se transmitían verbalmente de generación en generación y no fue hasta que apareció la escritura que éstos quedaron plasmados, siendo el primer texto escrito sobre el uso de plantas medicinales, con más de 4000 años de antigüedad, una tablilla de arcilla en la cultura de los sumerios, un antiguo pueblo que vivía al sur de los ríos Éufrates y Tigris, lo que equivaldría al actual Iraq (16). En las últimas décadas puede observarse como tendencia mundial, un aumento del consumo de plantas medicinales, tanto en los países industrializados como en los del tercer mundo. Se estima que alrededor del 80% de la población mundial, aproximadamente unos cuatro mil millones de personas, recurre a la medicina tradicional herbolaria para la atención primaria de la salud. En Asia, millones de personas mantienen su salud a través del uso de hojas, raíces y cortezas de árboles. De hecho el 25% de las medicinas prescritas por los médicos europeos y estadounidenses se derivan de plantas existentes en los bosques. Según reconocidos investigadores, prácticamente todas esas plantas se han descubierto gracias a la información derivada de su uso en medicina tradicional. (17). .. Como definición las plantas medicinales son las que contienen, en alguno de sus órganos, principios activos, los cuales, administrados en dosis suficientes, producen efectos curativos en las enfermedades de los hombres y de los animales en general. (18). .. Teniendo en la medicina moderna importantes aplicaciones: son fuente directa de agentes terapéuticos, se emplean como materia prima para la fabricación de medicamentos semisintéticos más complejos, la estructura química de sus principios activos puede servir de modelo para la elaboración de drogas sintéticas y tales 5.
(20) CAPÍTULO I: REVISIÓN BIBLIOGRÁFICA principios se pueden utilizar como marcadores taxonómicos en la búsqueda de nuevos medicamentos (19). Además, las nuevas formas de utilización de las sustancias naturales abren una galaxia, compuesta de propuestas de productos novedosos, en un principio clasificado como complementos alimenticios, ahora incluyendo nutracéuticos, suplementos dietéticos, dispositivos médicos, medicamentos preparados a base de hierbas y otros, todos ellos colectivamente llamados ingredientes botánicos por su origen. El siguiente paso, como evolución natural de esta tendencia, será la fusión de los aspectos nutricionales y de salud en los alimentos multifuncionales. (20). .. Existen en el mundo unas 250,000 especies vegetales de las cuales solo se conocen científicamente el 10 % de ellas, considerándose como medicinales alrededor de 12,000 especies en total(21). Al menos un 25% de los productos farmacéuticos modernos se derivan de las plantas, y los ingredientes de muchos otros son reemplazos sintéticos creados a partir de compuestos obtenidos de las plantas. Un número estimado de aproximadamente 70,000 especies de plantas se utilizan en medicina popular en todo el mundo, una cifra que ha sido confirmada recientemente por diferentes estudios. Como consecuencia, existe una enorme demanda de productos obtenidos de estas plantas tanto para su uso doméstico como para el comercio a nivel local, regional, nacional e internacional. (22). .. Entre las plantas medicinales, las plantas aromáticas juegan un rol importante. Las plantas aromáticas son aquellas que tienen un contenido sobresaliente en aceites esenciales y representan una amplia variedad de especies. Como grupo, son especies valoradas por sus aromas y sabores característicos así como por sus propiedades medicinales; representan alrededor de un 0,7% del total de las plantas medicinales. Existen desde plantas superiores hasta algas con propiedades aromáticas, para un total aproximado de 60 familias botánicas reconocidas con tales propiedades, entre ellas: Mirtáceas, Compuestas, Labiadas, Umbelíferas, Pináceas, Verbenáceas, Lamiáceas, Rutáceas, Lauráceas, Piperáceas, Apiáceas y Asteráceas. Constituyen, por tanto, un recurso valioso en los sistemas de salud de los países en desarrollo. El estudio científico de las plantas potencialmente medicinales y aromáticas trajo un inusitado desarrollo de la fitoquímica; la farmacognosia, la etnobotánica y otras 6.
(21) CAPÍTULO I: REVISIÓN BIBLIOGRÁFICA especialidades que estudian las plantas medicinales desde el punto de vista científico, desarrollándose fundamentalmente trabajos dirigidos al establecimiento de la relación estructura actividad, para ello se desarrollaron técnicas de tamizaje fitoquímico y farmacológico. En los años posteriores se desarrollaron otras técnicas y se aplicaron los avances del análisis instrumental Cromatografía de gases (CG), Cromatografía Líquida de alta Eficacia (CLAE), los métodos espectroscópicos etc. ponen hoy en día a disposición de la terapéutica productos de estas fuentes desarrollados bajo los criterios de calidad, seguridad y eficacia, que debe cumplir todo medicamento (23). Cuba, cuyos planes y programas de salud tienen una amplia cobertura que alcanza sus más remotas zonas, posee excelentes condiciones naturales que facilitan el desarrollo de una rica flora y una tradición popular en el empleo de las plantas medicinales. Este uso tradicional se encuentra fundamentalmente guiado por la existencia de numerosas evidencias de la actividad terapéutica de las plantas y porque en la mayoría de los casos, son más seguras en función de presentar menores contraindicaciones y efectos secundarios, que los encontrados en los productos de síntesis. (23). .. La riqueza de un país en plantas medicinales solo alcanza su verdadero valor cuando se da una correcta utilización de las mismas. Teniendo en cuenta todo lo anterior se propuso el desarrollo del presente trabajo que tiene como objeto de estudio los extractos obtenidos de las hojas de Mosiera crenulata. A continuación se relacionan los pocos aspectos encontrados en la literatura de esta planta.. 1.2. Estudios publicados de la planta incluida en el trabajo Mosiera crenulata 1.2.1. Breve descripción de la especie. Esta planta pertenece al género mosiera, el cual posee unas 40 especies de plantas con flores que pertenecen a la familia Myrtaceae. Aspectos taxonómicos(24) Nombre científico: Mosiera crenulata (Urb. & Ekman) Borhidi Nombre vernáculo: Sinonimia: Psidium crenulatum Urb. & Ekman; Myrtus crenulata (Urb. & Ekman) Bisse Familia: Myrtaceae. 7.
(22) CAPÍTULO I: REVISIÓN BIBLIOGRÁFICA Orden: Myrtales Clase: Magnoliopsida División: Magnoliophyta Descripción: arbusto con ramitas glandulosas; hojas aovadas, de 4-5 cm, obtusas a redondeadas en el ápice, truncadas o algo acorazonadas en la base, margen crenulado, pelositas en el envés en los nervios, reticuladas, puntos glandulosos translúcidos; pedúnculos axilares, de 4-15 mm., 1-2-floros.. Distribución: endemismo estricto de la zona de arenas cuarcíticas de Casilda (aproximadamente 70 km2), municipio Trinidad, provincia Sancti Spíritus, Cuba. Categoría de amenaza de extinción: En Peligro Crítico (EN) (25). La planta Mosiera crenulata es endémica de la región central de Cuba y después de haber realizado una exhaustiva búsqueda en bases de datos especializadas no se encontraron reportes de la misma en relación a su composición química y posibles usos en el campo farmacéutico.. 1.3. Metabolitos de plantas medicinales determinados en el presente trabajo. Su relación con la actividad antioxidante evaluada en la investigación. El valor medicinal de la planta curativa se debe a la presencia en sus tejidos de una sustancia química, el principio activo, que son las sustancias responsables de la acción farmacológica y las que le confieren valor terapéutico. Muchos de los principios activos son sumamente complejos y ocasionalmente aún se desconocen su naturaleza química, otros han sido aislados purificados e incluso, sintetizados. Por lo general pertenecen a estas categorías: alcaloides, glucósidos, gomas y resinas, sustancias antibióticas, ácidos grasos y otros metabolitos secundarios(26). Estos últimos juegan un rol muy importante en la adaptación de la planta con su medio ambiente, presentando sus actividades como antibióticos, antifúngicos, antiviral, antimicrobianos, protección de patógenos, de la luz UV, mientras que los ácidos grasos son componentes de marcadas importancias por el rol que juegan en la nutrición humana. (27). .. Los metabolitos secundarios se suelen clasificar según su ruta biosintética. Se consideran 3 familias moleculares grandes: alcaloides, terpenoides y esteroides y 8.
(23) CAPÍTULO I: REVISIÓN BIBLIOGRÁFICA compuestos fenólicos. Los terpenoides y los compuestos fenólicos forman la parte aromática volátil de la planta, presentes en el aceite esencial del mismo, los compuestos fenólicos están distribuidos extensamente en las plantas superiores (28). Ambos grupos de metabolitos constituyen los más conocidos por ser recursos muy útiles para el desarrollo de muchas ramas de la ciencia (29-32). A continuación se profundiza en la información de dos grupos de estos compuestos (compuestos fenólicos y ácidos grasos) que constituyeron los de mayor interés en el presente trabajo. 1.3.1. Determinación cualitativa de los metabolitos La determinación fitoquímica tiene una gran importancia para la determinación de los componentes activos de las plantas medicinales, su cuantificación y análisis de los efectos beneficiosos y perjudiciales a la salud humana. Esta ciencia trata sobre los métodos de obtención de esos componentes activos, su clasificación de acuerdo al grupo funcional químico orgánico a que pertenece y estudia los métodos analíticos para comprobar su calidad(33). Para determinar la composición química de las plantas medicinales y conocer sus constituyentes biológicamente activos pueden seguirse metodologías que van desde un análisis fitoquímico preliminar hasta estudios químicos sistemáticos bioguiados. Este último estudio requiere una inversión considerable de tiempo y recursos, sugiriéndose en ocasiones iniciar con estudios fitoquímicos preliminares que permitan hacer una discriminación de las plantas a estudiar en términos de su composición química, con el fin de seleccionar únicamente aquellas más interesantes para posteriores estudios sistemáticos(34). Los estudios fitoquímicos preliminares persiguen evaluar la presencia o ausencia de los principales grupos de metabolitos en una especie vegetal, a saber: alcaloides, antraquinonas y naftoquinonas, esteroides y triterpenos, flavonoides, taninos, saponinas, coumarinas, lactonas terpénicas y cardiotónicos. (33,. 34). . El tamizaje. fitoquímico consiste en la extracción de la planta con solventes apropiados y la aplicación de reacción de color y precipitación. Debe permitir la evaluación rápida, con reacciones sensibles, reproducibles y de bajo costo. Los resultados del tamizaje 9.
(24) CAPÍTULO I: REVISIÓN BIBLIOGRÁFICA fitoquímico constituyen únicamente una orientación y deben interpretarse en conjunto con. los. resultados. de. otros. ensayos. cuantitativos. así. como. de. estudios. farmacológicos(34). Dado que cada uno de los grupos de compuestos está relacionado con actividades biológicas específicas, partiendo de los resultados obtenidos en el estudio fitoquímico preliminar es posible orientar investigaciones posteriores para determinar la actividad biológica de la especie en cuestión y los principios activos involucrados. (33, 34). .. 1.3.2. Determinación cuantitativa del contenido de metabolitos de interés en la planta. El análisis de metabolitos secundarios en las plantas es un desafío por su diversidad química, normalmente baja abundancia y gran variabilidad que ocurre dentro una misma especie. Es estimado que 100,000 – 200,000 metabolitos están presentes en el reino de las plantas(35) y se considera que en muchas preparaciones herbales tradicionales orígenes de China o India contiene no solo una sino muchas plantas medicinales. Lo anterior obliga a la búsqueda de. métodos sensibles y con alta. selectividad y conllevan a incluir procesos, además, muy costosos. La variabilidad y cantidad de componentes activos presentes en las hierbas está relacionado con méltiples factores entre los que se destacan los factores medioambientales (clima, región de cultivo y época de cosecha), el tratamiento de la planta (lavado, secado, molinado y conservación), así como del uso de diferentes métodos de extracción que pueden variar la composición de las muestras. Además, estos metabolitos se encuentran en concentraciones muy bajas en la planta, lo que exige alta sensibilidad en el procedimiento analítico seleccionado.. Es por tanto una solución reportar el. contenido total de metabolitos, agrupados por sus características estructurales y químicas, en base a uno de ellos conocido como marcador. (36, 37). .. En la presente investigación constituyeron los metabolitos de interés los compuestos fenólicos y los ácidos grasos. A continuación se profundiza en las metodologías para la determinación cuantitativa de los mismos. Compuestos fenólicos. (Fenoles, flavonoides y taninos). 10.
(25) CAPÍTULO I: REVISIÓN BIBLIOGRÁFICA El término «compuestos fenólicos» comprenden un amplio rango de sustancias que poseen uno o más anillos aromáticos con por lo menos un grupo hidroxilo. Estos compuestos fenólicos o polifenoles constituyen uno de los grupos de sustancia más numeroso y distribuido extensamente en el reino de las plantas. Entre ellos podemos mencionar a los flavonoides, isoflavonoides, antraquinonas, antocianidinas y xantonas, a los ácidos fenólicos y a los fenoles simples, a los ácidos hidroxicinámicos, a los fenilpropenos, a las ligninas, etc. Los mismos actúan generalmente como capturadores y estabilizadores de radicales libres (38). La. determinación. del. contenido. fenólico. total. se. realiza. por. el. ensayo. espectrofotométrico desarrollado por Folin-Ciocalteau que se fundamenta en una reacción de oxidación/reducción como mecanismo básico; gracias al carácter reductor del reactivo Folin-Ciocalteau: 3H2O-P2O513WO3-5MoO3-10H2O: Heteropolianiónmolibdofosfowolfrámico, en el cual el Mo (VI) es reducido a Mo (V) con un e- donado por un antioxidante. Mo (VI) (amarillo) + e- (de AH) → Mo (V) (azul). La absorbancia del color azul desarrollado se mide a una longitud de onda. de 765nm y los resultados se expresan en µg de ácido gálico. equivalente/mg de muestra, utilizando ácido gálico como un estándar. (39). .. Esta técnica es ampliamente utilizada para determinar el contenido fenólico presente en plantas medicinales con el uso de diferentes sustancias estándares, siendo uno de los más utilizados el ácido gálico, esta metodología es considerada incluso como norma en algunas plantas como el té(40). Múltiples reportes en la última década dan fe del uso de la técnica, a continuación se enumera una breve representación de estos trabajos:. (41). relizaron determinaciones en los extractos de Thymus vulgaris L., Salvia. officinalis L., y Origanum majorana L. mientras que. (42). aplicaron esta misma técnica. con el mismo fin en Lamiaceae family (M. piperita, O. vulgare, R. officinalis L. y T. vulgaris L.) y en el año 2015. (43). utilizaron la técnica para determinar el contenido. fenólico en Euclayptus camaldulensis. Entre los fenoles a los flavonoides se les brinda una atención especial cuando se evalúa la actividad antioxidante, por el gran aporte que brindan estos metabolitos a la misma, lo que ha sido demostrado en múltiples publicaciones. Para la determinación del contenido total de estos compuestos en base a uno de ellos, la literatura propone 11.
(26) CAPÍTULO I: REVISIÓN BIBLIOGRÁFICA como la técnica de mayor uso: la espectrofotometría. Esta técnica se aplica para la determinación del contenido total de estos metabolitos en una matriz vegetal a través de dos métodos colorimétricos. El método tricloruro de aluminio es usado para determinar el contenido de flavonas y flavonoides y está basando en la formación de un complejo entre ion aluminio (III) y los grupos hidroxilo y carbonilo de los flavonoides. La muestra disuelta en metanol se hace reaccionar con tricloruro de aluminio, se espera 30 min y se lee en la absorbancia a 425 nm. Para cuantificar flavonones y dihidroflavonoles es usado el método 2,4-dinitrofenilhidracina que posibilita formar en el medio básico la fenihidrazona coloreada cuya solución resultante se mide a 486 nm. (44). .. Esta técnica se encuentra reportada en un gran número de publicaciones actuales que fueron consultados para el desarrollo del presente trabajo, con énfasis en el primer método (45). Aunque los flavonoides son considerados los compuestos fenólicos de mayor importancia, desde la perspectiva de salud humana, los taninos y los ácidos fenólicos también dan su aporte y son citados en la literatura como metabolitos de mayor interés cuando se evalúa la actividad antioxidante en un extracto obtenido de planta (46). Los taninos son un grupo de metabolitos fenólicos con pesos moleculares entre 500 y 30000 Da, los cuales se encuentran profundamente distribuidos en casi la totalidad de plantas, alimentos y bebidas. Pueden ser divididos por su estructura química o por su solubilidad y extractabilidad. Teniendo en cuenta su estructura química se dividen en cuatro. grupos. dependiendo. de. la. estructura. del. monómero:. Hidrolizables,. Condensados, Florotaninos y Taninos Complejos. Las prontocianidinas y los taninos hidrolizables son los grupos más representados de estos compuestos bioactivos. Los efectos biológicos de los taninos usualmente dependen de su grado de polimerización y solubilidad; taninos altamente polimerizados exhiben baja biodisponibilidad en el intestino delgado y baja fermentabilidad por la microflora. La investigación química de los taninos se inicia más bien tarde debido a la escasez de métodos adecuados para aislar y elucidar sus estructuras. Actualmente no hay métodos adecuados de análisis de taninos presentes en las plantas medicinales especialmente para los taninos altamente polimerizados cuyo análisis es mucho más difícil. La mayoría de los estudios concentrados en la literatura solamente incluyen los taninos de bajo peso molecular (47). 12.
(27) CAPÍTULO I: REVISIÓN BIBLIOGRÁFICA La técnica espectrofotométrica indirecta, con la reacción de Folin-Ciocalteau, es ampliamente utilizada para determinar el contenido total de taninos en las plantas medicinales, siendo metodologías descritas en la mayoría de las farmacopeas actuales consultadas(48) esta técnica incluida como oficial para la determinación de taninos en drogas vegetales utiliza con estándar el Pirogalol. La misma incluye un tratamiento previo de la muestra para la extracción del tanino en polvo de piel y el uso del reactivo de Folin-Ciocalteau (Solución de ácido fosfomoligdotungstico) como reactivo de color. Es importante destacar que los métodos espectrofotométricos son recomendados para la determinación cuantitativa de taninos extractables. (47). .. Ácidos grasos. Dentro de la gran diversidad estructural que caracteriza a los lípidos, los ácidos grasos son quizás las estructuras de mayor relevancia. Los ácidos grasos se dividen en dos grandes grupos según sus características estructurales: ácidos grasos saturados (AGS) y ácidos grasos insaturados(49). Estos últimos, dependiendo del grado de insaturación que posean se pueden clasificar como ácidos grasos monoinsaturados (AGMI) y ácidos grasos poliinsaturados (AGPI)(50). En la actualidad, gracias a los avanzados equipos de cromatografía de gases y al uso de columnas capilares que tienen gran poder de resolución, se conoce con detalle y precisión la composición de ácidos grasos en grasas y aceites. La cromatografía de gases permite determinar la composición de ácidos grasos en los aceites y en las grasas, después de realizar la conversión de triglicéridos en ésteres metílicos, que son más volátiles(51, 52). Los estudios analíticos reportados para la determinación cuantitativa de ácidos grasos en fuentes vegetales o animales incluyen un paso previo de derivatización. La literatura consultada muestra. que la principal. reacción de derivatización corresponde a la. obtención de los metil ésteres de ácidos grasos. Esta reacción incluye una metodología para la preparación de los metil ésteres, empleando metanol a través de una catálisis ácida y básica, la cual ha sido la más empleada durante las últimos tres décadas(53), con la posterior determinación por GC. Múltiples investigaciones dan fe de esta afirmación(54, 55), son solo algunos ejemplos consultados en el presente trabajo. 13.
(28) CAPÍTULO I: REVISIÓN BIBLIOGRÁFICA 1.3.3. Relación de los metabolitos de interés de la planta con la actividad antioxidante En la actualidad los compuestos fenólicos presentan gran interés nutricional por su contribución al mantenimiento de la salud humana. De hecho, desde 1990, varias organizaciones internacionales en el ámbito de la nutrición recomiendan un consumo diario de al menos 5 raciones de frutas y/o verduras para asegurar una adecuada ingesta de antioxidantes y prevenir enfermedades relacionadas con el estrés oxidativo. Así, muchos de los efectos beneficiosas asociados al consumo de alimentos de origen vegetal se atribuyen en gran medida a los compuestos fenólicos (56,. 57). . La actividad. antioxidante de los compuestos fenólicos se le asigna a su facilidad para ceder átomos de hidrógeno de un grupo hidroxilo aromático a un radical libre y a la posibilidad de deslocalización de cargas en el sistema de dobles enlaces del anillo aromático. (58). . Los. compuestos fenólicos poseen además una estructura química ideal para captar iones metálicos (principalmente hierro y cobre) y por tanto para inhibir la formación de radicales libres a través de reacciones de Fenton(56). En la tabla 1.1 aparecen reflejados una representación de trabajos de la última década donde se relaciona el contenido fenólico con la actividad antioxidante en extractos de plantas, empleando diversos métodos in vitro. Como se puede apreciar el método utilizado en todos para determinar los fenoles es el método de Folin-ciocalteau y los estudios suelen realizarse en extractos alcohólicos, en menor medida en medio acuoso y en solventes apolares.. 14.
(29) CAPÍTULO I: REVISIÓN BIBLIOGRÁFICA Tabla 1.1. Ejemplos de investigaciones que muestran el estudio de la actividad antioxidante en extractos de plantas. Actividad antioxidante Planta Referencias (Extractos) Métodos utilizados Resultados. Rubus grandifolius (Extracto etanólico, acuoso). Eucalyptus amaldulensis (Extracto metanólico, cloroformo y hexano). Actividad secuestradora del radical DPPH. FRAP. Actividad secuestradora del radical DPPH. FRAP. Determinación del contenido fenólico y de flavonoides.. Olive (O. europaea L.), Cromatografía gaseosa Jujube (Z. jujuba Mill), Fig acoplada Masa(GC-MS) (F. carica L.). Metasequioa glyptostroboides (Extracto hidroalcohólico). Gardenia jasminoides (Extracto metanólico). Determinación del contenido fenólico y de flavonoides. Actividad secuestradora del radical DPPH. Determinación del contenido fenólico Actividad secuestradora del radical DPPH. Actividad antioxidante total. Las bayas presentaron una mayor capacidad antioxidante y propiedades reductoras con respecto a las hojas y las flores. El extracto etanólico mostró una mayor capacidad antioxidante con respecto al acuoso. La mayor actividad antioxidantye se obtuvo para el extracto metanólico. Actividad del antioxidante para tres extractos era: metanol (IC50 = 89.11g/mL)> cloroformo (IC50 = 154.8g/mL)> hexano (IC50 = 532.9g/mL) Se logró una separación de 20 compuestos fenólicos, donde 8 de ellos se identificaron en las frutas del Olive,10 Fig , de los cuales el ácido 2,4-dihidroxibenzoico y ácido trans-cinámico fueron dominantes en estas frutas con concentración de 87.02, 5.25 y 14,16 mg / kg y 32,43, 5,77 y 11,70 mg / kg respectivamente. El contenido fenólico total y de flavonoides en la fracción acuosa liofilizada el 30% mostró la actividad antioxidante. La planta mostró una actividad antioxidante significativa en comparación con los patrones de referencias.. (59). (60). (61). (62). (63). Entre los compuestos fenólicos los flavonoides constituyen el grupo de compuestos fenólicos más diverso y ampliamente distribuido en las plantas. Su estructura básica (flaván) consta de dos grupos fenilo (A y B) unidos por un puente de tres carbonos que forma un anillo heterocíclico oxigenado (anillo CSon compuestos de bajo peso molecular que comparten un esqueleto común de difenilpiranos, un esqueleto C6-C3-. 15.
(30) CAPÍTULO I: REVISIÓN BIBLIOGRÁFICA C6 etiquetado A, C, B respectivamente, puede sufrir posteriormente muchas modificaciones y adiciones de grupos funcionales, por lo que los flavonoides son una familia muy diversa de compuestos, aunque todos los productos finales se caracterizan por ser polifenólicos y solubles en agua. Varias clases de flavonoides se difieren en el nivel de oxidación y orden de sustitución del anillo C, mientras que los compuestos individuales dentro de una clase se diferencian en orden de sustitución de anillo A y B (64). .. La actividad antioxidante de los flavonoides resulta de una combinación de sus propiedades quelatantes de hierro y secuestradoras de radicales libres, además de la inhibición de las oxidasas: lipooxigenasa, ciclooxigenasa, mieloperoxidasa y la xantina oxidasa; evitando así la formación de especies reactivas de oxígeno y de hidroxiperóxidos orgánicos. Unido a ello se ha comprobado que también inhiben las enzimas involucradas indirectamente en los procesos oxidativos, como la fosfolipasa A2; al mismo tiempo que estimulan otras con reconocidos propiedades antioxidantes como la catalasa y la superóxido dismutasa. En los últimos años se describe un incremento vertiginoso de publicaciones relacionadas con la comprobación de la actividad antioxidante de los flavonoides presentes en fuentes naturales, empleando métodos in vitro e in vivo. Seguidamente se citan reportes actuales que dan fe de la afirmación anterior: Un estudio realizado en la planta Leucaena leucocephala, nativa del sur de México y América Central, aportó la presencia de un grupo de flavonoides que fueron identificados por técnicas cromatográficas y espectrofotométricas en varios extractos; el extracto de acetato de etilo mostró la mayor cantidad de flavonoides que los extractos obtenidos con solventes apolares y por consiguiente resultó ser el de mayor actividad antioxidante (65). Determinaron la actividad antioxidante en extractos de semillas de cuatro variedades de Cucurbita spp con respecto a su contenido de flavonoides. Se obtuvieron extractos de polaridad decreciente utilizando los siguientes solventes: agua acidificada, metanol, acetona y acetato de etilo;. los flavonoides se cuantificaron con el método de. formación de complejos con AlCl3 al 5 %. La actividad antioxidante de los extractos se determinó por la técnica de decoloración del radical libre 2,2-difenil-1-picrilhidracilo 16.
(31) CAPÍTULO I: REVISIÓN BIBLIOGRÁFICA (DPPH•). Los valores de flavonoides oscilaron entre (32,18 ± 1,39) y (96,63 ± 1,14) mg de quercetina/g de extracto. La actividad antioxidante expresada como concentración inhibidora media (IC50) mostró los siguientes resultados: Tetsukabuto (117,69 ± 5,81), C. mixta Pangalo (77,75 ± 3,64), C. moschata (110,67 ± 1,70), C. maxima Duchesne (87,39 ± 8,64) (mg/ml). De los resultados obtenidos se observa una clara relación entre el contenido de flavonoides con actividad antioxidante. (66). .. El aislamiento de un flavonoide de tipo flavona, derivado de la Apigenina a partir del extracto metanólico de Alchornea coelophylla (Euphorbiaceae) a través de técnicas cromatográficas. El compuesto se cuantificó con el método de formación de complejos con AlCl3.L actividad antioxidante se determinó capacidad captadora de radicales libres: ensayo de ABTS, ensayo de DPPH, Actividad antioxidante (A.A.) como equivalentes TROLOX. El compuesto aislado mostró un buen perfil de actividad antioxidante, exhibiendo actividades de 96.1% y 100% para las técnicas de DPPH· y ABTS y con valores de IC50 de 1.28x10-5 μg/mL y 141.9 μg/mL, respectivamente. (67). .. En este estudio determinaron el contenido de flavonoides totales en plantas de guayabo (Psidium guajava L.). La extracción se realizó con ultrasonido empleando 0,5g de muestra seca y una mezcla metanol:agua (80:20% v/v). Para la cuantificación por espectrofotometría de absorción UV-VIS, se utilizó como estándar la catequina. Los resultados mostraron mayor contenido flavonoides (2.845,21 mg catequina.100 g-1 muestra seca) en hojas jóvenes en comparación con las recientemente maduras (1.705,83 mg catequina.100 g-1 muestra seca), destacándose la hoja joven como el mejor estado fenológico de la hoja para la cuantificación de flavonoides totales en plantas de guayabo(68). Por otra parte los ácidos grasos están presentes en las plantas medicinales constituyendo metabolitos de interés en el ámbito farmacéutico y nutricional, por el aporte que realizan ambos en estos ámbitos. Existen Múltiples beneficios e indicaciones que poseen los ácidos grasos Omega 6 y 3 para la salud humana, entre los que se destacan: Enfermedades cardiovasculares (los ácidos grasos omega-6 pueden ayudar a combatir el colesterol y los triglicéridos, enfermedades inflamatorias: (pueden sernos de gran ayuda en caso de enfermedades como la artritis reumatoide ya que reducen los niveles de prostaglandinas que son las responsables de muchos 17.
(32) CAPÍTULO I: REVISIÓN BIBLIOGRÁFICA procesos inflamatorios), diabetes (los ácidos grasos Omega 6 ayudan a tener unos niveles de insulina más estables). En los últimos años se ha demostrado la relación directa de los procesos oxidativos en estas enfermedades y existen reportes que relacionan el aporte de los ácidos grasos por su acción antioxidante (69).. 1.4. Actividad Antioxidante 1.4.1. Generalidades de Radicales Libres Los Radicales Libres (RL) son moléculas que en su estructura atómica presentan un electrón no apareado (aquél que ocupa una órbita atómica o molecular por sí mismo), pueden existir de forma independiente y debido a la inestabilidad de su configuración electrónica, son generalmente muy reactivos. Esta reactividad es la base de su toxicidad y de su corta vida media(70, 71). Los RL son elaborados continuamente como un producto del metabolismo normal de cada célula e inactivados por un conjunto de mecanismos (unos enzimáticos y otros de atrapamiento). Son componentes normales de células y tejidos, existiendo una poza de RL particular en cada estirpe celular y en algunos tipos celulares permiten la mejor adaptación a su hábitat. Al elevarse o disminuir las concentraciones fisiológicas de las especies reactivas de oxígeno, puede acarrear importantes alteraciones funcionales (72, 73). . En los sistemas vivos se generan muchos tipos de radicales libres, siendo los más. conocidos los radicales del oxígeno. Se utiliza el término Especies Reactivas del Oxígeno (ROS, siglas en ingles de reactive oxygen species,) como nombre colectivo para referirse a las especies derivadas del oxígeno, incluyendo tanto los derivados radicales como los no radicales, que son agentes oxidantes y/o fácilmente convertibles en radicales (la presencia de un ―·‖ en una especie reactiva indica que ésta posee un electrón no apareado, es decir, que es un radical). De forma análoga existen Especies Reactivas del Nitrógeno (RNS, siglás en inglés de reactive nitrogen species), del Cloro (RClS) y del Bromo (RBrS). (74). . El desbalance entre la producción de las especies. reactivas del oxígeno (EROS) y la defensa antioxidante provoca un daño orgánico conocido como estrés oxidativo, que lleva a una variedad de cambios fisiológicos y bioquímicos los cuales ocasionan el deterioro y la muerte celular.. 18.
(33) CAPÍTULO I: REVISIÓN BIBLIOGRÁFICA Los dos grandes grupos de especies reactivas implicados en la biología redox son: las especies reactivas del oxígeno (ROS) y las especies reactivas del nitrógeno (RNS). Especies reactivas del oxígeno (ROS) fisiológicas(75) Radicales: Anión superóxido (O2·-), Hidroxilo (.OH), Alcóxido (RO·), Peróxido (ROO·) No Radicales: Peróxido de hidrógeno (H2O2), Ácido hipocloroso (HClO), Ozono (O3), Oxígeno singulete (1ΔO2) Especies reactivas del nitrógeno (RNS) fisiológicas(75) Radicales: Óxido nítrico (NO), Dióxido de nitrógeno (NO2) No Radicales: Peroxinitrito (ONOO-), Ácido nitroso (HNO2), Catión nitrosilo (NO+), Anión nitroxilo (NO-), Peroxinitritos alquilo (ROONO) Debido al propio funcionamiento del metabolismo aeróbico, pequeñas cantidades de ROS se generan constantemente en el organismo, la mayoría a partir de las cadenas de transporte de electrones. Destacan el radical hidroxilo (·OH), el anión superóxido (O2·-), el oxígeno singulete (1ΔO2) y el peróxido de hidrógeno (H2O2). Nuestro organismo está expuesto a una gran variedad de ROS y RNS que pueden generarse a partir de fuentes endógenas, relacionadas con el metabolismo del oxígeno y con las diversas reacciones de defensa de nuestro sistema inmunitario, o de fuentes exógenas, como el tabaco, la contaminación del aire, la radiación ultravioleta, el ozono y ciertos medicamentos(76). Aunque la exposición a las ROS procedentes de fuentes exógenas sea extremadamente elevada, la exposición a fuentes endógenas es mucho más importante y extensa, debido a que es un proceso que se da de forma continua en las células de nuestro organismo a lo largo de la vida(77). 1.4.2. Daños producidos por los Radicales Libres Los RL, a pesar de que, hasta cierto punto, resultan necesarios en el mantenimiento de la homeostasia celular, han dado explicación a los mecanismos de acción tóxica de una gran cantidad de compuestos. Debido a la diversidad estructural de los RL que se pueden generar y a sus diferentes propiedades, es difícil generalizar sus efectos biológicos; ya que los mismos variarán en dependencia del sitio de formación del radical, del tiempo de vida media del radical y de la naturaleza de la molécula diana con. 19.
(34) CAPÍTULO I: REVISIÓN BIBLIOGRÁFICA que interactúe. Las macromoléculas y las membranas celulares son particularmente vulnerables al daño(78, 79). Cuando el organismo se ve desbordado por un exceso de RL, prácticamente cualquier estructura biológica que lo integra (ADN, ARN, proteínas, carbohidratos y lípidos) puede convertirse en diana de la acción de estas especies reactivas y resultar dañada (80). . El daño causado por el ataque de ROS y RNS puede originar lesiones en el ADN,. pérdida de función de enzimas, incremento de la permeabilidad celular, disrupción de la señalización en la célula y, en ocasiones, muerte celular por necrosis o apoptosis (81). Por este motivo, es común relacionar el daño provocado por las diversas especies reactivas con la fisiopatología de varias enfermedades como el cáncer (78, diabetes(83,. 84). 82). , la. y enfermedades pulmonares como la enfermedad pulmonar obstructiva. crónica y la sarcoidosis(85); enfermedades cardiovasculares(78,. 86). neurodegenerativos como el Alzheimer(87) y el Parkinson(87,. ; enfermedades. ; desórdenes. 88). hepáticas(89) ; colitis ulcerativa(90); ateroesclerosis(91); artritis reumatoide(86) entre otros procesos inflamatorios(78, 86); procesos autoinmunes y de inmunosupresión(86, 87). Es importante destacar que no todas las especies reactivas presentan la misma capacidad de reacción o son igual de reactivas. Ciertos compuestos como el H 2O2, O2·y NO·, reaccionan de forma relativamente selectiva con sólo ciertas moléculas biológicas in vivo, mientras que el radical ·OH es altamente reactivo, ya que reacciona instantáneamente con cualquier molécula que encuentra(75). 1.4.3. Agentes Antioxidantes. Definición. El término antioxidante fue utilizado inicialmente para referirse específicamente a un producto químico que previniera el consumo de oxígeno. A finales del siglo XIX y a principios de siglo XX, extensos estudios fueron dedicados a las aplicaciones de antioxidantes en importantes procesos industriales, tales como la prevención de la corrosión del metal, la vulcanización del caucho y la polimerización de combustibles en la formación de escoria en motores de combustión interna (77). Las primeras investigaciones sobre el rol de los antioxidantes en biología se centró en su uso en la prevención de la oxidación de grasas insaturadas, que es la causa de la rancidez. (92). ,. pero fue la identificación de las vitaminas A, C, y E como antioxidantes la que. 20.
(35) CAPÍTULO I: REVISIÓN BIBLIOGRÁFICA revolucionó este campo y condujo a dilucidar la importancia de los mismos en la bioquímica de los organismos vivos(93). En las células vivas, existen varias líneas defensivas contra el daño oxidativo de los RL y de las especies reactivas del oxígeno y del nitrógeno. Dentro de los metabolitos con estas funciones están: el ácido abscórbico (vitamina C), el glutatión, el ácido lipoico, el ácido úrico, los carotenos y el α- tocoferol (vitamina E); y existen además enzimas y sistemas enzimáticos como la superóxido dismutasa, la catalasa, las peroxirredoxinas, el sistema de la tiorredoxina y el del glutatión, que incluye la glutatión reductasa, la glutatión peroxidasa y la glutatión transferasa(94). Todos ellos, en condiciones normales, evitan que los RL y las especies reactivas sean formadas, o las eliminan antes de que puedan dañar los componentes vitales de la célula, siendo entonces antioxidantes ―naturales‖ o ―propios‖ del organismo. No obstante, en situaciones de estrés oxidativo, como se planteó anteriormente, el organismo requiere de una mayor cantidad de agentes antioxidantes de los que puede producir, de ahí la importancia que se le ha dado a las aproximaciones que pretenden descubrir nuevos compuestos con esta propiedad biológica. Gutteridge y Halliwell definieron ―antioxidante‖ como ―cualquier sustancia que, cuando está presente a bajas concentraciones respecto a las de un sustrato oxidable, retrasa o previene significativamente la oxidación de este sustrato‖(95). La definición enfatiza la importancia de la diana estudiada (sustrato oxidable) y la fuente de especies reactivas (RS) usada cuando se examina la actividad antioxidante. Dado que la definición no tenía en cuenta ciertos sistemas como el sistemas de reparación (del ADN o de residuos de proteínas) o inhibidores de la generación de RL, se simplificó la definición a ―cualquier sustancia (o acción) que retrasa, previene o elimina el daño oxidativo de una molécula diana‖(78). Los antioxidantes pueden actuar en los diferentes procesos de la secuencia oxidativa y tener más de un mecanismo de acción(96). Para que un antioxidante (AH) tenga actividad antiradicalaria debe cumplir una característica básica que es generar un radical más estable y menos dañino (RH) después de reaccionar con la especie radical (R·)(97). Esta reacción se basa en una transición redox en la que está implicada la donación de un electrón (o un átomo de hidrógeno) a la especie radicalaria. Como 21.
(36) CAPÍTULO I: REVISIÓN BIBLIOGRÁFICA resultado de esta transferencia, se formará un radical derivado del antioxidante (A·) que puede tener carácter inerte, estable o presentar cierta reactividad(98). Para caracterizar la acción antioxidante de un compuesto, lo primero que se debe concretar es cómo el antioxidante ejerce su actividad, ¿actúa directamente?, es decir, mediante el secuestro de ROS o inhibiendo su generación, o ¿está actuando de forma indirecta?, es decir, por ―up-regulation‖ de las defensas antioxidantes endógenas. Para evaluar la acción directa de los antioxidantes, que es probablemente la más común in vivo, es importante plantearse y responder a ciertas preguntas(95). ¿A qué biomolécula está protegiendo el antioxidante? y ¿es suficiente la cantidad de antioxidante que alcanza a esa diana in vivo? ¿Cómo ejerce su actividad protectora el antioxidante, por el secuestro de ROS, previniendo su formación, o reparando el daño que han producido? Si el mecanismo de actuación del antioxidante es por secuestro de ROS ¿es posible que los radicales derivados de la actividad del propio antioxidante causen algún tipo de daño por sí mismos? ¿Puede el antioxidante causar daños en otros sistemas biológicos? Otros dos puntos importantes en la evaluación de la actividad antioxidante son: -que el compuesto debe utilizarse a concentraciones ―reales‖, es decir, alcanzables in vivo y que se deben usar ROS biológicamente relevantes como el anión superóxido (O2·-), el peróxido de hidrógeno (H2O2), el radical hidroxilo (·OH), radicales peroxilo (ROO·), peroxinitritos y el oxígeno singulete (1ΔO2). 1.4.3.2. Métodos para evaluar la actividad antioxidante. La actividad antioxidante es ampliamente utilizada como parámetro para caracterizar diferentes materiales vegetales. Esta actividad se relaciona con compuestos capaces de proteger un sistema biológico del efecto potencialmente dañino de procesos que causan excesiva oxidación, involucrando especies reactivas del oxígeno. Existen diversos métodos para la evaluación de la capacidad antioxidante de muestras biológicas. Algunos de ellos utilizan la producción de un radical orgánico o especies reactivas del oxígeno y otros se basan en la oxidación-reducción de iones metálicos(99). La actividad antioxidante es ampliamente utilizada como parámetro para caracterizar diferentes materiales vegetales. Esta actividad se relaciona con compuestos capaces. 22.
(37) CAPÍTULO I: REVISIÓN BIBLIOGRÁFICA de proteger un sistema biológico del efecto potencialmente dañino de procesos que causan excesiva oxidación, involucrando especies reactivas del oxígeno. Los métodos que se utilizarán en este trabajo son ampliamente empleados por diferentes investigadores, el potencial antioxidante de los extractos de plantas, debido a su compleja composición química, debe evaluarse por dos o más métodos que den fe del efecto antioxidante total de los vegetales(100, 101). I.. Actividad secuestradora del radical libre DPPH· (2,2-difenil-1picrilhidracilo):. Se basa en la reducción del radical por captación de un átomo de hidrógeno al añadir el antioxidante. Se emplea sobre todo para determinar la eficacia antiradicalaria de compuestos fenólicos(101, 102). (OHINISHI, 1994)(103). Evaluó la actividad de compuestos específicos o extractos usando el radical libre estable 2,2-difenil-1-picrilhidracilo (DPPH•) en una solución metanólica y acuosa. La reducción del DPPH• se monitorea por la disminución en la absorbancia a una longitud de onda característica. En su forma de radical libre, el DPPH• absorbe a 517 nm y cuando sufre reducción por un antioxidante, esta absorción desaparece. En consecuencia, la desaparición del DPPH• proporciona un índice para estimar la capacidad del compuesto de prueba para atrapar radicales. El modelo que explica la actividad de un compuesto como antirradical se ejemplifica con la siguiente ecuación: Donde AH es un antioxidante que actúa como antirradical donando átomos de hidrógeno, dando como resultado radicales con estructuras moleculares estables que detendrán la reacción en cadena, tal es el caso de los fenoles. El nuevo radical formado (A˙) puede interactuar con otro radical para formar moléculas estables (DPPHA, A-A). La reacción entre el DPPH• y un compuesto depende de la conformación estructural del mismo, por lo que las comparaciones cuantitativas no siempre son apropiadas. Este método de neutralización del radical libre 2,2-difenil-1-picrilhidracilo (DPPH) es estable y con él se mide la capacidad de secuestro de cualquier compuesto con actividad antioxidante. La reacción química consiste en que el radical libre DPPH sustrae un átomo de hidrógeno proveniente de un donador (compuesto químico puro o 23.
(38) CAPÍTULO I: REVISIÓN BIBLIOGRÁFICA extracto), producto de este cambio se desarrolla un cambio de color, de violeta a amarillo, al disminuir la concentración del radical libre; esta intensidad es leída en el espectrofotómetro después de un tiempo de 30 minutos de reacción.. II.. Ensayo de la fuerza antioxidante reducida del ión férrico (FRAP). Este método es mayormente conocido por sus siglas en ingles FRAP, fue desarrollado como metodología por Benzie y Strain (1996)(104), con el objetivo de estimar la capacidad de reducir el ion férrico que contiene el plasma, como medida de su estado antioxidante. En este método se determina la cantidad del catión férrico que se reduce a ferroso en presencia de un agente acomplejante, el denominado TPTZ (2,4,6tri(pyridyl)-1,3,5-triazine). El complejo de TPTZ y el hierro III actúan con las sustancias antioxidantes obteniéndose como producto un ion complejo de hierro II, TPTZ y sustancias oxidadas. Este ion complejo [Fe(TPTZ)2]2+ resultante es de color azul intenso y tiene una absorción máxima a 595 nm. Este ensayo es llevado a cabo a pH acido (pH 3,6)(105). III.. Actividad Quelante:. En el ensayo para determinar la capacidad antioxidante de un compuesto basándose en la propiedad de quelación de metales, la Ferrozina al unirse al hierro (Fe2+) produce un complejo de color violeta. En presencia de un agente quelante (compuesto antioxidante), la formación de este complejo se ve interrumpida y como consecuencia de ello el color violeta del complejo disminuye hasta tomar un tono rojizo. En este ensayo se suele emplear como compuesto de referencia el etilen diamin tetra ácido. 24.
(39) CAPÍTULO I: REVISIÓN BIBLIOGRÁFICA acético (EDTA). Con un máximo de 652 nm donde una incremento de la absorbancia indica la significancia de la capacidad antioxidante del compuesto en cuestión (101, 106). IV.. Determinación de la capacidad antioxidante total por el método del molibdato de amonio (TAOC).. En la determinación de la actividad antioxidante de un compuesto natural ha sido empleado en múltiples ocasiones el método del fosfo-molibdato. Este ensayo refleja la capacidad de un sistema de defensa antioxidante no enzimático. Este es un método espectrofotomérico que se ha desarrollado para la determinación cuantitativa de capacidad antioxidante total de un compuesto. Está basado en la reducción de molibdeno VI (Mo6+) a fosfato/Mo5+ con la consiguiente formación de un complejo de color verde y un pH ácido. Con un máximo de absorción a los 695nm y empleando como patrones a la vitamina E o al ácido ascórbico (vitamina C) (107). En él, un incremento en los valores de la absorbancia indica que la muestra posee una significativa capacidad antioxidante(108, 109).. 25.
(40) CAPITULO II Materiales y Métodos.
(41) CAPÍTULO II: MATERIALES Y MÉTODOS CAPÍTULO II: MATERIALES Y MÉTODOS 2.1. Tipo de estudio. Se realizó un estudio experimental en el Departamento de Farmacia, Facultad Química – Farmacia de la Universidad Central ―Marta Abreu‖ de Las Villas, en el período comprendido entre los meses de febrero y junio de 2016. La realización del estudio se llevó a cabo en tres etapas: 1°. Obtención del material vegetal y determinación del contenido fenólico. 2°. Evaluación in vitro de la actividad antioxidante. 3°.. Relación. del. contenido. fenólico. con. la. actividad. antioxidante. 2.2. Extractos, equipos y reactivos. Equipos, instrumentos de medición. Balanza analítica digital (Sartorius, BS–124S, Alemania) Balanza técnica digital (Sartorius TE 12000, Alemania) Baño ultrasónico, BRANSON 1510, México. Cristalería de laboratorio. Roto evaporador, EYELAN 1000, Japón. Espectrofotómetro UV-VIS, Termo electrón, Genesys 10UV, Estados Unidos. Cromatógrafo Gaseoso, Agilent 6890N series, EE.UU. Estufa, BINDER Filtro miliporo de 0,45 μm, MILLEX-HA Micropipetas de 5, 20, 100, 1000 μL, EPENDORF, Alemania. Micropipetas de 5 mL, EPENDORF, Alemania. Molino de cuchilla de 5 pulgadas (Chisty & Norris) Zaranda MLV-THYS2, Alemania.. Reactivos más utilizados: Metanol, Lichrosolv, Merck Ácido Sulfúrico, Panreac. Heptano, Panreac 26.
(42) CAPÍTULO II: MATERIALES Y MÉTODOS Hidróxido de potasio, Panreac Tiosulfato de sodio, Merck Tolueno, Panreac Bicarbonato de potasio, Merck 1,4-Cineol, SIGMA- ALDRICH 1,8-Cineol, SIGMA- ALDRICH 2,2- difenil-picril-hidracilo(DPPH),SIGMA- ALDRICH. 2,4,6 Tripiridil-s-triazina, ACROSS-ORGANICS10 M. Ácido acético UNI-CHEM Acido Ascórbico UNI-CHEM Acetato de sodio, UNI-CHEM. Ácido clorhídrico, UNI-CHEM. Ácido sulfúrico, UNI-CHEM. Acetaldehído, SIGMA- ALDRICH Acetona, UNI-CHEM. Alcanfor, SIGMA- ALDRICH Agua desionizada y destilada. Bicarbonato de potasio, UNI-CHEM. Carbonato de sodio, MERCK. Carvacrol, SIGMA- ALDRICH Cloruro de sodio, UNI-CHEM. Cloruro férrico, MERCK. Carbón activado UNI-CHEM. EDTA, UNI-CHEM Ferrizine, SIGMA- ALDRICH Fosfato sódico, RIEDEL-de Haĕn. Molibdato de Amonio, REACHIM. N-hexano, MERCK. Hidróxido de potasio, Panreac. Rutina, ACROS- ORGANICS. Reactivo Folin-Ciocalteau (FCR), SIGMA –ALDRICH. Sulfato de sodio anhidro, UNI-CHEM. Salicilato de metilo, SIGMA- ALDRICH Terpinene, ACROS ORGANICS Timol, SIGMA- ALDRICH Tolueno, Scharlau. Tricloruro de aluminio, MERCK. Tocoferol, SIGMA. Quercetina, ACROS-ORGANICS. Polvo de piel, SIGMA- ALDRICH Pirogalol, ACROS-ORGANICS. 27.
(43) CAPÍTULO II: MATERIALES Y MÉTODOS. 2.3. Obtención y determinación del rendimiento de extractos secos obtenidos a partir de las hojas de Mosiera crenulata. Los extractos objetos de análisis se obtuvieron a partir de las hojas de la Mosiera crenulata, la identificación taxonómica del material vegetal se realizó en el lugar de colecta por el especialista Julio Pavel García-Lahera, se secó el material vegetal de las hojas en la estufa durante 3 días a 30 oC para su evaluación analítica. Se utilizó, en todos los procedimientos desarrollados, cristalería específica de laboratorio, previamente descontaminada, empleando reactivos de calidad analítica y equipos certificados como aptos para el uso. Las hojas de Mosiera crenulata fueron recolectadas en horas de la mañana en procedentes Casilda municipio Trinidad, provincia Sancti Spíritus, Cuba, en el mes de febrero de 2016. La identificación taxonómica del material vegetal se realizó en el lugar de colecta por el especialista Julio Pavel García-Lahera. El material recolectado fue trasladado en bolsas de nylon al Laboratorio de Química Farmacéutica y lavado con abundante agua potable. El material, se sometió a un proceso de secado en la estufa a 30°C y posteriormente se trituró con un molino de cuchillas con un tamiz de talla 3 mm a 4750 rpm.. 2.3.1. Metodología de obtención y almacenamiento de los extractos Se pesaron 10 g de muestra (polvo seco de las hojas) y se realizaron extracciones con 100 mL de metanol, acetato de etilo y n- hexano, a temperatura ambiente, con agitación en Zaranda durante 24h, realizándose separadamente 2 extracciones bajo las mismas condiciones. Los extractos se combinaron y se eliminó la clorofila por tratamiento con carbón activado 1% (1 g por 100 mL de extracto(110). Los extractos se filtraron y se evaporó el solvente por rotoevaporación.. 28.
Figure


Documento similar
Fuente de emisión secundaria que afecta a la estación: Combustión en sector residencial y comercial Distancia a la primera vía de tráfico: 3 metros (15 m de ancho)..
Debido al riesgo de producir malformaciones congénitas graves, en la Unión Europea se han establecido una serie de requisitos para su prescripción y dispensación con un Plan
Abstract: This paper reviews the dialogue and controversies between the paratexts of a corpus of collections of short novels –and romances– publi- shed from 1624 to 1637:
E Clamades andaua sienpre sobre el caua- 11o de madera, y en poco tienpo fue tan lexos, que el no sabia en donde estaña; pero el tomo muy gran esfuergo en si, y pensó yendo assi
Habiendo organizado un movimiento revolucionario en Valencia a principios de 1929 y persistido en las reuniones conspirativo-constitucionalistas desde entonces —cierto que a aquellas
The part I assessment is coordinated involving all MSCs and led by the RMS who prepares a draft assessment report, sends the request for information (RFI) with considerations,
De hecho, este sometimiento periódico al voto, esta decisión periódica de los electores sobre la gestión ha sido uno de los componentes teóricos más interesantes de la
La campaña ha consistido en la revisión del etiquetado e instrucciones de uso de todos los ter- mómetros digitales comunicados, así como de la documentación técnica adicional de