Sistema de dosificación automático de inhibidor de corrosión en sistemas estacionarios no presurizados
Texto completo
(2) NDICE. Capítulo 1 Introducción 1.1 1.2 1.3 1.4 1.5 1.6. Motivación personal Origen del problema Antecedentes del problema Objetivo Estructura de la tesis Investigación futura. 3 3 4 6 6 7. Capítulo 2 Estado del Arte 2.1 2.1.1 2.1.2 2.2 2.2.1 2.2.2 2.2.3 2.2.4 2.2.5 2.2.6 2.2.7 2.2.8 2.3 2.3.1 2.3.2. Naturalez.a de la corrosión Factores que intervienen en la corrosión electroquímica Factores que estimulan la corrosión Tipos de daño por corrosión Corrosión uniforme Corrosión galvánica Corrosión por picaduras Corrosión en hendiduras Corrosión por influencia biológica Corrosión inducida por flujo Erosión corrosión Corrosión cavitación Métodos de protección Recubrimientos Protección catódica. 8. 9 9. 10 10 10. 11 11 12 12 12 12 13 13 15. Capítulo 3 Marco teórico Técnicas electroquímicas para el control y estudio de la corrosión 3.1 3.1. l Resistencia a la polariz.ación 3.1.2 Técnica de extrapolación de Tafel o de intersección 3.1.3 La técnica de ruido electroquímico. 21 21 25. 29. Capítulo 4 4.1 Selección del sistema de control 4.2 Teoría de Control 4.2.1 Control de lazo abierto 4.2.2 Control de lazo cerrado 4.2.3 Transitorios que producen perturbaciones 4.2.4 Frecuencia del transitorio 4.2.5 Respuesta a la frecuencia 4.2.6 Estabilidad y comportamiento de un control automático 4.2. 7 Arquitectura de los microcontroladores vis procesadores. 33 33 33 33 34 34 34 35 35. 1.
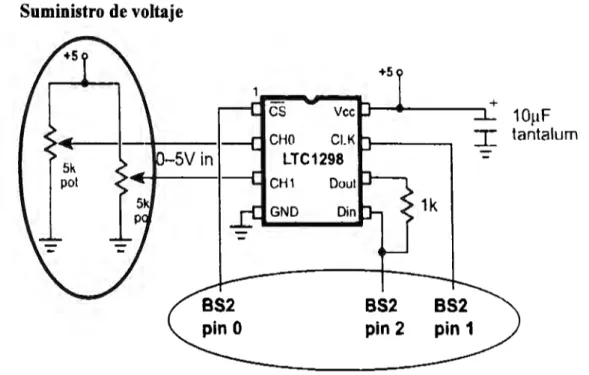
(3) 4.3 Ciclo de programa 4.3.1 4.3.2 4.3.3 4.3.4 4.3.5. Operaciones de Gestión del Sistema Lectura del estado de las entradas Ejecución del programa del Control Lógico Programable Escritura de las salidas Consideraciones en tomo a la ejecución del ciclo de programa. 38 38 38 38 38 39. 4.4 Sistema de Control Seleccionado. 39. 4.4.1 4.4.2 4.4.3. 40. Arquitectura del Basic Stamp 2 Montaje del microcontrolador en la tarjeta de educación Servomotores para simulación del sistema. 39 41. Capítulo 5. 5.1 Introducción 5.2 Estructura del sistema de control. 42 42. 5.2.1 5.2.2 5.2.3. 43 43. El potenciómetro El microcontrolador El Servomotor. 5.3 5.4. 44. Desarrollo experimental Condiciones de la prueba 5.5 Arreglo de la celda electroquímica 5.6 Componentes de la celda electroquímica 5.7 Gráficas generadas por el potenciostato 5.8 Adecuaciones requeridas para la adquisición de señales analógicas 5.9 Arreglo del convertidor 5.10 Listado de programas cargados al microcontrolador. 44. 49. 5.10.1 Listado de programa arranque paro ( Programa 1) 5.10.2 Listado de programa arranque retardado ( Programa 2). 50 51. 44 44 45 46. 47 48. Capítulo 6. 6.1 6.2 6.3 6.4 6.5 6.6. Introducción Interfaz con el usuario Personalización del programa (Secuencia, arranque y paro) Función del programa Personalización del programa (Secuencia encendido con retardo) Función del programa. 6. 7 6.8 6. 9 6.1 O 6.11. Recursos involucrados Recomendaciones para la implementación del sistema Aplicaciones industriales del sistema Costo del sistema propuesto y ventajas v/s uso de PLC Conclusiones. Bibliografia Anexos Normas aplicables. 53 53 54 54. 55 55 55 56 56 57 58 59. 60 2.
(4) CAPITULO 1 INTRODUCCIÓN 1.1 Motivación personal El motivo principal para la realización de este trabajo obedece, al interés de consolidar la aplicación de los principios teóricos, mediante la solución de un problema en particular que dada su naturaleza represente un reto técnico académico, que al ser solucionado, su repercusión ostente un beneficio tangible en la dinámica social; siendo un beneficio económico el que se plantea en este documento. Otro motivo obedece a evidenciar de manera escrita el desarrollo de actividades de investigación teórica y experimental que fonnan parte del programa académico de las maestrías que dirige la EGIA (Escuela de Graduados de Ingeniería y Arquitectura) del Tecnológico de Monterrey, Campus Ciudad de México. En el ámbito profesional, la realización de una tesis aporta conocimientos importantes a la formación del futuro maestro en ciencias en el área de metodología de la investigación, área importante del conocimiento que después de ejercitada, se puede afinnar, que es conocimiento que produce conocimiento. El desarrollo de la tesis contiene los fundamentos teórico-prácticos que enuncien la forma de implementar un sistema capaz de procurar condiciones favorables para reducir los efectos negativos de la corrosión, en los materiales de los que están construidos los recipientes de contención de fluidos. Es importante el contrarrestar los efectos negativos de la corrosión en estos recipientes, ya que estos fonnan parte de los elementos mas costosos y vitales dentro de los equipos de proceso que conforman las instalaciones que componen las obras de infraestructura de un país.. 1.2 Origen del problema Los problemas derivados del daño por corrosión, tienen un impacto importante en la dinámica económica mundial. En general, los costos por corrosión en muchos de los países que encontramos en la tabla 1.1 se encuentran ubicados en un rango que va del 2 - 4% de producto interno bruto. [3] País. Año. Inglaterra Australia China Estado Unidos Union Soviética Alemania Canadá. 1970 1982 1986 1975 1969 1969 1991. Costo de corrosión (Billones de dólares) 3.2 (3% OF GDP). 4%GDP 70 (4.2%GDP) 6.7 (2% GDP) 6.0 ( 3%GDP) 3.475(0.52%GDP). Tabla 1.1 Porcentaje de participación del producto interno bruto en gastos asociados a daños por corrosión.. 3.
(5) Un estudio realizado por la NACE, "Asociación Nacional de Ingenieros de Corrosión" presentó un análisis detallado, de las ramas y sectores industriales más afectados por la corrosión. En Estados Unidos este estudio reveló que en el año de 1998 los costos directos ascendieron a 276 Billones de dólares, representando un 3.1 % del producto interno bruto. [19] Cabe señalar que el realizar estudios de esta naturaleza implicaron estudios que implican costos importantes, y sobre todo la cooperación y coordinación de dependencias sectoriales especializadas que agrupan y clasifican los costos asociados al giro al cual se asocian.[6] Tomando como referencia la información con la que se cuenta de otros países a lo largo de algunos años. Se observa que el dato que relaciona porcentaje de participación del producto interno bruto asociado a los costos directos por corrosión se mantiene constante dentro de un rango que va de un 2 a 4%, lo cual es una cantidad muy cuantiosa para cualquier país. De lo anterior, asumimos que México aunque no tiene cuantificados los gastos en los que incurre en este rubro; las cantidades de recursos que se involucran a este respecto son importantes, y son susceptibles de ser reducidas.[3] 1.3. Antecedente del problema. En la actualidad, aún con los avances en el desarrollo de inluoidores. No existe un criterio o estándar de dosificación, que garantice la efectividad de la sustancia protectora de forma permanente en el sistema. Los proveedores sólo se limitan a recomendar volúmenes de disolución, asociados generalmente a una rutina que establece tiempos de aplicación promedio. [20] Si tomamos en cuenta que cada inhibidor fue diseñado para proteger dadas condiciones muy particulares de la aplicación. Como ejemplo de estas variables se pueden mencionar, la presión, la temperatura, el volumen, el pH , las condiciones de flujo "estático o dinámico" así como la ubicación geográfica precisa de la instalación. A continuación, se describe de manera general el repertorio de substancias inhibidoras que dependiendo de la combinación de variables del caso, se pueden aplicar para combatir efectivamente los efectos negativos de la corrosión. Definición de sustancia inhibidora. Substancias que se agregan en pequeñas cantidades a las fuentes de agua o cualquier otro fluido liquido o gas, para disminuir o evitar las reacciones de corrosión. Mecanismos de acción. o o o. Incrementar la Polarización del ánodo. Incrementar la Polarización del cátodo Incrementar la Resistencia Eléctrica del circuito por formación de depósitos en la superficie metálica.. 4.
(6) Tipos de lnhibidores. o o a a a a. Anódicos (Pasivadores) Catódicos Ohmicos Orgánicos De Precipitación En fase vapor. Naturaleza de acción de los inhibidores o Inhibidores tipo" veneno" Interfieren con las reacciones de reducción, ( sulfuros, seleniuros, arsénico, bismuto).Pueden provocar ampollamiento o fragilización por hidrógeno. a. Inhibidores de precipitación. Forman precipitados en la superficie Catódica, generalmente en función del pH; (carbonatos de calcio y magnesio, sulfato de zinc y sales de metales como antimonio, manganeso y níquel). a Inhibidores removedores de oxígeno Previenen la despolarización catódica provocada por el oxígeno, pueden ser inorgánicos (sulfito de sodio, S02) u orgánicos (hidrazina). a. Inhibidores ohmicos. Incrementan la Resistencia ohmica del circuito, por la formación de una película sobre la superficie Metálica. Pueden ser Anódicos, catódicos o combinados. a. lnhibidores Orgánicos. Este tipo de Inhibidores afectan la superficie total del Metal por adsorción sobre él y bloqueando las dos reacciones - anódica y catódica - . Pueden estar "cargados" positiva (aminas) o negativamente (sulfonatos). La eficiencia depende de la acción combinada con halógenos ( cloruros, bromuros, yoduros, fluoruros) y de la estructura y tamaño de la molécula. a. Inhibidores de Precipitación. Los inhibidores que inducen precipitación, son compuestos formadores de películas que interfieren con las reacciones anódicas y catódicas. Los más empleados son del tipo silicatos y fosfatos, los cuales requieren oxígeno para ser eficientes.. 5.
(7) [J. Inhibidores fase vapor. También llamados inhibidores volátiles de corrosión(VCI), son compuestos que son transportados a los sitios requeridos, por volatiliz.ación. En calentadores compuestos alcalinos (morfolina, octadecylamina) transportados a partir de líquidos. En espacios cerrados, como contenedores en barcos, sales de Carbonato, Benzoato, Nitritos, ciclohexilamina o imina de hexametileno son transportados de sólidos. En este momento es importante mencionar que cualquier modificación, alteración o cambio en las condiciones operativas consideradas originahnente, pueden ocasionar un abatimiento en la eficiencia de los productos de inhibición de la corrosión diseñados específicamente para cada caso, por lo que se deben vigilar continuamente las condiciones operativas imperantes. Los productos inhibidores se fabrican para dar solución a problemáticas específicas, pero no para solucionar problemas de corrosión interior bajo cualquier circunstancia [20] Cabe señalar, que no existe un producto inhibidor universal para la protección contra la corrosión interior de contenedores, por lo que se deben conocer con precisión las características que presenta cada sistema, a fin de contar con los productos idóneos para cada caso. [20] Por lo anterior, se establece que si se desea incrementar la eficiencia del método de aplicación de inhibidores en sistemas estáticos, es necesario contar con alguna herramienta que cuantifique la efectividad de la acción protectora, y que de detectarse alguna deficiencia en su función protectora, inmediatamente exista alguna acción correctiva. Que lleve al sistema en cuestión a un régimen protegido. Esto con el fin de garantiz.ar un periodo de vida útil mayor, que impacte de manera directa en la reducción de costos derivados del daño ocasionado por corrosión. 1.4. Objetivo. Diseflo y desarrollo de un sistema de control para la dosificación de inhibidor de corrosión para un contenedor de almacenamiento. 1.5. Estructura de la tesis. Capítulo 1 Introducción. En esta sección se esboza el objeto de la investigación así como su origen histórico e impacto tecnológico, se descnben las repercusiones económicas que en la actualidad modifican nuestro entorno. Como puntos interesantes en esta sección se pueden encontrar la delimitación del problema, la cual a su vez nos ayudó a establecer los objetivos importantes que se pretenderían alcanzar en una investigación futura. Capítulo 2 Fundamentos teóricos del fenómeno de corrosión. Esta sección recopila una revisión bibliográfica que describe los fundamentos teóricos inherentes al fenómeno de corrosión necesarios para comenzar la fase experimental. En esta sección es en donde mediante la evidencia teórica se comienza a delimitar las variables de estudio que se tomarán en cuenta para el desarrollo experimental.. 6.
(8) Capítulo 3 Técnicas electroquímicas para el control y estudio de la corrosión En esta sección se describen las técnicas actuales empleadas para el monitoreo de la corrosión en los sistemas industriales, y se describen los fundamentos teóricos de las técnicas electroquímicas para el control y estudio de la corrosión.. Capítulo 4 Sistema de control Este capítulo contiene los fundamentos teóricos del control industrial en su contexto general, y al final del capitulo se describe el sistema de control seleccionado que se propone para satisfacer la aplicación del algoritmo.. Capítulo 5 Desarrollo del sistema de control Se describe el sistema de control propuesto, se define al principio la información de referencia obtenida en la parte del desarrollo experimental que sirvió de base para el diseño del sistema, y que a su vez ilustra, el formato que muestra la forma en como la industria documenta la información relacionada con la naturaleza del fenómeno de corrosión. Más adelante se describen las adecuaciones requeridas para integrar algunos componentes periféricos de hardware que ofrecieran una solución para alcanzar el objetivo planteado al principio del trabajo. Se muestran un análisis detallado de los listados de programas necesarios para cumplir con el objetivo planteado.. Capítulo 6 Análisis de resultados En esta parte se analizan los resultados de algunas pruebas y se comentan las modificaciones necesarias si es que el arreglo que se propone, se quisiera implantar para el control de la corrosión en otro medio y de esta manera lograr la generalidad del alcance de este trabajo a otros casos similares.. 1.6. Investigación futura. Como se menciono en la sección 1.4 en lo que se refiere al objetivo de esta investigación un parámetro clave para la delimitación del problema de estudio fue la condición de que la experimentación se realizarán en condiciones estacionarias del fluido, y sin perturbaciones mecánicas que alteraran las condiciones de reposo así como el que el sistema se considerara en todo momento no presurizado. Como investigación futura, se plantea evaluar la misma propuesta experimentai con la diferencia de que el objeto de estudio sería el analizar el comportamiento del sistema en condiciones dinámicas del fluido es decir en tuberías, en donde posiblemente, se pudiera incluir la condición de presurizado.. 7.
(9) CAPITUL02 ESTADO DEL ARTE 2.1 Naturaleza de la corrosión. La corrosión es un ataque destructivo a los metales que puede ser de naturaleza quúnica directa, sólo se verifica en condiciones extraordinarias que comprenden un ambiente altamente corrosivo, o una elevada temperatura o ambas cosas. Son ejemplos, los metales en contacto con ácidos o álcalis concentrados y la formación de óxido de hierro por disociación del agua en contacto con tubos de caldera recalentados. Sin embargo, la mayoría de los fenómenos que comprenden la corrosión de metales que contienen agua o están sumergidos en ella, o su corrosión en la atmósfera por películas de humedad, son de naturaleza electroquímica (1] El mecanismo de la corrosión electroquímica se evidencia más en el caso de metales distintos acoplados eléctricamente como el cobre y el zinc sumergidos en agua de modo que el último forme el ánodo de una pila galvánica y el cobre el cátodo, la reacción se verifica en dos partes: [I] 1) La reacción anódica, durante la cual se disuelve el metal en el electro lito en forma de iones cargados positivamente. 2) La reacción catódica, en la que los iones cargado positivamente cubren con una capa de hidrógeno atómico la superficie catódica. Los electrones liberados por la reacción anódica circulan por el circuito metálico hasta el cátodo, donde neutralizan un número exactamente equivalente de iones de hidrógeno. El caso más común es el de un solo metal el cual la superficie es de polaridad heterogénea, formada por pequeñas y separadas zonas anódicas y catódicas tan estrechamente juntas que no se puedan distinguir. Pequeñas diferencias de potencial resultan de leves variaciones en la composición, en el acabado superficial, en los esfuerzos, en los depósitos o inclusiones, o bien por las diferencias de concentración del electrolito o de los solutos gaseosos en la fase liquida adyacente. La penetración prosigue en las zonas anódicas, produciendo una amplia variedad de picados, rugosidades y desgastes. La película de hidrógeno catódica y los precipitados anódicos insolubles son factores entorpecedores igualmente importantes que pueden utilizarse para retardar la corrosión.[l] Un índice de la fuerza impulsora de la reacción electroqwmi.ca es el potencial, o fuerza electromotriz, de la pila galvánica, el cual es la suma de los potenciales de las semipilas formadas por el ánodo y el cátodo y el agua que los rodea Estos potenciales son característicos del metal ( u otro material del electrodo ) y varían con el contenido iónico del electrolito, la temperatura y otros factores. El potencial de los electrodos se califican fijando, por convención, la concentración de equilibrio de los iones metálicos en I molar( un mol por litro); sólo pueden determinarse por mediciones cuando no circula corriente, en ausencia de la reacción de los electrodos. De otra manera, serían alterados mediante la polarización por un incremento conocido por sobre tensión y que está relacionado por las variaciones de energía en los electrodos. La sobre tensión de hidrógeno está asociada a la liberación de hidrógeno en el cátodo.[2]. 8.
(10) 2.1.1 Factores que intervienen en la corrosión electroquímica Metal. La tendencia de un metal a disolverse en agua, conocida por presión de solución, se mide por el potencial eléctrico (sin corriente) que tiene que ser aplicado para evitar toda acción cuando el metal está swnergido en una solución de una de sus sales a la concentración estándar o normalizada (1 molar).. Aunque en la práctica nunca se encuentran la concentración normalizada de las sales metálicas ni la ausencia completa de corrientes de polarización, esta serie enwnera, no obstante, a los metales en orden general, la tendencia de los metales a la corrosión. Cuando dos metales que están en contacto se swnergen en agua, el que está en la parte superior en esta serie se vuelve anódico, sufre la corrosión y protege al otro metal, por que lo vuelve catódico.. El electrolito es el factor dominante controlable. En el caso normal, el agua está en contacto con los metales, contiene impurezas, como sales, gases y vapores. Su actividad electrolítica es una función de los iones que aumentan su conductividad; por tanto, una salinidad elevada promueve la corrosión electroquímica. Es muy importante mencionar que el agua rara vez es neutra (pH = 7.0), sino que es, ya sea, ácida (pH inferior a 7.0) o básica (pH superior a 7.0).El exceso de iones hidrógeno que acompaña a un pH decreciente aumenta la fuerza de avance y la velocidad de reacción de la corrosión electroquímica; por tanto, los ácidos y las sales ácidas producen un ambiente corrosivo. A la inversa, un awnento en la concentración de iones hidroxilo ( pH alto) deprime la corrosión electroquímica y puede suministrar excelente protección, incluso sin la formación de película, por ejemplo cuando se agregan cáusticos, amoniaco o aminas a agua condensada, desmineralizada o suavizada por completo.[3]. Oxígeno. El oxígeno gaseoso disuelto en agua reacciona con el hidrógeno atómico protector que se las zonas catódicas de las superficies metálicas, destruye la película por encuentra sobre despolarización y permite que continúe la corrosión. La rapidez o intensidad de la corrosión está limitada, en general, por la velocidad de difusión del oxígeno disuelto hacia la superficie metálica y , como consecuencia, se produce un amplio ataque del oxígeno al nivel del agua o cerca de él. En la mayoría de los problemas de corrosión, el oxígeno disuelto es el que domina y muchos de ellos pueden resolverse por completo mediante la desaeración del agua por medios mecánicos, térmicos o químicos.[}]. 2.1.2 Factores que estimulan la corrosión Cualquier condición de falta de uniformidad dentro del metal, como la que puede originarse por un recocido o un trabajo en frío inadecuados, puede aumentar la heterogeneidad y la intensidad de las diferencias en polaridad; es obvio que el uso de metales desiguales puede ocasionar la corrosión de uno de ellos, como ocurre con los tubos de aluminio de los intercambiadores de calor que están adyacentes a las varillas de amarre de hierro en el grupo de tubos. La falta de uniformidad de las concentraciones en el electrolito produce células de concentración que favorece el ataque corrosivo. Es muy conocido que la falta de uniformidad en la distribución del oxígeno sean anódicas, en relación con las que están en contacto con una concentración elevada de oxígeno. Por tanto, la turbulencia y el aire arrastrado ocasionan corrosión en los extremos de entrada de los tubos de condensadores y sobre la lámina de los tubos. La despolarización de la película de hidrógeno por el oxígeno disuelto ocurre con más rapidez en unos metales que en otros; el zinc y el aluminio son menos activos que el hierro y se cataliza por la presencia de costras de laminado. 9.
(11) 2.2. Tipos de daños por corrosión. 2.2.1. Corrosión uniforme. Es la forma más común de corrosión y es caracterizada como la reacción química o electroquímica que forma parte de manera uniforme sobre la totalidad de la superficie expuesta. El metal se torna cada vez más delgado y eventualmente resulta en la perforación o falla del elemento. Para esta forma de corrosión se puede evaluar la tasa de corrosión por experimentación como el caso de sencillas inmersiones del material tipo en el medio en el que se desea analizar su comportamiento.. 2.2.2. Corrosión galvánica. Se genera cuando existen celdas de corrosión en las cuales un metal o parte de él, se comporta como Ánodo y otro metal o parte de él se comporta como cátodo. El comportamiento de un "par" se puede determinar de la serie electromotriz o de las series galvánicas específicas. El daño por lo general ''uniforme", implicando una pérdida relativamente homogénea en toda la superficie del ánodo.. o Factores de influencia Diferencia de potencial entre ánodo y cátodo. Esto se refiere a la posición que guarde cada uno de ellos en la escala de potenciales. Potasio Magnesio Berilio. Mayor energía de activación. Aluminio Zinc Cromo Acero Níquel Cobre. Plata. Menor energía de activación. Platino Oro. Relaciones geométricas de las zonas anódicas y catódicas, como factores geométricos podemos citar ciertas como: Área superficial del metal noble> Área del metal activo= Relación desfavorable Área del metal activo> Área del metal noble= Relación favorable. 10.
(12) a Factores de distancia. Entre más cercanos estén los electrodos el efecto galvánico será mayor; sin embargo este efecto es función de la conductividad del medio.. 2.2.3. Corrosión por picaduras. Ataque extremadamente locali7.ado que produce cavidades u hoyos de paredes paralelas y con un diámetro abierto a la superficie aproximadamente igual a su profundidad.Es un ataque ''sin pérdidas de peso" por lo que es dificil de predecir y generalmente se detecta hasta que el metal se perfora. Las picaduras generalmente nuclean en defectos de superficie, heterogeneidades estructurales, inclusiones, etc. En superficies "libres de defectos", las picaduras se inician por rompimiento de las películas pasivas, por acción mecánica, química y/o electroquímicas con el medio que rodea al material. Una vez nucleada, la picadura tiende a crecer muy rápido. a Mecanismo de disolución. Al disolverse la capa pasiva el metal se disuelve por una reacción anódica, generándose una elevada acidez en el fondo de la picadura debido a la hidrólisis de los iones disueltos. a. Mecanismo de tubo. Por interacción ente las paredes de la picadura y la superficie adyacente se genera hidróxido de sodio, el cual es oxidado por el oxígeno disuelto dando una mezcla de óxidos metálicos que crecen en forma anular.. 2.2.4. Corrosión en hendiduras. Ataque locali7.ado que se genera cuando un medio liquido es atrapado en el interior de discontinuidades del material. La discontinuidad debe ser abierta y grande como para permitir el ingreso del liquido (humedad) pero, suficientemente cerrada como para que no escape. Cabe mencionar que el liquido se considera como estancado. a. Rasgos particulares. 1.-0currencia de corrosión uniforme 2.-Desarrollo de reacciones electroquímicas. 2H20 + 02 + 4e = 40H. (catódica). 3.- Cada electrón liberado por la reacción anódica es consumido por la reducción de oxígeno. 11.
(13) 4.- El electrolito en el interior de la hendidura se va empobreciendo en oxígeno hasta que se agota, momento en que la reacción catódica se suspende. 5.- En el interior de la hendidura se produce un desequilibrio de carga, la concentración de iones positivos se incrementa y la reacción anódica continua. 6. - El balance de carga se logra por la migración de iones negativos (aniones) hacia el interior de la hendidura. 7.- Por la elevada acidez se rompe la película pasiva y se genera un proceso de ataque, auto catalítico.. 2.2.5. Corrosión por influencia biológica. a Corrosión biológica activa. Interacción química directa de organismos con materiales para producir nuevas reacciones químicas corrosivas o acelerar marcadamente los procesos de corrosión existentes. a Corrosión biológica pasiva. El material biológico (bio-masa), se comporta como material inerte, actuando como cualquier tipo de depósito.. 2.2.6. Corrosión inducida por flujo. Este tipo de corrosión esta asociada fundamentalmente a consideraciones de ''flujo de fluidos" y a la disponibilidad de especies requeridas para desarrollar las reacciones electroquímicas. Un aumento en la velocidad del fluido incrementará la velocidad de corrosión por: 1.- Remoción de películas protectoras 2.- Aumento en la velocidad de difusión de especies nocivas. 2.2. 7. Erosión corrosión. Proceso de degradación inducido por el flujo, que consiste en la remoción mecánica de películas protectoras por la acción del flujo y el posterior ataque electroquímico. Los factores de influencia en este caso particular de corrosión podemos citar entre otros: Flujo, transferencia de masa, temperatura, pH y oxígeno disuelto.. 2.2.8. Corrosión cavitación. Causada por la formación y colapso de burbujas de gas en un liquido. Remoción de películas protectoras por la "implosión" de las burbujas de gas, produciéndose ondas de choque que alcanzan esfuerzos de hasta 60 Ksi. El ataque es resultante de efectos hidromecánicos de líquidos en regiones de baja presión. 12.
(14) 2,3. Métodos de protección. Pueden deducirse,· asimismo, de la relaciones precedentes de los metales, electrólitos y oxígeno disuelto, con la corrosión electroquímica. Las medidas de protección incluyen el uso de ánodos de sacrificio, como zinc o magnesio, la aplicación de una fueIZa contraelectromotriz mediante diversos dispositivos de protección catódica y la pasivado de metales (es decir, tratarlos para reducir su solubilidad en los ácidos y la rapidez de precipitación de otros iones metálicos de las soluciones). El contacto con el electrolito se evita con diversos revestimientos protectores, sean aplicados o precipitados de la solución, como ocurre en el caso del carbonato de calcio, cromo hidratado y óxidos de hierro. [2] Otro método que se emplea en la actualidad y que es el método que se pretende emplear para la realización de la fase experimental de esta investigación; son la adición de inhibidores, que son sustancias que se agregan en pequeñas cantidades a las fuentes de agua o cualquier otro fluido -líquido o gas-, para disminuir o evitar las reacciones de corrosión.[4] 2.3.1. Recubrimientos. La forma más antigua de proteger a los metales contra la corrosión ha sido mediante la aplicación de recubrimientos los cuales lo aíslan de la acción directa de los ambientes corrosivos como suelo, agua y atmósferas agresivas.. o Pintura Empleada con fines decorativos; tiene como característica espesores menores a 50 µ. Como ejemplo de características distintivas de la pinturas tenemos. Mezclas de substancias líquidas buenas propiedades químicas y mecánicas, excelente adherencia Densidad de reticulado contra elasticidad. Secado contra curado. o Recubrimientos Anticorrosivos Los recubrimientos son los más empleados en el control de la corrosión y en realidad son un sistema, que consiste de: 1.- Un primario que debe tener buena adherencia, ser compatible con las capas subsecuentes y actuar como inhibidor. 2.- Un intermedio que actúa como enlace, incrementa espesor y aumenta la compatibilidad. 3.- Un acabado que da las propiedades o características finales requeridas. o Materiales poliméricos usados como recubrimientos La mayoría de los componentes en pinturas, lacas y barnices son polímeros los cuales se transforman en sólidos por la acción del secado y/o curado Los termoplásticos son polímeros de cadena lineal o entrecruzada pero no reticulada entre cadenas y tiene temperatura de fusión. 13.
(15) Los termo fijos se endurecen por la acción de la temperatura o agente acelerador y desarrolla una estructura reticular definitiva y no tiene temperatura de fusión. Los elastómeros pueden ser de origen natural o sintético y poseen cadenas lineales con gran capacidad elástica y con posibilidades de tener una estructura reticular controlada por el proceso de vulcanización.. o. Recubrimientos metálicos. Son metales, diferentes al sustrato, aplicados en capas delgadas, para dar resistencia a la corrosión y/o una mejor apariencia. Ejemplo de estos tipos tenemos: Galvanizado (Zinc) Cromado (Cromo) Niquelado (Níquel) Cadminizado ( cadmio) Estañado (Estaño) Aluminiz.ado (Aluminio). o. Métodos de aplicación de recubrimientos metálicos. Inmersión en caliente ( Galvanizado) Metalizado por proyección (Termo rociado) Chapeado (Alelad) Electrodepositación Electroforesis Depósito en vacío Evaporación de Metales Difusión Electrólisis Reducción de óxidos. o. Recubrimientos inorgánicos. Pueden ser ricos en zinc, vidrio y porcelana.. o. Ricos en zinc. Base silicatos inorgánicos y Zn metálico aplicación hasta 300° C, preparación superficial hasta metal blanco. • • •. Auto curante (base agua o solvente) Post Curado Orgánicos. 14.
(16) o • • • • •. 2.3.2. De conversión Proveen un perfil rugoso Dan apariencia especial Superficie fácil de lubricar Resistentes a la abrasión Fosfatado, cromatizado y anodizado. Protección catódica. o Historia de la protección catódica En 1824 Sir Humphrey Davy desarrolló la protección catódica al conectar electrodos de Fe y Zn para proteger el casco de Cu de barcos de madera. Sin embargo, hasta 1930 se reportaron avances en la protección catódica al registrarse mayor actividad en la explotación y el transporte de productos petroleros. En la actualidad, los usos y aplicaciones de la protección catódica se han generalizado desde reactores nucleares, puentes de concreto reforzado, barcos e instalaciones portuarias y hasta el automóvil, etc.. o Fundamentos de la protección catódica La protección catódica es el método más utilizado para proteger estructuras metálicas en contacto con aguas, suelos y electrolitos corrosivos. El :fundamento del método consiste en mantener la polarización del cátodo, aplicando una corriente externa, de tal manera que, ambos electrodos (ánodo y cátodo) alcancen el mismo potencial. La corriente se puede aplicar en dos formas distintas y/o combinadas, ya sea mediante ánodos galvánicos o bien por medio de una corriente impresa aplicada a través de un rectificador.. En principio, lo que se hace es crear una celda galvánica en la cual el metal a proteger actúe forzosamente como cátodo.. o Ánodos de sacrificio Los materiales metálicos que en la serie electroquúnica son más electronegativos que la estructura a proteger se conocen como ánodos de sacrificio o galvánicos. La diferencia entre el potencial natural del ánodo y el acero causa un flujo de corriente positiva en el suelo ( electrolito), del ánodo hacia la estructura metálica convirtiéndola en un enorme cátodo. Para el acero, los metales mas electronegativos en la serie electromotriz, se reducen a: Aluminio . . magnes10 y zmc. El intervalo de trabajo de los ánodos de sacrificio están limitados por la diferencia de potencial contra la estructura a proteger.. 15.
(17) a Propiedades de los materiales anódicos. Tener un potencial de disolución suficientemente negativo, como para polariz.ar la estructura [-0.85 V <Cu/ CuS04; Cobre/ Sulfato de Cobre), para Acero]. El potencial no debe ser muy negativo porque provocaría un gasto de corriente innecesario y puede producir hidrógeno. Debe presentar una tendencia pequeña a polarizarse (desarrollar películas protectoras). Fácil de adquirir y fundir en diferentes geometrías. Tener un elevado rendimiento eléctrico (ampere-hora 1Kg), lo que constituye la capacidad de drenado de corriente. Tener un costo razonable, de modo que, en conjunto con las características electroquímicas correctas pueda lograrse una protección adecuada a un bajo gasto de ampere-año a. Ventajas y desventajas de los ánodos galvánicos. Ventajas Independientes de fuentes de energía. Instalación relativamente sencilla.. No hay posibilidad de daño a estructuras vecinas, debido a la baja entrega de corrientes. Pueden ser unidos por "pernos" o soldados directamente a la estructura a proteger, evitando perforaciones. Sus conexiones se protegen catódicamente. No puede haber error en la conexión.. Desventajas La corriente disponible es limitada. Pueden resultar imprácticos en medios de alta resistividad, debido a la salida limitada de corriente. Su inspección requiere pruebas con instrumentos portátiles, en cada uno de los ánodos o entre pares adyacentes. Su vida útil varia con las condiciones del terreno.. Internamente, puede modificar condiciones de flujo, en sistemas de circulación.. a Pr:otección catódica a Fundamentos. Se caracteriz.an por la aplicación de una corriente directa o impresa a través de un transformador o rectificador de voltaje y se complementa con el empleo de ánodos inertes (no galvánicos). Con éste sistema se busca superar la resistividad del suelo para distribuir la corriente de protección hasta una distancia de 2 Km de una estructura enterrada con recubrimiento defectuoso o de hasta 50Km si el recubrimiento está en buenas condiciones.. 16.
(18) a Factores ambientales. El deterioro de metales en partes expuestas o en contacto con suelos, se atribuye a las propiedades del suelo sin considerar las corrientes inducidas por líneas eléctricas como el ferrocarril y el tranvía o torres de alta tensión. a Factores que relacionan la corrosividad del suelo. • • • •. Pobre aeración Altos valores de acidez Baja resistividad Contenido de sales minerales y humedad. a Características de instalación y operación. Toda conexión eléctrica entre la tubería enterrada y la cama de ánodos deberá estar muy bien aislada para evitar fugas de corriente. Nunca conectar la terminal positiva (+) del rectificador a la tubería o estructura enterrada, porque invertiría el proceso de protección y se acelera la corrosión del metal base. a Criterios de protección e inteñerencias. Los criterios establecidos sirven para evaluar la efectividad de un sistema de protección catódica y entre los más utilizados están las mediciones de potencial tubo-suelo y la determinación de la corriente de protección. También se utiliza la medición del potencial redox entre un electrodo de platino y otro de referencia Cu / CuS04 en el medio electrolítico húmedo. En cuanto a las interferencias o fugas de corriente, se hace una medición de continuidad eléctrica entre la estructura protegida y cualquier otra superficie o línea electrificada que pueda generar corrientes parásitas. a Corrientes de protección. La corriente necesaria para proteger catódicamente una estructura deberá ser de una magnitud que permitirá el control de la corrosión hasta un punto económicamente aceptable, porque depende de la agresividad del medio y si tiene o no un buen recubrimiento orgánico, etc. La corriente de protección se puede calcular teóricamente o se puede determinar en campo a prueba y error. a Diseño de sistemas de protección catódica. Para el diseño de un sistema de protección catódica se requiere de un mínimo de información previa concerniente a la estructura a proteger y al medio de exposición. Con la información previa desarrollada y con un mínimo de datos de resistividades se puede definir la localización de la cara de ánodos, tamaño tipo y cantidad de ánodos de sacrificio o la capacidad y número de rectificadores necesarios o fuente de suministro para la corriente de salida DC, etc.. 17.
(19) a Considenciones respecto a la est111ctun:. • Material de la estructura. • Especificaciones y propiedades del recubrimiento orgánico. • Características de construcción y dimensiones geométricas. • Mapas de localización y planos de detalles de construcción. • Localización de otras estructuras metálicas enterradas en las proximidades y sistemas de protección aplicados y líneas electrificadas que generen inducción de corrientes. • Información sobre fuentes de corriente AC de baja y media tensión para alimentación de rectificadores u otras fuentes alternas de energía. a Desventajas de la protección catódica con corriente impresa. • • • • • • •. Requiere potencia externa Voltaje y corriente de aplicación variable Mayor capacidad de swninistro de corriente de protección Aplicable en cualquier medio electrolítico Puede ser afectado por otros sistemas de protección o la proximidad de líneas electrificadas Aplicable para grandes áreas de exposición. Mantenimiento riguroso y caro. a Substancias inhibidons. Definición Substancias que se agregan en pequeñas cantidades a las fuentes de agua o cualquier otro fluido liquido o gas-, para disminuir o evitar las reacciones de corrosión. • Mecanismos de acción • Incrementar la polariz.ación del ánodo. • Incrementar la polariz.ación del cátodo • Incrementar la resistencia eléctrica del circuito por formación de depósitos en la superficie metálica. Tipos de inhibidores. • • • • • •. Anódicos (Pasivadores) Catódicos Ohmicos Orgánicos De Precipitación En fase vapor. 18.
(20) Inhibidores anódicos Causan grandes cambios en el potencial de corrosión hacia la región pasiva. En cantidades inadecuadas (generalmente menor a la requerida) pueden provocar "Picaduras" e incrementar la velocidad de corrosión. Dentro de este grupo existen los oxidantes y los no oxidantes. [6] Oxidantes: Actúan en ausencia de oxígeno, como los cromatos, nitratos y nitritos. No Oxidantes: Requieren de oxígeno, como fosfatos, tungstatos y molibdatos.. Inhibidores catódicos Disminuyen la velocidad de la reacción catódica dificultando la descarga de hidrógeno ( reducción de H2), o precipitan selectivamente en las áreas catódicas, incrementando la resistencia del circuito y restringiendo la difusión de las especies reducibles.Dentro de este tipo de inhibidores existen tres subtipos que se describen a continuación:. Inhibidores tipo " veneno" Interfieren con las reacciones de reducción, (sulfuros, seleniuros, arsénico, bismuto).Pueden provocar ampollamiento o &agilización por hidrógeno.. Inhibidores de precipitación Forman precipitados en la superficie catódica, generalmente en función del pH; (carbonatos de calcio y magnesio, sulfitto de zinc y sales de metales como antimonio, manganeso y níquel).. Inhibidores removedores de oxigeno Previenen la despolam.ación catódica provocada por el oxígeno, pueden ser inorgánicos (sulfito de sodio, SOi) u orgánicos (hidrazina).. Inhibidores ohmicos Incrementan la resistencia ohmica del circuito, por la formación de una película sobre la superficie metálica. pueden ser anódicos, catódicos o combinados.. Inhibidores orgánicos Este tipo de inhibidores afectan la superficie total del metal por absorción sobre él y bloqueando las dos reacciones - anódica y catódica - . Pueden estar "cargados" positiva (aminas) o negativamente (sulfonatos). La eficiencia depende de la acción combinada con halógenos ( cloruros, bromuros, yoduros, fluoruros) y de la estructura y tamaño de la molécula.. Inhibidores de precipitación Los inhibidores que inducen precipitació~ son compuestos formadores de películas que interfieren con las reacciones anódicas y catódicas. Los más empleados son del tipo silicatos y fosfatos, los cuales requieren oxígeno para ser eficientes. 19.
(21) a lnbibidores fase vapor. También llamados inhibidores volátiles de corrosión(VCI), son compuestos que son transportados a los sitios requeridos, por volatilización. En calentadores compuestos alcalinos (morfolina, octadecylamina) transportados a partir de líquidos. En espacios cerrados, como contenedores en barcos, sales de carbonato, benzoato; nitritos, ciclohexilamina o imina de hexametileno son transportados de sólidos. En contacto con la superficie metálica, el vapor condensa y se hidroliz.a, liberándose en compuesto inhibidor. Los compuestos deben tener una elevada volatilidad, como para llenar todo el espacio dispomble, pero no tan alta como para que se pierda por fuga a través de pequeños espacios abiertos. La compatibilidad con materiales ferrosos debe ser considerada cuidadosamente.. Técnicas de aplicación de los inhibidores Se clasifican de acuerdo a su aplicación o presentación. • • • • •. Inyección Continua Tratamiento ''Batch" Volatilización En recubrimiento Tratamiento "Esponja". 20.
(22) CAPITULO 3 MARCO TEÓRICO 3.1. Técnicas Electroquimicas para el Control y Estudio de la corrosión. 3.1.1. Resistencia a la Polarización Introducción. La resistencia a la polarización (Rp) o polarización lineal es una de las técnicas electroquímicas que ha sido más utilizada en los últimos 50 años. Con el paso del tiempo se han desarrollado herramientas experimentales que son más complejas que la RP , aportan información mecanicista e implican el uso de instrumentación costosa y sin embargo no han conseguido desplaz.ar a esta técnica de un lugar importante en el ámbito de la ingeniería de corrosión. Ciertamente tiene limitaciones. El conocimiento de las limitaciones de la RP y de sus ventajas y bondades, resultará en un uso correcto y una clara interpretación de los resultados que se obtengan al aplicar esta técnica en sistemas simples y complejos. Es importante conocer los pormenores de un método electroquímico que se ha empleado para determinar la velocidad de corrosión en sistemas tan diversos como el hormigón, pinturas y hasta en alimentos, lo que es demostración de la versatilidad de la RP • a Generalidades. Stem & Geary descnbieron que las pendientes guardaban una relación con velocidad de corrosión. Lo cual fue una nueva aproximación experimental al estudio de la electroquímica de los metales. La ecuación desarrollada por Stem & Geary toma el nombre de los investigadores y se presenta a continuación:. ( 3.1). ( 3.2). Donde: ba y be son las pendientes de Tafel anódica y catódica, respectivamente, y B la constante para pasar de la proporcionalidad a la igualdad.. La ecuación de Stem y Geary (3 .1) establece la relación entre la densidad de corriente de corrosión Cicorr), es decir, la velocidad de corrosión, con la resistencia a la polarización.. 21.
(23) Esta ecuación recuerda la conocida Ley de Ohm, donde se establece que la diferencia de potencial entre dos puntos resulta en un flujo de corriente limitado por la presencia de una resistencia. La constante Ben la ecuación (3.2) sirve para pasar de la proporcionalidad a la igualdad y presenta una. relación existente entre la pendientes de Tafel. Queda claro a partir de esta relación, que es indispensable que exista el comportamiento tafeliano en el sistema electroquímico, para que la ecuación de Stem y Geary pueda ser aplicable. Lo que se debe de hacer es realiz.ar la extrapolación de Tafel para determinar los valores de las pendientes anódica y catódica; en ocasiones basta saber que la velocidad de corrosión está aumentando en función del tiempo, por lo que sería suficiente conocer el comportamiento de la RP contra el tiempo de manera que, al ser inversamente proporcionales, será muy fácil determinar la variación de icorr· Por otra parte, se ha observado que la mayor parte de las pendientes de Tafel oscilan ente valores de 60 y 120 mV/ década, de donde se ha optado por hacer una aproximación suponiendo que ambas pendientes tuvieran el segundo valor. As~ se obtiene una B = 26 mV que puede emplearse con reserva, ya que las pendientes del sistema bajo estudio no tienen por qué tener esos valores. En cualquier caso, si se aplica este valor de constante B a un estudio, los valores de velocidad de corrosión serán comparables y éstos serán al menos del mismo orden de magnitud que si se emplearan las pendientes de Tafel reales. La técnica electroquímica llamada resistencia a la polarización es el resultado de la aproximación de bajo campo a la ecuación de Butler-Volmer y por este motivo, se debe aplicar solamente cuando exista control activacional o por transferencia de carga Posteriormente, se discutirá una aproximación que a nivel ingenieril puede aplicarse si el sistema se encuentra controlado por transporte de masa o difusión. Sin embargo, debe quedar claro, que se trata solamente de una aproximación. Los materiales que son susceptibles de ser evaluados mediante la aplicación de la polarización lineal deben estar inmersos en electrólitos conductores, es decir, que la resistividad de las soluciones no sea alta, y deben encontrarse hbres de películas resistivas, pues laRP es una técnica inclusiva que globaliza todas las contribuciones resistivas y no alcanza a discriminarlas. Si se trabaja con sistemas altamente resistivos, se recomienda mejor que la R P , el uso de la espectroscopia de impedancia electroquímica. La aproximación de bajo campo implica que, aunque el sobrepotencial y la corriente se relacionan a través de una ecuación que implica la diferencia entre dos exponenciales(ec. Butler-Volmer), en la inmediación del potencial de corrosión se puede asumir que el comportamiento es lineal. Por supuesto, esta supuesta linealidad no existe en esa zona de la curva E-1, por lo que es bueno recordar que la RP también se ha definido como: R = p. [(aE)] can. ( 3.3) J-40. O bien. 22.
(24) (3.4). O dicho en otras palabras, la tangente a la curva de polarización evaluada en el potencial de corrosión o cuando la corriente tiende a cero. o Difusión. En los sistemas electroquímicos controlados por difusión, se presenta un fenómeno especial en el que la corriente catódica se ve limitada por la concentración de los reactivos catódicos, es decir, por el transporte de masa a través del electro lito (difusión). En esas condiciones, lo mejor seria no emplear esta técnica, pero la tentación de utilizar un método tan rápido y sencillo es muy grande y se ha realiz.ado una aproximación que se muestra a continuación. Es importante recordar que se trata de una aproximación y que los resultados obtenidos con ella, solo pueden ser un indicativo de los valores de velocidad de corrosión que se tendrían determinados por otros métodos más adecuados en las condiciones planteadas. Cuando hay control difusional, se dice que se tiene una corriente límite, con una pendiente de Tafel catódica que tiende a infinito. La ecuación de Sterm-Geary se ve reducida a la siguiente expresión: lcorr. =. b. a. (2.303xRP). (3.5). o Procedimiento experimental. •. Para realizar un estudio experimental de Resistencia a la polarización, el procedimiento a seguir es el descrito por la nonna, ASTM G 59-91.Los pasos a seguir de acuerdo con la norma son lo:, siguientes: • Usar un puente salino que acerque el electrodo de referencia a 2 o 3 mm de la superficie del electrodo de trabajo. • Registrar el potencial de corrosión después de 5 minutos. • Aplicar un potencial 30mV más negativo que el potencial registrado • Un minuto después de que se aplique el potencial, se inicia un barrido en dirección anódica a 0.6 V/h (lOmV/min), registrando el potencial y la corriente continuamente. • Terminar el barrido cuando se alcanza un valor de 30 mV más positivo que el potencial de corrosión. • Graficar la curva de polarización. • Determinar gráficamente la resistencia a la polarización, Rr, como la tangente a la curva en el origen de la gráfica (AE = O).. 23.
(25) o Consideraciones experimentales. Como se indicó en la sección anterior, la perturbación puede realizarse en potencial registrando la respuesta en corriente. La curva de polarización lineal puede obtenerse de manera potenciostática aplicando escalones equipotenciales y esperando a que se alcance el estado estacionario antes de registrar la respuesta en corriente. La función de transferencia entre estímulo y respuesta es la RP • Si por el contrario se realiza la curva de manera potenciodinámica, se puede aplicar la metodología descrita en inciso anterior. Varios detalles de esta metodología se discutirán en apartados posteriores. No se acostumbra realizar la perturbación en corriente y registrando el potencial ( galvanostática o galvanodinámica), sin embargo este tipo de perturbación es muy útil cuando se tiene un sistema en el cual el potencial no es estable. En las curvas potenciostáticas y potenciodinámicas, es indispensable determinar el potencial de corrosión y que éste sea estable. Cuando el sistema presenta una deriva importante, se recomienda realizar una perturbación en corriente. Sin embargo, aunque en la literatura se menciona esta posibilidad, no se habla acerca del intervalo en el cual se puede considerar la validez del bajo campo. Lo mejor serla correr una prueba preliminar de RP de manera potenciostática para determinar el orden de magnitud de la corriente y con base en este dato, detenninar la perturbación que llevará a mantener la linealidad indispensable en esta técnica.. o Ventajas de la RP •. Se trata de una técnica no destructiva pues emplea bajas perturbaciones.. •. Proporciona velocidad de corrosión instantánea.. • No hace falta instrumentación muy sofisticada pues solamente se necesita un potenciostato y, en consecuencia, es una técnica económica. •. Para aplicar la metodología no hace falta personal altamente especializado.. o Limitaciones de la RP •. Es necesario que el potencial sea estable.. •. Caída ohmica en sistemas altamente resistivos.. •. Es necesario seleccionar una velocidad de barrido adecuado.. 24.
(26) a Velocidad de barrido. Mientras que la nonna ASTM sugiere 0.6 V/ h, en la práctica se sugiere que la máxima velocidad de barrido tiene que ser seleccionada en función de una frecuencia característica correspondiente con el "break point" en baja frecuencia en un diagrama de Bode, lo que implicaría que para efectuar la prueba de RP no bastaría con hacer el ensayo, sino que a las pruebas paralelas de extrapolación de Tafel para determinar las pendientes, habrá que efectuar una prueba de Espectroscopia de Impedancia Electroquímica. En la siguiente ecuación se menciona que en función de la constante de tiempo depende del valor de la resistencias del electrolito y a la polarización y de la capacitancia de la doble capa electroquímica.. 1 ; =. 1. [(Ru x e)+ 1(Rp x cJ]. (3.6). Townley asegura que este método subestima la máxima velocidad que se puede emplear. Sugiere emplear la primera frecuencia de "break point" ( no la segunda como Mansfeld y Kendig) y medir la RP no en I=O, sino al final del barrido, sugiriendo que éste sea de 30 mV. Existe un análisis de series de Fourier, demostrando que cuando las sefiales se hacen variar lentamente, una vez que desaparecen los transitorios, la intensidad y el voltaje están en fase. En otras palabras, habría que hacer muy lento el barrido de potencial. Este investigador define el concepto de RP aparente, es decir, la RP que depende de la velocidad de barrido en contraposición con la RP real que sería aquella que no cambia con la velocidad de barrido. El análisis de series de Fourier demuestra también que la histéresis en altas velocidades de barrido de potencial se refleja en un descenso en la RP aparente. a No linealidad. Ya se ha mencionado anteriormente que la supuesta linealidad entre el potencial y la corriente en realidad no existe. Se puede discutir que la no linealidad invalidaría el empleo de la ecuación de StemGeary, pero no ocurre de esta manera de acuerdo con lo mencionado en la literatura. Cabe mencionar además, que en la literatura se manejaron hace años varios programas de cómputo que permitían el cálculo de las pendientes de Tafel a partir de datos pretafelianos ( no lineales). 3.1.2. Técnica de Extrapolación de tafel o de intersección. Si la concentración de los reactivos y de los productos es uniforme en el electrolito, la ecuación de Butler-Volmer toma la forma. J. =. joexp(: )-joexp(;). (3.7). Donde pa y pe, son los coeficientes de Tafel anódico y catódico respectivamente: 25.
(27) f3a = RT anF. f3c. (3.8). =. RT (1-a)nF. (3.9). Donde:. a = Coeficiente de transferencia de carga de la reacción de oxidación. NF = Transferencia de carga. Esta ecuación se aplica a las reacciones electródicas en las cuales la velocidad está controlada por el proceso de transferencia de carga en la interfase electrodo / electrolito. Esta situación se conoce a menudo como control por activación o control activacional y el sobrepotencial correspondiente como sobrepotencial de activación, TIA· El valor de los coeficientes de Tafe~ pa y pe, depende del mecanismo de las reacciones que tiene lugar en los electrodos, los cuales comprenden muy a menudo varias etapas. Sin embargo, no es necesario conocer este mecanismo para poder utilizar la ecuación de Butler-Volmer, ya que ésta describe la cinética del proceso de transferencia de cargas de una manera global, independientemente del mecanismo, a partir de tres magnitudes fácilmente medibles: jo, Pa y Pe· Las siguientes fórmulas definen los coeficientes de Tafel anódico y catódico.. dE. f3a = din CJ. dE. (3.10). /Je= - dlnijc. (3.11) 1. Rectas de Tafel. Para determinar experimentalmente los parámetros cinéticos jo, Pa y Pe, es recomendable una representación gráfica en la que la densidad de corriente esté en una escala logarítmica, ya que así se pone en evidencia la relación lineal existente entre el log j y el sobrepotencial, TI, especialmente cuando este último, en valor absoluto, tiene un valor grande. Se denomina región ó dominio de Tafel anódico ( Zona Tafeliana), aquella región en la cual el ar¡>> 1. potencial que corresponde. i=i, =io. P. exp(;). . La ecuación se convierte en: (3.12). Tomando logaritmos se obtiene: (3.13). ªª. Pasando a logaritmos de base diez y definiendo las constantes de Tafel anódicas, y ha se obtiene la ecuación de Tafel de una reacción anódica, también llamada recta de Tafel anódica:. 26.
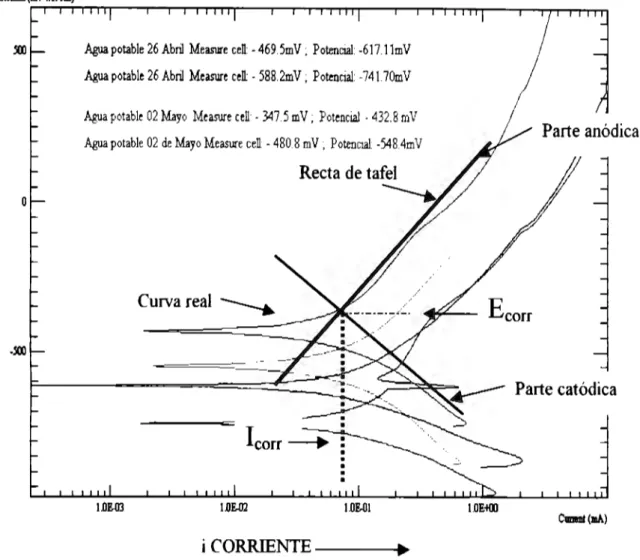
(28) r¡. = ªª + ba log j. aa = - 2.303 ~ª lnjo. ba = -2.303 ~a. (3.14). De manera análoga, para el dominio catódico de Tafel ,. !L <<1: f3c. Lo cual pennite expresar las constantes de Tafel catódicas, ac y be de la ecuación de Tafel de una reacción catódica:. ba = -2.303. ~a. Las ecuaciones de Tafel describen los límites anódicos y catódico de la ecuación de Butler-Vohner. Su descubrimiento a principios del sigo XX, en el afio de 1904, por Tafel al estudiar el comportamiento del sobrepotencial para la reacción de desprendimiento de H2 en función de la densidad de corriente, precedió durante muchos años a la ecuación de Butler- Vohner. Cuando se obtiene una curva de polarización experimental, la extrapolación de la recta que aparece en el dominio Tafeliano al valor del potencial de equilibrio, pennite detenninar la densidad de corriente de intercambio, j0 • El inverso del valor de la pendiente de estas rectas proporciona el valor de los coeficientes de Tafel, ~ª y ~e· IJ. Método de extrapolación de Tafel o de intersección. Para polarizaciones suficientemente grandes. > RT T/- aNf. o bien. RT - 11 > --,---~---· -(1-a)nF. (3.15). La ecuación general de Wagner y Traud se reduce a las ecuaciones de las semireacciones anódica y catódica que corresponden con las rectas de Tafel respectivas, con pendientes b = 2.3RT ª anF. o bien. b = -2.3RT e (1-a)nF. (3.16). Entonces, para un sistema metal/ electrolito dado,jcorr tiene un valor determinado y el primer término del segundo miembro puede englobarse en la constante a de la ley de Tafel. En las proximidades de Ecorr, para polarizaciones pequeñas, los procesos anódicos y catódicos se influyen mutuamente y las curvas de polarización experimentales se apartan del curso semilogarítmico previsto por la ley de Tafel. Sin embargo, para 11 = O (es decir, cuando E= Ecorr), de cualquiera de las ecuaciones resulta: 27.
(29) Ja =. jjcl. =Jcorr. lo cual permite determinar la iorr buscada sin más que extrapolar cualquiera de las rectas de Tafel obtenidas a polarizaciones grandes hasta el valor E= E corr. La principal ventaja y desventaja de este método, derivado en principio por Wagner, Traud, Evans y Hoar, y que tiene gran aplicación práctica, reside en la necesidad del traz.ado completo de las curvas de polarización que por una parte posibilita un análisis electroquímico de la cinética del proceso de corrosión y, por otra, puede dar lugar a modificaciones de la superficie del electrodo por efecto de las elevadas polarizaciones aplicadas. Inversamente, si se llega a una concordancia entre los valores de las velocidades de corrosión derivadas de los ensayos gravimétricos de pérdidas de peso y las obtenidas con la utiliz.ación de este método, puede concluirse que el proceso de corrosión se realiza según un mecanismo electroquímico característico. El cálculo de la velocidad de corrosión por el método de extrapolación de Tafei conocido también como método de intersección, se basa en la extrapolación de la zona lineal o de Tafel en un diagrama experimental E vs log j. Según este método se puede obtener la jcorr sin más que extrapolar cualquiera de las rectas de Tafel hasta el valor de Ecorr· En la práctica, muchos sistemas de corrosión están controlados cinéticamente por la polarización de activación y obedecen por tanto a la ecuación de Butler - Volmer. Si éste es el caso, la representación gráfica del logaritmo de la corriente respecto al potencial aplicado debe presentar un comportamiento lineal (Tafeliano) en sentido anódico y catódico que indica precisamente el control cinético del sistema bajo estudio. Sin embargo, puede existir complicaciones, como por ejemplo: 1. Polarización por concentración, cuando la velocidad de la reacción está controlada por la velocidad a la que llegan las especies reactivas a la superficie metálica. A menudo las reacciones catódicas presentan una polarización por concentración para altos valores de corriente, cuando la difusión del 02 o de los iones Ir no es lo suficientemente rápida como para mantener un control cinético activacional. 2. La formación de óxidos, los cuales pueden llevar o no a la pasivación del metal, pero alteran la superficie de la muestra metálica ensayada. El estado de la superficie puede afectar los valores de las constantes de la ecuación. 3. Otros efectos que pueden modificar la superficie, tales como la disolución preferencial de un componente de una aleación son también causa de problemas. 4. Un control mixto del proceso de corrosión cuando más de una reacción, anódica o catódica, pueden ocurrir simultáneamente, puede complicar el modelo. Un ejemplo de control mixto es la reducción simultánea del 02 y Ir . 5. Por ultimo, otra causa de error en el modelo cinético controlado únicamente por activación necesario para la validez de la ecuación de Tafel es la caída de potencial que tiene lugar como resultado del paso de la corriente que circula por la celda a través de la resistencia eléctrica del electrolito de la misma celda. Si este efecto no es muy severo puede llegar a corregirse. 28.
(30) (compensarse) con el dispositivo de compensación de IR del propio potenciostato. Finalmente, las caídas de potencial resultado del paso de una corriente a través de la resistencia de la solución en la celda produce errores en el modelo cinético. Este último efecto, si no se muy severo puede ser corregido mediante la compensación IR del propio potenciostato.. En muchos casos, las complicaciones como las indicadas anteriormente , pueden ser la causa de la nolinealidad en las gráficas de Tafel que no tenga una bien definida región lineal deben ser utiliz.ados con mucha precaución. Como ya se ha indicado anteriormente, el análisis clásico de Tafel se lleva a cabo mediante la extrapolación de la porción lineal de la curva de polarización(log j vs E), anódica y/o catódica, al valor del potencial de corrosión. El valor tanto de la corriente anódica como de la catódica en la intersección, es decir la correspondiente al E com es I corr. Desafortunadamente, los sistemas de corrosión reales no presentan, muy a menudo, en sus curvas de polarización, una región lineal lo suficientemente extensa que permita una extrapolación con garantías. La mayoría de los equipos modernos disponen de un software adecuado para este tratamiento. En los equipos comerciales, los valores experimentales se ajustan a la ecuación de Butler - Volmer, modificando los correspondientes valores del Ecorr, lcorr, ha, y be, Este método de ajuste de la curva tiene la ventaja que no requiere una bien definida porción lineal en la correspondiente curva de polarización.. 3.1.3. La técnica de ruido electroquímico. o Introducción Ruido es un término común que significa interferencia, en términos científicos es aquello que no puede ser explicado con relación a la variabilidad de las mediciones obtenidas en un experimento. Sin embargo, esto no quiere decir que no contenga información. En el estudio del ruido electroquímico no se trata con señales audibles, sino con oscilaciones en el potencial y corriente electroquímicas. El ruido electroquímico en potencial se define como las oscilaciones estocásticas del potencial electroquímico de un electrodo respecto a un electrodo de referencia, mientras que el ruido electroquímico en corriente es la oscilación estocástica de una corriente electroquímica. La medición del ruido electroquímico es relativamente simple, aunque lo importante es la obtención de la información relevante que puede ser en muchos casos más problemática.. o Medición de ruido electroquímico La medición del ruido electroquímico de potencial y corriente puede acres de manera simultánea. El ruido en potencial se realiza a través de la medición de las oscilaciones del potencial de corrosión respecto a un electrodo de referencia, o bien de un electrodo nominalmente "idéntico". El ruido en corriente se obtiene midiendo las oscilaciones de la corriente entre dos electrodos idéntico o de un solo electrodo bajo control potenciostático. La medición simultánea permite obtener por analogía con la Ley de Ohm la resistencia de ruido electroquímico y mediante análisis espectral la impedancia de ruido electroquímico.. 29.
(31) Esta resistencia es equivalente a la resistencia de polarización, y en ella se incluyen oscilaciones debidas a la transferencia de carga (cinética electroquímica), o bien por ejemplo oscilaciones de la resistencia de la solución debidas a la nucleación, crecimiento y desprendimiento de burbujas. o Características del ruido electroquímico. Las características del ruido electroquímico varían frecuentemente a lo largo del tiempo, siendo por esto la señal no estacionaria. La mayor información se obtiene de las oscilaciones de baja frecuencia (menor de 1O Hz). La amplitud de las oscilaciones es pequeña, siendo su desviación estándar del orden de µ V a mV para el ruido electroquímico en potenciai y de nA a µA para el ruido electroquímico en corriente. El límite inferior de sensibilidad está determinado por el ruido del instrumento. Considérese un sistema de dos electrodos de acero inmersos en una solución de cloruro de sodio. Se mide el ruido en potencial entre un electrodo de acero y un electrodo de referencia de calomel. El ruido en corriente se mide entre dos electrodos a través de un amperímetro de resistencia cero, suponiéndolo ideal (sin caída de vahaje), comportándose los dos electrodos de acero utilizados para medir la corriente efectiva, como un solo electrodo del doble del área de uno de ellos.. o Información del ruido electroquímico Para efectos de análisis las gráficas obtenidas se pueden dividir por lo menos en dos partes el comportamiento registrado y presente en las series de tiempo. La primera parte es el comportamiento para período largo que consiste en un decaimiento transitorio o corrimiento de la señal de potencial, a medida que se desarrolla el producto de corrosión o película sobre la superficie la cual suministra una barrera creciente al oxígeno. La segunda parte o característica de la serie de tiempo presenta oscilaciones a una escala de tiempo menor en su estructura. Ciertamente la primera parte contiene información acerca del proceso de corrosión, pero debe tenerse cuidado al utiliz.ar muchos de los métodos de análisis estadísticos que suponen que las propiedades del sistema son constantes en el tiempo, lo cual no es el caso para un comportamiento transitorio. La oscilaciones de potencial y corriente para periodos más cortos de tiempo, son el verdadero ruido electroquímico, pero aún aquí las propiedades del ruido cambiarán con el paso del tiempo cuando la película de productos de corrosión se desarrolle. En el caso del acero en solución salina no existe una estructura definida en el ruido, ni que procesos fisicos lo están produciendo. Mientras la reacción de corrosión en este caso la controla el transporte de oxígeno a la superficie metálica, las causas probables del ruido observado se pueden asociar con fluctuaciones en el transporte de oxígeno. Se puede observar esto, si se rasga la superficie de uno de los electrodos con un instrumento punzante. Notar que las escalas en la gráfica son muy diferentes; que es por lo que el ruido electroquímico de fondo parece diferente. Así como se demuestra el posible papel que juega el transporte de oxígeno en la generación de ruido electroquímico, también ejemplifica que es muy sencillo que influencias externas produzcan efectos en la señal de ruido registrada El ruido electroquímico pennite obtener información acerca de la cinética de reacción, o sea la velocidad de corrosión; siendo posible la identificación del tipo de corrosión ya sea: uniforme, 30.
Figure


![Fig. 4.3 Proto Board [ 22]](https://thumb-us.123doks.com/thumbv2/123dok_es/2197235.510294/41.956.191.719.87.530/fig-proto-board.webp)
![Fig. 4.4 Montaje del microcontrolador sobre la tarjeta de educación. [ 22 ] 4.4.3 Senromotores para simulación del sistema](https://thumb-us.123doks.com/thumbv2/123dok_es/2197235.510294/42.956.220.722.91.468/fig-montaje-microcontrolador-tarjeta-educación-senromotores-simulación-sistema.webp)
Documento similar
Abstract: This paper reviews the dialogue and controversies between the paratexts of a corpus of collections of short novels –and romances– publi- shed from 1624 to 1637:
Después de una descripción muy rápida de la optimización así como los problemas en los sistemas de fabricación, se presenta la integración de dos herramientas existentes
por unidad de tiempo (throughput) en estado estacionario de las transiciones.. de una red de Petri
Por lo tanto, en base a su perfil de eficacia y seguridad, ofatumumab debe considerarse una alternativa de tratamiento para pacientes con EMRR o EMSP con enfermedad activa
The part I assessment is coordinated involving all MSCs and led by the RMS who prepares a draft assessment report, sends the request for information (RFI) with considerations,
o Si dispone en su establecimiento de alguna silla de ruedas Jazz S50 o 708D cuyo nº de serie figura en el anexo 1 de esta nota informativa, consulte la nota de aviso de la
Proporcione esta nota de seguridad y las copias de la versión para pacientes junto con el documento Preguntas frecuentes sobre contraindicaciones y
[r]
![Fig 5.1 Sistema propuesto [ 22]](https://thumb-us.123doks.com/thumbv2/123dok_es/2197235.510294/43.956.315.791.761.1126/fig-sistema-propuesto.webp)

![Fig 5.3 Servomotor [ 22 ]](https://thumb-us.123doks.com/thumbv2/123dok_es/2197235.510294/45.956.297.662.282.614/fig-servomotor.webp)