Estudio de Residuales del proceso de obtención de etanol a partir de bagazo
Texto completo
(2) Pensamiento.
(3) Pensamiento. “Nunca consideres el estudio como una obligación sino como una oportunidad para penetrar en el bello y maravilloso mundo del saber.”. Albert Einstein.
(4) Dedicatoria.
(5) Dedicatoria. Le dedico mi Tesis de Grado a: La mujer más hermosa y más capaz nacida en la tierra, mi mamá, Susana González Pérez, muchísimas gracias por regañarme, darme tu cariño, tu amor, comprensión y felicidad, guiarme por el camino correcto en este mundo tan difícil de vivir. Para tí recíprocamente todo lo que tú siempre has querido y querrás. “Siempre vivirás convencida que yo viviré para ti”. El hombre que puso su granito en el lugar y momento preciso, mi padre, Luis Manuel Peralta Suárez, “El mejor en todo y de todos”, sin duda una persona magnífica. Muchísimas gracias por regañarme, darme tu cariño, amor, comprensión y felicidad, guiarme por el camino correcto en este mundo tan difícil de vivir. “Siempre vivirás convencido que yo viviré para ti”. A mi hermana, mujer que para mi es y será un ejemplo a seguir como persona y profesional. Gracias a todas esas broncas que cuando éramos niños corríamos por toda la casa, que lo menos que surgió desde ese tiempo fue y seguirá siendo el gran cariño y amor que siento por tí. “Siempre vivirás convencida que yo viviré para ti”. No por ser la última es menos importante en mi vida, sino más especial y es a la mujer que amo, con la cual compartiré mis defectos, virtudes, felicidad y mi vida entera. A ella tan chiquita de tamaño pero con un corazón sin límites, te doy las gracias por permanecer a mi lado en los buenos y malos momentos en estos cuatro años que llevamos juntos, mi chiquitita Yoslainy Echevarría Valdés te amo con todo mi corazón y te deseo lo mejor en esta vida. “Siempre vivirás convencida que yo viviré para ti”..
(6) Agradecimientos.
(7) Agradecimientos. Quiero agradecer a todas aquellas personas que de una forma u otra estuvieron presentes en mi formación académica. 3. A mi tu tutor José Orestes Guerra de. 3. A mi otra familia entre ella a mi. León por su dedicación y esmero en el desarrollo. chiquitita Yoslainy Echevarría Valdés que. de la tesis, así como Edell Jiménez López por. estuvo presente en cuatro de los cinco años de. su ayuda incondicional.. la carrera apoyándome en los buenos y malos. 3. Agradezco a todos lo profesores del. momentos, así como también a mis dos suegros. departamento de Lic. en Química que. realmente no quiero conocer otros, para mi dos. influyeron en mi formación profesional así. personas magníficas que siempre me han. como a los técnicos de laboratorio.. ayudado en todo lo que ha estado a su alcance.. 3. A mi Mamá Susana Gonzáles Pérez, mi. Papá Luis Manuel Peralta Suárez, María Josefa Peralta González y mis abuelos Rafael y María guías de mi educación y formación en la vida. 3. No por ser los últimos son menos. importantes para mí sino que son más especiales, me refiero al grupo que ha sido único e inseparable en estos cinco años de la carrera, ellos son: Yoslainy Echevarría Valdes, Lisdelys González Rodríguez, Yoan Hidalgo Rosa, Oscar Martínes Santiago, Reinier Tumbarell Silva y Manuel Alejandro Treto Suárez. Para ellos mis más humildes agradecimientos y les deseo lo mejor del mundo tanto en sus vidas cotidianas como profesional..
(8) Índice.
(9) ĺndice Resumen. 1. Abstract. 2. Introducción. 3. Capítulo I: Revisión Bibliográfica. 6. 1.1 Hemicelulosa. 6. 1.1.1 Caracterización de Hemicelulosa. 7. 1.2 Xilanos. 12. 1.2.1 Caracterización de xilanos y xilooligosacáridos. 15. Capítulo II: Materiales y Equipos. 19. 2.1. Principales equipos utilizados. 19. 2.2. Reactivos y disolventes. 19. 2.3. Tratamiento de los residuales del proceso industrial. 20. 2.4 Determinación de cenizas. 22. 2.5 Determinación cualitativa de azúcares. 22. 2.5.1 Hidrólisis de los polisacáridos. 22. 2.5.2. Obtención de derivados para la Cromatografía Gaseosa. 22. 2.5.2.1. Acetilación. 22. 2.5.2.2. Silalización. 23. 2.5.2.3 Preparación de los patrones. D-xilosa y D-arabinosa. 23. Capítulo III: Resultados y Discusión. 24. 3.1 Estudio de los residuales acuosos R-1 y R-2. 24. 3.2. Estudio de los productos R’-1 y R’-2. 27. 3.3 Estudio de R’-1 y R’-2 mediante la técnica de cromatografía gaseosa acoplada a un espectrómetro de masas. 29. Conclusiones. 33. Recomendaciones. 34. Bibliografía. 35. Anexos.
(10) Resumen.
(11) Resumen. Resumen Del proceso de obtención de etanol a partir de bagazo de caña se obtienen residuales ricos en carbohidratos que fueron sometidos a un proceso de neutralización y decoloración utilizando una columna de carbón activado, hasta. obtener. productos. con. mayor. grado. de. pureza.. Utilizando. procedimientos químicos de hidrólisis y derivatización, en combinación con la cromatografía gaseosa acoplada a la espectrometría de masas, junto a la información ofrecida por la espectrometría infrarroja y de resonancia magnética nuclear, nos permitió una caracterización parcial de uno de estos productos, el cual está constituido fundamentalmente por polímeros de xilosa y arabinosa, lo que le confiere a este proceso un valor adicional. Palabras claves: Bagazo, carbohidratos, derivatización, Resonancia Magnética Nuclear, Espectrometría IR, Cromatografía Gaseosa.. 1.
(12) Abstract.
(13) Abstract. Abstract They obtain themselves of the process of obtaining of ethanol as from bagasse of cane residual rich in carbohydrates that they were subdued to a process of neutralization and discoloration using a column of coal activated, to get products with bigger degree from purity. Using chemical procedures of hydrolysis and derivatization in combination with the gaseous coupled chromatography to the spectrometry of mass, beside the information offered by the infrared spectrometry and of magnetic nuclear resonance, you allowed us to a partial characterization of one of these products, that is constituted fundamentally from polymers of xylose and arabinose, that you confer this process an additional value. Key word: Bagasse, carbohydrates, derivatizatión, Spectrometry NMR,. IR Spectrometry, Gas Chromatography..
(14) Introducción.
(15) Introducción. Introducción El bagazo de caña de azúcar es un desperdicio lignocelulósico abundante típicamente encontrado en países que procesan caña de azúcar como Brasil, India, Cuba, y China (Martinez, 2003). En general, las fábricas de azúcar generan aproximadamente 270 kg de bagazo por tonelada métrica de caña de azúcar. El Bagazo generalmente contienen celulosa del 40-45% y 30-35% de hemicelulosas (Sun, 2004). Esta biomasa es, por consiguiente, una materia prima renovable para la elaboración de productos químicos de valores. agregados. a. partir. de. componentes. lignocelulósicos,. como. hemicelulosas, siendo el bagazo usualmente almacenado, constituyendo un problema medioambiental, debido al riesgo de combustión espontánea del bagazo (Baudel, 2005). El proceso de obtención de etanol a partir de bagazo actualmente en fase de investigación y desarrollo, es una vía promisoria que aporta soluciones a la problemática medio ambiental y energética. Una ruta química es la conversión de celulosa y hemicelulosa a azúcares fermentables a partir de los cuales es posible obtener el etanol por vía fermentativa. Los azúcares fermentables obtenidos son glucosa, xilosa, arabinosa, galactosa y manosa. En el proceso el bagazo transcurre por dos pre tratamientos los cuales son necesarios para un mejor rendimiento de estos azúcares. La biomasa se pre trata primeramente con ácido sulfúrico (1.25%) para dar lugar a un residual ácido y un segundo tratamiento con hidróxido de sodio (1.5-30. %). y. Etanol. (10-45. %). obteniéndose. un. residual. básico,. posteriormente se realiza la hidrólisis enzimática y el producto obtenido se fermenta, como muestra la figura 1.1.. H2 O. Bagazo. H2SO4. Tratamiento. R-1. H2O EtOH NaOH. Tratamiento. Hidrólisis Enzimática. R-2. Figura 1.1. Proceso de obtención de alcohol a partir de bagazo.. 3. Fermentación. Destilación.
(16) Introducción Esta biomasa provee materias primas baratas para la producción biológica de combustibles y productos químicos, el cual ofrece ventajas económicas, medioambientales, y estratégicas. Después de la celulosa, la hemicelulosa es la segunda familia del mundo más abundante de polímeros y así representan un recurso renovable enorme que permanece casi completamente sin uso. Sin embargo, en estos últimos años emerge interés para la aplicación de hemicelulosas como polímeros y otro compuestos (Gatenholm, 2004). Por ejemplo: xilanos, obtenidos a partir de madera o paja del cereal, han sido probados como formadores de gel o para materiales termoplásticos (Rajesh, 2001), Además de los polímeros, la xilosa obtenida por la hidrólisis ácida diluida, pueden ser convertidos a xilitol, un producto de alto valor específico para la hidrogenación catalítica o enzimática (Mikkola, 2001). En el campo de la alimentación se emplean como prebióticos, tales azúcares se denominan ingredientes. alimenticios. Xilooligosacáridos,. no. digestibles,. que. Fructooligosacáridos,. están. presentes. en. Glucooligosacáridos,. Galactooligosacáridos y son aplicados en dietas especiales de antiobesidad. En el campo farmacéutico se utiliza en la prevención y tratamientos de infecciones gastrointestinales, es agente activo en contra de Osteoporosis, Otitis, Enfermedades en la piel y el pelo. En el campo de la agricultura es utilizado como agente madurante, acelera y estimula el crecimiento, logrando un aumento del rendimiento (Wang, 2009).. 4.
(17) Introducción. Estos residuales, deben estar constituidos por alguno de los componentes que originalmente tiene el bagazo, pero hasta el momento no se les da ningún uso por tanto estamos en presencia del siguiente problema científico: 3 No se conoce la naturaleza y composición química de los residuales del proceso de producción de etanol a partir de bagazo de caña, razón por la cual estos constituyen un problema medioambiental y no se ha evaluado la posibilidad de utilización para la obtención de otros productos, que beneficien el balance económico del proceso. Para resolver el mismo nos planteamos la siguiente hipótesis de trabajo: 3 Los residuales generados durante la producción de etanol a partir del bagazo de caña están constituidos básicamente por polisacáridos de los que podrían obtenerse productos de interés que confieren a este proceso un valor adicional a la vez que se reduciría la carga contaminante. Para esto nos trazamos el siguiente objetivo general: 3 Determinar la composición y naturaleza química de los residuales obtenidos del proceso de obtención de alcohol a partir de bagazo. Como objetivos específicos: 3 Implementar un procedimiento para el tratamiento de los residuales que permita obtener productos de mayor pureza. 3 Estudiar las condiciones de trabajo necesarias para la determinación de carbohidratos mediante la técnica de cromatografía gaseosa acoplada a espectrometría de masas. 3 Utilizar las técnicas espectroscópicas de IR y RMN en el estudio estructural de los productos obtenidos.. 5.
(18) Revisión Bibliográfica.
(19) Revisión Bibliográfica. Capítulo I Revisión Bibliográfica 1.1 Hemicelulosa La hemicelulosa contiene un grupo de polisacáridos complejos, son biosintetizados en grandes cantidades, en la mayoría de árboles y plantas terrestres. Una producción anual mundial estimada de hemicelulosas está en el rango de 60 billones de toneladas. Basados en el estadio del conocimiento actual, las hemicelulosas pueden estar divididas en cuatro clases generales de diferentes estructuras de polisacáridos de la pared celular: xilanos, mannanos, β-glucanos, xiloglucanos. Una estructura de la hemicelulosa ha sido propuesta (Oraphin Chaikumpollerta, 2004). Ver figura 1.2.. 6.
(20) Revisión Bibliográfica 1.1.1 Caracterización de Hemicelulosa Un grupo de investigadores chinos estudiaron la hemicelulosa del bagazo de caña de azúcar, mediante las extracciones obtenidas por el método de extracción ultrasónico. Los resultados mostraron que las extracciones con tratamiento ultrasónico, en medio alcalino y peróxido alcalino bajo las condiciones. dadas. dieron. para. una. liberación. sobre. el. 90. %. de. hemicelulosas y lignina originales. Este hecho así como también la composición de azúcar y características estructurales de las siete fracciones hemicelulósicas aisladas indicaron que la ultrasonificación atacó las paredes celulares íntegramente, cortó los enlaces de éter entre la lignina y la hemicelulosa, y aumentó accesibilidad y extracción de la hemicelulosa. Aumentando la concentración alcalina de 0.5 al 2M y el porcentaje de peróxido de hidrógeno (pH 11.5) de 0.5 % a 3.0 % dieron como resultado degradación de la cadena principal hemicelulósica como se muestra por una disminución en sus pesos moleculares de 43580 hasta 14470 g mol-1 y 30180 hasta 18130 g mol-1, respectivamente. Sin embargo, no hubo diferencias significativas en las características estructurales de las siete secuenciales fracciones de la hemicelulosa alcalina y solubles en peróxido, las cuáles están compuestas principalmente de L-Arabino-(4-O-metil-Dglucurono)-D-xilanos y se encontró que ácidos Ferúlico y p-coumárico están químicamente vinculados con la hemicelulosa (Jing-Xia Sun, 2004). Alrededor del 90 % de la hemicelulosa y lignina original en las paredes celulares del bagazo fue secuencialmente extraído con agua destilada, 0.5M de NaOH, 0.5, 1.0, 1.5, 2.0 y H2O2 (3.0 %) a pH 11.5, y NaOH (2.0 M) a 55 ºC por 2 h. La composición química, las propiedades físico-químicas, y las estructuras de las ocho hemicelulosa fueron elucidadas por una combinación de análisis de azúcar, oxidación con nitrobenceno de lignina enlazada,. determinación. molecular,. transformada de Fourier, RMN (1H y. 13. espectroscopía. C) y análisis térmico.. 7. infrarroja. con.
(21) Revisión Bibliográfica Los resultados demostraron que los tratamientos secuenciales fueron muy efectivos en el fraccionamiento y extracción de la hemicelulosa del bagazo, la concentración de álcali y peróxido tuvieron gran influencia en las características químicas y estructurales de la hemicelulosa del bagazo, contenido de lignina asociado y el peso molecular. La fracción de la hemicelulosa aislada en H2O2 (0.5%) a pH 11.5 por 2h bajo 55 ºC tiene una cadena principal de xilosa enlazada β-(1-4) y se encontró residuos de unidades de arabinofuranosil y 4-O-metilglucopiranosil como cadenas laterales. Un estudio comparativo de los polisacáridos de la hemicelulosa del bagazo de la caña de azúcar en solubilidad alcalina y solubilidad en solvente orgánico ácido fue estudiado por F. Xu y colaboradores. Se realizó un tratamiento de dos etapas del bagazo de caña de azúcar en medio ligeramente. básico. y. 1,4-dioxano. en. medio. ligeramente. ácido.. Pretratamiento con solución acuosa NaOH (1 M) a 20, 25, 30, 35, y 40 °C por 18h resultando 55.5 %, 57.3 %, 59.1 %, 60.9 %, y 62.1 % de la hemicelulosa. original,. respectivamente.. El. post. tratamiento. del. correspondiente residuo con 1,4-dioxano y HCl (2M) (9:1, v/v) a 87 °C por 2h, respectivamente, degradó 11.6 %, 11.9 %, 11.4 %, 10.9 %, y 10.6 % de hemicelulosa (% materia seca del material de partida). Fue encontrado que las cinco preparaciones solubles en álcali de la hemicelulosa, contenía mayor cantidad de xilosa (78.0-82.2%) y ligeramente alto los ácidos urónicos. (4.8-5.8%),. principalmente. de. ácido. 4-O-metil-D-. glucopiranosilurónico, pero fue inferiores en arabinosa (9.3-11.7%) y glucosa (2.2-4.1%) que las cinco fracciones acídicas correspondientes a la hemicelulosa degradada en dioxano, en las cuales: xilosa (44.9-46.8%), arabinosa (35.9-38.1%) y glucosa (13.0-13.7%) fueron los componentes principales de azúcar. Los estudios revelaron que las cinco preparaciones solubles en álcali de la hemicelulosa fueron más lineales, tuvieron un peso molecular más alto (35200-37430 g mol-1) que las fracciones de la hemicelulosa degradada durante el post tratamiento acídico con dioxano (12080-13320 g mol-1).. 8.
(22) Revisión Bibliográfica Esto demostró que el post tratamiento con dioxano acídico bajo las condiciones usadas dio como resultado degradación sustancial de los polímeros de la hemicelulosa. Las 10 muestras de hemicelulosa fueron más allá caracterizadas por análisis FT-IR, espectroscopía de RMN (1H y. 13. C) y. análisis térmico (F. Xu, 2006). La estructura de la hemicelulosa extraída a partir de hierbas Vetiver (Vetiveria Zizanioides Nash) fue estudiada por Oraphin Chaikumpollert y colaboradores. Las composiciones de monosacáridos y la posición de los enlaces entre monosacáridos en la hemicelulosa fueron definidas por hidrólisis con TFA y análisis de metilación, respectivamente. Los métodos espectroscópicos. 13. C RMN y FT-IR dieron detalles de la configuración de los. enlaces anoméricos y confirmaron la estructura de la hemicelulosa. La estructura propuesta de la hemicelulosa de esta materia prima es un arabinoxilano principalmente consistente en (1-4)-β-D-xilano de cadena principal substituida en O-2 y O-3 por residuo de α-L-arabinosa, residuo de ácido α-D-glucurónico y las cadenas cortas de residuos de azúcares conteniendo arabinosa, xilosa y galactosa. Además, los enlaces β-(1-4) de los D-xilopiranosil residuos en la cadena principal pueden contener ácidos fenólicos substituidos (por ejemplo ácido ferúlico y ácido p-coumárico). Los ácidos fenólicos substituidos son esterificados por sus grupos carboxilos, por el hidroxilo del C-5 de los residuos de α-L arabinofuranosil como cadena lateral (Oraphin Chaikumpollerta, 2004). Runcang. Sun. y. equipo. de. trabajo. estudiaron. seis. fracciones. hemicelulósicas, las cuales fueron extraídas sucesivamente de paja de trigo ya descerada con hidróxido sódico en incremento de fortaleza de 0.25 hasta 2.OOM. La estructura de la fracción hemicelulósica 2 fue investigada usando hidrólisis ácida, análisis de metilación y experimentos. 13. C-RMN. Se confirmó. que la hemicelulosa esta formada por (1-4)-β-D-xilanos enlazado con ácido D-Glucopiranosilurónico (ácido 4-O-metil-α-D-glucopiranosilurónico) grupo adjunto en posición 2, L-arabinofuranosil y grupos de D-Xilopiranosil adjunto en posición 3. Para cada 26 residuos de D-Xilopiranosil en la cadena principal, hubo una unidad de ácido urónico, para 13 residuos Dxilopiranosil, hubo un grupo de L-Arabinofuranosil, y para 18 residuos de DXilopiranosil, hubo un grupo de D-Xilopiranosil (Runcang Sun, 1996).. 9.
(23) Revisión Bibliográfica Youssef Habibi junto a colaboradores lograron aislar xilanos del pericarpio de semillas de pera de Opuntia Ficus indica (OFI) por extracción alcalina, fraccionada por precipitación y purificada. Seis fracciones fueron obtenidas y caracterizadas por análisis de azúcares y espectroscópico de RMN. Fue asumido para ser (4-O-metil-D-glucurono)-D-xilanos, con grupos de ácido 4-O-α-D-glucopiranosilurónico enlazados en C-2. La composición de azúcar y los espectros de 1H,. 13. C RMN demostraron que sus estructuras químicas. fueron muy similares, pero con proporciones diferentes de D-Xilosa y ácido 4-O-Me-D-Glucorónico. Los resultados mostraron que, como promedio, los xilanos solubles en agua tiene un residuo terminal poco reductor ácido 4-Ometil-D-glucurónico por cada 11 hasta 14 unidades de xilosa, considerando los xilanos poco solubles en agua cuando las unidades de xilosa pueden variar de 18 hasta 65 residuos por un residuo terminal no reductor de ácido 4-O-metil-D-glucurónico (Youssef Habibi, 2002). El material proveniente de la pared celular de arbustos chino Haloxylon Ammodendron y Elaeagnus angustifolia fue fraccionado por extracciones sucesivas con etanol/H2O (60:40, v/v) bajo condiciones acídicas (HCl 0.2N) a 70 °C por 4h, y 2 % H2O2 a pH 11.5 por 16 h, respectivamente. El tratamiento secuencial de dos etapas dio como resultado la disolución de 83.9 % y 87.6 % de la hemicelulosa original descerada de H. ammodendron y E. angustifolia, respectivamente. Xilosa, glucosa, y galactosa fueron los componentes principales de azúcar en las dos preparaciones acídicas de la hemicelulosa soluble en solventes orgánicos. Las dos fracciones solubles en peróxido de la hemicelulosa fueron mostradas para ser compuestas primordialmente de xilosa, comprendiendo sobre 80 % de los azúcares totales.. Los. resultados. también. mostraron. que. las. dos. fracciones. hemicelulósicas soluble en peróxido alcalino fue más lineal, y tuvo masa molecular y estabilidad térmica mayor que las dos fracciones acídicas de la hemicelulosa soluble en organosolvente. El post tratamiento de H2O2 (2 %) no resultó en ningún cambio significativo en la estructura macromolecular de la hemicelulosa aislada. Es probable que la lignina proteja a la hemicelulosa y la celulosa fuese atacada por peróxido (Xiao-Feng Sun, 2002).. 10.
(24) Revisión Bibliográfica Los polisacáridos de Hemicelulosa fueron aislados de órganos de la palma de Phoenix Dactylifera L. por extracción alcalina y fraccionados por precipitación.. Las. investigaciones. estructurales. fueron. logradas. por. espectroscopía RMN y análisis de azúcares. Las fracciones solubles en agua fueron asumidas para ser arabinoglucuronoxilanos, con grupos de ácido 4O-α-D-glucopiranosilurónico enlazado en C-2 y arabifuranosil en C-3. Las fracciones no solubles en agua fueron asumidas para ser (1-4)-β-D-xilanos enlazado con un grupo ácido 4-O-metil-α-D-glucopiranosilurónico enlazado en C-2. La composición de azúcar y los espectros de. 1. H,. 13. C RMN. demostraron que sus estructuras químicas fueron muy similares, pero con proporciones diferentes de 4-O-Me-D-GlcA (Abdelkader Bendahou, 2007). Los polímeros principales de la matriz hemicelulósica, de la pared celular de Aristida pungens, una hierba perenne ampliamente distribuida en las regiones áridas argelinas fueron aislados de las hojas con solución acuosa KOH (14%). El método de extracción produjo dos fracciones de la hemicelulosa (A y B) dando razón de 3.5 y 10.1 % del material de partida respectivamente. Los métodos GC y. 13. CRMN mostraron la presencia de. xilosa como el componente principal con residuos arabinosil. Ambos análisis mostraron. que. la. hemicelulosa. de. las. hojas. de. A.. pungens. son. arabinoxilanos. Los materiales resultantes fueron caracterizados por FT-IR, espectroscopía de. 1. HRMN y análisis termogravimétricos (Lahouari Chaa,. 2008). 1.2 Xilanos Los xilanos están ubicados a lo largo del crecimiento de la pared y forman la masa de la fracción de la hemicelulosa de las angiospermas. La estructura general de los xilanos en plantas más altas son de cadena principal de Dxilopiranosa unidos por enlaces β-(1-4) (Oraphin Chaikumpollerta, 2004, F. Xu, 2006, Paul Robert and LUC SAULNIER*, 2005). Los xilanos son moléculas grandes con un grado de polimerización de 150-200. Adjunto a la cadena carbonada están las cadenas laterales terminales pequeñas.. 11.
(25) Revisión Bibliográfica En las angiospermas éstas son unidades de ácido 4-0-metil-D-glucurónico que están adjuntado a la xilosa de la cadena principal por enlaces α-(1-2), y estos están distribuidos al azar a lo largo de la cadena principal. Aproximadamente la relación en que se encuentran es un ácido urónico para cada diez residuos del xilosa (Youssef Habibi, 2002) y en la mayoría estos grupos ácidos están presentes como ésteres y no como ácidos libres (Aline Barbat, 2008, ZHU, 2005). En la naturaleza cerca de la mitad de los grupos de xilosa en la cadena del polisacárido están acetilados. La mayoría de la acetilación ocurre en C-3 aunque hay una cierta cantidad en C-2, y ciertos residuos de xilosa están acetilados en ambos, C-2 y C-3 (Debora Nabarlatz, 2007). Cuando los xilanos acetilados están aislados se encuentra que son solubles en agua, especialmente comparado con los polímeros desacetilados obtenidos a partir de la pared celular por extracción alcalina. Los grupos de acetilo son lo suficientemente numerosos para impedir alineación de las cadenas moleculares, y la agregación molecular no puede tener lugar. Así la presencia de los grupos de acetilo tiene influencia sobre la asociación de estas cadenas con otras y con otros polisacáridos dentro de la estructura de la pared celular (NORTHCOTE, 1972). La conformación de la formación de xilanos han sido investigadas por análisis de rayos X, y la presencia de enlaces de hidrógenos han sido estudiadas por investigaciones infrarrojas polarizadas. Ha sido mostrado que las moléculas existen como las cadenas extendidas en forma de tornillo, pero a diferencia de celulosa las cadenas no están estabilizadas por enlaces intermoleculares de hidrógeno. No obstante, los agrupamientos ocurridos de la cadena ha sido mostrado para estar estabilizado por la inclusión de moléculas de agua en la estructura cristalina, y hay un rango continuo de xilanos hidratados. La estructura del hidrato de los xilanos pueden ser representada por un enrejado cristalino en el cual un sitio dentro del enrejado es ocupado por una. columna. de. moléculas. de. agua. que. estabiliza. la. estructura. (NORTHCOTE, 1972). Este sitio hidrófilo dentro del enrejado también puede acomodar el ácido 4-O-metil-D-glucurónico y las cadenas laterales de arabinofuranosa que pueden sujetar las moléculas de agua en esta posición. Diferentes tipos de xilanos así como sus oligómeros se han reportado en la literatura: kenaf, hierbas, frutas, cereales, tallo del tabaco, del algodón, del girasol.. En. la. figura. 4. se 12. ilustran. algunos. ejemplos..
(26) Revisión Bibliográfica. 13.
(27) Revisión Bibliográfica 1.2.1 Caracterización de xilanos y xilooligosacáridos Los diferentes desperdicios agrícolas, particularmente el tallo de tabaco (TS), el tallo de algodón (CS), el tallo del girasol (SS), y la paja de trigo (WS),. sirvieron. para. la. producción. de. xilooligosacáridos. (XOs).. La. producción de XOs fue realizada por hidrólisis ácida de xilanos, el cual fue obtenido por extracción alcalina de estos desperdicios agrícolas.. El. componente principal de estos desperdicios agrícolas fue determinado como celulosa (30-42%), fue seguido por xilanos (20%) y lignina (20-27%). Los xilanos de estos desperdicios tuvieron principalmente xilosa (85-96%) con pequeñas cantidades de glucosa, mientras que los xilanos de la paja de trigo contenían también arabinosa. La mejor conversión de xilanos en XOs fue lograda con H2SO4 (0.25 M) con tiempo de reacción 30 min. En estas condiciones, el rendimiento de XOs estaba entre 8 % y 13 %. El rendimiento de XOs depende de ambos, el tiempo de hidrólisis y concentración de ácido, pero el rendimiento de monosacárido depende de la estructura y composición del xilano, además de la concentración de ácido y el tiempo de reacción. El xilano más ramificado, WSX, dio el rendimiento de monosacárido más alto (16 %) y furfural (49 mg/100 g xilano) (Ozlem Akpinar *, 2009). La producción de Xilooligosacáridos (XOs) fue realizada por hidrólisis enzimática de xilano que fue obtenido por extracción alcalina del tallo de tabaco (CS) del tallo de algodón (TS), y paja de trigo (WS). El xilano fue hidrolizado usando Trichoderma Longibrachiatum Xilanasa, y los efectos de pH, temperatura, tiempo de hidrólisis, las concentraciones de substrato y de la. enzima. en. polimerización. el. rendimiento. fueron. de. investigados.. Xilooligosacáridos Fue. encontrado. y. el. que. grado estos. de tres. desperdicios agrícolas contenían cantidades diferentes de xilano, celulosa y que la lignina y el xilano obtenido a partir de estas fuentes contenían cantidades diferentes de azúcar y ácido urónico. Los xilanos de WS tuvieron cantidades mayores de arabinosa mientras los otros xilanos principalmente tuvieron xilosa y cantidades pequeñas de glucosa.. 14.
(28) Revisión Bibliográfica Trichoderma longibrachiatum xilanasa hidrolizó la paja de trigo donde los xilanos estaban altamente ramificado (WSX) en mayor medida que los xilanos del tallo de algodón (CSX) y del tallo de tabaco (TSX), bajo condiciones favorables (tiempo de reacción de 8 h a pH 4.6 y 50 ºC). El análisis TLC de los productos de hidrólisis indicó que el producto de hidrólisis de T. longibrachiatum xilanasa contenía cantidades diferentes de oligosacáridos (X2, X3, X4, X5, X6, X7) con algunos monosacáridos. A pesar de las diferencias estructurales de los tipos del xilanos, todos generaron XOs con grados diferentes de polimerización (Bostanci, 2009). Un análisis de metilación y parcial hidrólisis ácida de xilanos del vástago y corazón del kenaf (Hibisco cannabinus) mostró que la cadena principal de estos xilanos consiste en residuos (1-4)-β-D-xilopiranosil (Xilp), algunas unidades de la cadena principal llevan enlazados ácido α-(1-2)-4-O-metil-Dglucopiranosilurónico (Me-GlcAp) y residuos de ácido glucopiranoslurónico (GlcAp) de las cadenas laterales. La hidrólisis parcial de los xilanos del kenaf le proporcionó dos series de ácidos aldourónico a partir de aldobio hasta los ácidos aldotetraourónico. Los ácidos de la primera serie compuesta de residuos de 4-O-Me-D-GlcAp y de D-Xilp: 4-O-Me GlcA-Xil3, 4-O-Me GlcA-Xil2 y 4-O-Me GlcA-Xil. Las segundas series compuestas de DGlcAp y D-Xilp: GlcA-Xil3, GlcA-Xil2 y GlcA-Xil. Además para estos ácidos, otro ácido aldobiourónico, 4-O-(α-D-GalAp)-D-Xil fue encontrado para estar presente en el parcial hidrolizado. La relación molar de GalA, GlcA, 4-O-MeGlcA, y los residuos de Xil calculados fueron 1.0:2.0:9.4:119 para los xilanos del vástago y 1.0:1.3:7.9:99.4 para los del corazón del Kenaf (H. Komiyama, 2008). Seis diferentes residuos agrícolas de origen botánico, particularmente mazorcas (CC), conchas de almendra (AS), semillas de olivo (OS), cáscaras de arroz (RH), paja de trigo (WS), y paja cebadaza (BS), fueron probados como materias primas para la producción de xilooligosacáridos (XOs) por auto hidrólisis a 179 °C por 23 min. El rendimiento de XOs dependió del contenido de xilanos y su accesibilidad y fue proporcional para el contenido de acetilo de las materias primas.. 15.
(29) Revisión Bibliográfica El rendimiento fue mayor para CC (60 %) y AS (55 %), mientras RH proveyó un rendimiento bajo (30 %) de acuerdo con su contenido mínimo de acetilo. Los análisis de composición de los productos de hidrólisis mostraron que contenían oligómeros parcialmente acetilados y fragmentos de polímeros de xilanos, y algunos monosacáridos y productos de degradación. Combinando los espectros RMN (13C y 1H) de 1D y 2D (HSQC) de las muestras dializadas de XOs revelaron que los grupos de acetilo estaban localizados en los residuos del xilosa principalmente en posición 3 (entre 60 y 67 mol%), considerando la ocurrencia de grupos de acetilo en posición 2 y en ambas posiciones 2 y 3 fueron similares (19-30 mol% y 825 mol%, respectivamente). El análisis de RMN mostró la presencia de residuos de ácido 4-O-metilglucurónico (MeGA) en todas las pruebas de XOs, como indicó la relación molar MeGA/Xil, 2.5:100 para CC hasta 9.1:100 para OS. A pesar de las diferencias estructurales de los tipos de xilanos presente en los materiales de la planta de partida, todos los XOs mostraron la característica estructural de un parcialmente O-acetilado 4-Ometilglucuronoxilano (Debora Nabarlatz, 2007). La zona de la huella dactilar en FT-IR de endosperma de arabinoxilanos de trigo (AX) fue investigada usando un grupo de polisacáridos exhibiendo variación de su grado de sustitución y unidades de xilosa que consisten de xilooligosacáridos mono o disustituido por residuos de arabinosa. La sustitución de la xilosa de la cadena principal por unidades laterales de arabinosa fue más profundamente estudiada en la región espectral 1000800 cm-1, usando la segunda derivada. La región espectral 1020-920 cm-1 reveló dos bandas de absorción a 984 y 958 cm-1, las intensidades de las cuales varió conforme al grado de sustitución, aumentando la intensidad de la banda en 958 cm-1 y decreciendo la banda en 984 cm-1. Los datos espectrales de la segunda derivada de los xilooligosacáridos señalaron que estos cambios podrían ser atribuidos a la sustitución del xilano en la cadena principal por residuos de arabinosa, y la banda en 958 cm-1 fue adscrita a la presencia de residuos de xilosa disustituida.. 16.
(30) Revisión Bibliográfica Los componentes principales del análisis espectral FT-IR de modelos de mezclas de AX, β-glucans, y arabinogalactanos sugirieron que cabe evaluar las proporciones relativas de los polímeros y el grado de sustitución de AX en mezclas complicadas como la pared celular de granos del cereal (Paul Robert and LUC SAULNIER*, 2005). De la planta medicinal Rudbeckia Fulgida, var sullivantii (Boynton Et Beadle) un polisacárido de bajo peso molecular 4-O-metil-α-D-glucurono-D-xilano fue aislado por extracción alcalina, seguido por precipitación con etanol, por cromatografía del intercambio de iónico y filtración de gel. Los resultados de composición y análisis de enlaces, sustentados por mediciones de 1H y. 13. C. RMN de oligómeros generados en la hidrólisis ácida parcial, mostró los enlaces β-(1-4) de residuos D-xilopiranosil de la cadena principal con aproximadamente 18 % de ácido α-(1-2)-4-O-metil-D-glucurónico enlazado a los residuos de la xilosa. Se determinó que de cada seis unidades de Dxilosa. hay. un. residuo. de. ácido. KardosÏova *, 1998).. 17. 4-O-metil-d-glucurónico. (Alzbeta.
(31) Materiales y Equipos.
(32) Materiales y Equipos. Capítulo II Materiales y Equipos 2.1. Principales equipos utilizados. 3 Espectros IR: se realizaron en un equipo WQF-510 FTIR. Las unidades se expresan en cm-1. 3 Espectros de RMN: Se registraron en equipos Varian INOVA-400. Los disolventes utilizados fueron DMSO-d6 y D2O. Para el calibrado de los desplazamientos químicos δ (expresados en ppm) y las constantes de acoplamiento J (medidas en Hz) se referencia respecto a los picos residuales de los disolventes que son 2.5 ppm (DMSO-d6) y 4.8 (D2O) en 1H-RMN 3 Cromatogramas gaseosos: Se registraron en un Cromatógrafo gaseoso acoplado a un espectrómetro de masas (CROM-MAS) SHIMADZU GC/MSD GP5050 A. 2.2. Reactivos y disolventes 3 Todos los disolventes y reactivos utilizados son de las firmas MERCK, Panreac y BDH. 3 Los disolventes de calidad técnica fueron destilados y secados antes de ser utilizados.. 18.
(33) Materiales y Equipos. 2.3. Tratamiento de los residuales del proceso industrial. Los residuales utilizados en el trabajo fueron muestras promedios de las condiciones de trabajo en que se desarrolló el proceso de obtención de etanol. Una porción de cada uno de ellos se evaporó a sequedad para realizar las determinaciones de cenizas, contenido de sólidos y otros análisis cualitativos. Con el resto se siguieron los siguientes pasos: 3 Se ajustó el pH a 7 utilizando solución de NaOH (25%). 3 Se adicionaron a una columna cromatográfica (30 cm de altura por 5 cm de diámetro) conteniendo carbón activado como fase estacionaria y se eluyó con agua destilada (proceso de decoloración). 3 Una vez decolorado, el residual fue evaporado a vacío hasta la sequedad De esta forma se obtuvo a partir del residual ácido R-1, el producto R’-1 y del residual básico R-2, el producto R’-2.. 19.
(34) Materiales y Equipos. H2O. Bagazo. H2SO4. Tratamiento. H2O. EtOH NaOH. Tratamiento. R-1. R-2. Residuo Neutralizado. Bagacillo. Bagacillo. Carbón Activado. Rotovaporador. R’-1. R’-2. Figura 2.1. Diagrama de obtención de R’-1 y R’-2 a partir de los residuales ácido y básico.. 20.
(35) Materiales y Equipos. 2.4 Determinación de cenizas Se determinó mediante la diferencia de peso de la muestra antes (1 g) y después de la incineración a 500 ºC durante 4h. 2.5 Determinación cualitativa de azúcares. Se realizó mediante el uso de los ensayos clásicos utilizados en la determinación de azúcares (Daniel J. Pasto, 1995). 2.5.1 Hidrólisis de los polisacáridos. 0.1g de la muestra fueron suspendidos en 10ml de H2SO4 (0.25M), calentando a ebullición durante 60 min. en un balón con un condensador en posición de reflujo. 2.5.2. Obtención de derivados para la cromatografía gaseosa (Knapp, 1979). 2.5.2.1. Acetilación 100mg de la muestra se disolvieron en 3ml de Piridina y 1.5ml de Anhídrido Acético, calentando a ebullición durante 60 min. en un balón con un condensador en posición de reflujo. A partir de aquí se emplearon dos procedimientos: Procedimiento A: Se evaporó a sequedad y el sólido fue disuelto en dimetilsulfóxido e inyectado en el CG-MSD. Procedimiento B: La mezcla de reacción se extrajo con cloroformo y éste fue inyectado en el CG-MSD.. 21.
(36) Materiales y Equipos 2.5.2.2. Silalización 10mg de la muestra se disolvieron en 1ml de piridina, se adicionaron 10mg de ácido tricloroacético y se calentó la mezcla durante 1h a 75 ºC. 2.5.2.3 Preparación de los patrones. D-xilosa y D-arabinosa. Como patrones se utilizaron las pentosas D-xilosa y D-arabinosa, que fueron derivatizadas siguiendo los procedimientos anteriormente descriptos.. 22.
(37) Resultados y Discusión.
(38) Resultados y Discusión. Capitulo III Resultados y Discusión En. este. capítulo. analizaremos. lo. concerniente. a. la. purificación. y. caracterización de los residuales del proceso de obtención de etanol para lo cual empleamos procedimientos cromatográficos y espectroscópicos. 3.1 Estudio de los residuales acuosos R-1 y R-2 Del pretratamiento en medio ácido realizado sobre el bagazo en el proceso industrial obtuvimos un licor oscuro (R-1) rico en hemicelulosa mientras que del pretratamiento en medio básico se obtuvo un producto con la misma apariencia (R-2) pero rico en materiales lignocelulósicos. En ambos casos los resultados fueron positivos para los ensayos con la 2,4-dinitrofenilhidrazina y el reactivo de Benedit. Algunas características determinadas en los mismos se muestran en la tabla 3.1 Tabla 3.1. Residuales. pH. % sólido. % cenizas. R-1 R-2. 2.39 6.16. 58.69 58.25. 10.57 10.57. En ambos casos estos productos presentan un alto contenido de cenizas y casi un 60 % de sólidos. El pH de R-1 resultó muchos más bajo, teniendo en cuenta que este residual procede de un tratamiento ácido, a diferencia de R2, que el residual procedente de la etapa del tratamiento básico. Estos licores fueron llevados a pH neutro mediante adición de solución de NaOH (25 %) y posteriormente se rotoevaporaron hasta la obtención de residuos sólidos (R’-1 y R’-2) de color oscuro que fueron sometidos a un proceso de decoloración utilizando una columna cromatográfica con carbón activado. En ambos casos se registraron los espectros IR antes y después de ser tratados en la columna.. 23.
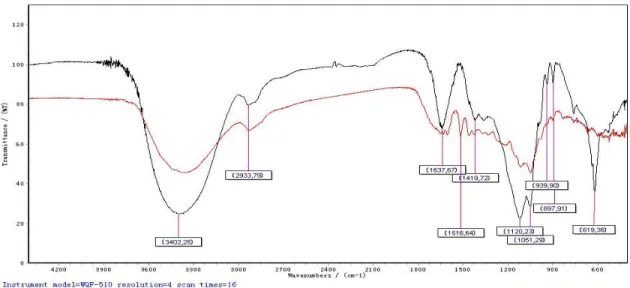
(39) Resultados y Discusión. Figura 3.1. Espectro IR de R-1 (rojo) y R’-1 (negro).. Los espectros IR de R-1 y R’-1 resultaron ser característicos de azúcares de esta biomasa y se asemejan a los encontrados en la literatura (C.F. Liu, 2006, J.X. Sun, 2004), muestran entre las señales más importantes las correspondientes a las vibraciones de valencia de los grupos hidroxilos (ﬠ 3402 cm-1), la vibración Csp3-H (ﬠ. C-H. O-H. 2933 cm-1), así como el típico patrón de. compuestos aromáticos en 1604 y 1516 cm-1. Además, las señales en 1419 cm-1 y 1363 cm-1 son debidas a las vibraciones de deformación δ. C-C. y δ. C-OH,. ( o δ C-H) en el plano respectivamente (M. KacÏuraÂkovaÂ, 1999 ), así como las bandas de mayor intensidad alrededor de 1120 cm-1 (ﬠ. C-O-C. ) producto de. las vibraciones de valencia de los enlaces anoméricos y en 1051 cm-1 debido a las vibraciones de valencia relacionadas con las conformaciones del anillo hemiacetálico (ﬠ. C-C,. ﬠ. C-O. ). En la región anomérica (700-950 cm-1) una. banda resuelta a 897 cm-1 se debe a las vibraciones de deformación (δ. C-H). de los enlaces glicosídicos para la configuración β entre la unidades de azúcares del polisacárido (Jing-Xia Sun, 2004, R. Singh, 2005, F. Xu, 2006, C.F. Liu, 2006, J.X. Sun, 2004).. 24.
(40) Resultados y Discusión. Es de señalar la similitud entre los espectros registrados antes y después del proceso de decoloración excepto la aparición de una señal 619 cm-1 que pudiera. ser. debida. a. vibraciones. C-S. (Dahlman,. 2002). pero. que. contradictoriamente no aparece en el espectro correspondiente a la muestra antes de ser decolorada. La banda ancha 1636cm-1 que aparece en el espectro IR de R’-1 y que es debida al agua residual, pudiera enmascarar a las señales de los grupos carboxilatos de las unidades de ácido glucorónico y posibles ácido. pcoumárico o ácido ferúlico que están enlazados a azúcares de la cadena principal. y. a. azúcares. de. las. cadenas. laterales. del. polisacárido. respectivamente (Oraphin Chaikumpollerta, 2004). Un análisis similar puede hacerse para el caso de R’-2, destacándose las señales siguientes los grupos hidroxilos (ﬠ. O-H. 9 grupos carboxílos (ﬠ. 3454 cm-1), C=O. 9 compuestos fenólicos (δ 9. 1714cm-1), C-C. 1662, 1629, 1448 cm-1). otras vibraciones típicas de los carbohidratos en 1144, 1398, 1361, 995 y 876 cm-1.. Sin embargo, a diferencia del caso anterior, no hemos encontrado en la literatura información suficiente que nos permita hacer comparaciones. Ver figura 3.3.. 25.
(41) Resultados y Discusión. Figura 3.3. Espectro IR correspondiente a R’-2.. 3.2. Estudio de los productos R’-1 y R’-2. Tanto los productos R’-1 como R’-2 resultaron ser sólidos blancos rindiendo 58.69 % y 58.25 % (m/v) respectivamente, dando resultados positivos para los ensayos con la 2,4-dinitrofenilhidrazina y el reactivo de Benedit. Estos, al ser suspendidos en agua, muestran apariencia de dispersión coloidal. Los espectros de. 1. H-RMN de ambos productos fueron registrados y los. mismos presentan las características típicas de estos compuestos. Del análisis de la bibliografía conocemos que las señales más desapantalladas (por. encima. de. 4. ppm). corresponden. a. los. protones. anoméricos,. específicamente desde 4.0 a 4.7 ppm aparecen los protones de configuración β, mientras que desde 4.7 a 5.6 ppm resuenan los de configuración α para polisacáridos de la hemicelulosa del bagazo. Entre 2.0 y 4.0 ppm aparecen los protones ecuatoriales y axiales de los azúcares que constituyen el polímero (Jing-Xia Sun, 2004, F. Xu, 2006, J.X. Sun, 2004).. 26.
(42) Resultados y Discusión. Al registrar el espectro de. 1. H-RMN de R’-1 en DMSO-d6 aparecen las. siguientes señales, que hemos asignado por comparación con datos que aparecen en la literatura para la misma biomasa. Ver tabla 3.2 y 3.3. (Ver espectros 1HRMN en el anexo 1).. Tabla 3.2.. R’-1 DMSO-d6. Señales. Asignaciones de las señales por comparación. 6.6 ppm. H aromáticos del ácido p-coumárico o ácido ferúlico. 6.2 ppm. H aromáticos de residuos de la lignina. 5.13 ppm. (d, J=3.8) H-1 de α–arabinofuranosa (Señal muy poco intensa). 4.8 ppm. (d, J=3.6) H-1 de α-xilopiranosa. 4.2 ppm. (d, J=7.6) H-1 de β-xilopiranosa. 1.6 ppm. (s) debido a grupos metoxilos del ácido glucorónico. Tabla 3.3.. R’-2 DMSO-d6 Señales. Asignaciones de las señales por comparación. 8.4 ppm. (s) No ha podido ser asignada. 4.8 ppm. señal deformada que no ha podido ser asignada.. 4.2 ppm. (d, J=7.5) H-1 de β-xilopiranosa. 1.6 ppm. (s) debido a grupos metoxilos del ácido glucorónico. 27.
(43) Resultados y Discusión. De acuerdo a estos resultados se evidencia, además de otros restos, la presencia de xilosa en ambos productos y arabinosa en R’-1 pero a través de una señal muy poco intensa por lo que decidimos repetir el espectro para esta muestra, en este caso utilizando agua deuterada como disolvente; los resultados fueron los mismos pero la señal en 5.13 ppm se intensificó. 3.3 Estudio de R’-1 y R’-2 mediante la técnica de cromatografía gaseosa acoplada a un espectrómetro de masas. Con el objetivo de conocer características estructurales de estos polímeros realizamos un estudio utilizando el procedimiento de cromatografía gaseosa acoplada a un espectrómetro de masas y combinando procesos de derivatización e hidrólisis. (Ver todos los cromatogramas correspondientes a los diferentes experimentos en el anexo 2). Inicialmente y con el objetivo de ir buscando las condiciones de trabajo, utilizamos la reacción con anhídrido acético en piridina para obtener derivados acetilados antes de la inyección en la columna del cromatógrafo. En un primer experimento, este proceso se realizó directamente sobre los productos (R’-1 y R’-2) y los resultados se muestran en la figura 3.4. (x100,000) 4.0 3.5 3.0 2.5 2.0 1.5 1.0 0.5 5.50. 5.75. 6.00. 6.25. 6.50. 6.75. 7.00. 7.25. Figura 3.4. Cromatograma correspondiente a R’-1 acetilado (rosado), R’-2 en las mismas condiciones (negro) utilizando como disolvente DMSO.. 28.
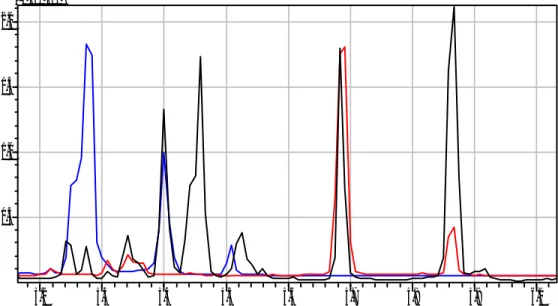
(44) Resultados y Discusión. Para R’-1 se observan dos picos cuyos espectros de masas corresponden a pentosas peracetiladas (probablemente isómeros alfa y beta) que se encuentran en forma libre en la muestra (ver anexo 3). Para R’-2, en la región de trabajo no se apreció señal alguna. Teniendo en cuenta los resultados obtenidos hasta el momento y la poca cantidad que disponíamos de este último producto, continuamos el trabajo solamente con R’-1. En otro experimento, este compuesto fue primeramente hidrolizado y posteriormente acetilado y el producto de reacción fue disuelto en DMSO antes de ser inyectado en la columna. Por otra parte, patrones de D-xilosa y D-arabinosa fueron derivatizados y cromatografiados utilizando el mismo procedimiento. En la figura 3.5 aparecen de forma superpuesta los cromatogramas de muestra y los patrones. Ver espectros de masa en el anexo 4.. (x1,000,000) 5.5 5.0 4.5 4.0 3.5 3.0 2.5 2.0 1.5 1.0 0.5. 5.8. 5.9. 6.0. 6.1. 6.2. 6.3. Figura 3.5. Cromatogramas de los patrones de D-xilosa, D-arabinosa y producto de hidrólisis de R’-1 peracetilados. Producto de hidrólisis (negro), patrón de D-xilosa (azul) y patrón de D-Arabinosa (rojo) usando como disolvente DMSO.. 29.
(45) Resultados y Discusión. Para cada patrón aparecen varios picos, comportamiento éste que ha sido anteriormente. reportado. (SARAH. L.. VALLANCE,. 1998);. estos. son. coincidentes con los de la muestra por lo que de esta forma se confirma la presencia de xilosa y arabinosa como constituyentes del polímero y que estos se encuentran en una relación 0.38 (Ara/Xil) según la determinación relativa de las áreas bajo la curva. Con el objetivo de buscar una mayor calidad en los cromatogramas repetimos éste último procedimiento pero, en lugar de utilizar DMSO como disolvente, los productos de reacción fueron extraídos con cloroformo y éste fue inyectado en la columna. Los resultados son similares a los descritos anteriormente pero en este caso puede apreciarse una mejor resolución de los picos así como mayor facilidad de comparación con los patrones correspondientes.. Se. puede. ver. que. la. muestra. está. compuesta. fundamentalmente por dos azúcares, arabinosa y xilosa. Ver figura 3.6. (x100,000) 3.0 2.5 2.0 1.5 1.0 0.5 0.0 5.6. 5.7. 5.8. 5.9. 6.0. 6.1. 6.2. 6.3. Figura 3.6. Cromatogramas correspondientes a R’-1 (hidrolizado y peracetilado) (rojo), patrón de xilosa peracetilada (negro) y patrón de Arabinosa peracetilada (azul) realizado después de extracción con CHCl3.. 30.
(46) Resultados y Discusión. Por último, repetimos este procedimiento pero utilizando como derivado los trimetilsilanos (TMS) en lugar de la acetilación. La sililación es el método de derivatización más usado actualmente para análisis por GC. Los reactivos son de fácil manejo en la formación de los derivados. En la sililación, un hidrógeno activo es reemplazado por un grupo del alquilsilil, como trimetilsilil. Comparados con otros derivados son más volátiles, menos polares, y más termoestables. Como consecuencia, la separación y detección es óptima. El cromatograma de la figura 5.7 muestra el resultado del uso de este derivado sobre el producto de hidrólisis de R’-1, en este caso los resultados son similares a los mostrados anteriormente aunque la relación Ara/Xil fue de O.55, aspecto éste en que debemos seguir profundizando. (Ver espectros de masas en el anexo 5). Por otra parte, a un tiempo de retención de alrededor de 5.46 aparecen dos picos muy unidos que no hemos podido asignar. (x1,000,000) 2.0. 1.5. 1.0. 0.5. 5.2. 5.3. 5.4. 5.5. 5.6. 5.7. 5.8. 5.9. 6.0. Figura 3.7. Cromatograma correspondiente al producto de hidrólisis de R’-1 TMS (negro), patrón de D-xilosa TMS (rojo) y patrón de D-Arabinosa TMS (azul).. 31.
(47) Conclusiones.
(48) Conclusiones. Conclusiones: 3 Se estableció un procedimiento para el tratamiento de los licores oscuros residuales (neutralización-decoloración) hasta obtener los productos R’-1 y R’-2 de color blanco.. 3 Utilizando el método de cromatografía gaseosa acoplada a la espectroscopía. de. masas. se. montaron. técnicas. de. determinación de pentosas mediante el uso de derivados acetilados y sililados.. 3 Mediante el uso combinado de las técnicas de espectrometría IR, RMN 1H y CROM-MASS se determinó en el residual ácido (R’-1) la presencia de xilosa y arabinosa libres o formando parte de sustancias poliméricas.. 32.
(49) Recomendaciones.
(50) Recomendaciones. Recomendaciones. 3 Profundizar. en. los. estudios. para. las. determinaciones. cuantitativas de los azúcares encontrados. 3 Trabajar en el tamizaje de los polímeros de acuerdo a sus masas moleculares. 3 Estudiar. el. uso. de. otras. determinación de carbohidrato.. 33. técnicas. instrumentales. en. la.
(51) Bibliografía.
(52) Bibliografía. Bibliografía ABDELKADER BENDAHOU, A. D., HAMID KADDAMI, YOUSSEF HABIBI (2007) Isolation and structural characterization of hemicelluloses from palm of Phoenix dactylifera L. Carbohydrate Polymers, 68, 601-608. ALINE BARBAT, V. G., *,† CHARLOTTE MOINE,† ODILE SAINTE-CATHERINE,‡ MICHEL KRAEMER,‡ HE´LE`NE ROGNIAUX,§ DAVID ROPARTZ,§ AND PIERRE KRAUSZ† (2008) Structural Characterization and Cytotoxic Properties of a 4-O-Methylglucuronoxylan from Castanea satiWa. 2. Evidence of a Structure-Activity Relationship. Natural Products, 71, 1404-1409. ALZBETA KARDOSÏOVAÂ *, M. R. M., ANNA MALOVÕÂKOVA (1998) (4-OMethyl-alpha-d-glucurono)-d-xylan. fromRudbeckia. fulgida,. var.. sullivantii(Boynton et Beadle). Carbohydrate Research, 308, 99105. BAUDEL, H. M. Z., C.; ABREU, C. A. M. IND. (2005) Crops Prod., 21, 309– 315. BOSTANCI,. Ö.. A.. A.. S.. (2009). Xylooligosaccharide. production. from. lignocellulosic wastes with Trichoderma longibrachiatum xylanase. Food, Agriculture & Environment, 7, 70-74. C.F. LIU, R. C. S., J. YE (2006) Structural and thermal characterization of sugarcane bagasse phthalates prepared with ultrasound irradiation. Polymer Degradation and Stability, 91 280-288. DAHLMAN, S. B. A. O. (2002) Chemical Compositions of Hardwood and Softwood Pulps Employing Photoacoustic Fourier Transform Infrared Spectroscopy in Combination with Partial Least-Squares Analysis Analitical Chemistry, 74, 5851-5858. DANIEL J. PASTO, C. R. J. (1995) Determinación de Estructuras Orgánicas. DEBORA NABARLATZ, A. E., DANIEL MONTANÉ (2007) Autohydrolysis of agricultural by-products for the production of xylo-oligosaccharides. Carbohydrate Polymers, 69, 20-28.. 34.
(53) Bibliografía F. XU, J. X. S., C. F. LIUB AND R. C. SUNB (2006) Comparative study of alkali-. and. acidic. organic. solvent-soluble. hemicellulosic. polysaccharides from sugarcane bagasse. Carbohydrate Research, 341, 253-261. GATENHOLM, P. T., M. (2004) ACS Symp. Ser., 864, 1–2. H. KOMIYAMA, A. K. B., H. AIMI, J. OGIHARA, K. SHIMIZU (2008) Chemical structure of kenaf xylan. Carbohydrate Polymers, 72, 638-645. J.X. SUN, X. F. S., R.C. SUN, Y.Q. SU (2004) Fractional extraction and structural. characterization. of. sugarcane. bagasse. hemicelluloses.. Carbohydrate Polymers 56 195-204. JING-XIA SUN, R.-C. S., XIAO-FENG SUNB AND YINQUAN SUA (2004) Fractional and physico-chemical characterization of hemicelluloses from ultrasonic irradiated sugarcane bagasse. Carbohydrate Research, 339, 291-300. KNAPP, D. R. (1979) Handbook of Analytical Derivatization Reactions, New York. LAHOUARI CHAA, N. J., VINCENT LEQUART, CÉLINE FAUGERON, JEANCLAUDE MOLLET, PATRICK MARTIN, HENRI MORVAN (2008) Isolation, characterization and valorization of hemicelluloses from Aristida pungens leaves as biomaterial. Carbohydrate Polymers, 74, 597-602. M. KACÏURAÂKOVAÂ, N. W., A. EBRINGEROVAÂ, Z. HROMAÂDKOVAÂ, R.H. WILSON,. P.S.. BELTON. (1999. ). Characterisation. of. xylan-type. polysaccharides and associated cell wall components by FT-IR and FTRaman spectroscopies. Food Hydrocolloids, 13, 35-41. MARTINEZ, E. A. S., S. S.; SILVA, J. B. A.; SOLENZAL, A. I. N.; FELIPE, M. G. A. (2003a) Process Biochem., 38, 1677–1683. MARTINEZ, E. A. S., S. S.; SILVA, J. B. A.; SOLENZAL, A. I.N.; FELIPE, M. G. A. (2003b) Process Biochemistry, 38, 677–1683.. 35.
(54) Bibliografía MIKKOLA, J. P. S., T. (2001) Catal. Today, 64, 271–277. NORTHCOTE, D. H. (1972) CHEMISTRY OF THE PLANT CELL WALL. Annu. Rev. Plant. Physiol, 23, 113-132. ORAPHIN CHAIKUMPOLLERTA, P. M., KRISDA SUCHIVA (2004) Structural elucidation. of. hemicelluloses. from. Vetiver. grass.. Carbohydrate. Polymers, 57, 191-196. OZLEM. AKPINAR. *,. K.. E.,. SEYDA. BOSTA. (2009). Production. of. xylooligosaccharides by controlled acid hydrolysis of lignocellulosic materials. Carbohydrate Research. PAUL ROBERT, M. L. M., † CEÄ CILE BARRON,§ FABIENNE GUILLON,† AND & LUC. SAULNIER*. (2005). FT-IR. Investigation. of. Cell. Wall. Polysaccharides from Cereal Grains. Arabinoxylan Infrared Assignment. Agricultural and Food Chemistry, 53, 7014-7018. R. SINGH, S. S., K.D. TRIMUKHE, K.V. PANDARE, K.B. BASTAWADE, D.V. GOKHALE, A.J. VARMA (2005) Lignin–carbohydrate complexes from sugarcane bagasse: Preparation, purification, and characterization. Carbohydrate Polimers, 62 57–66. RAJESH, K. J. S., M.; GLASSER, W. G. (2001) Cellulose, 7, 319–336. RUNCANG SUN, J. M. L. W. B. B. (1996) Fractional and structural characterization. of. wheat. straw. hemicelluloses.. Carbohydrate. Polymers, 29, 325-331. SARAH L. VALLANCE, B. W. S., S. M. HITCHEN, & J. H. TOWNSEND (1998) THE. DEVELOPMENT. AND. INITIAL. APPLICATION. OF. A. GAS. CHROMATOGRAPHIC METHOD FOR THE CHARACTERIZATION OF GUM MEDIA. JAIC, 37, 294-311. SUN, J. X. X., F.; SUN, X. F.; SUN, R. C.; WU, S. B. (2004) Polymers Int., 53, 1711–1721. WANG, Y. (2009) Prebiotics: Present and future in food science and technology Food Research International, 42, 8-12.. 36.
(55) Bibliografía XIAO-FENG SUN, R.-C. S., QI LU, FENG XU, AND LU LIN (2002) Fractional Isolation and Physico-Chemical Characterization of Hemicelluloses by a Two-Stage Treatment from Haloxylon ammodendron and Elaeagnus angustifolia. Agricultural and Food Chemistry, 50, 6400-6407. YOUSSEF HABIBI, M. M., MICHEL R. VIGNONA (2002) Isolation and structure of D-xylans from pericarp seeds of Opuntia ficus-indica prickly pear fruits. Carbohydrate Research, 337, 1593-1598. ZHU,. L.. (2005). AFFECTING. FUNDAMENTAL ENZYMATIC. STUDY. OF. HYDROLYSIS. BIOMASS.. 37. STRUCTURAL OF. FEATURES. LIGNOCELLULOSIC.
(56) Anexos.
(57) Anexos. Anexo 2 Espectro HRMN de R’-1 en DMSO. 250. 200. 150. 100. 50. 0. 5.0. 0.0. ppm (t1). Espectro HRMN de R’-2 en DMSO. 100. 50. 0. 5.0 ppm (f1). 0.0.
(58) Anexos Espectro HRMN de R’-1 en D2O. 100. 50. 0. 10.0 ppm (t1). 5.0. 0.0.
(59) Anexos. Anexo 2 Cromatogramas de R’-1 y R’-2 en los diferentes experimentos. DMSO R’-1 peracetilado (x1,000,000). 2.0. 1.5. 1.0. 0.5. 5.0. 7.5. 10.0. 12.5. 15.0. 17.5. 7.5. 10.0. 12.5. 15.0. 17.5. R’-2 peracetilado (x1,000,000) 2.5. 2.0. 1.5. 1.0. 0.5. 5.0.
(60) Anexos Producto de la hidrólisis peracetilado 2.25. (x1,000,000). 2.00 1.75 1.50 1.25 1.00 0.75 0.50 0.25 5.0. 7.5. 10.0. 12.5. 15.0. 17.5. 12.5. 15.0. 17.5. CHCl3 Producto de hidrólisis de R’-1 peracetilado (x1,000,000) 1.25. 1.00. 0.75. 0.50. 0.25. 5.0. 7.5. 10.0.
(61) Anexos TMS Producto de hidrólisis de R’-1 TMS 8.0. (x1,000,000). 7.0. 6.0 5.0 4.0 3.0 2.0 1.0. 5.0. 7.5. 10.0. 12.5. 15.0. 17.5. Anexo 3 Espectro de Masa de R’-1 acetilado. %. 68. 100.0. 75.0. 128 63 115. 50.0. 60 86 73. 25.0. 78. 57. 97 103. 170. 114. 0.0 50.0. 75.0. 100.0. 157. 125.0. 150.0. 175.0. 200.0.
(62) Anexos. Anexo 4 Espectros de masa de R’-1 (hidrolizado y acetilado) para los picos 3 (xilosa) y 5 (arabinosa) % 68. 100.0. 128 75.0 115 86 50.0. 60. 97 73. 25.0. 103 170. 57. 157. 114 63 78. 0.0 50.0. 139. 100 87. 75.0. 100.0. 125.0. 145 150.0. 175.0. 200.0. % 69. 100.0. 128. 75.0. 115. 86 60 97. 50.0. 103. 63 73. 25.0. 57. 170 114. 78. 139. 100. 0.0 50.0. 75.0. 100.0. 125.0. 157. 150.0. 175.0. 200.0.
(63) Anexos Espectro de masa del patrón de D-Arabinosa peracetilada %. 128. 100.0. 75.0 115 69. 50.0. 86. 170. 103. 25.0. 97. 73. 63 57 61. 157. 78 100. 0.0 50.0. 75.0. 139 145. 113. 87 100.0. 125.0. 171. 150.0. 175.0. 200.0. Espectro de masa del patrón de D-xilosa peracetilada % 128. 100.0 68 114 75.0 85. 96 102. 50.0. 170 157. 72. 25.0 56. 60. 99. 139. 62 52 0.0 50.0. 77 81 75.0. 145 86. 111 100.0. 171. 130 125.0. 150.0. 175.0. 199 200.0.
(64) Anexos. Anexo 5 Espectros de masa del producto de hidrólisis de R’-1 de los picos 4 (arabinosa) y 8 (xilosa) TMS % 73. 100.0. 75.0. 50.0. 25.0 217. 147 59 0.0 50.0. 191 204. 69 75 83 89 75.0. 133 134 143 155 125.0 150.0. 103 117 100.0. 171 175.0. 189. 206 200.0. 218 231 245 246 259 291 305 225.0 250.0 275.0 300.0. 333 325.0. 350.0. 333 325.0. 350.0. % 100.0. 73. 75.0. 50.0. 204. 25.0 147 75 59 69 0.0 50.0. 103. 79 89 75.0 100.0. 191. 217. 189 206 218 117 133 134 143 157 169 194 231 243 259 279 292 305 125.0 150.0 175.0 200.0 225.0 250.0 275.0 300.0.
(65) Anexos Espectro de masa del patrón de D-xilosa TMS % 73. 100.0. 75.0. 50.0 204. 25.0. 40 0.0. 191. 147. 45 69 59 55 67 76 50. 89. 101. 129 116 127. 100. 148. 169. 150. 217. 192. 221 231 243 259 250. 200. 279 291 305 300. 333. Espectro de masa del patrón de D-arabinosa TMS % 73. 100.0. 75.0. 50.0. 217 25.0 191 204. 45. 0.0. 147 59 69 5561 76. 50.0. 75.0. 103 89 97 100.0. 117 129 125.0. 148 157 169 150.0 175.0. 192 200.0. 215. 231 243 259 225.0 250.0 275.0. 305 300.0.
(66)
Figure



Documento similar
Además de aparecer en forma de volumen, las Memorias conocieron una primera difusión, a los tres meses de la muerte del autor, en las páginas de La Presse en forma de folletín,
que hasta que llegue el tiempo en que su regia planta ; | pise el hispano suelo... que hasta que el
dente: algunas decían que doña Leonor, "con muy grand rescelo e miedo que avía del rey don Pedro que nueva- mente regnaba, e de la reyna doña María, su madre del dicho rey,
Abstract: This paper reviews the dialogue and controversies between the paratexts of a corpus of collections of short novels –and romances– publi- shed from 1624 to 1637:
E Clamades andaua sienpre sobre el caua- 11o de madera, y en poco tienpo fue tan lexos, que el no sabia en donde estaña; pero el tomo muy gran esfuergo en si, y pensó yendo assi
por unidad de tiempo (throughput) en estado estacionario de las transiciones.. de una red de Petri
Habiendo organizado un movimiento revolucionario en Valencia a principios de 1929 y persistido en las reuniones conspirativo-constitucionalistas desde entonces —cierto que a aquellas
Ciaurriz quien, durante su primer arlo de estancia en Loyola 40 , catalogó sus fondos siguiendo la división previa a la que nos hemos referido; y si esta labor fue de