Degradación de la fluoresceína sódica por fotocatálisis heterogénea en un reactor heliofotocatálitico
Texto completo
(2) DEGRADACIÓN DE LA FLUORESCEÍNA SÓDICA POR FOTOCATÁLISIS HETEROGÉNEA EN UN REACTOR HELIOFOTOCATÁLITICO. JHON MAURO LAINA AGUDELO. Trabajo de grado para optar al título de Tecnólogo en Química. Director: HÉCTOR FABIO CORTES H. UNIVERSIDAD TECNOLÓGICA DE PEREIRA FACULTAD DE TECNOLOGÍA ESCUELA DE QUÍMICA PROGRAMA DE TECNOLOGÍA QUÍMICA PEREIRA 2010 2.
(3) Nota de aceptación: ________________________ ________________________ ________________________. ________________________ Presidente del jurado. ________________________ Jurado. ________________________ Jurado. Pereira, ___ de ______de 2010 3.
(4) “La investigación científica es indispensable para cualquier nación; investigar en catálisis es estratégico para cualquier país” Bernard Delmon 4.
(5) Dedico este trabajo a todas las personas que hicieron posible que este sueño se viera realizado.. A dos grandes mujeres que lo son todo en mi vida; mi abuela Alicia Montoya y mi hermana Alejandra Mª Laina; que gracias a sus esfuerzos he llegado a ser lo que soy. Por no desfallecer, estar siempre a mi lado y enseñarme que no hay que darse por vencido nunca.. Y en especial a mi madre Oneida Agudelo que donde este logre cumplir su sueño y que sigue siendo mi inspiración para seguir adelante en cada paso que doy y en cada proyecto que emprendo.. 5.
(6) AGRADECIMIENTOS. A HÉCTOR FABIO CORTES, Director del trabajo, por su colaboración y por compartir conmigo parte de sus conocimientos.. A HOOVER ALBEIRO VALENCIA, por su apoyo incondicional en la realización del trabajo y por enseñarme con esmero lo que necesitaba para realizarlo.. A CARLOS HUMBERTO MONTOYA y MARÍA VICTORIA SANCHEZ, por su disposición y colaboración en el préstamo de los equipos, laboratorios y reactivos usados.. A todos los profesores, por enseñarme y brindarme un poco de su conocimiento.. A mis amigos, Laura, Sandra, Steffany, Juan Andrés, Juan David, Juan Manuel, Juan Pablo, Sebastián; que siempre me apoyaron para que siguiera adelante y no me diera por vencido; y en especial a Mario Correa, Luis Valladales y Remmy.. Y a mis compañeros, por su apoyo incondicional en momentos difíciles; en especial a Jenny, Lina y Daniel.. 6.
(7) CONTENIDO. Pág. 1. INTRODUCCIÓN. 18. 2. PLANTEAMIENTO DEL PROBLEMA. 21. 3. JUSTIFICACIÓN. 22. 4. OBJETIVOS. 23. 4.1 OBJETIVO GENERAL. 23. 4.2 OBJETIVOS ESPECÍFICOS. 23. 5. MARCO DE REFERENCIA. 24. 5.1 MARCO DE ANTECEDENTES. 24. 5.2 MARCO TEÓRICO. 25. 5.2.1 Fotocatálisis heterogénea.. 25. 5.2.2 Parámetros que influyen en el proceso de fotocatálisis heterogénea. 28. 5.2.3 Fluoresceína Sódica.. 37. 6. METODOLOGÍA. 41. 6.1 MUESTRA DE ANÁLISIS. 41. 6.1.1 Solución madre de Fluoresceína Sódica (200 ppm).. 41. 6.1.2 Longitud de onda.. 41. 6.1.3 Curva de calibración.. 41. 6.1.4 Límite de detección.. 42. 6.1.5 Límite de cuantificación.. 42. 6.1.6 Espectrofotometría de UV.. 42. 7.
(8) 6.1.7 Demanda Química de Oxigeno (DQO).. 43. 6.1.8 Carbono Orgánico Total (COT).. 43. 6.1.9 Muestra para Reactor Solar.. 43. 6.1.10 Muestra para Reactor Artesanal.. 44. 6.1.11 Medida de la cinética de la reacción. 44. 6.1.12 Análisis estadístico por comparación de medias.. 45. 7. RESULTADOS. 46. 7.1 BARRIDO ESPECTRAL PARA UNA SOLUCIÓN DE FLUORESCEÍNA SÓDICA. 46. 7.2 CURVA DE CALIBRACIÓN PARA LA FLUORESCEÍNA SÓDICA. 46. 7.3 LÍMITE DE DETECCIÓN. 48. 7.4 LÍMITE DE CUANTIFICACIÓN. 49. 7.5 ENSAYOS. 49. 7.5.1 Ensayo 1.. 50. 7.5.2 Ensayo 2.. 51. 7.5.3 Ensayo 3.. 52. 7.5.4 Ensayo 4.. 55. 7.5.5 Ensayo 5.. 57. 7.5.6 Ensayo 6.. 58. 7.5.7 Ensayo 7.. 59. 7.6 COMPARACIÓN CON REACTOR ARTESANAL. 60. 7.6.1 Ensayo 1 Reactor Artesanal.. 60. 7.6.2 Ensayo 2 Reactor Artesanal.. 61. 7.6.3 Ensayo 3 Reactor Artesanal.. 62 8.
(9) 7.6.4 Ensayo 4 Reactor Artesanal.. 64. 7.7 REUTILIZACIÓN DEL DIÓXIDO DE TITANIO. 65. 7.8 CINÉTICA DE LA REACCIÓN. 67. 7.9 ANÁLISIS ESTADÍSTICO POR COMPARACIÓN DE MEDIAS. 70. 8. ANÁLISIS DE RESULTADOS. 71. 9. CONCLUSIONES. 77. 10. RECOMENDACIONES. 78. 11. BIBLIOGRAFÍA. 79. 9.
(10) LISTA DE TABLAS Pág. Tabla 1. Absorbancia medidas para el límite de detección. 48. Tabla 2. Resultados obtenidos en el ensayo 1. 50. Tabla 3. Resultados obtenidos en el ensayo 2. 51. Tabla 4.Resultados obtenidos en el ensayo 3. 53. Tabla 5. Resultados obtenidos en el ensayo 4. 55. Tabla 6. Resultados obtenidos en el ensayo 5. 57. Tabla 7. Resultados obtenidos en el ensayo 6. 58. Tabla 8. Resultados obtenidos en el ensayo 7. 59. Tabla 9. Resultados obtenidos ensayo 1 Reactor Artesanal. 60. Tabla 10. Resultados obtenidos ensayo 2 Reactor Artesanal. 61. Tabla 11. Resultados obtenidos ensayo 3 Reactor Artesanal. 62. Tabla 12. Resultados obtenidos ensayo 4 Reactor Artesanal. 64. Tabla 13. Resultados obtenidos ensayo reutilización del TiO2. 66. Tabla 14.Resultados obtenidos para la cinética de la reacción. 67. Tabla 15. Resultados obtenidos para el análisis estadístico por comparación de medias. 70. Tabla 16. Datos obtenidos para irradiación solar. 72. 10.
(11) LISTA DE FIGURAS Pág. Figura 1. Proceso general de la fotocatálisis heterogénea. 27. Figura 2. Reactor Solar cilindro parabólico compuesto. 31. Figura 3. Reactor Artesanal. 31. Figura 4. Estructura de la Fluoresceína Sódica. 37. Figura 5. Evaluación estática de la lente inicial por pigmentación con Fluoresceína Sódica. 38. Figura 6. Espectroscopia UV-vis de la Fluoresceína Sódica en solución básica, neutra y ácida. 40. Figura 7. Barrido espectral de la solución madre de Fluoresceína Sódica. 46. Figura 8. Gráfica de la curva de calibración para la Fluoresceína Sódica. 47. Figura 9. Gráfica Tiempo (min) vs. Concentración (ppm) ensayo 1. 50. Figura 10. Gráfica Tiempo (min) vs. % D. P ensayo 1. 51. Figura 11. Gráfica Tiempo (min) vs. Concentración (ppm) ensayo 2. 52. Figura 12. Gráfica Tiempo (min) vs. % D. P ensayo 2. 52. Figura 13. Gráfica Tiempo (min) vs. Concentración (ppm) ensayo 3. 53. Figura 14. Gráfica Tiempo (min) vs. % D. P ensayo 3. 54. Figura 15. Gráfica Tiempo (min) vs. DQO (mgO2/L) ensayo 3. 54. Figura 16. Gráfica Tiempo (min) vs. Concentración (ppm) ensayo 4. 55. Figura 17. Gráfica Tiempo (min) vs. % D. P ensayo 4. 56. Figura 18. Gráfica Tiempo (min) vs. DQO (mgO2/L) ensayo 4. 56. 11.
(12) Figura 19. Gráfica Tiempo (min) vs. DQO (mgO2/L) ensayo 5. 57. Figura 20. Gráfica Tiempo (min) vs. DQO (mgO2/L) ensayo 6. 58. Figura 21. Gráfica Tiempo (min) vs. DQO (mgO2/L) ensayo 7. 59. Figura 22. Gráfica Tiempo (min) vs. DQO (mgO2/L) ensayo 1 Reactor Artesanal. 61. Figura 23. Gráfica Tiempo (min) vs. DQO (mgO2/L) ensayo 2 Reactor Artesanal. 62. Figura 24. Gráfica Tiempo (min) vs. Concentración (ppm) ensayo 3 Reactor Artesanal. 63. Figura 25. Gráfica Tiempo (min) vs. % D. P ensayo 3 Reactor Artesanal. 63. Figura 26. Gráfica Tiempo (min) vs. Concentración (ppm) ensayo 4 Reactor Artesanal. 64. Figura 27. Gráfica Tiempo (min) vs. % D. P ensayo 4 Reactor Artesanal. 65. Figura 28. Gráfica Tiempo (min) vs. Concentración (ppm) ensayo reutilización del TiO2. 66. Figura 29. Gráfica Tiempo (min) vs. % D. P ensayo reutilización del TiO2. 67. Figura 30. Gráfica Tiempo (min) vs. Concentración (ppm). 68. Figura 31. Gráfica Tiempo (min) vs. Ln Concentración. 68. Figura 32. Gráfica Tiempo (min) vs. 1/Concentración. 69. Figura 33. Gráfica Tiempo (min) vs. 1/Concentración2. 69. Figura 34. Componentes de la radiación solar. 72. Figura 35. Gráfica Irradiación solar (W/m2) vs. % D. P ensayos 1 a 4. 73. Figura 36. Gráfica Irradiación solar (W/m2) vs. % D. P ensayos 5 a 7. 74. 12.
(13) LISTA DE ESQUEMAS Pág. Esquema 1.Reacción global de la fotocatálisis heterogénea. 25. Esquema 2. Reacción entre el semiconductor y un fotón de energía (hv). 26. Esquema 3. (a) Reacción hueco (h+) – Agua (H2O), (b) reacción hueco (h+) – ion hidroxilo (OH-).. 26. Esquema 4. Reacción de formación del radical superóxido. 26. Esquema 5. (a) Reacción de fragmentación del contaminante (RH), (b) reacción de fragmentación hasta degradación.. 27. Esquema 6. (a) Reacción peróxido de hidrogeno (H2O2) – hueco de banda de valencia (h+vb), (b) reacción de H2O2 – electrón de banda de conducción (e-bc), (c) reacción de H2O2 – radical superóxido (·O2-).. 29. Esquema 7. Reacción de peróxido de hidrogeno (H2O2) – radical hidroxilo (·OH). 29. Esquema 8. Reacciones generales del TiO2 en la fotocatálisis heterogénea.. 33. Esquema 9. Cinética de los principales pasos en el mecanismo fotoelectroquímico del TiO2. 34. Esquema 10. Destino de los electrones y los huecos dentro de una partícula esférica de titanio en presencia de moléculas aceptoras (A) y (D). 34. Esquema 11. Reacciones secundarias con especies activadas del oxigeno en el mecanismo fotoelectroquímico.. 35. Esquema 12. Superficie del dióxido de titanio y su hidroxilación a través de la quimisorción disociativa del agua.. 36. Esquema 13. Ácido nucleico marcado con un marcador fluoresceínado.. 39. 13.
(14) ACRÓNIMOS. Abs. = Absorbancia.. ADN. = Ácido Desoxirribonucleico.. COT. = Carbono Orgánico Total.. CPC. = Cilindro Parabólico Compuesto.. DQO. = Demanda Química de Oxígeno.. e-. = Especie portadora de carga negativa “electrón”.. e-cb. = Electrón de la banda de conducción.. eV. = Electro voltio.. FRET. = Transferencia resonante de energía.. h+. = Hueco. h+vb. = Hueco de la banda de valencia.. hv. = Fotón de energía.. H2O2. = Peróxido de hidrógeno.. ms. = Microsegundos.. NC. = No Cuantificable.. ND. = No Detectable.. nm. = Nanómetros.. ns. = Nanosegundos.. O2 ·O2. = Oxígeno molecular. -. = Radical Superóxido.. OH-. = Ion Hidroxilo.. ·OH. = Radical Hidroxilo.. Ox. = Oxidante.. ppm. = Partes por Millón.. Red. = Reductor.. ·RO2. = Radical Peroxilo.. RP. = Residuos Peligrosos.. Sln. = Solución. 14.
(15) t. = Tiempo.. TiO2. = Dióxido de Titanio.. UV. = Radiación Ultravioleta.. Vis. = Visible.. µm. = Micrómetros.. λ. = Longitud de Onda.. % D. P = Porcentaje de Degradación Primaria. []. = Concentración.. 15.
(16) RESUMEN. Mediante el método avanzado de oxidación para la eliminación de contaminantes de aguas residuales llamado fotocatálisis Heterogénea, se realizó la degradación de la Fluoresceína Sódica, colorante obtenido en los laboratorios de Química Orgánica II en la Escuela de Química de la Universidad Tecnológica de Pereira; como parte de los laboratorios de docencia allí desarrollados.. Para la realización de la Degradación de la Fluoresceína Sódica por fotocatálisis heterogénea en un Reactor Heliofotocatálitico, se ejecutaron 7 ensayos diferentes, lográndose como condiciones optimas una concentración de peróxido de hidrogeno (H2O2) de 300 ppm; dióxido de titanio (TiO2) 1 g/L y un pH acido (pH ≈ 3,15), con una irradiación solar de 271, 68 W/m2.. A partir de los datos obtenidos para la Degradación de la Fluoresceína Sódica por fotocatálisis heterogénea en un Reactor Heliofotocatálitico en condiciones optimas, se realizo todo el proceso para determinar el porcentaje de degradación 100 % y el porcentaje de mineralización 48,8 %.. Palabras claves: Fotocatálisis heterogénea, Fluoresceína Sódica, TiO2, H2O2, Porcentaje de degradación, porcentaje de mineralización.. 16.
(17) ABSTRACT. Through advanced oxidation method for removing pollutants from wastewater called Heterogeneous photocatalysis was carried out the degradation of sodium fluorescein dye obtained in the laboratory of Organic Chemistry II at the School of Chemistry at the Technological University of Pereira, as part teaching laboratories developed there.. For the realization of the degradation of sodium fluorescein by heterogeneous photocatalysis in a Reactor Heliofotocatalitico, different tests were carried out in July, achieving such optimal conditions a concentration of hydrogen peroxide (H2O2) of 300 ppm; titanium dioxide (TiO2) 1 g / L and an acid pH (pH ≈ 3.15), Whit a solar radiation of 271,68 W/m2.. From the data obtained for the degradation of sodium fluorescein by heterogeneous photocatalysis in a Reactor Heliofotocatalitico in optimal conditions, the whole process was conducted to determine the percentage degradation of 100% and 48.8% rate of mineralization.. Keywords: Heterogeneous photocatalysis, Fluorescein Sodium, TiO2, H2O2, percentage of degradation, rate of mineralization.. 17.
(18) 1. INTRODUCCIÓN. El agua es un recurso escaso en muchas regiones del mundo y sus múltiples usos la convierten en un recurso vital y limitado; con lo cual surge la necesidad de ser reutilizada tanto en procesos industriales como en la agricultura. Por otra parte, la energía solar es abundante en muchas regiones de la tierra por lo que puede ser utilizada libremente en procesos que aprovechen su radiación, entre los cuales se encuentran la descontaminación de aguas. [1] La contaminación del agua se da debido a la producción de Residuos Peligrosos (RP), los cuales afectan seriamente a los ecosistemas en los cuales son desechados; estos residuos provienen de grandes y pequeños productores de los mismos. Para distinguir entre los grandes y pequeños productores de RP se debe tener en cuenta la cantidad que producen anualmente; se clasifican como pequeños productores de RP aquellos que no llegan a producir la cantidad de 10000 kilogramos por año; y entre estos se encuentran industrias de servicio, hogares, centros de investigación e instituciones educativas. Por lo que se nota que la gran mayoría de la contaminación del agua es generada de manera casera, industrial y en labores de investigación y enseñanza; siendo estos focos de contaminación fluvial los que se convierten en un gran reto en la sociedad de hoy, ya que los residuos generados crean un gran desequilibrio en los entornos en los cuales son desechados. [2] El desequilibrio causado en los ecosistemas proviene en su gran mayoría de los desechos que en su composición contiene compuestos orgánicos que no se degradan con técnicas oxidativas comunes. Hasta la fecha se han utilizado diferentes tecnologías de tratamiento terciario, como lo son la nanofiltración, la microfiltración, la electrocoagulación; los cuales consisten en retirar partículas de tamaños definidos y floculos generados químicamente, pero, que no aseguran la destrucción de los compuestos orgánicos presentes en los RP, por lo cual se utilizan en este caso tecnologías avanzadas de oxidación; los procesos avanzados H2O2 / UV y la fotocatálisis heterogénea y homogénea, así como tratamientos combinados de fotocatálisis y oxidación electrolítica. [3,4] La fotocatálisis es un proceso catalítico promovido por energía de determinada longitud de onda, capaz de excitar a un catalizador (semiconductor) al grado de hacer que se comporte como un material conductor en cuya superficie se 18.
(19) desarrollaran reacciones de óxido-reducción. Estas generan radicales libres muy reactivos. Estos atacaran a las especies a su alrededor rompiendo los enlaces moleculares y oxidando o reduciéndolas hasta convertirlas en especies menos complejas. Esta reducción en la complejidad molecular generalmente se traduce en una reducción del grado de contaminación de la especie que se esté tratando. [5,6]. El concepto de fotocatálisis heterogénea es simple: el uso de un sólido semiconductor (ej. TiO2, ZnO, ZrO2, CeO2, etc., o sulfuros como CdS, ZnS, etc.), que forma una suspensión estable bajo irradiación para estimular una reacción de la inter-fase sólido/ líquido o sólido / gas. En el caso de los procesos fotocatalíticos heterogéneos donde interviene un sólido semiconductor el mecanismo de fotorreacción comienza cuando un semiconductor es iluminado con fotones con energía igual o mayor a la separación energética existente entre la banda de valencia y la de conducción. En esta situación, tiene lugar una absorción de esos fotones y la creación en el seno del catalizador de pares electrón-hueco, los cuales se disocian en fotoelectrones libres en la banda de conducción y foto-huecos en la banda de valencia. Simultáneamente tiene lugar una adsorción de los contaminantes y el foto-hueco genera un radical hidroxilo (·OH) que oxidara al contaminante adsorbido. El flujo neto de electrones es nulo y el catalizador permanece inalterado. [7] En los últimos años se han producido muchos trabajos utilizando ésta técnica para la degradación de todo tipo de sustancias orgánicas, sustancias de alto potencial tóxico, pesticidas, herbicidas, metales pesados, colorantes, bacterias; entre otros, obteniendo resultados satisfactorios y aportando conocimientos tanto teóricos como prácticos.[8, 9,10] El objetivo general es aplicar el método de fotocatálisis heterogénea para degradar la Fluoresceína Sódica en aguas residuales producidas en los laboratorios de docencia de la Escuela de Química de la Universidad Tecnológica de Pereira. Se realizan ensayos de Demanda Química de Oxigeno (DQO), Carbono Orgánico Total (COT) y concentración para una solución de Fluoresceína Sódica que fue sometida a reacción durante diferentes periodos de tiempo, y condiciones de: Reacción bajo luz solar, en presencia de un catalizador (TiO2) y en presencia del catalizador más Peróxido de Hidrógeno (H2O2) como compuesto oxidante; a la vez 19.
(20) estos primeros ensayos fotocatalíticos en un Reactor Heliofotocatálitico Cilindro Parabólico Compuesto permitirán iniciar más trabajos en este campo en la Universidad Tecnológica de Pereira al lograr las condiciones requerida para este tipo de estudios.. 20.
(21) 2. PLANTEAMIENTO DEL PROBLEMA. En los laboratorios de La Escuela de Química de la Universidad Tecnológica Pereira se realizan diariamente síntesis de diferentes sustancias debido desarrollo de actividades académicas e investigación; como consecuencia genera una gran cantidad de desechos acuosos tóxicos generalmente naturaleza orgánica.. de al se de. La Fluoresceína Sódica es un colorante sintetizado para fines académicos y los desechos acuosos generados en esta práctica contienen una alta concentración, además de diferentes pH. La sustancia al ser suministrada por cualquier medio puede causar nauseas, vomito, urticaria, hipotensión aguda, anafilaxia, reacción anafiláctica, paro cardiaco y muerte súbita [11]; y es nociva para los organismos acuáticos; por lo cual no debe ser vertida al agua sin tratamiento previo.. Por lo tanto para mejorar los procesos y adaptar nuevas tecnologías que ayuden a disminuir el impacto ambiental producido por esta actividad se buscó desarrollar un método de degradación para la Fluoresceína Sódica sostenible, de alto rendimiento y bajos costos de operación.. De lo anteriormente planteado, ¿Cuál será el porcentaje de degradación primaria de la Fluoresceína Sódica, con el uso de un Reactor Heliofotocatálitico Cilindro Parabólico Compuesto y luz solar; en comparación con un reactor de bandejas con luz UV artificial?. 21.
(22) 3. JUSTIFICACIÓN. La “Degradación de la Fluoresceína Sódica por Fotocatálisis Heterogénea en un Reactor Heliofotocatálitico” es realizada como un método para reducir el impacto ambiental producido por la actividad académica para la síntesis de este colorante en los laboratorios de La Escuela de Química de la Universidad Tecnológica de Pereira. La degradación por fotocatálisis heterogénea con TiO2 es actualmente una de las aplicaciones más interesantes en la comunidad científica por tratarse de un método que puede utilizar la radiación solar como fuente primaria de energía y puede emplearse para mezclas complejas de contaminantes. El TiO2 es un semiconductor de elevada estabilidad química y reacciona con bajo consumo energético; utilizado entonces como catalizador para la degradación por fotocatálisis heterogénea asegura ser un método sostenible que puede ser fácilmente aplicado en los laboratorios de La Escuela de Química de la Universidad Tecnológica de Pereira y se hace extensiva a otros desechos tóxicos como por ejemplo Resorcinol, Rojo Recoltive, Atrazina, y Fosfato de tetrabutilamonio entre otros. [12]. 22.
(23) 4. OBJETIVOS. 4.1 OBJETIVO GENERAL Degradar la Fluoresceína Sódica por medio de Fotocatálisis Heterogénea en un Reactor Heliofotocatálitico Cilindro Parabólico Compuesto.. 4.2 OBJETIVOS ESPECÍFICOS. Determinar el porcentaje de degradación primaria de la Fluoresceína Sódica, por medición de espectrofotometría UV – Vis. Determinar el porcentaje de mineralización de la Fluoresceína Sódica, mediante el estudio de la Demanda Química de Oxígeno (DQO) y Carbono Orgánico Total (COT). Determinar el tiempo de estadía según las condiciones de radiación UV de luz solar. Acoplar las variables de un reactor de bandejas con luz UV/cercano artificial, a un Reactor Heliofotocatálitico Cilindro Parabólico Compuesto y luz solar.. 23.
(24) 5. MARCO DE REFERENCIA. 5.1 MARCO DE ANTECEDENTES. Actualmente la principal línea de investigación en fotocatálisis heterogénea se refiere a la investigación ambiental aplicada, es decir al uso de técnicas para la descontaminación del agua y el aire. El proceso de purificación de aguas por fotocatálisis heterogénea con TiO2 como catalizador es hoy una de las aplicaciones más interesantes en la comunidad científica y la mayor parte del trabajo se ha orientado a tratar una concentración de contaminantes orgánicos aproximadamente de 1000 ppm [13].. La fotocatálisis heterogénea a diferencia de la mayoría de los procesos fotoquímicos no es selectiva y puede emplearse para mezclas complejas de contaminantes. El TiO2 como catalizador presenta estabilidad química y es económicamente asequible. Finalmente la posibilidad de utilizar radiación solar como fuente primaria de energía le otorga un significativo valor ambiental. Todo esto convierte la fotocatálisis heterogénea con TiO2 en un claro ejemplo de tecnología sostenible [14].. Existen una gran cantidad de estudios realizados para la degradación de compuestos colorantes por fotocatálisis heterogénea con TiO2 en los cuales se evidencio que el proceso de degradación mejora cuando se trabaja con bajas concentraciones de contaminante y concentración de catalizador TiO2 de 0.33 g/L a 1.0g/L. Es importante destacar que en estos estudios la adición del agente oxidante peróxido de hidrogeno (H2O2) incrementó la velocidad de degradación del proceso. El porcentaje de degradación para estos estudios fue de 70% a 90% y el porcentaje de mineralización fue de 50% a 70%, teniendo en cuenta que se realizaron con sistemas de lámparas UV/ Vis. [8, 9]. Para la degradación de la Fluoresceína Sódica por fotocatálisis heterogénea, se estudio la molécula de esta y la interacción que presenta con los electrones que genera el catalizador; con lo cual se deduce que a medida que el catalizador libera electrones estos comienzan a ocupar los orbitales moleculares antienlazantes y 24.
(25) los orbitales enlazantes decrecen con lo cual la degradación aumenta su velocidad debido a que a menor cantidad de orbitales enlazantes menor fuerza de enlace.. 5.2 MARCO TEÓRICO. 5.2.1 Fotocatálisis heterogénea. Se entiende como fotocatálisis heterogénea el proceso que implica la utilización conjunta de la luz ultravioleta y un material sólido inorgánico semiconductor, para promover una transformación química. La radiación incidente que inicia estas transformaciones pertenece a una región de longitudes de onda (región visible del espectro) que será absorbida preferentemente por el semiconductor o catalizador, más que por el sustrato de interés. Inversamente a lo que podría concluirse, la luz no actúa como catalizador, sino como inductor de la catálisis, consumiéndose en el proceso. [15, 16, 17]. Este proceso de fotodegradación basado en el uso de semiconductores contribuye a la formación de especies altamente oxidantes como lo es el radical hidroxilo (·OH), el cual se encarga de mineralizar la materia orgánica hasta los productos deseados, dióxido de carbono y agua (CO2, H2O). Este proceso es capaz de degradar los contaminantes hasta niveles de concentración aceptables según la legislación vigente para estos. Además la fotocatálisis heterogénea permite la degradación e incluso la mineralización de diversos compuestos orgánicos ya que es un proceso no selectivo, lo que permite que contaminantes no biodegradables puedan ser tratados dentro de aguas residuales en las que aparecen muchos compuestos orgánicos, como se muestra en el esquema 1. [14, 18, 19]. Esquema 1. Reacción global de la fotocatálisis heterogénea.. Con el fin de que la reacción se inicie, la fotocatálisis heterogénea requiere que el semiconductor absorba la radiación en forma de fotón de energía (hv), la especie absorbente genera pares electrón–hueco (h+- e-); como se muestra en el esquema 2. [20]. 25.
(26) Esquema 2. Reacción entre el semiconductor y un fotón de energía (hv).. Por otra parte en los sistemas acuosos los constituyentes más importantes son el agua, el oxígeno molecular y algunas otras especies disueltas, ocasionalmente algunos contaminantes que deben ser eliminados. En esta etapa del proceso los huecos (h+), reaccionan con sustancias adsorbidas generando radicales hidroxilo (·OH) que permanecen retenidos en la superficie del catalizador como se muestra en el esquema 3. [14]. Esquema 3. (a) Reacción hueco (h+) – Agua (H2O), (b) reacción hueco (h+) – ion hidroxilo (-‐OH).. Entretanto los electrones (e-‐) que se encuentran libres reducen el oxígeno (O2) adsorbido o disuelto para formar el radical superóxido (·O2-‐) como se muestra en el esquema 4. [4]. Esquema 4. Reacción de formación del radical superóxido.. Estos radicales hidroxilo (·OH) son altamente reactivos frente a la mayoría de las moléculas orgánicas, ya que presentan un elevado potencial de oxidación (Eº=2,8V) característica que los hace de gran efectividad para el proceso de oxidación de compuestos orgánicos principalmente por eliminación de hidrógeno. Es decir; se forman radicales orgánicos libres que pueden reaccionar con oxígeno molecular (O2) para crear peroxirradicales, iniciándose incluso una serie de reacciones de oxidación que conducen a la mineralización completa de los. 26.
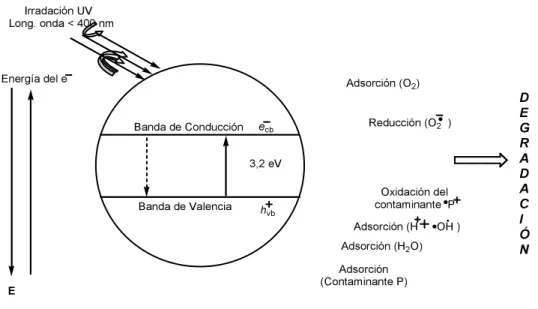
(27) compuestos orgánicos contaminantes tratados, como se muestra en el esquema 5. [21]. Esquema 5. (a) Reacción de fragmentación del contaminante (RH), (b) reacción de fragmentación hasta degradación.. Las reacciones que se dan en los procesos de fotocatálisis; desde la incidencia de la radiación en el catalizador, las reacciones que ocurren en la matriz de este; hasta los procesos generados por las especies portadoras de carga: electrones en la banda de conducción (e-‐cb) y huecos en la banda de valencia (h+vb) se muestran en la figura 1. [12]. Figura 1. Proceso general de la fotocatálisis heterogénea.. 27.
(28) Se debe prestar gran atención al hecho que uno de los aspectos más críticos es la alta probabilidad de recombinación electrón – hueco (e-‐- h+), que compite con la separación entre las cargas fotogeneradas. El cual puede ser contrarrestado por la adición de mediadores como agentes oxidantes, por ejemplo el oxígeno (O2) y el peróxido de hidrogeno (H2O2). [22]. 5.2.2 Parámetros que influyen en el proceso de fotocatálisis heterogénea. pH. El pH es un factor que puede afectar tanto las propiedades superficiales del catalizador como la forma química del compuesto a degradar, lo cual se manifiesta en alteraciones de la velocidad de degradación y en la tendencia a desactivar el catalizador. Normalmente el proceso de degradación es más eficiente en medio ácido (3 ≤ pH ≤ 5). Al aumentar el pH en la fase acuosa el poder oxidante disminuye y el poder reductor se incrementa debido a la dependencia de los potenciales con la acidez del medio. Además este factor puede afectar el proceso de fotocatálisis posibilitando o inhibiendo reacciones químicas determinadas. [14, 23]. Agente oxidante. Los agentes oxidantes generalmente son imprescindibles para la degradación del contaminante, ya que participan en la reacción de oxidación; estos son los responsable de una de las semirreaciones que se dan (captura de huecos) y cuanto más efectivo sea el agente oxidante para capturar huecos mayor será la velocidad del proceso.. El peróxido de hidrogeno (H2O2) como agente oxidante cumple con múltiples funciones en el proceso de fotocatálisis heterogénea, ya que este es capaz de reaccionar tanto con los huecos presentes en la banda de valencia (h+vb) como con los electrones en la banda de conducción (e-‐cb), generando en ambos procesos radicales hidroxilo (·OH). Además, es capaz de oxidar directamente algunos de los intermediarios, generando en el proceso radicales hidroxilo (·OH) adicionales. Este proceso se puede observar en el esquema 6. [23]. 28.
(29) Esquema 6. (a) Reacción peróxido de hidrogeno (H2O2) – hueco de banda de valencia (h+vb), (b) reacción de H2O2 – electrón de banda de conducción (e-‐bc), (c) reacción de H2O2 – radical superóxido (·O2-‐).. Sin embargo, si se presenta un exceso de peróxido de hidrogeno (H2O2) y altas concentraciones de radicales hidroxilo (·OH); se dan en el proceso reacciones competitivas que producen un efecto inhibitorio en la degradación. Debido a que los radicales hidroxilo (·OH) son susceptibles de recombinación o de reaccionar como muestra el esquema 7. [22]. Esquema 7. Reacción de peróxido de hidrogeno (H2O2) – radical hidroxilo (·OH). Presencia de iones. La presencia de iones metálicos o iones inorgánicos en solución, pueden mejorar o empeorar la cinética de la reacción. Pues estos compiten con las especies orgánicas por los sitios activos del catalizador y disminuyen la velocidad, además disminuyen la producción de radicales superóxido (·O2-); bloqueando la reacción de los radicales hidroxilo (·OH) libres fotogenerados en la reacción. [15, 24, 25]. Temperatura. Cuando se aumenta la temperatura la solubilidad del oxígeno (O2) disuelto puede disminuir, por lo cual su disponibilidad en la reacción también lo hace. Se puede suponer que al existir un aumento en la temperatura los choques moleculares entre el contaminante y el semiconductor aumentan, mejorando de esta manera la cinética de la reacción, sin embargo,. 29.
(30) algunos radicales poseen bajas energías de activación por lo tanto no se ven influenciadas por la temperatura. [15, 26]. Separación del semiconductor. Al final del proceso el semiconductor se encuentra en la disolución acuosa en forma coloidal, lo cual implica que se debe realizar un proceso de separación adicional; como lo es la filtración de poro fino (< 2 µm). [15, 27]. Adsorción. La adsorción puede poseer una particular importancia, ya que las reacciones que se dan en la fotocatálisis heterogénea pueden efectuarse en la interfase solución – superficie del semiconductor o ser promotoras de que el contaminante se descomponga en diferentes especies que hacen que la reacción de degradación se produzca en la disolución. [15, 27, 28]. Cinética de la reacción. La cinética de la reacción depende de la concentración del contaminante a degradar, y que la energía que llegue a la disolución (fotones) sea suficiente para generar la formación del par electrón – hueco (e- - h+). [15, 26, 29]. Diseño del reactor. Los colectores solares poseen diferentes diseños, un colector solar como el Reactor Cilindro Parabólico Compuesto (CPC) proporciona una de las mejores ópticas para los sistemas de baja concentración. Debido al diseño de su superficie reflectante toda la radiación (directa y difusa) puede ser captada y disponible para el proceso fotocatalítico en el reactor; la reflexión de la radiación UV es distribuida alrededor de la parte posterior con lo cual la mayoría de la circunferencia del tubo se encuentra iluminada.. Este diseño presenta diferentes ventajas como los son: Bajo coste de instalación, ausencia de vaporización de compuestos volátiles y flujo turbulento que favorece la transferencia de materia. [30] En comparación con el Reactor Artesanal.. 30.
(31) Figura 2. Reactor Solar Cilindro Parabólico Compuesto.. Figura 3. Reactor Artesanal.. Contaminante. En los sistemas de fotocatálisis a diferencia de muchos otros sistemas de descontaminación, la velocidad de degradación existente exhibe un comportamiento de saturación con respecto a la concentración del contaminante. Un incremento por encima de este valor de saturación, disminuye notablemente la velocidad de abstracción del contaminante. Cada aplicación de la fotocatálisis debe desarrollarse individualmente ya que no existe una norma general de aplicación; aunque se espera que para determinado caso la concentración orgánica máxima deberá ser de varios cientos de partes por millón (ppm) debido a que los procesos de eliminación de contaminantes por fotocatálisis heterogénea son razonablemente eficientes en. 31.
(32) concentraciones medias y bajas, teniendo en cuenta que cada contaminante se comporta de manera diferente con lo cual varía según su naturaleza. Si bien el límite varía con la naturaleza del contaminante, la fotocatálisis heterogénea no es habitualmente una opción favorable si las concentraciones exceden el valor de 1000 ppm a menos que se establezca un paso de dilución previa. [23]. Catalizador. El proceso de fotocatálisis heterogénea se fundamenta en la transferencia de carga a través de la interfaz generada entre un catalizador (semiconductor) iluminado y una solución acuosa, es en esta interfaz donde se presenta una densidad de carga diferente a la del seno de ambas fases, originándose un campo eléctrico que actúa como fuerza impulsora en el proceso de transferencia. El potencial de reducción de los huecos (h+vb) formados en la banda de valencia del catalizador es termodinámicamente apropiado para oxidar cualquier tipo de molécula orgánica; de la misma manera el potencial de óxido – reducción del electrón (e-cb) promovido a la banda de conducción es termodinámicamente adecuado para reducir los agentes oxidantes presentes en la solución.[19, 22]. En la fotocatálisis heterogénea el catalizador más usado es el dióxido de titanio (TiO2), dado que este es química y biológicamente inerte, no es tóxico, es estable a corrosión fotoquímica y química, es abundante y económico, además posee una banda prohibida de energía de 3,2 eV que puede ser excitada con luz UV de λ < 387 nm, la cual puede ser aportada por la luz solar. El mecanismo general para el TiO2 en la fotocatálisis heterogénea se muestra en el esquema 8. [20, 31]. 32.
(33) Esquema 8. Reacciones generales del TiO2 en la fotocatálisis heterogénea.. De igual manera la eficiencia cuántica total de transferencia de carga interfacial está determinada por dos etapas críticas; como lo son la competencia entre la recombinación del portador de la carga y la captura, seguido de la competencia entre la recombinación del portador golpeado y la transferencia de carga interfacial. Como se muestra en el esquema 9. [20]. 33.
(34) Esquema 9. Cinética de fotoelectroquímico del TiO2.. los. principales. pasos. en. el. mecanismo. También se puede observar el destino de los electrones y los huecos dentro de una partícula esférica de dicho catalizador, en presencia de moléculas aceptoras; como se muestra en el esquema 10. [12]. Esquema 10. Destino de los electrones y los huecos dentro de una partícula esférica de titanio en presencia de moléculas aceptoras (A) y (D). 34.
(35) Así mismo en la mayoría de aplicaciones con fotocatalizadores el oxígeno actúa como el principal receptor de electrones; como consecuencia de la reducción de los dos electrones que posee el oxígeno es formado el H2O2. Este proceso es de interés particular debido a que la transferencia del electrón al oxigeno puede ser el paso limitante de la velocidad de la reacción del catalizador; los radicales hidroxilo (·OH) son formados en la superficie del TiO2 por la reacción del hueco (h+vb) con agua adsorbida, hidróxido o grupos titanol (>TiOH). Dichos procesos se resumen en el esquema 11. [20]. Esquema 11. Reacciones secundarias con especies activadas del oxígeno en el mecanismo fotoelectroquímico.. Como se ha observado una de las etapas más importantes es la formación de los radicales hidroxilo (·OH), al entrar el catalizador (TiO2) en contacto con una solución acuosa da paso a la etapa de hidroxilación de la superficie de este, a través de la quimisorción disociativa. La quimisorción disociativa del agua sobre una superficie plana genera dos tipos de grupos OH: aquellos en los que el átomo de oxigeno está unido a un solo átomo de titanio (sitios A), y aquellos en los que el. 35.
(36) átomo de oxigeno está unido a dos átomos de titanio (sitios B). Sin embargo por ser una red tridimensional en arista se genera un tercer grupo de sitios, en menor cantidad pero más reactivos que los anteriores, caracterizados porque el átomo de titanio está unido a dos grupos OH (sitios C). Este proceso de hidroxilación se muestra en el esquema 12. [19]. Esquema 12. Superficie del dióxido de titanio y su hidroxilación a través de la quimisorción disociativa de agua.. 36.
(37) Por lo anteriormente mencionado el TiO2 es uno de los catalizadores más estudiados y utilizados, cuyas características hacen de él parte importante y uno de los parámetros más primordiales en la fotocatálisis heterogénea.. 5.2.3 Fluoresceína Sódica. La fluoresceína sódica es un colorante obtenido en los laboratorios de la Escuela de Química de la Universidad Tecnológica de Pereira, practica realizada en el desarrollo del plan de trabajo de la asignatura Química Orgánica II orientada en los programas de Tecnología Química y Química Industrial. Dicho colorante es vertido a la poseta de manera directa sin tener ningún tipo de tratamiento lo que genera un desequilibrio ambiental debido a que es altamente estable y a su alta solubilidad en agua (detectable en diluciones de 1:40000000).. La fluoresceína sódica 2-(3-Oxo-6-óxido-3H-xanten-9-il) benzoato disódico, figura 4, es un sólido de color rojo – naranja, higroscópico e inodoro, altamente soluble en agua y moderadamente en alcohol. Cuya fórmula química es C20H10Na2O5 y de peso molecular 376,3 g/mol; el cual no debe poseer menos de 95% y no más de 103% de C20H10Na2O5 calculado sobre la sustancia anhidra. Proveniente de los colorantes xantenos, los cuales poseen una coloración brillante en el intervalo de los tonos amarillo verdosos a violeta y azul oscuro, y exhiben fluorescencia con menor intensidad en comparación con otros sistemas cromofóricos. Perteneciente específicamente a los derivados hidroxílicos de este tipo de colorantes, los cuales presentan el bloque constitutivo de la mayoría de los xantenos sustituidos con grupos hidroxilo o fluoronas. [32]. Figura 4. Estructura de la fluoresceína sódica. 37.
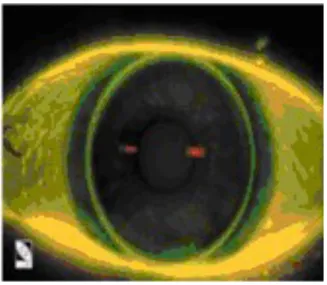
(38) A pesar de ser un colorante de tipo xanteno no es utilizado como colorante textil ya que posee una mala solidez a la luz [33], debido a sus características fluorescentes sus principales usos se dan en los campos de microbiología, biología molecular, bioquímica [34], optometría, oftalmología y medicina [35]. De igual manera algunos derivados han sido altamente usados en nuevas técnicas de marcación molecular, como por ejemplo el isotiocianato de fluoresceína, Oregón verde, Tokio verde y carboxinaftofluoresceina. [11] Uno de los usos actuales más conocidos es en el examen de fluoresceinoangigrafía del fondo y de la vasculatura del iris del ojo; el cual consiste en administrar la fluoresceína sódica por inyección en la vena cubital, el colorante tarda de 10 a 15 segundos en aparecer en lo vasos coroideos y retinianos lo que permite detectar anormalidades vasculares en el fondo del iris del ojo, como se muestra en la figura 5. [11]. Figura 5. Evaluación estática de la lente inicial por pigmentación con fluoresceína sódica.. De igual manera se usa en la marcación de ácidos nucleicos ya que presenta control en el marcaje de la sonda y permite visualizar directamente la calidad del marcaje, como se muestra en el esquema 13. [36]. 38.
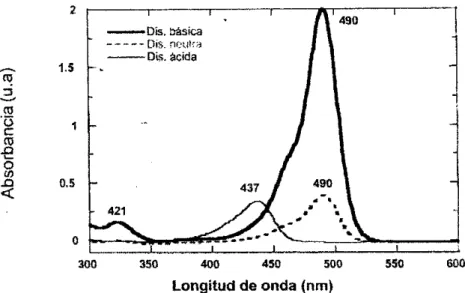
(39) Esquema 13. Ácido nucleico marcado con un marcador fluoresceínado.. En los últimos años se ha estudiado una herramienta versátil en el estudio de sistemas biológicos por medio de la Transferencia Resonante de Energía (FRET) entre colorantes e intercaladores de ADN. Se desarrollan sensores de detección de secuencias específicas de ADN relacionados con genes concretos. Se emplean diferentes metodologías y estrategias para el estudio de FRET entre ADN etiquetado con nuevos y mejorados derivados de la fluoresceína sódica e intercaladores bifuncionales de ADN. La extensión de estos sistemas demuestra su aplicabilidad a sistemas biológicos in vivo. Además como marcador se ha hecho muy útiles en la determinación de la hibridación de ácidos nucleicos en medios homogéneos. [36]. Dicho colorante también ha sido usado en el sistema fluvial, como colorante añadido a las aguas pluviales en las pruebas de simulación del medio ambiente para ayudar en la localización y análisis de cualquier fuga de agua; además de haber sido famoso en los años sesenta por su uso en la tinción del Río Chicago para el día de San Patricio. [11]. Uno de los únicos usos que se le da en la química actual es su propiedad de actuar como indicador ácido-base, ya que el color depende directamente del pH. Tal diferencia se hace más evidente si se observan los espectros de absorción en la región del UV-vis. Como se muestra en la figura 6. [11]. 39.
(40) Figura 6. Espectroscopia UV-vis de la fluoresceína en solución básica, neutra y ácida.. Como todo reactivo la fluoresceína sódica posee grandes reacciones adversas para la salud humana, entre las más conocidas por diferentes vías de suministro, sea tópico, oral o intravenoso son náuseas, vómito, urticaria, hipotensión aguda, anafilaxia, anafilaxis y reacciones anafilactoides, paro cardiaco y muerte súbita. [11] Por lo cual se debe manejar de manera cuidadosa para así evitar inconvenientes. Además también es perjudicial para los organismos acuáticos, pues al ser una molécula altamente estable genera intoxicación y posteriormente muerte de dichos organismos.. Sobre el tema se han desarrollado diferentes trabajos, entre los cuales se encuentran la “Degradación fotocatalítica de la Fluoresceína” realizado en la Universidad Tecnológica de Pereira, por el método de foto fentón y lámparas UV/vis; obteniéndose un porcentaje de degradación del 84,467 % y un porcentaje de mineralización del 42,57 %. Así mismo el trabajo “Degradación fotocatalítica de la Fluoresceína Sódica con óxido de titanio”, con el uso de lámparas UV/vis; obteniéndose un porcentaje de degradación del 90 % y un porcentaje de mineralización del 70 %. [8, 42]. 40.
(41) 6. METODOLOGÍA. 6.1 MUESTRA DE ANÁLISIS. 6.1.1 Solución madre de Fluoresceína Sódica (200 ppm). En la elaboración de la solución madre se realizó el siguiente procedimiento:. Se preparó una solución de Fluoresceína Sódica de concentración conocida en ppm pesando 0,2000 g de Fluoresceína Sódica, la cual se transfirió a un matraz aforado de 1,0 L, adicionando 0,5 L de agua destilada. Está solución se agitó hasta disolución completa de la Fluoresceína Sódica y finalmente se enraso la solución a 1,0 L agitándose nuevamente.. 6.1.2 Longitud de onda. En la determinación de la longitud de onda se realizó el siguiente procedimiento:. Se tomó una alícuota de la solución madre preparada en el numeral 6.1.1. realizándose un barrido espectral en el espectrofotómetro de UV entre 400 y 600 nm, seleccionando la longitud de onda (λ) en la cual las moléculas de Fluoresceína Sódica absorben la radiación y verificando el pico de absorción correspondiente a la λ para la Fluoresceína Sódica.. 6.1.3 Curva de calibración. En la construcción de la curva de calibración se realizó el siguiente procedimiento:. Se prepararon patrones de 20, 40, 60, 80, 100, 120, 140, 160, 180 y 200 ppm midiendo las alícuotas correspondientes de la solución madre preparada en el numeral 6.1.1. Estas alícuotas se transfirieron a matraces aforados de 100 mL con adición de 50 mL de agua destilada y agitación; se enrasaron las soluciones a 100 mL y se agito nuevamente. Se midieron las absorbancias de los patrones preparados a la longitud de onda hallada en el numeral 6.1.2. Finalmente se representó gráficamente los datos de Absorbancia vs.. 41.
(42) Concentración (ppm) para obtener la curva de calibración, aplicándose el método de mínimos cuadrados para hallar la ecuación de la recta obtenida en la gráfica realizada.. 6.1.4 Límite de detección. En la determinación del límite de detección se realizó el siguiente procedimiento:. Se pesó 1,0000 g de dióxido de titanio (TiO2) el cual se transfirió a un matraz aforado de 1,0 L con adición de 0,5 L de agua destilada, esta solución se agitó por 1 hora, pasado este tiempo se enraso la solución a 1,0 L y se colocó en agitación por 15 minutos más. Pasado este tiempo se tomaron 30 alícuotas de 10 mL cada una, las cuales se filtraron a través de un filtro fisherbrand de poro 0,22 µm. Se midieron en celdas de vidrio en el espectrofotómetro de UV a la longitud de onda hallada en el numeral 6.1.2, los datos obtenidos fueron tabulados y tratados estadísticamente para hallar el límite de detección.. 6.1.5 Límite de cuantificación. En la determinación del límite de cuantificación se realizó el siguiente procedimiento:. Se tabularon los datos obtenidos en el numeral 6.1.4, a los cuales se les realizo el debido tratamiento estadístico para hallar el límite de cuantificación.. 6.1.6 Espectrofotometría de UV. En el estudio por espectrofotometría de UV se siguió el siguiente procedimiento:. Se encendió el equipo dejando que cargue, eligiendo la opción 1 (cuantificación), al tener esta opción lista se eligió la longitud de onda hallada según el numeral 6.1.2 y realizando la calibración del equipo con el blanco a cero. Se tomaron alícuotas de 10 mL de la muestra a analizar y se filtraron con un filtro fisherbrand de poro 0,22µm, midiéndose las muestras en celdas de vidrio, finalmente se tabularon los datos de las absorbancias halladas en el espectrofotómetro de UV.. 42.
(43) 6.1.7 Demanda Química de Oxigeno (DQO).El estudio de DQO se realiza según el procedimiento descrito en el Standard Methods for the Examination of Water and Wastewater. [37]. 6.1.8 Carbono Orgánico Total (COT). El estudio de COT se realizó por siguiente procedimiento:. el. Método del Test en Cubetas COT (Merck). En la determinación de COT por este método se realizó el siguiente procedimiento:. Se midió 1 mL de muestra transfiriéndose a un matraz aforado de 10 mL, aforándose con agua destilada, se adicionaron 2 gotas de Reactivo TOC-1K agitándose la solución y comprobándose el pH (el cual debe ser menor a 2,5), se ajustó con H2SO4 si se requería y se agitó nuevamente durante 10 minutos a velocidad media. Se tomó una alícuota de 3 mL de la solución preparada, transfiriéndose a una cubeta de reacción con adición de una microcucharada de Reactivo TOC-2K, posteriormente se tapó firme e inmediatamente la cubeta con tapa de aluminio y se calentó la cubeta invertida a 120 ºC en un termoreactor durante 2 horas, pasado este tiempo se dejó enfriar la cubeta en forma invertida durante 1 hora a temperatura ambiente y se giró de nuevo la cubeta; la cual se midió en espectrofotómetro en los siguientes 10 minutos.. 6.1.9 Muestra para Reactor Solar. La preparación de la muestra se realizó por dos métodos diferentes, para los cuales se ejecutó el siguiente procedimiento:. Método 1.Para la preparación de la muestra por este método se realizó el siguiente procedimiento: Del residuo líquido obtenido en la práctica número 8 del laboratorio de Química Orgánica II, se midió 1,4 L de solución de Fluoresceína Sódica adicionando 12,6 L de agua y verificando el pH, esta solución se llevó al Reactor ilustrado en la figura 2. Se colocó la solución en recirculación sin contacto con la luz solar por 10 minutos adicionando 14 g de TiO2. La solución preparada se colocó en recirculación en contacto con la luz solar y las muestras a analizar se 43.
(44) tomaron cada media hora. Se terminó la recirculación de la solución en un tiempo comprendido entre 210 y 330 minutos, midiéndose el pH de la solución final; finalmente se lavó y apago el Reactor Solar.. Método 2. Para la preparación de la muestra por este método se realizó el siguiente procedimiento: Del residuo líquido obtenido en la práctica número 8 del laboratorio de Química Orgánica II, se midió 0,5 L de solución de Fluoresceína Sódica adicionando 15,5 L de agua verificando y ajustando el pH (pH ácido o básico), esta solución se llevó al Reactor ilustrado en la figura 2. Se colocó la solución en recirculación sin contacto con la luz solar por 10 minutos adicionando 16 g de TiO2 y 8 mL de H2O2 La solución preparada se colocó en recirculación en contacto con la luz solar y las muestras a analizar se tomaron cada media hora. Se terminó la recirculación de la solución en un tiempo comprendido entre 210 y 330 minutos, midiéndose el pH de la solución final; finalmente se lavó y apago el Reactor Solar.. 6.1.10 Muestra para Reactor Artesanal. La preparación de la muestra se realizó el siguiente procedimiento:. Se tomó una alícuota de 0,5 L de la solución preparada según el método 2 del numeral 6.1.9. que se lleva al reactor ilustrado en la figura 3, la solución se colocó en agitación constante y las muestras a analizar se tomaron cada media hora. Se terminó la agitación e iluminación en un tiempo comprendido entre 210 y 330 minutos midiéndose el pH de la solución final, finalmente se apagó el Reactor Artesanal.. 6.1.11 Medida de la cinética de la reacción. La medida de la cinética de la reacción se realizó el siguiente procedimiento:. A las condiciones óptimas, con el menor tiempo de reacción y mayor porcentaje de degradación se preparó una solución de Fluoresceína Sódica de concentración 30,8 ppm, tomándose muestra cada 10 minutos y midiéndose 44.
(45) por espectrofotometría de UV según el procedimiento descrito en el numeral 6.1.6 y hallándose la concentración y él % Degradación Primaria según las ecuaciones 1 y 2.. 6.1.12 Análisis estadístico por comparación de medias. Para el análisis estadístico por comparación de medias se realizó el siguiente procedimiento:. Se halló la media de los datos de % Degradación Primaria para los ensayos 1 a 4 en el Reactor Solar, al igual que la varianza de los mismos; de igual manera se procedió para los datos obtenidos en los ensayos 5 a 7. Se planteó una hipótesis nula (H0=µ1=µ2) y una hipótesis alterna (H1=µ1≠µ2) con un intervalo de confianza del 95 %.. 45.
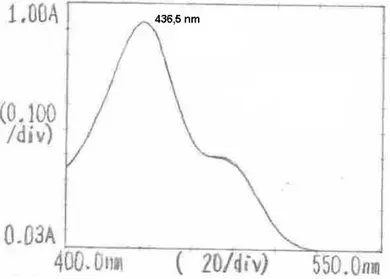
(46) 7. RESULTADOS. 7.1 BARRIDO ESPECTRAL PARA UNA SOLUCIÓN DE FLUORESCEÍNA SÓDICA. Se realizó el barrido espectral de la solución madre de Fluoresceína Sódica preparada en el numeral 6.1.1 en el espectrofotómetro de UV y se seleccionó el pico de absorción correspondiente a la longitud de onda en la cual las moléculas de Fluoresceína Sódica absorbieron la radiación. La longitud de onda encontrada para la Fluoresceína Sódica fue 436,5nm. Como se muestra en la figura 7.. Figura 7. Barrido espectral de la solución madre de Fluoresceína Sódica.. 7.2 CURVA DE CALIBRACIÓN PARA LA FLUORESCEÍNA SÓDICA. Se realizaron patrones de concentración conocida de Fluoresceína Sódica en ppm según el procedimiento descrito en el numeral 6.1.3, para realizar la medición por espectrofotometría de UV a una longitud de onda de 436,5 nm y registrar la señal instrumental (absorbancia). Con los datos obtenidos se construyó la gráfica (Figura 8), Absorbancia vs. Concentración (ppm), con la cual se obtuvo la. 46.
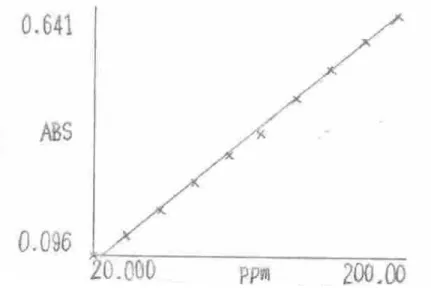
(47) ecuación de la gráfica y posteriormente fue posible obtener una ecuación para hallar la concentración de Fluoresceína Sódica a partir de los datos instrumentales obtenidos en las mediciones por espectrofotometría de UV según el procedimiento descrito en el numeral 6.1.6.. Figura 8. Gráfica de la curva de calibración para la Fluoresceína Sódica.. La ecuación 1 es usada para hallar la concentración de Fluoresceína Sódica a partir de la medición descrita en el numeral 6.1.6 a la longitud de onda hallada en el numeral 6.1.2.. La concentración de Fluoresceína Sódica empleada en cada ensayo varía dependiendo de si se usa el método 1 ó 2, según el numeral 6.1.9.. 47.
(48) La ecuación 2 relaciona la concentración inicial ([ ] 1) y final ([ ] 2) para hallar el porcentaje de Degradación Primaria (% D.P) para cada ensayo realizado a la muestra de análisis.. 7.3 LÍMITE DE DETECCIÓN. Se efectuó el procedimiento descrito en el numeral 6.1.4, obteniéndose los datos (Tabla 1).. Tabla 1. Absorbancias medidas para el límite de detección. Alícuota 1 2 3 4 5 6 7 8 9 10. Absorbancia 0,019 0,019 0,020 0,020 0,021 0,020 0,022 0,023 0,024 0,022. Alícuota Absorbancia 11 0,021 12 0,023 13 0,021 14 0,021 15 0,022 16 0,022 17 0,022 18 0,023 19 0,023 20 0,024. Alícuota Absorbancia 21 0,024 22 0,023 23 0,024 24 0,023 25 0,024 26 0,023 27 0,023 28 0,024 29 0,023 30 0,024. Gracias a los datos obtenidos (Tabla 1) se realizó el tratamiento estadístico para hallar el límite de detección de la técnica empleada.. 48.
(49) 7.4 LÍMITE DE CUANTIFICACIÓN. Se realizó el procedimiento descrito en el numeral 6.1.5, con los datos contenidos en la Tabla 1, se efectuó el respectivo análisis estadístico para hallar el límite de cuantificación de la técnica empleada.. 7.5 ENSAYOS. Se realizaron diferentes ensayos según el procedimiento descrito en el numeral 6.1.9. Las muestras tomadas se analizaron según los procedimientos descritos en los numerales 6.1.6, 6.1.7 y 6.1.8. De igual manera se aplicaron las ecuaciones 1 y 2, para hallar la concentración y el porcentaje de Degradación Primaria (% D.P) respectivamente.. 49.
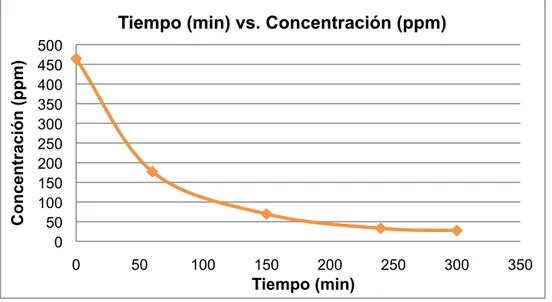
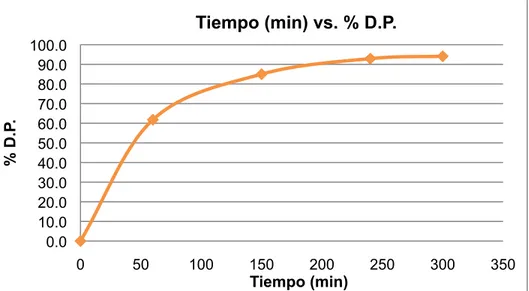
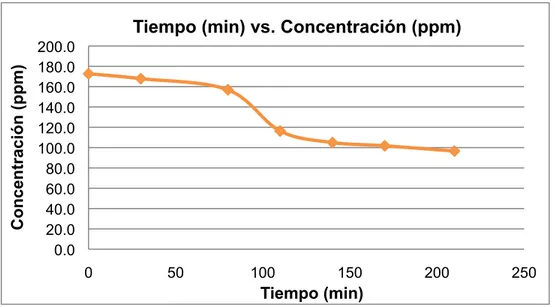
(50) 7.5.1 Ensayo 1. Se realizó el ensayo 1 de acuerdo al procedimiento descrito en el numeral 6.1.9, método 1. Obteniéndose los datos (Tabla 2).. Tabla 2. Resultados obtenidos en el ensayo 1. Muestra 1 2 3 4 5. t (min) 0 60 150 240 300. Abs 1,458 0,568 0,234 0,121 0,103. Concentración (ppm) 464,4 177,3 69,5 33,1 27,3. % D. P 0,0 61,8 85,0 92,9 94,1. Con los datos obtenidos (Tabla 2) se construyó la gráfica (Figura 9) Tiempo (min) vs. Concentración (ppm); y la gráfica (Figura 10) Tiempo (min) vs. % D.P.. Concentración (ppm). Tiempo (min) vs. Concentración (ppm) 500 450 400 350 300 250 200 150 100 50 0 0. 50. 100. 150. 200. 250. 300. 350. Tiempo (min). Figura 9. Gráfica Tiempo (min) vs. Concentración (ppm) ensayo 1.. 50.
(51) % D.P.. Tiempo (min) vs. % D.P. 100.0 90.0 80.0 70.0 60.0 50.0 40.0 30.0 20.0 10.0 0.0 0. 50. 100. 150. 200 Tiempo (min). 250. 300. 350. Figura 10. Gráfica Tiempo (min) vs. % D.P ensayo 1.. 7.5.2 Ensayo 2. Se realizó el ensayo 2 de acuerdo al procedimiento descrito en el numeral 6.1.9, método 1. Obteniéndose los datos (Tabla 3).. Tabla 3. Resultados obtenidos en el ensayo 2.. Muestra 1 2 3 4 5 6 7. t (min) 0 30 80 110 140 170 210. Abs 0,554 0,539 0,505 0,379 0,344 0,334 0,318. Concentración (ppm) 172,7 167,9 156,9 116,3 105,0 101,8 96,6. % D.P 0,0 2,8 9,1 32,7 39,2 41,1 44,1. Con los datos obtenidos (Tabla 3) se construyó la gráfica (Figura 11) Tiempo (min) vs. Concentración (ppm), y la gráfica (Figura 12) Tiempo (min) vs. % D.P.. 51.
(52) Concentración (ppm). Tiempo (min) vs. Concentración (ppm) 200.0 180.0 160.0 140.0 120.0 100.0 80.0 60.0 40.0 20.0 0.0 0. 50. 100. 150. 200. 250. Tiempo (min). Figura 11. Gráfica Tiempo (min) vs. Concentración (ppm) ensayo 2.. % D.P. Tiempo (min) vs. % D.P 50.0 45.0 40.0 35.0 30.0 25.0 20.0 15.0 10.0 5.0 0.0 0. 50. 100. 150. 200. 250. Tiempo (min). Figura 12. Gráfica Tiempo (min) vs. % D.P ensayo 2.. 7.5.3 Ensayo 3. Se realizó el ensayo 3 de acuerdo al procedimiento descrito en el numeral 6.1.9, método 2. Obteniéndose los datos (Tabla 4).. 52.
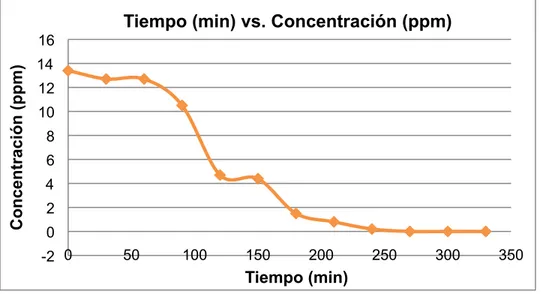
(53) Tabla 4. Resultados obtenidos en el ensayo 3.. Muestra t (min) 1 0 2 30 3 60 4 90 5 120 6 150 7 180 8 210 9 240 10 270 11 300 12 330. Abs 0,060 0,058 0,058 0,051 0,033 0,032 0,023 0,021 0,019 0,018 0,017 0,015. Concentración (ppm) 13,4 12,7 12,7 10,5 4,7 4,4 1,5 0,8 0,2 ND ND ND. % D.P 0,0 5,2 5,2 21,6 64,9 67,2 88,8 94,0 98,5 NC NC NC. DQO(mg O2/L) 44 44 66 66 88 264 44 44 44 44 66 66. Con los datos obtenidos (Tabla 4) se construyó la gráfica (Figura 13) Tiempo (min) vs. Concentración (ppm), la gráfica (Figura 14) Tiempo (min) vs. % D.P y la gráfica (Figura 15) Tiempo (min) vs. DQO (mg O2/L). Tiempo (min) vs. Concentración (ppm) Concentración (ppm). 16 14 12 10 8 6 4 2 0 -2 0. 50. 100. 150. 200. 250. 300. 350. Tiempo (min). Figura 13. Gráfica Tiempo (min) vs. Concentración (ppm) ensayo 3.. 53.
(54) Tiempo (min) vs. % D.P 120.0 100.0. % D.P. 80.0 60.0 40.0 20.0 0.0 0. 50. 100. 150. 200. 250. 300. 350. Tiempo (min). Figura 14. Gráfica Tiempo (min) vs. % D.P ensayo 3.. Tiempo (min) vs. DQO (mg O2/L). 300. DQO (mg O2/L). 250 200 150 100 50 0 0. 50. 100. 150. 200. 250. 300. 350. Tiempo (min). Figura 15. Gráfica Tiempo (min) vs. DQO (mg O2/L) ensayo 3.. 54.
(55) 7.5.4 Ensayo 4. Se realizó el ensayo 4 de acuerdo al procedimiento descrito en el numeral 6.1.9, método 2. Obteniéndose los datos (Tabla 5).. Tabla 5. Resultados obtenidos en el ensayo 4. Muestra t (min) 1 0 2 30 3 60 4 90 5 120 6 150 7 180 8 210 9 240 10 270 11 300 12 330. Abs 0,162 0,148 0,135 0,113 0,097 0,086 0,071 0,062 0,048 0,040 0,026 0,021. Concentración (ppm) 46,3 41,8 37,6 30,5 25,3 21,8 16,9 14,0 9,5 6,9 2,4 0,8. % D.P 0,0 9,7 18,8 34,1 45,4 52,9 63,5 69,8 79,5 85,1 94,8 98,3. DQO (mg O2/L) <2 <2 66 66 <2 0 0 176 242 <2 66 88. Con los datos obtenidos (Tabla 5) se construyó la gráfica (Figura 16) Tiempo (min) vs. Concentración (ppm), la gráfica (Figura 17) Tiempo (min) vs. % D.P y la gráfica (Figura 18) Tiempo (min) vs. DQO (mg O2/L).. Concentración (ppm). Tiempo (min) vs. Concentración (ppm) 50 45 40 35 30 25 20 15 10 5 0 0. 50. 100. 150. 200. 250. 300. 350. Tiempo (min). Figura 16. Gráfica Tiempo (min) vs. Concentración (ppm) ensayo 4. 55.
(56) Tiempo (min) vs. % D.P. 120.0 100.0. % D.P. 80.0 60.0 40.0 20.0 0.0 0. 50. 100. 150. 200. 250. 300. 350. Tiempo (min). Figura 17. Gráfica Tiempo (min) vs. % D.P ensayo 4.. Tiempo (min) vs. DQO (mg O2/L) 300. DQO (mg O2/L). 250 200 150 100 50 0 -50. 0. 50. 100. 150. 200. 250. 300. 350. Tiempo (min). Figura 18. Gráfica Tiempo (min) vs. DQO (mg O2/L) ensayo 4.. 56.
(57) 7.5.5 Ensayo 5. Se realizó el ensayo 5 de acuerdo al procedimiento descrito en el numeral 6.1.9, método 2; Obteniéndose los resultados (Tabla 6).. Tabla 6. Resultados obtenidos en el ensayo 5. Muestra t (min) 1 0 2 30 3 60 4 90 5 120 6 150 7 180 8 210 9 240 10 270 11 300 12 330. Abs 0,021 0,011 0,010 0,006 0,004 0,004 0,004 0,004 0,004 0,003 0,003 0,003. Concentración (ppm) 0,8 ND ND ND ND ND ND ND ND ND ND ND. % D.P 0,0 NC NC NC NC NC NC NC NC NC NC NC. DQO (mg O2/L) 44 154 154 154 264 88 66 66 44 22 22 <2. Con los datos obtenidos (Tabla 6) se construyó la gráfica (Figura 19) Tiempo (min) vs. DQO (mg O2/L).. Tiempo (min) vs. DQO (mg O2/L). 300. DQO (mg O2/L). 250 200 150 100 50 0 0. 50. 100. 150. 200. 250. 300. 350. Tiempo (min). Figura 19. Gráfica Tiempo (min) vs. DQO (mg O2/L) ensayo 5.. 57.
(58) 7.5.6 Ensayo 6. Se realizó el ensayo 6 según el procedimiento descrito en el numeral 6.1.9, método 2. Obteniéndose los resultados (Tabla 7). Tabla 7. Resultados obtenidos en el ensayo 6. Muestra t (min) 1 0 2 30 3 60 4 90 5 120 6 150 7 180 8 210 9 240 10 270 11 300 12 330. Abs 0,009 0,007 0,003 0,001 0,000 0,000 0,000 0,000 0,000 0,000 0,000 0,000. Concentración (ppm) ND ND ND ND 0,0 0,0 0,0 0,0 0,0 0,0 0,0 0,0. % D.P NC NC NC NC NC NC NC NC NC NC NC NC. DQO (mg O2/L) 88 154 154 88 88 110 110 132 198 352 352 352. Con los datos obtenidos (Tabla 7) se construyó la gráfica (Figura 20) Tiempo (min) vs. DQO (mg O2/L).. Tiempo (min) vs. DQO (mg O2/L). 400. DQO (mg O2/L). 350 300 250 200 150 100 50 0 0. 50. 100. 150. 200. 250. 300. 350. Tiempo (min). Figura 20. Gráfica Tiempo (min) vs. DQO (mg O2/L) ensayo 6.. 58.
(59) 7.5.7 Ensayo 7. Se realizó el ensayo 7 de acuerdo al procedimiento descrito en el numeral 6.1.9, método 2. Obteniéndose los resultados (Tabla 8).. Tabla 8. Resultados obtenidos en el ensayo 7.. Muestra t (min) 1 0 2 30 3 60 4 90 5 120 6 150 7 180 8 210. Abs 0,029 0,009 0,000 0,000 0,000 0,000 0,000 0,000. Concentración (ppm) 3,4 ND 0,0 0,0 0,0 0,0 0,0 0,0. % D.P 0,0 NC NC NC NC NC NC NC. DQO (mg O2/L) 286 154 132 176 220 198 242 154. Con los datos obtenidos (Tabla 8) se construyó la gráfica (Figura 21) Tiempo (min) vs. DQO (mg O2/L).. Tiempo (min) vs. DQO (mg O2/L) 350. DQO (mg O2/L). 300 250 200 150 100 50 0 0. 50. 100. 150. 200. 250. Tiempo (min). Figura 21. Gráfica Tiempo (min) vs. DQO (mg O2/L) ensayo 7.. 59.
(60) 7.6 COMPARACIÓN CON REACTOR ARTESANAL. Se ejecutaron diferentes ensayos en el Reactor Artesanal para realizar la comparación con los resultados obtenidos en el Reactor Solar. Las muestras tomadas se analizaron según los procedimientos descritos en los numerales 6.1.6, 6.1.7 y 6.1.8. De igual manera se aplicaron las ecuaciones 1 y 2, para hallar la concentración y el porcentaje de Degradación Primaria (% D.P) respectivamente.. 7.6.1 Ensayo 1 Reactor Artesanal. Se realizó el ensayo 1 para el Reactor Artesanal según el procedimiento descrito en el numeral 6.1.10. Obteniéndose los resultados (Tabla 9).. Tabla 9. Resultados obtenidos ensayo 1 Reactor Artesanal.. Muestra t (min) 1 0 2 30 3 60 4 90 5 120 6 150 7 180 8 210 9 240 10 270 11 300 12 330. Abs 0,005 0,004 0,004 0,003 0,002 0,000 0,000 0,000 0,000 0,000 0,000 0,000. Concentración (ppm) ND ND ND ND ND ND ND ND ND ND ND ND. % D.P NC NC NC NC NC NC NC NC NC NC NC NC. DQO (mg O2/L) 22 22 22 66 66 66 66 66 66 110 352 352. Con los datos obtenidos (Tabla 9) se construyó la gráfica (Figura 22) Tiempo (min) vs. DQO (mg O2/L).. 60.
(61) Tiempo (min) vs. DQO (mg O2/L). 400. DQO (mg O2/L). 350 300 250 200 150 100 50 0 0. 50. 100. 150. 200. 250. 300. 350. Tiempo (min). Figura 22. Gráfica Tiempo (min) vs. DQO (mg O2/L) ensayo 1 Reactor Artesanal.. 7.6.2 Ensayo 2 Reactor Artesanal. Se realizó el ensayo 2 para el Reactor Artesanal según el procedimiento descrito en el numeral 6.1.10. Obteniéndose los resultados (Tabla 10).. Tabla 10. Resultados obtenidos ensayo 2 Reactor Artesanal. Muestra t (min) 1 0 2 30 3 60 4 90 5 120 6 150 7 180 8 210 9 240 10 270 11 300 12 330. Abs 0,007 0,003 0,003 0,003 0,002 0,002 0,002 0,002 0,002 0,001 0,001 0,001. Concentración (ppm) ND ND ND ND ND ND ND ND ND ND ND ND. 61. % D.P NC NC NC NC NC NC NC NC NC NC NC NC. DQO (mg O2/L) 110 88 286 198 88 198 88 44 154 154 110 198.
(62) Con los datos obtenidos (Tabla 10) se construyó la gráfica (Figura 23) Tiempo (min) vs. DQO (mg O2/L).. Tiempo (min) vs. DQO (mg O2/L). 350. DQO (mg O2/L). 300 250 200 150 100 50 0 0. 50. 100. 150. 200. 250. 300. 350. Tiempo (min). Figura 23. Gráfica Tiempo (min) vs. DQO (mg O2/L) ensayo 2 Reactor Artesanal.. 7.6.3 Ensayo 3 Reactor Artesanal. Se realizó el ensayo 3 para el Reactor Artesanal preparando 3 soluciones de concentraciones (ppm) diferentes. Obteniéndose los resultados (Tabla 11).. Tabla 11. Resultados obtenidos ensayo 3 Reactor Artesanal.. t (min) 0 55 105 165 225 285 345. Solución 1 Abs [ppm] %D.P 0,251 75,0 0,0 0,215 63,4 15,5 0,118 32,1 57,2 0,109 29,2 61,1 0,040 6,9 90,8 0,031 4,0 94,7 0,027 2,7 96,4. Solución 2 Abs [ppm] %D.P 0,393 120,8 0,0 0,338 103,1 14,7 0,324 98,5 18,5 0,226 66,9 44,6 0,131 36,3 70,0 0,115 31,1 74,3 0,067 15,6 87,1. 62. Solución 3 Abs [ppm] %D.P 0,751 236,3 0,0 0,592 185,0 21,7 0,448 138,5 41,4 0,367 112,4 52,4 0,330 100,5 57,5 0,266 79,8 66,2 0,257 76,9 67,5.
(63) Con los datos obtenidos (Tabla 11) se realizó la gráfica (Figura 24) Tiempo (min) vs. Concentración (ppm) y la gráfica (Figura 25) Tiempo (min) vs. % D. P.. Tiempo (min) vs. Concentración (ppm) Concentración (ppm). 250.0 200.0 150.0 Sln 1 100.0. Sln 2 Sln 3. 50.0 0.0 0. 100. 200. 300. 400. Tiempo (min). Figura 24. Gráfica Tiempo (min) vs. Concentración (ppm) ensayo 3 Reactor Artesanal. Tiempo (min) vs. % D. P 100.0. % D. P. 80.0 60.0 Sln 1 40.0. Sln 2 Sln 3. 20.0 0.0 0. 100. 200. 300. 400. Tiempo (min). Figura 25. Gráfica Tiempo (min) vs. % D. P ensayo 3 Reactor Artesanal.. 63.
(64) 7.6.4 Ensayo 4 Reactor Artesanal. Se realizó el ensayo 4 para el reactor artesanal preparando 2 soluciones de concentración (ppm) diferentes. Obteniéndose los resultados (Tabla 12).. Tabla 12. Resultados obtenidos ensayo 4 Reactor Artesanal.. t (min) Abs 0,187 0,094 0,067 0,060 0,025 0,023. 0 60 120 180 240 300. Solución 1 [ppm] 54,4 24,4 15,6 13,4 2,1 1,5. % D.P 0,0 55,1 71,3 75,4 96,1 97,2. Abs 0,277 0,183 0,122 0,071 0,061 0,049. Solución 2 [ppm] 83,4 53,1 33,4 16,9 13,7 9,8. % D.P 0,0 36,3 60,0 79,7 83,6 88,2. Con los datos obtenidos (Tabla 12) se realizó la gráfica (Figura 26) Tiempo (min) vs. Concentración (ppm) y la gráfica (Figura 27) Tiempo (min) vs. % D. P.. Tiempo (min) vs. Concentración (ppm) Concentración (ppm). 90 80 70 60 50 40. Sln 1. 30. Sln 2. 20 10 0 0. 50. 100. 150. 200. 250. 300. 350. Tiempo (min). Figura 26. Gráfica Tiempo (min) vs. Concentración (ppm) ensayo 4 Reactor Artesanal.. 64.
(65) Tiempo (min) vs. % D. P 120.0. % D. P. 100.0 80.0 60.0. Sln 1. 40.0. Sln 2. 20.0 0.0 0. 50. 100. 150. 200. 250. 300. 350. Tiempo (min). Figura 27. Gráfica Tiempo (min) vs. % D. P ensayo 4 Reactor Artesanal.. 7.7 REUTILIZACIÓN DEL DIÓXIDO DE TITANIO En el ensayo efectuado para estudiar la posibilidad de reutilización del dióxido de titanio (TiO2) se preparó una solución cuya concentración fuese 105 ppm, la cual se distribuyó en dos beakers diferentes adicionando 1 g de TiO2 a cada uno; ambos beakers fueron llevados al Reactor Artesanal con agitación constante durante un tiempo de 300 minutos, tomando muestra para análisis al inicio y al final de este tiempo, midiéndose en espectrofotómetro de UV según el procedimiento descrito en el numeral 6.1.6. De igual manera se aplicaron las ecuaciones 1 y 2 para hallar la concentración y el porcentaje de Degradación Primaria (% D. P) respectivamente.. Pasado el tiempo de reacción se filtró la solución y se realizó un lavado del TiO2 con agua caliente durante 15 minutos, pasado este tiempo se efectuó el mismo procedimiento, para así de esta manera poder realizar la respectiva comparación de la efectividad en la reutilización del TiO2. Obteniéndose los resultados (Tabla 13).. 65.
Figure

Documento similar
En junio de 1980, el Departamento de Literatura Española de la Universi- dad de Sevilla, tras consultar con diversos estudiosos del poeta, decidió propo- ner al Claustro de la
E Clamades andaua sienpre sobre el caua- 11o de madera, y en poco tienpo fue tan lexos, que el no sabia en donde estaña; pero el tomo muy gran esfuergo en si, y pensó yendo assi
Sanz (Universidad Carlos III-IUNE): "El papel de las fuentes de datos en los ranking nacionales de universidades".. Reuniones científicas 75 Los días 12 y 13 de noviembre
(Banco de España) Mancebo, Pascual (U. de Alicante) Marco, Mariluz (U. de València) Marhuenda, Francisco (U. de Alicante) Marhuenda, Joaquín (U. de Alicante) Marquerie,
Por otra parte, se puede observar que para las membranas funcionalizadas, la porosidad y flujo es menor en comparación a sus muestras sin funcionalizar, una explicación a esto podría
= 1.4 mM, concentración de catalizador de 2 g/l y tiempo de irradiación de 45 min. ... 68 Figura 3.22: Cromatograma de la reacción utilizando el fotocatalizador
Para recibir todos los números de referencia en un solo correo electrónico, es necesario que las solicitudes estén cumplimentadas y sean todos los datos válidos, incluido el
2.6.3. Las soluciones de polímeros son mezclas líquidas de largas cadenas de polímeros y pequeñas moléculas de disolvente. Ellas juegan un papel muy importante en