0 UNIVERSIDAD NACIONAL DE LA AMAZONÍA PERUANA
FACULTAD DE FARMACIA Y BIOQUÍMICA
“EVALUACIÓN DE LA ACTIVIDAD ANTIBACTERIANA In Vitro DEL EXTRACTO ETANÓLICO DE LAS HOJAS DE Plantago major (Llantén) FRENTE
A Pseudomonas aeruginosa y Staphylococcus aureus, POR EL MÉTODO DE DIFUSIÓN EN DISCO Y MACRODILUCIÓN”
TESIS PARA OPTAR EL TITULO DE QUÍMICO FARMACÉUTICO
PRESENTADO POR: Bach. Crisanto Ahuite Amadeo Bach. Reaño Rojas Cesar Denis
ASESORES:
Q.F. Henry Vladimir Delgado Wong Q.F. Claudio Adriano Apagueño Arévalo BLGA. Jessy Vásquez Chumbe
ING. Alenger Alva Arévalo.Dr CO- ASESOR
Q.F. Jhesus Jean Pierre Lopez Mesia IQUITOS – PERÚ
1 UNIVERSIDAD NACIONAL DE LA AMAZONIA PERUANA
Facultad de Farmacia y Bioquímica
“EVALUACIÓN DE LA ACTIVIDAD ANTIBACTERIANA In Vitro DEL EXTRACTO ETANÓLICO DE LAS HOJAS DE Plantago major (Llantén) FRENTE
A Pseudomonas aeruginosa y Staphylococcus aureus, POR EL MÉTODO DE DIFUSIÓN EN DISCO Y MACRODILUCIÓN”
_________________________________
Q.F. Luis Alberto Vílchez Alcalá.
PRESIDENTE
_________________________________ ____________________________
Ing. Reyna Gladys Cárdenas de Reátegui Ing. Cleto Jara Herrera
MIEMBRO
MIEMBRO
_________________________________
Ing. Alenguer Alva Arévalo
ASESOR
___________________________ ___________________________
Ing. Jessy Patricia Vásquez Chumbe Q.F. Henry Vladimir Delgado Wong
ASESOR
ASESOR
___________________________ ___________________________
Q.F. Claudio Adriano Apagueño Arévalo Q.F. Jhesus Jean Pierre López Mesia
2 “EVALUACIÓN DE LA ACTIVIDAD ANTIBACTERIANA In Vitro DEL
EXTRACTO ETANÓLICO DE LAS HOJAS DE Plantago major (Llantén) FRENTE A Pseudomonas aeruginosa y Staphylococcus aureus, POR EL MÉTODO DE
DIFUSIÓN EN DISCO Y MACRODILUCIÓN”
Crisanto Ahuite Amadeo, Reaño Rojas Cesar Denis
Resumen
El estudio corresponde al periodo 2015, con muestras recolectadas en la comunidad Nina-Rumí, provincia de Maynas, distrito de San Juan, departamento de Loreto, Perú. El propósito del presente estudio fue determinar la actividad antibacteriana In Vitro del extracto Etanólico de hojas de Plantago major (llantén), mediante los Métodos de Macrodilución y Difusión en Disco, la evaluación se realizó en los Laboratorios de la UNAP, mediante la metodología de Macrodilución en caldo y difusión de disco en agar frente a Staphylococcus aureus ATCC 25923 y Pseudomonas aeruginosa ATCC 27853. El extracto etanólico de hojas de Plantago major mostraron halos de inhibición de 20.3 mm y 20 mm a una concentración de 12 mg y 6 mg respectivamente, los resultados de la concentración mínima inhibitoria del extracto etanólico de hojas de Plantago major fueron de 1 mg/mL y de 4 mg/mL para Staphylococcus aureus y Pseudomonas aeruginosa respectivamente, mostrando concentraciones bactericidas mínimas de 4 mg/mL y 32 mg/mL respectivamente.
3
EVALUATION IN VITRO ANTIBACTERIAL ACTIVITY ETHANOL EXTRACT
OF LEAVES PLANTAGO MAJOR (Llantén), AGAINST Pseudomonas aeruginosa
ANDStaphylococcus aureus, BY THE METHOD OF DISC DIFFUSION AND
MACRODILUTION.
Crisanto Ahuite Amadeo, Reaño Rojas Cesar Denis
Abstract
The study corresponds to the period 2015, with samples collected in community Nina-Rumí province of Maynas, District of San Juan, department of Loreto, Peru. The purpose of this study was to determine the in vitro antibacterial activity of ethanol extract of leaves of Plantago major (Plantain) using the methods Macrodilution and disk diffusion, the evaluation was conducted in the laboratories of the UNAP, using the methodology of Macrodilution broth and agar disc diffusion against Staphylococcus aureus ATCC 25923 and Pseudomona aeruginosa ATCC 27853. The ethanolic extract of leaves of Plantago major showed inhibition zones of 20.3 mm and 20 mm at a concentration of 6 mg and 12 mg respectively, the results of the Minimum Inhibitory Concentration of ethanolic extract of leaves of Plantago major were 1 mg/mL and 4 mg/mL for Staphylococcus aureus and Pseudomonas aeruginosa respectively showing Minimum Bactericidal Concentrations of 4 mg / mL and 32 mg / mL respectively.
4
“Dedicatoria”
Dedico este trabajo a DIOS, porque está conmigo en cada momento, guiándome por el
buen camino, dándome fortaleza, sabiduría y humildad para continuar. Recalco
indiscutiblemente a mis padres CARLOS y MARIA ELENA, porque son quienes a lo
largo de mi vida trabajaron muy duro para darme lo mejor y hacer de mí un hombre de
bien, y porque han depositado en todo momento su entera confianza en cada reto que se
me presentaba, sin dudar ni un solo momento de mi inteligencia y capacidad. A mis
PADRINOS ELENA Y ALBERTO Y A MI HERMANO MARTIN y ROY porque son parte
de mi motivo e inspiración de seguir siempre adelante. A mis AMIGOS: MARCIA,
ALEXANDER, FLAVIO, MIJAIL, MARCOS, que siempre serán como mi GRAN
CORAZA DE AMISTAD y RECIPROCIDAD la cual fortaleció nuestra HERMANDAD.
A mi abuelito FRANCISCO ALBERTO que desde el cielo ilumina mi camino y me
GUÍA a buenos Senderos y finalmente a mis Profesores que en todo momento
colaboraron y aportaron un granito de arena con sus conocimientos y enseñanzas en lo
profesional y en lo Humano.
CESAR DENIS REAÑO ROJAS
Este proyecto de tesis dedico principalmente a mi Madre, una mujer luchadora y con un
infinito don de amar que desde la niñez me ha guiado.
A mi Padre quien a lo largo de su vida ha velado por mi bienestar y educación siendo
mi apoyo en todo momento. Depositando su entera confianza en cada reto que se me
presentaba sin dudar ni un solo instante de mi inteligencia y capacidad.
Es por esas dos personas maravillosas que soy lo que soy ahora.
5
“Agradecimiento”
Nuestro agradecimiento a DIOS y a todas aquellas personas que de una u otra forma estuvieron compartiendo con nosotros, tanto en el ámbito profesional como en el personal, conocimientos, consejos, apoyo, experiencias, anécdotas e intercambios de opinión.
La culminación de esta presente tesis no habría sido posible sin la ayuda de las siguientes personas:
Al Ing. ALENGUER ALVA ARÉVALO, DR, por la ayuda brindada. Por ello queremos expresarle nuestra gratitud por habernos aceptado en su Laboratorio.
A la Blga. JESSY VASQUEZ CHUMBE, por haber dedicado una importante parte de su tiempo en compartir sus conocimientos y por abrirnos las puertas de su centro laboral.
Al BACH. EN BROMATOLOGIA Y NUTRICION
ALEXANDER JAVIER IMAN TORRES por habernos apoyado en la parte microbiológica, durante la ejecución de la parte experimental de la tesis.
Al Q.F. HENRY VLADIMIR DELGADO WONG, por su apoyo durante la redacción y culminación de la tesis.
Al Q.F. CLAUDIO APAGUEÑO AREVALO por los consejos brindados durante el desarrollo de la investigación y ayudarnos con ello a lograr nuestros objetivo de ser Químico Farmacéutico.
2.1.2.1 CLASIFICACION TAXONOMICA 2.1.2.2 SINONIMIA
2.1.2.3.DESCRIPCIÓN BOTÁNICA 2.1.2.4.DISTRIBUCIÓN
2.1.2.5.USOS DEL LLANTÉN
2.1.2.6.EFECTOS ADVERSOS Y TÓXICOS 2.1.2.7. COMPOSICIÓN QUÍMICA
2.1.2.8. ACCIÓN FARMACOLÓGICA
2.1.2.9. CARACTERÍSTICAS DE LAS CEPAS EN ESTUDIO 2.1.2.9.1. Staphylococcus aureus
2.1.2.9.1.1.CARACTERÍSTICAS MORFOLOGICAS 2.1.2.9.2. Pseudomona aeruginosa
2.1.2.9.2.1. CARACTERÍSTICAS MORFOLOGICAS:
7 2.7.1.1. METODO DE DILUCION EN PLACA O EN CALDO
2.7.1.2 TEST DE DILUCION EN AGAR 2.7.1.3 METODO DE DIFUSION EN DISCO 2.3. DEFINICIONES OPERACIONALES 2.3.1. VARIABLES
2.3.1.1. INDEPENDIENTE 2.3.1.2. DEPENDIENTE 2.3.2. INDICADORES
2.3.2.1. INDICADORES CONCENTRACION MINIMA INHIBITORIA 2.3.2.2. INDICADORES PARA EL METODO DE DIFUSION EN DISCO 2.3.2.3.EXTRACTO ETANÓLICO OBTENIDO DE LAS HOJAS DE Plantago major (LLANTÉN) - INDEPENDIENTE
2.4. HIPOTESIS
CAPITULO III
3.1.. METODOLOGIA 3.1.1 TIPO DE ESTUDIO
3.2. DISEÑO DE LA INVESTIGACIÓN 3.3. POBLACIÓN Y MUESTRA.
3.4. PROCEDIMIENTOS DE RECOLECCION DE DATOS 3.4.1. OBTENCION DEL EXTRACTO
3.4.1.1. RECOLECCIÓN DE LA MUESTRA VEGETAL 3.4.1.2. IDENTIFICACIÓN DE LA MUESTRA VEGETAL: 3.4.1.3. OBTENCIÓN DEL EXTRACTO ETANÓLICO 3.4.2. . METODO DE DIFUSION DE DISCO EN AGAR. 3.4.2.1. PREPARACION DEL INOCULO.
3.4.2.2. DILUCION DE EXTRACTOS. 3.4.2.3. INOCULACIÓN DE LAS PLACAS. 3.4.2.4. APLICACIÓN DE LOS DISCOS. 3.4.2.5. INCUBACIÓN.
3.4.2.6. LECTURA DE LAS PLACAS E INTERPRETACIÓN DE LOS RESULTADOS.
8 3.4.3.2. PREPARACION DE DILUCIONES.
3.4.3.3. COLOCACIÓN DEL INÓCULO EN LOS TUBOS 3.4.3.4. INCUBACIÓN.
3.4.3.5. LECTURA E INTERPRETACIÓN DE LA CIM. 3.5. ASPECTOS ETICOS
3.6. PLAN DE ANALISIS E INTERPRETACION DE DATOS
CAPITULO IV
4.1. RESULTADOS 4.2. DISCUSION 4.3. CONCLUSION
4.4. RECOMENDACIONES 4.5. BIBLIOGRAFIA
4.6. ANEXOS
9
INDICE DE TABLAS
Tabla N° 01: Porcentaje de rendimiento del Extracto etanólico de Plantago major “Llantén”
Tabla N° 02: Actividad antibacteriana obtenida del Extracto etanólico de Plantago major “Llantén” frente a Staphylococcus aureus. Según Diámetro de la zona de inhibición.
Tabla N° 03: Actividad antibacteriana obtenida del Extracto etanólico de Plantago major “Llantén” frente a Pseudomona aeruginosa. Según Diámetro de la zona de inhibición.
Tabla N° 04: Concentración Mínima Inhibitoria (CMI), Concentración Bactericida Mínima (CBM) del extracto de Plantago major “Llantén” frente a Staphylococcus aureus y Pseudomona aeruginosa.
Tabla N° 05: Concentración Inhibitoria Mínima (CIM), del extracto acuoso liofilizado de Plantago major “Llantén” frente a Pseudomona aeruginosa.
Tabla N° 06: Actividad antibacteriana del extracto etanólico de Plantago major “Llantén” según Concentración Mínima Inhibitoria (CIM), frente a Staphylococcus aureus y Pseudomona aeruginosa.
10
INDICE DE FIGURAS
Figura N° 01: Observación microscópica de Staphylococcus Aureus Figura N° 02: Observación microscópica de Pseudomona aureginosa Figura N° 03:. Direcciones en el sembrado del inóculo sobre la superficie del agar
Figura N° 04: Categorización del Extracto etanólico de Plantago major “Llantén” frente a Staphylococcus aureus según Diámetro de la zona de inhibición.
Figura N° 05: Actividad antibacteriana de Plantago major “Llantén”
frente a Staphyloccoccus aureus según Porcentaje de inhibición.
Figura N° 06: Categorización del Extracto etanólico de Plantago major “Llantén” frente a Pseudomona aeruginosa según Diámetro de la zona de inhibición.
Figura N° 07: Actividad antibacteriana de Plantago major “Llantén” frente a Pseudomona aeruginosa según Porcentaje de inhibición.
PAGINA 26 27
40
47
48
50
11
INDICE DE ANEXOS
Anexo N° 01.- Preparación del agar Mueller Hinton
Anexo N° 02.- Procedimiento para la preparación y el control de calidad de la turbidez estándar de Mc- Farland.
Anexo N° 03.- Recuperación de cultivos conservados
Anexo N° 04.- Procedimiento del método de macrodilución en caldo Anexo N° 05.- Procedimiento del método de macrodilución: control positivo
Anexo N° 06.- Flujo grama de obtención del extracto etanólico de Plantago major (llantén).
Anexo N° 07.- Procedimiento para obtención del extracto etanólico de Plantago major (llantén)
Anexo N° 08.- Preparación del inóculo
Anexo N° 09.- Dilución de Extractos y Aplicación de Discos Anexo N° 10.- Incubación
Anexo N° 11.- Macrodilución
Anexo N° 12.- Preparación de las diluciones Anexo N° 13.- Incubación de los microtubos Anexo N° 14.- Concentración bactericida mínima Anexo N° 15.- Lectura del CMB
Anexo N° 16.- Constancia de Certificación Anexo N° 17.- Mueller Hinton Agar Anexo N° 18.- Escala de McFarland
12
CAPITULO
13 1.1. INTRODUCCION.
La medicina tradicional se viene utilizando desde hace miles de años, y sus practicantes
han contribuido enormemente a la salud humana, en particular como proveedores de atención primaria de salud al nivel de la comunidad.1
Actualmente a nivel mundial y en los países en vías de desarrollo, se están realizando estudios sobre diferentes especies de plantas consideradas como medicinales, ya que son empleadas en la medicina tradicional, por los diferentes efectos terapéuticos que se les atribuyen.2
Cada día se presta más atención al estudio de las plantas medicinales de forma que la etnobotánica, la fitoterapia y la Fitoquímica, están tomando un auge insospechado, tanto en la práctica de la medicina complementaria como en el ámbito académico. El 80% de la población mundial, más de cuatro mil millones de personas, utiliza las plantas como principal remedio medicinal, según nos señala la OMS. Esta práctica está asociada al empirismo en muchos casos, y faltan estudios químicos, clínicos y epidemiológicos que confirmen de forma fehaciente los efectos fisiológicos de las plantas y los principios activos responsables. No hay que olvidar que el 25% de los fármacos existentes se obtienen de extractos vegetales, o bien se han sintetizado a partir de sustancias halladas en la investigación fitoquímica.3
El Perú es un país con una geografía muy diverso que determina la existencia de una gran variabilidad de pisos climáticos, en sus amplias listas de flores y fauna se citan especies endémicas, nativas e introducidas además goza de una gran riqueza ancestral en la utilización de plantas como medicamentos empleados para un sin fín de enfermedades; haciéndolas parte de la cultura de los pueblos.4
14 El empleo de las plantas medicinales con fines curativos es una práctica que se ha
utilizado desde tiempo inmemorial. Durante mucho tiempo los remedios naturales y sobre todo las plantas medicinales, fueron el principal e incluso el único recurso disponible para los médicos. Esto hizo que se profundizara en el conocimiento de las especies vegetales con propiedades medicinales y se ampliara la experiencia en el empleo de los mismos. El estudio de la flora medicinal es motivo de investigación por parte de los especialistas, que se encargan de conocer la diversidad de especies vegetales útiles a través del conocimiento que poseen los grupos indígenas. Las labores en las cuales se centra el interés científico están en recuperar Las plantas medicinales como una de las bases de la medicina tradicional.5
Las hojas de llantén como medicina tradicional es utilizado en cocción por algunos pobladores de la Regiones selváticas del Perú, para combatir enfermedades infecciosas como: Diarreas, de piel, vaginales, vías urinarias; es utilizado también como: astringente, antiinflamatorio y expectorante. 5
Con el presente estudio de investigación esperamos confirmar la actividad antibacteriana del extracto etanólico de las hojas de Plantago major (llantén), lo cual permitirá contar con información científica e incentivar su cultivo y uso por parte de los pobladores de la región pudiendo ser esta una alternativa económicamente menos costosa para el tratamiento de enfermedades producidas por Staphylococcus aureus y Pseudomonas aeruginosa.
15 1.2. OBJETIVOS
Generales
Evaluación de la actividad antibacteriana in vitro del extracto etanólico de las hojas de Plantago major (llantén), frente a
Pseudomona aeruginosa y Staphylococcus aureus, por el método de difusión en disco y macrodilución.
Específicos
Obtener el extracto Etanólico de las hojas de Plantago major (llantén). Determinar la actividad antibacteriana del extracto etanólico obtenido
de la hoja de Plantago major (llantén), por el método disco difusión frente a Staphylococcus aureus y Pseudomonas aeruginosa
Determinar la concentración mínima inhibitoria (CMI) del extracto etanólico obtenido de las hojas de Plantago major (llantén), por el método de macro dilución en caldo frente a Staphylococcus aureus y Pseudomonas aeruginosa
Comparar la actividad antibacteriana de la hoja de Plantago major (llantén), contra Staphylococcus aureus y Pseudomonas aeruginosa frente a Gentamicina, respectivamente usándolo como control positivo.
16
CAPITULO
17 2.1. MARCO TEORICO.
2.1.1. ANTECEDENTES.
Alvarado V., Moromi N. (2010), estudiaron la actividad antibacteriana in vitro de los extractos hidroalcohólicos de tres plantas medicinales: Plantago major L. (llantén), Erythroxy lumnovo grantensevar truxillense (coca Trujillo) y Camellia sinensis (té verde) mediante el método de difusión en agar con discos, sobre cinco cepas patrones de bacterias orales: Streptococcus mutans ATCC 25175, Lactobacillus ácido philus. ATCC 314, Actinomy cesviscosus ATCC 15987, Prevotella melaninogenicus ATCC 25845 y Fusobacterium nucleatum ATCC 25586.Al realizar las pruebas de sensibilidad in vitro, se obtuvieron los siguientes resultados: los tres extractos hidroalcohólicos en ambas concentraciones presentaron actividad antibacteriana mayor al alcohol etílico (5,8 mm) y menor que el PerioAid® (22,0 mm) sobre las cinco cepas bacterianas en estudio. La mayor actividad presentó el extracto hidroalcohólicos de Camellia sinensisa 50 μg/mL, la menor actividad presento Plantago major a 25 μg/mL. Se concluye que los tres extractos hidroalcohólicos en las diluciones de 25 y 50 μg/mL presentaron actividad antibacteriana sobre Streptococcus mutans, Lactobacillus ácido philus, Actinomy cesviscosus, Prevotella melaninogenica y Fusobacterium nucleatum. El efecto antibacteriano aumentó con la concentración en P. melaninogenica, que fue la cepa más sensible y A. viscosusla menos sensible.6
18 Claros M., Gonzáles E (2006) estudiaron la actividad antibacteriana de
Plantago major concluyendo que los extractos diclorometánico e hidroalcohólico de esta especie vegetal no presentan actividad antibacteriana frente a microorganismos patógenos (Clinopodiumbolivianum- Piperangustifolium).7
Mccutcheon A., (1992) estudió los extractos acuosos, metanólico y etanólico al 50% y 70% por la técnica de difusión de disco sobre diferentes bacterias tanto Gram positivas como Gram negativas, midiendo la zona de inhibición para determinar el efecto. El extracto metanólico resultó activo contra Salmonella typhimurium, El extracto de etanol al 50% es activos contra S. aureus, B. subtilis, S. disenteriae y E. coli, El extracto de etanol al 70% tiene actividad contra S. flexneri, Las actividades antibióticas registradas del Plantago major eran más débiles en comparación con la Gentamicina usado como control positivo.8
Ruiz C., (2013) demostró mediante un estudio In Vtro, según el método de difusión con discos en agar Sabouraud, el efecto antifúngico de una crema elaborada con las hojas de Plantago major en una concentración de 20,7 g de sólidos por cada gramo de ungüento hidrófilo; ésta resultó muy efectiva frente a Cándida albicans, en menor grado, frente al Trichophytumrubrumy no se observó actividad antimicótica in vitro frente al Microsporumcanis. El empleo de esta crema significa un ahorro importante, pues su costo es inferior al de los antimicóticos comerciales empleados en nuestro estudio (ketoconazol, nistatina y tolnaftato).9
Asia occidental donde crece en terrenos incultos, baldíos
terraplenes y taludes.11 Magnoliópsida, clase Magnoliópsida, orden Plantaginales y a la familia Plantaginaceae12.
El Plantago major es una hierba perenne que desarrolla su ciclo de vida entre seis y siete meses. Posee una altura entre los 15 cm a 30 cm; sin embargo, su longitud puede variar según los distintos hábitats de crecimiento. Las hojas son glabras, ovaladas, de color verde claro y se unen al tallo por un largo pecíolo; poseen aproximadamente 50 cm de longitud y un ancho de 20 cm en plantas adultas.13
20 Presenta Flores muy pequeñas, hermafroditas, dispuestas en
inflorescencias en tallo floral larguirucho vertical de 20-30 cm de largo, de color verde amarillento. Los frutos son cápsulas elipsoides de 2 a 4 mm de ancho. Las semillas se recogen por amasado de la inflorescencia fácilmente entre los dedos. Multiplica por semillas. En Brasil se utilizan para los mismos fines en la medicina popular y el Plantago lanceolata Hook. de origen europeo y Plantago australis Lam nativa del sur y el sudeste de Brasil. Otro tipo de origen oriental.14
El tallo es un rizoma corto de color amarillo, el cual puede llegar a medir 15 cm de longitud en una planta adulta. Por otro lado, las raíces son blancas y de tamaño uniforme, surgen del tallo subterráneo.
Las hojas son glabras, ovaladas, de color verde claro y se unen al tallo por un largo pecíolo; poseen aproximadamente 50 cm de longitud y un ancho de 20 cm en plantas adultas. Nacen a ras del suelo en forma de roseta y se desarrollan verticalmente12.
21 parte, las anteras son color lila, al inicio, y luego se vuelven
amarillentas. Los pedúnculos florales nacen del mismo punto de donde arrancan los pecíolos, y son de mayor longitud12. Es polinizada por el viento. El fruto es una pequeña cápsula que, cuando madura, se abre transversalmente dejando caer las semillas que contiene. Se producen más de 20.000 semillas por planta, estas tienen forma ovalada, tamaño muy reducido y un ligero sabor amargo; se localizan de 8 a 16 semillas por cápsula12.
Con el clima húmedo, las semillas se vuelven pegajosas, lo que provoca que se adhieran a los animales y, de esta manera, logran dispersarse. El endospermo representa la mayor parte de la semilla y cubre completamente al embrión; las células del endospermo están constituidas por gruesas paredes de celulosa, cuyo lumen celular contienen proteínas y gran cantidad de aceites12.
2.1.2.4. Distribución
Dentro del género Plantago (Plantaginaceae) existen aproximadamente 300 especies distribuidas en todo el mundo, que tienen en común la presencia de mucílago en sus semillas. 13
La importancia medicinal de las especies que forman este género se debe a la presencia de diversos glicósidos iridoides como la aucubina, fenilpropanoides, flavonoides, etc. Estos principios activos pueden hallarse en hojas, tallos y semillas (Penseiro 2012) 13
2.1.2.5. Usos del llantén
Las propiedades medicinales del Llantén tienen una larga historia en
la medicina popular, siendo utilizado para el tratamiento de las
mordeduras de perros rabiosos, como un protector de la epilepsia y la
heridas externas, es la que más la popularizó como planta medicinal,
aunque también posee otras virtudes, como anti-inflamatorio,
antiséptico, cardíaco, emoliente, diurético, expectorante, hemostático,
laxante, oftálmico, cataplasma, refrigerante y vermífugo. 14
Posee cierta acción antihemorroidal, que podemos aprovechar
escogiendo hojas frescas y machacándolas las añadiremos a fuego
lento con manteca, donde se unirán formando una especie de pomada
para calmar el dolor de las hemorroides. Sobre llagas o úlceras de
difícil curación, a las que protegerá con su acción antibacteriana y
antiséptica acelerando su cicatrización.14
Se considera un diurético, antidiarreico, expectorante, hemostática, siendo empleado contra las infecciones de las vías respiratorias superiores (faringitis, amigdalitis, estomatitis), bronquitis crónica, y como una ayuda en el tratamiento de las úlceras pépticas. Se emplean tanto las flores como las semillas, contra la conjuntivitis y las irritaciones de los ojos causadas por trauma. Las semillas se utilizan como un laxante y purgante mientras que las hojas se utilizan internamente para el tratamiento de la diarrea. Se utiliza para tratar los trastornos de la piel (acné y puntos negros), quemaduras y picaduras de insectos. 14
23 (HSV-1 y HSV-2) y adenovirus (ADV-3) y el ácido clorogénico
mostró que la actividad contra el adenovirus 11 (ADV-11). En otro estudio, el extracto de la planta exhibió actividad inmunomoduladora mediante el aumento de la proliferación de linfocitos y la secreción de interferón.14
Una dosis típica de Plántago major para uso oral es de 1-3 gramos tres veces diariamente. Se usan jarabes e infusiones para la tos.15 Cataplasmas preparadas con hojas machacadas y aplicada sobre heridas, quemaduras y picaduras de insectos, para la prostatitis, se indica baño de asiento, 20 minutos, 2 veces al día, preparado hirviendo 5 cucharadas de hojas picadas en 1 litro de agua.16 La aucubigemina, derivado de la aucubina, es el compuesto activo de mayor relevancia y se cree que es responsable de la actividad antibacteriana de la planta.17 Entre los múltiples usos de esta planta en el campo de la salud humana, se encuentran sus propiedades astringentes adecuadas para detener la diarrea, disentería y amebiasis. Además, una infusión de hojas de Plantago major, inhibe en un 82 a 95% la acidez de la secreción gástrica.12
2.1.2.6. Efectos adversos y tóxicos
Para las semillas podrían generar hinchazón o sensación de obstrucción del esófago o del intestino, en particular cuando la cantidad de líquido ingerido con la planta es insuficiente. 12
2.1.2.7. Composición química
24 Esta planta, conocida científicamente como Plantago major, posee
entre sus componentes varias sustancias azucaradas, como el sorbitol, la sacarosa y la fructuosa. Además, esta planta contiene las sustancias plantagonina e indicaína, las cuales son alcaloides. 12
Dentro de su composición posee flavonoides, que poseen excelentes propiedades cicatrizante y antioxidante. Los flavonoides que contiene el llantén son la luteolina y la noscapina. El llantén contiene vitamina C entre sus componentes, ésta se encuentra principalmente en las hojas de la planta. Además, la planta en general posee una importante cantidad de fibras. 12
La especie vegetal (llantén), no posee muchas sales minerales dentro de su composición, sin embargo, se destaca por su abundancia el potasio. El llantén posee propiedades alimentarias, esto se debe a que posee una gran cantidad de proteínas y de fibras, principalmente en las hojas. 12
Además se ha encontrado mucílagos (6%): arabinogalactanos, ramnogalacturonanos, glucomananos y pectinas: Ácidos fenoles como el ácido p-hidroxibenzoico, ácido protocatéquico, ácido gentísico y ácido cafeico: Iridoides (0.3-2.5%): asperulina y el mayoritario es la aucubina, Taninos y otros componentes como: cumarinas, ácido salicílico, sales minerales, especialmente zinc y K. 12
2.1.2.8. Acción Farmacológica
25 contenido de alantoina, una sustancia que tiene la propiedad de
estimular el crecimiento de las células de la epidermis y sustituir aquellas que estaban dañadas con lo que produce una regeneración de la misma. 12
Emoliente, antiinflamatorio, antimicrobiana. La acción emoliente es debida al elevado contenido en mucílagos. La actividad antiinflamatoria se ha relacionado con los iridoidesheterosídicos y los derivados del ácido cafeico. Este último a demostrado también actividad antioxidante. 12
26 2.1.2.9. CARACTERÍSTICAS DE LAS CEPAS EN ESTUDIO
2.1.2.9.1. Staphylococcus Aureus.16
Especie coagulasa positiva, es un reconocido patógeno humano, siendo agente etiológico de un amplio espectro de infecciones de origen comunitario y nosocomial., tiene una amplia gama de determinantes de virulencia, que abarca componentes de pared celular y una gran variedad de exoproteínas que contribuyen en su habilidad para colonizar y causar enfermedad en mamíferos. 16
Reino Bacteria
Nombre binomial Staphylococcus aureus
Fig. N° 01: Observación microscópica de Staphylococcus Aureus 2.1.2.9.1.1. CARACTERÍSTICAS MORFOLOGICAS:
Staphylococcus aureus presenta colonias de 1 a 3 mm de diámetro, lisas, levemente elevadas, de bordes enteros, levemente convexas y generalmente pigmentadas con un color que puede ir desde el crema al amarillo. 16
27 A nivel nosocomial Staphylococcus aureus es un importante
agente de infecciones de herida quirúrgica, de prótesis y otras. 18
Staphylococcus epidermidis es integrante de la flora normal de piel pero produce infecciones crecientes de piel y anexos, colonizando cuerpos extraños y también es causa de infecciones profundas en huéspedes inmunocomprometidos. Staphylococcus saprophyticus es causa de infección urinaria baja en la mujer joven.19
2.1.2.9.2. Pseudomonas Aeruginosa.20
Especie patógena, que puede causar diversos tipos de infecciones pero rara vez causa enfermedades graves en personas sanas sin algún factor predisponente. Coloniza predominantemente partes dañadas del organismo, como quemaduras y heridas quirúrgicas, el aparato respiratorio de personas con enfermedades subyacentes o las lesiones físicas en los ojos. Desde estos lugares puede invadir el organismo y causar lesiones destructivas o septicemia y meningitis. 20
Dominio Bacteria Fig N° 02: Observación microscópica de Pseudomonas Aeruginosa 2.1.2.9.2.1. CARACTERÍSTICAS MORFOLOGICAS:
28 mucoides, no forma esporas. En un medio de agar sangre, las
colonias son grandes, irregulares con pigmento verde o azul-verde difusible llamado piocianina. 20
Son bacilos cortos, en parejas, en cadenas o aislados, Gram (-), el flagelo polar monotrico no es visible en una tinción de Gram ya que el flagelo es muy delgado, para poderlo observar habrá que realizar un proceso de tinción especial llamado Tinción flagelar de Leifson-Clarck, generalmente el flagelo no se usa como identificación, sin embargo hay ocasiones que es necesario cuando las pruebas bioquímicas no son suficientes para identificar al género bacteriano te apoyas distinguiendo de las bacterias que no tienen flagelo.20
La elastasa produce los rasgos patológicos observados en las infecciones de la córnea, además produce una enterotoxina que puede ser responsable de la diarrea asociada en infecciones intestinales, también da lugar a infecciones del tracto urinario, infecciones de quemaduras y heridas, abscesos, meningitis, bronconeumonía y la endocarditis bacteriana sub-aguda. Tratamiento: con antibióticos como polimixina B, colistina y Gentamicina, en casos graves se utiliza la carbenicilina en combinación con la gentamicina.20
2.2.11. MÉTODO DE MACRODILUCIÓN PARA BACTERIAS
29 miniaturización simple de la técnica se conoció como macrodilución en
caldo.21
En el método de macrodilución se emplea por cada combinación de microorganismo con antimicrobiano, un juego de tubos. Habitualmente se prepara el juego de tubos con 1ml de caldo Muller Hinton (Anexo N° 17) suplementado con Ca++ y Mg++ estéril sin antimicrobiano. 21
Para un pequeño número de pruebas se preparan diluciones al doble directamente en los tubos, del modo siguiente. Se colocan 2 ml de solución de antibiótico en el primer tubo de la serie de diluciones. En cada uno de los tubos restantes se añade 1 ml de caldo MH. Con una pipeta estéril se transfiere 1 ml del primer tubo al segundo. Después de mezclar el contenido del segundo tubo, se transfiere 1 ml con una pipeta diferente (en esta transferencia y en todas las sucesivas) al tercer tubo.21
El proceso continúa hasta el penúltimo tubo, al que se le quita1 ml, que se descarta. El último tubo no recibe solución de antibiótico y sirve de control de crecimiento. Las concentraciones finales de antibióticos en esta prueba son iguales a la mitad de la serie inicial de dilución, debido al agregado de una concentración igual de inóculo <en el caldo. Se prepara un inóculo bacteriano que contenga 105 a 106 UFC/ml ajustando la turbidez de un caldo de cultivo al estándar y diluyendo luego a 1:200 en caldo. Añadir a cada susceptibilidad, el huésped y el fármaco. 23
30 2.2.11.1.1. Método de dilución en placa o en caldo:
Es el Gold Standard de los test in vitro. En este un inóculo bacteriano (usualmente 10 unidades formadoras de colonias) determinado se expone a diluciones seriadas del antibiótico por 18 a 24 horas. El resultado se expresa en concentración inhibitoria mínima (CIM) que es la menor concentración en microgramos por mililitro que inhibe el crecimiento de microorganismos. En general la susceptibilidad es definida como una CIM que es equivalente o menor a de un dieciseisavo a un cuarto de la concentración pico sérica. Esta información es cuantitativa. 23 2.2.11.1.2. Test de dilución en agar:
Se basa en los mismos principios a excepción que las bacterias son inoculadas en platos. La CMI es definida como la menor concentración a la cual no se observan colonias, tiene como desventaja el mayor costo y el no brindar una información cuantitativa. 23
2.2.11.1.3. Método de difusión en disco:
Se emplean discos de papel impregnados de antibiótico localizados en zonas libres de microorganismos con dosis seriada. Observando el tamaño del halo de inhibición de crecimiento se puede obtener resultados semicuantitativos. La sensibilidad está determinada por el diámetro del halo cuya lectura viene estandarizada. 23
31 2.3. DEFINICIONES OPERACIONALES
2.3.1 Variables
2.3.1.1 Independiente
Extracto etanólico obtenido de las Hojas de Plantago major (Llantén) 2.3.1.2 Dependiente
Actividad antibacteriana: - Por el método de difusión en disco
- Por el método de Microdilución
2.3.2. INDICADORES
2.3.2.1. CONCENTRACIÓN MÍNIMA INHIBITORIA (MICRODILUCION)
DEPENDIENTE (X): CONCENTRACIÓN DEL EXTRACTO
Concentración baja: 0.25 mg/mL
Concentración media: 4 mg/mL
Concentración alta: 32 mg/mL
2.3.2.2. MÉTODO DE DIFUSIÓN EN DISCO
DEPENDIENTE (X): CONCENTRACIÓN DEL EXTRACTO
Concentración baja : 6 mg
Concentración media : 12 mg
2.3.2.3. EXTRACTO ETANÓLICO OBTENIDO DE LAS HOJAS DE Plantago major (LLANTÉN) - INDEPENDIENTE
Porcentaje de rendimiento del extracto
2.4. HIPOTESIS
2.3.3. OPERACIONALIZACIÓN DE LAS VARIABLES:
Variable Dependiente
Definición Conceptual Indicador Índices Definición
Operacional bacteria Staphylococcus aureus, y Pseudomonas aeruginosa, causado por agentes químicos externos produciendo una inhibición en el crecimiento del mismo.
Grado de sensibilidad que presentan los medios de cultivos inoculados con Staphylococcus
una infección dada por la
cepa en estudio puede ser
tratada apropiadamente
con la dosis de extracto
recomendada para el tipo
de infección y la especie
infectante, a menos que
Variable dependiente
Definición Conceptual
Definición Operacional Indicador Índices Escala de
35
CAPITULO
3.1. METODOLOGIA
3.1.1. TIPO DE ESTUDIO.
Experimental: Porque se evaluó un fenómeno dado introduciendo elementos
que pueden modificar el comportamiento de las variables en estudio, los que fueron medidos en determinados momentos.
Prospectivo: Porque se desarrolló a través del tiempo.
Longitudinal: Porque nos permitió realizar la recolección sistemática de las variables involucradas en función del tiempo.
3.2DISEÑO DE LA INVESTIGACIÓN
En la presente investigación se empleó el estudio experimental, prospectivo y longitudinal, cuyo objetivo principal consistió en determinar la actividad antibacteriana frente a 2 cepas patógenas (Staphylococcus aureus y Pseudomonas aeruginosa), utilizando 2 métodos: Difusión en disco (Kirby-Bauer) representada por la presencia de halos de inhibición en concentraciones de 6 mg y 12 mg. Macrodilución, que determina la concentración mínima inhibitoria representada por la ausencia de turbidez producida en el tubo con la menor concentración (mg/mL-extracto; µg/mL-antibiótico), la interpretación del ensayo se realizó por comparación visual utilizándose para ello concentraciones de 32 mg/mL a 0.25 mg/mL y para el control positivo (Gentamicina de 160 mg/2ml) fue de 512 ug/mL a 2 ug/mL.
3.3. POBLACIÓN Y MUESTRA
3.3.1. Población vegetal
3.3.2. Muestra vegetal
La muestra vegetal estuvo formada por las Hojas de Plantago major (Llantén).
CRITERIOS DE INCLUSIÓN
La muestra vegetal no presentó ataques por bacterias, hongos y herbívoria.
CRITERIOS DE EXCLUSIÓN
La muestra vegetal presentó ataques por bacterias, hongos y herbivoria.
3.3.3. Población microbiológica
La población microbiológica estuvo constituido por bacterias y hongos obtenidos del Instituto Nacional de Salud.
3.3.4. Muestra microbiológica
Las muestras microbiológicas estuvieron constituidas por bacterias: Staphylococcus aureus ATCC 25923
Pseudomonas aeruginosa ATCC 25922
CRITERIOS DE INCLUSIÓN
Cultivos de reciente crecimiento (bacterias jóvenes). Cultivos que no presentaron contaminación.
CRITERIOS DE EXCLUSIÓN
Cultivos que presentaron contaminaciones.
3.4. PROCEDIMIENTOS DE RECOLECCION DE DATOS
3.4.1. OBTENCION DEL EXTRACTO
3.4.1.1. RECOLECCIÓN DE LA MUESTRA VEGETAL
Las muestras de Plantago major (Llantén), fueron recolectadas en el campus de la Facultad de Farmacia y Bioquímica, cuya ubicación es Latitud 3°50´23” Sur y Longitud 73°22´41” Oeste, Centro Poblado Nina Rumi, Distrito de San Juan, Provincia de Maynas – Departamento de Loreto.
3.4.1.2. IDENTIFICACIÓN DE LA MUESTRA VEGETAL:
La recolección de la muestra se hizo con el apoyo del botánico del Herbario de la Universidad Nacional de la Amazonia Peruana Ing. Juan Ruíz, cuya muestra fue enviada al Herbarium Amazonense para la certificación correspondiente. (Ver Anexo N° 16), posteriormente la materia prima fue transportado a la Planta Piloto de la Facultad de Industrias Alimentarias ubicada en la Av. Freyre N° 610 – Iquitos, para la ejecución de la parte experimental.
3.4.1.3. OBTENCIÓN DEL EXTRACTO ETANÓLICO
El material vegetal fue lavado y se procedió al secado, para ello se colocó en paneles por un periodo de 20 días a temperatura ambiente, tiempo en el cual diariamente se observaba para evitar contaminación de la muestra.
presión de 640 mmHg., una vez concentrado el extracto se colocó en placas Petri para la evaporación total del solvente a temperatura ambiente por 3 días.
3.4.2. METODO DE DIFUSION DE DISCO EN AGAR.
3.4.2.1. PREPARACION DEL INOCULO.
a. Se seleccionó cuatro a cinco colonias bien aisladas, del mismo tipo morfológico, de un cultivo en placa con agar M-H.
b. Se Tocó la superficie de cada colonia con un asa de siembra y transfirió a un tubo que contiene de 2 - 3 mL de NaCl 0,9 %
c. Se ajustó la turbidez del inóculo con solución salina o caldo apropiado hasta el tubo 0.5 de la escala de Mc. Farland, por comparación visual con el estándar.
d. La suspensión preparada contiene aproximadamente 1,5 x 108 UFC/mL. 16,17,24.
3.4.2.2. DILUCIÓN DE EXTRACTOS.
Se pesaron 360 mg de cada extracto en micro tubos estériles, fueron diluidos 0,6 ml de una mezcla Etanol/Agua estéril (1:1) para alcanzar una concentración de 600 mg/ml (Concentración A.) en la separación inicial.
Los extractos diluidos fueron homogenizados en vórtex hasta la disolución completa.
Para preparar la concentración B, se tomó 0,2 mL de la Conc. A y se disolvió en 0,2 mL de una mezcla Etanol/Agua estéril (1:1) para alcanzar una concentración de 300 mg/ml (Concentración B)
3.4.2.3. INOCULACIÓN DE LAS PLACAS.
Dentro de los 15 minutos siguientes al ajuste de la turbidez del inóculo, se inoculó 100 µL del inóculo sobre la superficie seca de la placa de Mueller Hinton, diseminando con la espátula de Drigalsky en todas las direcciones para asegurar una distribución uniforme del inóculo (Figura 1). Antes de colocar los discos se dejó secar la placa a temperatura ambiente durante 3 a 5 minutos para que cualquier exceso de humedad superficial sea absorbido.
Figura N° 03. Direcciones en el sembrado del inóculo sobre la superficie del agar.
3.4.2.4. APLICACIÓN DE LOS DISCOS.
Se colocaron los discos individuales o multidisco sobre la superficie del agar con la ayuda de una pinza estéril o la punta de una aguja presionando suavemente sobre cada disco para asegurar un contacto completo con la superficie del agar.
Se colocaron los discos uniformemente, de modo que estén a una distancia mínima de 25 mm uno del otro. Un disco no debe ser removido una vez que tomó contacto con la superficie del agar debido a que algunos antibióticos se difunden rápidamente. 16,17
3.4.2.5. INCUBACIÓN.
Incubar lar placas en posición invertida a 35°C dentro de los 15 minutos posteriores a la aplicación de los discos.
3.4.2.6. LECTURA DE LAS PLACAS E INTERPRETACIÓN DE LOS RESULTADOS.
Se midieron los diámetros de las zonas de inhibición completa (incluyendo el diámetro del disco), usando Calibrador Vernier.
El punto final se tomó como el área que no muestra un crecimiento obvio, visible, que puede ser detectado mediante observación visual, no incluyendo velo de crecimiento o colonias muy pequeñas que puedan ser detectadas solo con mucha dificultad en el borde de la zona.
3.4.3. METODO DE MACRODILUCION. (ANEXO N°04)
3.4.3.1. PREPARACIÓN DEL INÓCULO.
a. Se seleccionó cuatro a cinco colonias bien aisladas, del mismo tipo morfológico, de un cultivo en placa con agar M-H.
b. Se Tocó la superficie de cada colonia con un asa de siembra y transfirió a un tubo que contiene de 2 - 3 mL de NaCl 0,9 %
c. Se ajustó la turbidez del inóculo con solución salina o caldo apropiado hasta el tubo 0.5 de la escala de Mc. Farland (Anexo N° 18), por comparación visual con el estándar.
d. La suspensión preparada contiene aproximadamente 1,5x 108 UFC/mL. 16,17,24
3.4.3.2. PREPARACION DE DILUCIONES.
A.EXTRACTOS.
Se pesaron 320 mg del extracto en viales tipo Spendorff estériles, diluidos en 0,5 ml de agua estéril para alcanzar una concentración de prueba de 640 mg/ ml (Solución madre o Stock)
De la solución madre se tomó 0.2 ml y será añadido al tubo N° 01 que contendrá 1.8 ml de caldo Mueller Hinton.
Del tubo N° 01 se tomó 1 ml para ser añadido al Tubo N° 02 y así sucesivamente hasta llegar al tubo N°08
Del tubo N° 08 se tomó 1 ml que fue desechado.
Después de este proceso se agregó a todos los tubos 1 ml de la suspensión bacteriana.
El volumen final mínimo, en cada tubo, será de 2 ml.
Las concentraciones estuvieron comprendidas entre los rangos de 32 mg/ml a 0.25 mg/mL, teniendo como control de crecimiento el tubo N° 09.
B.CONTROL. (ANEXO N°05)
El control positivo empleado en la prueba fue el antibiótico Gentamicina (160 mg/2ml), del cual se utilizó 0.64 ml y se enrasó hasta 5 ml en un tubo estéril para obtener una solución madre o stock de 10240 ug/ml.
De la solución madre se tomó 0.2 ml y fue añadido al tubo N° 01 que contendrá 1.8 ml de caldo Mueller Hinton.
Del tubo N° 01 se tomó 1 ml para ser añadido al Tubo N° 02 y así sucesivamente hasta llegar al tubo N°08
Del tubo N° 08 se tomó 1 ml que será desechado.
Después de este proceso se agregó a todos los tubos 1 ml de la suspensión bacteriana.
El volumen final mínimo, en cada tubo, será de 2 ml.
3.4.3.3. COLOCACIÓN DEL INÓCULO EN LOS TUBOS
Se agregó 1 ml del inóculo estandarizado a cada tubo de dilución de muestra y al tubo control de crecimiento y se homogenizó la mezcla. No deben transcurrir más de 15 minutos entre la preparación del inóculo y su colocación en el tubo. Se debe tener en cuenta que tanto la muestra, como el inóculo sufrirán una dilución al medio. Es aconsejable realizar un control de pureza del inóculo subcultivando una alícuota en un medio sólido no selectivo.24
3.4.3.4. INCUBACIÓN.
El tiempo de incubación para la mayoría de los microorganismos es de 16 a 20 horas, para la técnica de macrodilución. 24
3.4.3.5. LECTURA E INTERPRETACIÓN DE LA CIM.
La CIM corresponde a la mínima concentración de antibiótico en donde no se observa desarrollo (turbidez). La CIM se expresa en mg/ml en los extractos y en µg/ml en el antibiótico.16
3.5. ASPECTOS ETICOS
El experimento se realizó siguiendo los principios de las 3 R (Reducción, Refinamiento, Reemplazo), en la cual se pudo Reducir a cero el número de animales; se refinaron las pruebas experimentales por un método alternativo de mayor sensibilidad y se reemplazaron por un método alternativo in vitro.
3.6. PLAN DE ANALISIS E INTERPRETACION DE DATOS
RESULTADOS
4.1. Obtención del extracto:
TABLA N° 01: Porcentaje de rendimiento del Extracto etanólico de Plantago major Peso Porcentaje
Muestra Vegetal 7000 --- Extracto
etanólico 650 9.3
En la tabla N° 01 se observa que de los 7 Kg de muestra molida se obtuvo 650 g de extracto etanólico de Plantago major que representa un porcentaje de rendimiento 9.3 %
4.2. Actividad antibacteriana de Plantago major “Llantén”. 4.2.1. Método de difusión en disco (Kirby - Bauer).
4.2.1.1. Actividad antibacteriana frente a Staphylococcus aureus
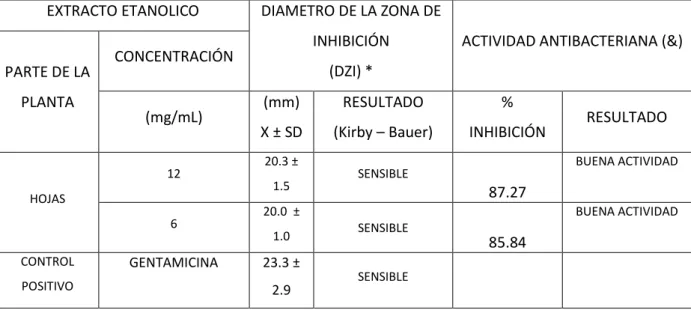
TABLA N° 02 : Actividad antibacteriana obtenida del Extracto etanólico de Plantago major “Llantén” frente a Staphylococcus aureus. Según Diámetro de la zona de inhibición.
EXTRACTO ETANOLICO DIAMETRO DE LA ZONA DE
INHIBICIÓN
* Esquema DZI frente a Control positivo & Actividad antimicrobiana Porcentaje de inhibición Resistente: <12 mm Inactivo: < 40% Intermedio: 13 - 14 mm Poco activo: 40 – 50%
Sensible: > 15 mm Moderadamente activo: 51 – 75% Buena actividad :> 76 %
La Tabla Nº 02, se muestra el promedio y desviación estándar de los diámetros de la zona de inhibición que se obtuvieron en las lecturas del ensayo de disco difusión, a diferentes niveles de concentraciones del extracto etanólico de hojas de Plantago major “Llantén” frente a Staphylococcus aureus.
El control Positivo (Gentamicina 10 µg), obtuvo un promedio de 23.3 mm. En el Diámetro de la zona de inhibición (DZI), encontrándose como resultado SENSIBLE según parámetros del método de Kirby – Bauer (Sensible = >15 mm.).
La actividad antibacteriana se mide principalmente por el porcentaje de inhibición que demuestran los extractos etanólicos a las diversas concentraciones evaluadas, encontrándose 87.27% y 85.84% en las concentraciones de 12 mg y 6 mg respectivamente; lo cual demuestra tener BUENA ACTIVIDAD frente a Staphylococcus aureus.
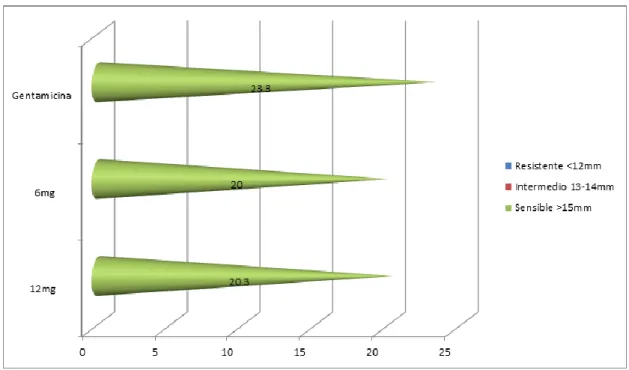
Figura N° 04: Categorización del Extracto etanólico de Plantago major “Llantén” frente a Staphylococcus aureus según Diámetro de la zona de inhibición.
El grupo control positivo obtuvo un diámetro de inhibición de 23.3mm, lo cual lo categoriza como SENSIBLE según el manual de procedimiento para la prueba de sensibilidad antimicrobiana por el método de disco difusión.
Los grupos con las diferentes concentraciones del extracto etanólico de Plantago major, obtuvieron valores de DZI mayores a 15mm, por lo cual se categoriza como SENSIBLE.
Figura N° 05: Actividad antibacteriana de Plantago major “Llantén” frente a Staphyloccoccus aureus según Porcentaje de inhibición.
La figura N° 05, muestra los porcentajes de inhibición del extracto etanólico de Plantago major “Llantén” en las diferentes concentraciones frente a Staphylococcus aureus.
4.2.1.2. Actividad antibacteriana frente a Pseudomona aeruginosa.
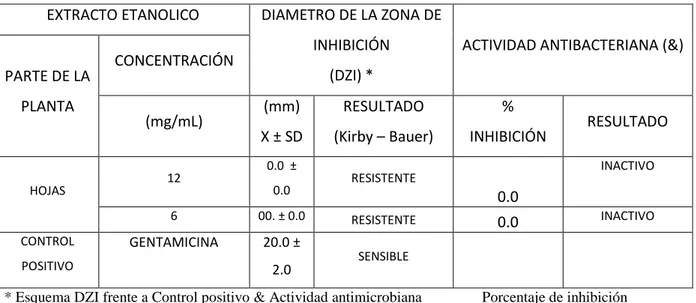
TABLA N° 03 : Actividad antibacteriana obtenida del Extracto etanólico de Plantago major “Llantén” frente a Pseudomona aeruginosa. Según Diámetro de la zona de inhibición.
EXTRACTO ETANOLICO DIAMETRO DE LA ZONA DE
INHIBICIÓN
* Esquema DZI frente a Control positivo & Actividad antimicrobiana Porcentaje de inhibición Resistente: <12 mm Inactivo: < 40% Intermedio: 13 - 14 mm Poco activo: 40 – 50%
Sensible: > 15 mm Moderadamente activo: 51 – 75% Buena actividad :> 76 %
Fuente: Instituto Nacional De Salud, Ministerio De Salud Del Perú. 2002. “Manual De Procedimientos Para La Prueba De Sensibilidad Antimicrobiana Por el método de disco difusión”
La Tabla Nº 03 , se muestra el promedio y desviación estándar de los diámetros de la zona de inhibición que se obtuvieron en las lecturas del ensayo de disco difusión, a diferentes niveles de concentraciones del extracto etanólico de la Planta entera de Plantago major “Llantén” frente a Pseudomona aeruginosa.
El control Positivo (Gentamicina µg), obtuvo un promedio de 20.0 mm. en el Diámetro de la zona de inhibición (DZI), encontrándose como resultado SENSIBLE según parámetros del método de Kirby – Bauer (Sensible = >15 mm.).
RESISTENTE, por encontrarse por encima del parámetro de comparación según control positivo (Resistente = <12 mm).
La actividad antibacteriana se mide principalmente por el porcentaje de inhibición que demuestran los extractos etanólicos a las diversas concentraciones evaluadas. No encontrándose actividad en ninguna de las concentraciones ensayadas; lo cual demuestran ser INACTIVOS frente a Pseudomona aeruginosa.
Figura N° 06: Categorización del Extracto etanólico de Plantago major “Llantén” frente a Pseudomona aeruginosa según Diámetro de la zona de inhibición.
La Figura N° 06, muestra la categorización de las diferentes concentraciones del extracto etanólico de Plantago major y del control positivo (Gentamicina 10 µg), respecto al Diámetro de la Zona de Inhibición (DZI) frente a Pseudomona aeruginosa.
Los grupos con las diferentes concentraciones del extracto etanólico de Plantago major, obtuvieron valores de DZI menores a 12mm, por lo cual se categoriza como RESISTENTE.
Figura N° 07: Actividad antibacteriana de Plantago major “Llantén” frente a Pseudomona aeruginosa según Porcentaje de inhibición.
La figura N° 07 muestra los porcentajes de inhibición del extracto etanólico de Plantago major “Llantén” en las diferentes concentraciones frente a Pseudomona aeruginosa.
4.1.2. Método de Macrodilución: Determinación de la Concentración Mínima Inhibitoria (CIM) y Concentración Bactericida Mínima (CBM).
4.2.2.1. Determinación de la Concentración Mínima Inhibitoria (CIM)
4.2.2.1.1. Concentración Mínima Inhibitoria - Staphylococcus aureus.
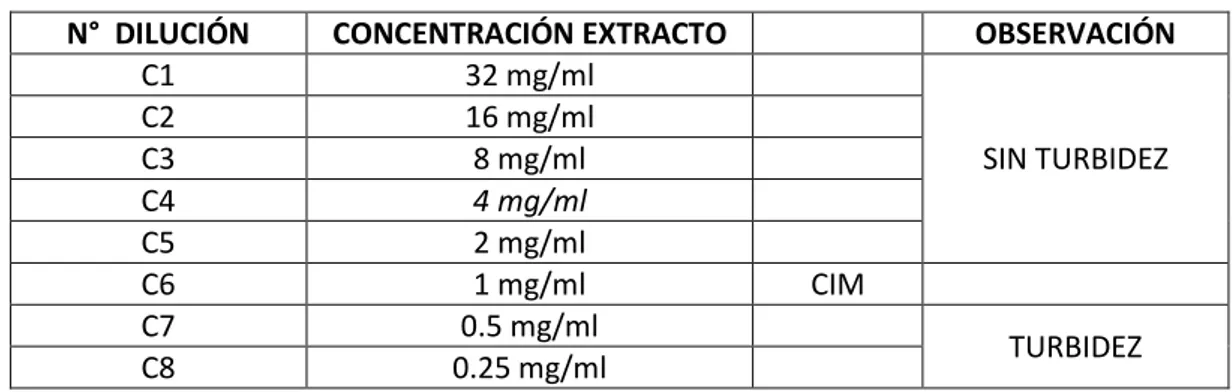
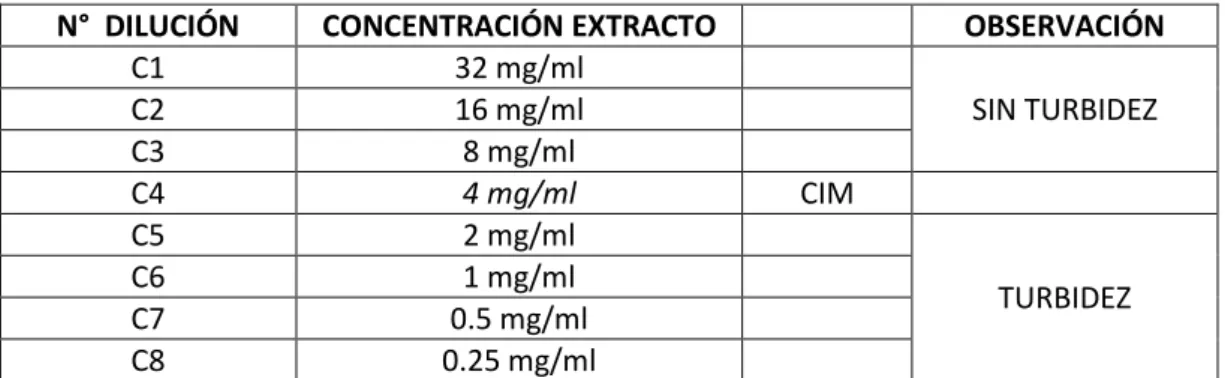
TABLA N°04: Concentración Inhibitoria Mínima (CIM), del extracto etanólico de Plantago major “Llantén” frente a Staphylococcus aureus.
N° DILUCIÓN CONCENTRACIÓN EXTRACTO OBSERVACIÓN
C1 32 mg/ml
SIN TURBIDEZ
C2 16 mg/ml
C3 8 mg/ml
C4 4 mg/ml
C5 2 mg/ml
C6 1 mg/ml CIM
C7 0.5 mg/ml
TURBIDEZ
C8 0.25 mg/ml
4.2.2.1.2. Concentración Mínima Inhibitoria - Pseudomona aureginosa.
TABLA N°05: Concentración Inhibitoria Mínima (CIM), del extracto etanólico de Plantago major “Llantén” frente a Pseudomona aureginosa.
N° DILUCIÓN CONCENTRACIÓN EXTRACTO OBSERVACIÓN
C1 32 mg/ml crecimiento bacteriano de Pseudomona aureginosa, se encuentra inhibido desde el tubo de ensayo C1 de mayor concentración hasta el tubo de ensayo C4, por la actividad del extracto etanólico de Plantago major “Llantén”, en el cual no se observa la turbidez característica de la cepa.
Desde el tubo de ensayo C5 (2 mg/ml) hasta el tubo de ensayo C8 (0.25 mg/ml) se observa turbidez marcada.
4.2.2.2. Consolidado: Resultados Concentración inhibitoria Mínima (CIM).
TABLA N°06: Actividad antibacteriana del extracto etanólico de Plantago major “Llantén” según Concentración Mínima Inhibitoria (CIM), frente a Staphylococcus aureus y Pseudomona aureginosa.
BACTERIA EN ESTUDIO N° DILUCIÓN CMI RESULTADO (*)
Staphylococcus aureus C6 1 mg/ml MODERADO ACTIVO
Pseudonoma aureginosa
En la Tabla N°06, se muestra los resultados de la actividad antibacteriana del extracto etanólico de Plantago major “Llantén” frente a Staphylococcus aureus y Pseudomona aureginosa según la determinación de la Concentración Mínima Inhibitoria (CIM).
Según rango de lectura de la concentración inhibitoria mínima, encontrada en el ensayo de macrodilución, el efecto del extracto etanólico de Plantago major “Llantén” demostró ser Moderado activo frente a Staphylococcus aureus.
Asimismo, en el rango de lectura de la concentración inhibitoria mínima, encontrada en el ensayo de macrodilución, el efecto del extracto etanólico de Plantago major “Llantén” demostró ser Moderado activo frente a Pseudomonas aeruginosa.
4.2.2.3. Determinación de la Concentración Bactericida Mínima (CBM).
TABLA N°07: Concentración Bactericida Mínima (CBM) del extracto de Plantago major “Llantén” frente a Staphylococcus aureus y Pseudomona aureginosa.
Especies bacterianas Clasificación CBM
S. aureus Cocos gram-positivos 4 mg/ml
P. aureginosa Bacilos gram-negativos 32 mg/ml
En la tabla N°07, se muestra la concentración Bactericida mínima presentada por la acción del extracto etanólico de Plantago major “Llantén” frente a Staphylococcus aureus y Pseudomona aeruginosa.
4.2. DISCUSION
El presente estudio fue diseñado para obtener información sobre el espectro antibacteriano de Plantago major por el método de difusión de disco en agar y macrodilución. El procedimiento fue estandarizado mediante la evaluación de la Gentamicina frente las bacterias utilizadas en el estudio, determinando que la concentración mínima inhibitoria de la Gentamicina frente a Staphylococcus aureus y Pseudomona aeruginosa fue de 2 µg/mL en ambas bacterias y los halos de inhibición mediante el método de difusión en agar frente a Staphylococcus aureus y Pseudomona aeruginosa de 18.7 y 18.0 mm respectivamente; clasificando a las bacterias utilizadas como sensibles.
Los resultados mostraron que el porcentaje de rendimiento obtenido fue de 9.3 %, respeto a la evaluación microbiológica los resultados mostraron una notable actividad antibacteriana del extracto etanólico de Plantago major frente a Staphylococcus aureus; se evaluaron a concentraciones de 12 y 6 mg encontrándose diámetros en la zona de inhibición de 20.3 mm. y 20.0 mm. Respectivamente, los cuales obtuvieron como resultados la clasificación de SENSIBLE, por encontrarse por encima del parámetro de comparación según control positivo (Sensible = >15 mm). Éstos resultados de Difusión en Disco difieren con lo expresado por Claros et al. 7 (2006) quienes concluyen que los extractos diclorometánico e hidroalcohólico de Plantago major no mostraron actividad antibacteriana frente a algún microorganismo, por otro lado, los resultados de este ensayo coinciden con lo expresado por Basma et al 10 (2012) concluyeron que el extracto de Plantago major posee propiedades antimicrobianas por el método de difusión de disco frente a gram positivas (Lactobacillus sp. y Staphylococcus aureus con halos de inhibición promedio de 25 mm y 21 mm respectivamente) y gram negativas (Proteus sp., Pseudomonas aeruginosa, Escherichia coli y Enterococcus sp. con halos de inhibición promedio de 20 mm, 24, mm, 18 y 12 mm respectivamente) concluyendo que se pueden utilizar como una fuente potencial de principios activos para alimentos, productos farmacéuticos, industria o conservantes.
85.84% de actividad comparativa en las concentraciones de 12 mg y 6 mg respectivamente; lo cual demuestra tener BUENA ACTIVIDAD frente a Staphylococcus aureus. Mccutcheon 8 (2009) determinaron la actividad antibacteriana de Plantago major afirmando que el potencial antibacteriano del extracto etanólico de las hojas de Plantago major son más débiles en comparación con la Gentamicina usado como control positivo.
Respecto al ensayo de macrodilución en la Tabla N° 03 se demuestra que la concentración mínima inhibitoria se observó en el tubo de ensayo C6 con la concentración 1 mg/ml, frente a Staphylococcus aureus y de 4 mg/mL frente a Pseudomona aeruginosa, se determinó además que la Concentración bactericida mínima (CBM) del extracto etanólico obtenido de la hoja de Plantago major (Llantén) frente a Staphylococcus aureus y Pseudomonas aeruginosa fue de 4 mg/mL y 21 mg/mL respectivamente.
Plantago major se utiliza para diferentes propósitos en la medicina tradicional en todo el mundo; por lo tanto, los investigadores han probado para diferentes tipos de actividades biológicas. La mayoría de las pruebas se han realizado en extractos crudos sin examinar la naturaleza de los compuestos activos.25
Actualmente no se sabe exactamente qué fitoquímicos en P. major son más importantes en la mediación de los efectos beneficiosos, tanto polisacáridos y polifenoles han sido propuesto para ser bioactivo, las hojas de Plantago major contener una mezcla de diferentes polifenoles antioxidantes que pueden contribuir a su herida propiedades curativas.26
También parece haber compuestos de polaridad intermedia y no polares de relativamente bajo peso molecular en Plantago major que tienen actividad antibiótica contra algunas gram negativas y gram positivas bacterias, estos resultados coinciden con los reportados en nuestro estudio en relación a la bacteria gram positiva (Staphylococcus aureus) pero difieren con la bacteria gram negativa.27
bacterias gram negativas en comparación con la estructura de membrana única de las bacterias gram positivas o su relación con lipopolisacáridos en su membrana externa.28,29
4.3. CONCLUSION
Se obtuvo el extracto Etanólico de las hojas de Plantago major (llantén).
Se determinó la actividad antibacteriana del extracto etanólico obtenido de las hojas de Plantago major (llantén), por el método de difusión de disco en agar obteniendo diámetros de zona de inhibición de 20.3 mm. y 20 mm. frente a Staphylococcus aureus a una concentración de 12 mg y 6 mg respectivamente, mientras que el resultado no resultó activo frente a Pseudomona aeruginosa.
Se determinó la Concentración Mínima Inhibitoria (CMI) del extracto etanólico obtenido de la hoja de Plantago major (Llantén), por el método de macrodilución frente a Staphylococcus aureus y Pseudomonas aeruginosa obteniendo una concentración de 1 mg/mL y 4 mg/mL respectivamente.
Se determinó la Concentración bactericida Mínima (CBM) del extracto etanólico obtenido de la hoja de Plantago major (Llantén) frente a Staphylococcus aureus y Pseudomonas aeruginosa obteniendo una concentración de 4 mg/mL y 21 mg/mL respectivamente.
4.4. RECOMENDACIONES
Se recomienda identificar, separar y elucidar la molécula responsable de la actividada antimicrobiana reportada en el presente trabajo, con el fin de generar alternativas para la obtención de nuevos antimicrobianos de amplio espectro a aprtir de una fuente de origen natural.
Se recomienda realizar estudios in vivo con el fin de determinar la toxicidad de esta especie vegetal ycon el fin de determinar la estabilidad del extracto obtenido frente a agentes físicos y químicos que puedan interferir en la actividad antimicrobiana descrita en el presente trabajo.
4.5. BIBLIOGRAFIA
1. Pollak E.2001. “La medicina tradicional venezolana”. 1era. ed. Montalbán, ucab. pag.7
2. Bazalar D, Alcántara L, león E.1996. “Acción inhibitoria de extractos acuoso y metanólico exento de alcalides de erythroxy lumnovo granatense (Morris) var”. truxillenserusby, frente a uropatógenos Gram negativos. act. II encuentro iberoamericano sobre las ciencias farmacéuticas y alimentarias. la habana, cuba. 3. Berdonces J, Preciado I, Ródenas P, Sanés A, Uriarte X.1995. “Las plantas
medicinales hoy día”. natura medicatrix 34:37-38.
4. Mejía K, Rengifo E.1995. “Plantas medicinales de uso popular en la amazonia peruana”.
5. Pardo M, Gómez E.2003. “Etnobotánica; aprovechamiento tradicional de plantas y patrimonio cultural”. anales del jardín botánico de Madrid, 60. pág. 171.
6. Alvarado N, 2010. “Plantas medicinales: efecto antibacteriano in vitro de plantago major l, erythroxy lumnovo granatense, plowmanvartruxillensey camellia sinensis sobre bacterias de importancia estomatológica, odontol”. sanmarquina pag - 13(2): 21-25.
7. Claros M, Gonzáles E, 2006. “Determinación de la actividad anti-helicobacter pylori de plantago major (llantén), verbena officinalis (verbena), clinopodiumbolivianum (khoa), caléndula officinalis (caléndula), piperangustifolium (matico) y rubusboliviensis (kharikhari ) por el método de difusión de disco”. universidad mayor de san Andrés facultad de ciencias farmacéuticas y bioquímicas carrera de química farmacéutica. La Paz - Bolivia.
8. Mccutcheon A, Ellis S, Hancock R, Towers G. 2009. “Antibiotic screening of medicinal plants of the british colombian native peoples, journal of ethnopharmacology”. vol. 37, p. 213–223.
9. Ruiz C. 2013. “Determinación del efecto antifúngico de cuatro especies de plantas chilenas sobre la flora fúngica presente en una cámara de maduración de quesos, universidad austral de chile facultad de ciencias agrarias escuela de ingeniería en alimentos”. Valdivia – chile.