Formulación y caracterización de nano emulsiones de aceite de parafina tipo agua en aceite (W/O)
Texto completo
(2) AGRADECIMIENTOS. . Quiero expresar mi agradecimiento a la Dra. Josefina Barrera Cortés, investigadora del CINVESTAV unidad Zacatenco, por haberme abierto las puertas del laboratorio que dirige, por la oportunidad que me brindó de llevar a cabo este proyecto. Gracias por todo el apoyo. A la Dra. Margarita Sánchez Domínguez, investigadora del CIMAV unidad Monterrey, por sus valiosas asesorías, consejos y orientaciones así como la confianza que siempre depositó en mi. Gracias también por el tiempo dedicado a éste proyecto. Al Dr. Luis Fernando Rojas Ochoa, Coordinador Académico del departamento de Física del CINVESTAV, por su apoyo para que se efectuara la determinación de tamaños de gota en el equipo de DLS 3D. Al Dr. Jorge Tiburcio Báez así como al Dr. Omar Solorza Feria y al Dr. Ruy Cervantes Díaz del Departamento de Química del CINVESTAV por su apoyo para efectuar caracterizaciones en el zeta sizer. A la Universidad Tecnológica de Tula-Tepeji por brindarme la oportunidad de estudiar esta maestría. A mi esposo, por su invaluable apoyo en todo este proceso. A mis hijos, por su comprensión y ayuda. . . i .
(3) INDICE. AGRADECIMIENTOS ...................................................................................................................... i INDICE ............................................................................................................................................... ii Índice de Figuras .............................................................................................................. v Índice de Gráficas ........................................................................................................... vii Índice de Tablas.............................................................................................................. vii Resumen ........................................................................................................................................... 1 Abstract .............................................................................................................................................. 2 I. Introducción ................................................................................................................................... 4 II. Antecedentes ................................................................................................................................ 7 2.1 Emulsiones ................................................................................................................. 7 2.2 Surfactantes. ............................................................................................................... 9 2.2.1 Clasificación de los surfactantes. ............................................................................... 11 2.2.2 Formación de micelas .................................................................................................. 14 2.2.3 HLB de los surfactantes .............................................................................................. 15 2.3 Inestabilidad de las Emulsiones............................................................................... 16 2.4 Diseño de Emulsiones Convencionales.................................................................... 18 2.5 Formulación de nanoemulsiones .............................................................................. 18 2.5.1 Parámetros de formulación. ........................................................................................ 20 2.6 Formación de Nanoemulsiones. ............................................................................... 22 2.6.1 Métodos de Dispersión: Fuerza de cizalla (Alta Energía) ...................................... 22 2.6.2 Métodos Fisicoquímicos – inversión de fases (Baja Energía) ............................... 23 2.6 Estabilidad de Nano-emulsiones. ............................................................................. 24 2.7 Nano-emulsiones de parafina. .................................................................................. 25 2.8 Aplicación en formulaciones de bioinsecticidas. ....................................................... 26 2.9 Caracterización de las nanoemulsiónes. .................................................................. 27 2.9.1. Dispersión Dinámica de la Luz. ................................................................................. 27 2.9.2 Conductividad ............................................................................................................... 29 2.9.3 Determinación de estabilidad cinética ....................................................................... 30 Justificación .................................................................................................................... 31 Hipótesis ......................................................................................................................... 32 Objetivo General ............................................................................................................. 33 Objetivos Específicos ............................................................................................................ 33 . . ii .
(4) III. Materiales y métodos. .............................................................................................................. 34 3.1 Componentes de la nano-emulsión. ......................................................................... 34 3.2. Materiales y Equipos................................................................................................ 35 3.3 Formulación de la nano-emulsión. ............................................................................ 35 3.4 Procedimiento experimental ..................................................................................... 37 3.4.1 Etapa 1: Estudio exploratorio ..................................................................................... 37 3.4.2 Etapa 2: Optimización del sistema seleccionado ................................................... 38 3.4.3 Etapa 3 Estrategia por baja energía .......................................................................... 39 3.5 Metodología de Caracterización ............................................................................... 39 3.5.1 Tamaño de gota. .......................................................................................................... 39 3.5.2 Estabilidad ..................................................................................................................... 40 3.5.3 Signo de la nano-emulsión ......................................................................................... 40 IV. Resultados y discusión ............................................................................................................ 41 4.1. Etapa 1: Estudio exploratorio. ................................................................................ 41 4.1.1. . Estudio exploratorio en sistema abierto. ......................................................... 41 . a) Sistema con Span®80 (S80). ....................................................................................... 41 b) Sistema formado con Span®20 (S20) ........................................................................ 42 c) Sistema con Span®20/Tween®80 (S20/T80) ............................................................ 42 d) 4) Sistema con Span®80/Tween®80 (S80/T80) ....................................................... 42 Tamaño de gota. .................................................................................................................... 44 Estabilidad. .............................................................................................................................. 49 4.1.2. . Barrido en sistema cerrado. ............................................................................ 51 . a) Sistema formulado con Span®80 (S80). ........................................................................ 51 b) Sistema formulado con S20. ............................................................................................ 51 c) Sistema formulado con una mezcla de surfactantes S20/T80 en relación 62:38 (HLB: 11.09). ........................................................................................................................... 52 d) Sistema formulado con una mezcla de surfactantes S80/T80, relación 70:30, HLB 7.5. ............................................................................................................................................ 53 Tamaño de gota. ............................................................................................................. 54 4.2. Etapa 2: Optimización del sistema seleccionado. .................................................. 57 4.2.1. Efecto de la adición de sal. ..................................................................................... 57 Estabilidad. ................................................................................. ¡Error! Marcador no definido. Determinación del tipo de nano-emulsión....................................................................... 60 Conductividad. ........................................................................................................................ 61 4.2.2. Efecto de la variación de la temperatura .............................................................. 61 4.3. Etapa 3: Estrategia por baja energía. .................................................................... 64 . . iii .
(5) 4.3.1. Sin ultrasonido. ......................................................................................................... 64 4.3.2. Método PIC ............................................................................................................... 65 Comparación de las mejores formulaciones (S80/T80). ................................................. 69 V. Conclusiones. ............................................................................................................................ 71 5.1 Etapa 1. Estudio exploratorio. ................................................................................... 71 5.2 Etapa 2. Optimización del sistema seleccionado...................................................... 72 5.3 Etapa 3. Estrategia por baja energía. ....................................................................... 72 VI. Bibliografía ................................................................................................................................ 74 ANEXO 1 Interpretación de DLS. ................................................................................... 80 . . . iv .
(6) Índice de Figuras Figura II.1 Estructura de un surfactante ............................................................................. 10 Figura II.2 Efecto de los tensoactivos al colocar una gota acuosa sobre una superficie hidrófoba. ............................................................................................................................ 11 Figura II.3 Formación del sorbitan a partir del sorbitol ..................................................... 12 Figura II.4 Estructura química de los surfactantes Span®80, Span®20 y Tween®80 ...... 13 Figura II.5 Micelas. A la derecha con las colas hidrófobas agrupadas al centro. A la izquierda una micela inversa. (Valdés-Pinal, 2010) ........................................................... 14 Figura II.6. Diferentes tipos de micelas. (Salager, 1992) ................................................... 15 Figura II.7 Clasificación de los surfactantes de acuerdo a su valor de HLB (Oliva, 2013) . 16 Figura II.8 Radio hidrodinámico obtenido por DLS. (Fritsch) ............................................. 29 Figura III.1 Equipo DLS de Malvern Instruments ................................................................ 40 Figura IV.1 Sistema con S80/T80 a la izquierda se observa la mezcla de aceite con el surfactante. ......................................................................................................................... 43 Figura IV.2 A la izquierda la muestra del sistema S80/T80 solo con agitación magnética. A la derecha después de aplicar ultrasonido ......................................................................... 43 Figura IV.3 Sistema con mezcla de surfactantes S80/T80 preparado para comprobar reproducibilidad (Muestras a las que se aplicó ultrasonido. ............................................... 44 Figura IV.4 Estabilidad de nano-emulsión a los 8 meses. Muestra 1B, preparada con S80/T80 .............................................................................................................................. 49 Figura IV.5 Sistema formulado con S80/T80, con 7.4% fase acuosa, antes y después de someter a ultrasonido (Muestra I) ...................................................................................... 54 Figura IV.6 Sistema son S80/T80 con 10.71% de fase acuosa, antes y después de someter a ultrasonido. (Muestra II) .................................................................................... 54 Figura IV.7 Muestra II a los 6 meses de haber sido preparada......................................... 56 Fig. IV.22 Tamaño de gota de nano-emulsiones formuladas con mezclas de surfactantes no-iónicos. (Tomado de Porras, et. al. 2004) ..................................................................... 57 Figura IV.8. Sistema preparado con S80/T80 6.54% fase acuosa NaCl 0.1M antes y después de ultrasonido (Muestra III) ................................................................................. 59 Figura IV.9 Antes y después de aplicar ultrasonido con 8.25% y 10.71% de concentración de fase acuosa (Sistema formulado con S80/T80) A la izquierda Muestra IV ................... 59 Figura IV.10 S80/T80 con 6.54 % de fase acuosa (Muestra III) y con 8.25 % (Muestra IV) a los 6 meses de su preparación ........................................................................................ 61 Figura IV.11 S80/T80 con 10.71 % de fase acuosa a los 6 meses de su preparación. ..... 61 Figura IV.12. Sistema preparado por encima de la Temperatura HLB (muestra V) .......... 63 Figura IV.13 Sistema S80/T80, 8% fase acuosa, preparado a 50 ºC (Muestra V) a los 3 meses de haber sido preparada ......................................................................................... 65 . . v .
(7) Figura IV.14 S80/T80 con 6% de fase acuosa sin ultrasonido ........................................... 66 Figura IV.15. Primero se adicionó la fase acuosa al sistema y la fase oleosa fue añadida después. Véase aspecto antes (izq) y después de sonicar (der). (Muestra VII) ............... 67 Figura IV. 17La preparación mediante proceso PIC se ha sometido a ultrasonido. .......... 68 Figura IV. 16 A la izquierda la mezcla de fase acuosa y surfactantes. A la derecha ya se ha añadido aceite ............................................................................................................... 69 Figura A.1 Medición de las fluctuaciones de intensidad de dispersión con el tiempo (Nobbmann) ........................................................................................................................ 81 Figura A.2 Función de auto-correlación y correlograma (Nobbmann) ............................. 81 Figura A.3Interpretación del correlograma ......................................................................... 82 Figura A.4 Gráfica de distribución de tamaño de partículas. La de la izquierda indica mayor polidispersidad, la de la derecha menor polidispersidad así como menor tamaño de partícula (Malvern) .............................................................................................................. 83 Figura A.5 Ubicación del valor de b en la función de correlación.(Malvern Instruments)... 84 . . vi .
(8) Índice de Gráficas . Índice de Tablas Tabla IV.1. Tamaño de gota ______________________________________________ 46. Tabla IV.2. Sistema formulado con S80 _____________________________________ 51. Tabla IV.3. Sistema formulado con S20 _____________________________________ 52. Tabla IV.4. Sistema con mezcla de surfactantes S20/T80 ______________________ 52. Tabla IV.5 _____________________________________________________________ 53 Sistema formulado con una mezcla de surfactantes S80/T80 _____________________ 53 Tabla IV.6. Tamaño de gota Sistema S80/T80 _______________________________ 54. Tabla IV.7 _____________________________________________________________ 57 Sistema con S80/T80 con sal añadida _______________________________________ 57 Tabla IV.8. Tamaño de gota Sistema S80/T80 con sal añadida __________________ 59. Tabla IV.9. Tamaño de gota S80/T80 preparadas a 50 ºC, sonicadas. _____________ 63. Tabla IV.10. Tamaño de gota sin aplicar ultrasonido ___________________________ 65. Tabla IV.12. Tamaño de gota S80/T80 mediante PIC – ultrasonido. _______________ 66. Tabla IV.13 Tamaño de gota S80/T80 mediante PIC-ultrasonido con 6 % fase acuosa _ 68 . . . vii .
(9) Resumen . Las nano-emulsiones son referidas en la literatura también como miniemulsiones, emulsiones ultrafinas y emulsiones submicrométricas. Son un tipo de emulsiones que presentan un tamaño de gota que va en un rango de 20 a 500 nm. Son sistemas cinéticamente estables y ópticamente transparentes o translúcidas y azulosas. Debido a que son termodinámicamente inestables, no se forman de manera espontánea y sus características dependerán del método de preparación utilizado. Requieren para su formación suministro de energía ya sea por medios mecánicos como homogenizadores de alta presión, agitación a altas velocidades o aplicación de ultrasonido; o bien, provista por el potencial químico de los componentes y/o los cambios de fase experimentados durante la preparación de las mismas. Encuentran aplicación en una amplia variedad de industrias donde se requiera dispersar materiales acuosos en fases oleosas (o viceversa) y/o entrega eficiente de sustancias activas, encapsulamiento de materiales sensibles a la oxidación. Las nano-emulsiones pueden ser de dos tipos de acuerdo a la naturaleza de las fases continua y dispersa: aceite-en-agua (O/W) o agua-en-aceite (W/O). En la literatura se encuentra reportado acerca de la formación de nano-emulsiones tipo aceite-en-agua, pero del tipo agua-en-aceite se encuentra muy escasa información. En este proyecto se establece una formulación que permite obtener una nano-emulsión tipo agua-en-aceite (W/O) obteniendo tamaños de gota por debajo de los 100 nm, utilizando un sistema ternario o pseudoternario aceite de parafina / surfactantes no iónicos / agua. Los surfactantes considerados son el Span® 80, Span® 20 y Tween® 80, que se utilizaron en forma aislada o en mezcla. Se considera la utilización de métodos de alta energía mediante aplicación de ultrasonido así como una adaptación de métodos fisicoquímicos que involucran inversión de fases, denominados de baja energía como es el método PIT (Phase Inversion Temperature) y el método PIC (Phase Inversion Composition). Se logró establecer las condiciones de composición y metodología . 1 .
(10) para obtener nano-emulsiones W/O basadas en parafina con tamaños de gota entre 20 a 30 nm y buena estabilidad cinética, mediante una estrategia que combina baja energía con una pequeña aportación de alta energía por ultrasonidos.. Abstract . Nano-emulsions are also referred in the literature as mini- emulsions, emulsions and ultrafine submicron emulsions. This type of emulsions has a droplet size in a range, from 20 to 500 nm. They are kinetically stable and optically transparent or translucent bluish systems. Because they are thermodynamically unstable, they do not form spontaneously and their characteristics depends on the preparation method used. The nano-emulsions required for forming power supply either by mechanical means such as high pressure homogenizers, high speed stirring or ultrasonic application, or provided by the chemical potential of the components and/or the phase changes which occur to the system during their preparation. Nano-emulsions are used in a variety of industries which required the dispersion of aqueous materials in oil phases (or viceversa) and / or efficient delivery of active substances,. encapsulating. materials. sensitive. to. oxidation:. cosmetic,. pharmaceutical, agrochemical and food products. Nano-emulsions exist in two forms, according to the nature of the dispersed and continuous phase: oil-in-water ( O/W ) or water-in-oil ( W/O). In literature there are numerous reports on the formation oil-in-water nano-emulsions, but the information on water-in-oil nano-emulsion is scarce. In this project, an strategy that allows the formation of water-in-oil (W/O) nano-emulsion with droplet size below 100 nm, using a non-ionic / water ternary or pseudoternary paraffin oil / surfactant has been established. The Surfactants used were nonionics Span ® 80, Span ® 20 and Tween ® 80, used both individually and in mixtures. Methods using high energy were considered by the use of ultrasound; in addition, an adaptation of low energy and physicochemical methods involving phase inversion such as the PIT method . 2 .
(11) (Phase. Inversion. Temperature). and. the. PIC. method. (Phase. Inversion. Composition) were also employed. It was possible to establish the conditions of composition and methodology for the formation of W/O nano-emulsions based on paraffin with droplet size of 20-30 nm and very good kinetic stability, by a strategy that combines low energy with a small contribution of high energy by ultrasound.. . . 3 .
(12) I. Introducción . Aunque ya Demócrito, filósofo griego que vivió entre los siglos V-IV antes de Cristo, afirmaba que la materia esta formada de partículas indivisibles llamadas átomos, se siguió con la idea de Sócrates de la materia como un todo continuo. No fue hasta el siglo XX en que quedó demostrado que Demócrito tenía razón, la materia está formada por átomos. Con el descubrimiento de la teoría atómica y la tecnología para manipular la materia a nivel atómico, surge la nanotecnología ofreciendo diseñar materiales con nuevas propiedades que den solución a las necesidades. de diversas industrias mediante el reordenamiento de átomos y. moléculas. En la historia del hombre puede observarse que éste se ha visto obligado a manipular los materiales para su supervivencia o para mejorar sus condiciones de vida. Manipular los materiales fue uno de los primeros retos del Hombre y aun en esta época sigue siendo una de sus preocupaciones. La nanotecnología, que se dedica al control de la materia a nivel de átomos y moléculas, se compone de nanociencia y nanotecnología. La nanociencia estudia los procesos que ocurren en la materia en tamaños que van de 1 a 100 nanómetros y la nanotecnología se encarga del estudio y del diseño de materiales nanoscópicos para alguna aplicación práctica.. La unidad de medida en. nanotecnología es el nanómetro. Un nanómetro es una mil millonésima parte de un metro, es decir, un nanómetro es igual a 10-9 metros. Para darse una idea de la escala de tamaño que se maneja considere que en un milímetro hay 1,000,000 de nanómetros. El interés de estos materiales con estructuras nanométricas reside en que las propiedades físicas, químicas y biológicas que estos presentan son muy diferentes de las propiedades que estos mismos materiales presentan en tamaños mayores ya que los materiales a escala de 1 a 100 nm se encuentra en el mundo cuántico regido por las leyes de la mecánica cuántica y se comportaran de manera muy diferente a como lo hacen cuando se encuentran en dimensiones mayores (Wing, 2006).. . 4 .
(13) Las emulsiones tienen interés en diversas industrias: farmacéutica, cosmética, alimenticia, agroquímica. Dado que son dispersiones de dos materiales inmiscibles entre ellos, permiten incluir sustancias acuosas en materiales oleosos y viceversa. Estas sustancias pueden ser pigmentos, saborizantes, vitaminas, nutrimentos, sustancias activas, medicamentos, entre otros. Cuando las gotas que están dispersas son del orden de las micras el aspecto de la emulsión es lechoso, pero al disminuir el tamaño de las gotas al orden de los nanómetros el aspecto de la emulsión deja de ser lechoso y se vuelve translúcido o transparente, aspecto que resulta de gran interés mercadotécnico para diversas industrias. El pequeño tamaño de las gotas le proporciona a las nano-emulsiones transparencia óptica, estabilidad frente a la sedimentación y alta estabilidad cinética, lo que resulta interesante para aplicaciones que precisen cierta estética y una larga vida de anaquel (Hernández, 2004). Además del aspecto, otra particularidad en una nano-emulsión es su poder de penetración (Svarc, 2013; Fernández, 2012). Dicha característica encuentra aplicación en la industria cosmética ya que permitirá entrega de sustancias activas atravesando distintos niveles de capas de piel (estrato córneo); así mismo, sus características encuentran aplicaciones en la industria farmacéutica en la entrega de medicamentos en productos de aplicación tópica, parenteral y administración intra-nasal, ésta última con la finalidad de liberar el fármaco directamente en el cerebro (Kumar y colaboradores, 2008) y atravesar la barrera hemato-encefálica lo cual requiere de tamaños de gota especialmente pequeños. Las nano-emulsiones presentan ventajas sobre otras formas de dosificación entre las que se puede mencionar aumento en la absorción en el tracto gastrointestinal, mayor solubilización de fármacos tanto lipofílicos como hidrofílicos, enmascaramiento de sabores desagradables, protección frente a la oxidación del fármaco (OMS, 2011; Almengor, 2009; Fernández, 2012). Así mismo, se han reportado efectos biocidas de las nano-emulsiones (Ramalingam y colaboradores, 2012) frente a esporas de Bacillus anthracis, Bacillus cereus, Bacillus subtilis, H. Influenzae y Vibro cholerae,. . 5 .
(14) en formulaciones no nocivas para la piel basadas en algunos tipos de aceites. (Puerta y colaboradores., 2008; Hamouda y colaboradores. 2001; Hamouda y colaboradores. 2000; Ferreira y colaboradores. 2010). También, las nanoemulsiones son utilizadas como medio de reacción en la obtención de nanopartículas poliméricas (Sadtler y colaboradores, 2012). Y en la industria agroquímica han tenido aplicación en el tratamiento de enfermedades de plantas, como nano-emulsiones que contienen nano-partículas de pesticidas o herbicidas (Lugo-Medina, 2010).. . . 6 .
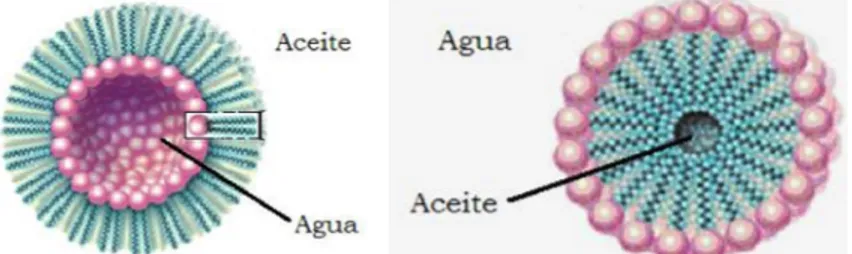
(15) II. Antecedentes . 2.1 Emulsiones . Una emulsión es un sistema coloidal de un líquido disperso en otro líquido. (Maron & Prutton, 1982). Tal dispersión se mantiene por un tiempo en forma de gotas, con ayuda de un agente emulsionante. El agente emulsionante es afín a ambas fases y se localiza en la interfase de las gotas formadas evitando su coalescencia (Fitzpatrick, 2010). Es decir, es una unión forzada de por lo menos dos sustancias líquidas que son inmiscibles entre sí de manera natural, formando dos fases: una fase se denomina fase dispersa (las gotas) y la otra es llamada fase dispersante (fase continua). Según la naturaleza de la fase dispersa y la fase dispersante, existen dos tipos de emulsiones: emulsiones agua-en-aceite y emulsiones aceite-en-agua. En las emulsiones agua-en-aceite (denominada W/O por sus iniciales en inglés) la fase dispersa es agua y la fase dispersante es aceite, el contenido de agua es típicamente menor al 25%. En las emulsiones aceite-en-egua (denominada O/W) el contenido del componente acuoso es generalmente mayor a 31% pudiendo tener hasta un 80% de agua; en este tipo de emulsión la fase dispersa es un aceite y la fase dispersante es agua (Cubero, 2002). En general, se cumple la ley de Brancroft que dice que la fase dispersante es aquella en la que es soluble el emulsificante. (Aranberri y otros, 2006) Existen también las emulsiones múltiples, son aquellas en las que la fase interna es también una emulsión; la simbología para señalarlas es W/O/W si se trata de una emulsión múltiple de agua-en-aceite-en-agua y O/W/O si se trata de una emulsión múltiple de aceite-en-agua-en-aceite. (Salager, 1999) Las emulsiones son termodinámicamente inestables debido al exceso de energía libre en la superficie de las gotas, lo que hace que estas tengan la. . 7 .
(16) tendencia a unirse para reducir su superficie; a este efecto se le llama coalescencia, y al ocurrir esto las fases se van separando macroscópicamente destruyendo la emulsión por lo que para minimizarlo se agrega el agente emulsionante, el cual suele ser un surfactante (Gennaro, 2003). Los surfactantes son moléculas con una parte polar y otra apolar. La parte apolar les permite tener afinidad con la fase oleosa, la sección polar interactúa con la fase acuosa. (Buceta, 2012). El surfactante se coloca en la interfase de una manera orientada: la parte polar hacia el agua, la parte apolar hacia el aceite. En una emulsión existen fuerzas de atracción y fuerzas de repulsión. Las fuerzas de atracción dependen del volumen de las gotas, las fuerzas de repulsión dependen del surfactante adsorbido por lo que finalmente dependerán del área superficial de las gotas. Al disminuir el tamaño de las gotas se estará favoreciendo a las fuerzas repulsivas y disminuyendo las fuerzas atractivas, lo que asegura la estabilidad de la dispersión. (Salager, 1999) El tamaño de gota en una emulsión se encuentra entre 0.5 a 10 micras, lo que les da la particularidad de un aspecto lechoso. Debido a su inestabilidad termodinámica, se requiere el aporte de energía para su formación (Lissant, 1984). Pueden ser clasificadas de acuerdo al tamaño de gota, se consideran macroemulsiones aquellas que presentan un tamaño mayor de 500 nm (0.5 micra) y se denominan nanoemulsiones a aquellas inferiores a 500 nm. Es importante aclarar que las microemulsiones nos son una categoría que se encuentre entre las macroemulsiones y las nano-emulsiones. La principal diferencia es que las microemulasiones, a diferencia de las macroemulsiones y de las nanoemulsiones, se forman espontáneamente una vez que se tienen las condiciones adecuadas de composición y temperatura, ya que son termodinámicamente estables. Su nombre fue aceptado unánimemente desde su introducción por Schulman en 1959 y se ha mantenido como tal por razones históricas, aunque también se les conoce como micelas hinchadas. (Solans y colaboradores, 2004). “Las microemulsiones son sistemas monofásicos dentro de los cuales un surfactante particularmente eficaz. . 8 .
(17) hace posible la coexistencia, a escala casi molecular, de agua y aceite. Las microemulsiones presentan nanodominios, no necesariamente esféricos, de pequeñas dimensiones, típicamente del orden de 2 a 50 nm, fluctuando rápidamente dentro del tiempo y el espacio” (Salager y colaboradores, 2001, p.p 2). Además de las microemulsiones O/W y W/O, en las cuales existe una fase discreta (la fase dispersa en forma de gotas), existen también microemulsiones bicontinuas en las cuales, como su nombre lo indica, ambas fases (tanto la acuosa como la oleosa), son continuas, presentando estructuras tipo esponja con canales interconectados. Otra clasificación de las nano-emulsiones es de acuerdo a la concentración de la fase dispersa, siendo emulsiones diluidas aquellas con una fracción en volumen de fase dispersa (ϕ) menor a 0.2. Son concentradas aquellas con un valor de ϕ entre 0.2 y 0.74; y son altamente concentradas las que presentan un valor de ϕ mayor a 0.74. (Aranberri y colaboradores, 2006; Lissant 1984). Esta división es más o menos arbitraria, basándose en la concentración en que aparecen cambios de importancia en la reología: las concentradas son viscosas con comportamiento plástico o pseudoplástico; las altamente concentradas presentan un aspecto sólido o semisólido, en las cuales debido a la alta concentración de gotas, se encuentran deformadas presentando una forma polihédrica en lugar de esférica. (Boatella, 2004).. 2.2 Surfactantes. . La palabra surfactante se origina del acrónimo surfactant, de la lengua inglesa, formado por surface active agent; también se les conoce como tensoactivos y como emulsificantes. (Rosen, 2012). Un surfactante es una sustancia anfífila, es decir, posee una doble afinidad ya que tiene una parte polar y una parte no-polar. La parte polar contiene átomos como O, S, P, y N que se encuentran en grupos alcohol, ácido, fosfato, sulfato, amina, amida, cetona, éter, etc. El grupo apolar esta conformado por lo regular por cadenas hidrocarbonadas, . 9 .
(18) aunque también puede estar conformado por cadenas siliconadas o de perfluorocarburo. La parte polar presenta afinidad por sustancias polares como el agua por lo que se le denomina parte hidrofílica. La parte apolar presenta afinidad a sustancias no-polares como los lípidos, por lo que también se le conoce como parte lipofílica. (Salager, 2002) Se considera que la molécula del surfactante posee una ‘cabeza’, que es la parte hidrofílica, y una ‘cola’ que es la parte lipofílica. (Ver Fig. II.1). Figura II.1 Estructura de un surfactante. Los surfactantes, al ser sustancias anfífilas, tienden a migrar a la interfase debido a que por su doble polaridad una parte de su molécula siempre presentará fobicidad si se encuentra en el seno de una fase. Si sólo hay presente una fase migraran a la superficie, si hay dos fases migraran a la interfase orientando la parte polar hacia la fase acuosa y la parte apolar hacia la fase oleosa. Precisamente por esta actividad es que se les denomina surfactantes; cabe mencionar que no todos los anfífilos presentan tal actividad, ya que para que esto suceda se requiere que la molécula no sea ni demasiado hidrófila ni demasiado hidrófoba. Un tensoactivo tiene actividad sobre la tensión superficial o interfacial, sobre la energía libre de Gibbs, disminuyendo la tensión. (Salager, 2002). La energía libre interfacial es la cantidad mínima de trabajo requerido para crear esa interfase; esta energía libre interfacial por área es la tensión interfacial y es la cantidad mínima de trabajo para crear una unidad de área de interfase o para expandirla una unidad de área. También indica una medida de la naturaleza de dos fases en contacto en la interfase ya que al ser menos similares estas dos sustancias, se incrementa la tensión interfacial . El surfactante hace cambios . 10 .
(19) significativos en la cantidad de trabajo requerido para expandir la interfase, aunque generalmente se le utiliza para reducir la energía libre interfacial. (Rosen, 2012) En la Figura II.2 se ejemplifica el efecto sobre la tensión superficial de los tensoactivos.. Figura II.2 Efecto de los tensoactivos al colocar una gota acuosa sobre una superficie hidrófoba.. 2.2.1 Clasificación de los surfactantes. . Los surfactantes se clasifican de acuerdo a su disociación al ser disueltos en agua, de ésta manera se evitan confusiones en una clasificación según su función. Los surfactantes aniónicos se disocian en un anión anfífilo y en un catión que generalmente es un metal alcalino o un amonio cuaternario. Los surfactantes catiónicos se disocian en un catión orgánico anfífilo, generalmente una sal de amonio cuaternario, y un anión que generalmente es del tipo halogenuro. Los surfactantes anfóteros son aquellos que combinan en su molécula los dos caracteres: aniónico y catiónico. Los surfactantes catiónicos y los anfóteros son caros por lo que se utilizan para aplicaciones muy particulares. Los surfactantes no-iónicos no se ionizan en solución acuosa ya que poseen grupos hidrófilos del tipo alcohol, fenol, éter o amida. (Salager, 2002). Dado que en éste proyecto se ha experimentado con surfactantes tipo no-iónicos, se les describirá en mayor detalle a continuación. Surfactantes no-iónicos. Son aquellos tensoactivos que no se ionizan en solución acuosa lo que los hace compatibles con otros surfactantes para formar mezclas complejas, así mismo son menos sensibles a la presencia de electrolitos por lo que pueden . 11 .
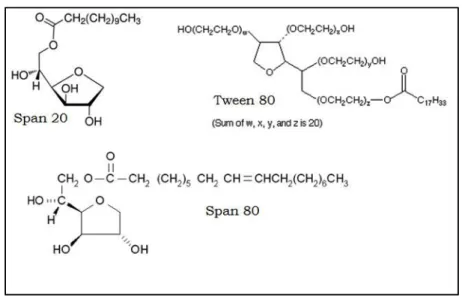
(20) utilizarse en presencia de salinidad alta. Existen diferentes tipos de surfactantes no-iónicos. predominando aquellos que contienen una cadena poli(óxido de. etileno) enlazada con un grupo hidroxilo o una amina (Fernández, 2004). Los surfactantes comerciales indican la distribución de número de grupos de óxido de etileno, en forma abreviada EON (número de óxido de etileno). Se requieren por lo menos 5 a 7 grupos óxido de etileno para obtener buena solubilidad en agua. La parte hidrofílica es la cadena poli-óxido de etileno y es mucho más voluminosa que la parte lipofílica, esto es debido a que los oxígenos del grupo etoxilo poseen dos pares de electrones libres, los cuales forman puentes de hidrógeno con las moléculas de agua, formando una grande y voluminosa vaina de hidratación. Los EO(óxido de etileno) poseen dos grupos metileno por cada oxígeno, el metileno es de carácter lipofílico y el oxígeno de carácter hidrofílico. Una propiedad de los surfactantes no-iónicos es que se vuelven menos hidrofílicos conforme la temperatura aumenta. Esto es debido a que los puentes de hidrógeno antes mencionados, se van rompiendo a medida que la temperatura incrementa (Fernández, 2004). El Span® es una serie de surfactantes derivados del sorbitan. El sorbitan se obtiene a partir del sorbitol (ver Fig. II.3).. . Figura II.3 Formación del sorbitan a partir del sorbitol. . 12 .
(21) Los hidroxilos del sorbitán pueden esterificarse con ácidos grasos, dependiendo del grado de esterificación y del tipo de ácido graso se formarán surfactantes con más o menos lipofilico. El Span®80 es monooleato de sorbitán, formado por la esterificación del sorbitán con ácido oleico, por tanto la cadena lipofilica está conformada por 18 carbonos. El Span®20 es monolaurato de sorbitán, formado mediante la esterificación del ácido láurico; su cadena lipofílica es de 12 átomos de carbono ( Fernández, 2004). Los surfactantes Tween® consisten en sorbitán polietoxilado (de 4 a 20 EO) y esterificado con uno a tres ácidos grasos: en pocas palabras, son Span® etoxilados. El Tween®80 es monooleato de sorbitán polietoxilado con 20 unidades de EO. (ver Fig. II.4) Estos surfactantes derivados del sorbitol presentan muy baja toxicidad por lo que se utilizan en alimentos y en la industria farmacéutica. (Salager, 2002). Figura II.4 Estructura química de los surfactantes Span®80, Span®20 y Tween®80. . 13 .
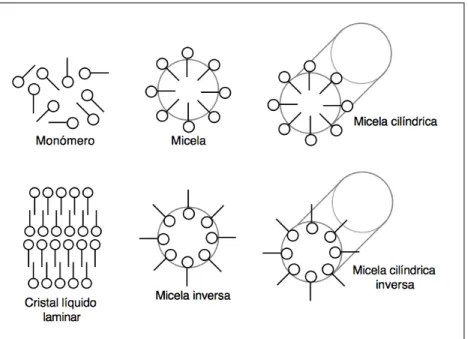
(22) 2.2.2 Formación de micelas Las aplicaciones de los surfactantes están directamente relacionadas con sus propiedades de adsorción y de asociación. Los surfactantes, debido a su anfifilidad, se transfieren a la interfase y se adsorben en ella. La adsorción en la interfase causa una disminución en la tensión interfacial. El surfactante se coloca de manera orientada en una capa, generalmente una monocapa, en la interfase. La fuerza que mueve a las moléculas de surfactantes a adsorberse puede ser por atracción polar por presencia de cargas, efecto hidrofóbico, formación de estructuras de baja energía (Salager, 1992). Debido al fenómeno de asociación, el surfactante forma micelas debido principalmente a la hidrofobicidad ya que ésta ocasiona la sustracción de las colas hidrófobas de la molécula al estar en contacto con el agua (Ver Fig. II.5); estas micelas presentan un diámetro típico de 20 a 100 Å, dependiendo de la longitud de la molécula de surfactante. La presencia de un alcohol de cadena media (co-surfactante) o de electrolitos reduce las fuerzas repulsivas y favorece la micelización. (Salager, 1992). Figura II.5 Micelas. A la derecha con las colas hidrófobas agrupadas al centro. A la izquierda una micela inversa. (ValdésPinal, 2010). Los surfactantes forman diversos tipos de micelas: micelas directas, micelas inversas, micelas cilíndricas y cristal líquido laminar (ver Fig.II.6).. La micela. inversa tiene al centro de la misma las cabezas polares, se presenta en. . . 14 .
(23) emulsiones tipo W/O (Ver Fig. II.5). El cristal líquido laminar posee propiedades birrefringentes. (Salager, 1992) . Figura II.6. Diferentes tipos de micelas. (Salager, 1992). 2.2.3 HLB de los surfactantes Con el fin de medir la lipofilicidad e hidrofilicidad de los surfactantes, Griffin (Becher and Griffin, 1970) ideó un sistema denominado balance hidrofílicolipofílico conocido como HLB, mediante un sistema numérico de índices de manera que en cuanto más grande sea ese valor, mayor es su carácter hidrofílico. Así, los surfactantes Span® tienen valores de HLB bajos (de 1.8 a 8.6). Los surfactantes Tween® presentan valores de HLB altos (9.6 a 16.7) (Hait, 2001). En la Fig. II.7 se encuentra la clasificación y aplicación de los surfactantes de acuerdo con su HLB.. . 15 .
(24) . Figura II.7 Clasificación de los surfactantes de acuerdo a su valor de HLB (Oliva, 2013). 2.3 Inestabilidad de las Emulsiones. . El proceso de ruptura de una emulsión involucra cuatro diferentes mecanismos: 1. Cremado/sedimentación: Es un proceso causado por la acción de la gravedad en el que las gotas se concentran sin variar la distribución del tamaño de las mismas. En el cremado (o flotación) las gotas se concentran en la superficie. Ocurre cuando la fase dispersa se concentra en la parte superior, causada por el movimiento de las gotas que poseen una densidad inferior a la de la fase continua. Es un proceso reversible. En las emulsiones O/W ocurre mayormente el cremado por la menor densidad del aceite. La sedimentación es un proceso similar en que las gotas se concentran en la parte inferior (Aranberri, 2006). La velocidad de cremado para una gota está dada por la siguiente ecuación (Dikinson, 1992):. 𝒗 = 𝟐𝒂𝟐. . 𝝆∘ − 𝝆 𝒈 𝟗𝜼 16 .
(25) donde: 𝑎 = El radio de la gota 𝜌 = Densidad de la fase dispersa. 𝜌∘ = Densidad de la fase continua 𝑔 = Aceleración debido a la gravedad 𝜂 = Viscosidad absoluta de la fase continua. 2. Floculación: las gotas se adhieren sin fusionarse, ocurre debido a que la. energía cinética que se libera por las colisiones lleva a las gotas hacia donde las fuerzas atractivas operan ocasionando que las gotas se peguen unas a otras. El proceso está controlado por un equilibrio entre las fuerzas de atracción de Van der Waals y las fuerzas repulsivas tipo estéricas (Aranberri, 2006). Por lo tanto, las fuerzas que mantienen unidas a las gotas en este mecanismo son débiles y es un proceso reversible. 3. Coalescencia: Consiste en la fusión de las gotas formando otras más grandes. A mayor tamaño de gota, mayor es la tendencia a la coalescencia (Lissant, 1984). Se cree que esta inestabilidad está relacionada con la preferencia de la curvatura y la rigidez de la capa de surfactante (Aranberri, 2006). Es un proceso irreversible. 4. Maduración de Ostwald (Engrosamiento de gotas): Se debe a la difusión molecular del componente de la fase dispersa a través de la fase dispersante, se da de las gotas pequeñas hacia las gotas grandes, hasta que las pequeñas desaparecen. La velocidad de este proceso está en función de la solubilidad de la fase dispersa en la fase continua, aumentando con la temperatura. Se debe a que la presión osmótica dentro de las gotas pequeñas es mayor que en las gotas grandes (Aranberri, 2006) Las inestabilidades de las emulsiones pueden ocurrir como combinación de los cuatro mecanismos. El surfactante minimizará o evitará. la separación de la. emulsión en fases, o al menos la retardará aumentando su estabilidad cinética.. . 17 .
(26) 2.4 Diseño de Emulsiones Convencionales . Los factores que pueden ser manipulados para que las gotas de las emulsiones tengan ciertas propiedades son las siguientes: a) Características. de la gota: Mediante la selección adecuada de los. componentes y de las condiciones de preparación, puede ser controlada la composición, la concentración y la distribución de tamaño de gota. b) Características interfaciales: Con la selección apropiada tanto del surfactante como de otros componentes activos de superficie, se pueden controlar las características de espesor, carga eléctrica, la reología, permeabilidad y liberación controlada de activos en la capa interfacial del surfactante. c) Características generales: La densidad, viscosidad, índice de refracción, y la tensión interfacial entre la fase acuosa y oleosa pueden ser controlados por la selección y combinación de aceites y surfactantes apropiados y / o mediante el uso de aditivos en alguna de las fases, tales como agentes espesantes, agentes gelificantes, agentes de carga, sales, y co-solventes.. 2.5 Formulación de nanoemulsiones . Una nano-emulsión es aquella cuyo tamaño de gota se encuentra comprendido entre 20 – 500 nm. Son transparentes o translúcidas, poseen elevada. estabilidad. cinética,. no. requieren. elevadas. concentraciones. de. surfactantes. Son termodinámicamente inestables, sus propiedades dependen del método de preparación. Otros términos utilizados para referirse a ellas es miniemulsiones, emulsiones ultrafinas o emulsiones submicrométricas. (Solans y otros, 2004). La formulación de la nano-emulsion determina el comportamiento de fase del sistema, es primordial porque las propiedades dependen de ella. El tipo de emulsión, el tamaño de gota y su estabilidad cinética dependerán finalmente de la formulación (Salager, 1998). Al formular una emulsión es importante considerar que el surfactante que se ha de seleccionar favorezca el tipo de emulsión que se. . 18 .
(27) pretende preparar (O/W ó W/O); tener en cuenta la concentración de la fase dispersa en el volumen total de la emulsión ya que la fase mayoritaria tiende a ser la fase continua; además, establecer la temperatura en la que se trabajará la emulsión considerando que a mayor temperatura se disminuye la tensión superficial pero considerando la sensibilidad al calor de los componentes (Boatella, 2004). La formulación implica la selección de valores de dos tipos de variables: las variables de composición y las variables de formulación fisicoquímica. Las variables de composición son las proporciones relativas de los constituyentes del sistema: aceite, surfactante, agua. Las variables de formulación fisicoquímica incluyen: temperatura, presión, naturaleza de los constituyentes. Se requiere más de una variable para definir cada uno de los constituyentes de la terna; por ejemplo, el surfactante está definido por la naturaleza de su zona hidrofílica y el largo de la cadena lipofílica; en lo que respecta al agua, depende de los tipos y concentración de electrolitos que tenga disueltos. En cuanto al aceite, se ve influenciado por el largo de la cadena hidrocarbonada, presencia de grupos funcionales, isomería de posición. (Salager y otros, 2001) Al hablar de formulación fisicoquímica se hace referencia a la naturaleza de los componentes. En un sistema de emulsiones existen tres componentes: surfactante, agua y aceite, teniendo cada uno de estos componentes un potencial químico que define su estado fisicoquímico. Las variables de formulación son aquellas que caracterizan a los componentes del sistema y su interacción en la interfase, estas son: longitud de la cadena alquílica del surfactante, el grupo hidrofílico del surfactante, la salinidad de la fase acuosa, tipo de aceite, presencia de alcoholes, la temperatura y la presión. Debido a la existencia de tantas variables se suele seleccionar la variable que se considere más importante y manteniendo constante a las demás (Salager, 1999).. . 19 .
(28) 2.5.1 Parámetros de formulación. HLB. . La naturaleza anfótera de los surfactantes se ha medido con una escala empírica denominada HLB. Este término fue introducido por William Griffin en 1949. Se forma con las iniciales de las palabras Hydrophile-Lypophile Balance refiriéndose a la medida de la afinidad relativa del surfactante para las fases de agua y de aceite. Estima en una escala del 1 al 20 la atracción simultánea que presenta el surfactante por las fases oleosa y acuosa; un valor de HLB = 10 indica que existe la misma atracción por ambas fases. (Salager, 1999). Este concepto sigue siendo el más difundido para definir un surfactante. El balance hidrofilicolipofílico del sistema puede ser alterado por las variables de formulación; por ejemplo, para los surfactantes no iónicos del tipo etoxilado, la variación de temperatura puede cambiar el HLB de un surfactante de un valor correspondiente a una emulsión tipo O/W a un valor correspondiente a W/O, es decir, el HLB tiende a disminuir cuando la temperatura aumenta. Lo mismo puede ocurrir para los surfactantes iónicos al modificar la concentración de electrolitos en el sistema. Los cálculos presentados por Griffin para surfactantes no iónicos se encuentran en la siguiente ecuación: 𝐻𝐿𝐵 = 20. 𝑀𝑎𝑠𝑎 𝑚𝑜𝑙𝑒𝑐𝑢𝑙𝑎𝑟 𝑑𝑒 𝑙𝑎 𝑝𝑜𝑟𝑐𝑖ó𝑛 ℎ𝑖𝑑𝑟𝑜𝑓í𝑙𝑖𝑐𝑎 𝑑𝑒 𝑙𝑎 𝑚𝑜𝑙é𝑐𝑢𝑙𝑎 𝑃𝑒𝑠𝑜 𝑚𝑜𝑙𝑒𝑐𝑢𝑙𝑎𝑟 𝑡𝑜𝑡𝑎𝑙 . Para ésteres en general sería: 𝐻𝐿𝐵 = 20. 1−. 𝑁ú𝑚𝑒𝑟𝑜 𝑑𝑒 𝑠𝑎𝑝𝑜𝑛𝑖𝑓𝑖𝑐𝑎𝑐𝑖ó𝑛 𝑑𝑒𝑙 é𝑠𝑡𝑒𝑟 𝑁ú𝑚𝑒𝑟𝑜 𝑑𝑒 𝑎𝑐𝑖𝑑𝑒𝑧 𝑑𝑒𝑙 á𝑐𝑖𝑑𝑜𝑑𝑒𝑙 𝑐𝑢𝑎𝑙 𝑑𝑒𝑟𝑖𝑣𝑎 𝑒𝑙 é𝑠𝑡𝑒𝑟 . El HLB requerido ( HLBreq) del aceite se refiere al valor HLB del surfactante para que un sistema O/W sea estable. El valor HLBreq de todos los aceites para formar una emulsión W/O se encuentra entre 4 y 6. (Salager, 1998). . 20 .
(29) La temperatura HLB ( THLB) es aquella en la cual el surfactante tiene la misma afinidad hacia la fase oleosa que hacia la fase acuosa y su curvatura natural es cero. Cuando la temperatura es inferior a la THLB el surfactante es hidrófilo, forma micelas normales con curvatura positiva. Cuando la temperatura es superior a la THLB el surfactante es lipófilo, forma micelas inversas con curvatura negativa. (Miñana, 1982). Formulación generalizada. . Este método es llamado SAD (Diferencia de Afinidad del Surfactante) y representa la energía libre de transferencia de una molécula de surfactante desde la fase acuosa hasta la fase oleosa. El SAD expresa las contribuciones de las variables de formulación: parámetro característico del surfactante, el número de carbonos del alcano en caso de que el aceite sea un alcano, la salinidad en caso de que el agua contenga cloruro de sodio, temperatura y presión. Una forma adimensional de expresar el SAD es mediante el HLD (Hydrophilic-Lipophilic Deviation) que indica de forma cuantitativa la desviación de la formulación con respecto a la denominada formulación óptima. (Forgiarini. et. al. 2006). La. formulación óptima es aquella en que el surfactante tiene igual afinidad hacia la fase acuosa que a la fase oleosa, la tensión interfacial es mínima, corresponde a un sistema Winsor III. Esta expresión se basa en la diferencia del potencial químico del surfactante en las dos fases. La siguiente ecuación muestra el cálculo del HLD. (Brayner et. al., 2013). HLD = α – EON + bS – kACN + tΔT + aA Donde: α. k, t son parámetros característicos del surfactante usado. EON es el número de grupos óxido de etileno del surfactante no iónico. S es el porcentaje en peso de electrolitos en la fase acuosa (salinidad del agua) ACN es el número de carbonos del alcano de la fase oleosa. ΔT es la diferencia de temperatura con respecto a 25°C. A es el porcentaje en peso del alcohol añadido. a es una constante característica del alcohol y tipo de surfactante . . 21 .
(30) b es una constante característica de sal añadida . HLD = 0 corresponde a una formulación óptima donde el surfactante tiene igual afinidad tanto hacia el agua como hacia el aceite y se forma una microemulsión. HLD > 0 representa un comportamiento de alta lipofilicidad formándose preferentemente una macroemulsión agua-en-aceite. comportamiento. de. alta. hidrofilicidad. formándose. HLD < 0 indica un preferentemente. un. macroemulsión aceite-en-agua. (Rosen y Kunjappu, 2012). 2.6 Formación de Nanoemulsiones. . Las nanoemulsiones pueden ser preparadas por métodos de dispersión de alta energía. Ejemplo de ello son los ultrasonidos o los homogeneizadores de alta presión. O por métodos de condensación o fisicoquímicos, que son denominados de baja energía donde se ocupa ligera agitación y/o cambios de temperatura o composición. 2.6.1 Métodos de Dispersión: Fuerza de cizalla (Alta Energía) . Estos métodos consisten en la elongación de la gota mediante un alto cizallamiento producido por mezcladores de hélice o de turbina, para reducir el tamaño de gota se precisa suministrar más energía mecánica ya que al disminuir el tamaño de gota aumenta la presión de Laplace (Marquez y otros, 2004). El efecto sobre el tamaño de la gota que ejercen los equipos de emulsificación son los siguientes: la agitación produce tamaños de gota de ~10 micras, el molino de coloides ~5 micras, ultraturrax ~1.1 micras, el Microfluidizador (sistema microfluídico a alta presión) de ~0.1 a 0.2 micras. (Benita, 1993) Además de la energía aplicada, el tamaño y la polidispersidad dependerá de la composición, particularmente de la relación entre el surfactante y la fase dispersa. Los equipos más eficientes son los homogeneizadores de alta presión y la aplicación de ultrasonido (Walstra, 1983; Nakajima, 2010). En emulsiones concentradas o altamente concentradas, la aplicación de excesiva energía mecánica puede producir una inversión de fases. (Boatella et. al., 2004 ). . 22 .
(31) 2.6.2 Métodos Fisicoquímicos – inversión de fases (Baja Energía) . Los métodos de baja energía permiten obtener nanoemulsiones de tamaño de gota muy pequeño con muy baja polidispersidad. En estos métodos la energía requerida proviene de las transiciones o cambios de fase que se producen durante su formación. ( Márquez y otros, 2007) Cuando se cambian las variables en un sistema que se encuentra en equilibrio termodinámico, este pasa a un estado de desequilibrio que bajo tales condiciones se traduce en transiciones de fases formándose emulsiones con pequeño tamaño de gota o nano-emulsiones (Shinoda, 1967). De acuerdo a la literatura, dichos métodos pueden clasificarse en dos grupos: emulsificación “espontánea” y emulsificación por inversión de fases. En el método de emulsión “espontánea” la nanoemulsión se forma mediante un proceso de dilución de la fase continua. En el método de inversión de fases ocurre la emulsificación por un proceso de cambio de curvatura de la molécula del surfactante, ya sea mediante cambios de temperatura o de composición. Cabe mencionar que aunque algunos autores denominan. a ciertos métodos como. formación “espontánea”, ésta no puede ocurrir porque las nano-emulsiones son por naturaleza termodinámicamente inestables. Sucede que en esos métodos la emulsión se forma al entrar en contacto los componentes del sistema en ausencia de o poca agitación, dando la impresión de una formación espontánea. (Rang y Miller, 1999). Entre los métodos fisicoquímicos utilizados para la formación de nanoemulsiones se encuentra en método PIT ( Phase Inversion Temperature) y el método PIC (Phase Inversion Composition). . PIT . Este método fisicoquímico para la formación de nano-emulsiones consiste en la inversión de fases produciéndose la inversión de una emulsión O/W a una emulsión W/O, o viceversa, al variar la temperatura. A esa temperatura se le ha llamado Temperatura de Inversión de Fase PIT ( Phase Inversion Temperature) y. . 23 .
(32) es aquella donde la afinidad del surfactante es la misma para ambas fases, lo que indica la equivalencia conceptual de los términos PIT y THLB, aunque la correlación entre ambos no es perfecta ya que la PIT se basa en una metodología experimental bien definida tomando en cuenta el ambiente fisicoquímico. (Salager, 1998). La PIT está limitada a los surfactantes no-iónicos y al intervalo de temperaturas en que el agua se encuentra en estado líquido (Salager, 1999); originalmente la PIT se refería a la temperatura a la cual el surfactante cambiaba su afinidad hacia la fase acuosa por la afinidad a la fase oleosa debido a la deshidratación de la cadena polioxietilénica. El método PIT consiste en llevar al sistema a un cambio rápido de temperatura desde una temperatura igual o inferior a la PIT hasta una temperatura superior a la misma. ( Solans y otros, 2004). PIC Este método de formación de nanoemulsiones, denominado PIC (Phase Inversion Composition), se realiza mediante la inversión de fases por composición, pasando de una emulsión W/O a una O/W por adición de agua en sistemas constituidos por agua/surfactante/aceite, a temperatura constante y sin necesidad de aplicar fuerte agitación. Es importante realizar detallados estudios previos de comportamiento de fases con la finalidad de identificar zonas de cristal líquido laminar y micro-emulsiones bicontinuas, que tienen un papel muy importante en la formación de las nano-emulsiones al utilizar los métodos PIC y PIT. (Solans y otros, 2001). 2.6 Estabilidad de Nano-emulsiones. . Las nano-emulsiones presentan estabilidad ante la sedimentación debido a que la agitación térmica producida en gotas inferiores a 0.5 micras, conocida como movimiento Browniano, es mayor que la velocidad de sedimentación producida por la fuerza de gravedad. (Tadros, 1983). En lo que respecta a la floculación, la fuerza de Laplace evitaría que por deformación se adhirieran unas gotas a otras, pero el movimiento browniano provoca que por los choques se produzca la. . 24 .
(33) deformación (Batchelor, 1976). Las nano-emulsiones presentan estabilidad frente a la coalescencia debido a que las moléculas del surfactante se encuentra adsorbido en la interfase. agua/aceite en forma de monocapas, bicapas y. multicapas. También se ha reportado que las gotas de las nano-emulsiones se comportan como esferas rígidas, lo que evita que se deformen en capas planas ocasionando coalescencia. (Katsumoto y colaboradores, 2000). 2.7 Nano-emulsiones de parafina. . Se han realizado algunos estudios sobre el comportamiento de emulsiones W/O utilizando parafina con la finalidad de encontrar técnicas para utilizarlas en la desestabilización de emulsiones de desechos de petróleo crudo. (Morales, et. al., 2011). Las nano-emulsiones O/W de parafina han sido estudiadas para aplicarlas como materiales de cambio de fase para almacenamiento de calor latente. En dicho estudio se utilizó una mezcla de los surfactantes Span 60® y Tween 60® utilizando métodos de baja energía. (Schalbart & Kawaji, 2013). Liu y colaboradores (2006) reportaron la obtención de nano-emulsiones de parafina del O/W a diferentes temperaturas de emulsificación utilizando el método EIP (Emulsion Invertion Point) obteniendo tamaños de gota debajo de 200 nm. Reportan haber utilizado mezclas de surfactantes Span 80® y Tween 80® para obtener un HLB de 10.3, manejando concentraciones de 3 a 8% de surfactante con la finalidad de investigar los efectos de la concentración del surfactante en el tamaño de gota. Encontraron que a mayor concentración de surfactante se estrecha la distribución de tamaños y disminuye el tamaño de gota, ya que la cantidad de surfactante determina el área interfacial. Anton & Saulnier (2013) reportan haber obtenido nano-emulsiones tipo W/O utilizando parafina por el método PIT (Phase Inversion Temperature) empleando surfactantes no iónicos y agua con NaCl 0.5M ya que han demostrado un vínculo con la ubicación de la PIT y la concentración de electrolitos. Utilizaron una. . 25 .
(34) metodología de tres pasos: 1) formulación de una macroemulsión agitando magnéticamente (~ 500 rpm) controlando la temperatura. 2) Llevar el sistema y mantenerlo en la zona de inversión de fase permaneciendo bajo moderada agitación 3)Dilución del sistema con 2-metilbutano (isopentano) a temperatura ambiente. Muestran que a temperaturas más bajas que la PIT las moléculas de surfactante están concentradas en la fase acuosa y que dicha fase puede ser repentinamente rota por dilución con un aceite fluido de bajo peso molecular y baja viscosidad que penetre las redes del surfactante formando las gotas acuosas de la nanoemulsión. No obstante la desventaja de esta metodología radica en la extremadamente alta volatilidad e inflamabilidad del aceite utilizado para diluir, el 2-metilbutano, además de que finalmente dicho aceite representó un mayor porcentaje que el aceite de parafina. 2.8 Aplicación en formulaciones de bioinsecticidas. . La. escasa. biodegradabilidad. de. los. plaguicidas,. así. como. su. bioacumulación, su toxicidad en aire, agua, suelos y para el ser humano, han sido las causas de la búsqueda de nuevas opciones para el control de las plagas. Una de estas opciones es el empleo de bioinsecticidas, que consiste en utilizar las toxinas bacterianas para el control de ciertos insectos. sin causar daño a las. plantas ni a otros animales (Alonso, et. al. 2012). Debido a que estos activos precisan de protección frente a la luz y el calor, así como a la manipulación del biocida por el operador, los biocidas se presentan en microencapsulados. GarcíaGutierrez y col. (2011) reportan la microencapsulación de proteínas cristal y esporas liofilizadas de Bacillus thuringiensis probando la toxicidad de éste bioinsecticida en Spodoptera frugiperda. La microencapsulación permite la liberación. controlada y sostenida de. activos así como protección la oxidación, la fotosensibilidad, y/o la volatilidad. Es definida como una tecnología de empaquetamiento de materiales. Dentro de las técnicas de microencapsulación se encuentra el método de encapsulación por. . 26 .
(35) emulsión. En esta técnica, la fase dispersa consta de la matriz que incluye el componente a encapsular; una solución de alginato-toxina bacteriana se dispersa en una fase oleosa seguida de una fuente de calcio que inicia la gelificación de las fase dispersa. Posteriormente se desestabiliza la emulsión y se separan las cápsulas formadas. (Lupo et. al. 2012). Esta técnica ha presentado los inconvenientes de una gran polidispersidad y cápsulas muy grandes, lo que ocasiona desperdicio de sustancia activa. Se busca disminuir el tamaño de la cápsula y estrechar la dispersión de tamaños. Se tiene la hipótesis de que si se forma la encapsulación en emulsión cuya fase continua sea una nano-emulsión tipo W/O en lugar de aceite puro se logrará que las cápsulas sean más pequeñas y uniformes en tamaño; por esa razón se busca la formulación que permita la formación de una nano-emulsión agua-en-aceite utilizando parafina como fase oleosa.. 2.9 Caracterización de las nano-emulsiones. . La caracterización es la identificación de un material mediante el estudio de sus propiedades físicas, químicas o estructurales; en la caracterización de una nano-emulsión interesa conocer el tamaño de gota de la fase dispersa, el signo o tipo de la emulsión (O/W o W/O) y la dispersión de tamaños de gota. La técnica de caracterización de tamaño de gota de una nano-emulsión se realiza normalmente es mediante la Dispersión Dinámica de la Luz, conocida como DLS (Dynamic Light Scattering).. 2.9.1. Dispersión Dinámica de la Luz. Es una técnica experimental basada en la interacción radiación-materia. Cuando un haz de luz atraviesa un medio donde el índice de refracción es uniforme en la totalidad del medio, la luz no será desviada. La presencia de partículas variará el índice de refracción lo que hará que parte de la luz sea. . 27 .
(36) dispersada en todas direcciones. Al ser tocados por el haz de luz, los átomos y moléculas se polarizan y re-emiten luz débil de la misma longitud de onda que la del haz incidente. La DLS, a la cual también se le conoce como espectroscopia de correlación de fotones, está basada en que la luz dispersada por partículas con movimiento browniano presentan un desplazamiento minúsculo de su longitud de onda debido a el efecto Doppler, dicho desplazamiento solo puede ser medido mediante un rayo láser monocromático y muy intenso. El desplazamiento se utiliza para medir el coeficiente de difusión de las partículas, que a la vez sirve para calcular el radio de la partícula utilizando la ecuación de Stokes-Einstein (Gennaro, 2003): . 𝐷=. 𝐾∗𝑇 6∗𝜋∗𝜂∗𝑟 . Donde 𝐷 es el coeficiente de difusión, 𝐾 es la constante de Boltzman (1.38 x10-23 J/K), T es la temperatura en Kelvin, 𝜂 es la viscosidad del medio y 𝑟 es el radio de la gota. El diámetro medido mediante DLS es el diámetro hidrodinámico, que incluye la doble capa eléctrica y capa de solvatación adherida a su superficie que se desplaza junto con la partícula o gota, por tanto el tamaño obtenido por esta técnica suele ser mayor al que se mediría en un. Microscopio Electrónico de. Transmisión (TEM). (Ver Fig. II.8). . Figura II.8 Radio hidrodinámico obtenido por DLS. (Fritsch). . 28 .
(37) . 2.9.2 Conductividad. La conductividad es una medida de la capacidad de una solución acuosa para transmitir una corriente eléctrica. Ésta capacidad depende de la presencia de iones, de la concentración de los mismos así como su movilidad y valencia. La mayoría de los compuestos inorgánicos son buenos conductores al contrario de los compuestos orgánicos como aceites, azúcar y alcohol que no se disocian en soluciones acuosas, son pobres conductores de una corriente eléctrica.. La. conductividad eléctrica se define como la conductancia eléctrica de un cubo de solución electrolítica de 1 metro de arista (Arderiu y colaboradores, 1998). La unidad de conductividad eléctrica es siemens/ metro (S/m), milisiemens/metro (mS/m), microsiemens/centímetro (µS/cm). . 𝑑 𝑘 = 𝐺 𝑠. Donde k es la conductividad, G es la conductancia eléctrica, s es la superficie transversal de los electrodos, d es la distancia de separación de los electrodos. . En una emulsión la conductividad de las dos fases que lo conforman es muy diferente, ya que la fracción acuosa generalmente contiene electrolitos presentando alta conductividad y la fracción oleosa no conduce la electricidad. La conductividad dependerá de naturaleza de la fase continua ya que la fase dispersa no presenta continuidad entre los electrodos. Por tanto, puede emplearse la conductividad para determinar el tipo de emulsión (Bello, 2000; FIRP # 231).. . 29 .
Figure



Documento similar
Triturar con el mezclador de inmersión hasta obtener una pasta lisa y agregar la goma Xanthan para mejorar la textura y evitar sinéresis.. Emulsión de Naranja y aceite
Como puede observarse, un aumento de la velocidad de agitación durante el procesado de la emulsión da lugar a un aumento con- tinuo de G N 0 , lo que implica una disminución de
Figura 1: Distribución de tamaños de gota de la emulsión primaria y final correspondiente al sistema que contenía 40 % en peso de aceite esencial de tomillo y 2% en peso de
Por otra parte, mediante el análisis de imagen se pudo determinar que las gotas de aceite presentes en las emulsiones elaboradas con pectinas presentaron un tamaño de partícula
Como puede observarse, un aumento de la velocidad de agitación durante el procesado de la emulsión da lugar a un aumento con- tinuo de G N 0 , lo que implica una disminución de
Emulsiones agua-en-aceite (W/O) que tienen como fase dispersa al agua o a un líquido polar y la fase dispersante es un líquido hidrofóbico. La Figura 2.a muestra de
Comparación de la distribución de tamaño de la formulación óptima con otras formulaciones Comparación distribuciones de tamaño para la emulsión optimizada del sistema
Como se observa en este estudio, una emulsión con un grado de dispersión alto una mayor relación área/superficie, permite una mayor incorporación de la fase oleosa AET entre las