1 “Año de la Promoción de la Industria Responsable y del Compromiso Climático”
UNIVERSIDAD NACIONAL DE LA AMAZONÍA PERUANA
FACULTAD DE FARMACIA Y BIOQUÍMICA
PROYECTO DE TESIS
TÍTULO:
Desarrollo y validación de un método analítico para la cuantificación de Permetrina 1% en Shampoo mediante Cromatografía Liquida de alta Resolución (HPLC).
PRESENTADO POR LOS BACHILLERES: Bach: Ruddy Verónica Guardia Vargas.
Bach: Susan Lizeth Elias Da Silva.
PARA OPTAR EL TÍTULO PROFESIONAL DE: QUÍMICO FARMACÉUTICO
ASESOR:
Q. F. Luis Domingo Nonato Ramírez.
2 DESARROLLO Y VALIDACIÓN DE UN MÉTODO ANALÍTICO PARA LA
CUANTIFICACIÓN DE PERMETRINA 1% EN SHAMPOO MEDIANTE CROMATOGRAFÍA LIQUIDA DE ALTA RESOLUCIÓN (HPLC).
Bach: Ruddy Verónica Guardia Vargas.
Bach: Susan Lizeth Elias Da Silva.
RESUMEN
Se desarrolló y validó una nueva técnica de análisis por Cromatografía Líquida de Alta Resolución (HPLC) para la cuantificación de Permetrina 1% en Shampoo, de acuerdo a la exigencia y normatividad vigente referida a Buenas Prácticas de Fabricación de productos farmacéuticos (USP 36). La técnica de análisis se realizó mediante el tipo de muestreo aleatorio al azar, se tomó en cuenta la preparación de la muestra para que el principio activo pueda ser cuantificado en un sistema (fase móvil, columna cromatográfica y longitud de onda). Como paso previo a la validación de la técnica de análisis, se evaluó la aptitud del sistema cromatográfico, asegurando de esta manera, el funcionamiento adecuado del mismo. Posteriormente, se procedió a la validación del método de análisis evaluando los parámetros que indican las obras oficiales, como son: selectividad, linealidad, precisión, exactitud y robustez. Seguidamente, se elaboró el Protocolo de validación del método, para lo cual se contó con el diseño experimental y los procedimientos estadísticos, concluyéndose así que el método analítico propuesto es selectivo, porque permite el análisis del principio activo sin la interferencia de los excipientes presentes en la formulación del Shampoo, es lineal, porque los resultados obtenidos son directamente proporcionales a la concentración de analito en la muestra, es preciso, porque nos permite obtener resultados repetitivos y reproducibles, cuando este es aplicado en análisis repetitivos de la misma muestra y es exacto, ya que permite la recuperación de la totalidad de analito presente en la muestra, comprobándose así su validez.
Palabras claves:
- Permetrina.
- Cromatografía líquida de alta resolución.
- Método analítico.
3 DEVELOPMENT AND VALIDATION OF A QUANTITATIVE ANALYTICAL
METHOD FOR permethrin 1% SHAMPOO IN LIQUID CHROMATOGRAPHY (HPLC).
Bach: Ruddy Verónica Guardia Vargas.
Bach: Susan Lizeth Elias Da Silva.
ABSTRACT
Was developed and validated a new analysis technique for liquid chromatography (HPLC)
for the quantification of Permethrin 1% by Shampoo, according to the requirement and
current regulations relating to good manufacturing practices for pharmaceutical products
(USP 36). The technique of analysis was performed using the type of random sampling
randomly, took into account the sample preparation for the active substance can be
quantified in a system (mobile phase chromatographic column and wavelength). Prior to the validation of analytical technique it was evaluated the system suitability chromatographic, thus ensuring the proper functioning thereof was evaluated. Subsequently, we proceeded to validate the method of analysis evaluating the parameters
that indicate the official work, such as: selectivity, linearity, precision, accuracy and
robustness. Then, Protocol validation method was developed, for which it had the
experimental design and statistical procedures, thus concluding that the proposed analytical
method is selective, it allows the analysis of the active ingredient without interference from
the excipients present in the formulation of the shampoo, is linear in that the results
obtained are directly proportional to the concentration of analyte in the sample, it is
necessary, because it enables us for repeatable and reproducible results, when this is
applied in repetitive analyzes of the same sample and exact because it allows the recovery
of all of the analyte present in the sample and checked for validity.
Keywords:
- Permethrin
- High Performance liquid Chromatography
- Analytical method
4 mano cuando sentía que el camino se terminaba, a ustedes por siempre mi corazón y mi agradecimiento.
Susan Lizeth Elías Da Silva.
A DIOS, por ser el principal sustento de principios y valores que han hecho de mí una gran persona, capaz de salir adelante en beneficio propio, de mi familia y de la sociedad.
5 AGRADECIMIENTOS
A la Facultad de Farmacia y Bioquímica de la Universidad Nacional de la Amazonía Peruana por la excelente formación profesional recibida.
A Laboratorios PORTUGAL S.R.L. en la persona de su jefe de control de calidad Dra: Nolly Huanca, por el apoyo y facilidades brindadas.
A nuestras familias, por su apoyo incondicional, permanente aliento que hizo posible la realización de este trabajo.
A la Ing. María Milagros Manrique Nina por su confianza y apoyo brindado.
Al asesor de esta tesis, nuestro profundo agradecimiento por sus valiosos aportes y tiempo brindado.
A los catedráticos de la Facultad, que con sus conocimientos brindados, forjaron y fortalecieron nuestro desarrollo profesional.
6
1.2 PLANTEAMIENTO DEL PROBLEMA………... 17
1.3 OBJETIVOS……….……….….…. 19
2.1.2.1 Piretrinas y Piretroides………... 23
2.1.2.1.1 Generalidades………... 23
2.1.2.1.2 Piretroides………... 24
2.1.2.1.2.1 Definición……… 24
2.1.2.1.2.2 Clasificación……… 24
2.1.2.1.3 Permetrina………... 27
2.1.2.1.3.1 Propiedades Físicas y Químicas de Permetrina………... 28
2.1.2.2 Cromatografía Liquida de Alta Resolución (HPLC)………. 28
2.1.2.2.1 Definición………... 28
2.1.2.2.2 Partes………... 29
7
b. Inyectores………... 29
c. Detectores……….. 30
d. Sistema de toma y procesamiento de datos………... 30
2.1.2.2.3 Parámetros cromatográficos………... 31
2.1.2.3 Validación de técnicas analíticas……….. 33
2.1.2.3.1 Razones que justifican la validación de métodos analíticos………... 34
2.1.2.3.2 Métodos susceptibles de ser validados………... 35
2.1.2.3.3 Tipos de validación………. 35
a. Validación Prospectiva……….. 35
b. Validación Retrospectiva………... 36
c. Revalidación……….. 36
2.1.2.3.4 Características de desempeño analítico……….. 36
a. Exactitud……… 36
b. Precisión……… 37
c. Selectividad………...……… 38
d. Linealidad……….………. 39
e. Intervalo………. 40
2.1.2.3.5 Datos requeridos para la validación……… 40
2.2 DEFINICIONES OPERACIONALES………... 41
2.2.1 Variables independientes……….. 42
2.2.2 Variables dependientes………. 43
8 CAPITULO III
3.1 METODOLOGÍA DE LA INVESTIGACIÓN………... 48
3.1.1 Método de investigación……….……….. 48
3.1.2 Población y Muestra……….. 49
3.1.2.1 Población……….... 49
3.1.2.2 Muestra……….……….. 49
3.1.2.2.1 Tipo de muestreo………. 49
3.1.2.2.2 Tamaño de la muestra………. 49
3.1.2.2.3 Identificación de muestra……… ………50
3.1.2.2.4 Procesamiento de muestra……….. 50
3.1.2.3 Placebo………..………50
3.1.3 Parte experimental……… 50
3.1.3.1Desarrollo y validación de la técnica analítica……….. 50
1. Objetivo………. 52
2. Alcance……….. 52
3. Método de Validación……….... 52
4. Técnica analítica……….………... 52
4.1 Desarrollo de la técnica analítica……..………. 52
4.2 Materiales, reactivos, producto de referencia y equipos………… 53
4.3 Procedimiento analítico……….. 56
4.3.1 Preparación de fase móvil………. 56
4.3.2 Preparación de solución estándar……….. 56
4.3.3 Preparación de solución prueba………. 56
4.3.4 Ensayo de aptitud del sistema……….... 57
5. Parámetros de validación………... 57
5.1Desarrollo de los parámetros de validación………. 57
5.1.1 Selectividad de la técnica analítica……….. 57
5.1.1.1Interferencia del método……… 57
5.1.1.2Prueba de estresamiento de muestras………….………58
5.1.2 Linealidad de la técnica analítica……… 59
5.1.2.1Linealidad del sistema………..…….……… 59
9
5.1.3 Exactitud de la técnica analítica……… 62
5.1.4 Precisión……… 63
5.1.5 Robustez……… 64
5.1.6 Intervalo……… 65
5.2 RESULTADOS…………..……… 66
5.2.1 Aptitud del Sistema……… 66
5.2.2 Selectividad……… 68
5.2.3 Linealidad……….………….………….………… 70
5.2.3.1Linealidad del sistema ………71
5.2.3.2Linealidad del Método……….72
5.2.4. Exactitud………..………...79
5.2.5 Precisión………... 81
5.2.5.1 Repetibilidad del sistema………82
5.2.5.2Repetibilidad del método……… 84
5.2.5.3Precisión Intermedia………85
5.2.6 Robustez de la técnica analítica ………..87
10 ÍNDICE DE TABLAS
Tabla 1: Características Generales
Tabla 2: Propiedades Físicas y Químicas de Permetrina.
Tabla 3: Datos Requeridos para la validación de técnicas analíticas
Tabla 4: Variable Independiente Tabla 5: Variable Dependiente Tabla 6: Estresamiento de Muestras Tabla 7: Aptitud del Sistema (HPLC). Tabla 8: Interferencia de las muestras. Tabla 9: Muestras Estresadas
Tabla 10: Linealidad del Sistema-Isómero Trans Tabla 11: Linealidad del Sistema-Isómero Cis Tabla 12: Linealidad del Método Analítico. Tabla 13: Exactitud de la técnica analítica. Tabla 14: Repetibilidad del Sistema
Tabla 15: Repetibilidad del Método
11 ÍNDICE DE FIGURAS
Figura 1: Piretro
Figura 2: Degradación del piretro Figura 3: Alcohol Elliot
Figura 4: Fenotrina Figura 5: Permetrina Figura 6: Cipermetrina Figura 7: Deltametrina Figura 8: Fenvalerato Figura 9: Cifenotrin
12 ÍNDICE DE GRÁFICOS
13 ANEXOS
ANEXO 1: Ensayo de Aptitud del Sistema (HPLC). ANEXO 2: Interferencia del Método.
ANEXO 3: Prueba de Estresamiento de Muestras. ANEXO 4: Linealidad del Sistema.
ANEXO 5: Linealidad del Método.
ANEXO 6: Exactitud de la técnica analítica. ANEXO 7: Repetibilidad del Sistema. ANEXO 8: Repetibilidad del Método. ANEXO 9: Precisión intermedia.
ANEXO 10: Robustez de la técnica analítica.
15 1.1 INTRODUCCIÓN
La industria farmacéutica se ha caracterizado desde sus inicios por la necesidad de alcanzar altos niveles de calidad, para lo cual fue desarrollando procedimientos que han evolucionado con una reglamentación estricta: en este avance por conseguir un alto dominio de la calidad, es cuando surge el concepto de validación.
El desarrollo y validación de técnicas analíticas, es una tarea que se viene realizando en diferentes laboratorios farmacéuticos peruanos en los últimos años, debido al mayor énfasis que ha puesto la industria en los temas de Aseguramiento de la Calidad y mejora de la productividad; así mismo, es parte integral de las Buenas Prácticas de Manufactura y del desarrollo de un método de análisis, puesto que sin fiabilidad de los resultados analíticos es imposible asegurar que un medicamento cumple con las especificaciones exigidas, además contribuye a garantizar la calidad de un producto determinado.
En el presente trabajo se ha desarrollado una técnica de análisis para cuantificar Permetrina 1% en shampoo por Cromatografía Liquida de Alta Resolución (HPLC). Las razones de la preferencia de este tipo de cromatografía son su sensibilidad, su fácil adaptación a las determinaciones cuantitativas exactas, su idoneidad para la separación de especies volátiles o termolábiles y, sobre todo, su gran aplicabilidad a sustancias que son de primordial interés en la industria y en muchos campos de la ciencia.
El desarrollo y validación de la presente técnica analítica fue realizada en Laboratorios Portugal S.R.L. en el Departamento de Control de Calidad de acuerdo a la exigencia y normatividad vigente referida a las Buenas Prácticas de Fabricación de productos farmacéuticos (USP 36).
17 1.2 PLANTEAMIENTO DEL PROBLEMA
La investigación y el desarrollo son muy importantes en la industria farmacéutica ya que de ello depende que se puedan desarrollar nuevos productos. (1)
El departamento de desarrollo farmacéutico por lo general trabaja con fármacos, excipientes, tecnología y formas farmacéuticas, para poder así alcanzar la innovación mediante la selección, modificación, combinación de lo ya conocido, con el objetivo de obtener una mejor calidad, disponibilidad, aceptación, eficacia y estabilidad en el medicamento. (2,3)
En el mercado farmacéutico actual, existen varios medicamentos de gran demanda por la población, cuyas técnicas de análisis no se encuentran publicadas en las obras oficiales que generalmente se consultan a saber: Farmacopea americana, británica, europea y japonesa. Esto hace necesario desarrollar nuevas técnicas de análisis en el laboratorio con el fin de separar y cuantificar los principios activos de dichos medicamentos. (4,5)
La literatura sobre el desarrollo y validación de métodos analíticos para la determinación de Permetrina (plaguicida sintético), en productos farmacéuticos es escasa, y la mayoría están destinados para el análisis de múltiples residuos de piretroides en diferentes y complejas matrices, por lo tanto, el pre-tratamiento de las muestras. (6)
Usualmente, cada método desarrollado es propuesto especialmente para un tipo de formulación, no habiendo un método universal propuesto como aplicable para el análisis de formulaciones de varios usos. (7,8)
Por lo tanto, el objetivo de este estudio será el desarrollo y validación de una metodología de análisis que emplea la Cromatografía Líquida de Alta Resolución (HPLC) para la determinación de Permetrina 1% en Shampoo y se pueda aplicar al control de calidad de estos productos.
18 ¿El método analítico por Cromatografía Liquida de Alta Resolución para la cuantificación de Permetrina 1% en shampoo, cumplirá con los parámetros de
19 1.3 OBJETIVOS
1.3.1 GENERAL
Desarrollar y validar un método analítico por Cromatografía Líquida de Alta Resolución (HPLC) para cuantificar Permetrina 1% en Shampoo.
1.3.2 ESPECÍFICOS
Desarrollar una metodología de análisis capaz de cuantificar el principio activo del Shampoo de Permetrina.
Demostrar que el método analítico propuesto cumple con las características de desempeño: selectividad, Precisión, linealidad y exactitud.
21
según los mismos autores, sólo el isómero Cis se considera activo para el uso previsto. (9)
Rezende, Oliveira y Siqueira. (2008): En el trabajo que desarrollaron para la cuantificación de Cis Permetrina por HPLC, refieren que Choi, Hoddgson y Rose (2002)
obtuvieron 9,39 y 19,17 mg/ml en los límites de detección y de cuantificación,
respectivamente, cuando se trabaja con una muestra de fluido biológico. Estos valores son
significativamente más altos en comparación con los encontrados en este estudio. (Límite de Detección = 1,6 mg / ml y Limite de cuantificación = 2,4 mg /ml), que pone de relieve la necesidad de validación mediante la variación de la matriz de la muestra. También en
relación con los límites de confianza del método para la cuantificación de Cis- permetrina
en loción capilar, se tiene que el valor medio obtenido para la prueba de precisión, medida
en concentraciones de 6,4 a 38,4 mg de Cis- permetrina/ml de muestra fue de 103%
(93,0-107,7%). Este valor es similar a la encontrada por Wang, Moorman y Burleson (2003), que es 98,8% (94,6%-103%).
En comparación con los resultados de la prueba de precisión intra-ensayo llevado a cabo
por Wang, Moorman y Burleson (2003), que se encontró que el coeficiente de variación
de 0,43%, el promedio de los coeficientes medios de variación obtenidos en el método
propuesto fue mayor (0,96%). Sin embargo, esta diferencia no pone en peligro la exactitud
del método publicado, ya que el valor recomendado por la Agencia Nacional de Vigilancia
Sanitaria (ANVISA) es hasta 5% (BRASIL, 2003). (10)
Modamio et al. (2008-2009): En su investigación, el ensayo de especificidad del método fue corroborado a través de los cromatogramas realizados, en los cuales los tiempos de
22
ensayo de linealidad se obtuvieron coeficientes de correlación de r= 0,9998 para el
isómero trans y r= 0,9997 para el isómero cis. La precisión se demostró a través del CV%
(coeficiente de variación) de la serie de medidas con un valor de 2,07 y 1,73% para el interdia de
los isómeros trans y cis y 2,1 y 0,73% para el intradia respectivamente. La exactitud se comprobó por el ER% (error relativo porcentual) con valores de -0,2% y -2,05% para el interdía para los isómeros trans y cis y -0,37% y -0,3% para el intradía de los isómeros. (11)
Tarinas et al. (2010): En su investigación, el ensayo de especificidad del método fue corroborado a través de los cromatogramas realizados, en los cuales los tiempos de
retención fueron entre 8,8 y 9,2 min para el isómero trans y entre 10,7 y 11,2 min para el
isómero cis. El coeficiente de correlación determinado para ambos isómeros fue mayor que
0,99; el coeficiente de variación fue menor que 3 % y el error relativo porcentual estuvo
entre -3 y 1 %, tanto para los estudios interdía como intradía. Se determinó que la media de
la concentración de permetrina en lotes de solución tópica 1 % resultó de 6 780,14 μg/mL.
En el ensayo de linealidad se obtuvieron coeficientes de correlación de r= 0,9991 para el
isómero trans y r= 0,9988 para el isómero cis. La precisión se demostró a través del CV%
(coeficiente de variación) de la serie de medidas con un valor de 2,48 y 2,0 % para el
ensayo interdía de los isómeros trans y cis y de 2,62 y 2,90 % para el intradía,
respectivamente. La exactitud se comprobó por el ER% (error relativo porcentual) con
valores de -1,02% y -2,71% para los isómeros Trans y Cis en el ensayo interdía, 0,59 y - 0,94 % para el intradía de los isómeros. (12)
Maja Shishovska y Marina Stefova (2010): Concluyeron en un artículo que las condiciones para el análisis de Permetrina utilizando una columna C18 de rápida resolución de 5cm x 4.6mm id con partículas de 1.8m son: fase móvil (Acetonitrilo: Agua en proporción 75:25); Velocidad de Flujo: 1,0mL/min, temperatura: 45°C y Detector: UV
a 215nm. Afirmando que el método propuesto es rápido, simple, exacto y preciso para el
análisis de ambos isómeros de Permetrina en varios tipos de formulaciones aplicables con
el sistema de HPLC convenientes. (13)
23
fabricación de vino son: columna de HPLC RP18 (25cm x 4mm id, 5m); fase móvil (Acetonitrilo: agua en proporción 70:30); Velocidad de flujo de 2ml/min; temperatura:
25°C y detector: UV a 215nm. En estas condiciones los isómeros de permetrina fueron
bien separados de los componentes naturales del vino y también uno del otro. (14)
M. Saeed Arayne, et al (2011): En el estudio que realizaron para la determinación de Permetrina, concluyeron que se puede determinar este principio activo usando el método
a 272nm. Teniendo la ventaja de simplicidad, estabilidad, reproducibilidad y precisión y se
asocia con una mayor sensibilidad y precisión. La no interferencia de excipientes hace que
el método sea adecuado para la determinación de la droga en forma de crema y por lo
tanto se puede utilizar para el control de rutina de la calidad de la formulación de
Permetrina de todas las potencias. (15)
Los trabajos mencionados muestran la necesidad de la validación de las técnicas analíticas y la importancia de su inclusión dentro de los programas de validación en los laboratorios de Control de Calidad, así como la ventaja en la reducción de costos por análisis y su aplicación a productos que se comercializan en el mercado.
2.1.2 CONSIDERACIONES TEÓRICAS
2.1.2.1 Piretrinas y Piretroides.
2.1.2.1.1 Generalidades
Las Piretrinas se obtienen del extracto de oleorresina de las flores del crisantemo,
Chrysanthemum cineriaefolium, los piretroides tienen la misma estructura pero se obtienen
por síntesis química modificando su estructura básica para incrementar su estabilidad en el ambiente natural.
24
Tabla 1. Características Generales de Piretrinas y Piretroides.
PIRETRINAS PIRETROIDES Se disuelven mejor en agua.
Fórmula química modificada para mejorar la estabilidad Más persistente.
Fuente: Piretrinas y piretroides. Dr. Diego Gonzales Machin.
2.1.2.1.2 Piretroides
2.1.2.1.2.1 Definición
Se definen como ésteres de ácidos derivados del ciclopropano. Son poco tóxicos para los mamíferos, quienes los metabolizan y excretan con rapidez. Dejan residuos muy bajos o nulos: en el suelo, se descomponen; son solubles en agua. (17)
2.1.2.1.2.2 Clasificación
a) Piretroides de Primera Generación
Se generaron en las décadas 40 al 60. Aletrinas y sus isómeros, Partrina, Dimetrina, Benatrina, Tetrametrina, etc. (17)
Figura1. Piretro
25
Figura 2. Degradación del Piretro
El alcohol Elliot es más efectivo y no tan tóxico (17)
.
Figura 3.Alcohol Elliot
El primero fue la FENOTRINA:
Figura 4. Fenotrina
b) Piretroides de Segunda Generación
26
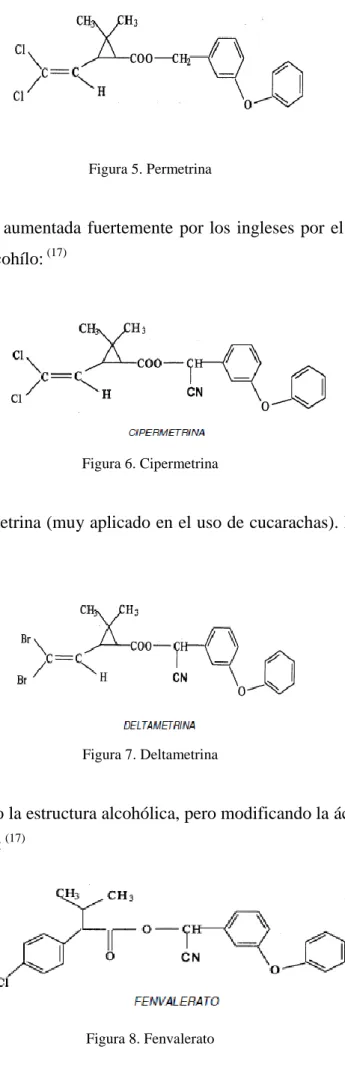
Figura 5. Permetrina
Su acción insecticida es aumentada fuertemente por los ingleses por el grupo ciano en el carbono del hidroxilo alcohílo: (17)
Figura 6. Cipermetrina
Luego aparece la deltametrina (muy aplicado en el uso de cucarachas). No es muy tóxico. (17)
Figura 7. Deltametrina
Finalmente, manteniendo la estructura alcohólica, pero modificando la ácida, eliminando el ciclopropano, se llegó al: (17)
27 c) Piretroides de Tercera Generación
Buscando fotoestabilidad, poca volatilidad, fuerte acción letal, buena estabilidad, pero eliminando los halógenos, por considerarlos causantes de residuos. Nace así el CIFENOTRIN. (17)
Figura 9. Cifenotrin
2.1.2.1.3 Permetrina
Es un plaguicida sintético de amplio espectro perteneciente al grupo químico de los piretroides, cuyo mecanismo de acción es la neurotoxicidad. (18)
Se usa principalmente para matar insectos, arañas y orugas, como también para repeler una amplia gama de insectos. Produce reacciones de hipersensibilidad en mamíferos, incluyendo a los seres humanos. (19)
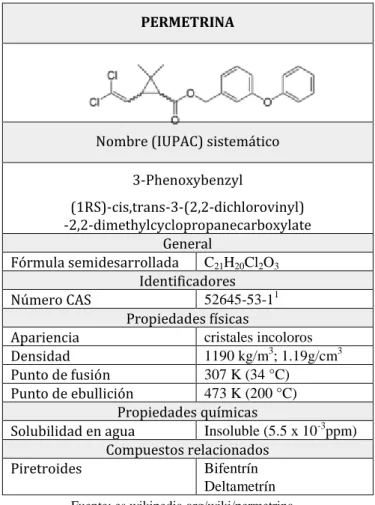
28 2.1.2.1.3.1 Propiedades Físicas y Químicas de Permetrina.
Tabla 2. Propiedades Físicas y Químicas de Permetrina.
Fuente: es.wikipedia.org/wiki/permetrina
2.1.2.2 Cromatografía Líquida de Alta Resolución (HPLC).
2.1.2.2.1 Definición
La Cromatografía de Líquidos de Alta Resolución - HPLC (por sus siglas en inglés), es una técnica utilizada para la separación, identificación cualitativa y determinación cuantitativa de componentes químicos en mezclas complejas. (21)
Ampliamente utilizada en la industria farmacéutica por las ventajas que la técnica presenta, obteniendo un análisis cuantitativo rápido y preciso, es una operación automatizada, tiene una alta sensibilidad de detección pudiendo detectar nanogramos, picogramos, inclusive niveles de femtogramos; y una de las ventajas más importantes es la susceptibilidad a la
Fórmula semidesarrollada C21H20Cl2O3 Identificadores
Número CAS 52645-53-11
Propiedades físicas
Apariencia cristales incoloros
Densidad 1190 kg/m3; 1.19g/cm3
Punto de fusión 307 K (34 °C)
Punto de ebullición 473 K (200 °C)
Propiedades químicas
Solubilidad en agua Insoluble (5.5 x 10-3ppm)
Compuestos relacionados
Piretroides Bifentrín
29 limitaciones que presenta, son que el sistema no cuenta con un detector universal como en otros sistemas, por lo tanto la detección es problemática si el analito no absorbe haces de luz UV, otra desventaja se da cuando el analito no es fácilmente ionizado; y por último, la técnica por HPLC, tiene muchos parámetros operacionales que lo hace dificultoso para un principiante. (22)
Existiendo cuatro tipos principales de técnicas de HPLC que responden a las fuerzas moleculares básicas: fuerzas iónicas, fuerzas polares y fuerzas de dispersión; cada técnica específica a cada una de ellas: las fuerzas polares son el tipo dominante de las interacciones moleculares empleadas en HPLC de fase normal; las fuerzas de dispersión son empleados en HPLC de fase reversa; las fuerzas iónicas son empleados en HPLC de intercambio iónico; y el cuarto tipo de técnica de HPLC de exclusión de tamaño, se basa en la separación dinámica de las moléculas de acuerdo al tamaño que presente, sin la interacción del analito con la fase estacionaria. (23)
2.1.2.2.2 Partes
a. Bomba
El sistema de bombas puede ser considerado como el corazón del HPLC; las características de funcionamiento y rendimiento de la bomba fundamentalmente definen y limitan el tipo de separaciones que pueden ser realizadas; las características más importantes son: a) la reproducibilidad de caudal, b) el rango de caudal, c) la estabilidad de la presión. (24)(25)
Existen cuatro tipos de bombas: Las bombas de presión constante, las bombas de caudal constante, las bombas alternativas y las bombas de jeringa. (25)
b. Inyectores
30 justificado cuando la cantidad de muestra es limitada; la utilización de inyectores automáticos facilita la transferencia de muestras y el procesamiento automático de variables operativas como el control de volumen, número de inyecciones, el intervalo entre las inyecciones, ciclos de enjuague de las muestras; suprimiendo factor del error humano y mejorando la precisión del método. (24)
c. Detectores
El propósito de un detector en un sistema de HPLC es identificar la presencia de componentes de interés del eluyente proveniente de la columna del HPLC. El analito es reconocido por interacciones fisicoquímicas como por ejemplo la de absorbancia de radiación UV en una cierta longitud de onda.
Los detectores pueden ser clasificados dentro de dos categorías; los detectores basados en una propiedad de disolución que responden cualquier cambio de la alguna propiedad física de la fase móvil, tal como el índice de refracción, la constante dieléctrica, o la densidad, que se modifica por la presencia de los analitos. Por contraste, los detectores basados en una propiedad del soluto responden únicamente a propiedades del analito, como la absorbancia UV, fluorescencia, o actividad electroquímica, que no son propias de la fase móvil.
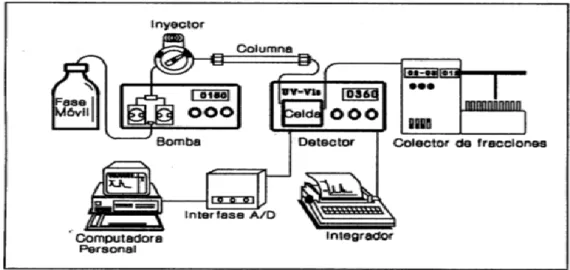
d. Sistemas de toma y procesamiento de datos
31
Figura 10. Esquema de una posible configuración de un cromatógrafo liquido isocrático
2.1.2.2.3 Parámetros Cromatográficos
a. Tiempo de Retención (tR)
Cada analito específico está representado por un pico en el cromatograma; estos picos son simétricos y se asemejan a una curva de distribución normal tipo Gaussiana.
La distancia máxima del pico desde el punto de inyección, expresado en unidades de tiempo se llama tiempo de retención (tR). El tiempo de retención de analito es
dependiente del caudal de fase móvil; a mayor velocidad del caudal de flujo, más pequeño es el tiempo de retención de analito. El producto del tiempo de retención de analito y el caudal de fase móvil es el volumen de retención (VR). (27)
b. Tiempo muerto
32 c. Factor de Retención (K)
La retención del analito se compone de dos partes: 1) El tiempo que el analito eluye en la fase móvil; 2) el tiempo que el analito es retenido en la fase estacionaria. La diferencia entre el tiempo total de retención (tR) y el tiempo de demora, se denomina
tiempo de retención reducido (t’R), y la correspondiente diferencia entre el volumen de
retención del analito y el volumen muerto se llama volumen de retención neta (V’R).
La relación entre el volumen de retención reducido y del volumen muerto da un parámetro adimensional llamado factor de retención, (K) llamado también factor de capacidad. (27)
d. Selectividad (α)
La capacidad del sistema Cromatográfico para discriminar diferentes analitos se llama selectividad (α). La selectividad se determina como la relación de los factores de retención de dos analitos, o la relación de los tiempos de retención reducida.
La retención relativa describe la capacidad de un sistema Cromatográfico de discriminar entre dos compuestos; es independiente de la longitud de columna y la velocidad de flujo; por el contrario es dependiente de la temperatura y las propiedades de la fase móvil y la fase estacionaria. (26)(27)
e. Eficiencia (N)
La eficiencia es la medida del ensanchamiento de cinta cromatográfica y el número de los platos teóricos (N) en la columna.
33 f. Resolución (R)
La resolución (R) está definida como la proporción de la distancia entre dos picos a la anchura media de los mismos y este descriptor abarca tanto eficacia como selectividad. (27)
2.1.2.3 Validación de Métodos analíticos
Es el establecimiento de la evidencia documental de que un procedimiento analítico conducirá con un alto grado de seguridad a la obtención de resultados precisos y exactos, dentro de las especificaciones y los atributos de calidad previamente establecidos. (28)
Aunque los estudios de validación de técnicas analíticas se han realizado en la industria farmacéutica durante mucho tiempo, hoy en día es de uso rutinario debido a un mayor énfasis de la industria en los últimos años de garantía de calidad y mejora de la productividad. La validación de técnicas analíticas es una parte necesaria del programa de gestión de calidad y es fundamental para una operación de producción eficiente y es parte integral de las Buenas prácticas de manufactura; todo el conjunto de procesos de validación están descritos en un Plan Maestro de Validaciones, este plan considera el desarrollo de actividades como la Calificación del Sistema que viene a ser la ejecución de pruebas para determinar si un componente de un proceso posee los atributos requeridos para trabajar correctamente la técnica analítica elegida, esta primera etapa considera:
Calificación del diseño (DQ):
34 Calificación de la Instalación (IQ):
Establece que el equipo y los sistemas auxiliares son entregados de acuerdo al diseño y especificación del fabricante, instalados en el ambiente seleccionado, y que este ambiente es conveniente para la operación y el empleo del instrumento.
Calificación operacional (OQ):
Es el proceso de demostración que un instrumento funcionará según su especificación operacional en el ambiente seleccionado, el objetivo principal es de asegurar que el hardware y software del equipo se encuentran funcionales según los datos específicos requeridos en el documento DQ.
Calificación del performance (PQ):
Establece por evidencia objetiva que el proceso, bajo condiciones delimitadas, produce constantemente un producto que cumple con las características de calidad deseadas y que las especificaciones del proceso no afectan al producto final.
Los métodos analíticos deben ser validados antes de su introducción en el uso de rutina; y revalidados al cambio de las condiciones del método validado (por ejemplo, un instrumento con características diferentes o muestras con una matriz diferentes); al cambio en el procedimiento analítico que se encuentra fuera del alcance de aplicación inicial del método; al cambio en la síntesis del principio activo, al cambio de la composición del producto terminado. (29-33)
2.1.2.3.1 Razones que justifican la validación de métodos analíticos
Demostrar que los métodos son adecuados a los análisis propuestos en las condiciones descritas, la validación es la herramienta que permite obtener las pruebas documentales al respecto.
35 Trabajar con métodos validados, permite no sólo el conocimiento del método analítico, sino también cumplir con las exigencias legales tanto de registro de especialidades farmacéuticas como las buenas prácticas de laboratorio, con el fin de asegurar la calidad y eficacia del producto.
La validación es también un paso o requisito previo de los procesos de transferencia de métodos analíticos. (28)
2.1.2.3.2 Métodos susceptibles de ser validados
Son validables los métodos analíticos clasificados en la siguiente forma: Ensayos de identificación.
Ensayos para la determinación del analito de interés de una materia prima o de una especialidad farmacéutica.
Ensayos para la determinación de características farmacotécnicas inherentes. Ensayo de límite de impurezas y de cuantificación de impurezas.
Ensayo para la determinación de analitos en fluidos biológicos y en productos naturales.
Ensayos microbiológicos.(28)
2.1.2.3.3 Tipos de validación
a) Validación Prospectiva
36 b) Validación Retrospectiva
Se realiza cuando la idoneidad del método o proceso analítico se basa en la garantía constatada a través de los datos analíticos del producto ya comercializado, se aplica a métodos no validados previamente y de los que se tiene una amplia historia de resultados. (34)
c) Revalidación
La introducción de un cambio que pueda afectar la idoneidad del método analítico establecido por la validación, podrá exigir una nueva validación, es decir una revalidación total o parcial de dicho método analítico. Los criterios a estudiar se deciden en función del tipo de cambio efectuado.
Entre los motivos que exige una nueva validación tenemos: Cambios importantes en la matriz del producto. Cambios importantes en el método analítico. Cambios en las especificaciones. (34)
2.1.2.3.4 Características de desempeño analítico.
a. Exactitud
La exactitud está definida como la concordancia entre el resultado obtenido mediante el método elegido y el valor verdadero. La falta de exactitud puede ser por exceso o por defecto; las desviaciones por exceso suelen producirse cuando existen interferencias analíticas y la selectividad del método no es la adecuada obteniéndose valores superiores al valor verdadero; las desviaciones por defecto suelen darse en métodos analíticos muy laboriosos, con varias fases, extracciones, purificaciones, etc., que se traducen en una disminución de la recuperación.
37 Estadísticamente, suele efectuarse un test de “t” de student para determinar si el valor medio del error y valor considerado verdadero no difieren significativamente para un grado de probabilidad determinado.
Las pautas de validación de los métodos analíticos descritos por la ICH recomiendan que se evalúe realizando un mínimo de nueve determinaciones de tres niveles de concentración, cubriendo así, el intervalo especificado. (28)(31)(35)(36)
b. Precisión
La precisión de un método analítico es el grado de concordancia entre los valores de una serie repetida de ensayos analíticos efectuados sobre una muestra homogénea o expresado de otra forma, es la distribución de los valores analíticos alrededor de su media. La precisión de un método analítico habitualmente se expresa como la desviación estándar o la desviación estándar relativa de una serie de mediciones. (28)
Dentro del término precisión se pueden distinguir el grado de reproducibilidad o de repetibilidad del método analítico en condiciones normales de operación. En este contexto, la reproducibilidad se refiere a la medida de precisión de los resultados de un método analítico efectuado por laboratorios diferentes y en condiciones diferentes (diferentes analistas, equipos, días, etc.). Una precisión intermedia expresa la variación dentro de un laboratorio, por ejemplo en diferentes días, con diferentes analistas o con equipos diferentes dentro del mismo laboratorio.
La repetibilidad se refiere a la medida de la precisión de un método efectuado en las mismas condiciones, sobre la misma muestra, por el mismo analista, en el mismo laboratorio, con el mismo equipo y en el curso de la misma serie de análisis efectuados durante un periodo de tiempo corto.
38 Las pautas de validación de los métodos analíticos descritos por la ICH recomiendan que se evalúe la repetibilidad analizando un mínimo de nueve determinaciones que cubran el intervalo especificado para el procedimiento. (28)(31)(35)(36)
c. Selectividad
Se define como la capacidad para medir y/o identificar simultáneamente el analito en presencia de aquellos componentes cuya presencia resulta previsible, como impurezas, productos de degradación y componentes relacionados o productos de degradación que puedan estar presentes en la matriz.
La selectividad de un método analítico, se determina comparando los resultados de análisis de muestras conteniendo impurezas, siendo un parámetro crucial para conseguir una buena exactitud por lo que es, en todos los casos, un criterio clave.
Los estudios de selectividad varían según el método aplicado:
Métodos de identificación. Debe demostrar que el método funciona en presencia de otras sustancias que pueden interferir y de aquéllas de composición similar.
Ensayos de pureza. Debe garantizar que el método analítico permite la evaluación de impurezas cualitativa o cuantitativamente.
Determinación cuantitativa de un componente. Debe asegurar que la señal medida con el método analítico procede únicamente de la sustancia analizada sin interferencia de excipientes, productos de degradación y/o impurezas cuando se determina el contenido en principio activo u otro componente (conservador, antioxidante) en un medicamento.
39 grupo de muestras a preparar serían: matriz, analito, matriz + analito, matriz + analito + impurezas + productos de degradación.
La otra aplicación es utilizando pruebas confirmatorias con muestras sometidas a estrés para generar compuestos potencialmente interferentes, por lo cual, adquiere importancia para métodos que se desea evaluar la estabilidad de un principio activo o forma farmacéutica; estas condiciones, para lograr una degradación se somete a degradaciones de luz, humedad relativa, calor, hidrólisis ácida, hidrólisis básica y oxidación.
La selectividad se confirma cuando un pico de la absorbancia es puro y no hay ninguna interferencia del placebo en el tiempo de retención correspondiente al analito. (28)(35)(36)
d. Linealidad
La linealidad de un método analítico incluye la proporcionalidad entre la concentración del analito y su capacidad de respuesta, así como el intervalo de concentraciones del analito para los cuales el método es satisfactorio. La linealidad se relaciona además, con la sensibilidad de calibrado (representación gráfica del cociente entre la señal del analito y la señal del patrón frente a la concentración de analito de los patrones).
La determinación de la linealidad se realiza calculando la curva de calibración que relaciona respuesta (áreas, alturas, absorbancias, etc.) con una concentración de analito determinado. Generalmente se pretende obtener una recta de calibración, determinándose los parámetros de la recta de regresión; para algunos casos, la obtención del parámetro de linealidad entre la respuesta de un analito y su concentración, se tienen que someter a una transformación matemática. Los datos obtenidos a través de la línea de regresión pueden ser útiles para proporcionar estimaciones matemáticas del grado de linealidad. Se debería presentar el coeficiente de correlación, la intersección del eje de ordenadas, la pendiente de la línea de regresión y la suma de los cuadrados residuales.
40 e. Intervalo
El intervalo del procedimiento se valida verificando que el procedimiento analítico proporciona precisión, exactitud y linealidad aceptables cuando se aplica a muestras que contienen el analito en los extremos del intervalo, al igual que dentro del intervalo. (37)
2.1.2.3.5 Datos Requeridos para la Validación
Los requisitos de las pruebas farmacopeicas varían desde determinaciones analíticas muy rigurosas hasta evaluaciones subjetivas de atributos. Considerando esta amplia variedad, es lógico que diferentes procedimientos de prueba requieran diferentes esquemas de validación.
Las categorías de prueba más habituales para las que se exigen datos de validación se indican a continuación: (37)
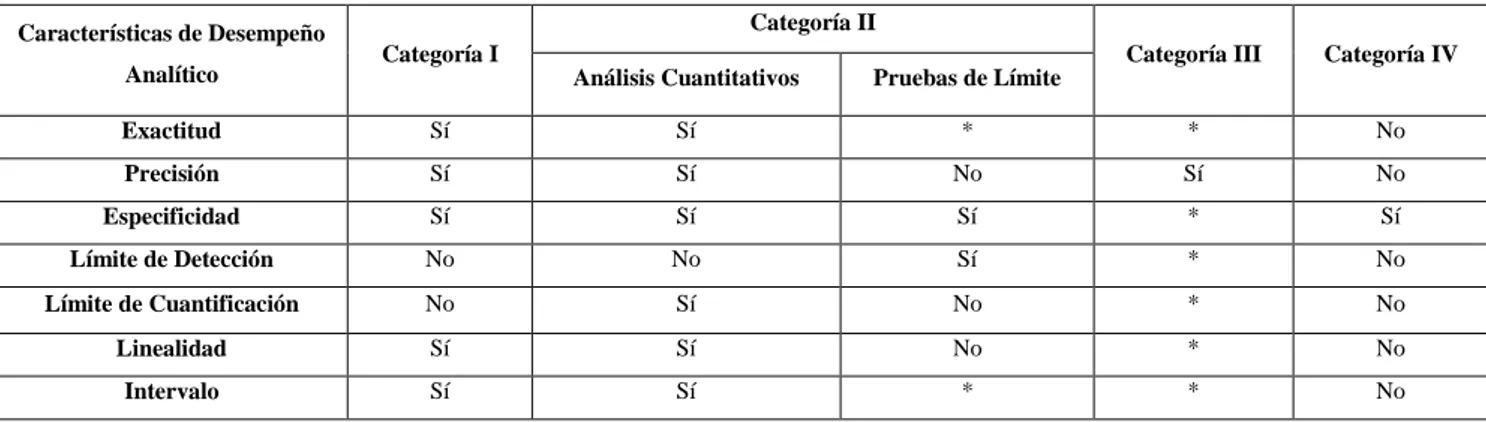
Categoría I: Procedimientos analíticos para la cuantificación de los componentes principales de fármacos a granel o ingredientes activos (incluyendo conservantes) en productos farmacéuticos terminados.
Categoría II: Procedimientos analíticos para la determinación de impurezas en fármacos a granel o productos de degradación en productos farmacéuticos terminados. Estos procedimientos incluyen análisis cuantitativos y pruebas de límite.
Categoría III: Procedimientos analíticos para la determinación de las características de desempeño (p.ej. disolución, liberación de fármacos, etc.).
Categoría IV: Pruebas de identificación.
41
Tabla 3. Datos requeridos para la validación de técnicas analíticas
Características de Desempeño
Analítico Categoría I
Categoría II
Categoría III Categoría IV Análisis Cuantitativos Pruebas de Límite
Exactitud Sí Sí * * No
Precisión Sí Sí No Sí No
Especificidad Sí Sí Sí * Sí
Límite de Detección No No Sí * No
Límite de Cuantificación No Sí No * No
Linealidad Sí Sí No * No
Intervalo Sí Sí * * No
*Pueden Requerirse, dependiendo de la naturaleza de la prueba específica. (USP 36)
2.2. DEFINICIONES OPERACIONALES
2.2.1 Variables Independientes.
Cuantificación de Permetrina.
2.2.2 Variables Dependientes.
42
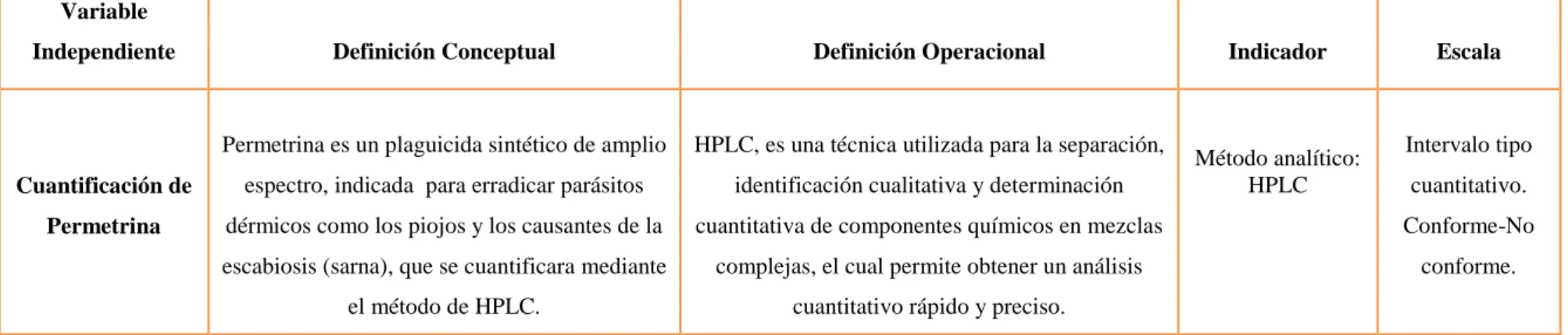
Tabla 4:Variable Independiente
Variable
Independiente Definición Conceptual Definición Operacional Indicador Escala
Cuantificación de Permetrina
Permetrina es un plaguicida sintético de amplio
espectro, indicada para erradicar parásitos
dérmicos como los piojos y los causantes de la
escabiosis (sarna), que se cuantificara mediante
el método de HPLC.
HPLC, es una técnica utilizada para la separación,
identificación cualitativa y determinación
cuantitativa de componentes químicos en mezclas
complejas, el cual permite obtener un análisis
43
Tabla 5: Variable Dependiente
Variables Dependientes
Definición Conceptual Definición Operacional Indicador Escala
Validación de
un proceso específico
coherentemente
producirá un producto
que cumpla sus datos
específicos
predeterminados y
atributos de calidad,
utilizando la
medir y/o identificar el analito en presencia
de aquellos componentes cuya presencia
resulta previsible, como impurezas, etc
Solución estándar [0,5mg/ml]
Linealidad:
Proporcionalidad entre la concentración del
analito y su capacidad de respuesta.
Se trabajará a concentraciones de 50%,
75%, 100%, 125%, 150%
r= indica el grado de correlación entre “x” y “y”. Si “r” es cercano a la unidad significa que
existe correlación con una probabilidad
elevada.
r2= Expresa la proporción de la variación total de “Y” explicada por el modelo lineal.
Selectividad
Coeficiente de Correlación (r)
44
Precisión:
Grado de concordancia entre los valores de
una serie repetida de ensayos analíticos.
CV(%)=expresa la relación entre la lectura
o respuesta y la concentración.
Estudia la variabilidad del método
efectuando una serie de análisis sobre la
misma muestra pero en condiciones
operativas diferentes.
Exactitud:
Concordancia entre el resultado obtenido
mediante el método elegido y el valor
verdadero
%R= Determina la fracción de analito adicionada a una muestra de prueba
(muestra fortificada o adicionada) previa al análisis
Precisión
Repetibilidad del Sistema: estudia la variabilidad
debida únicamente al instrumento.
Repetibilidad del Método: El ensayo se efectúa
sobre una muestra homogénea.
El % de recuperación promedio
45
Se utiliza el test de student para confirmar la recuperación del estudio.
Determina si las varianzas son homogéneas,
es decir si el factor de concentración no
influye en la variabilidad de resultados.
Se trabajará con concentraciones al 50%,
100% y 150%
Test de recuperación promedio y el 100% y n-1
Grados de Libertad
Según farmacopea estadunidense 36, y normas ICH
T exp. < T tabla (2,306)
46 2.3. HIPÓTESIS
48 3.1 METODOLOGÍA
3.1.1 Método de Investigación
a) De acuerdo al tipo de estudio:
Experimental: Porque existirá manipulación deliberada de variables, con el fin de investigar las posibles relaciones causa – efecto.
b) De acuerdo al periodo en que se capta la información:
Prospectiva: Porque se registrará la información según van ocurriendo los fenómenos.
c) De acuerdo a la evolución del fenómeno estudiado:
Transversal: Porque se estudiarán las variables simultáneamente en un determinado momento.
d) De acuerdo con la comparación de las poblaciones:
Descriptivo: porque se estudiará solo a una población, la cual se pretenderá describir en función de un grupo de variables.
e) De acuerdo con la interferencia del investigador en el fenómeno que se analiza:
49 3.1.2 Población y Muestra.
3.1.2.1 Población
SHAMPOO DE PERMETRINA 1%, fabricado en Laboratorios Portugal S.R.L.
3.1.2.2 Muestra
3.1.2.2.1 Tipo de muestreo. Aleatorio al azar.
3.1.2.2.2 Tamaño de la muestra
Se utilizó la fórmula para cálculo de datos globales:
Donde:
N: es el tamaño de la población o universo. k: Constante que depende del nivel de confianza. e: es el error muestral deseado, en tanto por uno.
50 3.1.2.2.3 Identificación de muestra
Las muestras se rotularon con la siguiente información: nombre del producto, lote, fecha de muestreo y nombre del muestreador.
3.1.2.2.4 Procesamiento de muestra
Las muestras se almacenaron en la sección del área de Desarrollo y Validación de Técnicas Analíticas, en un ambiente cerrado y protegido de la luz (si se considera necesario) hasta su respectivo análisis.
3.1.2.3 Placebo
Se preparó de acuerdo a su respectiva fórmula cuali-cuantitativa, 300ml de placebo del producto Shampoo de Permetrina 1%, el cual fue sumistrado en su totalidad al área de Desarrollo y Validación de Técnicas Analíticas.
Uso del placebo: Determinar si el producto tiene o no impurezas y si interviene con el principio activo.
3.1.3 PARTE EXPERIMENTAL
3.1.3.1 DESARROLLO Y VALIDACIÓN DE LA TÉCNICA ANALÍTICA
Departamento de Control
de Calidad PROTOCOLO DE VALIDACION DE
METODOS ANALITICOS VERSION: 01 PVT – 0304 - GEN
4.1 Desarrollo de la técnica analítica.
51 4.3.1 Preparación de fase móvil.
4.3.2 Preparación de solución estándar. 4.3.3 Preparación de solución prueba. 4.3.4 Ensayo de aptitud del sistema. 5. Parámetros de validación.
5.1 Desarrollo de los parámetros de validación. 5.1.1 Selectividad de la técnica analítica.
5.1.1.1Interferencia del método.
5.1.1.2Prueba de estresamiento de muestras. 5.1.2 Linealidad de la técnica analítica.
5.1.2.1Linealidad del sistema. 5.1.2.2Linealidad método analítico. 5.1.3 Exactitud de la técnica analítica. 5.1.4 Precisión de la técnica analítica. 5.1.5 Robustez de la técnica analítica. 5.1.6 Intervalo de la técnica analítica. 5.2 Resultados
5.2.1 Aptitud del Sistema
5.2.2 Selectividad de la técnica analítica. 5.2.3 Linealidad de la técnica analítica.
52 1. Objetivo
Establecer y demostrar que el método analítico para la valoración del analito Permetrina por cromatografía líquida de alta resolución, cumpla con las características de desempeño: selectividad, precisión, linealidad, exactitud, rango y robustez, cumpliendo en forma consistente y repetitiva las especificaciones establecidas, proporcionando resultados confiables.
2. Alcance
El Protocolo de Validación tiene por alcance realizar la valoración de todos los productos que tengan en su composición como analito Permetrina, y estén fabricados bajo la misma fórmula cuali-cuantitativa.
3. Método de Validación 3.1 Tipo de Validación
Se aplica la validación de tipo PROSPECTIVA al método analítico.
4. Técnica Analítica
La técnica analítica descrita se desarrolló y validó por Cromatografía Líquida de Alta Resolución (HPLC).
4.1 Desarrollo de la técnica analítica
Para armar la técnica analítica se procedió a desarrollar una serie de parámetros, con la finalidad de encontrar los adecuados y más afines al principio activo a evaluar.
De acuerdo a la naturaleza del principio activo, soluble en metanol, se preparó una fase móvil a base de metanol y agua en una proporción de 83:17 v/v descartándose así cualquier precipitación de la muestra dentro del equipo. Posteriormente se seleccionó la columna cromatográfica Nucleosil 100 C18 de 125mm x 4,0mm x 5m, permitiendo de esta manera una mejor separación de los compuestos.
53 Por último se preparó la muestra de Permetrina y se realizó el ensayo para seleccionar el volumen de inyección, flujo adecuado y estimar el tiempo de retención para los picos del principio activo. Una vez determinados estos parámetros se procedió a realizar la validación de la técnica analítica.
4.2 Materiales, Reactivos, Producto de referencia y Equipos
Materiales:
Pipetas graduadas de 1mL. Vaso de precipitado de 250mL. Probeta de 1000mL.
Probeta de 100mL.
Frascos vidrio con tapa azul de 2000mL. Fiolas de 5mL y 10mL.
Fiolas de 25mL y 20mL. Fiolas de ámbar de 100mL.
Pipeta volumétrica de 1mL, 2mL, 3mL y 5mL. Viales para HPLC de color ámbar.
Jeringas de 10mL.
Membranas filtrantes con tamaño de poro de 0,45 µm.
Reactivos:
Metanol, grado gradiente para cromatografía líquida, marca MERCK. Lote: I664707.
Lote: I670207. Lote: I687507.
Hidróxido de sodio en pellets GR para análisis, marca MERCK. Lote: 0000015080.
Ácido Clorhídrico al 37% para análisis, marca MERCK. Lote: K44364917.
54 Agua grado HPLC.
Lote: No aplica.
Producto de referencia: Estándar:
Nombre del estándar: Permetrina. Tipo de estándar: Secundario. Código: SSTD-60-01-12. Lote: 1203047.
Fecha de vencimiento: 2014-06-30.
Potencia: Isómero Cis 27.89% e Isómero Trans 68.38%
55 HPLC – 005 Marca: HITACHI
Modelo: Chromaster Se encuentra equipado con:
Autosampler Serie 1102-023
Detector RI Serie 1104-007
56 COLUMNA: Nucleosil 100 C18 de 125mm x 4,0mm (5,0m)
Código 82 Lote 201309162
Marca Agilent Serie USM001870
Dimensiones 125mm x 4,0mm x 5,0m Otros ---
4.3 Procedimiento analítico:
Tomando en cuenta el siguiente sistema cromatográfico:
Se procedió de la siguiente manera: 4.3.1 Preparación de fase móvil:
Metanol y agua (83:17), filtrar y desgasificar con filtro de membrana de PVDF de 0,45 µm.
4.3.2 Preparación de solución estándar:
Calentar el estándar de Permetrina a 40°C, hasta que se disuelva, luego dejar enfriar a temperatura ambiente por 5 minutos. Posteriormente pesar 50,0mg de Permetrina, transferirlo a un matraz volumétrico de 100mL, agregar 90mL de metanol y llevar a volumen con agua. Concentración final aproximada de 0.5mg/ml de Permetrina.
4.3.3 Preparación de solución prueba:
Pesar el equivalente a 50mg de Permetrina (aproximadamente 5ml de la muestra) a un matraz volumétrico de 100ml, agregar 90ml de metanol y llevar a volumen con agua.
Concentración final aproximada de 0.5mg/ml de Permetrina.
Detector UV, 254 nm.
Columna Columna Nucleosil C18 100 de 125mm x 4,0mm x 5m Velocidad de flujo 1,3mL/minuto
Volumen de inyección
20 µL
Temperatura 25 ºC
%DSR no es más del 2% para inyecciones repetidas Tiempo de corrida 10 minutos aproximadamente.
Tiempo de retención
57 Filtrar una porción de la solución estándar y de la solución prueba a través de filtro de membrana de PVDF de 0,45 µm descartando los primeros mililitros del filtrado.
4.3.4 Ensayo de aptitud del sistema:
Preparar una solución estándar (ver punto 4.3.2). Filtrar e inyectar 5 veces como mínimo la solución estándar en el HPLC. Obtener cromatrograma respectivo [Anexo 1] y resultados de aptitud del sistema (ver punto 5.2.1.1).
5. Parámetros de validación
5.1 Desarrollo de los parámetros de validación 5.1.1 Selectividad de la técnica analítica.
Este ensayo se realizó con la finalidad de evaluar de manera inequívoca el analito en presencia de aquellos componentes, cuya presencia resulta previsible, tales como impurezas, productos de degradación y componentes de la matriz.
5.1.1.1 Interferencia del método Muestra 1: (Fase Móvil)
Proceder según preparación de fase móvil (ver punto 4.3.1) y filtrar por membrana PVDF de 0,45 µm en un vial de HPLC.
Muestra 2: (Placebo)
Transferir 5,0mL de placebo y proceder según la preparación de solución prueba
(ver punto 4.3.2)
Muestra 3: (Estándar de Permetrina)
Proceder según preparación de solución estándar (ver punto 4.3.2)
Muestra 4: (Muestra)
Proceder según la preparación de solución prueba (ver punto 4.3.3)
58 5.1.1.2 Prueba de estresamiento de muestras
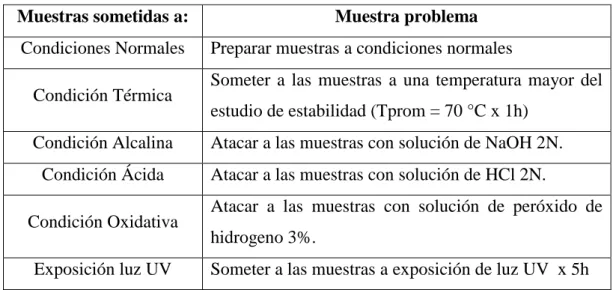
Una vez preparadas las muestras se someterán a las siguientes condiciones:
Tabla 6: Estresamiento de muestras
Preparación de las muestras:
Muestra a condiciones normales: transferir aproximadamente 5,0mL de la muestra (± 50,0mg de Permetrina) a un matraz volumétrico de 100mL, adicionar 90 mL de metanol y llevar a volumen con agua, mezclar. (Concentración final aproximada de 0,5mg/ml de Permetrina)
Muestra sometida a Degradación térmica: transferir aproximadamente 5,0mL de la muestra (± 50,0mg de Permetrina) a un matraz volumétrico de 100mL, adicionar 90 mL de metanol y llevar a 100ml con agua, mezclar. Luego llevar a baño maría a una temperatura de 70°C por una hora, dejar enfriar a temperatura ambiente y mezclar. (Concentración final aproximada de 0,5mg/ml de Permetrina)
Degradación alcalina: transferir aproximadamente 5,0mL de la muestra (± 50,0mg de Permetrina) a un matraz volumétrico de 100mL, adicionar 90 mL de metanol, 1mL de NaOH 2N, disolver y llevar a volumen con agua, mezclar. (Concentración final aproximada de 0,5mg/ml de Permetrina)
Muestras sometidas a: Muestra problema Condiciones Normales Preparar muestras a condiciones normales
Condición Térmica Someter a las muestras a una temperatura mayor del estudio de estabilidad (Tprom = 70 °C x 1h)
Condición Alcalina Atacar a las muestras con solución de NaOH 2N. Condición Ácida Atacar a las muestras con solución de HCl 2N.
Condición Oxidativa Atacar a las muestras con solución de peróxido de hidrogeno 3%.
59 Muestra sometida a Degradación ácida: transferir aproximadamente 5,0mL de la muestra (± 50,0mg de Permetrina) a un matraz volumétrico de 100mL, adicionar 90 mL de metanol, 1mL de HCl 2N, disolver y llevar a volumen con agua, mezclar.
(Concentración final aproximada de 0,5mg/ml de Permetrina)
Muestra sometida a Degradación oxidativa: transferir aproximadamente 5,0mL de la muestra (± 50,0mg de Permetrina) a un matraz volumétrico de 100mL, adicionar 90 mL de metanol, 1mL de H2O2 3%, disolver y llevar a volumen con agua, mezclar. (Concentración final aproximada de 0,5mg/ml de Permetrina)
Muestra sometida a Degradación por luz UV 254 nm: transferir aproximadamente 5,0mL de la muestra (± 50,0mg de Permetrina) a un matraz volumétrico de 100mL, adicionar 90 mL de metanol y llevar a volumen con agua, mezclar. Exponer a la luz UV 254 nm por 5 horas. (Concentración final aproximada de 0,5mg/ml de Permetrina)
Procedimiento:
*Preparar una solución estándar (ver punto 4.3.2). Filtrar e inyectar al sistema por quintuplicado como mínimo.
*Filtrar e inyectar todas las muestras por triplicado en el HPLC, obtener los cromatogramas respectivos [Anexo 3] y las áreas.
5.1.2 Linealidad de la técnica analítica.
Este ensayo se realizó con la finalidad de determinar la proporcionalidad entre la concentración del principio activo y su respuesta (áreas) y nos demuestra la capacidad que tiene el método de obtener resultados linealmente proporcionales a la concentración del principio activo en la muestra.
5.1.2.1 Linealidad del sistema
Se preparan 3 curvas de calibración correspondientes a 5 concentraciones que cubran el intervalo del analito (50%, 75%, 100%, 125% y 150%)
Preparación:
60 Tomar como referencia el peso del estándar al 100% y calcular el peso a las
diferentes concentraciones que formarán la curva de calibración. Estándar al 50%:
Calentar el estándar a 40°C hasta que se disuelva, luego dejar enfriar a temperatura ambiente por 5 minutos. Pesar luego aproximadamente 25,0mg de Permetrina, transferirlo a un matraz volumétrico de 100mL, agregar 90mL de metanol y llevar a volumen con agua. (Concentración final aproximada de 0,25mg/ml de Permetrina)
Estándar al 75%:
Calentar el estándar a 40°C hasta que se disuelva, luego dejar enfriar a temperatura ambiente por 5 minutos. Pesar luego aproximadamente 37,50mg de Permetrina, transferirlo a un matraz volumétrico de 100mL, agregar 90mL de metanol y llevar a volumen con agua. (Concentración final aproximada de 0,375mg/ml de Permetrina)
Estándar al 100%:
Calentar el estándar a 40°C hasta que se disuelva, luego dejar enfriar a temperatura ambiente por 5 minutos. Pesar luego aproximadamente 50,0mg de Permetrina, transferirlo a un matraz volumétrico de 100mL, agregar 90mL de metanol y llevar a volumen con agua. (Concentración final aproximada de 0,5mg/ml de Permetrina)
Estándar al 125%:
Calentar el estándar a 40°C hasta que se disuelva, luego dejar enfriar a temperatura ambiente por 5 minutos. Pesar luego aproximadamente 62,50mg de Permetrina, transferirlo a un matraz volumétrico de 100mL, agregar 90mL de metanol y llevar a volumen con agua. (Concentración final aproximada de 0,625mg/ml de Permetrina)
Estándar al 150%:
61 Permetrina, transferirlo a un matraz volumétrico de 100mL, agregar 90mL de metanol y llevar a volumen con agua. (Concentración final aproximada de 0,75mg/ml de Permetrina)
Procedimiento: Filtrar e inyectar los 15 estándares preparados por triplicado en el HPLC, de preferencia colocarlos en sentido creciente a la concentración.
Obtener las áreas y los cromatogramas respectivos [Anexo 4].
5.1.2.2 Linealidad método
Se preparan 3 curvas de calibración correspondientes a 5 concentraciones que cubran el intervalo del analito en la muestra (50%, 75% 100%, 125% y150%) Preparación:
Proceder a preparar las muestras (el cual será el 100%) de manera independiente (ver punto 4.3.3).
Tomar como referencia el peso de la muestra al 100% y calcular el peso a las diferentes concentraciones que formarán la curva de calibración.
Muestra al 50%:
Pesar aproximadamente 2,5mL de la muestra (± 25,0mg de Permetrina) llevar a un matraz volumétrico de 100mL, adicionar 90mL de metanol llevar a volumen con agua y mezclar. (Concentración final aproximada de 0,25mg/ml de Permetrina)
Muestra al 75%:
Pesar aproximadamente 3,75mL de la muestra (± 37,5mg de Permetrina) llevar a un matraz volumétrico de 100mL, adicionar 90mL de metanol llevar a volumen con agua y mezclar. (Concentración final aproximada de 0,375mg/ml de Permetrina)
Muestra al 100%:
62 Muestra al 125%:
Pesar aproximadamente 6,25mL de la muestra (± 62,5mg de Permetrina) llevar a un matraz volumétrico de 100mL, adicionar 90mL de metanol llevar a volumen con agua y mezclar. (Concentración final aproximada de 0,625mg/ml de Permetrina)
Muestra al 150%:
Pesar aproximadamente 7,5mL de la muestra (± 75,0mg de Permetrina) llevar a un matraz volumétrico de 100mL, adicionar 90mL de metanol llevar a volumen con agua y mezclar. (Concentración final aproximada de 0,75mg/ml de Permetrina)
Procedimiento:
Preparar una solución estándar (ver punto 4.3.2). Filtrar e inyectar por triplicado en el HPLC.
Filtrar e inyectar las 15 muestras preparados por triplicado en el HPLC, de preferencia colocarlos en sentido creciente a la concentración.
Obtener las áreas de cada inyección y los cromatogramas respectivos [Anexo 5].
5.1.3 Exactitud de la técnica analítica.
Este ensayo se realizó con la finalidad de determinar la proximidad entre los resultados obtenidos y el valor verdadero.
Preparar 3 curvas de calibración correspondientes a 3 concentraciones que cubran el intervalo del analito (50%, 100% y 150%).
Preparación de las 9 muestras: Preparar por triplicado las muestras, para lo cual se pesa cantidades conocidas de analito que cubran los tres niveles de la curva (50%, 100% y 150%).
Estándar + Placebo al 50%:
63 Estándar + Placebo al 100%:
Pesar en un matraz volumétrico de 100mL, aproximadamente 50mg de estándar de referencia de Permetrina y 5,0mL de placebo, agregar 90mL de metanol y llevar a volumen con agua.
Estándar + Placebo al 150%:
Pesar en un matraz volumétrico de 100mL, aproximadamente 75mg de estándar de referencia de Permetrina y 7,5mL de placebo, agregar 90mL de metanol y llevar a volumen con agua.
Procedimiento:
Preparar una solución estándar (ver punto 4.3.2). Filtrar e inyectar por quintuplicado en el HPLC.
Filtrar e inyectar las 9 muestras preparadas por triplicado en el HPLC, de preferencia colocarlos en sentido creciente a la concentración.
Obtener las áreas de cada inyección y los cromatogramas respectivos tanto del estándar y de las muestras [Anexo 6].
5.1.4 Precisión de la técnica analítica.
Este ensayo se realizó con la finalidad de determinar el grado de concordancia entre los resultados de las pruebas individuales cuando se aplica el procedimiento repetidamente a múltiples muestreos de una muestra homogénea.
5.1.4.1 Repetibilidad del sistema
Preparar una solución estándar (ver punto 4.3.2).
Procedimiento:
Filtrar e inyectar 6 veces la solución estándar.