UNIVERSIDAD AUTONOMA DE NUEVO LEON
FACULTAD DE CIENCIAS QUIMICAS
División de Estudios Superiores
Evaluación de la Persistencia de la Toxicidad de
Extractos de Fermentación de
Bacillus thuringiensis Almacenados por Largos
Periodos Contra Trichoplusia ni
T E S T S
Presentada como Requisito Parcial para
obtener el grado de:
MAESTRO EN CIENCIAS
Especialidad en:
| | j MICROBIOLOGIA INDUSTRIAL
p O r i
ra HEUODORO O. DELA GARZA TOLEDO
UNIVERSIDAD AUTONOMA DE NUEVO LEON
FACULTAD DE CIENCIAS QUIMICAS
División de Estudios Superiores
Evaluación de la Persistencia de la Toxicidad de
Extractos de Fermentación de
Bacillus thuringiensis Almacenados por Largos
Períodos Contra Trichoplusia ni
T E S I S
Presentada como Requisito Parcial para
obtener el grado de:
MAESTRO EN CIENCIAS
Especialidad en:
MICROBIOLOGIA INDUSTRIAL
Por:
V
<7
UNIVERSIDAD AUTONOMA DE NUEVO LEON FACULTAD DE CIENCIAS QUIMICAS DIVISION DE ESTUDIOS SUPERIORES
DR. ERARDO ELIZONDO VILLARREAL COORDINADOR DE LA ESCUELA
DE GRADUADOS EN CIENCIAS P R E S E N T E .
M e d i a n t e e s t e c o n d u c t o h a c e m o s d e su conocimiento que la tesis elaborada por el Sr. HELIODORO O. DE LA GARZA TOLEDO, titulada:
EVALUACION DE PERSISTENCIA DE LA TOXICIDAD DE EXTRACTOS DE F E R M E N T A C I O N DE B a c i l l U S t h u r i n q i e n s Í 3 A L M A C E N A D O S POR LARGOS PERIODOS CONTRA TrichODlusia ni.
ha sido aceptada como requisito parcial para obtener el grado académico de:
MAESTRO EN CIENCIAS, ESPECIALIDAD MICROBIOLOGIA INDUSTRIAL en virtud de haber cumplido íntegramente con el reglamento de tesis vigente.
A t e n t a m e n t e El Comité Dictamin»rtnr
MC. LUIS J. GALAN WONG ASESOR
Vo.Bo
A G R A D E C I M I E N T O S
A mi asesor el M.C. Luis J. Galán W. , por su apoyo y entusiasmo, que fueron fundamentales para la realización de este trabajo.
Al Ing. Víctor H. Castro Tavares y sus asistentes, por su ayuda en el análi-sis estadístico de los resultados.
A la QFB. Sachiko Leo Wong, por su va-liosa participación en los bioensayos.
A MIS PADRES:
A MI ESPOSA:
A MIS HIJOS:
HELIODORO DE LA GARZA CEPEDA JULIETA TOLEDO ROJAS
CAROLINA CAMPOS MENDEZ
OBJETIVO GENERAL
EVALUACION DE PERSISTENCIA DE LA TOXICIDAD DE EXTRACTOS DE F E R M E N T A C I O N D E B a c i l l u s t h u r i n a i e n s i s A L M A C E N A D O S POR LARGOS PERIODOS CONTRA Trichoplusia ni.
OBJETIVOS ESPECIFICOS:
1Q DETERMINAR LA TOXICIDAD DE EXTRACTOS DE FERMENTACION DE CEPAS DE Bacillus thurinaiensis ALMACENADOS POR MAS DE 10 AÑOS.
HIPOTESIS:
RELACION DE ABREVIATURAS UTILIZADAS. UANL = Universidad Autónoma de Nuevo León
FCB = Facultad de Ciencias Biológicas T. ni = Trichoplusia ni
Var. « Variedad
B.t. = Bacillus thurinqiensis
I. C. of I. P. and M.C.= Coloquio Internacional de Patología de Invertebrados y
Control Biológico. Ext.= Extracto.
Conc.= Concentración.
H D = C l a v e i n i c i a l p a r a d e f i n i r f o r m u l a c i o n e s d e extractos de fermentación. Ejem. HD-73
ug = Microgramos. KDa » Kilodalton. m i = Mililitro.
D L5 0 = Dosis letal media.
Vs. m contra.
U.I. = Unidades Internacionales. mg. = Miligramos.
S.C. - Suma de cuadrados. G.L. = Grados de libertad. C.M. = Cuadrado medio. F = Factor de tabla. F.C. = Factor calculado. NS. = No significativo. * = Significativo.
INDICE
RESUMEN
INTRODUCCION
1.1.- Antecedentes
1.2.- Historia del B.t.
1.3.- Clasificación de los B.t, 1.4.- Los cristales de B.t. 1.5. Mecanismos de acción de
-la s-endotoxina.
1.6.- Medios de fermentación. 1.7.- Los extractos de f e r m e n —
tación.
1.8.- Estandarización de bioin-secticidas.
1.9.- El T.ni. MATERIALES Y METODOS
2.1.- Selección de los ext. 2.2.- Bioensayos.
2.3.- Cuantificación de esporas viables.
2.4.- Observación de los c r i s — tales al microscopio. 2.5.- Evaluación de los r e s u l —
tados.
2.5.1.- Determinación del por ciento de mortalidad. 2.5.2.- Diseño estadístico. 2.5.3.- Determinación de la
D L5 0 y potencia.
RESULTADOS
CONCLUSION Y DISCUSION LITERATURA CONSULTADA APENDICE
página. . . . . 1
PAGINA
TABLA No. Clasificación de Serovariedades
de B.t. . . . TABLA No. 2.- Relación de extractos de
fermen-tación de B.t. analizados y años
de producción. 21 TABLA No. 3.- Análisis de varianza de la
rela-ción extractos-concentraciones. . . . 34 TABLA No. 4.- Análisis de Varianza para un
Di-seño de Bloques al Azar 34 TABLA No. 5.- Prueba de Duncan para análisis de
extractos del diseño de Bloques
-al Azar. 35 TABLA No. 6.- Prueba de Duncan para análisis de
concentraciones del diseño de
Blo-ques al Azar. 36 TABLA No. 7. Análisis de Varianza del Diseño
-de Bloques al Azar, -de
extractos-Vs. concentraciones seleccionados. . 36
TABLA No. 8.- Conclusiones de la Prueba de
Duncan para extractos. 37 TABLA No. 9.- Conclusiones de la Prueba de
Dun-can para concentraciones 37 TABLA No.10.- Conclusión final del análisis
es-tadístico de mortalidad de Ext-Conc . 37 TABLA No.11.- Porciento de mortalidad promedio de
los Ext. más potentes. 38 TABLA No.12.- Porciento de mortalidad de tres Ext.
en bioensayos de 25 repeticiones. . . 38 TABLA No.13.- Porcentaje de mortalidad promedio
de los extractos de fermentación
de B.t. 39 TABLA No.14.- concentración de datos estadísticos
TABLA No.15.- Comparación de valores de D L5 Q de
diferentes extractos. 41 TABLA No.16.- Comparación de las Dosis Letal M e —
dia de los extractos más activos. . . 42 TABLA No.17.- Valores de la Potencia de los Ext. . 43 TABLA No.18.- Potencia de extractos superiores a
1,000 Ul/mg. 44 TABLA No.19.- Potencia de extractos superiores a
10,000 Ul/mg. 44 TABLA No.20.- Relación de Potencias y valores de
Dosis Letal Media. 45 TABLA No.21.- Potencias de extractos en
diferen-tes años de Producción 46 TABLAS No.22-39.- Valores promedios de porcientos
de mortalidad de los Ext 68-76 TABLA No.4 0.- Concentración de datos de la
inter-acción Ext-Conc. 77 TABLA No.41,41a,41b.- Cálculos para Prueba de
Dun-can para Ext. 78-82 TABLA No.42,42a,42b.- Cálculos para Prueba de
Dun-can de Conc. 83-84 TABLA No.43.- Cuadro de concentración de datos de
Ext-Conc. seleccionados 84 TABLA No.44,44a,44b.- Cálculos de la Prueba de
Dun-can para Ext. seleccionados.. 85-86 TABLA No.45,45a,45b.- Cálculos de la Prueba de
Dun-can para Conc. 86-87 TABLA No.46.- Porciento de mortalidad de los
estándares. 87 TABLA No.47.- Ejemplo de cálculo de valores de
INDICE DE GRAFICAS Y FIGURAS
página FORMULA l.- Preparación de Dieta para las Larvas
de T. ni. . . . 66
GRAFICA 1.- Potencias de Ext. de fermentación. . . . 51 GRAFICA 2. Potencias de extractos de B.t. con
-valores superiores a las 1,000 Ul/mg . . . 52 GRAFICA 3. Potencias de extractos de B.t. con
-valores superiores a las 10,000 Ul/mg. . . 53 GRAFICA 4.- Valores promedios de DL^q (ppm) de
-los extractos de B.t. var. kurstaki
contra T.ni 54
0
55 GRAFICA 6, 6a.- Efecto de la concentración (ppm)
de los extractos seleccionados
RESUMEN
análisis Probit, la Dosis Letal Media (ug. de extractos/ mi. de dieta) y la potencia tóxica (U.I./mg.). Los resultados obtenidos mostraron que la actividad insecticida de los extractos de B. t. varió ampliamente de una cepa a otra aunque pertenecieran a la misma variedad, así mismo cepas iguales fermentadas en diferentes medios durante distintos años presentaron toxicidades significativamente diferentes. Sin embargo 5 extractos pertenecientes a las cepas 1, HD-183, HD-187 y HD-203 de la var. kurstaki y un extracto de la cepa HD-184 de la var. gallieriae presentaron altos grados de mortalidad semejante unos a otros a concentraciones de
I.-INTRODUCCION 1.1- Antecedentes.
El hombre a luchado contra las plagas desde los inicios de la civilización. Al empezar a cultivar la tierra, sus co-sechas fueron constantemente mermadas por la presencia de inumerables plagas que consumían, destruían o competían en los cultivos con pérdidas en los productos agrícolas.
De todas las plagas cabe destacar a los insectos, debido a su agresividad, su inmensa variedad de especies, su facilidad para crear resistencia a los compuestos químicos apiicados en su contra (1) , a la gran cantidad de cosechas que afectan y las enormes pérdidas económicas que ocasionan.
Por lo tanto es de esperarse que la mayor cantidad y variedad de plaguicidas que se han usado sea precisamente en contra de los insectos.(1)
Durante la primera parte del siglo XX se incrementó el uso de los insecticidas, incorporándose nuevos compuestos como el Flúor y productos botánicos, desde 192 0 surgió la preocupación sobre los residuos ocasionados por el empleo cada vez mayor de los plaguicidas.
En 1939 se d i ó a c o n o c e r u n d e s c u b r i m i e n t o q u e revolucionó el desarrollo de los insecticidas, en ese año se descubrió el valor insecticida del DDT y su aplicación durante la Segunda Guerra Mundial demostró el potencial que tenían los compuestos orgánicos como armas para el control de plagas.(2)
Desde entonces y para el mismo fin se han producido miles de sustancias químicas orgánicas principalmente de las
familias de los organoclorados, los organofosforados, los carbámicos, los nitrofenoles y últimamente los piretroides
( 2 ) .
Sin e m b a r g o con el p a s o d e l t i e m p o se a c u m u l a r o n pruebas de los daños que se ocasionan por el uso masivo e irracional de estos plaguicidas, hoy en la actualidad se consideran como sus principales defectos los siguientes:
- Su alta residualidad en el medio ambiente.
- Su potencial mutagénico capaz de crear resistencia en las especies atacadas.
- Su alta toxicidad a humanos y mamíferos en general. - Su amplio rango de acción que ocasiona la destrucción
La constante investigación del ser humano ha conducido a la obtención de nuevos productos que han disminuido estos efectos; tal como los piretroides o bien el de buscar otras opciones que sean más compatibles con la naturaleza como es el C o n t r o l B i o l ó g i c o . D e n t r o de e s t a n u e v a r a m a d e la Ciencia que implica el uso de seres vivos o sus productos en el c o n t r o l de p l a g a s , se i n c l u y e el u s o d e c o m p u e s t o s producidos por microorganismos que sean capaces de dañar a
los insectos (1).
A c t u a l m e n t e se c o n c e n c e r c a de 2 , 0 0 0 e s p e c i e s y v a r i e d a d e s d e b a c t e r i a s , v i r u s , h o n g o s , p r o t o z o a r i o s y nemátodos que presentan patogenicidad contra insectos (3).
De t o d o s e l l o s , el d e s a r r o l l o m á s s i g n i f i c a t i v o ha o c u r r i d o c o n la b a c t e r i a B a c i l l u s t h u r i n a i e n s i s principalmente por su acción reconocida contra Lepidópteros, Dípteros y recientemente contra Coleópteros (3).
1.2- Historia del Bacillufl thurinaiensis.
Bacillus thuringiensis se ha estudiado intensamente en las ú l t i m a s t r e s d é c a d a s d e b i d o a s u s c a r a c t e r í s t i c a s para el control de insectos.
identificación no fue completa; y fue en 1911 en Alemania donde Berliner aisló esta bacteria de la palomilla del Mediterráneo (Anaasta kuehniella), propone posteriormente el nombre de Bacillus thurinaiensis con el que hasta hoy se le conoce. Berliner y Mattes en estudios y épocas separadas observaron que las células de estas bacterias contenían además de la espora oval, un segundo cuerpo que Berliner llamó "Restekorper" o cuerpo de desecho, muchos años después
(19 5 3 ) el c a n a d i e n s e H a n n a y u t i l i z a n d o u n m i c r o s c o p i o electrónico confirmó las observaciones anteriores y encontró unos cuerpos paraesporales en forma de diamantes que llamó cristales.
Este mismo investigador propuso que los cristales, al encontrarse en el intestino de las larvas de Lepidópteros, e s t a b a n r e l a c i o n a d o s con la f o r m a c i ó n d e u n a s u s t a n c i a tóxica que inducía la aparición de septicemia en estas larvas. ( 4 )
B a c i l l u s t h u r i n a i e n s i s es u n a b a c t e r i a q u e se caracteriza por su habilidad natural para producir cuerpos p a r a e s p o r a l e s en forma de c r i s t a l e s y de p o d e r m a t a r
insectos especialmente durante su vida larvaria (5).
resistencia por parte de los insectos perjudicados, salvo en el caso de una utilización intensiva, como en los silos. (8)
A pesar de que desde 1960 se ha impulsado lo que Rachel C a r s o n t i t u l ó "La otra v í a " en su l i b r o L a P r i m a v e r a Silenciosa, que consiste en aplicar un enfoque biológico b á s i c a m e n t e no q u í m i c o p a r a c o n t r o l a r l o s i n s e c t o s p e r j u d i c i a l e s (7), no e s p o s i b l e q u e los p l a g u i c i d a s biológicos puedan reemplazar de manera significativa a los plaguicidas químicos en los próximos 10 años. Sin embargo a mediano plazo, la importancia de los bioplaguicidas será cada vez más importante. (8)
1.3- Clasificación de los Bacillus thurinaiensia.
Los bacilos esporulados se dividen en dos grupos según su relación con el oxígeno atmosférico: El género Bacillus que incluye las formas aerobias y el género Clostridium que agrupa a las anaerobias.
Según la nueva clasificación en el manual de Bergey para d e t e r m i n a r b a c t e r i a s e x i s t e n 22 e s p e c i e s de B a c i l l u s perfectamente bien definidas.
La mayor parte de las especies de Bacillus son formas saprofitas del suelo y algunas de ellas suelen ser patógenas para los insectos por lo que se ha desarrollado un creciente
interés para usarlos en el control de plagas. (9).
insecticida contra Lepidópteros se encuentra el Bacillus thurinqiensis la cual presenta propiedades adecuadas para utilizarse como un producto comercial, motivo por el cual es el que más se ha estudiado y el que más se ha aplicado sobre los cultivos en los últimos 20 años.
Las diferencia mostradas por los B.t. en cuanto a la capacidad para destruir sólo ciertas larvas de insectos implicó la necesidad de crear un método de clasificación capaz de agrupar a todas las variedades de esta bacteria.
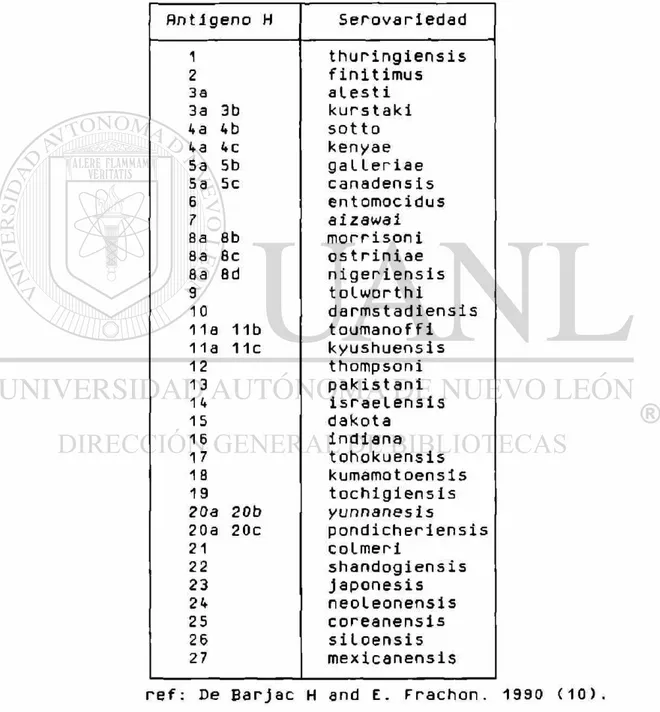
P a r a lograr esta c l a s i f i c a c i ó n se h a n u t i l i z a d o diversos métodos basados en sus propiedades morfológicas, b i o q u í m i c a s y f i l o g e n é t i c a s , sin e m b a r g o a c t u a l m e n t e la m a n e r a m á s s e n e i 1 l a y e s p e c í f i c a de c l a s i f i c a r a e s t a s bacterias es la serotipif icación, la cual se basa en la especificidad y estabilidad del antígeno H y se complementa en función de su patogenecidad ante un tipo de insecto determinado y en pruebas bioquímicas y genéticas (10) .
En la t a b l a No. 1 se m u e s t r a n las 27 v a r i e d a d e s y sus subgrupos aceptadas hasta 1990 de B.t. así como su
serotipo correspondiente.
Tabla No. 1.- c i a s i f i c a c i d n d e
Serovariedades
de Ej_ t h u r l n a i e n s i sflntigeno H S e r o v a r i e d a d 1 t h u r i n g i e n s i s 2 f i n i t i m u s
3d a l e s t i
3a 3b kurs t aki
4a 4b sot to
4a 4C k e n y a e 5a 5b ga L l e r i a e 5a 5c c a n a d e n s i s 6 e n t o m o c i d u s 7 a i z a w a i 8a 8b m o r r i s o n i 8a 8c o s t r i n i a e 8a 8d n i g e r i e n s i s 9 t o l w o r t h i
10 d a r m s t a d i e n s i s 11a 11b t o u m a n o f f i 11a 11c k y u s h u e n s i s 12 t h o m p s o n i 13 P a k i s t a n i 1 4 i s r a e l e n s i s 15 d a k o t a
16 I n d i a n a 17 t o h o k u e n s i s 1 8 k u m a m o t o e n s i s 19 t o c h i g i e n s i s
20a 20b
yunnanesis
20a 20c p o n d i c h e r i e n s i s 21 c o l m e r i
22 s h a n d o g i e n s is 23 j a p o n e s i s 24 n e o l e o n e n s i s 25 c o r e a n e n s i s 26 s i l o e n s i s 27 m e x i c a n e n s i s
1.4.- Los Cristales de Bacillus thurinaiensis.
Durante la esporulación de algunas de estas bacterias se produce una inclusión en forma de cristal compuesta de proteínas tóxicas llamadas s-endotoxina, la cual actúa en el
instestino de las larvas que la han ingerido (12).
Los genes de B.t. para formar las principales proteínas con propiedades insecticidas se han clonado y secuenciado conociéndose la relación de nucleótidos de muchos de ellos. Hofte y Whiteley (1989) identificaron 14 distintas clases de genes que codifican para la s-endotoxina; 13 de estos genes
fueron llamados "Cry" (codificantes de proteínas de 65 a 130 KDa) , la secuencia de aminoácidos en éstos mostraron un c o n s i d e r a b l e g r a d o de h o m o g e n e i d a d a p e s a r de q u e sus p r o t e í n a s p r e s e n t a n d i f e r e n t e g r a d o d e t o x i c i d a d c o n t r a diferentes órdenes de insectos. El catorceavo tipo de gene es diferente a los genes "Cry" y tiene un rango de toxicidad más amplio contra insectos y se le ha llamado "cyT" (Cristal Proteico Citolítico) de 27 KDa. Sin embargo, ambos tipos de toxinas presentan características en común: las dos son tóxicas solamente a un pequeño rango de larvas de insectos v i v o s . R e q u i e r e n de pH a l t o p a r a su s o l u b i l i d a d y d e proteólisis para su activación y actúan por un mecanismo citolítico de lísis de las membranas celulares. (13,18)
para actuar contra ciertos tipos de insectos; por ejemplo: las p r o t o x i n a s "Cry" II A , s o n a c t i v a s s o b r e a l g u n o s Lepidópteros y Dípteros, mientras que la protoxina "Cry" III A , e s a c t i v a s o l a m e n t e s o b r e a l g u n o s C o l e ó p t e r o s y la protoxina IV es activa contra otros tipos de Dípteros (16).
Sin embargo, no se descarta la posibilidad de que existan otras formas proteicas tóxicas para otros insectos, tal como informa Visser (1990) del descubrimiento de una nueva protoxina llamada "Cry" IE (15,16).
De las variedades de B.t. que más se han estudiado destaca la kurstaki, dentro de estas las cepas 1 y
HD-73 s o n p a r t i c u l a r m e n t e a c t i v a s c o n t r a l a r v a s de Lepidópteros. En los cristales producidos por esta variedad, han sido identificados tres genes llamados "Cry" IA (a),
"Cry" IA (b) y "Cry" IA (c) que codifican para la producción de las proteínas tóxicas (17).
L o s c r i s t a l e s p r e s e n t a n a l g u n a s c a r a c t e r í s t i c a s semejantes entre las que destacan:
- Ser c o n s i d e r a b l e m e n t e h i d r o f ó b i c o s y a l t a m e n t e insolubles a pH neutro.
Ser relativamente resistentes a la proteólisis de la mayoría de las proteasas.
Tener una relación alta de Arginina/Lisina.
No presentar Cistina a pesar de que su contenido de Cisteína es relativamente alto.
a n á l i s i s p o r e s p e c t r o s c o p i a de R a m a n , I n f r a r r o j a y de Dicromismo Circular, encontró la presencia de cadenas tipo a-helicoidal (33-40%) y formas planas tipo ñ (32-40%) y que a m b a s se e n c u e n t r a n f u e r t e m e n t e p l e g a d a s al f o r m a r la proteína del cristal. (19,27).
Hoy en día es bien conocido que el cristal llamado t a m b i é n s - E n d o t o x i n a es el r e s p o n s a b l e d e la a c t i v i d a d tóxica de los B.t., aunque existen otros tipos de toxinas como las a y ñ exotoxinas, que actúan sobre diferentes variedades de insectos. (20)
L a s s - e n d o t o x i n a s p r e s e n t a n a l g u n a s c a r a c t e r í s t i c a s comunes tales como:
- Ser un veneno estomacal (tiene que ser ingerido para matar).
Ser muy específicos actuando principalmente contra Lepidópteros, aunque en algunos casos han mostrado actividad tóxica contra Dípteros y en otros casos contra Larvas de Coleópteros.
1.5.- Mecanismo de Acción Tóxica de la s-Endotoxina.
medio de enzimas intestinales del tipo de la tripsina en pequeños polipéptidos tóxicos de un peso molecular promedio de 60 KDa, los cuales originan cambios patológicos en el
insecto, apareciendo también una toxemia general (21, 22,
24). A p a r e n t e m e n t e , u n f r a g m e n t o d e la m o l é c u l a p a s a a través de la pared del intestino a la linfa y origina una serie de acciones secundarias.
Estudios más recientes han mostrado que la toxina tiene que unirse a un receptor de la superficie de las células
(puede ser una glucoproteína para las toxinas "Cry" o un fosfolípido insaturado en el caso de las toxinas "CyT"), posteriormente las moléculas de la toxina se insertan dentro de la membrana y forman un poro permeable a los iones y a m o l é c u l a s p e q u e ñ a s . Esto c o n d u c e a un i n c r e m e n t o e n el
intercambio osmótico y a una subsiguiente Lísis. (23)
Para poder manifestarse el efecto tóxico, la protoxina debe hidrolizarse para formar fracciones de polipéptidos, l o s c u a l e s s o n r e s i s t e n t e s a p o s t e r i o r e s a t a q u e s de la tripsina y de otras enzimas proteolíticas. (25)
H o y se c o n o c e que el m o d o d e a c c i ó n de las s e n -dotoxinas es citolítico, la membrana celular es el sitio de la interacción con la toxina responsable de la actividad larvicida, principalmente en los bordes de unas vesículas del intestino medio de la larva (26).
polipéptidos que se producen durante la hidrólisis parcial de las proteínas (28). Hofte (1989) señala que la protoxina puede ser activada produciéndose una sustancia tóxica contra Dípteros o Lepidópteros, lo anterior depende del tipo y origen de la enzima proteolítica y por lo tanto, de la fracción polipéptida que se forme. (18)
1.6.- Medios de Fermentación
En base a los estudios del metabolismo de los B.t. se han propuesto diferentes medios de cultivo que permitieran no solamente un crecimiento adecuado del microorganismo sino también una buena producción del complejo espora-s-endo-toxina.
Dulmage (1970) encontró que la actividad tóxica de esta b a c t e r i a no e s t a b a d e t e r m i n a d a p o r la c a p a c i d a d de crecimiento del microorganismo así como tampoco por su
formación de esporas sino que dependía principalmente de la cepa o variedad utilizada así como también del medio de cultivo en el que se desarrollara. Por ejemplo: propuso el siguiente medio de cultivo para el B.t. HD-1 Var. kurstaki, con el objeto de producir altos niveles de cristales es decir la s-endotoxina:
(g/i)
sacarosa 5.0 extracto de lev. 2.0
G o l d e r g y C o l (1980) o p t i m i z a r o n u n m e d i o p a r a la p r o d u c c i ó n del c o m p l e j o e s p o r a - t o x i n a a e s c a l a p i l o t o utilizando:
(g/)
glucosa 30.0 peptona de soya 2 0.0
extracto de lev. 4.5 liq. remojo de maíz 5.0 sales minerales 11.5 Con una aereación de 0.3 W M , una agitación de 120 a 160 RPM Y UN PH de 6.2 a 7.4 ( 4 ) .
C a s t r o (1982) d e m o s t r ó q u e se p o d í a i n c r e m e n t a r la producción del complejo cuando se agregaba CaC03 al medio
de cultivo como amortiguador de PH y fuente de calcio ( 4 ).
1.7.- Los Extractos de Fermentación.
Uno de los pasos más importantes en la producción de bioinsecticidas es la recuperación del complejo espora-cristal.
El primer método utilizado fue la liofilización, pero los resultados no fueron satisfactorios y era demasiado c a r o (4); d e s p u é s se u t i l i z a r o n m é t o d o s q u í m i c o s q u e precipitaran las proteínas, usando acetona, pero se obtenían productos apelmazados y de baja solubilidad, posteriormente
E s t e m é t o d o c o n s i s t e e n c o n c e n t r a r el m e d i o y a f e r m e n t a d o , s u s p e n d e r l o en s o l u c i o n e s d e l a c t o s a y p r e c i p i t a r c o n a c e t o n a la m e z c l a d e l a c t o s a - c o m p l e j o proteínico y finalmente someterlo a un proceso de secado (4).
En la actualidad el método más común es el de una c o n c e n t r a c i ó n m e c á n i c a , ( c e n t r i f u g a c i ó n ) s e g u i d a d e u n secado por aspersión, obteniéndose un producto de buena calidad, más soluble y de baja cantidad de humedad. Este polvo seco contiene células muertas, esporas y cristales y se le c o n o c e como e x t r a c t o de f e r m e n t a c i ó n el c u a l ha demostrado ser el medio más eficaz para utilizarse en la elaboración de insecticida derivados de B.t.
La capacidad tóxica de estos bioinsecticidas se expresa como porciento de mortalidad o bien cuando se utiliza un estandar en los bioensayos se representa como potencia en U . I . / m g . ( 4 ) D u r a n t e a ñ o s se h a n o b t e n i d o e x t r a c t o s de diferentes cepas de B.t. fermentadas en diversas condiciones pero no se había evaluado la persistencia de su toxicidad después de varios años de almacenamiento.
El p o d e r c o n t a r c o n la c o l e c c i ó n d e e x t r a c t o s d e fermentación de B.t. de la F.C.B. nos permitirá evaluar su toxicidad después de haber estado almacenados por más d e 10 a ñ o s y s e l e c c i o n a r los q u e p r e s e n t e n m e j o r e s características.
p r o p i e d a d e s a los p r o d u c t o s t e r m i n a d o s , t a l e s c o m o d i s p e r s a n t e s , s u r f a c t a n t e s , h u m e c t a n t e s , e t c . , c o n el objetivo final de optimizar las propiedades físicas y lograr u n a m e j o r e s t a b i l i d a d , o en a l g u n o s c a s o s a u m e n t a r la potencia contra determinada plaga. (30)
En un futuro c e r c a n o a p a r e c e r á n e n el m e r c a d o n u e v a s f o r m u l a c i o n e s de m e z c l a s d e d i f e r e n t e s c u l t i v o s . También se prevee un gran impulso al tener disponible nuevas variedades de esta bacteria apoyados en una buena manipulación genética, lo cual finalmente permitirá producir generaciones nuevas de bioplagicidas (11).
1.8.- Estandarización de Bioinsecticidas.
D e b i d o a que las p r e p a r a c i o n e s c o m e r c i a l e s p r e s e n t a b a n v a r i a c i o n e s en su a c t i v i d a d i n s e c t i c i d a se tuvieron que establecer estándares primarios a partir de fermentaciones de cepas de B.t. de reconocida capacidad insecticida. Así en 1972 se aceptó la primera referencia primaria llamada HD-1 -1971, la cual estaba formada por un extracto de fermentación de la cepa B.t. HD-1 Var. kurstaki y a la que se le asignó una potencia de 18,000 Ul/mg (21).
T a m b i é n se p r o p u s o que p a r a m e d i r la c a p a c i d a d insecticida de los extractos de fermentación se debería hacer por medio de bíoensayos, en los que pudieran aplicarse
1.9.- El Trichoplusia ni
Este insecto pertenece a la familia de los Lepidópteros phalaenidae y al igual que muchas otras especies que la forman son de gran importancia agrícola ya que atacan una amplia variedad de cereales y cultivos hortícolas cuyas larvas son por lo general comedoras de hojas o taladradores de raíces (33).
2 • 1 - s e l e c c i ó n da E x t r a c t o s de F e r m e n t a c i ó n de Bacillus thurinaiensis.
De la c o l e c c i ó n de e x t r a c t o s d e f e r m e n t a c i ó n d e l Departamento de Microbiología Industrial y de Suelos de la Facultad de Ciencias Biólogicas de la CJANL, se seleccionaron al azar, 16 muestras de extractos correspondientes a las cepas:
HD - 1 HD - 73 HD - 183 HD - 187 HD - 203
catorce pertenecientes a la variedad kurstaki y dos muestras de extractos a la variedad galleriae cepa HD-184.
T a b l a No. 2._ R e l a c i ó n de los E x t r a c t o s de F e r m e n t a c i ó n S e l e c c i o n a d o s de B a c i l lus t h u r i n g l e n s i s y fifios de P r o d u c c i ó n .
C l a v e I n t e r n a
E x t r a e to aflo de p r o d u c c ión
V a r i e d a d S e r o t i p o
1036 HD- 1 1968 K u r s t a k i 3a 3b
508 HD- 1 1972 K u r s t a k i 3a 3b
837 HD- 1 1976 K u r s t a k i 3a 3b
183 HD- 7 3 1971 K u r s t a k i 3a 3b
471 HD- 7 3 1972 K u r s t a k i 3a 3b
658 HD- 7 3 1973 K u r s t a k i 3a 3b
928 H D - 7 3 1975 K u r t a k i 3a 3b
2.2.- Bioensayos.
Se diseñó un bioensayo para medir la toxicidad de los e x t r a c t o s de f e r m e n t a c i ó n de B.t. ( 3 2 , 3 3 , 3 4 , 3 5 ) c o n t r a larvas de T.ni. el cual consistió en lo siguiente:
D e l i n s e c t a r i o d e l L a b o r a t o r i o d e M i c r o b i o l o g í a Industrial y de Suelos de la FCB de la UNAL se obtuvieron l a r v a s de T . n i . de un d í a de n a c i d a s q u e h a b í a n s i d o reproducidas en condiciones controladas de especie, humedad, t e m p e r a t u r a , a l i m e n t a c i ó n etc. L a s l a r v a s n e o n a t a s se colocaron en copas de plástico que contenían una mezcla sólida del alimento especial para larvas de Lepidópteros y diferentes concentraciones de los extractos de fermentación. Fórmula No. 1 del apéndice.
Cada extracto de fermentación se suspendió en agua destilada y de él se prepararon 7 diluciones que mezcladas con la dieta originó otras diferentes concentraciones que fueron las de: 1,10,25,100,250 y 500 ug/ mi de dieta respectivamente para cada dilución.
L a s d i f e r e n t e s c o n c e n t r a c i o n e s de las m e z c l a s de extractos con el alimento fueron puestas en copas (10 copas p o r c o n c e n t r a c i ó n u t i l i z a d a ) las c u a l e s u n a v e z s o l i d i f i c a d a s r e c i b i e r o n larvas de T. ni. (una en c a d a c o p a ) . Las c o p a s se t a p a r o n con t a p a s d e c a r t ó n y se almacenaron por 7 días; al término de los cuales se contaron
Todos los bioensayos fueron hechos por triplicado en diferentes días, por lo que al final se usó una población de un total de 30 larvas para cada concentración.
Para los extractos que mostraron mayor porciento de mortalidad se volvió a efectuar otros bioensayos utilizando
25 larvas para cada concentración probada. Los testigos fueron 4 copas con larvas y alimento pero sin la toxina Los estándares fueron de 7 copas con larvas, el alimento y diferentes concentraciones de un extracto estandarizado de B. t. llamado s-endotoxina HD-1-1980, el cual contenía la toxina que servía de base para comparar el grado de m o r t a l idad p r o d u c i d o para los e x t r a c t o s e s t u d i a d o s . L a s concentraciones de estándar usadas fueron de 1, 5, 10, 20, 30, 40, y 50 ug / mi de alimento.
2.3.- Cuantificación de Esporas Viables.
2.4.- observaciones de cristales al Hicrosoopio
De cada una de las s u s p e n s i o n e s d e e x t r a c t o se prepararon frotis que fueron teñidas con azul de Coomasie (36) se observaron en un microscopio de alta resolución Microscopio Zeiss tipo 3, adaptado con un lente objetivo de contraste de fases PH-3.
2.5.- Evaluación de los Resultados.
2.5.1.- Determinación del Porciento de Mortalidad.
Con los datos obtenidos del número de larvas muertas para cada concentración y por bioensayo, se calculó el porcentaje de mortalidad para cada tratamiento y con esto el porciento de mortalidad promedio para cada concentración. (35)
2.5.2.- Diseño Experimental Estadístico.
Se efectuaron 3 repeticiones para cada tratamiento o combinación de los diferentes niveles de los factores.
Modelo Estadístico.
Yijk = u + ai + flj + (a,/3)ij + Eijk
i = son los niveles del factor 1 (Extracto). j = son los niveles del factor 2 (Concentración) k = es el número de repeticiones.
i = 1,2 18; j = 1,2 7; k = 1,2,3
Eijk = Los errores se distribuyen normalmente independientes con media cero y varianza ^
Yijk = Variable de respuesta. Es el parámetro a medir (porciento de mortalidad).
u = M e d i a del p a r á m e t r o a m e d i r q u e p o s e e el experimento por sí solo.
ai = Es el efecto debido al factor extracto.
J3j = Es el efecto debido a la concentración de cada extracto.
(aft)ij = Es el efecto debido a la interacción extracto-concentración .
Eijk = Error experimental.
Ho = Hipótesis Inicial o Nula. H1 = Hipótesis Alternante.
Prueba de Hipótesis.
(a).- Ho : No existe diferencia entre el porcentaje de mortalidad debido a los diferentes extractos.
H 1 : E x i s t e d i f e r e n c i a en el p o r c e n t a j e de mortalidad, (son diferentes).
Hl : Existe diferencia entre el porcentaje de m o r t a l i d a d d e b i d o a las d i f e r e n t e s concentraciones. (Son diferentes).
(c).- Ho : No existe diferencia entre el porcentaje de mortalidad debido a la interacción Extracto-concentración. (Son iguales).
Hi : E x i s t e d i f e r e n c i a e n t r e el p o r c e n t a j e de m o r t a l i d a d de la i n t e r a c c i ó n E x t r a c t o
-Concentración. (Son diferentes).
2.5.3.- Determinación de Valores de Dosis Letal Media. (DL^q) y de Potencia
L o s v a l o r e s de p o r c e n t a j e d e M o r t a l i d a d se transformaron a unidades Probit por medio de tablas (39,40) y se graficaron contra las concentraciones de extractos utilizadas, se ajustó cada recta por medio de una regresión
lineal y se calculó para cada extracto el valor de Dosis Letal Media (DL^q) así mismo se calcularon los valores de
d l9 0 y coeficientes de correlación para cada curva. (41,
42, 4 3 , 4 4 )
Se obtuvieron también los valores de D L5 0, DLgo y
coeficiente de correlación de cada uno de los estándares y se relacionaron con los valores de DL5q de las muestras por
m e d i o de la s i g u i e n t e e c u a c i ó n p a r a e x p r e s a r l o s c o m o potencia tóxica de los extractos.
D L5 0 estandar
Potencia = X 16,000
DL^q muestra
expresado en Unidades Internacionales ( U I / mg ). (32)
Después de 7 días de permanecer las larvas en una cámara bioclimática, donde permanecieron alimentándose en las copas sólo de la dieta balanceada en el caso de los controles; de la dieta y las diluciones del extracto de r e f e r e n c i a p a r a los e s t á n d a r e s y d e la d i e t a c o n las diluciones de los extractos de fermentación analizados; se contabilizó el número de los tratamientos. (Cuando el número d e l a r v a s p e r d i d a s fue m a y o r d e l 2 0% en m á s d e t r e s concentraciones, se repitió el bioensayo). Para corregir los d a t o s d e m o r t a l i d a d n a t u r a l se p r o p u s o a p l i c a r la e c u a c i ó n d e A b b o t s (46) t o m a n d o los v a l o r e s d e los testigos, pero como en los bioensayos el porciento de mortalidad de los mismos fue menor al 5% ya no se hicieron las correcciones por medio de esta ecuación.
C o m o los b i o e n s a y o s se r e p i t i e r o n 3 v e c e s , se obtuvieron los valores promedio de mortalidad para cada concentración, los cuales se muestran en la tabla No.13.
(Aunque en el análisis estadístico se tomaron 19 estractos, p a r a d e t e r m i n a r p r o m e d i o s de m o r t a l i d a d y p o t e n c i a s se eliminó el extracto HD-24 por pertenecer a otra variedad).
Para determinar si hubo diferencia entre la mortalidad, ya sea debido a los tipos de extracto o a las diferentes concentraciones de ellos; a los resultados obtenidos se les practicó un análisis estadístico de varianza, en el cual de acuerdo a las características del experimento, se utilizó un Diseño Completamente al Azar, con un Arreglo Factorial (45), dicho análisis arrojó los siguientes resultados:
Dado que la F.C. del factor extractos fué mayor que la F de tabla, se rechaza la hipótesis inicial de homogeneidad d e v a r i a n z a s y se a c e p t a la h i p ó t e s i s a l t e r n a n t e de heterogeneidad. Lo cual quiere decir que los diferentes extractos produjeron diferente grado de mortalidad.
Analizando el factor concentración observamos que se s i g u e la m i s m a t e n d e n c i a ; es d e c i r , q u e d e n t r o d e un extracto las diferentes concentraciones producen diferente índice de mortalidad.
La interacción de extractos-concentración también fue significativa, lo cual quiere decir que el porcentaje de mortalidad depende de la concentración determinada que tenga un extracto. Los valores de análisis de varianza se muestran en la tabla No. 3, los cuales fueron obtenidos de los valores de mortalidad de cada uno de los extractos cuyos datos se encuentran concentrados en el apéndice en las tablas de la 22 a la 39.
D e a c u e r d o a las c a r a c t e r I s i t i c a s d e l p r o b l e m a el diseño que se aplicó fue un Diseño de Bloques al Azar (47). El cuadro de concentración de datos aparece en la tabla No. 40 del apéndice.
Los resultados encontrados en el análisis de varianza se muestran en la tabla No. 4
De a c u e r d o al análisis de v a r i a n z a . E x t r a c t o e s significativo, lo cual confirma el análisis anterior de a r r e g l o f a c t o r i a l . Por lo que p a r a d e t e r m i n a r c u a l e s extractos fueron los que produjeron mayor porcentaje de m o r t a l i d a d , se a p l i c a r o n unas p r u e b a s e s t a d í s t i c a s de comparación llamadas Pruebas de Rango Múltiple, de entre las c u a l e s se e l i g i ó la más utilizada en i n v e s t i g a c i ó n ; la Prueba de Duncan.
Los datos numéricos de esta prueba se reportan en el apéndice en las tablas No. 41, 41a y 41b y cuyos resultados se presentaron en la tabla No. 5
En base al Análisis de Varianza del Diseño de Bloques al Azar (Tabla No. 4). Las concentraciones también fueron significativas y para determinar cuales de ellas produjeron diferencias de porcentaje de mortalidad, se les aplicó la misma Prueba de Duncan. Los datos se reportan en el apéndice en las tablas 42, 42a y 42b. Los resultados del Análisis de Varianza se señalan en la tabla No. 6.
óptimas, se les aplicó un nuevo análisis de varianza con un Diseño de Bloques al Azar a los mejores extractos contra las mejores concentraciones. Los datos resultantes están en la tabla No. 43 del apéndice. El análisis de varianza de Bloques al Azar de extractos Vs. concentraciones se señala en la tabla No. 7.
Para lograr una mayor exactitud de los resultados, aunque no sean significativos se les aplicarán las Pruebas de Duncan tanto a extractos como a concentraciones.
Las tablas de cálculos están en el apéndice; las 44, 44a y 44b corresponden a los extractos y las 45, 45a y 45b a las concentraciones.
Los resultados de la Prueba de Duncan para el análisis de extractos se señalan en la tabla No. 8 y los del análisis de las concentraciones en la tabla No. 9.
La conclusión final aparece en la tabla No. 10, donde se muestra que los extractos;
(1033) H D - 1 8 7 (12) H D - 1 8 3 (310) H D - 2 0 3 (63) H D - 2 0 3 (13) H D - 1 8 4 (837) H D - 1
Presentaron las mejores toxicidades y que éstas eran iguales a las concentraciones de 250 y 500 ppm.
De los e x t r a c t o s que se e s t u d i a r o n 6 de e l l o s resultaron como buenas posibilidades por el alto grado de
mortalidad que produjeron, principalmente a concentraciones de 250 y 500 ppm. En la tabla No. 11 aparecen los extractos de fermentación más potentes encontrados.
E n forma c o m p l e m e n t a r i a 3 d e e s t o s e x t r a c t o s se corrieron de nuevo en bioensayos de 25 repeticiones, los resultados se muestran en la tabla No. 12.
Para evaluar la capacidad tóxica de los extractos desde otro punto de vista se calculó para cada uno de ellos los v a l o r e s de D o s i s L e t a l M e d i a y p o s t e r i o r m e n t e los de Potencia (UI/mg.), para lo cual fue necesario utilizar el sistema Probit para convertir los porcientos de mortalidad p r o m e d i o en u n i d a d e s P r o b i t y e n c o n t r a r a s í las c o n c e n t r a c i o n e s c o r r e s p o n d i e n t e s en l o g a r i t m o s de la c o n c e n t r a c i ó n . Con estos n u e v o s v a l o r e s se t r a z a r o n inicialmente en papel logaritmo Vs. Probit de mortalidad, p e r o p o s t e r i o r m e n t e se p r e f i r i ó u t i l i z a r u n m o d e l o de cálculo estadístico usando una calculadora ya que ofreció mejores ventajas para poder hacer un ajuste de la recta por M í n i m o s C u a d r a d o s , p a r a e n c o n t r a r e n f o r m a d i r e c t a los valores de la pendiente, la intercepción, el coeficiente de correlación y finalmente por regresión lineal los de DL^q y D L9 0. El mismo tratamiento se realizó para los estándares
utilizados.
En la tabla No. 47 del apéndice se presenta un ejemplo • de la forma en que se calcularon los valores de DL^q.
En la tabla No. 15 aparecen los datos de D L5 0 de cada
C o n los v a l o r e s de la D o s i s L e t a l M e d i a d e los extractos y de los estándares de los bioensayos se calculó la potencia respectiva expresándola en Ul/mg. de extracto. En la tabla No. 17 se muestran los valores de potencia de los diferentes extractos de B.t. asi como sus años de producción.
En las tablas No. 18 y No. 19 se señalan los extractos seleccionados con potencias superiores a las 1,000 Ul/mg. y a 10,000 Ul/mg.
En la tabla No. 20 se concentran los datos de potencia y DL^q de cada uno de los extractos incluyendo el año en que se fermentaron.
En la gráfica No. 1 se ilustran las variaciones de las potencias de los extractos utilizados.
En las graf icas No. 2 y No. 3 se representan las p o t e n c i a s de los e x t r a c t o s q u e p r e s e n t a r o n m e j o r e s resultados.
En la graf ica No. 4 se representan los valores de D L5 0 de l°s extractos de B.t. var. kurstaki.
En la grafica No. 5 se presentan los valores de D L5 0 de
los extractos más activos.
TABLA No. 3.- A n á l i s i s de V a r i a n z a ( E x t r a c t o Vs. C o n c e n t r a c i ó n ) de un D i s e ñ o C o m p l e t a m e n t e el Azar con A r r e g l o F a c t o r i a l .
F . V . G. L S .C. C .M. F .C. F T A B L A
0 . 0 5 0.01 T R A T A M I E N T O 132 4 9 9 9 . 3 6 4 37 .8740 15.5151 ( * * ) 1.27 1.41 E X T R A C T O 18 2256. 221 125 . 3456 51 .3480 (**> 1.64 2 . 0 0 CONC . 6 1644.311 274 . 0519 1 12. 2 6 5 7 (#*) 2.13 2.87 E X T - C O N C 108 1 0 9 8 . 8 3 2 1 0 . 1 7 4 4 4 . 1 6 7 9 (**> 1.29 1.44
EE 266 649 . 333 2.441 1
TOTAL 398 5648 . 697
TABLA No. 4.- A n á l i s i s de V a r i a n z a p a r a un D i s e ñ o de B l o q u e s al A z a r .
F . V . G . L S . C . C . M. F . C . F T A B L A 0 . 0 5 0.01 E X T R A C T O 1 8 6 7 6 8 . 7 0 0 3 7 6 . 0 0 0 0 12 . 3 0 0 0 (**> 1.64 2 . 0 0 CONC . 6 4932 . 900 8 2 2 . 2 0 0 0 26 . 9 0 0 0 <**> 2.13 2 . 8 7 EE 108 3 2 9 6 . 5 0 0 3 0 . 5 0 0 0
5 8 5 4 6 6 6 9 9 1 3 1 1 7 3 1 6 1 8 4 1 0 7 5 2 6 0 2 8 8 0 0 0 1 3 3 2 3 0 9 8 1 8 0 1 6 8 3 9 3
6 3 3
5 0
- - -7
837 HD-1 * * * * * • * * * * * * * # * * * NS NS
12 H D - 1 8 3 * « * * * * * * * * * * * * * NS NS NS 63 H D - 2 0 3 * * * * * * * * * * # * * NS NS NS NS 13 H D - 1 8 4 * * * * * * * * * * * * * NS NS NS 310 H D - 2 0 3 * * * * * * * * * * * * * NS NS
705 H D - 1 8 3 * * • * * * * * * * * * * NS 1033 H D - 1 8 7 * * * * * * * * NS NS NS NS NS
1036 HD-1 * * * * * NS NS NS NS NS NS NS 389 H D - 2 4 * * * # * NS NS NS NS NS NS
183 H D - 7 3 * * * * * NS NS NS NS NS 928 H D - 7 3 * * * NS NS NS NS NS NS 906 H D - 1 8 3 * * # NS N 5 NS NS NS
661 H D - 1 8 7 * * * NS NS NS NS 820 H D - 2 0 3 * * NS NS NS NS 658 H D - 7 3 * NS NS NS NS
471 H D - 7 3 N5 NS NS NS 508 HD-1 NS NS NS 819 H D - 1 8 4 NS NS 540 H D - 1 8 7 NS
* / * ) . - C o r r e s p o n d e n a los No. filfa [ = ] S i g n i f i c a n c i a o E r r o r e n c e r r a d o s en ( ) de * [=] Son D i f e r e n t e s
TABLA No. 6.- Prueba de D u n c a n p a r a A n á l i s i s de C o n c e n t r a c i o n e s del D i s e ñ o de B l o q u e s al Azar
CONC. (ppm. de E x t r a c t o s de D i e t a )
C O N C . 1 10 25 50 100 250 500
500 * * * * * * NS
250 # * # * * NS
100 * # * * NS
50 * * NS NS
25 * NS NS
10 * NS
1 NS
TABLA No. 7.~ A n á l i s i s de V a r i a n z a del D i s e ñ o de B l o q u e s al Azar de E x t r a c t o s V s . C o n c e n t r a c i o n e s .
F . V . G. L S .C . C.M. F . C . F TABLA
0 . 0 5 0.01 E X T R A C T O 6 2 6 . 2 8 5 2 4 .3809 1 . 4 1 5 3 ( N S ) 3 . 0 0 4 . 8 2 CONC. 2 2 3 . 5 2 3 4 11 . 7 6 1 7 3 . 7 9 9 8 ( N S ) 3 . 8 8 6 . 9 3 EE 12 3 7 . 1 4 4 5 3 . 0 9 5 4
E X T R A C T O S
E X T R A C T O S ( 705 ) ( 1 0 3 3 ) ( 1 3 ) ( 3 1 0 ) ( 1 2 ) ( 8 3 7 ) ( 6 3 ) ( 6 3 ) H D - 2 0 3 DIF . IGUAL I G U A L I G U A L I G U A L I G U A L IGUAL ( 8 3 7 ) HD-1 DIF . IGUAL IGUAL I G U A L IGUAL IGUAL
( 1 2 ) H D - 1 8 3 DIF . IGUAL IGUAL I G U A L I G U A L ( 3 1 0 ) H D - 2 0 3 IGUAL IGUAL IGUAL I G U A L
(13) H D - 1 8 4 IGUAL IGUAL IGUAL ( 1033 ) H D - 1 8 7 IGUAL IGUAL
( 7 0 5 ) H D - 1 8 3 IGUAL
TABLA No. 9.- C o n c l u s i o n e s de la P r u e b a de D u n c a n para C o n c e n t r a c i o n e s .
CONC. (ppm. de E x t r a c t o s en D i e t a )
C O N C . 100 250 500
500 DIF . I G U A L IGUAL
250 IGUAL I G U A L
100 IGUAL
T A B L A N o . 10.- C o n c l u s i ó n f i n a l del A n á l i s i s E s t a d í s t i c o de M o r t a l i d a d de E x t r a c t o s Vs. c o n c e n t r a c i o n e s . ( p p m . de E x t r a c t o s de D i e t a ) .
E X T R A C T O \ C O N C E N T R A C I O N 250 500
( 1033 ) H D - 1 8 7 29. 0 30 . 0
( 1 2 ) H D - 1 8 3 30 . 0 30 . 0
( 3 1 0 ) H D - 2 0 3 30 . 0 30, 0
( 6 3 ) H D - 2 0 3 2 9 . 0 30 .0
( 1 3 ) H D - 1 8 4 30. 0 30 . 0
TRBlfl No. 11.- P o r c e n t a j e de M o r t a l i d a d P r o m e d i o de los E x t r a c t o s de F e r m e n t a c i ó n de B . t . m é s P o t e n t e s c o n t r a T. ni. a d i f e r e n t e s C o n c e n t r a c i o n e s .
C Q N C . (ppm. de E x t r a c t o s en D i e t a )
E X T R R C T O 25 50 100 250 500
( 8 3 7 ) HD-1 43 . 0 70.0 9 3 . 0 8 5 . 0 90 . 0 ( 1 2 ) H D - 1 8 3 47.0 73 . 0 70. 0 80. 0 97. 0 ( 1 3 ) H D - 1 8 4 50. 0 67 . 0 70. 0 87 . 0 9 7 . 0 ( 1 0 3 3 ) H D - 1 8 7 1 3 . 0 67 . 0 7 0 . 0 87 . 0 97. 0 ( 6 3 ) H D-2 0 3 50 . 0 77. 0 83. 0 83 . 0 100.0
( 3 1 0 ) H D - 2 0 3 10.0 73 . 0 77 . 0 8 7 . 0 100. 0
TflBLR N o . 12.- P o r c e n t a j e de M o r t a l i d a d de 3 E x t r a c t o s d e F e r m e n t a c i ó n de C e p a s de B . t . en B i o e n s a y o s de 25 R e p e t i c i o n e s V s . T . ni.
C0NC. (ppm. de E x t r a c t o s en D i e t a ) E X T R R C T O DE
F E R M E N T A C I O N 20 30 40 50
( 8 3 7 ) HD-1 32 . 0 56 . 0 60. 0 68 . 0
( 1 2 ) HD-1 44 . 0 68 0 80 . 0 100.0
TABLA N O . 1 3 . - R e l a c i ó n de % de M o r t a l i d a d de E x t r a c t o s de F e r m e n t a c i ó n de C e p a s de B . t . c o n t r a T . n i .
(Valores P r o m e d i o de cada C o n c e n t r a c i ó n ) , V a l o r e s p r o m e d i o de m o r t a l i d a d para cada c o n c e n t r a c i ó n (ppm de e x t r a c t o / m l . d i e t a )
C O N C E N T R A C I O N E S
E X T R A C T O DE F E R M E N T A C I O N
1 10 25 50 100 250 5 0 0
E X T R A C T O DE
F E R M E N T A C I O N % DE M O R T A L I D A D
( 1 0 3 6 ) H D - 1 0.0 6.7 10.0 2 3 . 3 46 . 7 4 3 . 3 93 . 3 ( 5 0 8 ) H D - 1 0 . 0 3.3 13.3 6 . 7 6 . 7 16.7 23 . 3 ( 8 3 7 ) H D - 1 23. 3 40 . 0 43.3 70 . 0 93 . 3 85 . 0 9 0 . 0 ( 1 8 3 ) H D - 7 3 0.0 6.7 10.0 16. 7 20 . 0 40 . 0 73.3 ( 4 7 1 ) H D - 7 3 3 . 3 3.3 10.0 6 . 7 13.3 13.3 16 . 7 ( 6 5 8 ) H D - 7 3 13.3 13.3 3 . 3 3 . 3 1 0 . 0 20 . 0 1 6 . 7 ( 9 2 8 ) H D - 7 3 36 7 13.3 3 . 3 13.3 3.3 13.3
E X T R A C T 0 I N T E R C E P . PEND.
C0EF. D E C 0 R R E L .
D L 5 0 E X T R A C T O
D L g0
E X T R A C T O
D L5 0
E S T A N D A R 1036 HD-1 - 0 . 6373 0 . 5 4 1 4 0. 9276 1 1 7 . 0 580 . 0 2 9 . 0 837 HD-1 -1 . 9602 0 . 6 9 5 9 0 . 9 2 8 5 33. 0 258 . 0 23. 0 508 HD-1 - 2 . 7787 1.2468 0 . 8 0 6 0 2 , 8 5 5 , 0 113 ,096 15.0 183 H D - 7 3 - 1 .4680 0.7761 0 . 9 5 0 9 260 . 0 2 , 5 5 4 . 0 15.0 471 H D - 7 3 - 4 . 9 3 8 7 1 . 8422 0 . 8 9 5 2 1 6 , 8 8 1 . 0 4 . 0E + 6 1 4 . 0 658 H D - 7 3 -1 . 8591 0 . 9 6 1 6 0.4481 888 . 0 1 5 , 1 7 0 . 0 1 9 . 0 928 H D - 7 3 - 3 . 7 5 1 0 1 . 3 1 2 2 0 . 9 1 5 0 646 . 0 31 , 046 . 0 8 . 0 12 H D - 1 8 3 -3 . 1749 0 . 8344 0 . 9 1 0 3 10.0 117.0 20 . 0 705 H D - 1 8 3 -3 . 5 0 2 0 1.2046 0 . 9 8 2 9 332 . 0 1 1 , 5 9 6 . 0 1 5 . 0 906 H D - 1 8 3 - 2 . 3 4 2 8 1.0518 0 . 9 2 4 7 825 . 0 1 8 , 3 8 7 . 0 1 6 . 0
540 H D - 1 8 7 i n f i n i t o
1033 H D - 1 8 7 -1 . 8 4 5 8 0.6991 0 . 9 4 4 5 31 . 0 351 . 0 20 . 0 661 H D - 1 8 7 -1 . 2 0 0 0 0 . 7 7 0 4 0 . 9 3 3 4 448 .0 4 , 355 . 0 9.0 63 H D - 2 0 3 -2 . 7092 0.80151 0 . 9 5 6 6 20 . 0 2 1 2 . 0 26. 0 310 H D - 2 0 3 -1 . 5 5 S 8 0 . 6 1 8 9 0 . 9 6 2 8 34 . 0 2 1 4 . 0 1 4 . 0 820 H D - 2 0 3 -1 . 1863 0 .7805 0 . 9 1 9 0 521 . 0 5 , 2 1 0 . 0 3 1 . 0 13 H D - 1 8 4 - 1 . 0 4 10 0. 5363 0 . 9 6 2 0 44 . 0 2 1 3 . 0 22 . 0
819 H D - 1 8 4 i n f i n i t o
T A B L A No. 15,- C o m p a r a c i ó n de V a l o r e s de D L 5 0 ( p p m ) d e d i f e r e n t e s E x t r a c t o s de B . t . V a r . k u r s t a k i
( V a l o r e s P r o m e d i o ) V s , T. n i .
E X T R A C T O
D L 5 0
(ppm. DE E X T R A C T O ) ( 1 0 3 6 ) H D - 1 1 1 7 . 0
( 8 3 7 ) HD-1 33 . 0
( 5 0 8 ) HD-1 2 , 8 5 5 . 0 ( 1 8 3 ) H D - 7 3 2 6 0 . 0 ( 4 7 1 ) H D - 7 3 1 6 , 8 8 1 . 0 ( 6 5 8 ) H D - 7 3 8 8 8 . 0 ( 9 2 8 ) H D - 7 3 646 . 0
(12) H D - 1 8 3 1 0 . 0
( 7 0 5 ) H D - 1 8 3 3 3 2 . 0 ( 9 0 6 ) H D - 1 8 3 8 2 5 . 0 ( 5 4 0 ) H D - 1 8 7 i n f i n i t o ( 1 0 3 3 ) H D - 1 8 7 31 . 0 < 6 61> H D - 1 8 7 4 4 8 . 0
(63) H D - 2 0 3 20 . 0
TABLA No. 16.- C o m p a r a c i ó n de D o s i s Letal M e d i a de los E x t r a c t o s más A c t i v o s de B . t . Vs. T. ni.
E X T R A C T O
D L5 0
(ppm. DE E X T R A C T O ) (12) H D - 1 8 3 1 0 . 0
(63) H D - 2 0 3 20 . 0
( 1 0 3 3 ) H D - 1 8 7 3 1 . 0
( 8 3 7 ) HD-1 33 . 0
( 3 1 0 ) H D - 2 0 3 34 . 0
TfiBLfl No. 17.- C o m p a r a c i ó n de V a l o r e s de P o t e n c i a de d i f e r e n t e s E x t r a c t o s de F e r m e n t a c i ó n de B.t. ( V a l o r e s P r o m e d i o ) Vs. T. ni .
E X T R A C T O
P O T E N C I A U l / m g . DE E X T R A C T O
( 1 0 3 6 ) HD-1 3 , 966 . 0 ( 8 3 7 ) HD-1 1 1 , 1 5 2 . 0 ( 5 0 8 ) HD-1 I N A C T I V A
( 1 8 3 ) HD-73 924 . 0
(471) H D - 7 3 I N A C T I V A
(658) H D - 7 3 343 . 0
( 9 2 8 ) H D - 7 3 198.0 (12) H D - 1 8 3 32 , 000. 0 ( 7 0 5 ) H D - 1 8 3 723 . 0 ( 9 0 6 ) H D - 1 8 3 3 1 0 . 0 ( 5 4 0 ) H D - 1 8 7 I N A C T I V A ( 1033 ) H D - 1 8 7 1 0 , 3 2 2 . 0 ( 6 6 1 ) H D - 1 8 7 321 . 0 (63) H D - 2 G 3 20 , 800 . 0 ( 3 1 0 ) H D - 2 0 3 6 , 588 . 0 ( 8 2 0 ) H D - 2 0 3 352. 0 ( 1 3 ) H D - 1 8 4 * 8 , 0 0 0 . 0 ( 8 1 9 ) H D - 1 8 4 * I N A C T I V A
Los e x t r a c t o s m a r c a d o s con (*) son de la v a r i e d a d g a l l e r i a e , el resto son de la v a r i e d a d k u r s t a k i .
TABLA No. 18.- P o t e n c i a s de E x t r a c t o s de B . t . con V a l o r e s s u p e r i o r e s a las 1,000 U l / m g .
E X T R A C T O P O T E N C I A (12) H D - 1 8 3 32 , 000 . 0 (63) H D - 2 0 3 20 , 800 . 0 ( 8 3 7 ) HD-1 1 1 , 1 5 2 . 0 ( 1 0 3 3 ) H D - 1 8 7 1 0 , 322 . 0
(13) HD- 18 4 8 , 000 . 0
( 1 0 3 6 ) HD-1 3 , 9 6 6 . 0 ( 3 1 0 ) H D - 2 0 3 6 , 5 8 8 . 0
TABLA N o . 19.- P o t e n c i a s de E x t r a c t o s de B . t. con V a l o r e s s u p e r i o r e s a las 1 0 , 0 0 0 U l / m g .
TABLA N o . 20.- R e l a c i ó n de V a l o r e s de D L5 0 y P o t e n c i a s de
E x t r a c t o s de B . t . var. k u r s t a k i y g a l l e r i a e Vs. T. ni. en sus d i f e r e n t e s flftos de P r o d u c c i ó n .
CEPA
AÑO DEL E X T R A C T O
L D5 0
(pprn. )
P O T E N C I A
(Ul/rng. ) V A R I E D A D S E R O T I P O (1036) HD-1
( 5 0 8 ) HD-1 (837) HD-1
1968 1972 1976
117.0 2 , 855 .0
33 . 0
3 , 9 6 6 . 0 85 .0 1 1 , 1 5 2 .0
K U R S T A K I K U R S T A K I K U R S T A K I
3a3b 3a3b 3a3b (183) H D - 7 3
(658) H D - 7 3 (471) H D - 7 3 (928) H D - 7 3
1971 1973 1972 1975
260 . 0 888 . 0 1 6 , 8 8 1 . 0
646 . 0
924 . 0 343. 0
14.0 198.0
K U R S T A K I K U R S T A K I K U R S T A K I K U R S T A K I
3a3b 3a3b 3a3b 3a3b (12) H D - 1 8 3
(705) H D - 1 8 3 (906) H D - 1 8 3
1971 1972 1975
10.0 332 . 0 825 . 0
32 , 000 . 0 723 . 0 3 1 0 . 0
K U R S T A K I K U R S T A K I K U R S T A K I
3a3b 3a3b 3a3b ( 540 ) HD- 18 7
( 1033 ) H D - 1 8 7 (661) H D - 1 8 7
1972 1972 1973
i n f i n i t o 31 . 0 448 . 0
0 . 0 10 , 322 . 0
321 . 0
K U R S T A K I K U R S T A K I K U R S T A K I
3a 3b 3a3b 3a3b (63) H D - 2 0 3
(310) H D - 2 0 3 (820 ) H D - 2 0 3
1970 1974 1976
20 . 0 34 . 0 521 . 0
2 0 , 8 0 0 . 0 6 , 588 . 0
952 . 0
K U R S T A K I K U R S T A K I K U R S T A K I
3a3b 3a3b 3a3b (13) H D - 1 8 4
(819) H D - 1 8 4
1971 1976
4 4 . 0 i n f i n i t o
8 , 0 0 0 . 0 0.0
G A L L E R I A E G A L L E R I A E
TABLA No. 21.- V a r i a c i o n e s de la P o t e n c i a de E x t r a c t o s de F e r m e n t a c i ó n de B . t . de d i f e r e n t e s A ñ o s d e P r o d u c c i ó n Vs. T.ni.
AÑO E X T R A C T O P O T E N C I A U I / m g . 1968 ( 1 0 3 6 ) HD-1 3 , 9 6 6 . 0
1970 (63) H D - 2 0 3 2 0 , 8 0 0 . 0 1971 ( 1 8 3 ) HD-73
(12) H D - 1 8 3 ( 1 3 ) H D - 1 8 4
924 . 0 32 , 000 .0 8 , 0 0 0 . 0 1972 ( 5 0 8 ) HD-1
( 4 7 1 ) H D - 7 3 ( 7 0 5 ) H D - 1 8 3 ( 540 ) H D - 1 8 7 ( 1 0 3 3 ) H D - 1 8 7
I N A C T I V A I N A C T I V A 723 . 0 I N A C T I V A 1 0 , 3 2 2 . 0 1973 ( 6 5 8 ) H D - 7 3
( 6 6 1 ) H D - 1 8 7
343. 0 321.0 1974 ( 3 1 0 ) H D - 2 0 3 6 , 5 8 8 . 0 1975 ( 9 2 8 ) H D - 7 3
( 906 ) H D - 1 8 3
198.0 3 1 0 . 0 1976 ( 8 3 7 ) HD-1
( 8 2 0 ) H D - 2 0 3 (819) H D - 1 8 4
T o d o s los extractos, a partir de las soluciones m a d r e s que fueron sembradas en los medios de cultivo p r e s e n t a r o n crecimiento masivo; el número promedio total d e esporas para los extractos seleccionados, son los siguientes:
(1033) HD-187 = 167 x 107 esporas/mg.
(12) HD-183 = 82 x 107 esporas/mg.
(310) HD-203 = 75 X 107 esporas/mg.
(63) HD-203 = 95 X 1O7 esporas/mg.
(13) HD-184 = 102 x 107 esporas/mg.
(837) HD-1 = 125 X 107 esporas/mg.
Demostrándose que poseen una fuerte habilidad natural para volver a iniciar un crecimiento del microorganismo. E s t o s e x t r a c t o s p u e d e n ú t i l i z a r s e p a r a d e s a r r o l l a r f e r m e n t a c i o n e s c o n el o b j e t o de p r o d u c i r f o r m u l a c i o n e s bioinsecticidas.
OBSERVACIONES DE CRISTALES AL MICROSCOPIO
Con un microscopio de alta resolución adaptado con una cámara fotográfica se lograron tomar fotografías de las preparaciones obtenidas a partir de las soluciones m a d r e de
los extractos y utilizando un colorante especial (azul de coomasie) capaz de teñir los cuerpos paraesporales.
T o d o s los cristales observados presentaban la forma bipiramidal clásica, aunque en los extractos (183) HD-73,
en algunas preparaciones se encontraron cristales libres y en otras se presentaban aún dentro de las células.
00 co o w
H fe
o ¡z¡
<
wOí CS H W X fe M I
o
w
tí H
to
C/D
<
Q W >
«J O
. >—
1 o œ u ^ oH Q Q
O ^ O 0- 6 Qá
O
CL
o £ Q
^ C/}
Ä w o
<
O GS <
E w
S3 w
2
< H J u < H X W <1 C/3 W Oí O W Q bo O Oo
'¡Z
w oo a , < ^ fiw
^ O H ^ CO ^ W W H ctí o oCu h
J<3 CNÎ >
o s
u< .
oCxh
cq
<
Ctí w o A co co o«—1 c
m
—
c\? m co • ••—i OD •H
»•H 03 "O (O NJ o Q. a;
o
co O)-o
o CD Xcu
<D
"O
<v
>
^
«
H X Cxi CO W 0Í O w Q 0ÍW ** Ç2 Sr S
u £ CO w w H Pi O O Ph HJ
<
CO > o o o¿ s
í
j
M fe m
<
pí w
a
QC\¡
co
c<¡
co co o Ò00 w MJ M s
£
LÜ • —<
tí H 0 1 O J Q
W Í3
« ^
o . Q W S O05
^ Ö H h Z w o o
«
<
oo tó _ É-" ^ ^ en ^ W . Q CQ W Q
00 ctí
mJ O ,^ S
<
O , o a<
oso
=3 coo
CM coo
CM coo
CM co l> coco
co
co
COco
CO CO CO COo
o
o
o
o
COo
o
o
o
o
o
CM
o
to
o
H o<
P5H
X
W «3 •o CD M Cü Q.tv
o CD I ^ Q 0)X TD
< O
O Z W Q O X CU CD
en
W 1
Oí 0> « ^
o
u
cuLO J
w
o O coo
w>
tí « H Q &
o t ¡
o «
s 3
^ <
o S Di£ £ .
O
<
W h C¿ W ü H Pi
<
¡Zi O Pi O nJ H a < X>
w
io co pq
¿ s
< Q
o —S
2
s so
coo
\Cì
•j a V o io •o TO sj 3 CD O. CL) O CD CD TD O CO X a> 03 TD QJ > CD OO
o
CO
o
o
5 K 6 H
O
Ü
U
2 co
o o
o Q
<
hJ w Q O O Ho
wh ^
W o
poi ce < w H X w CO O W Q CJ U i-J
w ~
CO h O<
u l-Hfe
<
Ph o co »H I Q EC co co o
<N
i Q œ coT I
co co co o w
1 Ci 1 Q o SS ¡E
^
0/ co i CO
I
co w
1 O Q X Ä
Los resultados de la determinación d e l porciento de m o r t a l i d a d y p o t e n c i a i n s e c t i c i d a d e l o s e x t r a c t o s de
fermentación de B.t. var. kurstaki contra T . n i . , mostraron que algunos extractos presentaron bajos n i v e l e s de actividad insecticida pero otros si mostraron v a l o r e s de toxicidad
(expresados en porciento de mortalidad) s u p e r i o r e s al 60 %. Los resultados del análisis estadístico d e varianza de la relación entre los diferentes extractos y las distintas c o n c e n t r a c i o n e s d e m o s t r a r o n que h u b o d i f e r e n c i a e n el porciento de mortalidad dependiendo del e x t r a c t o analizado y también de la concentración utilizada. La heterogeneidad de
los resultados permitió aplicar nuevos a n á l i s i s estadísticos con los cuales pudimos seleccionar 6 e x t r a c t o s con buenas p r o p i e d a d e s b i o i n s e c t i c i d a s . L a s c o n c e n t r a c i o n e s q u e produjeron mayor mortalidad fueron las de 250 y 500 ppm, pero la diferncia entre estos dos no fue significativa. Es recomendable utilizar la concentración de 2 5 0 ppm en futuras aplicaciones.
La capacidad tóxica de los extractos se reportó también como valores de Potencia (U.I./mg.). Del análisis de estos datos encontramos que los extractos con m á s Potencia fueron: De la var. kurstaki, el (877) HD-1, el (12) HD- 183, el
El análisis de la toxicidad de los extractos en función del año en que se obtuvieron mostró que no existia una relación cronológica de la Potencia (el extracto más nuevo debió tener más Potencia) , por lo que consideramos que la edad del extracto no es determinante en su toxicidad« Lo
importante es el tipo de cepa usada y las condiciones en que se efectuó la fermentación. Esto plantea también el problema de la reproducibilidad y homogeneidad de los resultados de
las fermentaciones para producir bioinsecticidas. Los
e x t r a c t o s s e l e c c i o n a d o s f u e r o n c a p a c e s de m a n t e n e r su toxicidad después de más de 10 años de estar conservados a temperatura ambiente. Estos datos pueden servir para conocer más de la estabilidad y permanencia de estos insecticidas, también serán útiles para hacer estudios sobre la posible creación de resistencia por parte de los insectos.
Todas las muestras de extractos fueron capaces de producir un nuevo crecimiento vegetativo a partir de las esporas que estaban presentes en los mismos.
Este hecho resulta interesante ya que es posible que los extractos seleccionados sean fermentados nuevamente para obtener concentrados con posibles aplicaciones comerciales.
Estas colecciones de cepas son una buena fuente de análisis del comportamiento de las mismas con respecto a su a c t i v i d a d b i o l ó g i c a y p u e d e n ser u n a n u e v a f o r m a de selección de cepas de B.t. altamente potentes que resulten eficaces y eficientes en su actividad plaguicida.
después de muchos años se plantea la necesidad de hacer estudios sobre la aparición de resistencia por parte de los insectos. Considero que estas colecciones de cepas son una buena fuente de análisis del comportamiento de las mismas c o n r e s p e c t o a su actividad b i o l ó g i c a y s u f o r m a d e selección. Es conveniente que los extractos que presentaron una mayor abundancia de células con cristales continúen siendo estudiados para detectar la presencia de posibles m u t a c i o n e s o bien la c o n s e r v a c i ó n de s u s p r o p i e d a d e s patógenas contra larvas de Lepidópteros. Los datos de mortalidad encontrados en las muestras de fermentación seleccionadas demuestran que el procedimiento de extracción con lactosa-acetona es adecuado para la conservación de las células y la actividad tóxica de los extractos, sin embargo es necesario hacer más estudios con tratamientos de recuperación por "spray-drier" para ver si hay cambios en su toxicidad.
L a s c e p a s s e l e c c i o n a d a s por h a b e r p r e s e n t a d o los niveles mas altos de mortalidad son: HD-1, HD-183, HD-187,
H D - 2 0 3 y H D - 1 8 4 .