Evaluación del ADN extraído de hojas y ramas de especímenes de herbario: estudio de caso en especímenes de Psychotria y Palicourea depositados en el herbario forestal UDBC
Texto completo
(2) RESUMEN Los especímenes botánicos depositados en los herbarios constituyen un recurso invaluable de ADN que no se ha aprovechado lo suficiente. Las investigaciones sobre este tema se han centrado en la extracción de ADN de las hojas de los especímenes, sin embargo, las ramas no se han evaluado de manera exhaustiva. Con el objeto de conocer la posibilidad de extraer ADN de las ramas de los especímenes de herbario, evaluamos el rendimiento de la extracción en hojas y ramas comparado con tejidos de hoja deshidratados en sílica gel. Se utilizaron especímenes de los géneros Psychotria y Palicourea depositados en la colección del herbario UDBC. Aunque se obtuvieron valores de concentración y pureza de ADN mayores en los tejidos deshidratados en sílica gel, también se pudo extraer ADN de las hojas y ramas de los especímenes botánicos. Las ramas de los especímenes de herbario son un recurso valioso como fuente de ADN que se debe explorar con más detalle ya que al ser comparadas con las hojas, representan ventajas tales como afectar en menor grado la integridad de los especímenes, no alterar de manera significativa la eventual descripción de las plantas y disminuir la posibilidad de extraer ADN de un organismo diferente. Palabras clave: CTAB, Extracción de ADN, especímenes de herbario, ramas, sílica gel. 2.
(3) ABSTRACT Botanical specimens deposited in herbaria are invaluable sources of DNA not used sufficiently. Research on this topic has focused on the extraction of DNA from specimen leaves, however, branches have not been evaluated exhaustively. In order to know the possibility of extracting DNA from branches of herbarium specimens, we evaluated the DNA quantity and quality in leaves and branches of botanical specimens treated with alcohol, compared to leaf tissues dehydrated in silica gel. We used specimens of the genera Psychotria and Palicourea deposited in the collection of the UDBC herbarium. DNA concentration and purity values were higher in dehydrated tissues in silica gel compared to DNA extracted from leaves and branches of botanical specimens. Branches of herbarium specimens are valuable sources of DNA that should be explored in more detail because, when compared to the leaves, they represent advantages such as affecting the integrity of the specimens to a lesser degree, not altering significantly the eventual description of the plants, and decreasing the possibility of extracting DNA from a different organism. Palabras clave: CTAB, DNA Extraction, herbarium specimens, branches, silica gel.. 3.
(4) TABLA DE CONTENIDO RESUMEN ........................................................................................................................................................ 2 ABSTRACT ...................................................................................................................................................... 3 ÍNDICE DE FIGURAS .................................................................................................................................... 4 ÍNDICE DE TABLAS ...................................................................................................................................... 4 AGRADECIMIENTOS ................................................................................................................................... 5 INTRODUCCIÓN ............................................................................................................................................ 5 MATERIALES Y MÉTODOS ........................................................................................................................ 9 RESULTADOS ................................................................................................................................................14 DISCUSIÓN .....................................................................................................................................................19 REFERENCIAS BIBLIOGRÁFICAS...........................................................................................................25. ÍNDICE DE FIGURAS Figura1. Protocolo de extracción de ADN ........................................................................... 12 Figura 2. Concentración de ADN promedio para los tres tejidos ......................................... 15 Figura 3. Pureza de ADN promedio para los tres tejidos (260/280) .................................... 16 Figura 4. Pureza de ADN promedio para los tres tejidos (260/230) .................................... 17 Figura 5. Análisis de correspondencia .................................................................................. 19. ÍNDICE DE TABLAS Tabla 1. Categorización de las variables concentración, edad y altitud ............................... 10 Tabla 2. Prueba de comparaciones múltiples para la variable de concentración.................. 15. 4.
(5) Tabla 3. Prueba de comparaciones múltiples para la variable de pureza (260/280)............. 17 Tabla 4. Prueba de comparaciones múltiples para la variable de pureza (230/260)............. 18 AGRADECIMIENTOS Agradecemos a la Universidad Distrital Francisco José de Caldas por su excelente aporte en nuestra formación profesional, al Laboratorio de Biología Molecular y al Herbario Forestal Gilberto Emilio Mahecha por la disposición y por permitirnos el desarrollo de esta investigación. A nuestra directora Rocío Cortés Ballén por darnos la oportunidad de participar en un proyecto que aporta gran conocimiento científico, por su continua colaboración, sus enseñanzas, valiosos consejos, confianza y paciencia a lo largo de esta investigación. A nuestro evaluador James R. Richardson. Al profesor Juan Camilo Dumar por su importante asesoría en el análisis estadístico. A nuestros padres, hermanos y amigos por creer siempre en nosotras, y demostrarnos su amor a través de la motivación y apoyo incondicional. A la causalidad de poder realizar con éxito este trabajo en equipo, disponer de las capacidades necesarias y la fluidez en su elaboración. A todas las personas que de una u otra forma contribuyeron en el desarrollo de este trabajo.. INTRODUCCIÓN El ADN antiguo (ADNa) es aquel obtenido de los restos de organismos muertos, así como de las muestras tomadas a organismos vivos que han sufrido procesos autolíticos o. 5.
(6) diagenéticos, o que han sido fijadas de alguna forma (Herrmann & Hummel, 1994). El ADNa incluye desde el tomado a tejidos de fósiles, momias, o insectos preservados en ambar, hasta el de tejidos embebidos en parafina, fijados en líquido, o especímenes preservados en colecciones biológicas (Hummel & Herrmann, 1994). En la década de los 80´s se realizaron los primeros trabajos exitosos en la extracción de ADNa como por ejemplo el de Higuchi, quien secuenció un fragmento de ADN a partir de un musculo disecado de Equus quagga, una especie que llevaba extinta cerca de 100 años, o el caso de Pääbo, quien extrajo ADN humano a partir de una momia egipcia de 2.400 años de antigüedad (Izagirre, Duran, De la Rua, 1997; Saiz, Álvarez, Martínez, Álvarez & Lorente, 2012). Los especímenes de herbario son una fuente potencial de ADNa. Las colecciones depositadas en los herbarios constituyen un recurso invaluable de ADNa ya que en ellos se encuentran la mayoría de plantas del mundo, incluyendo especies de distribución restringida, nuevas para la ciencia, extintas o con algún grado de amenaza, a las que se puede acceder fácilmente sin necesidad de invertir altos costos en recolectar material vivo en un punto geográfico específico (Särkinen, Staats, Richardson, Cowan, & Bakker, 2012). Debido a que estas colecciones son una fuente fundamental de material en estudios filogenéticos, desde la década de los 90 se han realizado investigaciones relacionadas con la extracción de ADNa de los especímenes de herbario (e.g. Savolainen, Cuinoud, Spichiger, Martínez, Crevecoeur & Manen, 1995; Pääbo, Poinar, Serre, Jaenicke-Despres, Klause, Vigilant & Hofreiter, 2004; Adams, 2011; Mazo, 2011). Teniendo en cuenta que los especímenes nunca fueron colectados con la intención de extraer ADN, existen limitaciones para la obtención de ADNa amplificable (Erkens, Cross, Maas, Hoenselaar, & Chatrou, 2008; Staats et al., 2011). Dentro de los factores que afectan la extracción de ADNa de los. 6.
(7) especímenes se encuentran, por ejemplo, la edad (el tiempo desde su colección), las condiciones de secado, la preservación y almacenamiento de las muestras, la interacción que ha tenido con sustancias químicas, así como el pH y la humedad (Neubig et al., 2014). A pesar de las limitaciones se ha logrado extraer ADN de material de herbario preservado en diferentes condiciones y de diferentes edades (Drábková & Kirschner, 2002; Erkens et al., 2008; Agostini, Lüdtke, Echeverrigaray & de Souz-Chies, 2011; Staats et al., 2011; Särkinen et al., 2012). Sin embargo, se han detectado problemas tales como la degradación del ADNa debido a los tratamientos químicos de preservación de los especímenes, que no permite obtener concentraciones de ADN muy altas. Adicionalmente, un problema particular en las plantas es la cantidad de metabolitos secundarios que poseen, especialmente abundantes polifenoles, asi como azúcares, y otros posibles inhibidores de la PCR que además pueden eventualmente provocar errores en las secuencias de ADNa. ( Drábková & Kirschner, 2002; Erkens et al., 2008; Agostini et al., 2011; Staats et al., 2011; Särkinen et al., 2012). En las plantas, el tejido foliar es el que se ha preferido para la obtención de ADNa. Sin embargo, existen registros de extracción de ADNa de tejidos lignificados, específicamente de madera del tronco de especies arbóreas (Deguilloux, Pemonge, & Petit, 2004; Deguilloux, Pemonge, Bertel, Kremer, & Petit, 2003; Deguilloux, Pemonge, & Petit, 2002; Liepelt et al., 2006). La extracción de ADNa de la madera representa un reto aún mayor que la extracción en tejido foliar, considerando que una gran proporción de madera está constituida por células muertas (duramen) y una menor proporción por células vivas (albura). Al igual que el tejido foliar, el ADNa obtenido de la madera puede presentar un porcentaje alto de sustancias que pueden inhibir la PCR ( Deguilloux et al., 2002). Existen. 7.
(8) varios estudios que evaluaron la extracción de ADNa de madera de roble (Quercus spp), con muestras de diferentes edades y procedencias, que fueron sometidas a diferentes tipos de secado, en los que se logró aislar ADNa amplificable, aunque solo en fragmentos cortos de regiones con un gran número de copias (Dumolin-Lapègue, Pemonge, Gielly, Taberlet, & Petit, 1999; Deguilloux et al., 2002; Deguilloux et al., 2003). Del mismo modo, se ha podido aislar ADNa de madera Cyclobalanaposis spp. de la familia Fagacea (Ohyama, Baba, & Itoh, 2001), así como de varias especies de Dipterocarpaceas tropicales (Rachmayanti, Leinemann & Gailing, 2006; Rachmayanti, Leinemann, Gailing & Finkeldey, 2009) y de diferentes especies de los géneros Eucalyptus, Pinus y Cupressus con hasta 1000 años de edad (Liepelt et al., 2006), en donde se evidencia el éxito que puede tener el tejido lignificado para la extracción de ADN amplificable. Los tejidos de las ramas de los especímenes de herbario no se han evaluado de manera exhaustiva como fuente de ADNa. Sólo se cuenta con un estudio de Asif & Cannon (2005), quienes extrajeron ADN de la madera de diferentes procedencias de la especie Gonystylus bancanus. Del total de muestras estudiadas, varias provenían de madera procesada, mientras que sólo tres provenían de especímenes de herbario. En general, los resultados arrojaron alta degradación en el ADN con fragmentos que oscilaron entre 50 pb y 10 kpb. Sin embargo, las muestras obtenidas de ramas de especimenes de herbario obtuvieron el mejor rendimiento de ADN (50 ng/µl) de todas las muestras analizadas. Los géneros Psychotria y Palicourea son dos de los más grandes de la familia Rubiaceae. Psychotria incluye alrededor de 1000 especies de distribución Pantropical (Taylor, 2016), mientras que las cerca de 600 especies de Palicourea se restringen al Neotropico (Taylor, 2018). En el Catálogo de Plantas y Líquenes De Colombia, Delprete & Cortes-B. (2015). 8.
(9) registraron 224 especies de Psychotria y 161 de Palicourea, sin embargo, cerca de 80 de las especies incluidas en Psychotria han sido recientemente sinonimizadas bajo el género Palicourea (eg. Taylor & Hollowell, 2016; Taylor, 2017, 2018). Los dos géneros se encuentran bien representados en las colecciones de los herbarios del país. Por ejemplo, en el Herbario Forestal UDBC se registran más de 500 especímenes de cada género. Teniendo en cuenta la representatividad de los géneros en la colección del Herbario Forestal, así como su cercanía filogenética, Psychotria y Palicourea constituyen un excelente modelo para evaluar la posibilidad de extraer ADN de especímenes de Herbario. Este proyecto comparó el rendimiento de la extracción de ADN en hojas y ramas de especímenes de los géneros Psychotria y Palicourea depositados en la colección del herbario UDBC. Específicamente, evaluamos la posibilidad de extraer ADN de las ramas de los especímenes de herbario y estimamos las diferencias entre la concentración y pureza del ADN obtenido en hojas y ramas de los especímenes. Además, evaluamos la influencia de la edad y procedencia del espécimen en la concentración de ADN obtenido.. MATERIALES Y MÉTODOS Diseño experimental Se realizó un diseño experimental en arreglo factorial completamente al azar, con tres tratamientos: Tratamiento 1: Tejido foliar deshidratado en sílica gel (blanco), abreviado como “Sílica gel” Tratamiento 2: Tejido de ramas tomado de espécimen botánico, abreviado como “Madera” Tratamiento 3: Tejido foliar tomado de espécimen botánico, abreviado como “Herbario”. 9.
(10) Las variables analizadas fueron concentración y pureza, evaluada por las relaciones 260/280 y 260/230 y las variables independientes de edad y altitud. Se realizaron dos repeticiones con sub-muestras de 51 especímenes en cada tratamiento. Se realizó una previa categorización de las variables para facilitar los análisis respectivos, de la siguiente manera: Categoría/ Concentración Altitud Variable (ng/ul) Edad(meses) (msnm) Alta. >500. >125. 2001-3500. Media. 100 - 500. 68-125. 1001-2000. Baja. <100. <68. 0-1000. Tabla 1. Categorización de las variables concentración, edad y altitud. Preparación del Material vegetal A partir de la base de datos de la colección de tejidos deshidratados en silica gel disponible en el laboratorio de Biología Molecular de la Facultad del Medio Ambiente y Recursos Naturales de la Universidad Distrital Francisco José de Caldas se seleccionaron 102 ejemplares, 46 del género Psychotria y 56 del género Palicourea. Los ejemplares seleccionados fueron sometidos al mismo proceso de colección usado en el Herbario Forestal UDBC, en el cuál los especímenes se alcoholizan en campo con una solución de alcohol al 70% y posteriormente se secan a una temperatura de 60ºC durante 24 horas. De los 102 ejemplares seleccionados, el 80% fueron colectados en el año 2017, mientras que el 20% se colectaron antes de esta fecha (Anexo 1). La altitud a la que fueron colectados los especímenes se puede ver en el anexo 1. De cada espécimen de herbario se tomó una muestra de hoja y de rama. Los tejidos se procesaron de la siguiente manera:. 10.
(11) Tejido foliar deshidratado en silica gel: Se pesaron entre 19 y 23 mg de tejido en un tubo eppendorf de 1,5 µl el cual contenía 3 perlitas de acero inoxidable. Tejido foliar y de ramas tomado de especímenes botánicos: Con ayuda de pinzas y aguja de disección se procedió a quitar los restos de pegamento que quedaban en las muestras a causa del montaje del espécimen. Se pesaron de 19 a 23 mg tejido en un tubo eppendorf de 1,5 µl el cual contenía 3 perlitas de acero inoxidable en el caso de las hojas y 0,417 g de arena estéril en el caso de la madera. La madera se astilló lo más fino posible con un bisturí antes de pesarla. Una vez pesados todos los tejidos se llevaron a la Biopulverizadora “MiniBeadBeater 16 Ring Rack”, por 30 segundos o hasta obtener un polvo fino. Extracción de ADN Con base en la técnica propuesta por Doyle & Doyle (1987), se utilizó el método de extracción CTAB modificado. Las modificaciones siguieron los lineamientos señalados en los protocolos internos del laboratorio de Biología Molecular del Jardín Botánico de Edimburgo RBGE. Con base en los resultados de experimentos realizados previamente, las muestras se mantuvieron a -20 ºC durante una semana antes de iniciar la fase de lavado del ADN. En la figura 1 se muestra un resumen de protocolo utilizado en el proceso de extracción de ADN.. 11.
(12) Figura1. Protocolo de extracción de ADN. 12.
(13) Concentración y Pureza del ADN Se analizó la cantidad y pureza del ADN por nano-espectrofotometría en un nanodrop 2000 de Thermo Fisher, obteniendo datos de concentración de ADN en ng/uL y relación de absorbancias 260/280 y 260/230 nm.. Análisis de la información Se generó una base de datos con 238 especímenes, en donde se registró la siguiente información: número de colección, nombre de colector, especie, fecha de colección, zona de vida de la procedencia, altitud y edad del espécimen (tiempo transcurrido desde la fecha de colección hasta la fecha de extracción). Finalmente se depuro la base a 102 especímenes, los demás fueron descartados en su mayoría porque en alguno de los tres tejidos no había respaldo o debido a que el material no alcanzaba el peso suficiente para realizar la extracción. Se analizaron las media estadísticas y su desviación estándar en los parámetros de concentración y pureza. Los Supuestos de normalidad se probaron mediante las pruebas de Shapiro-Wilks y Kolmogorov- Smirnov. Se realizó un análisis de varianza de una vía no paramétrica (prueba no paramétrica de Kruskal-Wallis), y comparaciones múltiples con el fin de evaluar la existencia de diferencias significativas para cada uno de los tratamientos. Finalmente se realizó un Análisis de Correspondencia, para identificar si existía o no relación entre los datos obtenidos y las variables independientes: edad y altitud usando el paquete estadístico Past 3 para Windows.. 13.
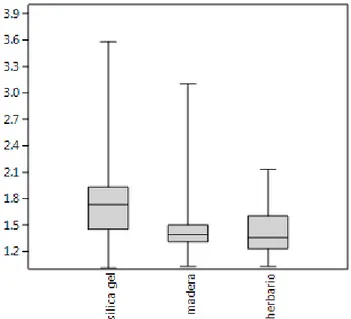
(14) RESULTADOS. Concentración de ADN Se realizaron un total de 306 extracciones. Se repitieron aquellas muestras que se alejaban considerablemente de los datos obtenidos en la mayoría de las muestras con el objetivo de descartar posible error humano. Para las muestras de sílica y herbario, la mayoría de los datos de concentración varió entre 100 y 500 ng/µl, con una representación de 39% y 50% respectivamente. En el caso de la madera, se encontraron concentraciones menores de 100 ng/µl en un 48 % de las muestras. La concentración promedio de ADN obtenido presenta alta variación en cada uno de los tejidos. Se evidencia que del tejido secado en sílica gel se extrajeron concentraciones más altas con respecto a los otros tratamientos (promedio 452,42 ng/µl). Estos resultados contrastan con los obtenidos en el tratamiento madera, en donde se obtuvieron menores concentraciones de ADN (prom195,63 ng/µl) (figura 2). Aunque se presentaron diferencias estadísticamente significativas (p=0,00**), se puede observar en el análisis de comparaciones múltiples, que madera y hojas de herbario se comportan de manera similar mientras que el tejido preservado en sílica gel presenta las mayores diferencias en la media de concentración. (Tabla 2). 14.
(15) Figura 2. Concentración de ADN promedio para los tres tejidos. TEJIDO SÍLICA HERBARIO MADERA. SIGNIFICANCIA GRUPOS HOMOGÉNEOS A 190,16 B 145,86 B 124,48. Tabla 2. Prueba de comparaciones múltiples para la variable de concentración. Pureza del ADN Relación 260/280 Alrededor de 21.24% de las muestras poseen un valor de absorbancia entre 1,7 y 2 nm, por lo cual se catalogan como muestras puras, libres de proteínas. De estas un 13.4% corresponde. 15.
(16) a sílica gel, un 2.29% a madera y 5.5% a muestras provenientes de hojas de herbario. Las muestras contaminadas con proteínas representan el 78.76 % de total, de estas un porcentaje menor corresponde al tratamiento de sílica gel con un 19.93%, un 31.04% de las muestras a madera y un 27.77% a muestras a herbario. Se encontraron diferencias significativas en la relación de absorbancia 260/280 (p=0,00**), en donde únicamente el tratamiento sílica gel alcanzo valores promedio de pureza aceptables de ADN con 1,7. Los tratamientos madera y herbario obtuvieron valores de pureza promedio de 1,54 y 1,42 respectivamente, indicando la posible contaminación con compuestos aromáticos o proteínas. (Figura 3). De igual manera las mayores diferencias se encuentran entre el tejido de sílica gel y los tratamientos madera y herbario (Tabla 3).. Figura 3. Pureza del ADN promedio para los tres tejidos (260/280). TEJIDO SÍLICA. SIGNIFICANCIA GRUPOS HOMOGÉNEOS A 196.42. 16.
(17) HERBARIO 135.77 MADERA 128.31. B B. Tabla 3. Prueba de comparaciones múltiples para la variable de pureza (260/280) En general, el tratamiento con mayor cantidad de muestras puras con absorbancias entre los 1,7 y 2 nm, corresponde al material almacenado en sílica gel, con 40,2% del ADN considerado puro y un restante 59.8% impuro. Del mismo modo, el tratamiento herbario presenta un total del 16,66% de las muestras puras y un 83,33% de muestras con ADN impuro. En el tercer lugar en términos de pureza según la relación 260/280 nm, se encuentra el tratamiento madera con tan solo un 6,86% de muestras con ADN puro.. Relación 260/230. Figura 4. Pureza del ADN promedio para los tres tejidos (260/230). 17.
(18) Se encontraron diferencias significativas en la relación de absorbancia 260/230 (p=0.0031), en donde ningún tejido alcanzó valores promedio de pureza aceptables (>2,0nm). El tratamiento sílica gel obtuvo un promedio de pureza de 0.60, el tratamiento de madera un valor promedio de 0,45 y el tratamiento de herbario obtuvo un valor promedio de 0.52, indicando la posible contaminación con compuestos fenólicos, sales y otros contaminantes (Figura 4). De igual manera las mayores diferencias se encuentran en el tejido de sílica gel. (Tabla 4).. TEJIDO SÍLICA HERBARIO MADERA. SIGNIFICANCIA GRUPOS RANGO HOMOGÉNEOS A 173.6 AB 155.15 B 131.78. Tabla 4. Prueba de comparaciones múltiples para la variable de pureza (230/260) En resumen, para la relación de 260/230 nm, se consideraron un 100% de las muestras impuras, excepto para el material secado en sílica gel con una única muestra pura, que representa el 0,98% del total de las muestras.. Análisis de la altitud de la colección y edad de las muestras En el Análisis de Correspondencia para los diferentes tejidos, se pueden ver comportamientos similares entre la relación de la concentración-edad. En las edades mayores se encuentran un total de 21 especímenes, que representan 63 datos de concentración, de los cuales 20 concentraciones se ven afectadas por la edad. En la Figura 5 se puede observar que. 18.
(19) indistintamente del tejido, las concentraciones se van agrupar de acuerdo a su categoría de concentración, en donde las concentraciones altas tienen una mayor varianza y muestran una relación con altitudes y edades altas.. Figura 5. Análisis de correspondencia entre las variables altitud y edad para los tejidos sílica gel, madera y herbario DISCUSIÓN La madera de especímenes de herbario como fuente de ADN De acuerdo a los resultados obtenidos, es posible extraer ADN proveniente de madera de especímenes de herbario que han sido alcoholizados en campo. Aunque en varios estudios se había logrado extraer ADN de madera seca (e.g. Dumolin et al., 1999; Deguilloux et al., 2003; Deguilloux et al., 2002; Liepelt et al., 2006; Rachmayanti, et al., 2009), sólo se registra un estudio en el que se extrajo ADN de la madera proveniente de especímenes de herbario, en el cual se usaron tres colecciones (Asif & Cannon, 2005) que, aunque fue un buen indicio, no es un número estadísticamente representativo. Por el contrario, reportamos por primera vez el éxito en la extracción de ADN de madera de 102 especímenes de herbario.. 19.
(20) Teniendo en cuenta que los especímenes fueron alcoholizados en el momento de la colección, que es una técnica generalizada en la recolección de material botánico, los resultados obtenidos demuestran que las ramas de los especímenes de herbario constituyen un recurso valioso como fuente de ADN. La mayoría de los estudios que han evaluado la extracción de ADN de especímenes de herbario utilizan tejido foliar (Drábková & Kirschner, 2002; Agostini, Lüdtke, Echeverrigaray & de Souz-Chies, 2011; Erkens et al., 2008; Staats et al., 2011; Särkinen et al., 2012). Sin embargo, la posibilidad de extraer ADN de las ramas de los especímenes de herbario presenta ventajas respecto al tejido foliar relacionadas con la integridad de los especímenes, con la reducción del número de caracteres morfológicos que se “pierden” al mutilar el espécimen botánico, así como con el aumento de la probabilidad de extraer ADN del organismo deseado. La extracción de ADN de las ramas de las colecciones botánicas afecta en menor grado la integridad de los especímenes ya que el área de tejido que se toma es mucho menor al área tomada a una muestra de hoja. Mientras que para obtener entre 19 y 23 mg de tejido se utilizó un área entre 3 y 5 cm² de tejido foliar, dependiendo de la textura de la hoja, para la obtención de la misma cantidad de tejido de madera se utilizó un área de la rama que osciló entre 0.6 y 1.2 cm². Una ventaja adicional de extraer ADN de la madera de la rama de especímenes es que, contrario a las hojas, las ramas tienen pocos caracteres morfológicos que se incluyen en las descripciones botánicas. En una descripción taxonómica promedio se describe solamente la forma, textura y presencia de indumentos de las ramas, mientras que de las hojas se describen muchos caracteres, por ejemplo, la forma, el margen, los diferentes grados de venación, el indumento y la textura, entre otros (e.g. Taylor, 2016, 2017, 2018). Además, las ramas de los especímenes tienen la ventaja de disminuir la. 20.
(21) probabilidad de extraer ADN de un organismo diferente asociado al tejido colectado. La mayoría de las veces las ramas de los especímenes de herbario se encuentran libres de hepáticas, musgos, hongos y líquenes, mientras que las hojas suelen tener en la superficie diversas especies asociadas. Por todas las razones señaladas, al comparar los tejidos de hojas y ramas de las colecciones botánicas para la extracción de ADN, el uso de una porción de alrededor de 2 cm de la rama de un espécimen afecta en menor grado su integridad, no altera significativamente la eventual descripción de la planta, y disminuye la posibilidad de extraer ADN de un organismo diferente.. La madera versus las hojas de especímenes de herbario como fuente de ADN De todos los tejidos evaluados, las porciones de hoja deshidratadas en silica gel presentaron la mayor concentración y pureza (relación 260/280) de ADN. Estos tejidos fueron colectados intencionalmente para la extracción de ADN, y no sufrieron los procesos de degradación causados por el secado a altas temperaturas, o por la aplicación de alcohol, que se consideran dos de las principales causas de la degradación del ADN en los especímenes de herbario (e.g. Pyle & Adams, 1989; Neubig et al., 2014). Desde la propuesta hecha por Chase & Hills (1991), de colectar hojas en silica gel en el campo, esta práctica se generalizó debido a lo útil, barata y práctica que resulta ser. Nuestros resultados reafirman lo valioso de esta práctica, y confirman los resultados obtenidos por Särkinen et al. (2012), quienes evaluaron diferentes métodos de preparación de especímenes para la obtención de ADN, y concluyeron. 21.
(22) que la deshidratación en sílica gel era el mejor método de secado comparado con el uso de calor o alcohol. No se obtuvieron diferencias significativas al comparar la concentración y pureza del ADN obtenido de las hojas y madera de los especímenes previamente alcoholizados. Se podría esperar que los tejidos más resistentes protegerían de una mejor forma el ADN, tal como lo señalan Herrmann & Hummel (1994) en el caso de huesos y semillas. En nuestro caso, la corteza de la madera podría actuar como una barrera de protección contra el efecto del alcohol. En este sentido, Asif & Cannon (2005) encontraron que el ADN de la madera se encontraba mejor preservado que el de las hojas y lo atribuyeron al secado rápido de las muestras, que pudo haber afectado más a las hojas que a la madera. Por otra parte, considerando que todas las células del tejido foliar se encontraban vivas al momento de la colección, mientras que en la madera algunas células ya se encontraban muertas, podría esperarse una mayor concentración de ADN en el tejido foliar. Teniendo en cuenta que no encontramos diferencias significativas en la concentración y pureza del ADN obtenido de tejido foliar y de madera, podríamos considerar que la corteza no actúa como una barrera de protección, ni que el número de celulas muertas al momento de la colección influyeron en la concentración y pureza de ADN de los especímenes previamente alcoholizados. Se encontró que es indiferente el tratamiento que se use para la extracción de ADN, pues el valor de concentración se mantuvo entre los rangos asignados, es decir, sin importar si la fuente de ADN provenía de material de herbario ( madera u hoja), o provenía de tejido foliar almacenado en el banco de sílica gel, el resultado de la concentración obtenida se mantuvo dentro del rango alto, medio o bajo para cada espécimen, por lo tanto el material de herbario es una fuente de ADN equiparable con el tejido foliar deshidratado en sílica gel y teniendo. 22.
(23) en cuenta, para el caso específico de colecciones botánicas almacenadas en herbarios, las ventajas que sobresalen en el uso de madera sobre las hojas, este resultado demuestra que es posible hacer uso de la madera de especímenes de herbario como fuente de ADN con la posibilidad de obtener un resultado de concentración de ADN equiparable al obtenido del material deshidratado en sílica gel.. La Edad del espécimen en la obtención de ADN De las 306 muestras evaluadas, sólo 63 tenían edades mayores a un año. Por consiguiente, no contamos con una muestra suficiente para determinar el efecto de la edad en la concentración y pureza de ADN de especímenes de herbario. Sin embargo, los resultados muestran una tendencia inversa entre la edad y la concentración de ADN. Es decir, que se obtuvo ADN más puro y en mayores concentraciones en los especímenes más jóvenes. Estos resultados concuerdan con los obtenidos por Erkens et al. (2008), quienes encontraron una disminución en la concentración de ADN por cada año de aumento de la edad en muestras de diferentes especies de Zehneria sp. Para poder evaluar la influencia de la edad en la pureza y concentración de ADN, es necesario evaluar ejemplares que abarquen un rango de tiempo más amplio. En nuestro caso no fue posible debido a que la edad se limitaba a los especímenes de herbario que tuvieran muestra de tejido en el banco de sílica gel. A pesar de que se muestra una relación entre las variables edad y altitud en una categoría alta con la variable concentración en esta misma categoría, cabe aclarar que debido a la falta de estandarización en el número de especímenes por cada edad evaluada e igualmente el número. 23.
(24) de especímenes por altitud registrada, no se establece una relación directa entre estas variables con el resultado de concentración obtenido.. CONCLUSIONES Y RECOMENDACIONES. Las ramas de los especímenes de herbario son un recurso valioso como fuente de ADN, pues al ser comparado con las hojas, afecta en menor grado la integridad de los especímenes, no altera de manera significativa la eventual descripción de la planta y disminuye la posibilidad de extraer ADN de un organismo diferente. Teniendo en cuenta que no se encontraron diferencias significativas en la concentración y pureza del ADN extraído de tejido foliar y de madera de los especímenes, se podría pensar que la corteza de la madera no actúa como barrera de protección del ADN, ni que el número de células muertas de la muestra en el momento de la colección influyen en la concentración y pureza del ADN. Se evidenció una tendencia en la disminución de la concentración del ADN con el aumento de la edad de los especímenes, en donde las mayores concentraciones y la mayor pureza de ADN se encontraron en los especímenes más jóvenes. Se recomienda evaluar un mayor número de variables tales como el grosor y el color de las hojas, la relación corteza-madera en la rama, así como un rango mayor de edad de los especímenes, con el objeto de aprovechar el invaluable recurso que representan los especímenes botánicos como fuente de ADN.. 24.
(25) REFERENCIAS BIBLIOGRÁFICAS. Adams, R. P. (2011). DNA from herbarium specimens: II. Correlation of DNA degradation with humidity. Phytologia, 93(December), 351–359. Agostini, G., Lüdtke, R., Echeverrigaray, S., & de Souz-Chies, T. T. (2011). Genomic DNA extraction from herbarium samples of Cunila D. Royen ex L. (Lamiaceae) and Polygala L.. (Polygalaceae).. Conservation. Genetics. Resources,. 3(1),. 37–39.. https://doi.org/10.1007/s12686-010-9277-3 Asif, M. J., & Cannon, C. (2005). DNA Extraction From Processed Wood : A Case Study forthe Identification of an Endangered Timber Species ( Gonystylus bancanus ). International Society for Plant Molecular Biology, 23(June), 185–192. Chase, M. W., & Hills, H. H. (1991). Silica Gel: An Ideal Material for Field Preservation of Leaf Samples for DNA Studies. Taxon, 40(2), 215. https://doi.org/10.2307/1222975 Deguilloux, M. F., Pemonge, M. H., & Petit, R. J. (2002). Novel perspectives in wood certification and forensics: Dry wood as a source of DNA. Proceedings of the Royal Society. B:. Biological. Sciences,. 269(1495), 1039–1046.. https://doi.org/10.1098/rspb.2002.1982 Deguilloux, M. F., Pemonge, M. H., Bertel, L., Kremer, A., & Petit, R. J. (2003). Checking the geographical origin of oak wood: Molecular and statistical tools. Molecular Ecology, 12(6), 1629–1636. https://doi.org/10.1046/j.1365-294X.2003.01836.x Deguilloux, M.-F., Pemonge, M.-H., & Petit, R. J. (2004). DNA-based control of oak wood. 25.
(26) geographic origin in the context of the cooperage industry. Ann. For. Sci, 61, 97–104. https://doi.org/10.1051/forest:2003089 Drábková, L., & Kirschner, J. (2002). Comparison of seven DNA extraction and amplification protocoles in historical herbarium specimens of Juncaceae. Plant Molecular Biology, 20(June), 161–175. Dumolin-Lapègue, S., Pemonge, M. H., Gielly, L., Taberlet, P., & Petit, R. J. (1999). Amplification of oak DNA from ancient and modern wood. Molecular Ecology, 8, 2137–2140. https://doi.org/10.1046/j.1365-294X.1999.00788.x Erkens, R. H. J., Cross, H., Maas, J. W., Hoenselaar, K., & Chatrou, L. W. (2008). Assessment of age and greenness of herbarium specimens as predictors for successful extraction and amplification of DNA. Blumea: Journal of Plant Taxonomy and Plant Geography, 53(2), 407–428. https://doi.org/10.3767/000651908X608052 Herrmann, B., Hummel, S., New, S.-V., Berlin, Y., London, H., Tokyo, P., … Budapest, B. (1994). Ancient DNA. Izagirre, N. & De La Rúa, C.(1999): “An mtDNA analysis in ancient basque populations implications for haplogrop V as a marker for a major paleolithic expansion from southwestern Europe”, Am. J. Hum. Genet. 65, pp. 199-207 Liepelt, S., Sperisen, C., Deguilloux, M. F., Petit, R. J., Kissling, R., Spencer, M., … Ziegenhagen, B. (2006). Authenticated DNA from ancient wood remains. Annals of Botany, 98, 1107–1111. https://doi.org/10.1093/aob/mcl188 Mazo, L. (2011). Evaluación y comparación de 3 protocolos de extracción y amplificación. 26.
(27) del adn contenido en exsicados de orquídeas conservadas en colecciones de herbario. Pontificia Universidad Javeriana. https://doi.org/10.1017/CBO9781107415324.004 Neubig, K., Whitten, M., Abbott, R., Elliott, S., Soltis, D., & Soltis, P. (2014). Variables affecting DNA preservation in archival plant specimens. In W. Applequist & L. Campbell (Eds.), DNA Banking for the 21st Century (Firts Edit, pp. 81–136). Trujillo, Perú: Graficart SRL. Ohyama, M., Baba, K., & Itoh, T. (2001). Wood identification of Japanese Cyclobalanopsis species (Fagaceae) based on DNA polymorphism of the intergenic spacer between trnT and. trnL. 5′exon.. Journal. of. Wood. Science,. 47(2),. 81–86.. https://doi.org/10.1007/BF00780554 Pääbo, S., Poinar, H., Serre, D., Jaenicke-Després, V., Hebler, J., Rohland, N., … Hofreiter, M. (2004). Genetic Analyses from Ancient DNA. Annual Review of Genetics. https://doi.org/10.1146/annurev.genet.37.110801.143214 Pyle, M. & Adams, R. (1989). In situ preservation of DNA in plant specimens. Taxon 38: 576-581. Rachmayanti, Y., Leinemann, L., & Gailing, O. (2006). Extraction, Amplification and Characterization of Wood DNA from Dipterocarpaceae. Plant Molecular Biology Reporter, 24, 45–55. Rachmayanti, Y., Leinemann, L., Gailing, O., & Finkeldey, R. (2009). DNA from processed and unprocessed wood: Factors influencing the isolation success. Forensic Science International: Genetics, 3(3), 185–192. https://doi.org/10.1016/j.fsigen.2009.01.002. 27.
(28) Särkinen, T., Staats, M., Richardson, J. E., Cowan, R. S., & Bakker, F. T. (2012). How to open the treasure chest? Optimising DNA extraction from herbarium specimens. PloS One, 7(8), e43808. https://doi.org/10.1371/journal.pone.0043808 Staats, M., Cuenca, A., Richardson, J. E., Vrielink-van Ginkel, R., Petersen, G., Seberg, O., & Bakker, F. T. (2011). DNA damage in plant herbarium tissue. PloS One, 6(12), e28448. https://doi.org/10.1371/journal.pone.0028448 Taylor, C. 2016. Rubiacearum Americanarum Magna Hama Pars XXXI: More New Neotropical Species and Morphological Notes for Psychotria (Psychotrieae). Novon 24(4): 413-434. Taylor, C. & V. Hollowell. 2016. Rubiacearum Americanarum Magna Hama Pars XXXV: The New Group Palicourea sect. Nonatelia, with Five New Species (Palicoureeae). Novon 25(1): 69-110. Taylor, C. 2017. Rubiacearum Americanarum Magna Hama XXXVII: The New Group Palicourea sect. Chocoanae with of the Chocó Biogeographic Region, with Two New Species (Palicoureeae). Novon 25(3): 322-342. Taylor, C. 2018. Rubiacearum Americanarum Magna Hama Pars XXXVIII: A New Circumscription of Palicourea sect. Bracteiflorae, an Andean Radiation with Several New Species (Palicoureeae). Novon 26(1): 66-138.. Anexo 1. Lista de los especímenes del Herbario Forestal UDBC evaluados N° Nombre científico. Colector. 1. M. Reina. Palicourea acuminata. N° Año Región colección 60 2018 Santander. Altitud (msnm) 1850. 28.
(29) 2. Palicourea acuminata. 3. Palicourea angustifolia R. Cortés. 2420. 4. R. Cortés. 3371. 5. Palicourea aschersonica Palicourea berteroana. R. Cortés. 3316. 6. Palicourea berteroana. R. Cortés. 3327. 7. Palicourea bertieroides R. Cortés. 3336. 8. Palicourea brachiata. R. Cortés. 3312. 9. Palicourea brachiata. R. Cortés. 3319. 10 Palicourea guianensis. J. Ruiz. 124. 11 Palicourea guianensis. R. Cortés. 2636. 12 Palicourea guianensis. R. Cortés. 3126. 13 Palicourea guianensis. R. Cortés. 3129. 14 Palicourea guianensis. R. Cortés. 3381. 15 Palicourea guianensis. R. Cortés. 3382. 16 Palicourea nitidella. R. Cortés. 3234. 17 Palicourea nitidella. R. Cortés. 3243. 18 Palicourea ovatistipula. R. Cortés. 3313. 19 Palicourea quadrilateralis 20 Palicourea quadrilateralis 21 Palicourea racemosa. R. Cortés. 3325. R. Cortés. 3326. R. Cortés. 3388. 22 Palicourea rosea. R. Cortés. 3310. 23 Palicourea sanluisensis R. Cortés. 3315. 24 Palicourea sanluisensis R. Cortés. 3321. 25 Palicourea schlimii. R. Cortés. 2458. 26 Palicourea solitudinum. J. Richardson J. Richardson J. Ruiz. 2017-16. 27 Palicourea solitudinum 28 Palicourea sp.. S. Combita. 77. 2017-17 JRM3. 2018 2018 2014 2005 2017 2017 2017 2017 2017 2017 2014 2014 2014 2002 2008 2008 2007 2003 2005 2008 2008 2008 2008 2008 2008 2009 2010. Santander. 2086. Santander. 2000. Cundinamarca 2174 Antioquia. 573. Antioquia. 678. Antioquia. 719. Antioquia. 573. Antioquia. 573. Meta. 498. Tolima. 495. Boyacá. 1295. Boyacá. 1277. Cundinamarca 1703 Cundinamarca 1703 Vaupés. 193. Vaupés. 193. Antioquia. 573. Antioquia. 678. Antioquia. 678. Chocó. 5. Antioquia. 573. Antioquia. 573. Antioquia. 865. Santander. 2000. Chocó. 5. Chocó. 5. Meta. 498. 29.
(30) 29 Palicourea sp.. R. Cortés. 2479. 30 Palicourea sp.. R. Cortés. 2863. 31 Palicourea sp.. R. Cortés. 3329. 32 Palicourea sp.. R. Cortés. 3332. 33 Palicourea sp.. R. Cortés. 3358. 34 Palicourea sp.. R. Cortés. 3361. 35 Palicourea sp.. R. Cortés. 3362. 36 Palicourea sp.. R. Cortés. 3363. 37 Palicourea sp.. R. Cortés. 3364. 38 Palicourea sp.. R. Cortés. 3365. 39 Palicourea sp.. R. Cortés. 3366. 40 Palicourea sp.. R. Cortés. 3370. 41 Palicourea sp.. R. Cortés. 3372. 42 Palicourea sp.. R. Cortés. 3375. 43 Palicourea sp.. R. Cortés. 3376. 44 Palicourea sp.. R. Cortés. 3378. 45 Palicourea sp.. R. Cortés. 3379. 46 Palicourea sp.. R. Cortés. 3380. 47 Palicourea sp.. R. Cortés. 3387. 48 Palicourea sp.. R. Cortés. 3389. 49 Palicourea stellata. M. Medina. 362. 50 Palicourea triphylla. R. Cortés. 3220. 51 Palicourea triphylla. R. Cortés. 3246. 52 Palicourea triphylla. R. Cortés. 3249. 53 Palicourea triphylla. R. Cortés. 3274. 54 Palicourea violacea. R. Cortés. 3103. 55 Palicourea violacea. R. Cortés. 3105. 56 Palicourea woronowii. R. Cortés. 3263. 2012 2012 2013 2017 2017 2017 2017 2017 2017 2017 2017 2017 2017 2017 2017 2017 2017 2017 2017 2017 2017 2017 2017 2017 2017 2017 2017 2017. Boyacá. 2739. Valledupar. 2000. Antioquia. 678. Antioquia. 719. Cundinamarca 2286 Cundinamarca 2176 Cundinamarca 2176 Cundinamarca 2176 Cundinamarca 2176 Cundinamarca 2176 Cundinamarca 2176 Cundinamarca 2125 Cundinamarca 2174 Cundinamarca 1703 Cundinamarca 1703 Cundinamarca 1703 Cundinamarca 1703 Cundinamarca 1703 Chocó. 5. Choco. 5. Santander. 2415. Vaupés. 289. Vaupés. 192. Vaupés. 192. Vaupés. 192. Boyacá. 1600. Boyacá. 3200. Vaupés. 192. 30.
(31) 57 Psychotria aff. carthagenensis 58 Psychotria aff. sylvivaga 59 Psychotria aff. sylvivaga 60 Psychotria anceps. R. Cortés. 2834. R. Cortés. 2419. R. Cortés. 2460. R. Cortés. 3101. 61 Psychotria anceps. R. Miranda. 137. 62 Psychotria aschersoniana 63 Psychotria brachiata. M. Reina. 310. J. Navarro. 229. 64 Psychotria brachiata. M. Correa. 2732. 65 Psychotria brachiata. R. Cortés. 3108. 66 Psychotria brachiata. R. Miranda. 196. 67 Psychotria carthagenensis 68 Psychotria carthagenensis 69 Psychotria cf sylvivaga. R. Cortés. 3286. R. Cortés. 3344. R. Cortés. 3409. 70 Psychotria cf tendlen. R. Cortés. 3414. 71 Psychotria cooperi. R. Cortés. 2660. 72 Psychotria cuspidata. M. Reina. 292. S. Ángel 73 Psychotria erythrocephala 74 Psychotria glomerulata J. Richardson W. Ariza 75 Psychotria hejdada. 226. 76 Psychotria humboldtiana 77 Psychotria longicuspis. R. Cortés. 3290. R. Cortés. 3252. 78 Psychotria longicuspis. R. Cortés. 3259. 79 Psychotria luxurians. S. Ángel. 219. 80 Psychotria micrantha. W. Ariza. 8013. 81 Psychotria microbotrys. R. Cortés. 3251. 82 Psychotria poeppigiana J. Richardson. 2017-13 8004. 2017-12. 2017 2017 2017 2017 2017 2017 2017 2017 2017 2017 2017 2017 2017 2017 2017 2017 2017 2017 2017 2017 2017 2017 2017 2017 2017 2017. Guajira. 500. Santander. 2000. Santander. 2000. Boyacá. 1231. Meta. 498. Santander. 2000. Antioquia. 573. Caquetá. 242. Boyacá. 1101. Meta. 498. Vaupés. 192. Antioquia. 201. Magdalena. 650. Magdalena. 650. Chocó. 43. Santander. 1850. Santander. 2000. Chocó. 5. Santander. 1200. Vaupés. 190. Vaupés. 192. Vaupés. 192. Santander. 2000. Santander. 1200. Vaupés. 192. Chocó. 5. 31.
(32) 83 Psychotria poeppigiana R. Cortés. 3227. 84 Psychotria rosea. W. Ariza. 8040. 85 Psychotria sacciformis. R. Cortés. 3348. 86 Psychotria saltatrix. R. Cortés. RC2463. 87 Psychotria sp.. E. Sastoque. 139. 88 Psychotria sp.. 2017-28. 90 Psychotria sp.. J. Richardson J. Richardson R. Cortés. 91 Psychotria sp.. R. Cortés. 2197. 92 Psychotria sp.. R. Cortés. 2872. 93 Psychotria sp.. R. Cortés. 3297. 94 Psychotria sp.. R. Cortés. 3299. 95 Psychotria sp.. R. Cortés. 3311. 96 Psychotria sp.. R. Cortés. 3314. 97 Psychotria sp.. R. Cortés. 3322. 98 Psychotria sp.. R. Cortés. 3323. 99 Psychotria sp.. R. Cortés. 3415. 10 Psychotria sp. 0 10 Psychotria sp. 1 10 Psychotria violacea 2. S. Ángel. 295. S. Ángel. 302. J. Mendoza. 137. 89 Psychotria sp.. 2017-47 1693. 2017 2017 2017 2017 2017 2017 2017 2017 2017 2018 2018 2018 2014 2014 2008 2008 2008 2008 2009 2009. Vaupés. 193. Santander. 1200. Antioquia. 201. Santander. 2000. Meta. 498. Chocó. 5. Chocó. 5. Meta. 467. Guainía. 200. Caquetá. 147. Vaupés. 180. Vaupés. 180. Antioquia. 573. Antioquia. 573. Antioquia. 865. Antioquia. 865. Magdalena. 650. Nariño. 1409. Nariño. 1409. Meta. 498. 32.
(33)
Figure



Documento similar
DS N° 012-2014-TR Registro Único de Información sobre accidentes de trabajo, incidentes peligrosos y enfermedades ocupacionales y modificación del art.110º del Reglamento de la Ley
Pero antes hay que responder a una encuesta (puedes intentar saltarte este paso, a veces funciona). ¡Haz clic aquí!.. En el segundo punto, hay que seleccionar “Sección de titulaciones
El contar con el financiamiento institucional a través de las cátedras ha significado para los grupos de profesores, el poder centrarse en estudios sobre áreas de interés
Cedulario se inicia a mediados del siglo XVIL, por sus propias cédulas puede advertirse que no estaba totalmente conquistada la Nueva Gali- cia, ya que a fines del siglo xvn y en
Abstract: This paper reviews the dialogue and controversies between the paratexts of a corpus of collections of short novels –and romances– publi- shed from 1624 to 1637:
Missing estimates for total domestic participant spend were estimated using a similar approach of that used to calculate missing international estimates, with average shares applied
Por lo tanto, en base a su perfil de eficacia y seguridad, ofatumumab debe considerarse una alternativa de tratamiento para pacientes con EMRR o EMSP con enfermedad activa
The part I assessment is coordinated involving all MSCs and led by the RMS who prepares a draft assessment report, sends the request for information (RFI) with considerations,

