CATEDRA: FISICA II
COMISIÓN Nº 8
Texto completo
COMISIÓN Nº 8
Figure
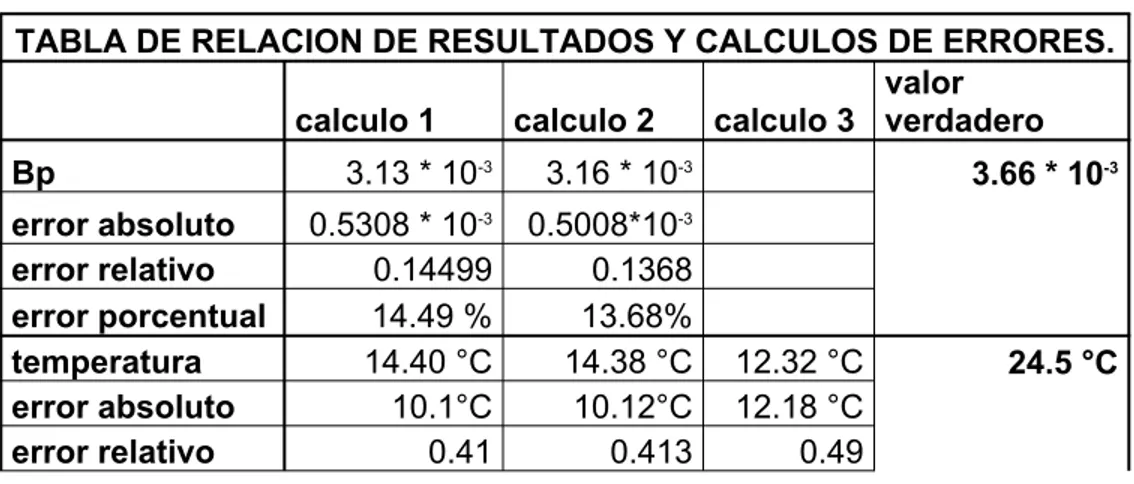
Documento similar
Para una minoría de los actores de la economía popular que ya participan como líderes de cadenas de valor en mercados competitivos, el freno mayor a su capacidad de expansión son
A partir de los resultados de este análisis en los que la entrevistadora es la protagonista frente a los entrevistados, la información política veraz, que se supone que
3.- Las tres barras delgadas de la figura son homogéneas y uniformes; en la intersección de las diagonales se encuentra una masa puntual según se muestra en la figura. En el punto
5.3 ROBERT BOSCH ESPAÑA, S.A. responde de las faltas de conformidad que existan en el momento de la entrega del pro- ducto y sean manifestadas por el consumidor, durante el plazo
Gastos derivados de la recaudación de los derechos económicos de la entidad local o de sus organis- mos autónomos cuando aquélla se efectúe por otras enti- dades locales o
1. LAS GARANTÍAS CONSTITUCIONALES.—2. C) La reforma constitucional de 1994. D) Las tres etapas del amparo argentino. F) Las vías previas al amparo. H) La acción es judicial en
Una vía intermedia sería la aplicabilidad teórica a otros tipos de suministros (¿con regularidad?), de determinadas normas del Regla- mento, especialmente las dedicadas a regular
En el material didáctico que se ofrece en este Proyecto Fin de Grado, como Actividades Prácticas, no se ha considerado cálculo de las instalaciones de