1
E L M U N D O
Q U E N O S
RODEA
INDICE
1.1 INTRODUCCIÓN ... 3
QUÍMICA: la ciencia de la materia ... 3
1.2 LA MATERIA ... 4
CONOCIENDO LA MATERIA ... 4
MASA, PESO Y ENERGÍA ... 4
1.3 LA MATERIA Y SUS ESTADOS ... 6
LOS ESTADOS DE AGREGACIÓN ... 6
El nivel submicroscópico ... 6
¿Qué es el plasma? ... 7
El modelo cinético ... 7
LOS CAMBIOS DE ESTADO ... 9
Los cambios de estado del naftaleno ... 12
1.4 LA MATERIA Y SUS PROPIEDADES ... 14
Propiedades extensivas e intensivas ... 14
1.5 LA CONSERVACIÓN DE LA MATERIA ... 19
¿QUÉ ES EL FLOGISTO? ... 19
El hombre que destruyó al flogisto. ... 19
¿Por arte de magia? ... 20
Equivalencia entre masa y energía ... 21
LA MEDICIÓN ... 23
La unidad de medida ... 23
QUÍMICA: la ciencia de la materia
Cotidianamente oímos la palabra química, pero en general, no sabemos de qué se trata. Entonces sur-ge la pregunta: ¿Qué es la Química? En nuestros días, la Química es una herramienta clave que nos permite
interpretar nuestro mundo circundante, desde lo más pequeño como las partícu-las constituyentes de la materia, hasta la composición de partícu-las galaxias o los fe-nómenos de la vida. Pero, ¿dónde ubicamos sus orígenes?
Es en el antiguo Egipto donde suele encontrarse el comienzo de las artes químicas. Los egipcios, expertos en el embalsamiento, en la metalurgia, la pre-paración de pigmentos, jugos e infusiones vegetales, son los que dan impulso a estos conocimientos.
Para algunos la palabra khemeia tiene sus orígenes en el nombre que los propios egipcios daban a su país: Kham. Así, khemeia podría significar “arte de los egipcios”. Para otros khemeia derivaría del griego khumos, cuyo significado es jugo de vegetales. Pero en lo que sí hay acuerdo es en establecer a khemeia como el antecedente de nuestra palabra química.
Fueron los filósofos griegos, quienes interesados en las causas de los fe-nómenos observados, a partir del siglo VI a.C desarrollaron lo que podríamos llamar la teoría química.
Es en la ciudad de Alejandría donde se produce la fusión de la química empírica de los egipcios con la teoría química de los griegos.
A partir del siglo VII, cuando los árabes se expanden, toman contacto con la tradición científica greco-egipcia asimilando rápidamente los saberes de la khe-meia. En árabe el vocablo khemeia se convirtió en al-kimya, palabra que luego los europeos la transformaron en Alquimia y sus cultores fueron llamados alquimistas. La alquimia fue la precursora de la Química y reinó por espacio de 200 años. Los alquimistas estaban obsesionados en transformar el cobre y el hierro en oro y pla-ta. Además, querían obtener algún líquido misterioso (elixir) que curase todas las enfermedades. Por supuesto, no lo lograron. Sus prácticas secretas y sus magros resultados los convirtieron en embusteros, tramposos y charlatanes.
En el siglo XVII, la alquimia entró en franca decadencia, transformándose en lo que hoy conocemos con el nombre de Química.
A partir de principios del siglo XIX, la Química ha tenido un desarrollo realmente vertiginoso. En nues-tros días la Química es imprescindible para la evolución de otras ciencias. Está presente en la Biología a tra-vés de la química celular, los microorganismos y las biomoléculas. En la Geología al estudiar la composición de las rocas y los minerales. En Medicina, mediante el estudio y aplicación de las drogas, en el mejoramiento de la nutrición, etc. En la industria aparecen constantemente mejores fibras sintéticas para la fabricación de ropas, metales más fuertes y mejores alimentos. En la Agricultura, cada vez es más frecuente el uso de insec-ticidas y de fertilizantes químicos, para regular el crecimiento de las plantas. Diariamente estamos en con-tacto con los cambios que ocurren en la naturaleza. Los árboles crecen, el agua se evapora, el carbón, la madera o el papel arden, el hierro se oxida, etc. La química tiene que ver con todos estos cambios.
Los fenómenos descriptos corresponden a procesos del mundo macroscópico, que podemos describir con nuestros sentidos. La Química también se ocupa de interpretar y explicar cómo y por qué ocurren las cosas. Para ello es necesario internarse en la naturaleza íntima de la materia, que nos conduce a un mundo que no podemos ver ni tocar, sino apenas imaginar. Es el mundo submicroscópico. El método científico para el avance de las ciencias, debe conciliar ambos mundos.
La Química es una ciencia experimental y como tal requiere de la observación y la experimentación, que provienen del mundo macroscópico. Pero, para explicar los hechos observados, se requiere de la creación de un modelo teórico a nivel submicroscópico. Aquí nos surge la pregunta ¿Qué es un modelo? En principio podemos decir que se trata de una teoría basada en la formulación de hipótesis o suposiciones, a través de
¿HACIA DONDE VAMOS ?
las cuales es posible explicar los hechos experimentales.
Finalmente y a manera de resumen podemos dar una respuesta más formal a la primera pregunta que hicimos, diciendo:
La Química es la ciencia que estudia la naturaleza de la materia, sus propiedades, las modificaciones que se producen en su composición y los cambios de energía que acompañan a las mis-mas.
Ahora los invitamos a realizar un viaje fantástico, para descubrir el mundo que nos rodea, sus misterios y las cosas que allí suceden.
¡Allá vamos!
CONOCIENDO LA MATERIA
Nos relacionamos con el mundo que nos rodea a través de nuestros sentidos. Son ellos los que nos permiten percibir los objetos que están a nuestro alrededor. Pero, ¿de qué están hechas las cosas?
En principio, podemos decir que todo objeto está constituido por materia. ¿Y qué es la materia?
Todo lo que nos rodea es de naturaleza material: una silla, un auto, un vele-ro, un pervele-ro, nosotros. En general, todo lo que podemos ver o tocar está constituido por materia.
Ahora podemos definir:
La materia tiene masa y ocupa un lugar en el espacio; decimos que es exten-sa. El mundo que nos rodea y el Universo, están formados por materia y en ellos ocurren fenómenos físicos y químicos.
Toda porción limitada de materia recibe el nombre de cuerpo. Es decir, un cuerpo es un objeto material caracterizado por su forma. Por ejemplo, son cuerpos una manzana, una silla, una pelota, el agua contenida en un vaso, el mismo vaso, etc. En otras palabras, los cuerpos están constituidos por materia.
También estamos en contacto con fenómenos como el viento, que lo percibi-mos aunque no lo podepercibi-mos ver ni tocar. Muchas veces nos habrepercibi-mos preguntado: ¿Qué es el viento? En princi-pio diremos que no es otra cosa que un desplazamiento de aire, producido por diversas causas, como por ejemplo diferencias de presión entre dos lugares.
MASA, PESO Y ENERGÍA
Ya hemos señalado que la materia está caracterizada por tener masa. Pe-ro,...¿qué es la masa de un cuerpo? Veamos:
Muchos objetos de forma y tamaño similar pueden diferir respecto de su mo-vimiento. Una esfera de plomo del tamaño y aspecto de una pelota de golf, se vería igual que una auténtica, aunque sería mucho más pesada. Imaginemos qué pasaría si golpeamos con un palo de golf a esta pelota. Evidentemente, apenas se movería. En cambio, si aplicamos el mismo golpe a una pelota verdadera ésta recorrería un gran camino. Esto ocurre debido a que la pelota de plomo ofrece mayor resistencia que la de golf.
La distinta resistencia que ofrecen los cuerpos al movimiento recibe el nombre de inercia y es propia del cuerpo. La magnitud que mide la inercia de un cuerpo es la
masa. La pelota de plomo tiene más inercia que la de golf y por lo tanto tiene mayor masa. Un objeto que tiene mucha masa presenta gran resistencia al movimiento. La unidad de masa adoptada por el Sistema Métrico Legal Argentino (SIMELA) es el kilogramo (kg).
¿En qué se diferencia la masa de un cuerpo de su peso?
Todos sabemos que al soltar un objeto que sostenemos en la mano, se cae. Si preguntamos por qué se cae, a menudo escuchamos que es por la
Ley de la Gravedad. Esta ley fue descubierta por Isaac Newton, según cuen-ta la leyenda, cuando escuen-tando sencuen-tado a la sombra de un manzano observó como se caían las manzanas. Pero no es debido a la ley de gravedad que se caen los objetos, ya que antes de Newton también se caían las manzanas. La experiencia nos muestra que si soltamos un objeto que está suspendido en el aire, se cae. La explicación de este hecho es que debe actuar alguna fuerza sobre el objeto que lo hace caer.
Newton descubrió que entre dos cuerpos cualesquiera siempre exis-te una fuerza de atracción, que recibe el nombre de fuerza gravitatoria. Esta afirmación es conocida como Ley de Gravitación Universal. La ley se extiende a todos los objetos del Universo: la Tierra atrae a la Luna y ésta atrae a la Tierra. De aquí surge el concepto de peso de un cuerpo:
En definitiva podemos decir que el peso y la masa son magnitudes distintas. La masa es una medida de la cantidad de materia de un cuerpo y es una constante propia del mismo. El peso, en cambio, es una fuerza y varía ligeramente con el lugar de la Tierra donde se mida. Los químicos no usan el peso sino la masa.
Seguidamente veamos otra característica que presenta la materia.
Lo que permite que los hombres caminen, las plantas crezcan, los autos corran, los trenes funcionen...lo podemos sintetizar en una sola pala-bra: Energía. Intuitivamente todos sabemos de qué se trata, pero nos resul-ta difícil definirla. A diferencia de la materia, no la podemos ver ni tocar, sólo la percibimos a través de sus efectos.
Los científicos reconocen principalmente dos formas básicas de ener-gía mecánica: la enerener-gía potencial y la cinética.
La energía potencial (Ep) es básicamente la capacidad que tiene un cuerpo de realizar trabajo debido a la posición que ocupa respecto de la Tierra. Por ejemplo, el agua que se encuentra en la parte superior de una cascada, tiene energía potencial, porque puede caer. También posee energía potencial una piedra sus-pendida en el aire, porque tiene la posibilidad de caer. En cambio, una pelota que ha caído sobre la playa no tiene más posibilidad de caer y por lo tanto no posee energía potencial. Cuanto más alto se halla un objeto, mayor es su energía potencial.
La energía cinética (Ec), en cambio, está asociada al movimiento de un cuerpo. Por ejemplo, el agua que está cayendo en la cascada, o la piedra yendo a través del aire. La energía cinética de un cuerpo puede calcularse mediante la fórmula Ec = ½ m v2, siendo m la masa del cuerpo y v su velocidad. Cuanto mayor es
la velocidad de un objeto mayor es su energía cinética.
Diariamente estamos en contacto con distintas manifestaciones de la energía. Por ejemplo, cuando conec-tamos una plancha, ésta recibe energía eléctrica que luego se transforma en calor (energía calórica). Si encendemos una lamparita, la energía eléctrica calienta el filamento de tungsteno, que devuelve la energía adquirida en forma de luz (energía radiante). Las pilas que usamos a diario, proveen energía eléctrica a ex-pensas de energía química. Estos ejemplos nos indican que la energía se presenta de distintas formas que pueden convertirse unas en otras.
No obstante las evidencias mencionadas, resulta difícil encontrar una definición que exprese en forma acabada que es la energía.
En principio, podemos decir que:
Energía: es la capacidad que tiene un cuerpo para realizar trabajo.
El peso de un cuerpo en un lugar determinado de la Tierra, es la fuerza de atracción que ejerce la Tierra sobre él.
Isaac Newton
LOS ESTADOS DE AGREGACIÓN
Una de las propiedades más destacadas de la materia, es quizá, estado físico. Habitualmen-te la maHabitualmen-teria se presenta en tres estados físicos diferenHabitualmen-tes denominados estados de agregación: sólido, lí-quido y gaseoso. Por ejemplo, tanto un trozo de madera como uno de carbón son sólidos; el agua o el alcohol son líquidos; el aire o el gas natural con que cocinamos, son gases. Pero, ...¿cuáles son las características de cada uno de estos estados?
Los sólidos tienen forma y volumen propios y prácticamente no se los puede comprimir (son incompresibles). A nivel submicroscópico, es el estado más ordenado y las partículas que lo constituyen for-man un conjunto compacto, que les impide trasladarse.
Los líquidos, en cambio, si bien tienen volumen propio, adoptan la forma del recipiente que los contiene, son poco compresibles, y sus partículas pueden deslizarse unas sobre otras, lo cual les posi-bilita fluir. El estado líquido es más desordenado que el sólido, pero menos que el gaseoso.
Finalmente, los gases, no tienen forma ni volumen propios. Ocupan todo el espacio del recipiente que los contiene y se comprimen fácilmente. Es el estado de máximo desorden y sus partículas se mueven al azar.
Tanto los líquidos como los gases presentan la cualidad de deslizarse, es decir, fluyen. Por esta razón se los conoce con el nombre de fluidos.
Cotidianamente estamos en contacto con materiales diferentes que se hallan en distintos estados. Por ejemplo, cuando abrimos una canilla (cuerpo sólido) nos encontramos con agua (líquido) que
fluye por ella. Haciendo lo propio con una perilla de la cocina, se escapa el gas que también fluye.
El nivel submicroscópico
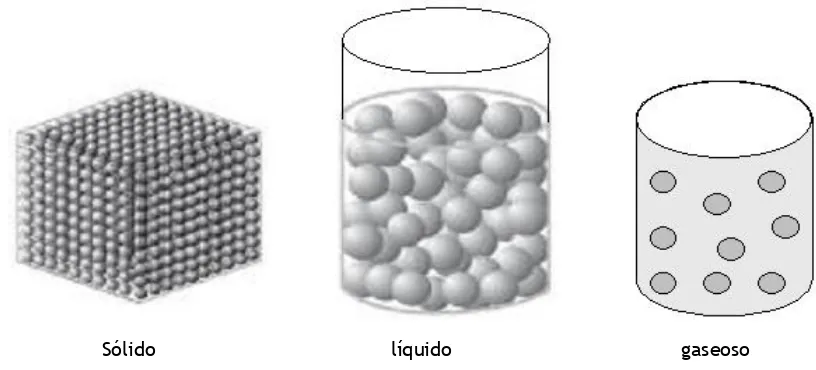
Para explicar los hechos observados en el mundo macroscópico, hay que estu-diar la estructura de la materia y para ello es indispensable recurrir al mundo submicroscópico. Podemos imaginar este mundo, admitiendo que está constituido por partículas tan pequeñas que no pueden ser perci-bidas directamente por nuestros sentidos ni aún en el microscopio más potente. Partiendo de la base que la materia está formada por minúsculas partículas invisibles, podemos representar, a nivel submicroscópico, los tres estados de la materia de la manera siguiente:
[image:6.595.99.507.508.693.2]Sólido líquido gaseoso
En la Figura 1 podemos apreciar que el sólido tiene forma y volumen pro-pio, el líquido adopta la forma del recipiente, mientras que el gas ocupa todo el espacio disponible.
Una manera de representar la materia a nivel submicroscópico, es median-te dibujos esquemáticos, que simbolizan un ínfimo número de partículas repre-sentativo de toda la muestra.
Estos esquemas pueden ser útiles para visualizar los estados de la materia. En las figuras que aparecen en la columna de la izquierda se ilustran los mismos. El estado sólido aparece como el más ordenado, el gaseoso el más desordenado y el líquido como un estado intermedio entre ambos.
¿Qué es el plasma?
Hemos presentado los tres estados de la materia, sin embargo, frecuentemente oímos hablar acerca de un cuarto estado: el plasma.
¿Qué es el plasma?
En principio podemos decir que el plasma es el cuarto estado de la materia, generalmente gaseoso, pero en este caso algunas de las partículas que lo compo-nen están cargadas eléctricamente. El plasma está constituido por un conjunto de partículas, que pueden ser neutras, positivas y negativas. Podríamos describir al plasma como un estado material semejante al gaseoso a alta temperatura, que, en conjunto resulta eléctricamente neutro. Prácticamente no existe el plasma en la naturaleza, salvo en los relámpagos y en las capas superiores de la atmósfera, donde se produce el fenómeno conocido como aurora boreal. Cuando los gases se encuentran a muy elevadas temperaturas, (millones de grados) como ocurre en el Sol y en otras estrellas, se obtienen partículas cargadas eléctricamente. Por eso, la mayor parte del Universo está constituido por materia al estado de plasma.
El modelo cinético
A los efectos de explicar la naturaleza de sólidos, líquidos y gases, es conveniente analizar el comportamiento de las partículas que los constituyen.
Cuando dejamos pasar los rayos del sol a través de una ventana, es muy frecuente observar partículas de polvo suspendidas en el aire, que se mueven continuamente en distintas direcciones como impulsadas por fuerzas invisibles. En 1827, Robert Brown observó un movimiento similar en pequeñas partículas sólidas (granos de polen) suspendidas en un gas o en un líquido. El movimiento era al azar en forma de zigzag y más intenso cuanto menor era la partícula suspendida, y más elevada la temperatura. Este fenómeno es conocido con el nombre de movimiento browniano, en homenaje a su descubridor.
Ahora bien, ¿Por qué se mueven las partículas sólidas suspendidas en un gas o un líquido?
En principio, podemos suponer que las partículas del gas o del líqui-do se mueven y chocan a las partículas del sólilíqui-do suspendilíqui-do, a las que les con-fieren su movimiento.
Hacia 1860 Maxwell y Boltzmann, con el objeto de dar una interpre-tación general de este fenómeno, propusieron la teoría cinética de la materia, basada en los siguientes enunciados:
Las partículas constituyentes de la materia están en movimiento, es decir, poseen energía cinética.
El calor es una manifestación de este movimiento Estado sólido
Estado líquido
Estado gaseoso
Trayectoria de un
movimiento
Cuanto mayor es la temperatura tanto mayor es la energía cinética media (promedio) de las partículas.
Entre las partículas existen fuerzas de atracción.
De acuerdo con esta teoría los químicos explicaron las características de sólidos, líquidos y gases, según:
Sólidos
Las partículas del sólido se atraen entre sí con gran intensidad, de tal modo que su energía cinética no es suficiente para que se deslicen. Están situadas muy cerca unas de otras, ocupando posiciones fijas en el espacio formando, en general, un ordenamiento regular que se mantiene en todo el sólido. Esto hace que los sólidos tengan forma y volumen propios y que al aumentar la presión su volumen prácticamente no varíe (son incompresibles).
Líquidos
En los líquidos las partículas se atraen entre sí con menor intensidad que en los sólidos, pero la atracción es suficiente como para que estén muy cerca unas de otras, por ello, los líquidos son casi incompresibles. Sin embargo, a diferencia de los sólidos, las partículas de los líquidos gozan de cierta libertad como para deslizarse unas sobre otras. Por esta razón los líquidos pueden fluir.
Gases
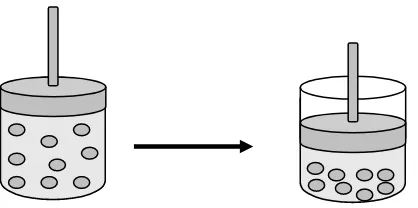
Las partículas de los gases chocan entre sí y con las paredes del recipiente que los contiene. Prácticamente no se atraen, por lo cual se encuentran muy alejadas unas de otras ocupan-do toocupan-do el espacio que tienen disponible. Esto explica la gran compresibilidad de los gases, daocupan-do que un au-mento de la presión implica una disminución de la distancia entre las partículas, disminuyendo el volumen, como se muestra en la Figura 2.
A continuación, con el objeto de verificar el movimiento de las partículas de un fluido como el agua, (movimiento browniano), les proponemos la siguiente actividad:
Un movimiento “partic
u
lar”
a) Llenar dos vasos de precipitados, uno con agua fría y el otro con agua caliente.
b) Agregar simultáneamente en ambos vasos una gota de tinta preferente-mente roja o verde.
[image:8.595.206.415.381.485.2]c) Observar lentamente, que la tinta se va mezclando lentamente con el agua. El proceso se denomina difusión.
Figura 2: Vista submicroscópica de la compresión de un gas.
d) ¿La velocidad de difusión es la misma en ambos vasos? e) Dejar en reposo sin tocar durante 24 horas. Luego de transcurrido ese tiempo, observar nuevamente.
Al cabo de las 24 h. se observa que la tinta ha difundido en el agua.
La difusión es más rápida a mayor temperatura.
Esto puede explicarse según la teoría cinética de la materia, de la siguien-te manera: las partículas de agua se mueven chocando con las partículas de tinta, por lo cual éstas se despla-zan lentamente en el agua, es decir, difunden.
A mayor temperatura, las partículas de agua se mueven a más velocidad, acelerando el proceso de difusión de las partículas de tinta.
LOS CAMBIOS DE ESTADO
La experiencia nos muestra que es posible pasar de un estado de agregación de la materia a otro.
Por ejemplo, todos sabemos que si dejamos durante un tiempo a temperatura ambiente (20ºC) un trozo de hielo (agua en estado sólido), se derrite formando agua al estado líquido. El hielo se ha fundido y este proce-so recibe el nombre de fusión. Durante la fusión del hielo la temperatura permanece constante en 0ºC. La fusión es el pasaje del estado sólido al líquido. En los siguientes esquemas representamos este proceso a nivel submicroscópico.
Podemos comprobar experimentalmente que durante cualquier proceso de fusión, la temperatura no cambia. La temperatura a la cual ocurre la fusión depende del material en cuestión y de la presión a la que se realiza. Luego definimos:
Si la fusión se realiza a presión atmosférica normal (1013 hPa), esta temperatura se denomina punto de fusión normal. Si luego de la fusión del hielo calentamos el agua obtenida, la temperatura aumenta hasta llegar a los 100ºC, donde permanece constante. A esta temperatura observamos que el agua hierve. Este proceso que ocurre en toda la masa del líquido, recibe el nombre de ebullición.
EBULLICIÓN: Es el pasaje de líquido a vapor que tiene lugar en toda la masa de líquido, a una temperatura y presión determinadas.
CONCLUSIONES DE
ACTIVIDAD 1
SE VIENEN LOS
CAMBIOS
PUNTO DE FUSIÓN:
Es la temperatura a la cual un sólido funde a una presión
determi-nada
.
Estado sólido Estado líquido
Durante la ebullición de cualquier líquido, la temperatura permanece constante. La temperatura a la cual un líquido hierve depende de la naturaleza del mismo y de la presión.
Luego definimos:
Si la ebullición ocurre a presión normal, esta temperatura recibe el nombre de punto de ebulli-ción normal.
Ahora bien, es evidente que luego de lavar el piso éste se seca a temperatura ambiente. Lo mismo ocurre cuando ponemos a secar ropa, o cuando se seca nuestro cabello luego de lavarlo. Estos hechos nos indican que el agua pasa de líquido a vapor aún a temperatura ambiente. Este proceso ocurre en la super-ficie del líquido a cualquier temperatura y se denomina evaporación:
EVAPORACIÓN: es el pasaje de líquido a vapor que se produce desde la superficie de un líquido a cualquier temperatura.
En conclusión, la diferencia esencial entre evaporación y ebullición reside en que la evapora-ción ocurre a cualquier temperatura y sólo desde la superficie, mientras que la ebullievapora-ción, sólo se produce a una temperatura determinada y en todo el líquido.
Los pasajes que experimenta la materia de un estado de agregación a otro, como consecuencia de absorción o liberación de calor, se denominan cambios de estado. Pueden lograrse mediante la variación de la temperatura, la presión o ambas a la vez.
Estos cambios que no producen alteraciones en la composición de la matera, son transformacio-nes físicas. Reciben nombres característicos, siendo los más utilizados los que indicamos en el siguiente es-quema:
volatilización
fusión vaporización
SÓLIDO LÍQUIDO GASEOSO
solidificación condensación[image:10.595.103.500.434.576.2]
sublimación
Figura 3: Esquema de los cambios de estado de la materia
Cotidianamente podemos presenciar los distintos cambios de estado de la materia. Por ejemplo:
Cuando calentamos cera, o cuando se producen los deshielos en el verano, estamos en presencia de procesos de fusión.
En el congelamiento de los lagos en invierno, o en la formación de hielo en el freezer, se produce solidificación.
Son ejemplos de vaporización, la ebullición del agua, la evaporación de un solvente, la evaporación del agua en el proceso de formación de las salinas, etc.
La condensación se presenta en la formación de las nubes, o de la niebla, o en las gotitas de agua que aparecen sobre el vidrio de una ventana, en épocas de bajas temperaturas.
El gas de garrafa (gas licuado) que se usa como combustible, o el nitrógeno
PUNTO DE EBULLICIÓN:
Es la temperatura a la cual un líquido hierve a una presión
líquido usado para preservación, preparados biológicos a bajas temperaturas (criogenia), son obtenidos por procesos de licuación.
La volatilización ocurre por ejemplo, con la naftalina que colocamos en la ropa como antipolillas, o cuando exponemos “hielo seco” al aire.
Cuando el yodo al estado gaseoso es enfriado, se obtienen cristales por su-blimación.
Con el objeto de observar la volatilización del dióxido de carbono sólido, les pro-ponemos la siguiente actividad.
“
Humos danzantes”
a) Colocar agua en un vaso de precipitados de 1 litro, hasta aproxima-damente la mitad de su capacidad.
b) Agregar unas gotas de tinta roja al agua.
c) Introducir un trozo de “hielo seco” mediante una pinza, para evitar el contacto con los dedos ya que produce quemaduras.
d) Observar que ocurre e interpretar los hechos.
El “hielo seco” es dióxido de carbono al estado sólido
El dióxido de carbono se volatiliza, es decir pasa del estado sólido directamente al gaseoso, sin pasar por el líquido.
Debido a que el hielo seco está a temperaturas inferiores a 0ºC y que además presenta las características de “no mojar”, es muy utilizado para la conservación de helados.
Los cambios de estado del agua
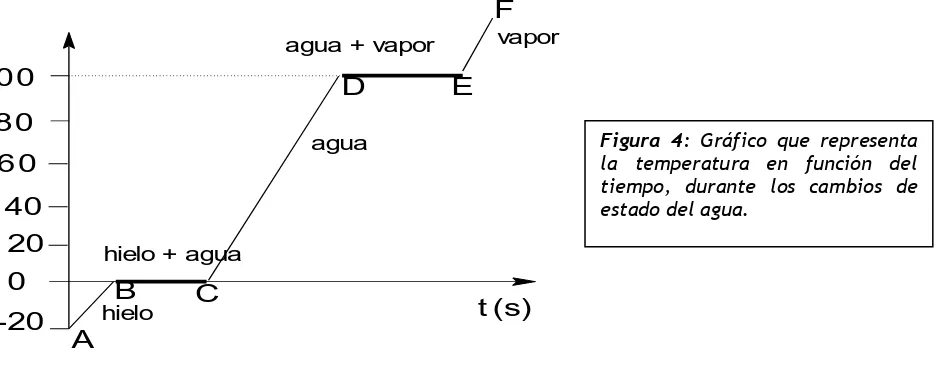
A continuación analizaremos los cambios de estado que se producen cuando, a presión normal, calentamos agua desde su estado sólido hasta llevarla a vapor. Para ello, podemos partir de cubitos de hielo extraídos del freezer, a –20ºC, colocados en un recipiente que luego de cerrarlo, se caliente uniformemente. Primero se produce el pasaje del estado sólido al líquido y luego del líquido al gaseoso.
Si medimos la temperatura del sistema y representamos sus valores en función del tiempo transcu-rrido, obtenemos un gráfico como el que se muestra en la Figura 4., denominado curva de calentamiento.
-20
0
20
40
6 0
80
100
hielo
hielo + agua
agua
agua + vapor vapor
A
B
C
D
E
F
t (s)
En el gráfico podemos distinguir dos situaciones diferentes, ya que hay unas líneas horizontales y
ACTIVIDAD 2
CONCLUSIONES DE
ACTIVIDAD 2
[image:11.595.70.538.558.741.2]otras oblicuas.
1) En cada uno de los tramos de las líneas oblicuas (A-B; C-D; E-F), hay un solo estado: hie-lo, agua líquida o vapor de agua. En cada uno de ellos, se observa un aumento de la temperatura del sistema sin que el estado de agregación se modifique. En estas zonas, el sistema (agua), aprovecha el calor recibido para aumentar la energía cinética media de sus partículas y aumentar en consecuencia la temperatura. 2) En los tramos horizontales ocurren los cambios de estado. En B-C, se produce la fusión del hielo (0ºC) y en D-E, ocurre la vaporización del agua líquida (100ºC). En ambas zonas, la temperatura permanece constante mientras que cambia el estado de agregación del sistema. Durante la fusión coexisten hielo y agua líquida, y en la vaporización, agua líquida y vapor de agua. En estos tramos, el calor recibido por el sistema no es utilizado para aumentar la energía cinética de las partículas sino para vencer las fuerzas de atracción que operan entre ellas. Por esta razón el calor entregado en estos tramos no se traduce en un au-mento de la temperatura. Durante la fusión coexisten hielo y agua líquida y en la vaporización, durante la cual se verifica la ebullición, agua líquida y vapor. Por otra parte, es claro que cuanto mayor sea la masa del sistema, tardará más tiempo en cambiar de estado y por lo tanto, las longitudes de las rectas BC y DE, serán mayores.
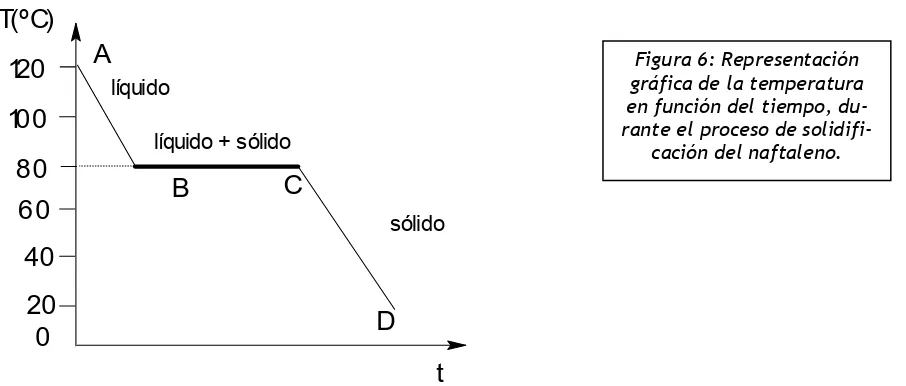
Los cambios de estado del naftaleno
Seguidamente analicemos el comportamiento del naftaleno sólido si lo calentamos hasta temperaturas superiores a su punto de fusión y luego se deja enfriar hasta temperaturas inferiores al mismo.
Representando gráficamente los valores de la temperatura en función del tiempo, podemos construir dos curvas: una de calentamiento y otra de enfriamiento.
Por otra parte, al análisis de estas curvas nos permitirá determinar el punto de fusión y el de solidifica-ción del naftaleno.
a) Curva de calentamiento
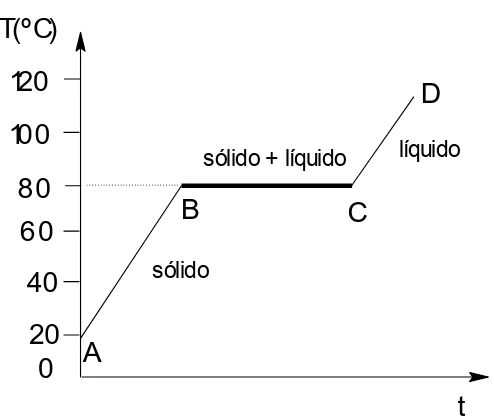
[image:12.595.178.425.506.715.2]Para realizar esta parte de la experiencia, pulverizamos en un mortero naftaleno sólido a temperatura ambiento y lo colocamos en un tubo de ensayos hasta un tercio de su capacidad. Luego introducimos el bulbo de un termómetro en el naftaleno y colocamos el conjunto en un vaso de precipitados con agua. Ahora calentamos el agua hasta ebullición, registrando la temperatura del naftaleno, hasta que ésta alcance aproximadamente los 95ºC. Observemos la temperatura en que comienza y termina la fusión.
Figura 5: Representación gráfica de la temperatura en función del tiempo, durante el proceso de fusión de naftaleno.
0
20
40
60
80
100
sólido
sólido + líquido
líquido
A
B
C
D
t
T(ºC)
En el gráfico podemos distinguir diferentes zonas:
La zona A-B, representa el calentamiento del sólido, sin que su estado de agregación se modi-fique. El sistema (naftaleno) utiliza el calor recibido para aumentar la energía cinética de sus partículas y aumentar consecuentemente la temperatura. En el punto B comienza la fusión.
En el tramo B-C, se produce la fusión del naftaleno (80ºC) y la temperatura permanece cons-tante. Durante la fusión coexisten naftaleno sólido y líquido. El calor recibido por el sistema no es utilizado para aumentar la energía cinética de sus partículas sino para vencer las fuerzas de atracción que operan en-tre ellas. Por esta razón el calor enen-tregado en este tramo no se traduce en un aumento de la temperatura. La parte C-D, del gráfico corresponde al calentamiento del naftaleno en estado líquido, sin cambiar su estado de agregación. Al igual que en la zona A-B, la temperatura asciende con el tiempo, debido a que el sistema utiliza el calor recibido para aumentar la energía cinética de sus partículas.
b) Curva de enfriamiento
Así como hemos desarrollado una curva de calentamiento, es posible representar el fenómeno correspondiente a una curva de enfriamiento. Como hemos visto, en el caso anterior, el sistema necesitó energía para pasar de la fase sólida a la líquida.
Cuando se produce el proceso inverso, es decir el pasaje del estado líquido al sólido, el siste-ma libera energía en forsiste-ma de calor.
Consideremos, el proceso de solidificación del naftaleno.
Para ello, primero lo calentamos hasta temperaturas superiores a su punto de fusión, por ejemplo a 95ºC, de modo que esté al estado líquido.
Si dejamos enfriar el sistema, la temperatura desciende en principio hasta los 80ºC, donde comienza la solidificación del naftaleno. Aquí coexisten líquido y sólido y la temperatura permanece constan-te, hasta que todo el naftaleno haya solidificado.
Luego que esto ocurre, la temperatura desciende nuevamente.
Midiendo la temperatura del sistema durante cierto tiempo, podemos construir una curva de enfriamiento, como el de la Figura 6.
En el tramo A-B, el naftaleno en estado líquido cede calor al medio ambiente, disminuyendo la energía cinética de sus partículas y la temperatura sin cambiar su estado de agregación.
En la zona C-D se produce el cambio de estado de líquido a sólido sin variar la temperatura. Durante la solidificación coexisten naftaleno líquido y sólido. El calor liberado por el sistema es utilizado en el proceso de solidificación y mientras éste dura la energía media de las partículas no varía y la temperatura tampoco.
Finalmente, la zona D-E representa el enfriamiento del naftaleno sólido, sin cambiar su es-tado de agregación. El sistema cede calor al medio ambiente disminuyendo la energía cinética y la
tempera-Figura 6: Representación gráfica de la temperatura en función del tiempo, du-rante el proceso de
solidifi-cación del naftaleno.
T(ºC)
80
sólido
líquido + sólido
líquido
A
B
C
D
t
0
[image:13.595.97.550.452.645.2]tura.
Si ahora comparamos el punto de solidificación del naftaleno con el de fusión, vemos que coinciden.
En la siguiente actividad intentaremos hervir agua en una caja de papel ¿Cómo puede ser?
“La olla de p
a
pel”
a) Doblar una hoja de papel de manera de armar una caja abierta.
b) Colocar la caja de papel sobre una tela metálica en un trípode c) Calentar hasta ebullición mediante un mechero
d) Registrar la temperatura de ebullición.
El agua hierve a 100ºC
El papel no se quema, debido a que está humedecido y esto impide la combustión.
Este hecho puede explicarse pensando que el calor suministrado es usado para vaporizar el agua y no para que el papel arda.
Propiedades extensivas e intensivas
Los cuerpos presentan diversas características que permiten distinguirlos entre sí, que son sus propiedades.
Son ejemplos de propiedades: densidad, color, volumen, masa, peso, etc.
A continuación presentamos la anécdota en la que Arquímedes descubrió como medir el vo-lumen de cuerpos de forma irregular y determinar la densidad de los mismos.
La corona de HierónCuenta la leyenda que Hierón II, rey de Siracusa (siglo III a.C) había encargado a un joyero una nueva corona, entregándole una determinada cantidad de oro
.
La corona terminada pesaba lo mismo que el oro recibido, pero el rey sospechaba que el joyero lo había mezclado con cierta cantidad de plata para beneficiarse.Ya por entonces se sabía que volúmenes iguales de materiales distintos no pesaban lo mismo. Un cubo de oro es más pesado que uno igual de plata. Una manera simple de descubrir si había habido engaño, era fundir la corona hacer con ella un cubo y pesarlo. Si pesaba menos que otro cubo de oro puro de igual tamaño, la corono había sido adulterada. Pero esta solución sencilla implicaba la destrucción de la corona. Hierón solicitó al sabio Arquímedes que constatara si la
ACTIVIDAD 3
CONCLUSIONES DE
ACTIVIDAD 3
corona que la había fabricado el orfebre, era realmente oro puro, pidiéndole que no la dañara.
Arquímedes se encontró con un verdadero acertijo. Así fue que luego de pensar durante muchos días, supuso que si comparaba los volúmenes de la corona con el de un trozo de oro de igual masa, de resultar iguales la corona sería auténtica. ¿Pero cómo medir el volumen de la corona, que era un cuerpo irregular?. Pasó un tiempo hasta que un día al sumergirse en una tina para darse un baño, encontró la solución. Al meterse en la bañera, naturalmente el volumen de agua subía. Cuanto mayor era la parte de su cuerpo sumergido, tanto más alto era el nivel alcanzado por el agua. El sabio se dio cuenta que había encontrado una excelente manera de medir el volumen de un cuerpo irregular. Supuso que el volumen del agua que se desbordaba de la tina, debería ser igual al volumen de la parte de su cuerpo sumergida. Luego, midiendo el volumen del agua que se desalojaba al meter la corona, podía conocer el volumen de la misma. Su descubrimiento le produjo tal excitación a Arquímedes, que salió del baño desnudo y fue corriendo hacia el palacio exclamando ¡Eureka, Eureka!. (Lo encontré, lo encontré). Al llevar a la práctica su descubrimiento, Arquímedes pudo comprobar que la corona era falsa. El rey había sido engañado y el codicioso orfebre fue declarado culpable y ejecutado.
Desde entonces sabios e ingenieros, hicieron la relación entre la masa de un cuerpo y el volumen del agua que desaloja siendo este cociente la densidad del cuerpo.
Seguidamente, les proponemos realizar la siguiente actividad, para determinar el valor de la densi-dad de diferentes materiales.
¡Eureka, Eureka!
a)Determinar, mediante una balanza, las masas de tres muestras suminis-trada de dos metales distintos (1y 2), como por ejemplo hierro y plomo.
b)Medir el volumen de cada una de ellas, utilizando una probeta graduada (¡Eureka! Exclamó Ar-químedes, al salir de la tina de baño y correr por las calles de Siracusa)
A partir de los resultados obtenidos, completar el siguiente cuadro:
Muestra Masa (g) Volumen
(cm3) m/v (g/cm3)
Metal 1 1 2 3 Metal 2 1 2 3
c) Determinar la densidad de ambos metales, efectuando el promedio de los resultados obteni-dos en la última columna del cuadro.
d) Identificar ambos materiales a través del valor de la densidad de cada uno (consultar tablas).
¿La densidad depende de la masa? ¿Es característica de cada sustancia?
Arquímedes
Nacido en Siracusa en el año 287 a.C, Arquímedes hijo de un as-trónomo griego, dedicó su vida a estudios filosóficos y matemáti-cos. De él es la célebre frase “Dadme un punto de apoyo y moveré el mundo”. Con ella sus-tentó el desarrollo del funciona-miento de la palanca, mediante el cual el hombre ha podido multiplicar su fuerza para mover objetos muy pesados. Le dio su nombre a un famoso principio de la hidrostática. Demostró ade-más, que la esfera es el cuerpo sólido de mayor volumen para igual superficie.
Las masas y los volúmenes de las muestras de los metales son diferen-tes, puesto que dependen de la cantidad de materia que contiene cada una de ellas.
La densidad es la relación entre la masa de un cuerpo y el volumen que ocupa = m / v
En la última columna del cuadro podemos observar que la densidad es la misma para las distintas muestras del mismo material. Por consiguientes, la densidad no depende de la cantidad del material utilizado.
Las densidades de ambos metales son diferentes. Luego, la densidad es característica de cada sustancia.Teniendo en cuenta la Actividad 4, tanto la masa como el volumen son propiedades que varían con la cantidad de materia tomada, y se las denomina propiedades extensivas:
Las propiedades extensivas deben medirse sobre toda la porción de materia considerada. Co-mo ejemplos de este tipo de propiedades, podeCo-mos citar: masa, peso, volumen, superficie, etc. Las propie-dades extensivas no permiten identificar un material. Por ejemplo, la plata y el platino pulidos son metales grises y brillantes que pueden confundirse. Midiendo las masas o los volúmenes de dos muestras de ambos metales no podemos discernir cuál es cuál. Por consiguiente, para identificar un material es necesario anali-zar otras propiedades que lo caractericen. Son las propiedades intensivas, cuyos valores no cambian con la cantidad de materia de las muestras consideradas. Por ejemplo, la densidad de la plata es 10.5 g/cm3 y la del
platino 21.4 g/cm3.
Como podemos comprobar en la última columna del cuadro de la actividad 4, la densidad es una propiedad intensiva. Luego definimos:
Estas propiedades están determinadas por la naturaleza del material considerado y no por la cantidad de materia que contiene, por lo tanto pueden medirse sobre cualquier porción del sistema. Son ejemplos de propiedades intensivas: densidad, punto de fusión, punto de ebullición, dureza, conductividad eléctrica, conductividad térmica, etc.
Las propiedades intensivas son características del material y permiten identificarlo. Así por ejem-plo, el punto de ebullición normal del agua es 100ºC y del alcohol etílico 78ºC. Luego si queremos diferenciar una muestra de agua de otra de alcohol, les determinamos sus puntos de ebullición normales. El líquido que hierve a 100ºC, es agua y el otro (78ºC) es alcohol.
Por otra parte, la densidad de los sólidos, líquidos o gases depende de la temperatura, debido a que el volumen cambia con la misma. En general, a medida que aumenta la temperatura de un cuerpo, au-menta su volumen y por lo tanto disminuye la densidad.
Sin embargo, el agua presenta un comportamiento particular, ya que alcanza el máximo valor de su densidad ( = 1 g/cm3), a 4ºC. A temperaturas inferiores o superiores de 4ºC, la densidad del agua disminuye
ligeramente. Esta característica única del agua, nos indica que el hielo, es menos denso que el agua al estado líquido. Esto explica los siguientes hechos:
El hielo flota en el agua. Este fenómeno se presenta en la naturaleza en el caso de los icebergs.
Los lagos se congelan sobre la superficie, permitiendo la vida de los peces debajo de la capa de hielo formada, donde el agua se encuentra a temperaturas mayores que 0ºC.
CONCLUSIONES DE
ACTIVIDAD 4
PROPIEDADES EXTENSIVAS:
Son aquellas que dependen de la cantidad de materia
consi-derada, es decir, de la masa del sistema.
PROPIEDADES INTENSIVAS:
Son aquellas que no dependen de la cantidad de materia
Finalmente, concluimos que las propiedades extensivas, cambian según el tamaño de la muestra, mientras que las intensivas no. Esta conclusión queda resumida en la siguiente tabla, donde se indican los valores de algunas propiedades para dos muestras de agua a 4ºC.
PROPIEDAD
Volumen de agua 10 cm3 100 cm3
Masa de agua 10 g 100 g
Densidad del agua 1.00 g/cm3 1.00 g/cm3
Punto de ebullición
nor-mal 100ºC 100ºC
Ahora los invitamos a pensar
1.
Los siguientes diagramas representan, a nivel submicroscópico, partículas de agua al estado sólido, líqui-do y gaseoso. Completar el esquema central y colocar los nombres faltantes en las líneas punteadas.2.
El meta-xileno es un solvente orgánico utilizado en la fabricación de barnices, pinturas e insecticidas. Se tiene una muestra de m-xileno líquido a –20ºC, a presión atmosférica. Se la calienta hasta 105ºC y siguesiendo líquida. Dadas las siguientes afirmaciones indicar si son o no correctas, justificando la respuesta: a) el punto de fusión normal del m-xileno es menor que cero
b) a 100ºC el m-xileno hierve
c) a temperatura ambiente es un gas d) a 0ºC se evapora
e) a –5ºC es un sólido
f) su punto de ebullición normal es mayor que el del agua
3.
Teniendo en cuenta las densidades del hierro y del plomo, determinar:a) los volúmenes de 100 g de hierro y de 0.12 kg de plomo
b) las masas de un trozo de hierro de 15 cm3 de volumen y de otro de 10 cm3
de plomo.
Datos: (hierro) = 7.87 g/cm3 , (plomo) = 11.32 g/cm3
Respuesta: a) 12.7 cm3 y 10.6 cm3; b) 118g y 113g
MANOS A LA
OBRA
___________
fusión
_ _ _ _ _ _ _
condensación
_ _ _ _ _ _ _
agua
_____________
4.
Un constructor desea comprar 10 varillas cilíndricas de hierro de 12m de largo y 10 mm de diámetro. El hierro se vende a $1.20 el kg. ¿Cuánto debe abonar?.Respuesta: $89.30
5.
Dadas las siguientes propiedades, indicar cuáles son intensivas y cuáles extensivas: a) masab) densidad c) volumen d) dureza
e) punto de ebullición f) peso
g) punto de fusión
h) conductividad eléctrica
6.
Indicar si las siguientes afirmaciones son correctas o no, justificando la respuesta: a) Los cuerpos sólidos poseen volumen propio, aunque no forma propiab) La evaporación de alcohol (etanol) se produce a cualquier temperatura
c) Durante la transformación de un trozo de hielo en agua líquida, la temperatura no varía d) En determinadas condiciones el agua puede hervir a temperatura ambiente
Lectura ampliatoria
¿QUÉ ES EL FLOGISTO?
Según las antiguas ideas griegas, todo material que podía arder debía contener al “elemento fue-go”, que se liberaba en determinadas condiciones.
El fenómeno de la combustión fue un misterio desde que el hombre descubrió el fuego, hasta me-diados del siglo XVIII.
A los efectos de explicar el proceso de combustión, el químico alemán G.E Sthal, desarrolló en el año 1700, una teoría por la cual supuso que todos los materiales combustibles contenían una sustancia misteriosa, que llamó flogisto. Afirmaba que cuando un cuerpo ardía, el flogisto se escapaba en forma de llama. Así, cuanto más ardía, más flogisto debía contener. Además, creía que la ceniza que queda luego de la combus-tión, era el cuerpo sin el flogisto y por eso no podía seguir ardiendo. Así, el carbón o la madera tenían flogis-to pero las cenizas no. De acuerdo con esta teoría, las sustancias de fácil combustión tales como la nafta o el carbón, contenían alta proporción de flogisto y por lo tanto, dejaban pocas cenizas luego de la combustión. Si ahora en un desborde de imaginación nos trasladásemos a un laboratorio del siglo XVIII, ¿cuáles de los siguientes materiales contienen flogisto?
Alcohol
Vidrio
Petróleo
Papel
Una roca
Un trozo de cobre
Grasa
El hombre que destruyó al flogisto.
La teoría del flogisto gozó de gran popularidad a lo largo de casi todo el siglo XVIII. En principio, parecía explicar razonablemente los hechos observados. Por ejemplo, duran-te el proceso de combustión de la madera o el carbón, el flogisto se liberaba en forma de llama. Las cenizas restantes eran mucho más livianas que los materiales originales, puesto que el flogisto los había abandonado. Pero la explicación era errónea. En reali-dad, la madera arde y a medida que se consume desprende un gas que se desvanece en la atmósfera, que-dando sólo las impurezas en forma de cenizas.
Si la combustión de la madera se efectuara en un recipiente cerrado en presencia de una cantidad limitada de aire, las cenizas, los gases formados y el aire quedarían dentro del sistema. Comparando el peso del sis-tema total luego de la combustión, con el del sissis-tema original, podía comprobarse que no había cambio al-guno. Esto dio por tierra con la teoría del flogisto que predecía una disminución de peso.
Estos hechos fueron observados por el eminente químico francés, Antoine Laurent Lavoisier, quien realizó numerosas experiencias utilizando sistemas cerrados, los que pesaba antes y después de cada proceso.
Antoine Lavoisier
Nacido en París en agosto de 1743, se lo conoce como el padre de la Química moderna por sus investigaciones, entre otras, que condujeron a la ley de conservación de la materia.
En 1789, año que triunfó la Revolución Francesa, publicó su Tratado elemental de Química, libro que fue traducido a varios idiomas y es considerado el primer texto moderno de química.
Alternó sus investigaciones científicas con la tarea de recaudador de impuestos de la monarquía francesa. Este cargo le costó la vida ya que luego de ocurrida la revolución, los extremistas se apoderan del proceso y arrestan a todos los funcio-narios. Uno de ellos era Lavoisier. El 8 de mayo de 1794 la guillotina le trinchó su vida. Así murió uno de los más grandes químicos que conociera el mundo. Al día siguiente de su muerte el insigne matemático Lagrange, expresó el sentimiento de toda Francia al decir: “Bastó un instante para cercenar esa cabeza, y quizá cientos de años no sean suficientes para prod u-cir otra semejante”.
“Nada se crea, nada se destruye, todo se transforma”, decía el eminente químico francés en la segunda mitad del siglo XVIII. En otras palabras, Antoine afirmaba que la masa de un sistema cerrado no se creaba ni se perdía durante una reacción química, sino que cambiaba de unas sustancias a otras.
Cuando quemamos un trozo de papel o de carbón, tanto el papel como el carbón se reducen a cenizas. El combustible de un automóvil se va agotando a medida que ésta circula. El alimento que ingerimos se consu-me. ¿Entonces, “desaparece” la materia? Todo se transforma, ahí estaba la clave. Agotar un material no sig-nifica destruirlo sino transformarlo en otro. Tanto el papel, como el carbón o la nafta, al quemarse se combi-nan con el oxígeno del aire convirtiéndose en dióxido de carbono gaseoso y vapor de agua. El alimento se va transformando en tejido vivo y en compuestos esenciales para el organismo. En otras palabras la materia se conserva, aunque se produzcan transformaciones químicas. Esto fue comprobado experimentalmente por Lavoisier, pesando los materiales antes y después de producirse una transformación química, en recipientes cerrados para evitar pérdidas de gases.
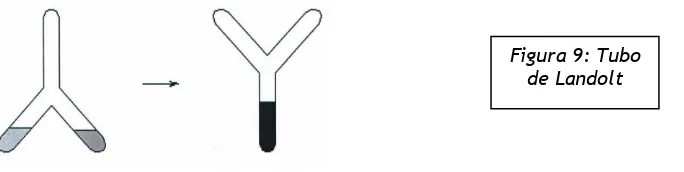
Para comprobar experimentalmente estos hechos resulta muy cómodo trabajar con un tubo en forma de “Y” invertida conocido como tubo de Landolt, que se muestra en la Figura 9.
Se coloca en las ramas de la Y del tubo las sustancias que se quieren hacer reaccionar y luego se da vuelta el tubo para que se produzca la transformación en la rama inferior. Pesando el sistema antes y después del pro-ceso, se pueden obtener importantes conclusiones como mostramos en la siguiente actividad.
¿Por arte de magia?
a) Colocar en una de las ramas del tubo de Landolt solución de nitrato de plata (AgNO3) y en la otra
solución de cromato de potasio (K2CrO4)
b) Cerrar el tubo y pesarlo mediante balanza analítica, cuidando que no entren en contacto las dos soluciones.
c) Invertir el tubo para permitir que ambas soluciones se mezclen. d) ¿Qué ocurrió? Observar el producto obtenido y volver a pesar el tubo.
[image:20.595.105.447.445.531.2]e) Realizar dos veces más la misma experiencia, modificando las cantidades colocadas en el tubo. f) Registrar los resultados obtenidos en el siguiente cuadro.
Figura 9: Tubo de Landolt
Experiencia Masa inicial (g) Masa final (g) Variación de la masa (g)
1
2
3
g) ¿El producto obtenido luego de cada reacción es siempre el mismo?. h) ¿Varía la masa del sistema después de efectuada cada experiencia?.
Al concluir cada experiencia se observa un precipitado de color rojo ladri-llo, debido a la formación de una nueva sustancia: cromato de plata (Ag2CrO4). Además se forma nitrato de potasio soluble e incoloro.
La transformación química ocurrida puede representarse de la siguiente manera:Nitrato de plata + cromato de potasio cromato de plata + nitrato de plata
No se registra variación de masa del sistema, fuera del error experimental, antes y después de ocurrida la transformación.La generalización de estos resultados a todas las reacciones químicas nos conduce a la Ley de conservación de la masa que puede enunciarse así:
Equivalencia entre masa y energía
No obstante, se ha comprobado que ciertos fenómenos liberan grandes cantida-des de energía a expensas de importantes pérdidas de materia. Por ejemplo, la energía térmica que irradia el sol, va acompañada de una pérdida de masa del mismo. Algo similar ocurre también con la enorme cantidad de energía puesta en juego en las explosiones atómicas. De inmediato cabe preguntarnos: ¿Es posible trans-formar materia en energía y viceversa?. ¿Qué ocurre entonces con la ley de conservación de la masa?.
Hacia 1905, Albert Einstein, partiendo de la base que todos los objetos del Uni-verso están constituidos por materia, y que ésta podía convertirse en energía y viceversa, supuso que ambas magnitudes debían ser equivalentes.
Finalmente llegó a la conclusión que toda transformación que absorba o libere energía debe ir acompañada por una variación de la masa del sistema, que puede calcularse mediante la fór-mula:
2
c
E
m
Siendo m la variación de masa que sufre el sistema, E el cambio de energía producida durante la transformación y c la velocidad de la luz, cuyo valor en el vacío es 3 x 108 m/s.
Debido al enorme valor de c2, que figura en el denominador, en los procesos químicos ordinarios el cambio de masa que se produce es tan pequeño, que no puede ser detectada por ba-lanza alguna.
Por ejemplo, en una reacción química como la combustión de un kg de carbón, se
CONCLUSIONES
DE LA
ACTIVIDAD
La masa de un sistema cerrado permanece constante, aún cuando
se verifiquen en él transformaciones químicas.
produce una liberación de energía del orden de 4.2 x 107 joules. Aplicando la ecuación de Einstein, la pérdida
de masa que acompaña esta transformación es aproximadamente 5 x 10-7g, mientras que las balanzas
analíti-cas más precisas miden masas de hasta 10-4 g. De esta manera, la Ley de conservación de la masa tiene
ple-na validez para las reacciones químicas corrientes, ya que la pérdida de masa producida es despreciable. En consecuencia, sólo es posible detectar la variación de masa cuando la energía puesta en juego es muy grande, como las explosiones nucleares y en el fenómeno por el cual el sol o las es-trellas liberan enormes cantidades de energía.
Por ejemplo, la liberación de energía que se produce en un reactor nuclear cuando reacciona (se fisiona) 1 kg de uranio, es del orden de 8.5 x 1013 J. Luego, según la ecuación de
APÉNDICE DEL CAPÍTULO 1
LA MEDICIÓN
La química es una ciencia experimental por lo cual en ella es esencial efectuar mediciones. Para poder medir correctamente debemos tener en cuenta que las medidas se obtienen por comparación del objeto que se quiere medir con una unidad estándar. Las mediciones siempre contienen una unidad y algún error inherente. Esto significa que en cualquier medición por precisa que sea siempre hay un error experimental.
Para medir se emplean diferentes instrumentos, según la magnitud que se desee medir. Así por ejemplo, para medir longitudes se emplea la cinta métrica, la masa se mide con una balanza, la temperatura con un termómetro y los volú-menes con diversos aparatos.
Los químicos usan en el laboratorio distintos aparatos de vidrio para medir volúmenes, que difieren según el tipo de medición deseada. Los aparatos volu-métricos usados más frecuentemente en el laboratorio son:
Probetas: son tubos cilíndricos graduados, entre 20 y 500 cm3, utilizadas
para medir volúmenes relativamente grandes, cuando no se requiere mayor exactitud.
Buretas: son tubos cilíndricos y largos, graduados al 0.1cm3, provistos en
su parte inferior de una llave (robinete) que permite dosificar la salida del líquido. Las buretas se usan para medir volúmenes pequeños cuando se requiere cierta precisión en la medida. Las más usadas tienen 10, 25 y 50 cm3 de capacidad.
Pipetas graduadas: son tubos estrechos graduados con muchas divisio-nes. Se usan para medir volúmenes muy pequeños, con cierta exactitud. Las más comunes tienen 1, 2, 5 y 10 cm3 de capacidad.
Matraces aforados: son recipientes en forma de pera y fondo plano. Tienen un cuello largo y delgado con una línea que lo rodea (aforo), que indica el volumen de líquido que contiene. Son utilizados para preparar soluciones. Vienen en distintos tamaños, siendo los más frecuentes los de 50, 100, 250 y 500 cm3 de capacidad.
La unidad de medida
A los efectos de expresar las mediciones en forma universal debe definirse un sistema de medición. En general, las unidades usadas en la ciencia son unidades del sistema métrico decimal, es decir, que están relacionadas entre sí por potencias de 10.
En la actualidad los científicos de todo el mundo están de acuerdo con el sistema internacional de unidades (SI), propuesto por La Conferencia General de Pesas y Medidas (Francia, 1960). Consiste en un conjunto de unidades necesarias para efectuar mediciones. Este sistema fue adoptado por la Argentina desde 1972 como Sistema Métrico (decimal) legal argentino (SIMELA).
Hay 7 unidades SI básicas, que se muestran en la siguiente tabla:
magnitud unidad símbolo
Longitud metro m
Masa kilogramo kg
Tiempo segundo s
Corriente eléctrica ampere
Temperatura kelvin K
Intensidad luminosa candela cd
Cantidad de sustancia mol mol
Debido a que estas unidades no siempre son las más apropiadas para reali-zar mediciones, se utilizan prefijos que permiten cambiar el tamaño de la unidad, en potencias de 10.
Prefijo Símbolo Notación
exponencial Valor
exa E 1018 1.000.000.000.000.000.000
peta P 1015 1.000.000.000.000.000
tera T 1012 1.000.000.000.000
giga G 109 1.000.000.000
mega M 106 1.000.000
kilo k 103 1.000
hecto h 102 100
deca da 101 10
--- 100 1
deci d 10-1 0.1
centi c 10-2 0.01
mili m 10-3 0.001
micro 10-6 0.000 001
nano n 10-9 0.000 000 001
pico p 10-12 0.000 000 000 001
femto f 10-15 0.000 000 000 000 001
ato a 10-18 0.000 000 000 000 000 001
Tabla 2Prefijos utilizados en las unidades SI.
A continuación presentamos algunas unidades SI derivadas, que pueden obtenerse de la unidades básicas.
MAGNITUD UNIDAD
Prefijo Símbolo Dimensión Nombre Símbolo SI
aceleración a velocidad / tiempo --- --- m s-2
actividad radiactiva --- tiempo-1 becquerel Bq s-1
área A long x long --- --- m2
carga q corriente x tiempo coulomb C A x s
densidad masa / volumen kg m-3
potencial eléctrico V potencia / corriente volt V W A-1
energía, trabajo, calor E, W, Q fuerza x distancia joule J N m
fuerza F masa x aceleración newton N kg m s-2
frecuencia v ciclos / tiempo hertz Hz s-1
potencia energía / tiempo watt W J s-1
presión P fuerza / área pascal Pa N m-2
resistencia R potencial / corriente ohm V A-1
velocidad v long / tiempo --- --- m s-1
volumen V long x long x long --- --- m3
Existen además algunas medidas que no son del SI, pero son muy utilizadas en Química:
Unidad Símbolo Tipo de unidad Conversión al SI
angstrom A Longitud 1 A = 10-10 m
atmósfera atm presión 1 atm = 1013 hPa
caloría cal calor 1 cal = 4.186 J
litro L volumen 1 L = 1 dm3
Masa atómica u masa 1 u = 1.66054 x 10-27 kg
Tabla 4Unidades de uso muy frecuente en Química.
Constantes Universales
Finalmente en la tabla indicamos algunas constantes fundamentales, de validez universal, de uso frecuente:
Constante Símbolo Valor
Carga del electrón e 1.602 x 10-19 C
Constante de Avogadro NA 6.022 x 1023 mol-1
Constante de Coulomb K0 8.987 x 109 N m2 C-2
Constante de Faraday F 9.6485 x 104 C mol-1
Constante de masa atómica mu 1.6605 x 10-27 kg
Constante de Planck h 6.626 x 10-34 J s
Constante de Rydberg RH 1.097 x 107 m-1
Constante gravitatoria G 6.673 x 10-11 N m2 kg-2
Constante de los gases R 8.3145 J K-1 mol-1
Masa del electrón me 9.109 x 10-31 kg
Masa del neutrón mn 1.675 x 10-27 kg
Masa del protón mp 1.673 x 10-27 kg
Velocidad de la luz en el vacío c 2.998 x 10-8 m s-1
Volumen molar (gas ideal) Vm 2.2414 x 10-2 m3 mol-1
Tabla 5 Constantes universales