SECUENCIA DIDÁCTICA
Bloque
Tema
Subtema
• Analiza algunas reacciones de óxido-reducción en la vida diaria y en la industria.
• Identifica las características oxidantes de la atmósfera y reductoras de la fotosíntesis.
• Establece una primera relación entre el número de oxidación de algunos elementos y su posición en la tabla periódica.
Aprendizajes esperados IV. La formación de nuevos materiales.
2. Oxidación y reducción.
2.2. Las reacciones redox.
• Experiencias alrededor de las reacciones de óxido-reducción.
ANTECEDENTES/IDEAS PREVIAS
Reacciones químicas: Ciencias Naturales. Sexto grado, lección 30. Algunos materiales y sustancias también son inventos. En esta lección se comenta la capacidad de los seres humanos para transformar algunas sustancias en otras, para producir nuevos materiales. Menciona que a partir de transformaciones conocidas como reacciones químicas, las sustancias obtenidas adquieren propiedades y aplicaciones diferentes de otros materiales. Señala como ejemplo, la producción de vidrio; por medio de un esquema presenta los reactivos, los procesos y los productos.
Características reductoras de la fotosíntesis: Ciencias I, bloque II, tema 2, subtema 2.3. Valoración de la importancia de la fotosíntesis como proceso de transformación de energía y como base de las cadenas alimenticias. Este tema es un antecedente, pues se menciona a la fotosíntesis como un proceso de transformación de materia y energía.
Características oxidantes de la respiración: Ciencias I, bloque III, tema 2, subtemas 2.2 Comparación entre respiración aerobia y anaerobia y 2.3. Relación de los procesos de respiración y fotosíntesis con el ciclo del carbono. Considera como ejemplo, la elaboración tradicional de queso, pan y vino, con los avances tecnológicos que permiten su producción masiva. Relaciona los procesos de respiración y fotosíntesis con las interacciones de oxígeno y dióxido de carbono en la atmósfera.
Oxidación: Ciencias III, bloque II, tema 1, subtema 1.2 ¿Cómo es la estructura de los materiales?, y tema 2, subtemas 2.1. Estructura y organización de la información física y química en la tabla periódica, y 2.2. ¿Cómo se unen los átomos? El tema de enlaces químicos se puede tratar por medio de modelos en los que se ilustre cómo los electrones se transfieren o comparten para formar dichos enlaces.
Reacciones óxido-reducción: Ciencias III, bloque III, tema 1, subtema 1.1. El cambio químico. Identifica reactivos y productos que participan en un cambio químico y diferencia sus propiedades.
Ideas previas de los alumnos1234
Reacciones óxido-reducción y número de oxidación.
• Los estudiantes confunden el número de oxidación con la valencia.
• No toman en cuenta que ocurre simultáneamente una oxidación y una reducción. • Pocos estudiantes atribuyen la corrosión a una reacción química, no siempre
incluyen al oxígeno y no lo asocian necesariamente con un incremento de masa. • La corrosión producida en la oxidación lenta del hierro puede percibirse como si
un agente activo se estuviera comiendo el metal.
ESTRUCTURA DE LA SECUENCIA DIDÁCTICA
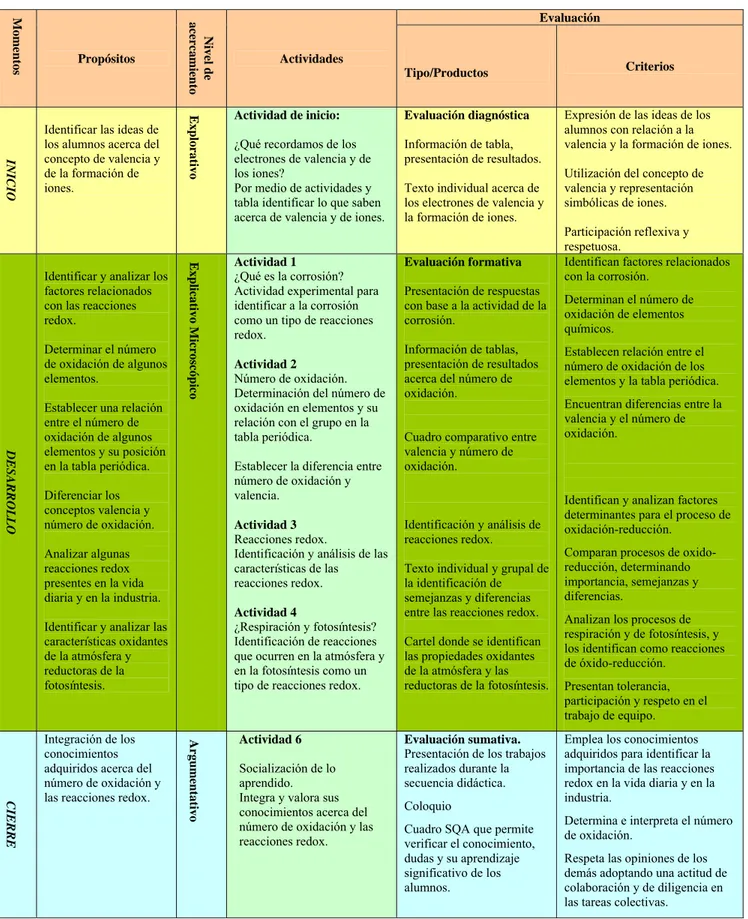
Mo
me
n
tos Propósitos
Niv el d e a cerca mi ento Actividades Evaluación
Tipo/Productos Criterios
IN
IC
IO
Identificar las ideas de los alumnos acerca del concepto de valencia y de la formación de iones.
Ex
plo
rativ
o
Actividad de inicio:
¿Qué recordamos de los electrones de valencia y de los iones?
Por medio de actividades y tabla identificar lo que saben acerca de valencia y de iones.
Evaluación diagnóstica
Información de tabla, presentación de resultados.
Texto individual acerca de los electrones de valencia y la formación de iones.
Expresión de las ideas de los alumnos con relación a la valencia y la formación de iones.
Utilización del concepto de valencia y representación simbólicas de iones.
Participación reflexiva y respetuosa.
DESARROLLO
Identificar y analizar los factores relacionados con las reacciones redox.
Determinar el número de oxidación de algunos elementos.
Establecer una relación entre el número de oxidación de algunos elementos y su posición en la tabla periódica.
Diferenciar los conceptos valencia y número de oxidación.
Analizar algunas reacciones redox presentes en la vida diaria y en la industria.
Identificar y analizar las características oxidantes de la atmósfera y reductoras de la fotosíntesis. Exp licativo M icroscóp ic o Actividad 1
¿Qué es la corrosión? Actividad experimental para identificar a la corrosión como un tipo de reacciones redox.
Actividad 2
Número de oxidación. Determinación del número de oxidación en elementos y su relación con el grupo en la tabla periódica.
Establecer la diferencia entre número de oxidación y valencia.
Actividad 3
Reacciones redox.
Identificación y análisis de las características de las reacciones redox.
Actividad 4
¿Respiración y fotosíntesis? Identificación de reacciones que ocurren en la atmósfera y en la fotosíntesis como un tipo de reacciones redox.
Evaluación formativa
Presentación de respuestas con base a la actividad de la corrosión.
Información de tablas, presentación de resultados acerca del número de oxidación.
Cuadro comparativo entre valencia y número de oxidación.
Identificación y análisis de reacciones redox.
Texto individual y grupal de la identificación de semejanzas y diferencias entre las reacciones redox.
Cartel donde se identifican las propiedades oxidantes de la atmósfera y las reductoras de la fotosíntesis.
Identifican factores relacionados con la corrosión.
Determinan el número de oxidación de elementos químicos.
Establecen relación entre el número de oxidación de los elementos y la tabla periódica. Encuentran diferencias entre la valencia y el número de oxidación.
Identifican y analizan factores determinantes para el proceso de oxidación-reducción.
Comparan procesos de oxido-reducción, determinando importancia, semejanzas y diferencias.
Analizan los procesos de respiración y de fotosíntesis, y los identifican como reacciones de óxido-reducción.
Presentan tolerancia, participación y respeto en el trabajo de equipo.
CI
ERRE
Integración de los conocimientos adquiridos acerca del número de oxidación y las reacciones redox.
Argum
entativ
o
Actividad 6
Socialización de lo aprendido. Integra y valora sus conocimientos acerca del número de oxidación y las reacciones redox.
Evaluación sumativa.
Presentación de los trabajos realizados durante la secuencia didáctica. Coloquio
Cuadro SQA que permite verificar el conocimiento, dudas y su aprendizaje significativo de los alumnos.
Emplea los conocimientos adquiridos para identificar la importancia de las reacciones redox en la vida diaria y en la industria.
Determina e interpreta el número de oxidación.
Orientación didáctica
Breve introducción de los contenidos y los aprendizajes esperados del subtema “Las reacciones redox”.
Establecer con los alumnos, los criterios de evaluación en cada una de las actividades a desarrollar. Todos los productos que se elaboren individualmente, en equipo y en grupo, formarán parte del portafolio para que estén disponibles en caso de ser necesaria su consulta.
Tiempo estimado: 10 minutos
Actividad de inicio. Tiempo estimado: 50 minutos
¿Qué recordamos de los electrones de valencia y de los iones?
Recordar a los alumnos la actividad 1 “¡Una cara, muchas máscaras!” y la actividad 3 “¿Qué representan los iones?” del bloque II, tema 1, subtema 1.2 ¿Cómo es la estructura de los materiales?
Formar equipos de 4 ó 5 integrantes. Con la información contenida en la tabla periódica, complementen la siguiente tabla:
Elemento Símbolo Grupo Número de electrones de valencia
Tendencia: cede, gana, comparte o está completo el
número de electrones
Sodio
Magnesio Oxígeno
Cloro
Carbono Neón
Nitrógeno Aluminio
En equipo, respondan las siguientes cuestiones.
• ¿Los electrones de valencia son aquellos que se encuentran en?
_________________________.
• ¿Qué función tienen los electrones de valencia? ___________________.
• Cuando un átomo ha cedido o atraído electrones, adquiere una carga positiva o negativa ¿a qué se debe esto?
__________________________________________________________. • ¿Un átomo con carga eléctrica se denomina? _____________________. • ¿Si la carga eléctrica del átomo es positiva, se llama?_______________. • ¿Y si es negativa, se nombra? _______________.
Representa a los siguientes iones
Nombre Electrones Ion
Ion sodio Cedió 1 Na +1
Ion cloruro Atrajo 1
Ion aluminio Cedió 3
Ion oxígeno Atrajo 2
Elegir un representante de cada equipo, para que explique ante el grupo, los resultados obtenidos con el trabajo realizado.
Para terminar la actividad, solicitar que elaboren también en equipo conclusiones acerca de la función de los electrones de valencia y de la razón por la cual un átomo adquiere carga eléctrica.
Evaluación diagnóstica
Se trata de la evaluación de las ideas previas de los alumnos. Es necesario escucharlas, registrarlas y relacionarlas con la temática y su posible desarrollo.
Tomar decisiones oportunas para valorar si la actuación docente está en correspondencia con las demandas de los estudiantes.
Identificar los obstáculos comunes que plantea la construcción del concepto número de oxidación, que servirán como referencia para que el docente diseñe sus actividades en función de los conocimientos de los alumnos.
Actividades de desarrollo.
Actividad 1 Tiempo estimado: 60 minutos
¿Qué es la corrosión?
Actividad para los alumnos:
Se sugiere dar a cada equipo, con una anticipación de dos semanas, un brillante y reluciente clavo de hierro, para que registren su masa, lo lleven a su casa y lo pongan en un sitio donde se pueda oxidar. Solicitarles contestar las siguientes preguntas:
• ¿Dónde pusieron el clavo?
• ¿Qué características tiene ese sitio?
• ¿Por qué consideraron que ese entorno favorece la oxidación del clavo? • ¿Qué idea tienen de un óxido?
Transcurridas las dos semanas, solicitar a los alumnos que traigan los clavos a la clase; nuevamente registrarán su masa. Se sugiere que en la clase se realice una exposición de los clavos, del más oxidado al menos oxidado, con las respuestas a las preguntas planteadas, así como los datos de masa antes y después de la oxidación.
Orientación didáctica
En equipos de trabajo y partiendo de la actividad anterior, preguntar a los alumnos: ¿cuáles son los factores necesarios para que se produzca la oxidación de un clavo? Escribir sus respuestas en el pizarrón y solicitar que cada equipo argumente sus respuestas. Se recomienda que, de acuerdo con sus argumentos, se borren del pizarrón los factores que no intervienen en el proceso de oxidación, hasta llegar a establecer los factores necesarios para que se lleve a cabo este tipo de reacción.
Plantear a los equipos de trabajo, las siguientes cuestiones: ¿de dónde viene el óxido que se formó en el clavo?, ¿hubo alguna variación entre la masa inicial del clavo y la final?, ¿por qué? Se sugiere que los alumnos consulten en diferentes fuentes (libros, revistas e Internet), para que indaguen y puedan contestar. Que discutan en equipo y lleguen a un acuerdo; después, que cada equipo proponga una respuesta. Se recomienda escribir las respuestas en una hoja de papel bond o en el pizarrón.
También se sugiere al profesor retomar las ideas de los alumnos respecto a la oxidación; partir de ellas, explicar que la oxidación es un cambio químico durante el cual el hierro del clavo reacciona con el oxígeno del aire, en presencia de agua, para formar un óxido de hierro hidratado. Ese óxido es una nueva sustancia formada sobre la superficie del clavo; el oxígeno que reaccionó con el hierro es el que aumenta la masa del clavo. El óxido es un polvo pardo rojizo, que se conoce como herrumbre.
4 Fe + 3 O2→ 2 Fe2O3
La oxidación, por tanto, es una reacción química en la cual un metal se combina con el oxígeno para formar una nueva sustancia. Cuando se presenta una reacción opuesta, es decir aquella en la que el óxido de un metal rompe sus enlaces con el oxígeno, se dice que el óxido se redujo o que se presentó una reacción de reducción. En realidad estos procesos siempre se presentan juntos, pues mientras el metal “se oxida”, el oxígeno responsable de este cambio “se reduce”. Por eso se prefiere el término general de reacciones de óxido-reducción, aunque en ocasiones se empleen las palabras como si fueran procesos separados. Además, en otros cambios similares no participa el oxígeno, por eso encontramos acepciones distintas –que veremos más adelante– a los términos oxidación y reducción.
Para concluir el tema, en equipo los alumnos responderán a los siguientes aspectos: Acerca de las reacciones óxido-reducción.
Qué sé Qué quiero saber Qué aprendí
Con base en las respuestas y la participación de los estudiantes, se evaluará la sesión.
Actividad 2 Tiempo estimado 60 minutos
Número de oxidación
A lo largo de la historia, los conceptos han cambiado o bien se amplían, como ha sucedido en el caso de este tipo de reacciones. Así, la definición actual de oxidación y reducción es: un elemento se oxida cuando en un cambio químico aumenta su número de oxidación y, al mismo tiempo, la disminución en el número de oxidación
Para saber cuándo sucede una reacción de óxido-reducción, se necesita conocer el número de oxidación de los átomos involucrados en la reacción química. Ahora se analizará cómo se determina el número de oxidación de algunos átomos.
Formar equipos de 4 ó 5 integrantes y realizar las siguientes actividades.
Un átomo neutro cualquiera tiene un número definido de electrones, el cual corresponde al número de protones que posee su núcleo –es decir, su número atómico–. Compruébalo mediante las siguientes actividades.
Completar la siguiente tabla:
Elemento (neutro)
No atómico Número de
protones
Número de electrones
Na 11 11 11 S 16
O 8 F 9 Al 13
H 1
Generalmente, cuando un elemento determinado se combina mediante una reacción química, el número de electrones asociado a él puede ser mayor o menor que su número atómico característico. Por ello el concepto de número de oxidación, significa el número de electrones en exceso o de déficit que se le asigna a un elemento, respecto a su número atómico, cuando forma parte de un compuesto: ya sea una molécula o en forma de ion, en una reacción, de acuerdo con ciertas reglas:
Si el número de electrones asignado a un elemento es mayor que su número atómico, se le confiere una carga aparente negativa. Por el contrario, si el número de electrones asignado es menor que su número atómico, se le otorga una carga aparente positiva. Con base en el ejemplo anterior, tenemos:
Átomo que forma parte de un compuesto:
molécula o ion.
Número atómico
Número de protones
Número de electrones
Número de oxidación
Na 11 11 10 1+
Orientación didáctica
Los cambios en el número de oxidación no deben interpretarse necesariamente como la transferencia real de electrones de un átomo a otro. No siempre es válido aplicar un modelo de transferencia de electrones, a una reacción de óxido-reducción, como es el caso de compuestos covalentes.
Orientación didáctica
Ejemplo: Sodio (Na), número de protones 11 (+), número de electrones 10 (-) tenemos finalmente un número de oxidación 1+, ya que tiene menos electrones que el elemento neutro. De esto podemos concluir que todos los elementos en su estado libre (neutro) tienen un número de oxidación igual a __________________.
Anotar los datos faltantes en la siguiente tabla.
Átomo que forma parte de un compuesto: molécula
ion.
No atómico
Número de protones
Número de electrones
Número de oxidación
S 16 16 18
O 8 8 10
F 9 9 10
Al 13 13 10
H 1 1 0
Li 3 3 2
N 7 7 10
En la tabla siguiente se muestra el número de oxidación de algunos átomos y el grupo al cual pertenecen. Su tarea es completarla.
Ion Grupo Ion Grupo
Li 1+ 1 H 1+
Mg 2+ Ca2+
F 1- Na1+
O 2- N
3-Al 3+ S2- 6
K1+ Be2+
¿Qué relación encuentran entre el número de oxidación de los átomos y su grupo, en la tabla periódica?
Después de haber determinado el número de oxidación de algunos átomos y haberlos relacionado con su grupo, explica: ¿qué diferencias encuentras entre la valencia o capacidad de combinación de un elemento y el número de oxidación de un átomo? Completa el cuadro comparativo.
Orientación didáctica
Recuerde establecer la diferencia entre valencia y número de oxidación.
La valencia se interpreta como la capacidad de combinación de un elemento; es decir, cuántos enlaces puede formar, y queda determinada por el número de electrones más externos del átomo en cuestión, que participan en los enlaces de un compuesto químico. Por ejemplo, el oxígeno, con seis electrones de valencia, suele tener valencia 2, pues realiza dos enlaces covalentes o bien, recibe dos electrones.
El número de oxidación representa la carga aparente que tiene o se le asigna a un átomo en un
Concepto Valencia Número de oxidación
Semejanzas •
Diferencias •
• •
• • •
Conclusiones •
Anotar los datos que faltan de la siguiente tabla.
Átomo Grupo Electrones
de valencia
Número de oxidación
S 6 6 2-
O F
Al 3
Na 1+
Mg Li
N 5 3-
¿Cuál es su conclusión, después de las observaciones realizadas, respecto a la cantidad de electrones de valencia y el número de oxidación de un átomo? ¿Para qué sirve saber cada uno?
Un representante de cada equipo explicará cómo se obtiene el valor del número de oxidación y la relación que tiene con la tabla periódica; así como las diferencias entre la valencia y el número de oxidación de un átomo.
Por escrito, cada alumno explicará las diferencias entre valencia y número de oxidación, dando dos ejemplos de cada uno. También explicará para qué sirve saber cada concepto.
Al evaluar la sesión se considerarán todos los ejercicios realizados y se pedirá a los estudiantes que pregunten sus dudas, para que los conceptos de número de oxidación y valencia queden perfectamente comprendidos, pues son indispensables para llevar a cabo las actividades siguientes.
Actividad 3
Reacciones de óxido-reducción Tiempo estimado: 60 minutos
Orientación didáctica
Orientación didáctica
Nota:Antes de la clase,solicite una hoja de papel bond y plumones.
Es común que en nuestro medio se lleven a cabo reacciones de óxido-reducción; sin embargo, no se presta atención y con frecuencia, no se observan de manera visible sus efectos. ¿Puedes identificar algunas reacciones de óxido-reducción que ocurran a tu alrededor?
A lo largo de la historia, el término oxidación tomó su nombre de los procesos en los cuales una sustancia reacciona con el oxígeno, ya sea que provenga de otra sustancia o del aire. Se dice que la sustancia que se combina con el oxígeno se ha oxidado, y la que rompe sus enlaces con el oxígeno se ha reducido.
Con el paso del tiempo, el concepto se amplió. Así, los términos de oxidación y reducción se identificaron con procesos en los que ocurre, ya sea transferencia de oxígeno, de hidrógeno o de electrones.
En todos los casos, la transferencia se lleva a cabo entre dos sustancias. Por lo tanto, es fundamental entender que siempre que se presenta una oxidación sucede una reducción, y viceversa; de tal forma que nunca se tiene un proceso sin el otro.
Formar equipos de 4 ó 5 integrantes. Entregar a cada equipo la lectura que viene a continuación, son ejemplos comunes de reacciones de óxido-reducción, para analizar estos cambios. Los alumnos deben reunirse, efectuar la lectura, identificar y analizar las características en cada caso, como se muestra en el ejemplo resuelto al final. Puede asignarse a cada equipo, el análisis de un proceso y pedir que lo expongan ante el grupo.
Para cada uno de los ejemplos, los alumnos responderán las siguientes preguntas. Escribirán las respuestas en una hoja de papel bond.
• ¿Qué importancia tiene el proceso descrito en la vida diaria? • ¿Cómo se lleva a cabo?
• ¿Tiene alguna importancia económica? ¿Por qué? • ¿Interviene el oxígeno? ¿cómo?
• ¿Por qué es una reacción óxido-reducción? Identifica los elementos que se oxidan y se reducen.
Si escuchamos hablar de “procesos de óxido-reducción”, estos términos puede parecernos sofisticados o pertenecientes a ámbitos complejos de la ciencia y la tecnología, lejanos a nuestra vida cotidiana. Todos hemos visto un clavo oxidado y sabemos que muchas piezas metálicas se oxidan fácilmente cuando se mojan, pero no suena fácil eso de identificar cambios con ese nombre. Sin embargo, los “procesos de óxido-reducción” son mucho más comunes y cercanos a ti de lo que piensas. No exageramos al decir que gran parte de los cambios químicos más comunes, incluidos los que ocurren en tu cuerpo, en tu casa, en la industria y en la calle, pueden incluirse en esta categoría. Para convencerte de esta afirmación, aquí van algunos ejemplos que seguro te suenan familiares.
a) La corrosión provoca pérdidas millonarias.
A este proceso o cambio químico se le conoce como corrosión, y si no la prevemos o evitamos, nos hará gastar grandes cantidades de dinero. Si no lo crees, sólo piensa qué es más fácil y barato, pintar una reja de la casa o los canceles de la ventana, si son de acero, o hacerlos nuevos cada vez que se deshacen en cachitos al oxidarse. O, pensando en la industria, ¿cuánto se arriesga si, en vez de pintar y aplicar otros procesos químicos en el casco de un enorme barco, también con casco de acero, permitimos que se desgaste rápidamente al contacto con el mar, hasta llenarse de hoyos? Si piensas en bicicletas, autos, camiones, aviones, llaves, alambres, varillas, maquinaria industrial y hasta joyas, encontrarás otros casos en los que evitar la corrosión resulta de mayor utilidad.
¿Quién es el “villano” principal de esta historia? Sorprendentemente, este villano que nos hace tomar muchas precauciones, es el “héroe” de otros procesos: el oxígeno del aire sin el cual, ¡no podríamos respirar! Para ejemplificar su acción, observa la reacción que ya conoces:
4 Fe + 3 O2→ 2 Fe2O3
b) ¿De dónde vienen los metales?
Si vas al bosque, a la selva, al desierto, a la playa o a cualquier paisaje natural donde el ser humano no haya hecho demasiadas modificaciones, no vas a poder encontrar ninguna pieza ni material metálico que no haya sido colocado ahí por alguna persona. Los metales, salvo algunas excepciones, no están en la superficie de nuestro planeta como tales. Entonces, ¿de dónde los sacamos?
La respuesta a esta pregunta nos permite referirnos a una actividad que comenzó en la antigüedad, pero que tomó gran auge en los últimos siglos: la minería. Y no es que de las minas se saquen los metales directamente, sino que se obtienen los minerales que los contienen, pero en forma de compuestos como óxidos y sales.
Para recuperar el metal, se requiere llevar a cabo el proceso contrario a la corrosión; esto se realiza en grandes plantas industriales. Por ejemplo, en las plantas llamadas de “altos hornos” ocurre la refinación del hierro para fabricar el acero. En este caso se combina, a muy altas temperaturas, el óxido del metal con carbono; estas interacciones producen los siguientes cambios:
2C + O2→ 2CO
CO + Fe2O3→ CO2 + 2 Fe
Para refinar otros elementos se emplean reacciones similares o bien se realizan procesos químicos distintos, todos encaminados a recuperar los elementos en su forma metálica.
c) ¿Qué me pongo en la cortada?
disoluciones desinfectantes o antisépticas. Algunas de ellas funcionan precisamente mediante reacciones de óxido-reducción. Como ejemplo tenemos al agua oxigenada, que es una disolución de peróxido de hidrógeno (H2O2) al 3% en agua, que se aplica sobre raspones o cortadas leves.
En la sangre y los tejidos tenemos una enzima llamada catalasa, ésta hace que el peróxido de hidrógeno se descomponga produciendo oxígeno (O2) y agua (H2O); la molécula de oxígeno ejerce un fuerte poder oxidante sobre las membranas de los microbios y los mata. La reacción que cataliza la catalasa es:
H2O2→ H2O + O2
d) Vamos a blanquear la ropa.
La higiene es indispensable para el mantenimiento de la salud. El lavado de la ropa suele hacerse con diferentes jabones y detergentes. Pero cuando queremos que se quiten diferentes manchas de las prendas blancas, empleamos disoluciones blanqueadoras, cuya función principal no es quitar, sino decolorar las sustancias que producen el color.
Para lograr esta función, las reacciones que se emplean son procesos de óxido-reducción. La sustancia más conocida de las usadas en estas disoluciones es el hipoclorito de sodio (NaClO), que es muy oxidante; lo que hace es transformar los materiales provocando que pierdan su coloración característica.
El hipoclorito de sodio no sólo quita el color, sino que también elimina muchos microbios; por ello resulta de gran utilidad para prevenir infecciones y para tratar materiales que hayan estado en contacto con personas enfermas. Esta propiedad también es importante.
En ocasiones llamamos “cloro” a estas disoluciones; pero en realidad, el cloro (Cl) es el que se usa para fabricarlas, pues el hipoclorito de sodio se produce cuando este elemento gaseoso burbujea en disoluciones de hidróxido de sodio (NaOH). La reacción que ocurre, entonces, es:
Cl2 + NaOH → NaClO + NaCl + H2O
Con los ejemplos anteriores puedes darte cuenta de que los “procesos de óxido-reducción” están más cerca de ti de lo que te imaginabas. ¡Y eso que no mencionamos que también forman parte de la respiración, la fotosíntesis, el procesamiento de alimentos en el cuerpo y la combustión!
Los números de oxidación en una ecuación química
Los alumnos podrán responder, tomando en cuenta su propia experiencia y razonamiento, cuál es la importancia económica y social de los procesos que se analizaron; sin embargo, para el análisis de la reacción, habrá que orientarlos para que argumenten por qué es un proceso de óxido-reducción. Asimismo, identificarán los elementos que se oxidan o se reducen, y señalarán los símbolos que representan elementos, compuestos, átomos o moléculas, como un repaso de temas anteriores.
ejemplo, se analiza lo que ocurre en uno de los casos citados en la lectura anterior: el del agua oxigenada.
a) Asignamos números de oxidación: H2+1O2-1 → H2+1O-2 + O20
b) Identificamos el elemento que cambió de números de oxidación: fue el oxígeno. Algunos de los átomos de este elemento se oxidaron, pues perdieron electrones; esto se refleja en el aumento de su número de oxidación:
O-1 - 1 electrón → O0
c) Otros átomos de oxígeno, los que formaron el agua, se redujeron al ganar electrones, lo que se aprecia en la disminución de su número de oxidación:
O-1 + 1 electrón → O-2
En este caso, entonces, podemos decir que ante la acción de la catalasa, algunos átomos de oxígeno de la molécula del peróxido de hidrógeno, funcionaron como oxidantes, mientras que otros funcionaron como reductores.
Ayude a los alumnos a que realicen un análisis similar con las demás reacciones
Para concluir la actividad:
Cada equipo debe elegir un representante, para que explique las respuestas ante el grupo.
• En el pizarrón, reunir las hojas de papel bond para poder apreciar las características semejantes y diferentes entre un proceso y otro.
• Responder de manera individual: ¿en qué se parecen todos los procesos analizados? ¿En qué son diferentes? ¿En qué radica la importancia de las reacciones óxido-reducción analizadas?
• Finalmente, elaborar una conclusión general, en una hoja de papel bond.
Esta conclusión de los alumnos debe considerar los siguientes aspectos:
• Las reacciones de óxido-reducción que aportan importantes beneficios al ser humano y aquéllas que de alguna manera nos afectan.
• Resaltar que el oxígeno es, sin duda, el agente oxidante más común. Oxida rápidamente la madera que arde en las fogatas y la gasolina en el motor del automóvil. Durante la corrosión, el oxígeno se combina lentamente con metales. Por fortuna, el oxígeno gaseoso es un agente oxidante suave en la concentración en que se encuentra en la atmósfera: 21% en volumen.
Al evaluar la sesión considerar todas las actividades realizadas por los estudiantes y plantear, oralmente, algunas preguntas para comprobar que los conocimientos se van reafirmando. Asimismo, sus conclusiones deben ser cercanas al conocimiento científico.
Nota: Antes de la clase,solicite material para diseñar un cartel: cartulina, plumones, libros y revistas de biología.
Es sorprendente lo mucho que damos por sabido. Por ejemplo, respiramos sin cesar; si dejáramos de respirar cinco minutos, aproximadamente, moriríamos. Sin embargo, raras veces nos preguntamos ¿de dónde viene el oxígeno que contiene el aire que respiramos? ¿Para qué respiramos? De igual manera, diariamente comemos para tener energía suficiente y realizar las funciones vitales que nuestro cuerpo necesita, aparte de poder cumplir con nuestras responsabilidades, pero ¿de dónde viene el alimento que consumimos diariamente? ¿Hay alguna relación entre estas preguntas y las reacciones de óxido-reducción? ¿Cómo podemos saberlo?
Formar equipos de 4 ó 5 alumnos. Con ayuda de libros, revistas y material a su alcance (documental, video, etcétera), indagar respecto a los procesos de respiración y de fotosíntesis; se sugiere que sea un trabajo breve y fértil.
Como resultado de la indagación se presentará un cartel que debe incluir las respuestas a las preguntas iniciales.
Sugerencia de lecturas.
La fotosíntesis
La vida en la Tierra depende fundamentalmente de la energía solar, la cual es atrapada mediante el proceso fotosintético, el responsable de la producción de toda la materia orgánica que conocemos. Las plantas verdes son capaces de utilizar la energía de la luz solar para producir alimentos a partir del dióxido de carbono (CO2) y el agua (H2O). Esta reacción que forma parte del proceso de fotosíntesis, produce compuestos orgánicos (alimentos) como la glucosa, liberando oxígeno (O2). Podemos resumir esto en la siguiente ecuación química:
Fotosíntesis
Energía + agua + bióxido de carbono alimento + oxígeno
Si representamos el caso particular de la glucosa, el carbohidrato más común del que obtenemos energía, tenemos:
Energía + 6H2O + 6CO2→ C6H12O6 + 6O2
Los seres fotosintéticos captan la luz mediante diversos pigmentos fotosensibles, entre los que destacan por su abundancia, las clorofilas y carotenos. Cuando los pigmentos absorben la luz, los electrones de sus moléculas reciben esta energía y la emplean para pasar a otros materiales: una molécula de pigmento se oxida al perder un electrón, el cual es recogido por otra sustancia, que se reduce. Así, la clorofila puede transformar la energía luminosa en energía química.
La respiración
respiración; éste se encuentra en la atmósfera. Los gases atmosféricos forman la mezcla que conocemos como aire, constituido principalmente por nitrógeno (N2) y oxígeno (O2), aunque también existen pequeñas cantidades de otros gases. El nitrógeno se encuentra en un 78.1% y el oxígeno forma aproximadamente el 21% de la atmósfera.
Así pues, durante la respiración se consume constantemente oxígeno para poder procesar los alimentos; como producto de la respiración se genera dióxido de carbono, agua y la energía necesaria para realizar nuestras distintas funciones. Podemos resumir este proceso en la siguiente ecuación:
Respiración celular
Alimentos + oxígeno dióxido de carbono + agua + Energía
Si ejemplificamos el proceso con la glucosa, la reacción sería:
C6H12O6 + 6O2→ 6H2O + 6CO2 + Energía
Nuestra existencia misma depende del oxígeno y de la oxidación de los alimentos. La propia vida es un fenómeno de óxido-reducción.
Para revisar la actividad
Cada equipo presenta su cartel al grupo y explica sus respuestas a las preguntas iniciales, mediante los procesos de respiración y fotosíntesis.
En plenaria, destacar las características oxidantes de la atmósfera, y reductoras de la fotosíntesis; así como el valor biológico de los dos procesos para la vida. Es importante que el alumno concluya que cuando un alimento (glucosa) reacciona con el oxígeno durante el metabolismo, se oxida para formar dióxido de carbono y agua; por lo tanto, el dióxido de carbono y el agua son formas oxidadas de la materia. El elemento que se reduce es el oxígeno (O20), que se integra a los compuestos como O2.
Las plantas verdes son capaces de utilizar la energía de la luz solar para producir alimentos. Si analizamos la reacción química de la fotosíntesis, podemos identificar que el oxígeno se oxidó, pues formaba parte del aCO2 y el H2O como O2- y se liberó como moléculas de oxígeno O20, perdiendo electrones. No resulta fácil identificar que el elemento que se redujo fue el carbono, que en la glucosa contiene una proporción menor de uniones con oxígeno que en el dióxido de carbono (CO2).
Los alimentos son formas reducidas de compuestos que al romper sus enlaces desprenden energía. Los alumnos seguramente podrán notar que la reacción global de la fotosíntesis es, en esencia, la inversa de la oxidación de los alimentos.
Como parte de la evaluación de la sesión, durante la plenaria asegúrese de que los procesos analizados han quedado claros. También es buen momento para pedir a los estudiantes que hagan un breve texto de tarea, en el que hagan notar la importancia de las reacciones de óxido-reducción para la vida, la sociedad y la industria, como una manera de reafirmar todo lo revisado hasta ahora.
Socialización de lo aprendido
Para concluir con las actividades de este tema, se propone llevar a cabo las siguientes actividades:
Efectuar una actividad práctica, en la que se puedan revisar procesos de óxido-reducción y se destaquen los conceptos relacionados con ellos.
Realizar una exposición con los trabajos realizados en la secuencia didáctica (los clavos, los carteles, las conclusiones en las hojas de papel bond y todos los demás).
Organizar un coloquio para comentar los conocimientos adquiridos y que permita a los alumnos reorganizar sus nuevas ideas al hablar y escuchar a los demás.
Para llevar a cabo las actividades prácticas hay muchas reacciones químicas de óxido-reducción que pueden resultar atractivas para los estudiantes. Su realización depende de la disponibilidad de materiales en el laboratorio.
Desmanchemos telas con agentes de óxido-reducción:
Sugerimos que realice esta actividad sencilla, que consiste en probar el poder decolorante del agua oxigenada y del hipoclorito de sodio, sobre manchas en telas blancas.
Para este experimento, será suficiente contar con telas blancas de composiciones diversas, éstas se ensucian con diferentes tintas, comida, aceites, pinturas, etcétera, y se someten a tratamiento con los reactivos ya descritos. Se propone organizar la sesión de manera que cada tela se ensucie con todos los agentes y se prueben disoluciones de agua oxigenada y de hipoclorito de sodio con diferentes diluciones, de forma que los alumnos controlen diferentes variables y organicen un análisis para sacar conclusiones sobre las mejores condiciones en que pueden emplearse esos decolorantes.
Debido a que todo este proceso se desarrolla como cierre de las actividades del tema, se sugiere que el profesor planee preguntas que inciten a los alumnos a recordar lo aprendido y a deducir lo que ocurre, con base en su experiencia. Pida además, que tomen notas para realizar un informe en el que profundicen en las observaciones y las conclusiones respectivas. Esta participación permitirá evaluar lo aprendido.
Finalmente, al terminar el experimento, se recomienda hacer el cierre final comentando con los alumnos la forma como se desarrolló el tema y los aspectos más importantes de lo aprendido.
Puntos a tratar:
Orientación didáctica
1. El aspecto macroscópico de las reacciones de óxido-reducción. ¿En qué radica la importancia de las siguientes reacciones de óxido-reducción en la vida diaria? ¿Y en la industria? ¿Qué pasaría con los siguientes procesos si la atmósfera del planeta no fuera oxidante?
• La corrosión. • La combustión. • Fabricación de acero.
• Los antisépticos y desinfectantes. • Los blanqueadores.
• La fotosíntesis. • La respiración.
2. El aspecto microscópico de las reacciones de óxido-reducción. • Diferentes acepciones de los términos oxidación y reducción.
• Número de oxidación: ¿cómo se determina?, ¿qué información proporciona?, ¿cómo se utiliza para interpretar una reacción de óxido-reducción?, ¿para qué usar el número de oxidación en las reacciones de óxido-reducción?
Discusión de dudas generales.
Como una forma de evaluación final, recupere los comentarios de los alumnos y solicite que integren los diferentes documentos en un portafolio.
Bibliografía.
A. Garritz y C. Rincón. (1997) Capricho valenciano (III) Valencia y números de oxidación. Corolario para docentes, Revista de Educación Química, UNAM, Vol. VIII No 3, pp 130-140
Morris Hein et al (2001), Fundamentos de química, México, Thomson Learning. pp. 434-460
Ralph A. Burns (2003), Fundamentos de química, México, Pearson Educación. pp. 507-538.
Rosalind Driver y col. (2000), Dando sentido a la ciencia en secundaria, México, Visor/SEP/(Biblioteca para la actualización del maestro), pp. 31-33.
Rosalind Driver y col. (2000),”Cambio químico” en Dando sentido a la ciencia en secundaria, México, Visor/SEP/(Biblioteca para la actualización del maestro), pp. 120-122.
Rosalind Driver y col. (1992), “Más allá de las apariencias: la conservación de la materia en las transformaciones físicas y químicas”, en Ideas científicas en la infancia y la adolescencia, Madrid, Morata, pp. 243-251.
Vanesa Kind (2004), “Ideas de los estudiantes sobre procesos químicos en sistemas abiertos”, en Mas allá de las apariencias, México, Santillana/SEP/(Biblioteca para la actualización del maestro), pp. 75-87
Páginas visitadas en Internet:
http://www.uba.ar/academicos/uba21/download/materias/qui_u3_oxiynomenclatura.p df
http://www.ciens.ucv.ve/eqsol/reacciones_electroquimicas/Curiosidades/reacciones_d e_oxido_reduccion.pdf
http://laguna.fmedic.unam.mx/~evazquez/0403/transporte%20de%20electrones.html
http://www.cienciahoy.org.ar/ln/hoy82/hormigon.htm corrosión
http://www.construaprende.com/t/05/T5p04.php#Proceso%20básico%20de%20oxíge no acero
http://omega.ilce.edu.mx:3000/sites/ciencia/volumen1/ciencia2/09/htm/sec_7.html
corrosión
http://depa.fquim.unam.mx/educquim/articulo.php?Id_articulo=431