"CONTEO DE CELULAS SANGUINEAS A TRAVES DE IMÁGENES DE MICROSCOPIA"
TESIS QUE PRESENTA ROBERTO JUAN NAVARRO RAMOS PARA LA OBTENCION DEL GRADO DE
MAESTRO EN CIENCIAS (INGENIERIA BIOMEDICA)
NOVIEMBRE DE 1999
DIVISION DE CIENCIAS BASICAS E INGENIERIA
A
mis asesores
M.
en C. José Rafael Godínez Fernández y
M.
en C.
Oscar Yañez Suárez, por todas
sus enseñanzas y consejos para la
elaboración del presente trabajo.
AI
laboratorio de
Biofísica y a todos sus integrantes por
sus
comentarios, criticas y recomendaciones para este trabajo.
A
todos los profesores de la Maestría en Ciencias (Ingeniería
Biomédica) de la Universidad Autónoma Metropolitana Unidad
Iztapalapa, por su gran apoyo en todo momento.
POR QUIENES HE LOGRADO TANTAS COSAS,
POR SUS
TANTAS HORAS DE DESVELOS, POR SUS ENSEÑASAS Y
CONSEJOS, POR SU AMOR,
SU
COMPRENSION, POR
DEDICARME SU VIDA..
.
GRACIAS
A MI HERMANO:
POR SU APOYO, CARIÑO
Y COMPRENSION, POR
SUS
OPINIONES Y CRITICAS
A
MI TRABAJO,
Y POR ENSEÑARME
CUANDO FUE NECESARIO
A
MIS
AMIGOS:
digital de imágenes, para contar automáticamente cifras totales de células rojas y blancas.
La técnica se ha automatizado para eliminar el error humano involucrado en los
conteos manuales. De esta forma, se pretende lograr conteos mucho más confiables con un
grado de reproducibilidad mucho mayor que con el conteo manual.
Se describe la metodología para realizar la exploración de las imágenes a través de
las diferentes etapas de procesamiento: segmentación (umbralización, erosión y
dilatación), reconocimiento de objetos (células) presentes en las imágenes y aplicando el
criterio de conteo en una cámara de Neubauer.
Se valoran los resultados obtenidos por medio del conteo automático
comparándolos con los obtenidos con conteo manual aplicando un estudio estadístico que involucra a la prueba de t para muestras pareadas, encontrando diferencias aceptables,
indicando que el sistema es válido para evaluar muestras sanguíneas y obtener el número de
ellas por mm3 de sangre.
Finalmente se describe la implementación y utilidad de un visor de morfologías, que
permita al patólogo o médico observar las muestras sanguíneas por medio de un monitor de
computadora, mismo que permite obtener algunos parámetros importantes para la
valoración del estado que guardan las células de un individuo. Este software también
1.0 IMPORTANCIA DE LAS CÉLULAS SANGUÍNEAS Y
su
CONTEO...
i1.1 GENERALIDADES ACERCA DE LOS CONTADORES DE CÉLULAS SANGUÍNEAS
...
5OBJETIVOS
...
35Objetivo General ... 35
Página
CAPITULO I1 ... 37
MATERIAL Y METODOS ... 37
2.1 MATERIAL ... 37
2.2 METODOS
...
412.2.1 MÉTODOS COMúNMENTE UTILIZADOS EN EL LABORATORIO ... 41
2.2.2.1 Citometría henzútica manual ... 41
2.2.2.2 Forma en que se realiza el conteo de células en una cúmara de Neubuuer ... 42
2.2.2.3 Errores en Citometría hemútica . . . 43
2.2.2.4 Recuento deglóbulos rojos o eritrocitos ... 45
2.2.2.7 Reactivos para realizar recuento celular en una cúmara de Neubauer ... 48
Pura el recuento de glóbulos blancos . . . 49
2.3 INNOVACIONES A LOS MÉTODOS UTILIZADOS
...
492.3.1 MÉTODOS PARA LA O B T E N C I ó N DE LAS MUESTRAS SANGUíNEAS ... 50
2.3.1. I Protocolo p a m la obtención de sangre en ratas ... 51
2.3.3 R E A L I Z A C I ~ N DE LOS EXPERIMENTOS ... 59
2.3.3.1 Innovaciones realizadas a la técnica ... 5Y Técnica de las células brillantes ó muestra fuera de foco ... 59
2.3.4 Visualización de mofologias (MORFOLOG) ... 63
2.2.1.1 Frotis o extensiones de sangre . . . 63
2.2.1.2 Coloración de los frotis ... 65
2.3.2 PROTOCOLO PARA LA OBTENCIóN DE MUESTRAS DE SANGRE HUMANA ... 54
CAPITULO 111
...
69ALGORITMOS COMPUTACIONALES ... 69
3.1 TÉCNICAS DE PROGRAMACI~N PARA EL PROCESAMIENTO DIGI TAL DE LAS IMÁGENES
...
693.1.1 CONTADOR DE CÉLULAS SANGUÍNEAS CONCELSAN
...
693.1.1.1 Concel ... 69
. 1 . 1.2 Celcon 75 3.2 VISOR DE MORFOLOGIAS MORFOLOG ... 77
3 ... 3.2.1 R A D I O ... 79
3.3 DISEÑO Y CONSTRUCCIóN DE UNA INTERFASE GRÁFICA
...
79. . . ...
R E S U L T A D O S ... 85
4.1 RESULTADOS OBTENIDOS ... 85
4.1.1 VALIDACIóN DE LOS CONTEOS EN LAS IMÁCENES ... 86
4.2 RESULTADOS OBTENIDOS. EN EL CONTEO DE CÉLULAS ROJAS DE RATA
...
884.3 RESULTADOS OBTENIDOS. COMPARACI~N Y V A L I D A C I ~ N DEL SISTEMA CONCELSAN Y EL CONTEO CLÁSICO EN UNA CÁMARA DE NEUBAUER CON CÉLULAS HUMANAS
...
894.3.1 CONTEO E N CÁMARA DE NEUBAUER ... 89
4.3.1.1 Conteo de células blancas ... 89
4.3.1.2 Células rojas ... 90
4.4 CONTEO A TRAVES DE CONCELSAN
...
9 1 4.4.1 CONTEO DE CÉLULAS BLANCAS ... 914.4.2 CONTEO DE CÉLULAS ROJAS ... 92
4.5 ESTADISTICA DE LOS CONTEOS ... 93
DISCUSION
...
97CONCLUSIONES
...
99COMENTARIOS Y RECOMENDACIONES
...
1011.0 Importancia de las células sanguíneas y su conteo.
La sangre es una forma especializada de tejido conectivo que consta de
elementos formes, o células sanguíneas, y una sustancia intercelular líquida, el plasma
sanguineo. El volumen de sangre en el adulto humano sano es aproximadamente de
cinco litros, y desde el punto de vista cuantitativo la sangre constituye alrededor del 8%
del peso corporal. A causa de la fluidez del plasma, las células sanguíneas no tienen
relación espacial definida; las células sanguíneas reciben su nombre según su aspecto en
estado fresco, no teñidas, y son de dos tipos principales: rojas (eritrocitos) y blancas
(leucocitos). Otros elementos formes que se encuentran en la sangre son las
plaquetas. [ 1 b]
El examen de los elementos formes de la sangre es de importancia clínica, ya que la morfología, el número y las proporciones de los diferentes tipos celulares
son indicadores de muchos cambios patológicos en el cuerpo. Aunque algunas
características de los elementos formes son visibles en sangre fresca, muchas otras sólo lo son después de fijarlas y teñirlas. Los métodos de tinción de Romanowsky, de los cuales son ejemplos los de Giemsa y de Leishman, se usan mucho en los laboratorios hsitológicos y clínicos. Incluyen la tinción en soluciones que son mezclas de azul de
metileno y eosina. Las cifras dadas (estas se mencionan posteriormente) para las
dimensiones y el número de las células sólo son valores aproximados, y que con
excepción de los eritrocitos, las dimensiones de las células son menores cuando se
miden en estado fresco que cuando se miden en un frotis de sangre seca y fijada.
Eritrocitos
Los eritrocitos, o glóbulos rojos, son células muy diferenciadas, especializadas
funcionalmente para el transporte de oxígeno. En los mamíferos el eritrocito es una
célula que ha perdido su núcleo y sus organitos citoplasmáticos durante el desarrollo.
Cada célula tiene la forma de un disco bicóncavo, y cuando se observa de frente tiene
contorno circular. En algunas enfermedades se altera la forma de los eritrocitos
humanos circulantes. Miden alrededor de 7.6 pm de diámetro, y 1.9 pm en su parte
Estado del arte
Los eritrocitos son mucho mas numerosos que cualquiera de los otros elementos
formes de la sangre. En los varones hay de 5 a 5.5 millones de eritrocitos y en las
mujeres, de 4.5 a 5 millones por mm’. La residencia prolongada en lugares elevados se
acompaña de aumento en el número de eritrocitos. La cifra total de eritrocitos por superficie es impresionante. Se eleva a 3500 m2 aproximadamente. Esta área enorme sirve para el intercambio de gases entre los eritrocitos y su medio.
Un eritrocito seco y aislado es de color amarillo verdoso pálido. Con regiones densas de color rojo. En un frotis seco de sangre periférica, los eritrocitos se tiñen de
rojo (con las tinciones de Leishman, o de Giemsa).
Leucocitos
Los leucocitos, o glóbulos blancos, son células con núcleo. Hay un promedio de
5 O00 a 9 O00 leucocitos por mm3 en la sangre humana normal. En los niños este
número es mayor. Su número varía notablemente en los estados patológicos. Si el
número aumenta por encima de 12 000, el trastorno se llama leucocitosis; si disminuye
por debajo de 5 000, se llama leucopenia.[ lb]
Hay dos tipos principales de leucocitos: agr-anulares y granulares. Los
leucocitos agranulares tienen citoplasma de aspecto homogéneo y núcleo con forma que va de esférica a reniforme. Los leucocitos granulares contienen gránulos específicos abundantes (que en vida son gotitas semilíquidas) en su citoplasma, y poseen núcleos de forma muy variable.
A su vez, hay dos tipos de leucocitos agranulares: los linfocitos, que son células
pequeñas con citoplasma escaso, y los monocitos, que son células ligeramente más
grandes que contienen algo más de citoplasma.
Los leucocitos granulares son de tres tipos: neutrofilos, basofilos y acidofilos (o
eosindfilos), que se identifican por la afinidad de sus respectivos gránulos por los
colorantes neutros, básicos y ácidos, respectivamente.
Los leucocitos participan generalmente en la defensa celular y humoral del organismo contra agentes extraños. Son capaces de efectuar movimientos ameboides que les ayudan a pasar a través de las paredes de los vasos sanguíneos, y poder penetrar en los tejidos conectivos.
En la sangre humana los linfocitos son células esféricas, con diámetro que varia
de 6 a 8 pm, aunque algunos pueden ser mayores. La mayor parte solo son un poco
mayores que los eritrocitos. Constituyen de 20 a 35% de los leucocitos de la sangre
normal. La característica más notable del linfocito pequeño es que tiene un núcleo relativamente grande rodeado por un anillo estrecho de citoplasma. El núcleo aparece esférico, pero por lo general muestra una pequeña identación en un lado.
Algunos de los linfocitos de la sangre circulante normal pueden medir de 1 O a 12 pm. Su tamaño más grande se debe principalmente a una cantidad mayor de citoplasma.
Estas células a veces se denominan linfocitos de tamaño medio.
Los monocitos, son células que constituyen del 3 al 8 % de los leucocitos de la
sangre normal. Miden de 9 a 11 pm de diámetro, pero en los frotis secos se pueden
aplanar para alcanzar un diámetro de 20 pm o más. El núcleo suele estar excéntrico en las células y es ovoide o reniforme. En las células más viejas el núcleo puede presentar una profunda depresión que le da la forma de herradura. En su interior, la cromatina se dispone en forma de una red fina, por lo que el núcleo no se tiñe con tanta intensidad como el de los linfocitos. El citoplasma es relativamente abundante y con la tinción de Wrigth es de color azul grisáceo pálido en los frotis secos. A menudo presenta un aspecto vacuolado o reticulado y contiene una población de gránulos azurófilos; éstos
suelen ser más numerosos, pero más pequeños que los de los linfocitos. Los gránulos
son lisosomas primarios. El citoplasma también contiene algo de retículo endoplásmico granuloso, pero menos ribososmas libres que los que se encuentran en los linfocitos.
Leucocitos granulosos
En contraste con los linfocitos y monocitos, los leucocitos granulares siempre contienen gránulos específicos. Se caracterizan por la presencia de un núcleo
multilobulado (poliformo). Por esta razón, a veces, se les ha llamado leucocitos
polimorfonucleares.
Neutrófilos
Los leucocitos polimorfonucleares neutrófilos tienen un diámetro de 7 a 9 pm en
estado fresco y de 10 a 12 pm en los frotis secos. Son el grupo más numeroso de
leucocitos en la sangre humana y constituyen el 65 a 75 YO del total. El núcleo es muy
variable en su forma. Suele constar de tres a cinco lóbulos ovoides irregulares unidos por filamentos delgados de cromatina. El número de lóbulos aumenta con la edad. No se observan nucleolos. En fiotis secos de sangre periférica de mujeres se puede observar un pequeño apéndice nuclear unido al resto del núcleo por una banda de cromatina en
casi 3 YO de los neutrófilos. Es probable que este “palillo de tambor”, observado por
primera vez por Davidson y Smith, represente el cromosoma sexual. Se supone que se encuentra en todas las células femeninas, pero en la mayor parte de las células está íntimamente unido a uno de los lóbulos del núcleo y por ello queda oculto.
Eosinófilos
Los leucocitos eosinófilos o acidófilos, son algo más grandes que los neutrófilos
y en estado fresco tienen un diámetro de 9 a 10 pm. En los fiotis secos, el tamaño de las
Estado del arte
de los glóbulos blancos. El núcleo suele ser bilobulado. Como característica, el citoplasma está lleno de gránulos gruesos refringentes de tamaño uniforme que se tiñen intensamente con los colorantes ácidos. Los gránulos específicos tienen un aspecto
llamativo en las micrografias electrónicas, pues parecen presentar bandas por la
presencia de cristales cilíndricos densos dentro de ellos. Se ha demostrado que los gránulos contienen peroxidasas, así como cierto número de enzimas hidrolíticas. Por ello estos gránulos como los de los neutrófilos, son de naturaleza lisosómica.
Basófilos
Es dificil encontrar estas células en la sangre humana, ya que sólo constituyen
alrededor de 0.5 a 1 % del número total de leucocitos. Tienen más o menos el mismo
tamaño que los neutrófilos, de 7 a 9 pm de diámetro en estado fresco y de 10 pm o un
poco más en los frotis secos. A menudo el núcleo presenta contorno irregular y está
parcialmente estrechado para formar dos lóbulos gruesos y de tamaño variable. De
manera característica, algunos cubren el núcleo y contribuyen a ocultar su entorno.
Estos gránulos son hidrosolubles y por lo tanto están disueltos en parte o faltan en las preparaciones sistemáticas. Son basófilos y metacromáticos y contienen histamina,
heparina, y serotonina. A diferencia de los gránulos de los otros tipos de leucocitos
granulares, no se considera que sean lisosomas.
El cuadro sinóptico 1.1 muestra detalladamente los diferentes elementos que
integran la fase de elementos formes de la sangre.
El factor primordial por el cual es de suma importancia conocer el número de células sanguíneas por mm3 que se encuentran en el cuerpo humano, es detectar posibles
patologías que se acompañan de una disminución o incremento en la densidad de las
células. También resulta de suma importancia conocer la morfología de cada tipo
celular a través de su observación, ya que el diagnostico preciso de una patología no
solo se basa en el conteo celular sino también en la observación detallada de la
Fase de elementos
formes
3 Granulocitos
Agranulocito
O Basófilos
O Neutrófilos
O Eosinófilos
0 Linfocito
Monocito
Cuadro sinóptico l . 1
Diferenciación de la fase de elementos formes de la sangre en sus componentes [IC]
1.1 Generalidades acerca de los contadores de células sanguíneas
Los primeros intentos para contar el número de células sanguíneas fueron realizados en el siglo XVII, poco tiempo después de haber sido descubiertas por el investigador Van Leeuwenheok. Utilizando un rudimentario microscopio y la sangre de un pollo, Van Leeuwenheok contó el numero de eritrocitos presentes en una muestra, depositada en un capilar graduado de vidrio[2b].
La técnica general del conteo de células empleando un microscopio, en un contenedor transparente, se fue desarrollando gradualmente, a través de mejoras tanto al microscopio como al contenedor, hasta llegar al diseño de "cámaras de conteo", esto
después de dos siglos de investigación continua. Es en el siglo XIX cuando se
Estado del arte
En el siglo XX, con los avances en la electrónica y la electroóptica, se han
realizado muchos intentos para simplificar el conteo de células sanguíneas. En 1934 Moldavan describió un procedimiento con el cual las células diluidas en suspensión son
contadas por medio de un dispositivo fotoeléctrico. Lamentablemente debido a
imperfecciones del dispositivo fotoeléctrico, este primer intento para automatizar la técnica de conteo de los eritrocitos, fue fallido. Posteriormente, infinidad de aparatos fueron diseñados utilizando el principio en el que se basa el dispositivo de Moldavan.
Aproximadamente en 1945, se describió un método con el cual la concentración de eritrocitos en la sangre podría ser determinada indirectamente utilizando turbidimetría. Este método fue estudiado y mejorado, resultando en un instrumento
apropiado, que se muestra esquemáticamente en la figura No l . 1. En este instrumento
los eritrocitos no son contados uno a uno, como en el caso de los primeros contadores automáticos, por ello el instrumento debía de ser calibrado contra una preparación de células de referencia o una preparación artificial estándar.
I Celda de absorción
Filtro :,
4 LamDara Anillo
fotocelda
Diafragm
Figura l. 1
En la misma década se describió otro instrumento con el cual los eritrocitos podían ser contados automáticamente, por medio de un punto de exploración fotoeléctrico, a través de una delgada capa de sangre diluida. En este instrumento, el microscopista es reemplazado por un fotomultiplicador y una unidad contadora. La cámara de conteo es movida por medio de un motor que maneja el sistema. Un instrumento basado en esta tecnología es conocido como el contador Casella, el cual se
muestra en la figura 1.2. Posteriormente, en instrumentos mas sofisticados, los cuales se
basaban en un punto de exploración flotante, se tomaron medidas especiales, para compensar los errores causados por la superposición (oclusión) o irregularidades en los bordes de las células.
Hendidura
P o t o m u l t i p l i c a d ~
Diagrama
Condensador de campo negro
Figura 1.2.
esquemático del dispositivo que utiliza punto de exploración fotoeléctrica
En 1953, se da a conocer un método, en el cual la sangre era forzada a pasar a
través de una estación óptica de detección en forma de un delgado hilo de fluido. Este
procedimiento reducía la probabilidad de superposición de las células sanguíneas, que podían ser contadas una a una. El contador EEL es un instrumento basado en este principio (el diagrama de este instrumento se muestra en la figura 1.3). Pero debido a la
conglomeración en el largo y delgado capilar, este método ya no es utilizado
Estado del arte
Figura 1.3
Diagrama esquemático de un sistema utilizando un método fotoeléctrico de conteo simultáneo de células[2b].
En 1956, Coulter [la] introdujo un contador automático de células. Este aparato se basa en la menor conductividad de los eritrocitos, en comparación con el líquido en el
cual se diluyen. En el instrumento de Coulter, las células sanguíneas suspendidas en
una solución electrolítica, son inducidas a un flujo a través de un campo eléctrico, en un
orificio pequeño taladrado en un zafiro delgado. El campo eléctrico que rodea este
orificio pequeño, es la parte sensora del instrumento. Gracias a la porción pequeña de la sección de sensado, las células sanguíneas son detectadas y contadas casi una a una.
Uno de los modelos de este instrumento se muestra en la figura 1.4.
Figura 1.4
Contador Coulter modelo F, con accesorios para hematócrito y calculo de HGM [3b].
Las mediciones del tamaño de las células también fueron iniciadas gracias al
microscopio, inventado por Van Leeuwenheok. Pero fue hasta 17 18 que Jurin estableció
adecuadamente el diámetro de las células rojas humanas. De igual modo que el conteo de células, el establecimiento del tamaño de estas fue realizado visualmente, hasta el
siglo XX. A comienzos del siglo XX, las técnicas de centrifugación fueron aplicadas a
toda la sangre, permitiendo una medida del “paquete de células rojas” o hematócrito. De aquí, Wintrobe definió los indices de las células rojas.
El desarrollo del método de Coulter, a mediados del siglo XX, para el conteo de
células, sugería que estas podían ser medidas simultáneamente, a través de la aplicación de un impulso eléctrico, el cual al pasar a través de las células da como resultado una corriente proporcional al volumen de estas. Argumentos similares fueron utilizados posteriormente para validar los sistemas de conteo con celdas fotoeléctricas. Así mismo,
por medio de estas técnicas se inicio el desarrollo de sistemas combinados con los
cuales se calculan tanto el tamaño como el número de las células presentes en una muestra.
1.2 TEORIA Y TECNOLOGIA PARA EL CONTEO DE CELULAS
1.2.1 Descripción del problema.
Conceptualmente, el conteo de células es simple. Un problema puede ser el
reconocer cada tipo celular presente en un determinado volumen en una muestra[ 1 1 b].
Algunos de los problemas más significativos son:
1. 2.
3.
4.
5.
La sangre es un fluido de dos fases con una viscosidad no constante.
El gran número de células por unidad de volumen de sangre, demanda que se
realice una dilución o que se utilice un elemento de sensado lo
suficientemente pequeño.
Las células son en general, mas densas que el fluido que las circunda. Esto crea un problema en cuanto a establecer y mantener una suspensión homogénea para realizar el análisis.
Las células son tan pequeñas, que se requieren de sensores con muy alta sensibilidad para discriminar entre ellas y ruido aleatorio.
Las diferencias entre los diferentes tipos celulares pueden ser muy sutiles, requiriendo complicadas preparaciones y algoritmos para discriminar entre las diferentes clases.
1.2.2 Métodos de dilución.
Para detectar células individuales como partículas distintas, es generalmente necesario diluir la muestra de sangre, previamente al conteo. Las diluciones para el conteo de células sanguíneas son completamente altas, y deben de ser tanto como
50,000 a l . De esta forma existen diversas técnicas de dilución para el conteo de células.
Los métodos de dilución incluyen pipeteo manual, dilución semiautomática y
Estudo del arte
1.2.3 Pipetas manuales.
En los métodos manuales de conteo de células (hematocitómetro), los diferentes tipos de células sanguíneas, requieren diluciones en un rango comprendido entre 1 en 20
para células blancas, y de 1 en 200 para células rojas. En principio, existen 3 formas en
las cuales las células pueden ser diluidas: (1) Pipetas de Thoma, estas pipetas están
diseñadas para contener simultáneamente la sangre y el líquido de dilución, (2) Pipetas
del tipo Sahli, que transfieren 20 pL de sangre a un contenedor, el cual contiene la
cantidad apropiada de liquido de dilución; y (3) Capilares diseñados para realizar una punción y retener en ellos el volumen requerido de sangre.
Para exactitud, las pipetas deben de ser calibradas ya sea a través de un
procedimiento gravimétrico o una valoración fotométrica. Los mktodos fotométricos,
son quizá técnicamente más fáciles de realizar, especialmente en el laboratorio de
hematología en donde la fotometría es un procedimiento de rutina. El método
gravimétrico es mucho más exacto, y debe de ser utilizado para métodos de referencia o
si se desea una inexactitud menor que el 1 %.
1.2.4 Dilución semiautomática
Diversos sistemas han sido diseñados para simplificar la operación de dilución,
eliminando uno o mas de los pasos. Estos sistemas incluyen, pipetas con autollenado,
automedición y dilución, recipientes flexibles, y micropipetas de ensayo [lb].
1.2.4.1 Pipetas con autollenado, automedición y dilución
Estos dispositivos consisten en un tubo capilar delgado, ajustado a un mango de
plástico, y a un recipiente también de plástico, en el cual está depositado un volumen
predeterminado de líquido de dilución. (ver figura 1.5).
La sangre es extraída hacia el capilar. La dilución es llevada a cabo después de introducir el capilar dentro del recipiente. Las paredes del recipiente son presionadas gentilmente antes de insertar el mango del capilar, esto es, se crea una presión negativa. Cuando las paredes son liberadas la sangre es extraída desde el tubo hacia el diluyente.
El tubo capilar es enjuagado con el diluyente apretando ligeramente el
recipiente, forzando al fluido dentro del capilar y llenando la cámara. Cuando la presión es liberada, el diluyente regresa hacia el recipiente. Después de mezclar la sangre con el
diluyente por medio de agitación, la pipeta de dilución es regresada a su posición inicial
poniendo el capilar y reconectándolo al recipiente. Ahora el recipiente es exprimido
gentilmente forzando a la sangre diluida hacia fuera del capilar, en forma de gotas
uniformes para llenar el hematocitómetro.
Capilar
Figura 1.5
Micropipeta de dilución de automedición, consiste en una cámara de plástico conteniendo una cantidad premedida de diluyente y un capilar [2b].
1.2.4.2 Recipientes flexibles.
Este es otro aparato que simplifica el método del capilar. El principio consiste en tomar la muestra directamente del tubo capilar por medio de un dispositivo metálico el cual es empujado a través del capilar y colecta la muestra tomada. El dispositivo
metálico es puesto después en el diluyente y la muestra es mezclada a través de
rotación, de aquí el nombre de "recipientes flexibles". La inexactitud de este método se
ha reportado menor a 1 % y una imprecisión de 0.24% para una muestra de 20 pL.
1.2.4.3 Micropipetas de ensayo.
Estos dispositivos simplifican la extracción y distribución de una muestra en una
pipeta ordinaria. Se utilizan medios mecánicos o automáticos para su desalojamiento.
En estos dispositivos, se puede lograr, una exactitud aproximada del 98% y una
reproducibilidad del 99%.
1.2.4.4 Dilución automática.
El problema de diseño de un sistema dilutor de sangre totalmente automático, es
lograr resultados exactos y reproducibles en un rango de 5 a 50 pL de muestra
sanguínea. Estos problemas son algo diferentes desde la perspectiva de diseño para grandes volúmenes de muestra sanguínea y pequeña dilución. Para esta última clase de dilutor, es usualmente adecuado proveer al sistema con dos pistones del mismo diseño, uno largo para el diluyente y otro pequeño para la muestra, estos conectados a través de una conexión de válvulas apropiada.
Cuando el volumen de la muestra es del orden de 5 a 50 pL, las limitaciones del
diseño deben de ser mucho más estrictas. Una variabilidad de f 2 pL, en una muestra
Estado def arte
inmanejable f 10% si el dispositivo tiene 20 pL. Como quiera que sea, esta cantidad es
muy fácil de perder en un sistema de válvulas o en un sistema de tubos distensibles.
Para un contador de células sanguíneas, el dilutor debe de tener las siguientes características: Cero distensibilidad en el sistema de muestreo del dispositivo, la válvula debe de ser del tipo no removible, o debe introducir variabilidad únicamente en muy altos volúmenes de diluyente donde puede ser mucho mejor tolerado, la unidad debe de permitir rápida calibración en el laboratorio para compensar cualquier deterioro, y debe de mantener su calibración por largos periodos de tiempo.
El método automático de dilución mas comúnmente utilizado emplea una válvula de corte para el dispositivo de muestreo (ver figura 1.6). La sangre es extraída y depositada en una pequeña cámara contenedora, dentro del elemento movible de la válvula. Después la muestra es capturada por el movimiento de la válvula, y esta es lavada por una gran cantidad de diluyente. Las válvulas de este diseño en general, están
fabricadas en metal o en cerámica.
1.2.5 Diluyentes para el conteo de células.
Preparar la sangre para el conteo de células involucra el realizar la dilución de la muestra. Debido a las diferentes densidades de los elementos formes de la sangre, el factor de dilución es diferente, se emplean diferentes diluyentes (ver tabla 1).
Sensor
Valvula rotatoria esquiuada
Muestra I
sanguinea
r
Figura 1.6
Método de dilución automática, en el cual la sangre diluida es aspirada (izquierda) dentro de una cámara capilar contenedora, dentro de una válvula rotativa de corte [2b].
1.3
Conteo decélulas rojas.
Diversos diluyentes para el conteo visual de células rojas han sido desarrollados
(ver tabla No 1).
Para contadores automáticos, especialmente aquellos basados en el método de resistencia eléctrica, es deseable evitar alteraciones en el pH, temperatura y en el grado de ionización, ya que esto puede influenciar al campo eléctrico y permitir alteraciones en el tamaño, forma y estabilidad de las células sanguíneas en el diluyente. La solución utilizada para la dilución debe estar lo más posible libre de partículas. Soluciones comerciales salinas (para uso intravenoso) son generalmente apropiadas; con otro tipo de soluciones podría ser necesario remover partículas de polvo a través de membranas
de filtración. El diluyente debe dar un conteo menor a 100 partículas en el volumen
medido. Cuando se utiliza solución salina fisiológica (9.0 g/L NaCl), los conteos deben ser realizados rápidamente después de la dilución, esto para evitar errores debidos a las alteraciones morfológicas y lisis de las células.
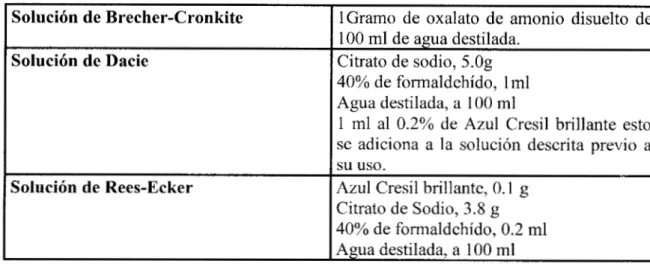
Tabla No 1.
Soluciones de dilución para el conteo de eritrocitos en hematocitómetro Ulbl
Solución de Dacie
Solución de Hayem
I
Solución Normal Salina~~
Solución Fuerte
Solución de Gowers
Solución de Toison
Citrato trisódico (30%), 99ml
Fonnaldehído concentrado, lml Cloruro de Mercurio, 0.25 g Cloruro de Sodio, 0.5 g
Sulfato de Sodio, 2.5g
Agua Destilada, a 100 m1
Cloruro de Sodio, 0.85 g
Agua Destilada, a 1 O0 m1
Citrato de Sodio, 1 .O g
Cloruro de Sodio, 0.6 g
Formaldehído, 1 .O m1
4gua destilada, a 100 m1
Sulfato de sodio, 6.75 g
4cido Acético (3%), 3.5 m1
4gua destilada, a 1 15.0 m1
Cloruro de Sodio, 1 .Og
Sulfato de Sodio, 8.0g
Violeta metílica 5B, 0.025g
Glicerol, 30.0 m1
TABLA No 1. (Continuación)
Soluciones de dilución para el conteo de plaquetas [ l l b ]
Solución de Brecher-Cronkite
Solución de Dacie
Solución de Rees-Ecker
lGramo de oxalato de amonio disuelto de
1 O0 m1 de agua destilada.
Citrato de sodio, 5.0g
40% de formaldehído, lml Agua destilada, a 100 m1
1 m1 al 0.2% de Azul Cresil brillante esto
se adiciona a la solución descrita previo a
Azul Cresil brillante, O. 1 g
Citrato de Sodio, 3.8 g
40% de formaldehído, 0.2 m1 Agua destilada, a 100 m1 su uso.
1.3.2 Conteo de células blancas.
Cuando se cuentan células blancas, es necesario destruir por hemólisis la mayor
parte posible o en el mejor de los casos el total de células rojas. Para el conteo visual se
emplea una solución de ácido acético o O. 1M HCI. Típicamente, un tinte, violeta de
genciana, se incluye en la solución, para colorear el núcleo de las células y hacer más
fácil su reconocimiento [ 12bl.
Para contadores automáticos se requiere una destmcci6n mas completa de la
membrana de las células rojas, esto para reducir la posibilidad de conteos falsos
producidos por los restos de las células. Típicamente, se emplea un agente con alta
concentración, que produzca lisis, tales como la saponina.
1.3.3Conteo de Plaquetas.
En el conteo de plaquetas por medios visuales, también es necesario eliminar la interferencia producida por las células rojas. Esto puede ser hecho a través de lisis en una solución de oxalato de amonio (10mgA). Alternativamente, las células rojas son eliminadas permitiendo que la muestra completa sedimente a baja temperatura (en un
refi-igerador). El plasma sobrenadante, el cual contiene a las plaquetas, sediluye en una
solución de formal-citrato. La cuenta es luego corregida multiplicando por un factor conocido el volumen del paquete de células rojas.
Algunos métodos automáticos para el conteo de plaquetas siguen técnicas similares. No obstante, las técnicas automáticas más comunes cuentan las plaquetas, y los diferentes tipos celulares al mismo tiempo, y en el mismo diluyente, empleando
discriminación electrónica para separar los dos tipos diferentes de células [ 1 1 b- 12bl.
1.4 Métodos de detección
La esencia de un contador automático de células es el detector. Existen dos tecnologías apropiadas para este propósito, la detección óptica y la detección eléctrica. En la primera (disparos de 1uz)un detector fotoeléctrico responde al cambio en la intensidad de la luz causada por la presencia de las células de la sangre. En la segunda (impedancia de apertura) la alteración de la impedancia de una pequeña apertura, llena con una solución conductiva, es causada por la presencia de las células sanguíneas [2a- 4a].
1.4.1Medición óptica
En términos muy generales, el método para la medición de las células a través del disparo de un haz de luz, se muestra en la figura 1.7. Un plano de onda
electromagnética monocromática de una longitud de onda
h
que se propaga en un mediocon un índice de refracción qo choca sobre la celda, la cual es caracterizada por su
volumen, forma e índice de refracción qp. La interacción de la radiación incidente y la
celda produce una onda pulsada, teniendo una intensidad la cual varía dependiendo del
ángulo a. La dependencia angular de la intensidad de la radiación pulsada es una
función de las propiedades de la partícula pulsada.
La teoría de pulsación de una radiación electromagnética ha sido desarrollada completamente para el caso particular de esferas homogéneas, y ahora existen disponibles programas de computadora para calcular la distribución de la intensidad y otras cantidades relevantes. La fuerte dependencia de las funciones de pulsación con el
tamaño de una partícula se ilustran en la figura 1.8 y son típicas para las células rojas de
la sangre.
Aceptancia de apertur
Fuente de Particula oulsada
Figura 1.7
Ejemplo de un arreglo óptico para conteo de células a través del sistema de luz pulsada [lb].
1.4.2 Método eléctrico (Impedancia de apertura).
El método eléctrico de medición de células se muestra esquemáticamente en la figura 1.9. Las células suspendidas en un electrolito se hacen pasar a travks de una
pequeña apertura en un aislante. En ambos lados de la apertura están ea tinas de
electrolito largas. Aplicando la ley de Ohm para el caso en donde no existe ninguna partícula en la apertura obtenemos [8a-9a]:
R = V l I = p ( l I Q j Ec. 1.1
donde V es el voltaje entre los electrodos, I es el flujo de la carga, R es la resistencia de
la apertura, p es la resistividad del electrolito, t es la longitud de la apertura, y a es el
área de sección cruzada de la apertura.
Cuando una partícula pequeña de muy alta resistividad, mayor que la del
electrolito, entra en la apertura, la resistencia en la apertura se incrementa. La partícula actúa como un hoyo no conductor desplazando al electrolito. El cambio en la resistencia
puede ser calculada a través de los principios básicos de cualquier circuito electrónico
cuando se conocen el voltaje, y la corriente circulante. Aquí se muestra, el caso d e la
esfera con resistencia infinita, la cual produce:
AI
4 843M = - = K v ( l + - - x + -
V 5 1120 x2 -P..
Ec. 1.2
donde
AI
es el cambio en el flujo de la corriente, K es la resistencia de la aperturadividida por su volumen, v es el volumen de la esfera y x es el radio de la sección
cruzada de la apertura.
Escogiendo un diámetro de apertura de 50 pm y manteniendo una corriente constante, que permita pulsos con voltajes lineales, con un volumen particular (dentro
de 5%) desde 10 fl a 140 fl. El tamaño de la resolución para este sistema es
esencialmente limitado por el ruido de Johnson de la resistencia de apertura y es
también típicamente menor que 1 fl.
Angulo de pulsado (grados)
Figura 1.8
Intensidades de pulsado diferenciales como hnción del ángulo de pulsado para el tamaño e índice de refracción, parámetros típicos de las células rojas [2b].
1.4.3 Métodos de transporte de células
La determinación del conteo de células requiere de contar cada célula en un volumen conocido de sangre diluida. Existen dos metodologías principales. En una
(transporte mecánico), las células son transportadas a una película estacionaria o al
fondo de una cámara poco profunda (hematocitómetro) el cual es llevado a través de la estación de detección o escudriñado ópticamente por medio de traslación mecánica (movimientos de la platina del microscopio). En el otro método (transporte de fluido),
las células están suspendidas, en un fluido el cual es llevado después por fuerzas
hidrodinámicas y pasado por la estación de detección; Ambos detectores, tanto ópticos
Estado del arte
ELECTROLITO
(P =RESISTAXDAD) ,
fj
ELECRTODO
\,
APERTURA/"- DE
SENSADO
1.4.4 Transporte mecánico
Un hematocitómetro es llenado con muestras de sangre diluida, y las células son sedimentadas formando una monocapa en el fondo. El conteo es ejecutado pasando la
imagen de esta monocapa de células a través de una estación de detección óptica o
visual. Esto puede ser efectuado transportando al hematocitómetro a través de una
estación óptica fija, o el hematocitómetro es fijado y una imagen de las células es
obtenida moviendo mecánicamente un prisma o espejo. El conteo de células se
determina contando el número de células en una área dada de la monocapa. El método
supone que las células se han sedimentado de manera aleatoria. Así,
célulaslmm3 = Dilzxcél~llas/área(mm2) Ec. 1.3
donde D es el factor de dilución y h es la altura de la cámara de conteo (mm).
La determinación del área de conteo es generalmente exacta. La exactitud del
método del hematocitómetro es limitada, debido a la incertidumbre en la altura de la
cámara. Puesto que un sistema de alta resolución óptica es requerido para contar las células, el espesor de la cámara y su cubierta selladora de cristal deben ser menores que
la distancia de trabajo de un objetivo de microscopio (0.1 mm). De esta forma, 10 pm
representan un error potencial en la cuenta del 10%. La incertidumbre de la
profundidad fisica de la cámara de conteo o una inclinación en la cubierta de cristal pueden ser de varios micrómetros, y esto llega a ser el factor límite en la exactitud del conteo de células.
1.4.5 Transporte de fluidos
En este método las células son contadas como parte del fluido que pasa a través de una estación de detección. El resultado es una secuencia de pulsos eléctricos cuya razón esta relacionada al conteo de células X como:
donde t es la razón del pulso de llegada (pulsos / S ) , Ki es la razón de flujo (m/s), y K es
el volumen del elemento de sensado (m3).
El conteo de células puede ser determinado de dos formas: directamente a través
de la ecuación anterior contando en un periodo conocido de tiempo o alternativamente
acumulando el número total de células contadas mientras un volumen conocido de fluido es pasado a través de un detector. En otro caso, los problemas técnicos son asegurar que la razón de fluido es conocida y constante durante el periodo de conteo, que no exista recirculación que cause múltiples conteos de una sola célula, y que cada célula sea detectada.
La razón de flujo es generalmente controlada por el desplazamiento de un pistón bien ajustado o una columna móvil de mercurio, moviéndose en un cilindro de dimensiones conocidas. Por ello, la geometría del flujo es dependiente del sistema de
detección. La Figura 1.10 muestra dos geometrías típicas de flujo comúnmente
a
Muestra de
de flnido
Aperhu'a que
estación detectora
contiene la I
Figura l . 1 O
Método de transporte de células [2b]. (a)Las células en una suspensión diluida son llevadas por un flujo laminar a través de la estación de detección. (b) Las células en una suspensión diluida son inyectadas en un sistema de flujo laminar y son llevadas, sin mezclarlas, por un fluido a través del centro de la estación de detección.
1.5 Procesamiento de señales postdetección
Para contadores automáticos de células, el resultado observado desde la estación
de medición es un tren de señales eléctricas (pulsos) no temporizado, lo cual representa
el paso de las células sanguíneas. Este tren de señales debe de ser procesado para crear
el resultado final. El procesamiento típico incluye (1) discriminación, (2) corrección de
coincidencia y (3) resultados en un formato especifico [la, 2a, 3a, 4a].
1.5.1Técnicas de discriminación.
Los instrumentos de conteo de células cuentan con la habilidad de discriminar
entre señales de un tipo particular de células, de las ocasionadas por ruido o en otros
casos señales de otras clases de células, al asumir, por ejemplo, que las señales de
interés son distinguibles por su amplitud.
Las diferentes técnicas, de uso común, de discriminación por la amplitud de las
señales de las células, son: (1) umbralización a priori, (2) umbralización a posteriori y
1.5.1.1 Urnbralización a priori
En esta técnica un comparador de voltaje (umbral) esta puesto por encima del nivel de ruido en el circuito eléctrico de posdetección y el conteo de células se deriva del número de veces que la señal cruza el umbral de voltaje durante el periodo de conteo.
1.5.1.2 Umbralización a posteriori
En este método un circuito similar es utilizado y puesto a un umbral bajo, lo cual incluye algo de ruido de los pulsos. La amplitud de cada pulso ocurrido durante el periodo de conteo es digitalizado y el resultado es almacenado en forma de un histograma de células versus la señal. Esto es analizado después del periodo de conteo. Los umbrales de discriminación son puestos después en los "valles" para aislar regiones
del histograma. (Figura l . 1 1)
B
& P
Canal
m Umbral
Figura l . 1 1
Técnicas de discriminación de células a posteriori [2b]. (a) Las células contadas están acumuladas en canales digitales proporcionales a la amplitud de la señal y forman un histograma resultante. (b) Alternativamente, una curva suavizada es ajustada a través del histograma y extrapolada. (c) Umbrales a posteriori son aplicados truncando los datos e integrando las células contadas restantes. (d) El conteo de células es obtenido después, por integración de la curva ajustada.
1.5.1.3 Ajuste de curvas
Estado del urte
1 5 1 . 4 Corrección de coincidencia
El volumen de la estación de detección introduce no linealidad en la relación entre el
conteo de pulsos y el conteo de células indicado por el factor exponencial
(Kx)
en laecuación (1.2). Aunque los detectores contadores de células tienen relativamente
volúmenes pequeños de sensado, es generalmente necesario aplicar una corrección por
la posibilidad de que más de una célula esté en la estación de detección al mismo
tiempo. Esto se llama corrección de coincidencia. Como un ejemplo, la figura l . 12
muestra la geometría típica para un contador de células utilizando detección óptica. La detección de volumen puede ser expresada en términos de la duración del pulso. De esta forma, la probabilidad de coincidencia está también dada por la razón de tiempo del ancho de pulso de las células o el "tiempo muerto" del detector. Este hecho puede ser utilizado para corregir el conteo:
r
Razón de conteo corregida= ~ Ec. 1.5
1- DT
donde es la razón observada y DT es el tiempo muerto.
Se incrementa mas el problema de la corrección en la coincidencia cuando mas
de un tipo de célula esta siendo enumerada por el mismo detector, como cuando las
células rojas y las plaquetas son contadas en la misma dilución. Cuando células de diferentes tipos están en coincidencia, usualmente un tipo es favorecido por el proceso
de clasificación y por lo tanto la corrección de coincidencia debe ser diferente para cada
uno. Las correcciones propias están determinadas para cada tipo de célula específico. Esto involucra calcular las probabilidades condicionales de coincidencia.
Figura l. 12
Geometría típica del flujo de células a través de un sistema de conteo óptico utilizando flujo de vaina
1.6 Resultados del conteo de células en un formato específico
Los resultados de las mediciones realizadas con los instrumentos de conteo de
células, pueden ser reportados en una o en mas de tres formas: conteos numéricos,
histogramas, y citogramas [ 1 a, 1 Oa].
1.6.1 Resultados numéricos
Los resultados son presentados generalmente como un simple número que representa la cantidad de células por unidad de volumen de la muestra original de sangre. En ocasiones tales, como en el conteo de los diferentes tipos de leucocitos, la concentración puede ser también representada por un porcentaje total de leucocitos.
1.6.2 Histogramas
Los resultados de conteo o de las dimensiones de las células son mostrados
gráficamente, como se ilustró en la figura 1.1 l .
1.6.3 Citogramas
En algunos sistemas de conteo de células, el paso de cada célula puede ser notado por dos vectores. Por ejemplo, en el conteo de células por el método óptico un detector puede ser utilizado para medir la luz pulsada y otro detector para medir la luz absorbida por cada célula. Las dos señales de amplitud, pueden ser trazadas en forma
gráfica representando cada célula como un punto en un citograma. La figura l . 13
muestra el citrograma producido después de medir el pulso y la absorción por las células blancas después de haber sido tratadas con una clase especial de enzimas.
LINF
L
u m
W
.-
2
NEUT
EOS
Figura l . I 3
Estado del arte
1.7 Calibración
y
Control de calidad
No hay preparaciones estables apropiadas para estándares primarios de conteos y mediciones de células. Consecuentemente, la calibración de cada instrumento de conteo y medición de células es realizada utilizando métodos de transferencia con materiales quasi-estables. Dos métodos comúnmente utilizados son: métodos con sangre fresca y
métodos con sangre estabilizada [ 1 b].
1.7.1 Calibración con sangre fresca
La estabilidad de sangre fresca para conteos y medición de células se limitan a pocas horas. Por ello, dicha técnica es apropiada únicamente para calibración cruzada o remover el sesgo entre instrumentos en el mismo laboratorio. Típicamente, el métofdo mas estable en el laboratorio es escogido como método de referencia y es utilizado para establecer los "valores de referencia'' para varias sangres frescas. El instrumento a ser calibrado es luego ajustado para recuperar los valores de referencia para las mismas muestras de sangre.
1.7.2 Calibradores de sangre estabilizada
En este método se utiliza un producto comercial, el cual esta constituido por células sanguíneas, las cuales han sido estabilizadas por medio de tratamiento químico.
Las células tratadas serán estables de 4 a 8 semanas, y existen valores asignados de
referencia para ser utilizados en la calibración del instrumento de conteo y medición de
células.
1.7.3 Técnicas de control de calidad
Las técnicas de control de calidad son utilizadas para verificar la constancia y
validez de la calibración. Para este propósito son utilizadas células de la sangre
generalmente estabilizadas. La constancia de calibración (falta de deriva) es verificada por muestre0 repetido de estos materiales. La validez (exactitud) de la calibración es asegurada por la participación de un programa de control de calidad de un
interlaboratorio donde las muestras de sangre estabilizada son enviadas como
desconocidos a un número de laboratorios participantes. Los resultados son analizados
centralmente y los análisis son compartidos entre los laboratorios participantes.
1.8 TIPOS DE EQUIPO DE CONTEO CELULAR
Estos instrumentos son utilizados rutinariamente para realizar conteos de células y obtener indices del tamaño de las células sanguíneas. Pueden ser divididos en tres categorías principales: (1) recursos manuales (cámaras hematocitómetros), (2) instrumentos de conteo semiautomático, y (3) instrumentos automáticos multiparámetro [2b, 2a].
1.8.1 Cámaras Hematocitómetro
La unidad más típica consiste (figura l . 14) de una delgada superficie de vidrio, modelada en forma de H, a través de la cual se forman dos áreas de conteo. Cuenta con dos soportes elevados para mantener un cubre objetos a una distancia constante de estas áreas. Cuando un cubreobjetos ópticamente plano es puesto sobre los soportes elevados,
se forma una cámara, la cual tiene una profundidad de O. lmm. Una pequeña concavidad
del fondo de la superficie, directamente sobre el rayado, introduce pequeños rayones,
los cuales restan eficiencia, y no serán vistos bajo el microscopio.
Figura l . 14
Cámara de Neubauer o hematocitómetro [ 1 i]
La cámara contiene un rayado cuadrado de 3mm con una geometría conocida
como tipo Neubauer mejorado (figura l . 15). La figura l . 16 ilustra el método utilizado
para contar las células sanguíneas.
Estado del arte
Figura l . 15
Area rayada del hematocitómetro Neubauer mejorado. R, áreas para el conteo de células rojas; W, áreas para el conteo de células blancas [2b].
Tabla No 2
Métodos de hematocitómetro [ 1 lb].
Células rojas
2 x 1 Thoma
200
Plaquetas
4x1
5 X 0.04 S ahli
200
Células blancas 20 Thoma
Figura l . 16
Método para contar células con un hematocitómetro. Las células que tocan las partes superior y derecha deberán ser contadas; las células que tocan las partes inferior e izquierda no se deberán de contar.[2b]
1.8.2 Contadores de células sanguíneas con redes neuronales
En la década de los 60, Prewitt y Mendelson descubrieron la importancia del
espectro de color de la luz transmitida a través de las partes constituyentes (núcleo,
citoplasma, etc.) de las células biológicas, determinando la identidad de la célula
iluminada. Este fenómeno fue posteriormente estudiado por Young, utilizando células
humanas de la serie blanca de la sangre teñidas con soluciones de Wright-Giemsa,
también investigadas por Tycko utilizando solución de tricromato de Orstein. Miller estudia mas este fenómeno examinando la distribución de probabilidad p(r,g,b,rl ,r2,r3) espacial multiespectral, donde r, g y b son los constituyentes espectrales rojo, verde y
azul y las cantidades rl , r2 y r3 indican los radiovectores de tricromato ocupados por las
células, donde el origen es tomado en el centroíde de la célula. Como se puede observar, la función de probabilidad tiene seis dimensiones, tres parámetros espectrales y tres parámetros espaciales. El sistema HEMATRAK de SmithKline se basa en el cálculo
simultaneo de 96 de estas medidas de probabilidad con' el propósito de analizar e
identificar imágenes de células blancas y en el caso de las células rojas se realizan 116 mediciones.
Las 96 mediciones mencionadas para la identificación de las células blancas y las 1 16 para el caso de las células rojas, no son mas que los datos de entrada a una red neuronal que es en realidad la que se encarga de realizar el reconocimiento de cada una de estas células.
Para poder obtener cada uno de estos parámetros y medirlo con precisión es necesario un preprocesamiento de cada una de las imágenes, este preprocesamiento se puede resumir en pocos pasos estos son:
l . Segmentacion, en núcleos celulares sanguíneos (células blancas), citoplasma
3. Identificación de cada uno de los segmentos.
Durante la década de los 60 se desarrollaron una amplia gama de estos
instrumentos, algunos de ellos son: el medidor Perkin-Elmer de Coulter electronics, el dispositivo corning electronics de Larc Company, el SmithKline de Hematrac, y el
ADC-500 de ABBOTT instruments.(Ver figura l. 17)
Figura l . 17
La figura muestra los diferentes tipos de aparatos que hncionan bajo los principios discutidos anteriormente, en (a) el aparato de Perkin-Elmer de Coulter electronics, (b) el Corning de LARC, (c) el
1.8.3 Citómetro de flujo
Sin duda alguna las tecnologías más nuevas con las cuales se trabaja actualmente para el conteo de células sanguíneas son aquellas basadas en los citómetros de flujo, pero incluyendo la fluorescencia, y la tecnología láser.
Estos dispositivos consisten de una unidad principal, una unidad de láser de poder, y una unidad neumática.
Existen instrumentos comerciales basados en esta tecnología, algunos de ellos son: Sysmex R-1000, Bayer H*3 Hematology analyzer, y Cell-Dyn 1400. (Ver figura
1.18).
Figura l. 18
Contador automático Cell-Dyn 1400 [2a].
1.8.4 Funcionamiento.
Miden el ángulo de dispersión, como también, la intensidad de fluorescencia para cada partícula analizada. La muestra completa de sangre es automáticamente teñida
con un agente fluorescente, Auramine O, el cual se une al ARN. Este fluorocromo tiene
un pico de absorción a los 432 nm y un pico de emisión a los 533 n m .
Cada célula es irradiada por el láser de argón a una longitud de onda de 488 nm.
La intensidad de la dispersión (ver esquema del citograma en la figura I . 19), da
Estado del arte
Figura l . 19
Esquema de un citograma, se presentan diversos tipos de poblaciones celulares: RCR = Radio de Células
rojas, RET = Reticulocitos, PLA = Plaquetas. Los reticulocitos se dividen a través de sus radios relativos de fluorescencia; RBF: Radio de fluorescencia bajo, RMF: Radio de fluorcscencia medio, RAF: Radio de fluorescencia alto [2b].
1.9
El
procesamiento digital de imágenes
Todos los métodos descritos anteriormente para el conteo de células sanguíneas, se pueden considerar como buenos o bastantes aceptables, ] u s mientras los métodos
manuales pueden incluir un gran error debido a la aprecinción de quien ejecute el
conteo, los métodos automáticos pueden tener un error intrínseco, debido a su limitada
capacidad de distinguir si lo que están contando es una célula o quizá una partícula de
polvo, que se encuentra en la solución diluyente. Los resultados se pueden ver afectados severamente y por lo tanto caer en un conteo falso.
Una forma de asegurar que todo lo que se tiene en una muestra, y requiere ser contado son células, partículas o simplemente cualquier objeto de interés, es a través de una imagen. En este sentido, el campo del procesamiento digital de imágenes puede ser de gran ayuda, debido al conjunto de herramientas existentes para llevar a la imagen hasta un punto en donde se pueda observar únicamente aquello de nuestro interés.
Cuando se requiere realizar un conteo, de las células sanguíneas, se recomienda
diluir la sangre en factores de 1 :200, para las células rojas, y 1 :20 para las células
blancas. Estas diluciones se deben realizar debido al gran número de células presentes en una muestra. Aun diluida la sangre, tomando en cuenta los factores antes mencionados, se presenta el fenómeno llamado oclusión, la oclusión significa el traslapamiento de dos o mas células, en diversos niveles, esto es, puede existir desde un
1% de oclusión hasta un 100% de oclusión. (sobre todo con los eritrocitos). Este
fenómeno puede ser eliminado hasta en un 100% diluyendo la sangre en factores cada
vez mas altos, pero se debe recordar que entre menor número de células sean contadas
en una misma área determinada, existirá una mayor incertidumbre en el resultado final
del conteo.
Existen una cantidad innumerable de algoritmos con los cuales se puede obtener
información acerca del contenido de una imagen y a través de ellos poder eliminar
algunos problemas como la oclusión. Por ejemplo el filtrado de una imagen, para quitar componentes de ruido en ella, o la segmentación, que es el procedimiento por medio del
cual podemos separar los componentes contenidos en una imagen, y observar aquellos
que sean de nuestro interés particular. Dentro del proceso de segmentación se pueden incluir varios procedimientos como la erosión. Esta consiste en eliminar pixeles de una imagen a través de un elemento estmcturante (la discusión acerca del elemento
estmcturante se deja para el capítulo I11 en donde se hablará ampliamente del tema), que
puede tener una forma específica como un rectángulo, un circulo, etc. esto dependerá de que forma geométrica tenga lo que se desea eliminar en la imagen. Otra parte de la segmentación es el proceso de dilatación que es la contraparte del proceso de erosión.
También el procesamiento digital de imágenes considera la clasificación de
objetos, a través del reconocimiento de patrones, o la identificación y clasificación de
algún objeto en particular por medio de sus características particulares, como son el color, la textura, tamaño, morfología, etc.
Existen algoritmos, con los cuales se pretende separar objetos que se encuentren
traslapados u ocluidos en una imagen, uno de ellos es el algoritmo de watersheds [ 1 Ob],
el cual primero segmenta a la imagen, y luego calcula la distancia media entre dos
objetos, y posteriormente calcula un limite arbitrario entre ellos, y de esta forma los separa como objetos distintos.
Figura 1.20
Segmentación y separación de objetos a través del algoritmo de watersheds [4b]
Lamentablemente este algoritmo tiene algunas fallas en el cálculo de la distancia media entre los objetos, estas fallas se ven reflejadas en el resultado final cuando en lugar de dos objetos se forman tres, en otros casos dos o mas objetos se fusionan en la
imagen y forman uno solo, como se muestra en la figura 1.2 l .
Por lo anterior es necesario diseñar una técnica que sea mas efectiva y logre la
Estado del urtc
Figura 1.2 1
(a) Muestra una imagen de prueba, antes de la aplicación del algoritmo de watersheds, en donde los círculos se encuentran ocluyéndose unos con otros, (b) Muestra el resultado del algoritmo en donde con números 1 y 3 muestran que el algoritmo no fue capaz de separar dos objetos, 2 muestra la doble separación entre dos objetos, y por lo tanto la creación de un tercero.
Estado del urte
OBJETIVOS
?
Con base en lo comentado en el capítulo I, se formulan los siguientes objetivos:
OBJETIVO GENERAL
Diseñar y construir un contador de células sanguíneas empleando técnicas de
procesamiento digital de imágenes.
OBJETIVOS PARTICULARES
Diseñar una metodología de conteo celular empleando la cámara de Neubauer y
el procesamiento digital de imágenes.
Desarrollar técnicas experimentales para disminuir la oclusión entre las células
sanguíneas y lograr conteos con gran exactitud.
Diseñar un visor que permita observar las características morfológicas de las
MATERIAL Y METODOS
2.1 MATERIAL
Para la realización de los experimentos desarrollados en este trabajo se empleo el
siguiente equipo, que se observa en la figura 2.1 :
Figura 2.1
Equipo empleado, integrado por un microscopio MX - T, computadora Hewlett Packard, pipetas de
Thoma, pipetas automáticas, cámara de video DIC-U de World Precision Instruments, cámara de Neubauer, soluciones para eritrocitos y leucocitos, etc.[ 1Ofl
Un microscopio óptico triocular (véase también figura 2.2), marca Microlux,
modelo MX-T, trabajando con un objetivo de 40X y oculares de 16X, es decir que la
imagen observada por una persona se aumenta 640 veces. En cuanto al ocular que trabaja con la cámara de video, este solo cuenta con una amplificación 1X. El microscopio tiene una fuente de poder variable propia, la cual alimenta a la fuente de
CAPITULO 11
Figura 2.2
Microscopio y Fuente de poder Microlux MX-T. ldicroscopio óptico con tres objetivos de 10 X, 40 X y lOOX con oculares de 16 X [4fl.
Microjeringas marca Unimetrics I.;niversal Corporation, con una capacidad de
25
p1,
(como se ilustra en la figura 2.3) para medir el volumen de sangre necesario parala valoración citométrica.
Figura 2.3
Microjeriga Unimetrics con capacidad de 25 pl [5fl.
Pipetas automáticas mostradas en la figura 2.4, marca GILSON, modelo
pipetman, con capacidad de 100 microlitros y 200 microlitros, respectivamente, para
Cámara de Neubauer doble, como se ilustra en la figura 2.5, marca BOECO,
modelo Brigth line, con las siguientes características:
1
-
Doble zona de conteo.2- Profundidad de O. lmm.
Figura 2.5
Cámara de Neubauer y cubre objetos, BOECO con profundidad de O. 1 mm[7fl.
Balanza automática marca SARTORIUS, modelo BASIC para pesar los diferentes compuestos que forman las soluciones, tanto para glóbulos rojos como para glóbulos blancos.
Para poder formar cada una de las soluciones de disolución, se necesitaron
diferentes compuestos, estos son:
1- Cloruro de sodio. 2- Acido acético
3- Violeta de genciana en polvo
4- Agua destilada

![Tabla No 2 Métodos de hematocitómetro [ 1 lb]. Células rojas 2 x 1 Thoma 200 Plaquetas 4x1 5 X 0.04 S ahli 200](https://thumb-us.123doks.com/thumbv2/123dok_es/5570889.124116/37.913.167.833.820.939/tabla-métodos-hematocitómetro-células-rojas-thoma-plaquetas-ahli.webp)