DISEÑO Y ELABORACIÓN DE UNA GUÍA PRELIMINAR
PARA LA VALIDACIÓN DE MÉTODOS MICROBIOLÓGICOS ESTÁNDAR
MARÍA ANDREA ORDOÑEZ PARRA DIANA MARCELA ROJAS SALAZAR
Trabajo de grado presentado como requisito parcial para optar al título de
MICROBIÓLOGAS INDUSTRIALES
PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS
NOTA DE ADVERTENCIA
Artículo 23 de la resolución No. 13 de julio de 1946
“La Universidad no se hace responsable por los conceptos emitidos por sus alumnos en sus trabajos de tesis. Solo velará porque no se publique nada contrario al dogma y la moral católica y porque la tesis no contenga ataques
DISEÑO Y ELABORACIÓN DE UNA GUÍA PARA LA VALIDACIÓN DE MÉTODOS MICROBIOLÓGICOS ESTANDAR
MARÍA ANDREA ORDOÑEZ PARRA DIANA MARCELA ROJAS SALAZAR
APROBADO
_____________________ _____________________ Dra. LORENA VALENCIA Dr. SAUL PEÑARANDA
Directora Codirector
_____________________ _____________________
NADENKA MELO ANDRES OTALORA
DISEÑO Y ELABORACIÓN DE UNA GUÍA PARA LA VALIDACIÓN DE MÉTODOS MICROBIOLÓGICOS ESTANDAR
MARÍA ANDREA ORDOÑEZ PARRA DIANA MARCELA ROJAS SALAZAR
APROBADO
_________________________ _____________________________ Dra ANGELA UMAÑA MUÑOZ, Dra. JANETH ARIAS PALACIOS
M. Phil Bacterióloga M.Sc-M Ed.
! "
# $% &
'
!
! (
)
'
&
!
'
!
'
AGRADECIMIENTOS
A la Dra. Lorena Valencia por todo su apoyo y dedicación y por compartir todos sus conocimientos para sacar este trabajo adelante.
Al Dr. Saúl Peñaranda por la paciencia y todo su aporte durante el desarrollo del trabajo.
TABLA DE CONTENIDO
INTRODUCCIÓN
1. MARCO TEORICO 9
1.1 ANTECEDENTES 9
1.2 TIPOS DE VALIDACIÓN SEGÚN SU OBJETIVO 14
1.2.1 Validación Primaria 14
1.2.2 Validación Secundaria 15 1.3 PARAMETROS ANALÍTICOS PARA LA VALIDACIÓN DE UNA TÉCNICA O MÉTODO 16 1.3.1 Selectividad 16 1.3.2 Especificidad 16
1.3.3 Calibrado y Linealidad 17 1.3.4 Precisión 17 1.3.5 Solidez y Robustez 18 1.3.6 Exactitud 19
1.3.7 Estabilidad 19
1.3.8 Limite de Detección 19
1.3.9 Límite de Cuantificación 20
1.3.10 Sensibilidad 20
1.4 MÉTODOS DE ENSAYO MICROBIOLÓGICOS 20
1.4.1 Métodos de Ensayo Microbiológicos Cualitativos 23
1.7 REPRESENTATIVIDAD Y CANTIDAD SUFICIENTE DE
MUESTRAS 27
1.7.1 Recuperación del Analito 28
1.7.2 Material de Ensayo 29
1.7.3 Detectores 30
1.8 SISTEMAS DE GESTIÓN DE CALIDAD EN LABORATORIOS
DE ANÁLISIS MICROBIOLÓGICO 32
1.8.1 Aseguramiento de la Calidad de los Resultados/ Control de
Calidad 33
1.8.2 Acreditación 36
2. FORMULACIÓN Y JUSTIFICACIÓN DEL PROBLEMA 38
2.1 FORMULACIÓN DEL PROBLEMA 38
2.2 JUSTIFICACIÓN 39
3. OBJETIVOS 41
3.1 OBJETIVO GENERAL 41
3.2 OBJETIVOS ESPECÍFICOS 41
4. MATERIALES Y MÉTODOS 42
4.1 TIPO DE INVESTIGACIÓN 42
4.2 POBLACIÓN ESTUDIO DE MUESTRA 42
4.3 RECOPILACIÓN Y REVISIÓN BIBLIOGRÁFICA 42
4.4 DOCUMENTACIÓN DE PARÁMETROS DE VALIDACIÓN PARA
MÉTODOS Y ENSAYOS EN MICROBIOLOGÍA ESTÁNDAR 43
4.5 DESPLIEGUE MODELO MATEMÁTICO PRELIMINAR PARA
VALIDACIÓN DE PRUEBAS MICROBIOLÓGICAS ESTÁNDAR 43
5. RESULTADOS Y DISCUSIÓN 45
5.1 REVISIÓN BIBLIOGRAFICA 45
5.2 MODELO MATEMÁTICO PRELIMINAR BÁSICO PARA LA
VALIDACIÓN DE MÉTODO MICROBIOLÓGICOS ESTÁNDAR 51
8. REFERENCIAS 57
ANEXOS
ANEXO 1. GUIA PARA LA VALIDACIÓN DE MÉTODOS
LISTA DE FIGURAS
FIGURA TITULO PAG
1 Estadísticas de la Red de Laboratorios 48 2 Esquema de Validación de Métodos Microbiológicos 65 3 Procesamiento de la Muestra 77
LISTA DE TABLAS
TABLA TITULO PAG
1 Bibliografía para procesos de validación en microbiología
Estándar 45
2 Acreditaciones 2008-2012 47 3 Grupos de alimento analizados en el Laboratorio de
Salud Pública, grupo de Vigilancia del Ambiente y del
RESUMEN
El propósito de este trabajo es brindar una guía práctica sobre la validación de ensayos microbiológicos estándar, ya que éstos deben brindar certeza en los resultados obtenidos, por lo que se hace necesaria la implementación de métodos que al ser verificados y ajustados a ciertas condiciones generan confiabilidad y competitividad.
Para llevar a cabo esta guía, se realizó una extensa revisión y recopilación bibliográfica para obtener la mayor información posible sobre cómo validar técnicas microbiológicas y poder abstraer un modelo preliminar de validación de los ensayos estándar que se realizan en microbiología. A partir de la búsqueda, se inicio una comparación de toda la información obtenida para diseñar el protocolo. Después de la obtención del esquema práctico que incluye desde la toma de la muestra (muestreo) hasta el procesamiento de la misma, se procedió a la consulta y diseño de un modelo estadístico preliminar para determinar parámetros y variables a tener en cuenta para llevar a cabo una validación.
Como resultado se obtuvo una guía en donde de forma clara, práctica y concisa se orienta a la aplicación de conceptos básicos de la microbiología estándar y herramientas estadísticas para determinar variables preliminares para la validación de un ensayo estándar en microbiología.
INTRODUCCION
En el mundo actual donde el interés de los laboratorios de las diferentes áreas de la microbiología es mantener controladas todas las variables que intervienen en sus procesos, tienen particular importancia los procesos de validación como una herramienta útil para asegurar la trazabilidad de cada una de las variables que se ve reflejada en los resultados de las pruebas realizadas. Adicionalmente, por requerimientos de sus sistemas de calidad y para lograr el cumplimiento de los requisitos derivados de las buenas prácticas de laboratorio; la validación actúa como sistema de aseguramiento de la calidad mediante el cual se establecen evidencias documentadas para demostrar que un proceso conduce a resultados de calidad consistentes dentro de las especificaciones predeterminadas.
Sin embargo, la gran cantidad de documentación y las pocas referencias de investigación sobre la validación de técnicas microbiológicas, hacen difícil la aplicación y arduo el entendimiento de este tema en los diferentes procedimientos de pruebas y ensayos.
En Colombia, programas como el INTERLABORATORIO y PICCAP, permiten a través de diferentes análisis la estandarización de los procedimientos microbiológicos que se realizan en los diferentes laboratorios participantes, más no se ejercen mecanismos de vigilancia y control sobre los procedimientos de validación, a pesar que muchos laboratorios se encuentran en capacidad de validar sus métodos para así poder acreditarse. No obstante, el crecimiento en el sector industrial en Colombia, hace que la demanda en cuanto a procedimientos con calidad aumente, y así mismo deben aumentar los laboratorios acreditados que ofrezcan a partir de la validación de sus métodos mejores resultados al cliente.
microbiológicas, lo cual se traduce en la exactitud de los resultados emitidos y la fiabilidad de sus pruebas.
Los laboratorios de análisis tienen como principal objetivo reportar resultados altamente confiables, por eso deben controlar y asegurar la calidad de sus resultados. El mejoramiento de la calidad en el laboratorio consiste en implementar un programa completo que vale el resultado final emitido por el laboratorio proporcionando resultados útiles. Este mejoramiento, no solo incluye los conceptos más tradicionales de control de calidad, como el mejoramiento y la evaluación externa de la calidad que tiene como propósito mantener en cualquier proceso un rendimiento a niveles aceptables según los estándares, sino que también incluye el mejoramiento continúo de la calidad bajo el concepto de “calidad total”.
1. MARCO TEÓRICO
1.1 ANTECEDENTES
Se requieren métodos analíticos fiables para cumplir con las normativas nacionales e internacionales en todas las áreas de análisis. Por lo tanto, está admitido internacionalmente que un laboratorio deba tomar las medidas pertinentes para asegurarse de que es capaz de producir, y de que lo hace efectivamente, datos con el nivel necesario de calidad. Dichas medidas comprenden:
• Utilización de métodos de análisis validados
• Utilización de procedimientos internos de control de calidad • Participación en ensayos de aptitud; y
• Obtención de la acreditación según una norma internacional, habitualmente ISO/IEC 17025.
Cabe resaltar que la acreditación ISO/IEC 17025 concierne específicamente el establecimiento de la trazabilidad de las mediciones, al tiempo que fija un conjunto de otros requisitos técnicos y de gestión que incluyen todos los indicados anteriormente. Así, la validación de métodos es un componente esencial de las medidas que un laboratorio debe implementar para producir datos analíticos fiables.
En los sistemas de calidad y en general en los sistemas de aseguramiento, lo que se busca es que los laboratorios cumplan con los requerimientos mínimos necesarios para asegurar que sus resultados ofrezcan confiabilidad y que las técnicas y/o ensayos utilizados sean realizados de manera correcta, hecho que minimiza totalmente las posibilidades de error. Como consecuencia se obtienen procesos controlados que conllevan a resultados con calidad. Esto indica que la organización, en este caso puntual, los laboratorios de microbiología trabajan con enfoques científicos reconocidos, de consenso general y que cualquier desviación en estos puede ser sustentada con fundamentos (validación) considerados aceptables por los expertos en el área. Para llegar a obtener esos resultados confiables, debemos hablar de validación de pruebas y/o ensayos que permitan que esos resultados sean reales y fiables. (http://www.ideam.gov.co/temas/calidad/Descripci%C3%B3n%20Gral.%20Norma% 20ISO-IEC%2017025.pdf)
Además es importante que un laboratorio demuestre la capacidad para reproducir los ensayos y/o pruebas que hace; ya que ésta indica que si en un ensayo se obtuvieron resultados objetivos, en los ensayos posteriores se obtendrán los mismos resultados con desviaciones aceptadas y con las limitaciones que supone el uso de los mismos procedimientos, equipos y personas involucradas en la ejecución del ensayo. Y Finalmente, se debe demostrar según la ISO NTC 17025 la transparencia de sus procesos; indicando que los resultados de los mismos están abiertos a la inspección interna y externa a fin de mitigar e identificar fácilmente los factores que podrían afectar de manera adversa la búsqueda de resultados objetivos basados en métodos científicos. Con lo que se concluye que los procesos validados, son la fuente de confianza para el que hace los análisis microbiológicos y para quien los solicita. (http://www.ideam.gov.co/temas/calidad/Descripci%C3%B3n%20Gral.%20Norma% 20ISO-IEC%2017025.pdf)
servicios que poseerán las características de calidad predefinidas (WHO Technical Report Series, No. 823, 1992).
Validar se refiere al conjunto de acciones que demuestran formalmente que un sistema realiza lo que se supone debe hacer, de forma continuada y ajustada al objetivo de análisis. Al validar un método se demuestra formalmente que el mismo posee un determinado nivel de parámetros analíticos básicos: exactitud, precisión, sensibilidad, intervalo lineal, selectividad y robustez (Useche, B).
En la validación del método en un solo laboratorio es de suma importancia tener en cuenta el sesgo del método y el sesgo del laboratorio. Existen unos pocos laboratorios cuyas instalaciones permiten despreciar estos sesgos, pero se trata de casos excepcionales (sin embargo, si un solo laboratorio realiza un análisis particular, el sesgo del método y el sesgo del laboratorio adquieren una perspectiva distinta). Normalmente, los efectos del método y del laboratorio deben considerarse factores de incertidumbre, pero a menudo son más difíciles de estudiar que el error de repetibilidad y el efecto de ejecución. En general, para valorar las incertidumbres que producen es necesario utilizar información recabada independientemente del laboratorio. Las fuentes generalmente más útiles de dicha información son: (i) estadísticas derivadas de ensayos colectivos (no disponibles en muchas situaciones de validación de un método en un solo laboratorio), (ii) estadísticas derivadas de ensayos de aptitud y (iii) resultados de análisis de materiales de referencia certificados. (RESOLUCIÓN OENO 8/2005).
Dentro de un proceso de validación se deben validar:
· Método analítico: En el cual se evalúan y analizan parámetros como sensibilidad, exactitud, linealidad, selectividad, etc.
· Sistema analítico: Incluye instrumentos, ordenador y método, con este se concluye que el conjunto funciona como se espera.
· Análisis de la muestra: Donde se evidencia por medio de la documentación la comprobación de los datos primarios (USP XXVI, 2003).
Por otro lado, se deben tener en cuenta algunos requisitos relacionados con el proceso de trazabilidad, tales como la confirmación de qué tan adecuada es la especificación del método. La validación del método debe suministrar una prueba razonable de la condición y la ecuación de medición. En un caso ideal dentro de un laboratorio individual incluiría las siguientes actividades: (Baracaldo, R)
a. Evaluación de la selectividad y especificidad para asegurar que el método responde a los analitos particulares de interés y no a otros similares.
b. Verificación con material de referencia certificado que demuestre que el método no tiene errores sistemáticos significativos.
c. Verificaciones razonables de otros efectos probables específicos no incluidos en la especificación del método.
e. Estudios adicionales sobre fuentes posibles de errores sistemáticos, incluyendo spiking y recuperación
f. Estudios sobre interferencias probables y reactividad cruzada que demuestren nuevamente que no hay efectos adicionales de importancia. (Baracaldo, R. )
Las comparaciones entre analistas y diferentes laboratorios o mediante otros métodos pueden también demostrar posibles deficiencias en el método. Si se manejan como pruebas para efectos adicionales, estás servirán de evidencia adicional de la capacidad de la especificación del método.
Las referencias usadas en la validación del método para controlarlo, calibrarlo y probarlo son por sí mismas trazables. Esto es importante para asegurar que los estudios de validación son relevantes en forma directa para los resultados obtenidos en análisis rutinarios. (Baracaldo, R)
La validación juega un papel clave para establecer la trazabilidad y no es una actividad opcional. Incluso cuando se emplee un método estándar que ya haya sido validado y probado totalmente sigue siendo necesario un nivel de validación. No es necesario repetir el estudio completo de todos los efectos posibles o probables: la especificación del método puede ser tomada completamente sin verificación adicional. Pero los métodos analíticos son complejos y susceptibles de error.
1.2 TIPOS DE VALIDACIÓN SEGÚN SU OBJETIVO
1.2.1 Validación primaria Esta se basa en un proceso exploratorio cuyo objetivo es el establecimiento de los límites operativos y las características de funcionamiento de un método nuevo que ha sido modificado o insuficientemente caracterizado. Este tipo de validación se efectúa generalmente por medio de planes de ensayo especialmente diseñados para este fin. (WHO Technical Report Series, No. 823, 1992).
Es conveniente que un laboratorio que esté desarrollando su propio método o una variante de una norma existente siga las etapas de validación primaria. Es obligatorio que los técnicos implicados en la validación primaria tengan una experiencia considerable en otros métodos microbiológicos. (WHO Technical Report Series, No. 823, 1992).
Según la ISO/TR 13843:2000 para la identificación del objetivo en la validación primaria, los estudios sobre cultivos puros durante el desarrollo inicial del método proporcionan la descripción básica de las colonias objetivo o del tubos P/A. Obviamente es preciso ensayar más de una cepa de cultivo puro del microorganismo objetivo.
Es conveniente que la validación primaria aporte las siguientes especificaciones, en cuánto a microbiología: (ISO/TR 13843:2000).
1. Identificación morfológica del microorganismo objetivo (presuntivo)
2. Instrucciones relativas a las condiciones de incubación (temperatura, tiempo, atmósfera gaseosa, humedad) y las características del medio (pH, estabilidad) 3. Una instrucción relativa a los límites de trabajo en términos de número de
4. Si es posible, expresiones de la incertidumbre dentro de los límites fiables especificados
5. Rango de aplicación y limitaciones.
1.2.2 Validación Secundaria Llamada también verificación, tiene lugar cuando un laboratorio pone en marcha un método desarrollado por otros. La validación secundaria tiene como objetivo principal recopilar los datos que permitan demostrar que el laboratorio es capaz de cumplir las especificaciones establecidas en la validación primaria. Actualmente, dichas especificaciones no están disponibles para la mayoría de los métodos. Puede ser necesario utilizar los resultados de aseguramiento de calidad externa como primera etapa para una validación secundaria completa. (WHO Technical Report Series, No. 823, 1992).
Por regla general, la validación secundaria utiliza los mismos modos operativos que la validación primaria pero bajo formas seleccionadas y simplificadas, aunque posiblemente extendidas a lo largo de un periodo de tiempo mayor. Las muestras naturales son los materiales de ensayo óptimos y el trabajo necesario se refiere exclusivamente a que el modo operativo se inscriba dentro de los límites operacionales definidos en la validación primaria. (WHO Technical Report Series, No. 823, 1992).
deben seguirse si se quiere que los resultados analíticos se acepten, esta es la evidencia objetiva de la validación. (WHO Technical Report Series, No. 823, 1992).
1.3 PARÁMETROS ANALÍTICOS PARA LA VALIDACIÓN DE UNA TÉCNICA O MÉTODO
1.3.1 Selectividad Un método selectivo aporta resultados exactos para todos los analitos de interés, mientras que uno específico produce resultados exactos para un analito, al tiempo que los otros analitos de interés pueden interferir los unos con los otros. (WHO Technical Report Series, No. 823, 1992).
La selectividad es el grado en que un método puede cuantificar el analito con precisión en presencia de interferentes. Idealmente, la selectividad debería evaluarse para todos los interferentes importantes susceptibles de estar presentes. Es de especial importancia comprobar los interferentes capaces de responder a la prueba de acuerdo con sus principios. En muchos tipos de análisis, la selectividad es esencialmente un estudio cualitativo basado en la significación, o bien un conjunto de pruebas pertinentes de interferencia. (RESOLUCION OENO 8/2005)
1.3.2 Especificidad Es la capacidad del método para diferenciar precisa y específicamente el compuesto de interés, en presencia de los demás componentes, que se espera estén presentes en la matriz de la muestra. Estos componentes pueden ser precursores de la síntesis o subproductos de la misma, impurezas, excipientes o productos de degradación. (WHO Technical Report Series, No. 823, 1992).
1.3.3 Calibrado y Linealidad Se refiere a la proporcionalidad entre la concentración del analito y su respuesta, es decir si la técnica o método produce resultados directa o indirectamente proporcionales a la concentración o cantidad del analito, dentro de un intervalo determinado. En algunos casos se requiere una transformación matemática de la respuesta. (WHO Technical Report Series, No. 823, 1992).
La linealidad determina la región de la curva de cuantificación en que hay relación directa entre la señal instrumental y la concentración del producto analizado, siendo un método lineal cuando presenta una r > 0,99. (GOMARA, F. L, et al. 2004).
Un método de análisis presenta regresión lineal, cuando al aplicar un método se obtienen las respuestas, las cuales directamente o después de transformaciones matemáticas son proporcionales a la concentración del compuesto analizado dentro de un intervalo de concentraciones apropiado. Su aplicación principal está en curvas de calibración (Useche, B).
1.3.4 Precisión Se relaciona con la dispersión de la medida alrededor de un valor medio o central y mide la concordancia entre ensayos individuales cuando el método se aplica repetidas veces a muestras separadas e idénticas, obtenidas del mismo lote de material homogéneo. (WHO Technical Report Series, No. 823, 1992).
Mide el grado de cercanía entre las medidas obtenidas de análisis realizados repetidamente de múltiples muestreos de una muestra homogénea. La precisión se mide por la dispersión que puede ser expresado como desviación estándar o coeficiente de variación (desviación estándar relativa) (Useche, B).
La precisión de un método comprende:
procedimiento que varía durante una ejecución, incluidas las contribuciones procedentes de errores gravimétricos y volumétricos conocidos, de la heterogeneidad del material de prueba y de la variación en las etapas de tratamiento del análisis, y se observa fácilmente en la dispersión de los análisis replicados. El efecto de ejecución se explica por las variaciones cotidianas en el sistema analítico, como los cambios de analistas o de lotes de reactivos, el recalibrado de los instrumentos y el entorno del laboratorio (ej.: cambios en la temperatura) (RESOLUCION OENO 8/2005).
Es la concordancia entre resultados obtenidos con el mismo método, en muestras idénticas y bajo las mismas condiciones (experimentador, reactivos, instrumentos, condiciones atmosféricas) (Useche, B).
- Reproducibilidad Esta se mide cuando el ensayo se realiza en diferentes laboratorios por diferentes analistas, diferentes días, diferentes instrumentos (precisión entre laboratorios). El grado de reproducibilidad se determina en función de las variables del ensayo. La reproducibilidad puede ser comparada con la precisión del análisis en condiciones normales obteniéndose así una medida de la solidez del método (WHO Technical Report Series, No. 823, 1992).
En conclusión, la reproducibilidad, es la concordancia entre resultados obtenidos de diferentes laboratorios o por diferentes experimentadores usando la misma metodología y trabajando con muestras idénticas (Useche, B.).
La robustez en un método es finalmente, el grado de reproducibilidad de los resultados obtenidos para las mismas muestras bajo variadas condiciones (diferentes experimentadores, diferentes lotes de reactivos). Se realiza un diseño experimental con varios factores y se aplica análisis de varianza (Useche, B)
1.3.6. Exactitud Se define como el grado de concordancia o como la diferencia entre la media de los resultados del ensayo obtenidos por el método y el valor verdadero o el valor aceptado como correcto para la cantidad medida. Se conoce también como error sistemático o sesgo (WHO Technical Report Series, No. 823, 1992).
Es una medida de la diferencia entre el promedio de los resultados del análisis y el valor verdadero; de allí se puede establecer un error promedio. Mide el grado de similitud entro los resultados del método evaluado y los obtenidos usando un método de referencia (Useche, B).
1.3.7. Estabilidad Se considera adecuada si la desviación estándar relativa calculada en los resultados obtenidos en diferentes intervalos de tiempo, no excede el 20% del valor correspondiente de la precisión del sistema (WHO Technical Report Series, No. 823, 1992).
1.3.8. Límite de detección Es un número expresado en unidades de concentración (o cantidad) que describe el más bajo nivel de concentración de un analito que puede determinarse como estadísticamente diferente del blanco analítico (WHO Technical Report Series, No. 823, 1992).
Aquella concentración de analito que proporciona una señal significativamente diferente de la señal de fondo. Es similar en muchos aspectos al nivel crítico. Se estableció como 1.645 veces la desviación estándar del blanco de análisis. (Useche, B. )
1.3.9. Limite de cuantificación Corresponde a la más baja cantidad del analito que puede determinarse cuantitativamente con precisión y exactitud aceptables. (WHO Technical Report Series, No. 823, 1992).
Es la concentración de analito que produce una señal más grande que el blanco y que puede ser detectada dentro de los límites aceptados por los laboratorios. Se estableció que es la concentración que produce una señal 10 desviaciones estándar del blanco. (Useche, B.)
1.3.10. Sensibilidad Es definida como la proporción de muestras positivas o reactivas correctamente identificadas por la prueba empleada. (OCHOA Rolando, . et al, 2005 ).
La sensibilidad es entendida como la capacidad del método de distinguir, con determinado nivel de confianza, dos concentraciones próximas (GOMARA, F. L, et al, 2004)
1.4 MÉTODOS DE ENSAYO MICROBIOLÓGICOS
Los laboratorios de análisis tienen como principal objetivo reportar resultados altamente confiables, por eso deben controlar y asegurar la calidad de sus resultados, entendiéndose calidad, como el conjunto de propiedades y características óptimas de un producto o servicio que prueban su actitud para satisfacer necesidades específicas e implícitas. El mejoramiento de la calidad en el laboratorio consiste en implementar un programa completo que vale el resultado final emitido por el laboratorio proporcionando resultados útiles. Este mejoramiento, no solo incluye los conceptos más tradicionales de control de calidad, como el mejoramiento y la evaluación externa de la calidad que tiene como propósito mantener en cualquier proceso un rendimiento a niveles aceptables según los estándares, sino que también incluye el mejoramiento continúo de la calidad bajo el concepto de “calidad total”. (Cuesta, A).
El control de calidad abarca en los laboratorios de microbiología el monitoreo de medios de cultivo, reactivos, equipos y/o instrumentos, validación de procedimientos técnicos y del personal. Por tanto, la validación de las pruebas microbiológicas es de vital importancia ya que por medio de ésta se busca determinar las variaciones entre ensayos para disminuir las posibilidades de error en los resultados, haciéndolos de esta forma reales y confiables. Así mismo se busca garantizar que las técnicas son compatibles con las condiciones en las que se está trabajando. En las pruebas de diagnóstico microbiológicas tanto para alimentos, como para aguas, el recuento en placa en profundidad es una técnica comúnmente utilizada para determinar el número de células viables y la ausencia y/o presencia de ciertos microorganismos, al igual que la técnica del número más probable (NMP) realizada a través del recuento en tubos. (ROMERO, Maria., et al, 2003).
normas oficiales vigentes tales como la ISO-NTC 17025. (ROMERO, Maria., et al,
2003).
El análisis microbiológico tiene como fin proporcionar información confiable acerca de la inocuidad y calidad sanitaria de una muestra cualquiera. Es por ello que es indispensable la elección de un método de ensayo adecuado. El laboratorio debe utilizar los métodos de ensayo que satisfagan la necesidad del cliente y que sean apropiados para los ensayos que realiza. Se deben aplicar métodos y procedimientos apropiados para todos los ensayos dentro de su alcance (incluye muestreo, manipulación, transporte, almacenamiento, preparación de las muestras a ensayar, estimación de la incertidumbre y empleo de técnicas estadísticas para el análisis de datos de los ensayos). El laboratorio puede utilizar métodos oficiales, métodos normalizados nacionales e internacionales, o métodos internos desarrollados por él mismo. (Cuesta, A).
Es recomendable la utilización de métodos normalizados o de referencia, siempre y cuando éstos estén disponibles y sean apropiados. Sin embargo, el laboratorio no está obligado a utilizar un método normalizado, si dispone de un método propio con el que obtenga resultados equivalentes o superiores, utilice tecnología más avanzada y presente un grado de validación adecuado. En todos los casos, el laboratorio debe demostrar que un método es adecuado para la finalidad pretendida.
la sensibilidad, el límite de cuantificación y/o de detección, los efectos matriciales y facilidad de uso, son características que deben tenerse en cuenta antes de seleccionar un determinado método de ensayo. El laboratorio debe elegir los métodos que mejor se adecuen a sus objetivos, y debe documentarlos debidamente. (GUARNIZO, Juliana. 2005).
Es necesario aplicar dos métodos en paralelo sobre las mismas muestras cuando se está desarrollando un método interno, y también cuando se está recopilando información justificativa del uso de un método alternativo (ISO/ TR 13843:2000).
El método que presente la tasa de recuperación más elevada para los organismos buscados es obviamente el mejor, salvo que precise siempre de confirmación para su utilización en rutina. Un método que permita obtener una tasa de recuperación algo inferior, pero que no precise confirmación resulta preferible. Si no pueden corregirse tasas elevadas de falsos positivos o de falsos negativos observadas en la validación primaria por medio de una definición más detalladas de las colonias objetivo, es conveniente considerar el método como no valido (ISO/TR 13843:2000).
1.4.1. Métodos de ensayo microbiológicos cualitativos Son métodos en los que el resultado se expresa en términos de ausencia/presencia.
Los procedimientos de confirmación e identificación del microorganismo, deben ser validados estimando, cuando sea apropiado, su especificidad, exactitud relativa, desviación positiva, desviación negativa, límite de detección, efecto matricial, repetibilidad y reproducibilidad.
Las diferencias debidas a las matrices deben tenerse muy en cuenta al analizar diferentes tipos de muestras. Los resultados deben evaluarse utilizando métodos estadísticos apropiados. (Cuesta, A).
1.4.2. Métodos de ensayo microbiológicos cuantitativos Debe considerarse la especificidad, sensibilidad, exactitud relativa, desviación positiva, desviación negativa, repetibilidad, reproducibilidad y el límite de cuantificación dentro de una variabilidad establecida y, en caso necesario, determinar cuantitativamente estos parámetros. Las diferencias debidas a las matrices deben tenerse en cuenta al analizar diferentes tipos de muestras. Los resultados deben evaluarse utilizando métodos estadísticos apropiados. (Cuesta, A).
Un ensayo cualitativo no brinda una información numérica de los resultados, pero esto no implica que sea inferior a una prueba cuantitativa. Las aplicaciones de estos dos ensayos pueden ser diferentes y en algunas situaciones un resultado cualitativo es suficiente. Debe tenerse en cuenta que en muchos casos no existen materiales de referencia y en otros la naturaleza de los mecanismos de protección no es bien conocida, lo que limita la cuantificación de los resultados o al menos su interpretación (OCHOA, Rolando et al. 2005)
La validación analítica es uno de los elementos básicos en sistemas de calidad. El hecho de validar trata de disminuir o controlar los factores que llevan a la imprecisión o inexactitud de un dato generado, a través de la realización de un trabajo analítico dentro de unos parámetros definidos. La validación de un método analítico provoca una mayor fiabilidad y aceptación de los datos generados, estando estas en proporción con la calidad del proceso de obtención de los mismos (GOMARA, F. L, et al, 2004).
aparatos, la evaluación de métodos de medición o para signar valores a materiales. Los materiales de referencia certificados son un material acompañado de un certificado, uno o más de los valores asignados a sus propiedades se certifican mediante un procedimiento que establece su trazabilidad a una realización exacta de la unidad en la cual el valor de la propiedad se expresa y para la cual cada valor certificado se acompaña de una incertidumbre a un nivel declarado de confianza. (Hernández, A.)
Los patrones de medición son una medida material, instrumento o sistema de medición o material de referencia destinado a definir, realizar, conservar o reproducir una unidad o uno o más valores de una magnitud para que sirva de referencia. (Useche, B. )
1.5 MEDICIÓN Y ERRORES
Aunque existen innumerables procesos de medición diferentes, todos ellos culminan con la obtención de un resultado, el cual es afectado por distintos errores que surgen de la interacción entre el aparato de medida, el observador y el sistema bajo estudio.
Los errores asociados a las mediciones pueden dividirse en dos grandes clases: a) errores sistemáticos, y b) errores aleatorios. Los errores sistemáticos, tal como su nombre lo indica, se cometen de una misma manera cada vez que se mide. Muchos errores sistemáticos pueden eliminarse aplicando correcciones muy simples. Estos errores son llamados también errores corregibles o determinados, a fines de distinguirlos de los errores aleatorios, los cuales se encuentran en toda medición y están fuera del control del observador.
varias. En consecuencia, estos errores son particularmente serios y peligrosos, y pueden eliminarse sólo después de realizar cuidadosas calibraciones y análisis de todas las posibles correcciones. Algunas veces, los errores sistemáticos se manifiestan como un corrimiento en valores medidos consecutivamente o como un cambio en el valor experimental medido cuando se cambia la técnica experimental de medición.
La segunda clase de errores, los errores aleatorios o accidentales, aparecen como fluctuaciones al azar en los valores de mediciones sucesivas. Estas variaciones aleatorias se deben a pequeños errores que escapan al control del observador. El propósito del tratamiento de los datos experimentales es justamente determinar el valor más probable de una cantidad medida y estimar su confiabilidad. (http://arfiexp.tripod.com/manual_de_laboratorio2.htm)
1.6 MATERIAL DE REFERENCIA
Se denomina material de referencia al material o sustancia que ostenta valores de una o más propiedades suficientemente homogéneas y bien conocidas que permite su uso en la calibración de aparatos, la evaluación de un método de medición o la atribución de valores a estos materiales. (ISO/IEC 17025).
1.6.1. Cultivos de Referencia Es el conjunto constituido por cepas de referencia, cepas de reserva y cepas de trabajo. Un laboratorio de microbiología cuenta con cultivos de referencia, a fin de acreditar o conservar la acreditación de un ensayo. Así, el número, la elección del género y su especie son dependientes de los ensayos que se elaboran y de las necesidades que asumen estos. (ISO/IEC 17025).
Según la "ISO 11133-1:2000", son:
• microorganismos definidos, por lo menos a nivel de género y especie
• catalogados
• muy caracterizados
• de origen conocido
Dichas cepas son distribuidas y presentadas comercialmente liofilizadas; asimismo, los organismos de acreditación son los encargados de considerar válida la fuente de procedencia de la cepa a fin de que se cumpla con el requisito de prevenir mutaciones, deterioro o alteración de las características típicas de las cepas. (ISO/IEC 17025).
El número de repiques a partir de la cepa de referencia ha de ser limitado, aceptándose hasta cinco repiques como máximo a partir de dicha cepa de referencia.
Asimismo, toda cepa adquirida por una vía que no sea la propia colección, no podrá mencionarse utilizando el número que tienen en esa colección, sino únicamente como derivada de la cepa de colección. (ISO/IEC 17025).
1.7. REPRESENTATIVIDAD Y CANTIDAD SUFICIENTE DE MUESTRAS
ensayos de funcionamiento de métodos microbiológicos. Las técnicas estadísticas, de utilizarse, se convierten en meras líneas directrices. (ISO/TR 13843:2000).
Para ser convincente, el número y variedad de las muestras a examinar debe ser suficiente. Sin la ayuda de la estadística no hay ninguna manera de precisa de tomar una decisión. En ciertos casos, la primera muestra estudiada puede indicar ya que el método no es suficientemente bueno. Pero, una sola muestra generalmente no basta. A veces, se necesita un millar de muestras para “demostrar” que dos métodos P/A no son equivalentes. Seleccionar una cantidad insuficiente de ejemplos puede constituir una pérdida de tiempo.
1.7.1 Recuperación del analito El analito microbiológico se compone de partículas vivas discretas, denominadas indistintamente unidades formadoras de colonias (UFC), partículas formadoras de colonias (PFC), gérmenes, propágalos, etc. El número de colonias observado es una aproximación del número de partículas vivas. El conjunto de ensayos de funcionamiento necesarios está limitado por la casi imposibilidad de conocer la cantidad real del analito contenida en una muestra o en una porción de ensayo analítica. Los detectores no pueden sembrarse con un número de gérmenes exactamente conocido. (ISO/TR 13843:2000).
En el medio ambiente, e incluso en las muestras de laboratorio, la distribución de partículas no es homogénea. La varianza de muestreo no es una característica del método, mientras que la varianza debido a la toma de alícuotas de la muestra de laboratorio sí que puede considerarse como una característica. Puede resultar imposible utilizar métodos de homogenización suficientes para asegurar el perfecto mezclado del contenido de la muestra sin ninguna pérdida de células viables. La varianza intramuestra con frecuencia es considerable y da problemas en la validación. Será necesario definir el funcionamiento para matrices diferentes, en particular en lo que se refiere a la precisión y a los límites de trabajo superiores. (ISO/TR 13843:2000).
La variación aleatoria debido a una muestra no homogénea de las partículas entre dos muestras paralelas, incluso en suspensiones perfectamente mezcladas, es una característica de los métodos microbiológicos. La variación aleatoria básica es inevitable y no tiene nada que ver con la competencia técnica o con el equipamiento. Esta variación obedece a una ley matemática conocida, la distribución de Poisson, y por lo tanto puede calcularse.
Puede ser útil e incluso necesario efectuar adición o enriquecimiento en la validación secundaria, siempre que sea difícil conseguir muestras naturales con el microorganismo buscado. El personal de laboratorio deberá ser capaz de familiarizarse con los microorganismos buscados. Es conveniente limitar la utilización de muestras negativas (blancos) a las operaciones de aseguramiento de la calidad interna. Su inclusión entre las muestras estudiadas para ver la equivalencia de métodos puede producir la impresión falsa de una buena correlación entre métodos. Si es posible saber de antemano que muestras naturales no contienen ninguno de los organismos objetivo, éstas podrían ser una buena elección para verificar los falsos positivos en los ejercicios reales de validación.
El rango óptimo de concentraciones para la validación de métodos microbiológicos es más estrecho que el rango de aplicación previsto. No es necesario utilizar concentraciones muy grandes. Estas muestras son comparables a cultivos puros y no permiten verificar el comportamiento del método o del laboratorio sometido a ensayo. Ciertos métodos microbiológicos se han venido usando durante décadas por centenares de laboratorios (por ejemplo, agar ENDO para coliformes totales, mFC para coliformes termotolerantes, agar m-Enterococcus para enterococos intestinales). Estos métodos teóricamente podrían resultar adecuados para estudios colaborativos sobre el funcionamiento de los métodos. (ISO/TR 13843:2000).
Para la mayor parte de los métodos de recuento de colonias, es posible desarrollar un líquido equivalente de la misma composición química pero desprovisto de matriz sólida (agar, membrana filtrante). El efecto del entorno sólido puede evaluarse comparando los recuentos de colonias con la estimación equivalente NMP, siempre que la reacción para la identificación del microorganismo buscado sea la misma para los dos tipos de detectores y que el número de tubos paralelos sea suficiente para obtener un final de precisión adecuado. Es posible evaluar la sensibilidad de los detectores P/A procediendo a comparaciones líquido-sólido similar. (ISO/TR 13843:2000).
Para que sean útiles en la validación, es conveniente que las características de funcionamiento sean cuantificables y que puedan ser sometidas a ensayo, esto es; relacionado al campo de aplicación (lista de situaciones y tipos de muestras a las cuales es aplicable el método), a la precisión, a la linealidad, tasa de recuperación, límites de trabajo en términos de número de colonias superior e inferior que se recomienda contar por placa, a la selectividad, especificidad y robustez (solidez).
1.8. SISTEMA DE GESTIÓN DE CALIDAD EN LABORATORIOS DE ANÁLISIS MICROBIOLÓGICO
La validación constituye una parte esencial de las buenas prácticas de laboratorio (BPL´s) y consiste en el establecimiento de una evidencia documentada que suministre un alto grado de seguridad de que un proceso específico elaborará de forma permanente un producto que cumpla con características y especificaciones de calidad predeterminadas. Desde 1972 y durante seis años la validación buscó satisfacer exigencias normativas y defender líneas de producción. Hacia 1983 sirvió como método de acción fundamental de mejora de procesos. Desde allí se enfoca a diferentes áreas de optimización de procesos. (JAIME, Carolina. 2002)
Desde una perspectiva metrológica amplia, todos los métodos microbiológicos estándar se comportan de igual manera. Los procesos envuelven homogenización cuidadosa de la muestra y la suspensión de una porción medida en una solución acuosa. Además, la dilución de la suspensión puede ser necesaria para llegar a la concentración apropiada para el instrumento de medición, donde la detección y conteo de las partículas tiene lugar (Niemelä. S, 2002).
En muy pocos métodos la preparación envuelve otros pasos además de la agitación para separar el analito (microorganismo específico) de la muestra matriz y de las especies no específicas interferentes. La pasteurización y el tratamiento ácido de las muestras son dos ejemplos de tales prácticas (Niemelä. S, 2002).
1.8.1 Aseguramiento de la calidad de los resultados/control de Calidad Según el apartado 5.9 de la NTC ISO 17025 el control de calidad se divide en:
Control de Calidad Interno Consiste en todos los procedimientos realizados por un laboratorio para la evaluación continua de su trabajo. El principal objetivo es asegurar la coherencia de los resultados obtenidos diariamente y el cumplimiento de los criterios establecidos. (G-ENAC-04).
Un programa de controles periódicos es necesario para demostrar que controla la variabilidad (por ejemplo, entre analistas y entre equipos o materiales, etc.). Dicho programa debe abarcar todos los ensayos incluidos en el alcance de acreditación del laboratorio. El programa puede incluir:
· El uso de muestras inoculadas
· El uso de materiales de referencia (incluidos los materiales utilizados en ensayos de aptitud)
· Uso de replicados
· Recuentos cruzados entre analistas
El intervalo entre estos controles dependerá del diseño del programa y del número de ensayos realizados. Es recomendable que, en la medida de lo posible, los ensayos incluyan controles para evaluar sus resultados. En circunstancias especiales, un laboratorio puede estar acreditado para realizar un ensayo que rara vez se demanda. Se reconoce que, en tales casos, un programa continuo de control interno de la calidad no siempre será apropiado, siendo preferible un sistema que se realice en paralelo al ensayo y que demuestre que los resultados son satisfactorios. (G-ENAC-04).
válidos. Es necesario proceder a un control de calidad analítico (AQC) en relación con los análisis de rutina cotidianos. Este control permite verificar la capacidad de utilizar satisfactoriamente un método. El AQC es un proceso continuo. Los gráficos de guía cuyos límites se han deducido a partir de las especificaciones del método (a partir de la validación primaria), o a partir de consideraciones teóricas, son las herramientas principales. (ISO/TR 13843:2000) (AOAC INTERNATIONAL)
El método de AQC es un complemento del proceso analítico de rutina, por ejemplo, replicados a distintos niveles o simplemente cálculos que no se efectúan corrientemente sobre los datos de rutina. Además, se utilizan materiales de referencia, intercalibraciones y muestras con adición. El control de calidad analítico debe efectuarse en combinación con las validaciones primaria y secundaria. Es conveniente utilizar solo los resultados fiables desde el punto de vista del AQC para definir los criterios de validación y las características de funcionamiento.
Diversos grupos de trabajo nacional e internacional han elaborado numerosos documentos sobre el control de calidad de los métodos microbiológicos. En las especificaciones se asume que los laboratorios disponen de los controles analíticos apropiados y de sistemas de aseguramiento de la calidad internos y externos de funcionamiento. Es preciso estudiar las muestras con un bajo contenido microbiano por razones de salud pública, pero, por razones estadísticas, estas muestras no son adecuadas para la comparación de métodos ni para otros ejercicios de validación. El problema queda obviado, ya que los métodos microbiológicos generalmente no son sensibles a la concentración en la parte baja de la escala. (ISO/TR 13843:2000)
Control de calidad externo (ensayos de aptitud) Los laboratorios deben participar regularmente en ensayos de aptitud relacionados con el alcance de su acreditación, dando preferencia a los programas de ensayos de aptitud que utilicen matrices apropiadas. En algunos casos concretos, esta participación puede ser obligatoria. Los laboratorios deben utilizar el control externo de la calidad no sólo para detectar desviaciones en los resultados obtenidos, sino también para verificar la validez de todo el sistema de calidad. (G-ENAC-04).
Cuando se hacen ensayos de competencia técnica para organismos objetivo específicos, con medios selectivos, las muestras casi obligatoriamente han de ser enriquecidas con cultivos puros o con mezclas de organismos. Otra solución es utilizar materiales de referencia certificados. Se trata de una situación artificial y simplificada. Algunas dificultades importantes experimentadas por diferentes laboratorios en el uso en rutina de los métodos sobre muestras naturales pueden quedar obviadas. En tanto en cuanto las características de funcionamiento de un método microbiológico no hayan sido expresadas cuantitativamente, estos tipos de programas de aseguramiento externo de la calidad constituyen, a pesar de todo, el medio más satisfactorio en lo que respecta a la validación secundaria (verificación) de un método (ISO/TR 31843:2000).
participantes tienen varios años de experiencia en lo que concierne a los métodos sometidos a ensayo y demostrada su capacidad para aplicarlos. Actualmente, la experiencia demuestra que los estudios colaborativos encaminados a la evaluación del funcionamiento de un método tienden a convertirse en ensayos de aptitud del laboratorio y en ejercicios de formación.
Métodos equivalentes Es necesario aplicar dos métodos en paralelo sobre las mismas muestras cuando se está desarrollando un método interno, y también cuando se está recopilando información justificativa del uso de un método alternativo. Las características de funcionamiento de un método constan de muchos aspectos. No hay ningún ensayo individual de equivalencia de métodos ni ningún criterio numérico correspondiente. Un método puede ser superior es especificidad pero inferior en cuanto a recuperación. Toda la información sobre robustez, la precisión y la especificidad recopilada durante los ensayos de validación puede utilizarse para la comparación de los métodos. Únicamente es necesario examinar los métodos en paralelo únicamente para las comparaciones de tasa de recuperación. (ISO/TR 31843:2000).
El método que presenta la tasa de recuperación más elevada para los organismos buscados es obviamente el mejor, salvo que precise siempre de confirmación para su utilización en rutina. Un método que permita obtener una tasa de recuperación algo inferior, pero que no precise confirmación resulta preferible. Si no pueden corregirse tasas elevadas de falsos positivos o de falsos negativos observadas en la validación primaria por medio de una definición más detalladas de las colonias objetivo, es conveniente considerar el método como no válido.
técnicamente competente para la realización de un ensayo o grupo de ensayos determinados. (G-ENAC-04).
La tarea de evaluar dicha competencia técnica y la eventual declaración pública de la misma es llevada a cabo, mediante la comprobación del cumplimiento por parte de los laboratorios de los requisitos concretos sobre estructura y organización, imparcialidad, personal, equipos, procedimientos técnicos, sistema de la calidad, etc., establecidos en normas internacionales. En definitiva, los criterios sobre los que se apoya la declaración de competencia técnica. (G-ENAC-04).
La acreditación genera, así, confianza en los informes y resultados de análisis emitidos por los laboratorios que voluntariamente se han sometido a la evaluación frente a estándares altamente profesionales. (G-ENAC-04).
2. FORMULACIÓN Y JUSTIFICACIÓN DEL PROBLEMA
2.1 FORMULACIÓN DEL PROBLEMA
Cuando un laboratorio pone en práctica pruebas microbiológicas que no están validadas, ¿cómo demuestra la veracidad de sus resultados? La validación de las técnicas microbiológicas ayuda a obtener resultados fiables a partir de la verificación del correcto desempeño y funcionamiento del método microbiológico estándar utilizado. Sin embargo, en Colombia la falta de cultura de calidad y conocimiento sobre el tema de validación y la importancia que éste tipo de procesos tiene sobre los ensayos microbiológicos, se ve reflejada en los escasos estudios que se han realizado respecto a este tema. Así mismo, el crecimiento en el sector industrial en Colombia, hace que la demanda en cuanto a procedimientos con calidad aumente, y así mismo deben aumentar los laboratorios acreditados que ofrezcan a partir de la validación de sus métodos mejores resultados al cliente.
2.2 JUSTIFICACIÓN
Actualmente, los laboratorios de análisis microbiológico que prestan servicios, cuentan con diferentes técnicas con las cuales llevan a cabo los análisis correspondientes, pudiendo así emitir ciertos resultados; de esta manera, cada laboratorio ha establecido y organizado sus procesos de forma aislada permitiendo así que se generen posibles errores en la ejecución de las técnicas, disminuyendo la confiabilidad de los resultados. Es por eso que se hace imperante la necesidad de validar las técnicas desarrolladas para aumentar la credibilidad de las mismas, disminuyendo las oportunidades de error.
La validación de las pruebas microbiológicas es de vital importancia ya que por medio de ésta se busca determinar las variaciones entre ensayos para disminuir las posibilidades de error en los resultados, haciéndolos de esta forma reales y confiables. Así mismo se busca garantizar que las técnicas son compatibles con las condiciones en las que se está trabajando. La validación y verificación de los ensayos microbiológicos estándar, es importante para que el laboratorio pueda elaborar, desarrollar y generar resultados confiables y seguros, como requisito parcial para dar cumplimiento a las normas oficiales vigentes tales como la ISO-NTC 17025.
3. OBJETIVOS
3.1. OBJETIVO GENERAL
• Diseñar y elaborar una guía para la validación de ensayos y métodos de análisis microbiológicos estándar.
3.2. OBJETIVOS ESPECÍFICOS
• Realizar una recopilación y revisión bibliográfica acerca de las validaciones de los métodos y ensayos microbiológicos estándar.
• Proveer una descripción práctica y detallada de los métodos básicos de uso rutinario y la estimación de variables importantes para la validación.
4. MATERIALES Y MÉTODOS
4.1. TIPO DE INVESTIGACIÓN
Esta investigación es de tipo descriptivo. Mediante este tipo de investigación, que utiliza el método de análisis, se logró caracterizar un objeto de estudio o una situación concreta, señalar sus características y propiedades. Combinada con ciertos criterios de clasificación sirve para ordenar, agrupar o sistematizar los objetos involucrados en el trabajo indagatorio. Además, puede servir de base para investigaciones que requieran un mayor nivel de profundidad.
4.2. POBLACIÓN Y ESTUDIO DE MUESTRA
La población objetivo de esta investigación fueron las pruebas de ensayo microbiológicas tanto cualitativas como cuantitativas, como los son: recuento en placa, ausencia/presencia, NMP, etc., que se desarrollan en las pruebas de diagnóstico microbiológico; el recuento en placa en profundidad es una técnica comúnmente utilizada para determinar el número de células viables y la ausencia y/o presencia de ciertos microorganismos, al igual que la técnica del número mas probable (NMP) realizada a través del recuento en tubos.
4.3. RECOPILACION Y REVISIÓN BIBLIOGRÁFICA
Con respecto a la utilización de fuentes primarias, se realizaron entrevistas con personas involucradas con los laboratorios que llevan a cabo pruebas y/o ensayos microbiológicos y también con personas conocedoras de temas como la validación y los modelos matemáticos a nivel microbiológico.
Se realizó lectura y análisis de cada uno de los documentos encontrados, para lograr a través de la organización y entendimiento de la información recolectada, el diseño y la elaboración de la guía para la validación de los métodos microbiológicos.
4.4. DOCUMENTACIÓN DE LOS PARÁMETROS DE VALIDACIÓN PARA MÉTODOS Y ENSAYOS EN MICROBIOLOGÍA ESTÁNDAR.
Después de la obtención y recopilación de la información, análisis y aplicación de los procedimientos estadísticos cualitativos y cuantitativos, se procedió a documentar y desarrollar los parámetros estudiados en la información recolectada. De esta manera, se inició el diseño de la guía para la validación de pruebas microbiológicas estándar.
4.5. DESPLIEGUE DE MODELO MATEMÁTICO PRELIMINAR PARA LA VALIDACIÓN DE PRUEBAS MICROBIOLÓGICAS ESTÁNDAR.
Con la estadística no paramétrica se estima la exactitud y la precisión de las
5. RESULTADOS Y DISCUSIÓN
5.1 REVISIÓN BIBLIOGRÁFICA
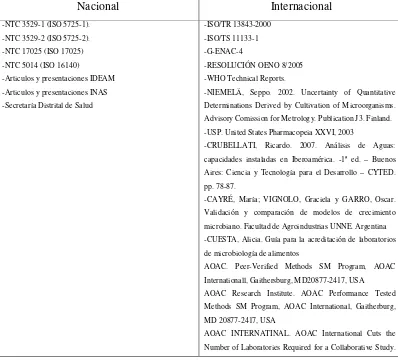
[image:50.595.108.506.361.721.2]Luego de la revisión bibliografíca realizada se encontró que a nivel internacional las principales fuentes de información sobre el tema son la ISO, la FAO, la WHO y a nivel nacional, el ICONTEC, las secretarias de salud y el IDEAM. Sin embargo, también se pudo observar que las más influyentes son a nivel internacional y nacional, la ISO y el ICONTEC respectivamente. La Tabla 1 muestra la bibliografía que más se destaca para procedimientos de validación en microbiología estándar:
Tabla 1. Bibliografía para procesos de validación en microbiología estándar
Nacional Internacional
-NTC 3529-1 (ISO 5725-1). -NTC 3529-2 (ISO 5725-2). -NTC 17025 (ISO 17025) -NTC 5014 (ISO 16140)
-Articulos y presentaciones IDEAM -Articulos y presentaciones INAS -Secretaría Distrital de Salud
-ISO/TR 13843-2000 -ISO/TS 11133-1 -G-ENAC-4
-RESOLUCIÓN OENO 8/2005 -WHO Technical Reports.
-NIEMELÄ, Seppo. 2002. Uncertainty of Quantitative Determinations Derived by Cultivation of Microorganisms. Advisory Comission for Metrology. Publication J3. Finland. -USP. United States Pharmacopeia XXVI, 2003
-CRUBELLATI, Ricardo. 2007. Análisis de Aguas: capacidades instaladas en Iberoamérica. -1ª ed. – Buenos Aires: Ciencia y Tecnología para el Desarrollo – CYTED. pp. 78-87.
-CAYRÉ, María; VIGNOLO, Graciela y GARRO, Oscar. Validación y comparación de modelos de crecimiento microbiano. Facultad de Agroindustrias UNNE. Argentina -CUESTA, Alicia. Guía para la acreditación de laboratorios de microbiología de alimentos
AOAC. Peer-Verified Methods SM Program, AOAC Internationall, Gaithersburg, MD20877-2417, USA AOAC Research Institute. AOAC Performance Tested Methods SM Program, AOAC International, Gaitherburg, MD 20877-2417, USA
Downloaded from http: //64.55.218.151/pubs/storyarchives/cutlabs.htm. 8/28/2003
[image:51.595.106.510.116.175.2]La revisión bibliográfica además de mostrarnos que el conocimiento y la investigación sobre validación a nivel internacional es mayor que a nivel nacional, lo cual se puede evidenciar por la cantidad de bibliografía internacional mostrada en la tabla 1, también permitió obtener información acerca de la situación actual en cuanto a validación y acreditación de los laboratorios de ensayo en Colombia.
Como resultado de la información analizada, se encontró que en Colombia la constitución política estableció como deber del Estado, entre otros, proteger los derechos de los consumidores frente a la calidad, la información y las garantías, y de igual manera velar por la protección de la salud, la seguridad y el medio ambiente, instaurando así su competencia estatal para intervenir y regular calidad (Crubellati, R. 2005).
Para dar cumplimiento a las políticas planteadas en cuanto a calidad se han venido brindando los siguientes marcos regulatorios: El estatuto de Protección al Consumidor y El Sistema Nacional de Normalización, Certificación y Metrología (SNNCM) a cargo de la Superintendencia de Industria y Comercio (SIC) (Crubellati, R. 2005). Esta superintendencia es la entidad que acredita a los organismos evaluadores de la conformidad que operan dentro del SNNCM, el cual de acuerdo con los lineamientos establecidos en el CONPES 3446 del 30 de octubre de 2006, se irá transformando en el nuevo Subsistema Nacional de la Calidad. (Organismo Nacional de Acreditación, 2007)
de inspección. A la misma fecha dicha entidad tenía un total de 185 solicitudes de acreditación en trámite y 16 solicitudes de ampliación del alcance de acreditaciones ya otorgadas.
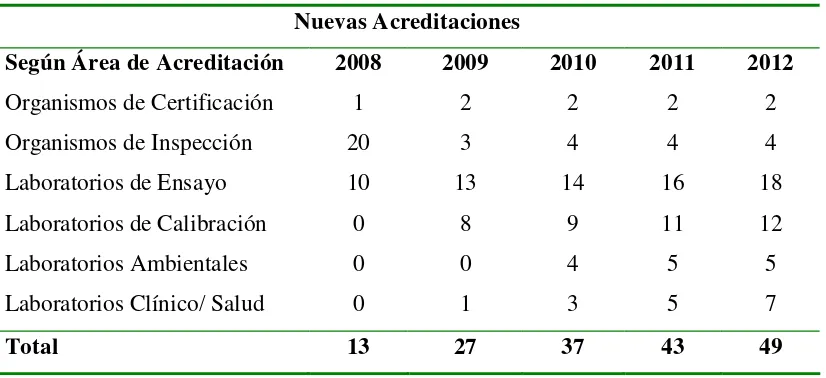
[image:52.595.108.521.439.628.2]Según las proyecciones de la demanda del futuro Organismo Colombiano de Acreditación (OCA), a partir de las acreditaciones otorgadas por el SIC y el IDEAM en el 2006 se realizó el calculo de la demanda para el periodo 2008-2012, en el cual, en el año 2008 solamente se acreditarán organismos de certificación, organismos de inspección y laboratorios de ensayo, en el año 2009 se iniciará la acreditación de laboratorios de calibración y laboratorios clínicos/salud y en el año 2010 se iniciará la acreditación de laboratorios ambientales siendo estas acreditaciones evaluadas anualmente mediante una auditoría de seguimiento. (Ver Tabla 2).(Organismo Nacional de Acreditación, 2007)
TABLA 2. Acreditaciones 2008-2012 Nuevas Acreditaciones
Según Área de Acreditación 2008 2009 2010 2011 2012
Organismos de Certificación 1 2 2 2 2
Organismos de Inspección 20 3 4 4 4
Laboratorios de Ensayo 10 13 14 16 18
Laboratorios de Calibración 0 8 9 11 12
Laboratorios Ambientales 0 0 4 5 5
Laboratorios Clínico/ Salud 0 1 3 5 7
Total 13 27 37 43 49
creado programas como los llamados Interlaboratorios supervisados por la Red de Laboratorios perteneciente al Laboratorio de Salud Pública, con actividades de diagnóstico, referencia, contrarreferencia, control de calidad, capacitación, investigación en apoyo a la vigilancia en salud pública, prevención, control y seguimiento de enfermedades que se adelanta en atención a las personas y al medio ambiente, análisis, vigilancia y control sanitario de medicamentos, sustancias químicas de riesgo para la salud humana, productos biológicos, alimentos, bebidas, cosméticos, insumos para la salud y productos varios (Secretaría Distrital de Salud: Prospectiva del Laboratorio Distrital de Salud Pública, 2003)
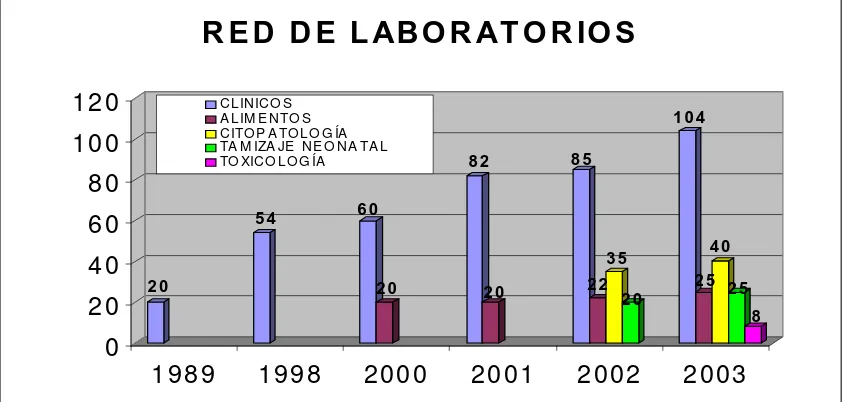
[image:53.595.102.524.495.696.2]La Red de Laboratorios de Alimentos se conformó en el año 2000 con 20 laboratorios (2 de Universidades, 2 de Supermercados, 6 de Industrias y 10 particulares), para iniciar con ellos el proceso de estandarización de técnicas y procedimientos. Al año 2003 se contaba con 104 laboratorios clínicos (76 privados y 28 públicos), 40 laboratorios de citopatología (39 privados y 1 público), 25 laboratorios privados de alimentos y 25 laboratorios de Tamizaje neonatal (15 privados y 10 públicos) (Ver Figura 1.).
Figura 1. Estadísticas de la Red de Laboratorios 2 0
5 4 6 0
2 0 8 2 2 0 8 5 2 2 3 5 2 0 1 0 4
2 5 4 0 2 5 8 0 20 40 60 80 1 00 1 20
19 89 19 98 2 000 2 00 1 200 2 200 3
R E D D E L AB O R AT O R IO S
Fuente: Secretaría Distrital de Salud: Prospectiva del Laboratorio Distrital de Salud Pública, 2003
El enfoque de riesgo establecido en el sistema de vigilancia ambiental, permitió que el uso de esta red fuera cada vez más racional. Esto se evidenció en el total de análisis realizados en los laboratorios de físico químico y microbiología de alimentos al reducir de 20.000 muestras en los años 1998 y 2000 a un promedio de 11.200 en los años 2001-2003 (Ver Tabla 3) (Secretaría Distrital de Salud: Prospectiva del Laboratorio Distrital de Salud Pública, 2003).
Los procesos de estandarización a los grupos operativos y la elaboración de protocolos han sido pilares en este proceso de mejoramiento. Esto se evidencia por ejemplo en los análisis realizados a los alimentos clasificados como de menor riesgo que pasaron de 6000 muestras en el año 1998 a un número de 400 en el año 2002 (Ver Tabla 3).
También se determinó en conjunto con los diferentes grupos de trabajo y a la luz del decreto 475 sobre vigilancia de la calidad del agua, establecer con claridad un muestreo adecuado en las pruebas analíticas de agua, disminuyendo de 9000 a un promedio de 6000 por año, que garantiza la vigilancia adecuada de la calidad de agua de consumo humano (Secretaría Distrital de Salud: Prospectiva del Laboratorio Distrital de Salud Pública, 2003).
Tabla 3. Grupos de alimento analizados en el Laboratorio de Salud Pública, grupo de Vigilancia del Ambiente y del Consumo, años 1998 - 1999 – 2000 – 2001 –2002
1998 1999 2000 2001 2002
Aguas 6668 9933 6039 6005 5501
Menor Riesgo 6042 298 202 413 Bebidas alcohólicas 823 1244 892 822 1272
Control Especial 1714 642 553 1377
Control de Calidad 410 457
Medicamentos 217 55 181 181
Microbiología Ambiental 11
Total 22114 22035 11517 9989 12306
Fuente: Secretaría Distrital de Salud: Prospectiva del Laboratorio Distrital de Salud Pública, 2003
La tabla 3 también permite apreciar cómo el correcto funcionamiento de la red de laboratorios de alimentos permite el aumento en el número de análisis con otras entidades como las de control de calidad que incluye la supervisión indirecta a los laboratorios de la red y las pruebas interlaboratorios que realiza el Laboratorio de Salud Pública (LSP) con otras entidades como el Instituto Nacional de Vigilancia de Medicamentos y Alimentos (INVIMA) y el Instituto Nacional de Salud (INAS).
El Programa Interlaboratorios de Control de Calidad para Agua Potable (PICCAP), fue creado por el grupo de Salud Ambiental- SNRL del Instituto Nacional de Salud.