UNIVERSIDAD NACIONAL DE LA AMAZONÍA
PERUANA
FACULTAD DE INDUSTRIAS
ALIMENTARIAS
ESCUELA DE FORMACIÓN PROFESIONAL DE BROMATOLOGÍA Y
NUTRICIÓN HUMANA
TRABAJO FINAL DE
CARRERA TÍTULO:
“EVALUACIÓN COMPOSICIONAL, CAPACIDAD ANTIOXIDANTES
DE PULPA Y CÁSCARA DE LA Annona muricata L. (GUANÁBANA)”.
PARA OPTAR EL TÍTULO PROFESIONAL
DE LICENCIADO EN NUTRICIÓN
HUMANA
PRESENTADO POR LOS BACHILLERES
ROSA CORINA ACOSTA VÁSQUEZ BETSI JOHANNA IVONNE DÍAZ PEÑA
ASESORADO POR:
Ing. EMILIO DÍAZ SANGAMA Msc.
“EVALUACIÓN COMPOSICIONAL, CAPACIDAD ANTIOXIDANTES
i
DEDICATORIA
CORINA
A mis padres, Iban y Ursula que siempre me apoyaron incondicionalmente, con su amor, dedicación y los consejos que me brindaron para poder seguir adelante y concluir con este proyecto.
JOHANNA
ii
AGRADECIMIENTO
CORINA
A Dios que siempre está guiándome por el buen camino y bendiciéndome.
A mis padres, hermana y novio, por el apoyo incondicional y por permitirme que todo esto fuese posible.
A los profesores del jurado, en especial al Dr. Alenguer Alva por las correcciones, sugerencias y tiempo, siendo estas contribuciones muy valiosas para la calidad de la tesis.
A ingeniero Emilio Díaz Sangama y amigos, a quienes estaremos agradecidas por la dedicación con nuestro trabajo, que ejercieron su papel de profesores con sabiduría y juicio.
JOHANNA
A Dios mi agradecimiento principal, por darme el ser, la fortaleza, sabiduría, salud y lo necesario para seguir adelante día a día para lograr mis objetivos con humildad, por haber puesto en mi camino a aquellas personas que han sido mi soporte y compañía durante todo este tiempo, y por permitirme disfrutar cada momento de mi vida y guiarme por el buen camino.
A mis padres, Jaime Díaz L. e Ivonne P. de Díaz, pilares fundamentales en mi vida, gracias a sus consejos, los valores que me inculcaron, el apoyo y motivación constante que me brindan en todo momento de mi vida, ya que sin ellos no estuviese logrando mis metas y sueños; su tenacidad y lucha insaciable han hecho de ellos mi gran ejemplo a seguir y destacar.
A mi novio, quien ha sido mi constante apoyo a terminar este trabajo de investigación y quien es parte de cada uno de los éxitos y logros obtenidos.
A mi asesor de tesis, el Ing. Emilio Díaz Sangama, mi más amplio agradecimiento, por el tiempo dedicado a nuestro proyecto de tesis, por habernos ayudado a enfocarnos en la investigación.
A tan excelente jurado, un especial agradecimiento al Dr. Alenguer Alva Arévalo, por sus consejos, sabiduría brindada, paciencia y tiempo, que tuvo con nosotras durante nuestra estancia en el área de investigación, donde hemos podido tener la oportunidad de aprender y clarificar en nuestro esquema la metodología utilizada poder terminar una parte de este trabajo de investigación.
A todas las personas que directa o indirectamente participaron dándonos ánimos y acompañándonos en todo momento.
ÍNDICE
2.1.1.2. Descripción botánica y habitad. 6
2.1.1.3. Origen. 9
2.1.1.4. Ecología y adaptación. 9
2.1.1.5. Métodos de propagación. 10
2.1.1.6. Perspectiva de mejoramiento del cultivo. 11
2.1.1.7. Formas de utilización y comercialización. 11
2.1.1.8. Otras investigaciones. 11
2.1.2. Clasificación taxonómica Annona muricata L. 12
2.1.2.1. Característica. 12
2.1.2.2. Propiedades alimentarias de la guanábana. 14
2.1.2.3. Propiedades medicinales de la guanábana. 16
2.2. INVESTIGACIONES SOBRE EL TEMA. 17
2.3. COMPOSICIÓN QUIMICA Y SUS PROPIEDADES 18
2.3.1. Caracterización físico-químico de las frutas. 19
2.3.2. Frutas como fuente de antioxidantes. 19
2.4. ANTIOXIDANTES 20
2.4.3. Importancia de las enzimas como antioxidantes. 23
2.5. ACTIVIDAD ANTIOCIDANTE 23
2.5.1. Radicales libre. 23
2.5.1.1. Formación de radicales libres. 24
2.6. SISTEMA DE DEFENSA DE ANTIOXIDANTES 25 2.6.1. Rx enzimático de la defensa antioxidante y mecanismo de acción y
Clasificación de los antioxidantes. 25 2.8.3.2.2. Acción antioxidante de los flavonoides. 34
2.8.3.2.3. Estructura de flavonoide. 35 2.8.3.3. Antocianinas. 35 2.8.3.4. Determinación de taninos. 37 2.8.3.4.1. Actividad antioxidante de taninos. 38
2.8.3.4.2. Estructura y estabilidad. 38 2.9. ENSAYO DEL DPPH (1,1-DIFENIL-2-PICRIL-HODRAZILO) 39 2.9.1. Los resultados del ensayo DPPH. 40 2.10. PARÁMETROS DE MEDICIÓN 41
3.3. MATERIALES, EQUIPOS Y REACTIVOS 46 3.4. TIPO Y DISEÑO DE ESTUDIO 49
3.5. DEFINICIÓN OPERACIONAL DE LAS VARIABLES 49 3.5.1. VARIABLES INDEPENDIENTES 49
3.5.2. VARIABLES DEPENDIENTES 49
3.6. DISEÑO MUESTRAL 50 3.7. PROCEDIMEINTO PARA LA RECOLECCIO DE LA INFORMACION DE LA MUESTRA VEGETAL 50 3.8.1.4. Determinación de proteínas. 55
3.8.1.5. Determinación de carbohidratos. 57
3.8.2. Evaluación de la actividad antioxidante por el método. 58
3.8.2.1. 2,2-difenil-1-picrilhidrazil (dpph). 58
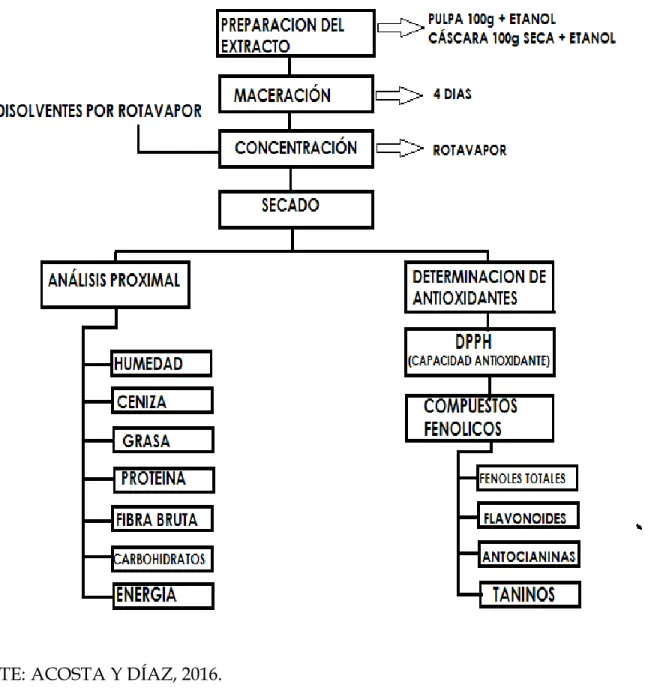
3.8.2.2. Preparación del extracto etanólico. 59
3.8.2.3. Determinación de fenoles totales. 59
3.8.2.4. Determinación de taninos condesados. 59
3.8.2.5. Determinación de antocianinas, por el método ph- diferencial. 59
3.8.2.5.1. Procedimiento. 60
3.8.2.6. Determinación de flavonoides. 61
3.8.3. Análisis de datos. 61
3.8.4. Vitamina C. 62
CAP. IV: RESULTADOS Y DISCUCIONES 63 4.1. Evaluación composicional de la cáscara y pulpa de la Annona muricata L 64
4.2. Evaluación de la actividad antioxidante, fenoles totales antocianinas, flavonoides y taninos de la pulpa y cascara de la especie Anonna muricata L 67 4.2.1. Determinación de la actividad antioxidante con el método del dpph 67 4.2.2. Determinación de la actividad antioxidantes de la pulpa de Annona muricata 67
4.2.3. Evaluación de fenoles totales de la pulpa Annona muricata L (guanábana). 70
4.2.4. Evaluación de antocianinas de la pulpa de Annona muricata L. (guanábana). 72
4.2.5. Evaluación de flavonoides de la pulpa Annona muricata L. (guanábana) 74 4.2.6. Evaluación de taninos de la pulpa Annona muricata L. (guanábana). 75
4.3. Determinación de la actividad antioxidantes de la cáscara de Annona muricata L 76
4.3.1. Evaluación de fenoles totales de la cascara de Annona muricata L (guanábana). 79
4.3.2. Evaluación de antocianinas de la cáscara de Annona Muricata L. 81
4.3.3. Evaluación de flavonoides de la cáscara de Annona Muricata L. 84
4.3.4. Evaluación de taninos de cascara de Annona Muricata L. 85
4.4. Comparación entre cáscara y pulpa de guanábana. 88
CAP. V: CONCLUSIONES 90
CAP. VI RECOMENDACIONES 92
CAP. VII: REFERENCIAS BIBLIOGRÁFICA 94
iii
ÍNDICE DE TABLAS
CONTENIDO Pág
Tabla N°01. Clasificación taxonómica ... 12
Tabla N° 02 Composición nutricional en 100g de pulpa fresca de la guanábana comparaciones bibliográficas ... .... 18
Tabla N°03. Clasificación de los antioxidantes según el sitio ejercen su acción .... .... 22
Tabla N°04. Clasificación de los antioxidantes ... .... 23
Tabla N° 05. Tabla de materiales ... .... 46
Tabla N° 06. Equipos ... .... 47
Tabla N° 07. Reactivos ... .... 48
Tabla N°08: Análisis Proximal de la especie Annona muricata L. (Guanábana cáscara) ... .... 64
Tabla N° 09: Análisis Proximal de la pulpa de la especie Annona muricata L. (GUANÁBANA) ... .... 65
TABLA Nº 10. Comparación de resultados con las fuentes ... .... 66
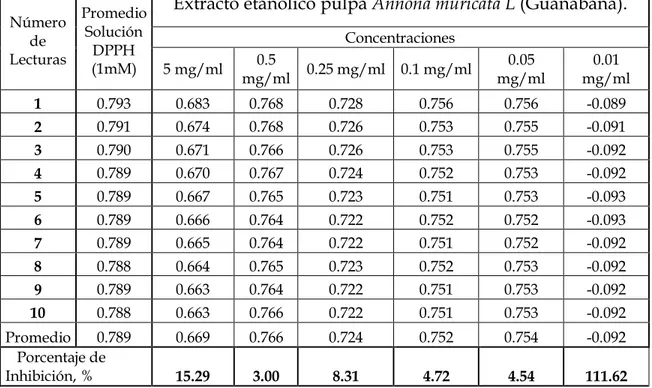
TABLA Nº 11. Promedios de las repeticiones y lecturas realizadas a la pulpa Annona muricata L. (GUANÁBANA) ... .... 68
TABLA N° 12. Porcentaje de inhibición a la pulpa Annona muricata L ... .... 68
TABLA Nº 13. Contenido de fenoles totales de la pulpa Annona Muricata L. (GUANÁBANA) ... .... 71
TABLA Nº 14. Absorciones y cálculo de antocianinas presentes en la PULPA Annona Muricata L (GUANÁBANA) ... .... 73
TABLA Nº 15. Determinación de flavonoides de la PULPA Annona Muricata L. (GUANÁBANA) ... .... 74
TABLA Nº 16. Contenido de taninos de la PULPA Annona Muricata L (GUANÁBANA) ... .... 75
iv
TABLA Nº18. Porcentaje de inhibición de las cáscara Annona muricata L.
(GUANÁBANA)77 TABLA Nº19. Contenido de fenoles totales de CÁSCARA DE
Annona Muricata L (GUANÁBANA) ... .... 80
TABLA N°20. Absorbancias obtenidas entre 400-700 nm para la determinación de
antocianinas de la CÁSCARA DE Annona Muricata L (guanábana) ... .... 81
TABLA Nº 21. Absorciones y cálculo de antocianinas presentes en la CÁSCARA
DE Annona Muricata L. (GUANÁBANA) ... .... 83
TABLA Nº 22. Determinación de flavonoides de la CÁSCARA DE Annona
Muricata L. (GUANÁBANA)... .... 84
TABLA Nº 23. Contenido de taninos de la CÁSCARA DE Annona
Muricata L (GUANÁBANA)... .... 87
TABLA Nº 24. Comparación de la actividad antioxidante y/o compuestos presentes ... ... 88
v
ÍNDICE DE FIGURA
CONTENIDO Pág.
Figura N° 01. Planta de Annona muricata L. ANNONACEAE. “Guanábana” ... .... 07
Figura N° 02. Fruto de Guanábana ... .... 09
Figura N°03. Transporte de nutrientes... .... 25
FIGURA N° 04. Mecanismo de Defensa Antioxidante... .... 26
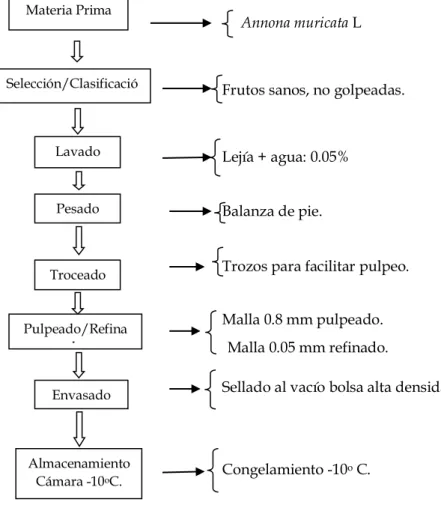
FIGURA N° 05. Flujo para la elaboración de pulpa de guanábana ... .... 51
FIGURA N° 06. Obtención de los extractos de la pulpa y cáscara de Annona Muricata L. (Guanábana) ... .... 52
FIGURA N° 07. Porcentaje de inhibición a las diferentes concentraciones de la pulpa Annona muricata L. (Guanábana) ... .... 70
FIGURA Nº 08. Absorción del extracto etanólico de la de 400 a 700 nm a pH 4.5 para la determinación de antocianinas ... .... 72
FIGURA Nº 09. Absorción del extracto etanólico de la de 400 a 700 nm a pH 1 para la determinación de antocianinas... .... 73
FIGURA Nº 11. Curva padrón de ácido gálico para cálculo de fenoles totales ... ... 79
FIGURA Nº 12. Absorción del extracto etanólico de la CÁSCARA DE Annona Muricata L (Guanábana) de 400 a 700 nm a pH 4.5 para la determinación de antocianinas ... .... 82
FIGURA Nº 13. Absorción del extracto etanólico de la CÁSCARA DE Annona Muricata L. (GUANÁBANA).De 400 a 700 nm a pH 1 para la determinación de antocianinas ... .... 82
1
RESUMEN
De la fruta de Annona muricata L (guanábana) recolectado del Centro Experimental “El
Dorado”-INIA se evaluó el contenido de composicional y antioxidante en cáscara y pulpa, utilizando un diseño por conveniencia, se realizó loa siguientes análisis proximales de cascara dando los resultados de 327.26kcal de energía, 0.98% de grasa, 72.78% de carbohidratos, 6.83% de proteínas, 1.79% de ceniza, 17.62% de humedad y 50.0mg de vitamina C; para pulpa deshidratada tenemos de 200.27 kcal de energía, 1.07% de grasa, 64.79% de carbohidratos, 7.87% de proteínas, 10.51% de ceniza y 5.76% de humedad. Para pulpa fresca tenemos 0.15 de acidez titulable, 0.23% de grasa, 14.78% de carbohidratos, 0.92% de proteínas, 0.56% de ceniza, 83.51% de humedad y 19.08mg de vitamina C.
El extracto obtenido por maceración en etanol al 1% de ácido fórmico, por medio del espectrofotómetro UV-Vis se realizaron pruebas de la Actividad Antioxidante (AA), de las cuales se encontraron con mayor presencia en la cáscara en este orden, fenoles totales (55.967 ± 0.061 mg EAG/100 g muestra original), antocianinas (-1.4300mg de cianidina-3-glucosido/100 g de muestra original), flavonoides (0.37 ± 0.00 g quercetina/100g muestra original), taninos (8.810 mg (+)-catequina/100g de muestra original), en la pulpa también se determinó la presencia de fenoles totales (369.398 ± 0.061 mg EAG/100 g muestra original), antocianinas (6.4691 ± 2.4099 mg de cianidina-3-glucosido/100 g de muestra original), flavonoides (0.01 ± 0.00 g quercetina/100g muestra original), taninos (84.925 ± 0,0 mg (+)-catequina/100g de muestra original). La Actividad Antioxidantes de la cáscara
2
3
I.INTRODUCCIÓN
La Annona muricata L. (guanábana) es una especie frutícola perteneciente a la familia
de las Anonáceas, originaria de América tropical (LAPRADE, 1989; Escobar y Sánchez, 1992) y sub tropical, cuyo centro de origen se ubica en Colombia o Brasil (Zarate, 1991; Escobar y Sánchez, 1992). Dentro de las Anonáceas, la guanábana es una de las especies comestibles más importantes por su agradable sabor y aroma, así como por sus múltiples usos tanto como fruta fresca como procesada (LABOREM, 1994).
Durante los últimos años 5 años las exportaciones de guanábana fresca han sufridos variaciones muy notorias. Se puede percibir que entre el 2007 al 2009 hubo una tendencia a la caída pasando de las 16.61 tm exportado a prácticamente no más 0.3tm, para luego entre el 2010 y 2011 presentar un notorio incremento pero con tendencia oscilatoria registrándose en el 2010 un total de 66.3 tm guanábana exportada para luego caer en el 2011 a solo 38.72 tm lo cual presento solo el 58.4% de lo enviado en el 2010.(Sierra exportadora ,2012)
Razón por la cual, los productores no se atreven a sembrar el cultivo a gran escala, ya que en las regiones donde prospera mejor, se obtienen bajos rendimientos y pocos frutos de buena calidad por árbol (BOSCAN, GODOY, 2004).
La calidad de la guanábana está condicionada por sus características externas que dependen de la variedad, forma, tamaño del fruto y grado de maduración, e internas, determinadas por el contenido de azúcar, vitaminas, carbohidratos, aminoácidos, minerales y las apreciadas por los sentidos olor, sabor, color y textura de la pulpa (LABOREM, 1994).
4
antioxidantes sobre la calidad nutricional de pulpa de guanábana (Annona muricata
L.) procedente de la zona (INIA - Iquitos) Loreto.
En el mundo existe una tendencia hacia un mayor consumo de frutas y hortalizas, motivado por una creciente preocupación hacia una dieta más equilibrada y una mayor conciencia de la importancia de los hábitos nutricionales humanos en los
problemas de salud y longevidad de las comunidades (INN, 2000). El consumo
estimado de frutas y verduras es muy variable en todo el mundo, oscilando entre 100 g/día en los países menos desarrollados y aproximadamente 450 g/día en Europa Occidental (LEON, 1987). Según la OMS, uno de los principales factores de riesgo de cáncer y enfermedades cardiovasculares es la dieta malsana (OMS, 2011). El cuerpo humano mediante su funcionamiento metabólico normal genera Especies Reactivas de Oxígeno (ROS, por sus siglas en inglés), las cuales al encontrarse en exceso pueden causar daños a macromoléculas biológicas como ADN, lípidos, carbohidratos y proteínas (RUIZ, 2000). Estos daños se han asociado al desarrollo de padecimientos como cáncer, enfermedades cardiovasculares, visuales y desordenes inmune y neurodegenerativos (RAFECAS, 2006).
En esta presente investigación se realizaron las siguientes evaluaciones, composicional (análisis proximal) y su determinación de su capacidad antioxidantes de la materia prima (cáscara y pulpa). Al realizar el análisis proximal de la pulpa y cáscara en base fresca y seca. Al evaluar la capacidad antioxidante en la pulpa y cáscara (método del DPPH). Al realizar las pruebas de compuestos fenólicos (tanino, antiocianinas, fenoles totales y flavonoides). Al obtener la evaluación composicional
y la capacidad antioxidante de la pulpa y cascara de Annona muricata L y cumplir con
los objetivos planteados en la investigación.
Entre los compuestos que pueden actuar como antioxidantes se encuentran vitaminas
C y E, carotenoides, antocianinas, flavonoides y otros compuestos fenólicos (LAKO et
al., 2007). Muchos de estos antioxidantes son lipofílicos y particularmente
importantes en la oxidación de lípidos en todos los sistemas, así como otros radicales
5
6
II.REVISIÓN BIBLIOGRÁFICA.
2.1. MATERIAS PRIMAS.
2.1.1. GUANÁBANA
2.1.1.1. Descripción general
Nombre científico: Annona muricata L.
Origen
Se han encontrado plantas en estado silvestre tanto en Antillas como en diversos puntos de la Amazonía, por lo que el centro de origen puede ser compartido entre varios lugares. La presencia es principalmente como forma domesticada, lo que no facilita la precisión de la zona de origen. La guanábana fue cultivada por las culturas precolombinas en la costa peruana. (GUZMÁN, 1992)
Descripción.
Planta de tallo grueso, con altura aproximada de cuatro a ocho metros con
pocas ramas.
Adaptación.
Climas tropicales y subtropicales, con suelos profundos de textura mediana.
Formas de utilización.
Fruta para preparar bebidas y planta para usos medicinales.
2.1.1.2. DESCRIPCIÓN BOTÁNICA Y HÁBITAT
Nombre común:
7
Sinonimia científica aceptada
Annona bonplandiana H.B.K., Annona cearensis Barbosa Rodríguez, Anonna
macrocarpa auct.nom. Barbosa rodri: werkle, Anonna muricata var.
Borinquensis Morales, Gunabanus muricatus L. (GUZMÁN, 1992).
Descripción botánica
Árbol de porte pequeño, de cuatro a ocho metro, tronco recto, copa que puede tener pocas ramas o ramificaciones bajas casi verticales. El árbol de guanábana, presenta una altura variable que oscila entre los 7 y los 11 m, aunque dependiendo de su manejo puede alcanzar altura superiores. Un árbol producido por semilla (vía sexual) presenta los siguientes partes:
LA COPA así se denomina al sistema aéreo de la planta conformado por el
tronco, el sistema de ramificación y el sistema foliar. (DUKE., VÁSQUEZ, 1994).
Figura N° 01. Planta de Annona muricata L. ANNONACEAE. “Guanábana”.
Fuente: CAVALCANTE., 1991.
8
Hojas alternas simples, brillantes en el has y amarillentas en el envés, oblongas a aovadas, sub coriáceas, 5 a 15 cm de largo por 2 a 6 cm de ancho, ápice acuminado y base aguda.
Flores solitarias o en pares que nacen a lo largo de la rama o del tronco, amarillas, tres sépalos y seis pétalos en dos verticilos; los tres pétalos externos de 2 a 3 cm de largo y muy ancho (2 a 4cm) y coriáceos. Los tres pétalos internos grandes también alternos con los primeros. El receptáculo es grande y pubescente, con numerosos estambres en la base y ovario en la parte superior.
Las flores se abren al amanecer cuando las anteras están iniciando la expulsión del polen; los pétalos externos caen algunas horas después y los internos pueden caer juntos o durar algunos días más. (GÓMEZ, 1999.)
Los frutos es un sincarpo ovoide, a menudo asimétrico (encorvado) debido a la polinización deficiente de los carpelos en el lado cóncavo (asimetría que también puede ser efecto de ataque de insectos), de 15 a 40 cm de largo por 10 a 20 cm de diámetro, pesa de 3 a 4kg.
Cáscara verde oscura brillante, delgada, con areolas que presentan un pequeño apículo carnoso en el centro, aunque existen variedades de frutos casi lisos. La pulpa es blanca, jugosa, aromática, sabor agridulce. Las semillas ovoides y aplanadas son numerosas, miden 1,5 a 2,0 cm y tienen color
9
Figura N° 02. Fruto de Guanábana
Fuente: CAVALCANTE., 1991.
2.1.1.3. ORIGEN:
La guanábana (Annona muricata L.), originaria de América y África tropical,
pertenece al género Guanabaní. La fruta es climatérica, considerada cómo tropical exótica, con características sensoriales excelsas que le brindan un potencial para su utilización bien cómo producto fresco o transformado
(CHAPARRO et al,1992; PINTO, 2006).
2.1.1.4. ECOLOGÍA Y ADAPTACIÓN.
10
lluvias en esta fase produce la caída de las flores. Los suelos más adecuados son los profundos, de textura media, sin problemas de drenaje y con adecuado nivel de nutrientes. Las plantas sembradas en suelos deficientes en calcios y fosforo y con alta saturación por aluminio, generalmente no fructifican bien. Desarrolla mejor suelo con pH mayor a 6.0. (GUZMÁN, 1992).
2.1.1.5. MÉTODOS DE PROPAGACIÓN.
El método más utilizado para propagar la guanábana es por semilla, se conoce la tecnología para su injerto por el método inglés de doble lengüeta, aunque también se utiliza el de yema con astilla y el de escudete. Las yemas deben provenir de ramas que tengan más de un año de edad. Las semillas tomadas de planta de buena productividad y buena condiciones sanitarias (descartar las atacadas por broca). Deben ser lavadas hasta eliminar el mucilago y secadas a la sombra por dos o tres días. Estas semillas guardadas en recipientes herméticamente cerrados conservan su variabilidad por varios meses. Para sembrar las semillas, estas deben ser remojadas en agua por doce horas y después colocadas a 5 cm entre si y 2 cm de profundidad en germinadores de 1.2 m de ancho por 0.20 m de profundidad de sustrato. En
promedio se utiliza 500g de semillas/m2, equivalente a 1,160 semillas. Las
11
2.1.1.6. PERSPECTIVA DE MEJORAMIENTO DEL CULTIVO.
Diversidad genética:
Debido a la dicogamia que favorece la polinización alogama, existe mucha diversidad genética en la especie. Esta diversidad se manifiesta en plantas cuyos frutos tienen pulpa dulce, algo agridulce y agridulce. Frutos con formas redondas, cordiformes y oblongas. Frutos con pulpas suaves a consistente. Frutos que la maduración mantienen la cáscara verde y frutos cuya cáscara se forma pardo oscuro. Frutos con areolas notorias y frutos con areolas no muy notorias. (BRAKO y ZARUCHI, 1993)
2.1.1.7. FORMAS DE UTILIZACIÓN Y COMERCIALIZACIÓN
Al igual que las otras anonáceas, la guanábana se consume como fruta fresca, pero mayormente se utiliza en forma industrializada como helados, jugos y néctares. El sabor agridulce característico, así como su aroma, le confiere buena aceptación. En el Perú las variedades cultivadas en la Amazonía tienen preferencia para la industrialización por su mayor sabor agridulce, con la relación a las variedades cultivadas con riego en la costa desértica. (BRAKO y ZARUCHI 1993).
2.1.1.8. OTRAS INVESTIGACIONES
Existen diversos estudios sobre la anonacina, el compuesto de la guanábana que tendría efectos anticancerosos, sin embargo, esos estudios fueron
solamente realizados in vitro o in vivo en animales, no existiendo aún ningún
estudio clínico, en humanos.
12
Un investigación in vitro realizados en conjunto por la Facultad de Farmacia y
Bioquímica de la Universidad Nacional Mayor de San Marcos y la Universidad Peruana Cayetano Heredia mostró que un extracto etanólico de
hojas de Annona muricata L tiene un efecto citotóxico sobre los tipos C678 y
H460 de cultivos de líneas celulares de adenocarcinoma gástrico y pulmonar. (PETKOVA, 2007)
2.1.2. CLASIFICACIÓN TAXONÓMICA, Annona muricata L. GUANÁBANA
Tabla N°01. Clasificación taxonómica.
Annona muricata L. Guanabana
División: Magnoliophyta
Sub clase: Archylamudeae
Orden: Magnoliales
Familia: Anonaceae
Tribu: Annoneae
Género: Annona
Fuente: CALDERÓN 1992.
2.1.2.1. CARACTERÍSTICAS.
La Annona muricata, guanábana o graviola, es un árbol de hoja perenne
13
Las propiedades de la annona muricata, nombre científico de la guanábana,
han sido muy estudiadas a partir de los beneficios que ofrecen las hojas de este árbol, conocidas como graviola, en el tratamiento del cáncer. A pesar de que no se habla habitualmente de sus contraindicaciones, sus principios activos producen determinados efectos que es conveniente que conozcas, antes de consumirla (ESCOBAR y SANCHEZ, 1992).
En Filipinas, las frutas jóvenes aun blandas con semillas se usan como
14
2.1.2.2. PROPIEDADES ALIMENTARIAS DE LA GUANÁBANA.
¿Qué propiedades tiene la guanábana?
Es conocida popularmente como guanábana este árbol frutal tiene su origen en Perú y pertenece a la familia de las Anonáceas, tiene mucha similitud con lo que es la chirimoya aunque su sabor es distinto, parecido pero no igual, la guanábana ha sido introducida en muchos países a pesar de ser originaria del Perú ya la tenemos en nuestro país. El fruto debe cortarse cuando la guanábana ha alcanzado su madures esto es algo muy notorio ya que el fruto pierde algo de su color verde oscuro y se torna un poco más opaco y su brillo disminuye, sus espinas se tornan más suaves y flexibles. Debemos evitar el cortar las guanábanas cuando están tiernas ya que una guanábana tierna no madurara bien y su sabor será amargo y nada agradable.
El fruto de la guanábana es de forma ovoide, algo curvo en su extremo inferior y de forma irregular muchas veces tiene forma de corazón aunque esto sucede rara vez, la fruta puede alcanzar entre los 10 hasta los 40 centímetros de largo cuando la fruta está muy bien desarrollada y llegan a pesar algunas hasta los 4 kilos su cáscara no es gruesa, es delgada, y cuando está madura lo es aún más, con pequeñas puyitas que no son puntiagudas ni causan algún dolor al cortar la fruta ya que estas espinas son flexibles, por dentro su pulpa es muy aromática y blanca como el algodón, cremosa muy
suave y jugosa por dentro sus semillas se encuentran cubiertas por la pulpa,
15
La pulpa de la guanábana está constituida principalmente por agua; además proporciona sales minerales, potasio, fósforo, hierro, calcio, lípidos, tiene un alto valor calórico debido a la presencia de hidratos de carbono; además es
rica en vitamina C y provitamina A, así como de vitamina B. (BARBOSA et
al., 1981).
La pulpa de la fruta puede consumirse en jugo o en agua y suele ser diurética, las hojas se pueden consumir en té al igual que la corteza del árbol, las semillas pulverizadas sirven como repelente de insectos untándoselas en la piel, el agua de las hojas de la guanábana también está indicado contra los piojos, es muy importante tener en cuenta que la guanábana a pesar de ser de un sabor agradable no por ello debe consumirse demasiada sino ir poco a poco es decir si lo toma en jugo deberá de tomar media taza en ayunas durante una semana esto es para que su cuerpo se vaya acostumbrando a los ingredientes que contiene y que no le caiga pesada, otra cosa que también debemos de tomar en cuenta es que la primera toma es decir la toma que se hace en ayunas es la más importante del día debido a que el organismo está vacío y por ello se aprovecha mejor cuando es tomado como tratamiento para combatir el cáncer. Deberá hacer tres tomas al día antes de cada alimento pero siempre recordando que es en forma de menos a más.
Las hojas de la guanábana son buenísimas cuando se está enfermo de paperas pero las hojas tienen que suavizarse ya sea hirviendo agua y metiéndolas un poco para poder suavizarlas o asándolas después de esto se ponen en las paperas con la ayuda de un paño esto ayudara a desinflamarlas más rápidamente. Las hojas de la guanábana son excelentes cuando la persona
16
2.1.2.3. PROPIEDADES MEDICINALES DE LA GUANÁBANA.
En los últimos años, el extracto de guanábana ha llegado a ser ampliamente aclamado por tener supuestas propiedades altamente potentes para combatir el cáncer. Las propiedades de la guanábana han sido estudiadas no sólo en el tratamiento del cáncer, sino también en otras enfermedades, ya que además de los beneficios de las hojas, tanto la corteza y semillas, como las flores y frutos han demostrado poseer propiedades en el tratamiento de diversos trastornos de salud.
La guanábana es buenísima para prevenir las gripes y cuando ya se tiene la enfermedad ayuda a la recuperación de esta y descongestiona el pecho para esto basta con cocer tres hojas de guanábana y un puñito de flores de la misma y el té se toma endulzado con miel, recuerden nunca endulcen un té con azúcar refinada nunca ya que lo natural es lo mejor y más cuando se está enfermo, convaleciente o se padece alguna enfermedad. El fruto de la guanábana cuando se consume en verde es muy bueno contra la ictericia (coloración amarillenta de la piel, mucosas y conjuntivas oculares).
Para esto basta con cortar la fruta cuando todavía no está madura cortar tres trozos pequeños los cuales se les quitaran las semillas y se licuaran para después ser colado para poder consumirse, se puede endulzar con miel para hacer un poco más agradable su sabor ya que cuando la fruta no está madura tiende ser un poco amargo su sabor.
El té de las hojas es bueno para contener las hemorragias internas se hace un
té con tres hojas de guanábana siempre endulzado con miel. (BARBOSA et al,
17
2.2. INVESTIGACIONES SOBRE EL TEMA
La Universidad San Martin de Porres (USMP), realizó una investigación sobre la capacidad oxidante y principales ácidos fenólicos y flavonoides de algunos alimentos, siendo las materias primas los siguientes: huacatay, olluco, aguaymanto y tumbo, donde se ácido clorogénico, ácido ferullico, ácido cafeíco, el flavonoide rutina, así mismo encontraron quecirtina y morina. Se evaluó la capacidad antioxidante y se determinó el coeficiente de inhibición al 50% del radical libre DPPH. Siendo el huacatay el producto más potente en este aspecto, seguido del
aguymanto, tumbo y olluco. (MUÑOZ et al, 2011).
18
2.3. COMPOSICIÓN QUÍMICA Y SUS PROPIEDADES
Tabla N° 02 Composición nutricional en 100g de pulpa fresca de la guanábana
comparaciones bibliográficas.
Compuesto Cantidad
1 2 3
Calorías 53.1-61.3
Agua 82.8g 78.0 a 82.0 78.2 a 82.0
Carbohidratos 14.63g
Grasas 0.97 g 0.2 a 0.3
Proteínas 1.0 g 0.6 a 1.2 0.6 a 1.2
Fibra 0.6g 3.7 a 4.2 1.6 a 3.2
Azucares totales 11.5 a 17.9
Azucares reductores 6.8 a 15.1 11.5 a 17.9
Pectinas 0.4 a 0.9 0.4 a 0.9
Cenizas 0.6 0.6
Minerales (mg)
Calcio 10.3 mg
Fosforo 27.7 mg 4.0 28
Hierro 0.64 mg
Potasio 3.4 3.4
Vitamina (mg)
Tiamina B1 0.11 mg 0.7 0.07
Niacina B3 1.28 mg
Riboflavina B2 0.05 mg 0.7 0.07
Ácido ascórbico C 29.6 mg 22.0 22 a 25
Ácido pantotenico B5 2.5 0.9
19
2.3.1. CARACTERIZACIÓN FÍSICO-QUÍMICA DE LAS FRUTAS
El conocimiento acerca de la evolución de las características físico-químicas en las frutas es de máxima importancia, ya que estos factores de la pos cosecha, determinan aspectos tan relevantes cómo, calidad sensorial, calidad comercial, calidad nutricional e índice de madurez, en general los vegetales tipo frutas y hortalizas son de naturaleza compleja y poseen exclusivas cualidades en lo referente a patrón de crecimiento, color, forma, densidad aparente y real y composición; en este último aspecto sobresalen diferentes ácidos y azúcares, normalmente expresados cómo concentración de sólidos solubles totales (SST), también son importantes aportantes de fitoquímicos o metabolitos secundarios de acción nutraceútica, los cuales evolucionan con los procesos de maduración
(CHARLEY 1991; CHAPARRO et al. 1992; LANDWEHR y TORRES, 1995;
TEJACAL, 2007).
2.3.2. FRUTAS COMO FUENTE DE ANTIOXIDANTES
Los alimentos, además de sus funciones plásticas y energéticas, tienen la facultad de proteger estructuras ante la formación de radicales libres este proceso, que constituye la oxidación celular que deriva de la aparición de estos radicales, va ligado tanto al envejecimiento fisiológico en general como a una serie de enfermedades (cardiovasculares, degenerativas, Alzheimer, Parkinson, así como distintos tipos de cáncer),los antioxidantes presentes en los alimentos pueden ayudar a prevenir algunos de estos procesos, pero también a paliar o enlentecer algunas de estas enfermedades. (MONTSE, 2007)
20
oxidativo real de un organismo. No se trata de consumir el mayor número posible de antioxidantes, sino que hay que ingerir la cantidad adecuada según cada situación, ya que el exceso de vitaminas podría originar también enfermedades. Por ello, se recomienda seguir una dieta equilibrada. Por otra parte, son también importantes los hábitos de vida, como el ejercicio físico, evitar el tabaquismo, el estrés o la contaminación ambiental, así como un exceso en la exposición solar. (MONTSE, 2007).
Algunos componentes existentes en las frutas pueden actuar como estimuladores del sistema inmunológico, moduladores de síntesis de colesterol y de la reducción de la presión sanguínea (LAMPE, 1999); la ingestión de frutos silvestres provoca un impacto positivo en la salud del corazón, además de
auxiliar en el combate de ciertas dolencias cardiovasculares,
neurodegenerativas, envejecimiento, obesidad y de ciertos tipos de cáncer, tales como del esófago y gastrointestinal (SEERAM, 2008).
2.4. ANTIOXIDANTES 2.4.1. DEFINICIÓN
Los antioxidantes son fuertes agentes reductores debido a las propiedades de óxido reducción de sus grupos hidroxilo y las relaciones estructurales entre diferentes partes de su estructura química, poniendo fin a la reacción en cadena, estabilizando así al átomo, que ha estado intentando encontrar una pareja para su electrón desparejado. (CHALLEM y RUEDA, 2008).
21
2.4.2. CLASIFICACIÓN DE LOS ANTIOXIDANTES
Los antioxidantes se clasifican en primarios, secundarios y terciarios, en dependencia de su mecanismo de acción o función, también se los clasifica según el sitio donde ejercen su acción y según su origen. (CESPEDES, 2000).
2.4.2.1. SEGÚN SU FUNCIÓN
2.4.2.1.1. PRIMARIOS
Previenen la formación de nuevos radicales libres, convirtiéndolos en moléculas menos perjudiciales antes de que puedan reaccionar o evitando la formación de radicales libres a partir de otras moléculas.
(BIRUETE et al., 2009).
Por ejemplo:
Superóxido dismutasa (SOD): convierte O2 en peróxido de hidrógeno.
Glutatión peroxidasa (GPX): convierte el peróxido de hidrógeno y los
peróxidos lipídicos en moléculas inofensivas antes de que formen radicales libres.
Proteínas de unión a metales (Ferritina, Ceruloplasmina): Limitan la
disponibilidad de Fe necesaria para formar el radical OH. (BAEZA et al,
1997; PETKOVA, 2007).
2.4.2.1.2. SECUNDARIOS
Capturan los radicales libres, evitando la reacción en cadena. Por ejemplo
Vitamina E, vitamina C, ácido úrico, albúmina. (YEN et al., 1997).
2.4.2.1.3. TERCIARIOS
Reparan las biomolecular dañadas por los radicales libres. (YEN et al.,
22
2.4.2.2. SEGÚN SU SITIO DE ACCIÓN.
Los antioxidantes impiden que otras moléculas se unan al oxígeno, al reaccionar-interactuar más rápido con los radicales libres del oxígeno y las especies reactivas del oxígeno que con el resto de las moléculas presentes, en un determinado microambiente –membrana plasmática, citosol, núcleo o líquido extracelular. Como encontramos en la tabla Nro. 03. (VENEREO, 2002). Las enzimas intracelulares son responsables del atrapamiento de
radicales libres producidos in situ como resultados del metabolismo celular.
(ARANCETA, 2007).
Las sustancias antioxidantes extracelulares están ampliamente distribuidas en el reino vegetal y pueden desempeñar un papel en la prevención de la aterosclerosis, teóricamente, porque protegen a las lipoproteínas de la oxidación en el líquido extracelular. (ARANCETA, 2007).
Tabla N°03. Clasificación de los antioxidantes según el sitio ejercen su acción.
INTRACELULAR MEMBRANA EXTRACELULAR
Superóxido dismutasa Vitamina E Ceruloplasmina
Catalasa Betacarotenos Tranferina
Peroxidasa Ubiquinol-10 Lactoferina
DT-deafarasa Albuminas
GSH Haptoglobina
Proteínas que ligan metales Vitamina
Sistemas proteolíticos Ácido úrico
Vitamina Vitamina E
Fuente: ARANCETA, 2007.
2.4.2.3. SEGÚN SU ORIGEN
23
Tabla N°04. Clasificación de los antioxidantes.
Fuente: MOYA, 2009
2.4.3. IMPORTANCIA DE LAS ENZIMAS COMO ANTIOXIDANTES
Hace unas tres décadas se descubrió que existe una enzima en nuestras células cuya única función aparente es la eliminación de un radical libre formado a partir del oxígeno y conocido con el nombre de Superóxido. Hasta entonces se pensaba que los radicales libres eran tan malos que producirlos nuestras células; pero la presencia de esta enzima, la superóxido dismutasa (SOD), demostró lo contrario, ya que cuando los glóbulos blancos se encuentran con una bacteria, producen superóxido para eliminarla, protegiéndonos de la infección. Fue así como se llegó a la conclusión de que en nuestra relación con el oxígeno también se forman radicales libres derivados del simple hecho de respirar y que su
presencia no está relacionada exclusivamente con el deterioro. (BAEZA et al,
1997)
2.5. ACTIVIDAD ANTIOXIDANTE
2.5.1. RADICALES LIBRES
Los radicales libres (RL) o más modernamente llamados especies reactivas de Oxígeno (ERO), son moléculas que tienen un número impar de electrones, su otro nombre se debe a que la mayor parte de los radicales libres de interés derivan del oxígeno. Esta peculiaridad química les hace muy reactivos y forma la base de su posible toxicidad. (HERNANDEZ, 1989).
EXOGÉNOS ENDÓGENOS COFACTORES
Vitamina E Glutatión Cobre
Vitamina C Coenzima Q Zinc
Betacaroteno Ácido fólico Manganeso
Flavonoides Enzimas: Catalasa
Superoxido dismutasa
24
2.5.1.1. FORMACIONES DE LOS RADICALES LIBRES
Los mismos se forman por fuentes endógenas y exógenas.
Hablando de las fuente endógenas, la mitocondria es el principal productor de las ERO, ya que la respiración celular se verifica específicamente a este nivel. Como se sabe el 90% del total del oxígeno inhalado se consume en la mitocondria y alrededor del 2% del oxígeno reducido se transforma en el
radical superóxido (O2·). (TUERNES, 1994).
Otra fuente de este radical son los fagocitos activados que producen el superóxido como mecanismo protector frente a agentes u organismos extraños. Dentro de las fuentes exógenas tenemos: Ambientales (tabaco, radiación electromagnética, luz solar, ozono etc.), farmacológicas (xenobióticos, drogas etc.), nutricionales (contaminantes, aditivos, etc.). (ARANCETA, 2007).
La peroxidación lipídica se relaciona con la formación de radicales libres, reactivos e inestables a nivel de la membrana celular, con reacciones en cadena subsiguiente que dan pie a oxidación y muerte celular. De particular importancia son las reacciones mediadas por radicales libres que traen como
consecuencia la peroxidación lipídica. La formación de cierta tasa de
25
2.5.2. ESTRÉS OXIDATIVO: PAPEL ENVEJECIMIENTO Y REACTIVIDAD DE LOS RADICALES LIBRES.
La reactividad de los radicales libres formados durante los procesos metabólicos normales, les permite inducir un amplio espectro de reacciones nocivas para el organismo humano, se crea un estrés oxidativo que se produce cuando el aumento del contenido intracelular de EROS sobrepasa las defensas antioxidantes de la célula, a través del cual se induce daño a moléculas biológicas ya que atacan a los lípidos y proteínas de la membrana celular por lo que la célula no puede realizar sus funciones vitales (transporte
de nutrientes, eliminación de desechos, división celular). (AVELLO, 2006;
BELLO, 2005)
Figura N°03. Transporte de nutrientes.
Fuente:SÁNCHEZ, 2011
2.6. SISTEMA DE DEFENSA DE ANTIOXIDANTE
2.6.1. RX ENZIMÁTICO DE LA DEFENSA ANTIOXIDANTE Y MECANISMO DE ACCIÓN Y CLASIFICACIÓN DE LOS ANTIOXIDANTES.
Los mecanismos de defensas antioxidante comprenden componentes enzimáticos y no enzimáticos a través de los cuales la célula anula la reactividad y/o inhibe la generación de radicales libres como se ilustra en la Figura No. 3. Conociéndose como antioxidante a las sustancias que cuando están presentes retardan o inhiben la oxidación de sustratos susceptibles al ataque de las ERO
(SÁNCHEZ, 2011). Para protegerse de los daños oxidativos, los organismos han
26
incluyen a las proteínas secuestrando ERO y materiales de transición, vitaminas C, E y enzimas antioxidantes especializadas, sin embargo cuando los sistemas antioxidantes defensivos del organismo se ven superados por la actividad antioxidante dañina de los radicales aparece un estrés oxidativo iniciador de situaciones patológicas con una mayor o menor trascendencia sobre la salud.
(BELLO, 2005; QUINTERO, 2010.)
Figura N° 04. Mecanismo De Defensa Antioxidante
Fuente:BOVERI, 1999
27
La otra línea de defensa son los antioxidantes endógenos y los exógenos, los cuales ofrecen electrones con gran afinidad para los oxidantes y que estos reaccionen con el antioxidante en lugar de que reaccionen y oxiden a las macromoléculas. (BELLO, 2005).
Todos estos mecanismos y respuestas condicionan el estrés oxidativo inducido por el insulto oxidativo y la calidad y cantidad de ambos determina el daño oxidativo resultante. (ESCORZA y CALDERÓN, 2009).
2.6.2. IMPORTANCIA DE LOS ANTIOXIDANTES EXÓGENOS
28
2.7. VITAMINA C
El ácido ascórbico o vitamina C es el antioxidante más abundante en los tejidos vegetales, su concentración es el orden de mili molar, aunque hay que tener en cuenta que el contenido de AA varía en función del tipo de tejido, del estado fisiológico de la planta, así como de las condiciones medioambientales. Los mayores niveles de AA se encuentran en tejidos fotosintéticos, frutos y órganos de almacenamiento y su contenido es mayor en tejidos jóvenes que en adultos.
(NOCTOR y FOYER, 1998; SMIRNOFF, 2000).
El ácido ascórbico, este es un compuesto químicamente sencillo, es un derivado lactónico del ácido hexurónico y se corresponde con una forma oxidada de la glucosa. En concreto es una cetolactona de seis átomos de carbono que muestra un anillo de lacona de cinco miembros y un grupo enediol bifuncional con un grupo carbonilo adyacente. El grupo enediol es esencial para su actividad biológica. (GIL, 2010).
Es un potente agente reductor que es capaz de neutralizar radicales libres en
sistemas biológicos. A pH fisiológico la forma predominante es el ascorbato.
A nivel celular, el AA se encuentra en el citosol, cloroplasto, vacuola, mitocondria y apoplasto. Sus niveles son especialmente elevados en el citosol y en los cloroplastos y su concentración oscila entre 10 y 20 M, respectivamente. (SMIRNOFF, 2000).
La acción antioxidante del AA es bien conocida. Así, este compuesto
1. Reacciona directamente con O2-, OH y O2• El ácido ascórbico puede actuar
reduciendo al O2- dando lugar a H2 O2 y dehidroascorbato (DHA) de acuerdo con
la reacción:
29
El ascorbato también es un secuestrador eficiente del oxígeno singlete y es capaz de reaccionar con los radicales OH y con el peróxido de hidrogeno, según la reacción:
2H++ascorbato+ H2 O2 →2 H2 O+DHA
2. Regenera la vitamina E, mediante la reducción del radical tocofeoxil en un ciclo
redox en el cual se transfiere un solo electrón según la ecuación (SHARMA Y BUETTNER, 1993): Ascorbato +vitamina E →Monodeshidroascorbato + Vit. E
3. Es esencial en la protección de enzimas que poseen metales de transición como
grupos protéticos (PADH, 1990). Por todo ello, el ácido ascórbico se considera un antioxidante muy eficiente aunque no debe ignorarse que en algunas circunstancias, como en presencia de metales traza y en condiciones de pH adecuadas, puede actuar como pro-oxidantes e incluso tener efectos mutagénicos (HALLIWELL, 2001) a forma disociada, el anión ascorbato (AA) es la predomínate a pH fisiológico (5-7).
El primer producto de la oxidación del AA es un radicas libre similar a las semiquinonas denominado monodehidroascorbato (MDHA). El MDHA dismuta espontáneamente a AA y deshidroascórbico (DHA). Además de su actividad antioxidante, el ácido ascórbico actúa como cofactor de un gran número de enzimas – dioxigenasas implicadas en diversas rutas metabólicas clave y participa en la regulación de diversas regulaciones de la fotosíntesis, la expansión celular y
el ciclo celular. (NOCTOR YFOYER, 1998; ARRIGONI Y DE TULLIO, 2000;
SMIRNOFF, 2000; SMIRNOFF Y WHEELER, 2000; DE QUEIROS PINTO, 1984;
POTTERS et al., 2004; TOKUNAGA et al., 2005).
30
de los neutrófilos como consecuencia de procesos inflamatorios o infecciosos. La vitamina C neutraliza al hipoclorito, potente oxidante generado por la mieloperoxidasa producida por los neutrófilos y los monocitos activados. (GIL, 2010).
2.8. COMPUESTOS FENÓLICOS
Los compuestos fenólicos de las plantas forman un grupo químicamente heterogéneo de unos 10.000 compuestos: algunos son solubles sólo en solventes orgánicos, otros son ácidos carboxílicos y glicósidos solubles en agua, mientras que otros son grandes polímeros muy insolubles. La fórmula general AR-OH, donde
AR es un anillo aromático y el –OH está directamente unido a este anillo, son
caracterizados por un núcleo bencénico que lleva uno o varios grupos hidroxilos. (FLANZY, 2003.)
Actúan como antioxidantes naturales, esta actividad puede variar significativamente dependiendo de ciertas variables como su concentración, la estructura química de la molécula y su grado de oxidación en cuanto a la concentración se ha encontrado que aún con cantidades pequeñas de antioxidantes, algunos antioxidantes fenólicos entran a la circulación sistémica y causan un aumento significativo en el estado antioxidante del plasma. (RAMIREZ, 2004.)
2.8.1. ACTIVIDAD BIOLÓGICA DE LOS COMPUESTOS FENÓLICOS
31
antioxidantes fenólicos naturales se correlaciona con una reducción de las enfermedades coronarias. Dietas ricas en compuestos fenólicos se asocian con mayor expectativa de vida. Estas propiedades incluyen actividad anticáncer, antiviral, antinflamatoria, efectos sobre la fragilidad capilar y habilidad para inhibir la agregación de las plaquetas humanas. (PALADINO, 2009).
2.8.2. ACTIVIDAD ANTIOXIDANTE DE LOS FENOLES EN LOS ALIMENTOS
Los taninos también son una fuente importante de antioxidantes. Debido a su presencia ubicua en los alimentos de origen vegetal, los humanos consumen compuestos fenólicos a diario. El rango de consumo es de 25 mg a 1g por día dependiendo del tipo de dieta (frutas, vegetales, granos, té, especias). En dosis muy elevadas, más de un 5% contenido en los alimentos o más de 100 mg/diarios, puede resultar tóxico, pues pueden provocar alguna alteración digestiva, como dolor de estómago, diarrea, falta de apetito, sangre en la orina,
etc. (SAMANIEGO 2007;TORREZ 2012.).
32
2.8.3. CLASIFICACIÓN DE LOS COMPUESTOS FENÓLICOS
Su clasificación está basada sobre la distinción entre compuestos no flavonoides
y flavonoides. Estos últimos tienen esqueleto en C6-C3-C6. Los polifenoles
incluyen también a los derivados (ésteres, metil ésteres, glicósidos, etc.) que resultan de las sustituciones de la estructura base. (FLANZY, 2003; RAMIREZ, 2004).
2.8.3.1. LOS COMPUESTOS NO FLAVONOIDES
Esta denominación abarca a los ácidos fenoles, divididos en ácidos benzóicos y ácidos cinámicos, portadores de una cadena lateral insaturada, pero también a otros derivados fenólicos como los estilbenos. (FLANZY, 2003)
Los fenoles libres y los ácidos fenoles se consideran en un mismo grupo, ya que generalmente se identifican simultáneamente durante el análisis de las plantas. La estructura básica de los ácidos fenólicos es un anillo aromático con un grupo carboxilo. Los ácidos de la serie benzoica, tales como el gálico, el vainillínico, el p-hidroxibenzoico son abundantes en las espermatofitas y los helechos. En el caso de la serie cinámica, los ácidos cinámicos (cafeíco, ferúlico, p-cumárico y sináptico) raramente se encuentran libres y en general se hallan en forma de derivados. (CASTILLO, 2007).
2.8.3.2. FLAVONOIDES
Flavo proviene del latín flavus y significa de color entre amarillo y rojo,
constituyendo la mayoría de los colores amarillo, rojo y azul de las plantas y frutas.
33
benceno; ya sea directamente o por puente de hidrógeno, formando así un tercer anillo en el centro, el cual puede tener cinco o seis miembros.
(ESCAMILLA et al., 2009.).
Se han caracterizado más de 5000 flavonoides que existen en la naturaleza proveniente de varias plantas; se clasifican en varios subgrupos de acuerdo a la posición del sustituyente sobre el anillo C. Tanto el estado de oxidación del anillo heterocíclico como la posición del anillo B, son importantes para la clasificación. Están los principales subgrupos de flavonoides que son: chalconas, flavonas, flavonoles, flavanonas, antocianinas e isoflavonoides.
(ESCAMILLA et al., 2009).
2.8.3.2.1. DETERMINACIÓN DE FLAVONOIDES
34
2.8.3.2.2 ACCIÓN ANTIOXIDANTE DE LOS FLAVONOIDES
La capacidad de los polifenóles vegetales para actuar como antioxidantes en los sistemas biológicos fue ya reconocida en los años treinta; sin embargo, el mecanismo antioxidante fue ignorado en gran medida hasta hace poco tiempo. El creciente interés en los flavonoides se debe a la apreciación de su amplia actividad farmacológica. Pueden unirse a los polímeros biológicos, tales como enzimas, transportadores de minerales
tales como Fe2+, Cu2+, Zn2+, catalizar el transporte de electrones, y
depurar radicales libres. Debido a este hecho se han descrito efectos protectores en patologías tales como diabetes mellitus, cáncer, cardiopatías, infecciones víricas, úlcera estomacal y duodenal e inflamaciones. Otras actividades que merecen ser destacadas son sus acciones antivirales y antialérgicas, así como sus propiedades
antitrombótica y antiinflamatorias. (GRYGLEWKI et al., 1987).
Los criterios químicos para establecer la capacidad antioxidante de los flavonoides, son:
• Presencia de estructura O-dihidroxi en el anillo B; que confiere una mayor estabilidad a la forma radical y participa en la deslocalización de los electrones.
• Doble ligadura, en conjunción con la función 4- oxo del anillo C.
• Grupos 3- y 5-OH con función 4-oxo en los anillos A y C necesarios para ejercer el máximo potencial antioxidante.
35
potente acción protectora está relacionada directamente con su
lipofilicidad. (SESTILI et al., 2002).
2.8.3.2.3. ESTRUCTURA DE FLAVONOIDE.
Se conocen como diez clases de flavonoides, todos contienen quince átomos de carbono en su núcleo básico y están arreglados bajo un sistema
C6-C3- C6, en el cual dos anillos aromáticos llamados A y B están unidos
por una unidad de tres carbonos que pueden o no formar un tercer anillo, que en casi de existir es llamado anillo C.
Los flavonoides se encuentran generalmente en mezclas como agliconas y/o glucósidos; en muchos casos, debido a la complejidad de la mezclas es más frecuente el estudio de estos compuestos bajo la forma de agliconas para lo cual los extractos deben hidrolizarse previamente. (LOCK, 1997). Para su estudio sistemático los más de 4000 flavonoides naturales se han clasificado en varias clases de acuerdo con las variantes estructurales que presenta la cadena central. De acuerdo con esto los flavonoides se clasifican en varios grupos: Chalconas, flavonas, flavonoles, flavanonas, flavanonoles, antocianidinas, catequinas, epicatequinas, auronas, isoflavonoides, pterocarpanos, rotenoides, etc. (MARTÍNEZ, 2005).
2.8.3.3. ANTOCIANINAS
Las antocianinas (del griego anthos = flor; kyanos = azul oscuro) son flavonoides (tipo flavanos) comúnmente encontrado en la naturaleza, más tarde se descubrió que no solo el color azul, sino también el púrpura, violeta y magenta, y que todos los tonos de rojo, rosado, escarlata, que aparecen en muchas flores, frutos y algunas hojas y raíces de plantas, se deben a pigmentos químicamente similares a los antocianinas.
36
Las antocianinas está basadas químicamente en una única estructura aromática, la cianidina para la aglicona, y todas ellas se consideran derivadas de ella por adición o sustracción de grupos hidroxilo, por metilación o por glicosidación. Son intensamente coloreadas y solubles en agua.
Las antocianinas como pigmentos naturales inocuos tienen considerable potencial en la industria alimentaria; pero a diferencia de los pigmentos rojos sintéticos rojos sintéticos que se utilizan actualmente, las antocianinas no son estables especialmente en soluciones neutras y alcalinas, con cambios en el procesamiento y almacenaje de la materia prima con pérdidas de color, oscurecimiento del producto y formación de precipitados.
Son sensibles a las variaciones de pH, a pH 3 el pigmento está presente como sales de flavilo de color rojo, a pH 8 es color violeta y a pH 11 es de color azul. Las antocianinas juegan un rol importante en la producción de vinos, siendo la “enocianina” responsable del color que se utilizan para intensificar el color de los vinos y en colorantes de alimentos como jugos, jamones y licores.
Su función en las plantas el ser atrapadores de insectos y pájaros para los procesos de polinización y diseminación de semillas, son antioxidantes, fotoprotectores (reduce la fotoinhibición), mecanismo de defensa (antifeed), cumple una función ecológica (fenómeno de la simbiosis).
37
forma exponencial, formándose las chalconas y productos incoloros y después degradadas a colores marrones.
Se conoce también degradación por enzimas y ataque no enzimáticos, polimerización. La presencia de otros compuestos puede contribuir a la estabilidad de las antocianinas.
La actividad biológica está asociado como un potente antioxidante, previene la oxidación del ácido ascórbico con la captura de los radicales libres; tiene actividad inhibitoria de las enzimas oxidativas de esa manera reduce el riesgo de cáncer y enfermedades del corazón.
2.8.3.4. DETERMINACIÓN DE TANINOS
El método de la vainillina se usa ampliamente para la cuantificación de proantocianidinas (taninos condensados) en frutas y granos. El ensayo de la vainillina es específico para flavan-3-ol, dihidrochalconas y proantocianinas, las cuales tienen un enlace simple en la posición 2,3 y poseen grupos hidroxilos en la posición meta del anillo B. La catequina es un flavan-3-ol monomérico frecuentemente usado como un estándar en el ensayo de la vainillina. El metanol, disolvente usado para el ensayo de la vainillina, puede afectar la cinética de reacción de la catequina y taninos con vainillina diferencialmente.
El ensayo de la vainillina en metanol es más sensible para los taninos poliméricos que para los flavan-3-oles monoméricos. Este ensayo es generalmente reconocido como un método útil para la detección y cuantificación de taninos condensados en plantas debido a su sensibilidad, especificidad y simplicidad. Sin embargo, debe ser considerada la posibilidad de interferencias con dihidrochalconas y antocianinas.
38
concentración óptima de reactantes y disolventes son elegidos (SHAHIDI y NACZK, 1995).
Este método se basa en la condensación de la vainillina con proantocianinas en una solución acidificada. La vainillina protonada, un electrófilo débil, reacciona con el anillo del flavonoide en la posición 6 u 8. El producto de esta reacción se deshidrata fácilmente para dar un color rosa ligero a un intenso rojo cereza. La estabilidad del color del aducto vainillina-tanino puede incrementarse cuando la luz es excluida y la temperatura de reacción es controlada y entonces se obtienen resultados exactos y reproducibles (SHAHIDI y NACZK, 1995).
2.8.3.4.1. ACTIVIDAD ANTIOXIDANTE DE TANINOS
Numerosos taninos, sobre todo los taninos hidrolizables, inhiben la peroxidación lipídica inducida por ADP y ácido ascórbico sobre mitocondrias hepáticas de rata in vitro, son (sobre todo los esteres HHDP de la glucosa) captadores de radicales libres, inhibidores de la formación del ion superóxido y algunos de ellos, inhibidores de la lipoxigenasa – pero no de la ciclooxigenasa- de los granulocitos peritoneales de rata. Algunos de ellos poseen un efecto inhibidor de la autoxidación del
linoleato de metilo. In vivo, la geraniína disminuye la concentración sérica
39
2.8.3.4.2. ESTRUCTURA Y ESTABILIDAD
Las antocianinas están consideradas en el grupo de los flavonoides, ya que
poseen el esqueleto característico C6-C3-C6 y el mismo origen biosintético,
pero absorben fuertemente en la región visible del espectro.
Hay 6 antocianinas comunes, siendo la cianidina la más común y responsable del color magenta, los colores rojo-naranja se deben a la pelargonina, mientras que los colores violeta y azul a la delfinidina.
Los azúcares presentes comúnmente está la glucosa, galactosa, ramnosa, xilosa y arabinosa y como disacáridos a la rutinosa, sambubiosa, soforosa, gentiobiosa y latirosa.
Las antocianinas aciladas están siendo descritas con mayor frecuencia en los últimos años, como sustituyentes alifáticos, aromáticos y azúcares; siendo los principales grupos acilantes los ácidos fenólicos como p-cumárico, cafeíco, ferúlico o sinápico y algunas veces los ácidos acéticos, malónico y p-hidroxibenzoico preferentemente en el azúcar del C-3.
2.9. ENSAYO DEL DPPH (1,1-DIFENIL-2-PICRIL-HIDRAZILO) (BERSET el al.,
1994)
Este método fue propuesto por BLOIS (1958) en el cual se demostró por primera vez la capacidad del radical libre DPPH● para aceptar un átomo de hidrógeno
40
reacciona con el sustrato antioxidante que puede donar un átomo de hidrógeno el color violeta se desvanece. El cambio de color es monitoreado espectrofotométricamente y es utilizado para la determinación de los parámetros para las propiedades antioxidantes. Después de aproximadamente tres décadas este ensayo comenzó a utilizarse rutinariamente para la caracterización de las propiedades antioxidantes. El procedimiento original para el ensayo DPPH● ha sido adoptado por muchos laboratorios y a pesar de que existen modificaciones a conveniencia, ha revelado que la mayoría de los estudios están basados en un tiempo de reacción de 20-30 min en vez de un tiempo de reacción total de 120 minutos requerido para alcanzar el estado estacionario y completar la reacción
redox (OJHA et al., 2012).
2.9.1. LOS RESULTADOS DEL ENSAYO DPPH
La mayoría de los estudios expresan los resultados como el valor de la
concentración máxima de la media inhibitoria (IC50), definido como la cantidad
de antioxidante necesario para disminuir la concentración inicial de DPPH al 50%. Este valor se calcula graficando el porcentaje de inhibición contra la concentración del extracto. Para extractos de plantas o compuestos puros el
valor IC50 cambia de acuerdo a la concentración final del DPPH● usado (DENG
et al., 2011). El ensayo DPPH tiene algunas desventajas que limitan su
aplicación, entre estas se encuentran:
-La diferencia en el mecanismo de reacción que normalmente ocurre entre antioxidante y radicales peroxilo.
41
evidencia en el tiempo necesario para determinar el IC50 que van en un rango de
1.15 min (Ácido ascórbico) a 103 min (Rutina).
-La reacción cinética entre el DPPH: y los antioxidantes no es lineal con la concentración de DPPH, por lo cual es arbitrario medir la capacidad
antioxidante usando IC50.
-La reacción de DPPH: con eugenol fue reversible, lo que podría resultar en falsas lecturas (bajas) para la capacidad antioxidante de muestras que contengan eugenol y otros fenoles que guarden un tipo de estructura similar.
2.10. PARÁMETROS DE MEDICIÓN
2.10.1. LA TRANSMITANCIA (T)
Es la relación entre la intensidad de radiación transmitido por una muestra (I) y
la intensidad de radiación que incide sobre la muestra (I0), medidos ambos en la
misma posición del espectro y con la misma rendija, T = I / I0 Se supone que el
haz es de radiación paralela y que incide sobre las superficies planas y paralelas de la muestra, formando ángulos rectos. (MANFRED, 1999).
2.10.2. LA ABSORBANCIA (Aº)
Es el logaritmo en base diez del recíproco de la transmitancia (T), en el que el
disolvente puro es el material de referencia; esto es, Aº = log10 1/T = - log10 T.
42
en una gran variedad de frecuencias o energías. Esta absorción se refleja en el espectrógrafo en forma de picos. No se deben tomar medidas de absorbancias muy bajas o muy altas puesto que disminuye la exactitud del método. La absorbancia es adimensional y generalmente se presenta con mínimo tres decimales, algunos instrumentos permiten obtenerla con cuatro decimaleS. (MANFRED, 1999).
2.10.3. LONGITUD DE ONDA
La distancia entre dos puntos consecutivos de una onda que tienen el mismo estado de vibración. La longitud de onda (λ) representa un concepto fundamental en la resolución de cualquier tipo de movimiento ondulatorio, y puede variar de valores muy grandes por ejemplo, cientos de metros para radio ondas largas a valores muy pequeños por ejemplo, de millonésimas de millón (10-12) para los rayos gamma. Las crestas y los valles son aquellos lugares en los que el movimiento transversal es máximo.
43
2.10.4. ÍNDICE DE ABSORBANCIA
Es el cociente de dividir la absorbancia (Aº) entre el producto de la concentración de la sustancia (c), expresada en gramos por litro, y la longitud de la trayectoria de la energía luminosa (b) expresada en centímetros.
No debe confundirse con los términos extinción específica o con el coeficiente de extinción. En otro medio distinto al vacío la velocidad de propagación es menor y la relación de la velocidad de propagación en el vacío a la velocidad en
cualquier otro medio, vi, es lo que se conoce como índice de refracción:
(MANFRED, 1999).
2.10.5. CURVA ESPECTRAL
Curva espectral de una sustancia química indica las características de absorción de dicha sustancia con relación a la longitud de onda. En muchas ocasiones la curva espectral se presenta como Absorbancia vs longitud de onda y el espectro se denomina espectro de absorción, o en función de la transmitancia, denominándose el espectro, espectro de transmisión. Resulta de la retención de cantidades discretas de energía radiante por la capa de material interpuesta en la trayectoria de la radiación, aunque la energía absorbida corresponde a una misma longitud de onda se observa una banda de absorción y no líneas, así la curva del espectro está constituida por las lecturas que realiza el aparato para reproducir un gráfico en función de una longitud de onda específica, con el fin de apreciar los trazos que capta el espectrofotómetro.
44
coeficiente de absorbidad molar, de la absorbancia A, o de la transmitancia T, en función de la longitud de onda origina el "espectro" o curva espectral de una sustancia química que indica las características de absorción de dicha sustancia con relación a la longitud de onda.
45
46
III. METODOLOGÍA
3.1. LUGAR DE EJECUCIÓN
El presente trabajo se desarrolló en la Planta Piloto, los Laboratorios de Análisis Físico- Químico de Alimentos, Laboratorio de Control de Calidad de Alimentos, Laboratorio de Ingeniería de Alimentos y Laboratorio de Biotecnología.
3.2. MATERIA PRIMA
La materia prima es la guanábana (Annona muricata L.), la cual es una fruta ovoide
grande de color verde con espinas suaves grandes, la cual fue adquirida en el Centro Experimental “El Dorado”del INIA, carretera Iquitos-Nauta Km. 24.
3.3. MATERIALES, EQUIPOS Y REACTIVOS
Los materiales y equipos utilizados en el trabajo de investigación se muestran en las siguientes tablas.
Tabla N° 05.Tabla de materiales.
01. Probetas de 10ml, 100ml y 250 ml 02. Pipetas graduada 50ml y 1ml 03. Placas Petri
04. Buretas de 25 ml y 50ml 05. Mortero y pilón
06. Cuchillos 07. Cucharas
08. Vaso de precipitado 09. Matraz Erlenmeyer 10. Soporte universal 11. Matraz aforado 50 ml 12. Crisoles
47
Tabla N° 06. Equipos
N° Equipos Marca Modelo Procedencia
01 Balanza Analitica Max=
07 Potenciometro Hanna Checker Rumania