UNIVERSIDAD NACIONAL JORGE BASADRE GROHMANN - TACNA
FACULTAD DE CIENCIAS
Escuela Profesional de Biología Microbiología
“BIODECOLORACIÓN DE TINTES SINTÉTICOS INDUSTRIALES POR BACTERIAS TERMÓFILAS CON ACTIVIDAD ENZIMÁTICA TIPO
LACASA”
TESIS
Presentada por:
Bach. Fiorela Virginia Salazar Torreblanca
Para optar el Título Profesional de:
BIÓLOGO MICROBIÓLOGO
TACNA – PERÚ
i
DEDICATORIA
A Dios, por ser mi luz en este camino;
ii
AGRADECIMIENTOS
Al Mgr. Roberto Castellanos Cabrera, mi asesor, por su confianza y apoyo incondicional, guiándome en el desarrollo de la presente investigación y todas sus enseñanzas.
A todos los integrantes del grupo de investigación INCIBIOL, que me acogieron desde el primer día en el laboratorio y con quienes compartí momentos hermosos en estos dos años de camino: Nesstor, Luis, Leylla, Helena, Cristina, Sergio y especialmente a Julissa, Ariadna, Israel, Mirella, José y Heber por estar siempre ahí dispuestos a escucharme y brindarme una palabra de aliento cuando más lo necesitaba.
A los profesores de los laboratorios de Biología, Química Inorgánica, Biotecnología, por permitirme hacer uso de su establecimiento y brindarme las facilidades durante la etapa experimental.
A la Universidad Nacional Jorge Basadre Grohmann de Tacna, por brindarme el co-financiamiento de tesis para optar el título de pregrado con fondos del Canon, Sobrecanon y regalías mineras en la Convocatoria 2015-I.
iii
ÍNDICE DE FIGURAS viii
RESUMEN x
I. INTRODUCCIÓN 1
1.1. Planteamiento del problema 3
1.2. Hipótesis 4
1.5.2. Efluentes del destintado de papel reciclado 9
1.5.3. Tratamientos biológicos 10
1.5.4. Bacterias termófilas 13
1.5.5. Actividad enzimática tipo lacasa 15 II. MATERIALES Y MÉTODOS
2.1 Materiales
2.1.1 Material biológico 20
2.1.2 Reactivos 20
2.1.3 Material de laboratorio 21
iv
2.1.5 Material de escritorio 22
2.1.6 Equipos 23
2.2 Métodos
2.2.1 Ubicación y delimitación del área de estudio 24
2.2.2 Población y muestra 24
2.2.3 Diseño de investigación 25
2.2.4 Evaluación de la actividad enzimática tipo lacasa de las
bacterias termófilas 26
2.2.5 Selección del cultivo bacteriano termófilo con el mayor potencial para la decoloración de tintes sintéticos en
pruebas de tubos de ensayos 30
2.2.6 Caracterización bioquímica e identificación molecular del
cultivo seleccionado 32
2.2.7 Determinación de las cinéticas de remoción durante el tratamiento con la bacteria termófila seleccionada 35 2.2.8 Determinación de la cinética de decoloración del efluente
simulado durante el tratamiento con la bacteria termófila
seleccionada 38
III. RESULTADOS
3.1 Evaluación de la actividad enzimática tipo lacasa 40 3.2 Selección del cultivo bacteriano termófilo con el mayor
potencial para la decoloración de tintes sintéticos 45 3.3 Caracterización bioquímica e identificación molecular del cultivo
seleccionado 50
v
3.5 Cinética de remoción del efluente simulado durante el tratamiento con la bacteria termófila seleccionada 62
IV. DISCUSIÓN 66
V. CONCLUSIONES 75
VI. RECOMENDACIONES 76
VII. REFERENCIAS BIBLIOGRÁFICAS 77
vi
ÍNDICE DE TABLAS
Tabla 1. Operacionalización de las variables 25
Tabla 2.Tintes textiles y tintas de impresión utilizadas en el ensayo del
potencial de decoloración 31
Tabla 3.Principios y componentes del sistema RapID STR 34
Tabla 4.Condiciones del tratamiento biológico según el tinte sintético
utilizada 35
Tabla 5. Porcentajes del tinte sintético utilizado 36
Tabla 6.Tinción Gram de las bacterias termófilas con potencial para la
decoloración de tintes sintético 41
Tabla 7.Características macroscópicas de las colonias de bacterias
termófilas seleccionadas 43
Tabla 8.Actividad enzimática tipo lacasa de bacterias termófilas en
medio sólido 44
Tabla 9.Selección del cultivo bacteriano termófilo con mayor potencial de decoloración de tintes sintéticos a las 24 horas 46
Tabla 10.Resultados del sistema RapID STR para la bacteria termófila
vii
Tabla 11.Resultados del reporte del BlastN para el secuenciamiento del ARN 16S de la bacteria termófila TM-12 51
Tabla 12.Análisis de varianza de los tratamientos para la decoloración de la tinta ciano por la bacteria TM-12 55
Tabla 13.Pruebas de múltiples rangos para las concentraciones de tinta de impresión ciano según el método de Fisher 56
Tabla 14.Resultados de remoción de tintes sintéticos obtenidos por decoloración con bacteria termófila TM-12 61
Tabla 15.Resultados de remoción del efluente mixto simulado por decoloración con la bacteria termófila TM-12 66
viii
ÍNDICE DE FIGURAS
Figura 1.Ciclo catalítico de la lacasa, tomada de Baldrian, 2006 18
Figura 2.Oxidación del 2,6 – dimetoxifenol catalizada por una lacasa en su correspondiente quinona, tomada de Sanchez-Amat y
Solano, 1997 19
Figura 3.Gráfico de porcentajes de las categorías de la evaluación de la actividad enzimática tipo lacasa en medio sólido 45
Figura 4.Gráfico de barras de la selección del cultivo bacteriano termófilo con mayor potencial de decoloración de tintes
sintéticos 50
Figura 5.Curva de remoción del tratamiento biológico con la bacteria
termófila TM-12 para rojo de Congo 52
Figura 6.Curva de remoción del tratamiento biológico con la bacteria termófila TM-12 para la tinta de impresión magenta 53
Figura 7.Curva de remoción del tratamiento biológico con la bacteria termófila TM-12 para la tinta de impresión negra 54
ix
Figura 9.Espectros de absorción del tratamiento biológico con la bacteria termófila TM-12 para el rojo de Congo 58
Figura 10.Espectros de absorción del tratamiento biológico con la bacteria termófila TM-12 para la tinta de impresión magenta 58
Figura 11.Espectros de absorción del tratamiento biológico con la bacteria termófila TM-12 para la tinta de impresión negra 59
Figura 12.Espectros de absorción del tratamiento biológico con la bacteria termófila TM-12 para la tinta de impresión ciano 60
Figura 13.Curva de crecimiento de la bacteria termófila TM-12 durante el tratamiento biológico para el efluente simulado 62
Figura 14.Curva de remoción del tratamiento biológico con la bacteria termófila TM-12 para el efluente simulado 63
x RESUMEN
En este trabajo se investigó la capacidad de decoloración de las bacterias termófilas del cepario del Laboratorio de Bioquímica con actividad enzimática tipo lacasa sobre tintes sintéticos industriales especialmente tintas de impresión que se liberan en los efluentes industriales en el momento del destintado del papel reciclado.
Por tal motivo, se seleccionaron los cultivos bacterianos termófilos CB-13, CB-25, FT-6 y TM-12, que presentaron mayor actividad enzimática tipo lacasa en medio sólido para los cuatro sustratos evaluados (2-MP; 2,6 – DMP; ABTS y SRG). Y entre ellos, se eligió a TM-12 por presentar el mayor potencial para la decoloración de tintes sintéticos en pruebas de tubos de ensayo, el cual fue identificado bioquímica y molecularmente como Geobacillus sp.
1
I. INTRODUCCIÓN
En la actualidad existen más de diez mil diferentes tintes sintéticos que se utilizan en diversos procesos industriales, desde la coloración de alimentos o cosméticos hasta la imprenta e industria textil, cuyas propiedades físicas y químicas son mejoradas para que sean más estables a los factores ambientales y permanezcan por más tiempo en el producto final. Sin embargo, se ha originado un grave problema ambiental debido al incremento de la resistencia de estos tintes sintéticos a los métodos convencionales de degradación por agentes químicos y biológicos (Robinson et al., 2001; Chacko & Subramaniam, 2011), lo que ocasiona que permanezcan durante largos periodos de tiempo en el medio ambiente sin poder controlar las consecuencias adversas para los seres vivos y el ecosistema por su naturaleza tóxica y mutagénica (Chung & Cerniglia, 1992; Ratna & Padhi, 2012).
La presencia de estos tintes en los vertidos industriales se debe a las ineficiencias en el teñido, se pierde alrededor del 15% de estos compuestos en los efluentes textiles (Wesenberg et al., 2003; Zaharia & Suteu, 2011) y al realizar el destintado del papel reciclado se contaminan los efluentes de las papeleras con pigmentos y colorantes de las tintas de impresión (Sulbarán, Turrado, Delgado, Rojas & Venditti, 2014), generándose cada año cientos de toneladas de estos efluentes contaminados con tintes sintéticos.
2 empleados son efectivos, resultan demasiado costosos por las grandes cantidades de reactivos y catalizadores que se emplean o requieren una disposición final de los residuos peligrosos que originan con gastos adicionales de operación (Ghoreishi & Haghighi, 2003; Crini, 2006).
Frente a este reto, la biotecnología aporta alternativas eficientes y amigables con el medio ambiente empleando la degradación biológica, (Verma & Madamwar, 2003). En este campo, los hongos, son los organismos más estudiados ya que degradan compuestos aromáticos complejos a través del sistema enzimático lignolítico conformado por peroxidasas y lacasas. No obstante, el tratamiento con hongos requiere condiciones de acidez, para la actividad óptima de sus enzimas y periodos largos de retención hidráulica para la decoloración completa (Banat, Nigam, Singh & Marchantl, 1996; Swamy & Ramsay, 1999); además, pueden inhibir el crecimiento de otros
microorganismos útiles. Por estas desventajas, las aplicaciones a gran
3
tiempo, favoreciendo su empleo a escala industrial por los amplios rangos de pH que presentan dichos efluentes y teniendo en cuenta que los microorganismos termófilos presentan propiedades fisicoquímicas óptimas para el uso industrial como amplios rangos de pH y termoestabilidad (Sheikhi, Ardakani, Naeimeh & Rodriguez-Couto, 2012). Este trabajo propone aprovechar las ventajas metabólicas de las bacterias termófilas estudiando la biodecoloración de los tintes sintéticos presentes en las tintas de impresión como una estrategia en el tratamiento de los efluentes procedentes del destintado industrial.
1.1. Planteamiento del problema
Frente a la búsqueda de nuevas tecnologías eficaces y económicamente rentables para la disminución de la contaminación de los tintes sintéticos presentes en los efluentes industriales, se plantea la siguiente interrogante: ¿Es posible la biodecoloración de tintes sintéticos industriales mediante un tratamiento con bacterias termófilas con actividad enzimática tipo lacasa?
1.2. Hipótesis
De acuerdo al problema planteado, se presenta la siguiente hipótesis:
4 1.3. Justificación
Al seleccionar una bacteria termófila con actividad enzimática tipo lacasa y determinar la cinética de degradación de cuatro tintes sintéticos presentes en los efluentes de la industria papelera, así como la cinética de un efluente simulado, se aportará información básica necesaria para cumplir con el objetivo final del proyecto:
TRATAMIENTO BIOTECNOLÓGICO CON ENZIMAS
TERMOESTABLES BACTERIANAS PARA EL DESTINTADO DEL PAPEL PERIÓDICO Y DE OFICINA EN SU PROCESO DE RECICLADO” (N° 099-2015-FONDECYT), del cual forma parte la presente tesis.
Además se podrá extrapolar los datos obtenidos a volúmenes mayores en biorreactores contribuyendo con una alternativa que tiene grandes posibilidades en su aplicación a escala industrial por ser un tratamiento biológico amigable con el medio ambiente y de bajo costo económico.
5 1.4. Objetivos
1.4.1. Objetivo general
Evaluar la biodecoloración de tintes sintéticos por bacterias termófilas con actividad enzimática tipo lacasa.
1.4.2. Objetivos específicos
Determinar la actividad enzimática tipo lacasa de las bacterias termófilas del cepario del Laboratorio de Bioquímica.
Seleccionar el cultivo bacteriano con el mayor potencial para la decoloración de tintes sintéticos en pruebas de tubos de ensayo.
Caracterizar e identificar molecularmente el cultivo seleccionado.
Determinar las cinéticas de remoción de tintes sintéticos durante el tratamiento con la bacteria termófila seleccionada
6 1.5. Marco teórico
1.5.1. Tintes sintéticos
La Sociedad de Tintoreros y Coloristas (SDC) y la Asociación Americana de Químicos Textiles y Coloristas (AATCC) publican desde 1924 el Colour Index, la guía mundial definitiva para los tintes esenciales, definidos como los colorantes o pigmentos responsables de otorgar color a un producto en ausencia de aditivos.
7
Siguiendo estas definiciones y considerando el origen de estas sustancias, en el presente trabajo se le denomina “tinte sintético” a toda sustancia que imparte color a un sustrato por absorción selectiva de la luz y que han sido obtenidas por síntesis química de otras sustancias como el benceno, naftaleno, antraceno, sosa cáustica, ácidos inorgánicos, aminas aromáticas, quinonas, etc.
El color de los tintes sintéticos es debido a la estructura cromógeno-cromóforo (aceptor de electrones), y la capacidad de afinidad a las fibras es debido a grupos auxócromos ionizables (donantes de electrones). El cromógeno se constituye a partir de una estructura aromática normalmente basada en anillos de benceno, naftalina, o antraceno, a la que están vinculados cromóforos que contienen enlaces conjugados dobles con electrones deslocalizados representados por los grupos azo, etileno, metino, carbonilo, carbono-nitrógeno, carbono-azufre, nitro o nitrozo. En cambio, los grupos auxócromos son ionizables y habitualmente son: -NH2 (amino), -COOH (carboxilo), -SO3H (sulfonato) y -OH (hidroxilo) (Suteu, Zaharia, & Malutan, 2011; Welham, 2000).
1.5.1.1. Tintes azoicos
8
Representan del 65-70 % de la producción total de los colorantes, debido a que son los tintes más utilizados industrialmente en una amplia gama de colores (rojo, azul, naranja, negro, amarillo); además, poseen alta estabilidad y su porcentaje de fijación es superior al 98 %. En la imprenta, los tintes azoicos están presentes principalmente en las tintas de impresión de color magenta y amarillo.
El litol rojo es uno de los colorantes azoicos que se utiliza normalmente como color estándar del magenta en los procesos de impresión a color. Su popularidad se debe a su gran intensidad de color, buenas propiedades de trabajo, sombra brillante y muy bajo precio, por lo que se continúa utilizando fórmulas mejoradas del mismo.
9 1.5.1.2. Tintes ftalocianinas
Son una familia de tintes sintéticos que pertenece a al grupo de las cianinas de cadena cerrada en el que dos átomos de nitrógeno están unidos por una cadena polimetina Los dos nitrógenos son cada parte independientemente de un heteroaromático, tales como pirrol (Kim & Bum, 2010).
Los tintes ftalocianinas de cobre y sus derivados son los pigmentos azules y verdes más utilizados y fabricados. Debido a su color único y propiedades de los que son difíciles de reproducir en otros pigmentos, fueron ingresados al mercado desde 1935 conservándose las dos formas de síntesis sin modificaciones (Peters & Freeman, 1995).
1.5.2. Efluentes del destintado de papel reciclado
10
El promedio aproximado de efluentes generados de la producción de papel gráfico a partir de fibra reciclada de papel de oficina es de 32 – 46 galones de agua por tonelada de pulpa recuperada (Bajpai, 2004). Esta cantidad dependen principalmente de la calidad del papel reusado empleado como materia prima y el destino final de la fibra recuperada.
Estos efluentes se caracterizan por sus valores elevados de DBO, sólidos suspendidos y pH debido a que contienen fibras perdidas, arcilla, material de recubrimiento, y otros productos químicos como hidróxido sódico, silicato sódico, carbonato sódico, hipoclorito sódico), junto a partículas dispersas de tinta de impresión (Hodge & Morgan, 1947; Nemerow & Dasgupta, 1998).
1.5.3. Tratamientos biológicos para la decoloración de tintes sintéticos
11
contaminantes orgánicos del agua, mas no la degradación final de estos y la decoloración del efluente.
Por otra parte, los métodos biológicos son una alternativa ambiental y económicamente sostenible para el tratamiento de aguas residuales contaminadas con tintes sintéticos, las cuales se depositan en lagunas de oxidación o biorreactores de membrana aerobios en las que se mantienen cultivos microbianos en suspensión agrupados en flóculos, tras un tiempo de retención, la biomasa generada pasa a un sedimentador secundario, cuya función es separar el efluente depurado de los lodos. Parte de los lodos se recirculan de nuevo al reactor, con objeto de mantener una concentración determinada de microorganismos y el resto, denominados lodos en exceso, se purgan periódicamente (Zaharia & Suteu, 2011).
12
La aireación suministra el oxígeno necesario para que se produzcan las reacciones de oxidación realizadas por los microorganismos, lográndose de este modo descomponer los compuestos orgánicos a su forma inorgánica en un proceso conocido como mineralización, obteniéndose como productos finales al dióxido de carbono, agua, nitrógeno amoniacal o nitratos, ortofosfatos y sulfuros característicos de la oxidación aeróbica de carbohidratos y lípidos; sin embargo, no se aplica a muchos compuestos aromáticos que tienen masa molecular alta, estado de oxidación alto y son estables bioquímicamente como los compuestos azoicos, antraquinónicos o ftalocianinos presentes en los tintes sintéticos.
Muchos estudios sobre la degradación biológica de tintes sintéticos afirman que se requiere de un sistema integrado aerobio y anaerobio o viceversa, dependiendo de las capacidades oxidorreductoras de los microorganismos presentes en los flóculos, el tipo de tinte sintético desechado y el producto final deseado.
13
es la oxidación aerobia de los compuestos azoicos con la escisión de los radicales disponibles como hidroxilo (-OH), amino (NH2), metilo (-CH3) o metoxilo (-OCH3) por lacasas y lignina-peroxidasas fúngicas o bacterianas a su correspondiente quinona o peróxidos (Chivukula & Renganathan, 1995; Abadulla et al., 2000). Esta última vía se considera como la más óptima, ya que las aminas aromáticas generadas por reducción tienen un alto potencial cancerígeno y mutagénico causando un daño mayor que el tinte sintético inicial (Raffi, Franklin & Cerniglia, 1990; Chung & Cerniglia, 1992). Por lo tanto, la oxidación por lacasas podría desintoxicar la decoloración de los tintes sintéticos porque los enlaces azo se rompen liberando nitrógeno molecular, lo cual impide que se formen las aminas aromáticas.
Se ha reportado que la estabilidad celular y la capacidad catalítica de los microorganismos pueden decrecer considerablemente debido a las características de los efluentes industriales que presentan tintes sintéticos (Deivea et al., 2010). Por esta razón, se requiere la presencia de microorganismos que prosperen en condiciones extremas.
1.5.4. Bacterias termófilas
14
nuevas especies con rutas metabólicas con la capacidad de degradar compuestos xenobióticos y contaminantes como los colorantes y lograr superar el enorme desafío un tratamiento biológico completo.
Existe una subclasificación dentro de este grupo donde los termófilos crecen a una temperatura óptima de 45-70 °C como
Bacillus acidocaldarius y Bacillus stearothermophilus, los termófilos extremos entre 70-80 °C como Thermus aquaticus y
Thermoanarobacter ethanolicus; mientras que la temperatura óptima de los hipertermófilos es por encima de los 80 °C como
Thermotoga marítima y Pyrococcus furiosus (Pedroza, 2001).
La habilidad de los microorganismos termófilos para vivir en altas temperaturas está basada en el metabolismo, la estructura y la función celular de sus componentes celulares (Stetter, 1999); principalmente, la membrana celular, la cual tiene un alto porcentaje de ácidos grasos insaturados con elevados puntos de fusión dependiendo de la temperatura de crecimiento, lo que les confiere gran flexibilidad y estabilidad térmica a la membrana celular (Pedroza, 2001).
15
conocidas como proteínas del choque térmico; son producidas por estos microorganismos, las cuales ayudan, después de su desnaturalización, a replegar las proteínas a su forma nativa y restaurar sus funciones (Haki & Rakshit, 2003).
1.5.5. Actividad enzimática tipo lacasa
Las lacasas son enzimas oxidorreductasas (EC 1.10.3.2, p-difenol:oxigeno-oxidoreductasa) que se caracterizan por su baja especificidad de sustrato y amplio rango de compuestos susceptibles de ser oxidados por estas enzimas, así se incluye a mono y polifenoles, aminofenoles o fenoles sustituidos con grupos metilo, metoxilo así como poliaminas aromáticas y algunos iones metálicos (Giardina et al., 2010).
Lo que dificulta definir la actividad lacasa es el solapamiento de sustratos en la oxidación de los ortodifenoles junto a otras dos enzimas fenoloxidasas: la tirosinasa (EC
1.18.14.1, cresolasa, monofenol o monooxigenasa,) y la catecol
oxidasa (EC 1.10.3.1, o-difenol:oxigeno-oxidoreductasa), por lo cual, se han realizado diversos estudios para diferenciar dichas enzimas. Algunos autores afirman que la oxidación de L-tirosina es una actividad única para tirosinasas y catecol oxidasas
16
Lo que llevó a considerar la oxidación de la siringaldazina junto a la incapacidad para oxidar la tirosina como indicadores de la actividad enzimática de las lacasas. Sin embargo, en el estudio de su actividad enzimática se recomienda incluir como sustratos específicos a la siringaldazina, ABTS o catecol, para los que la lacasa tiene una alta afinidad, y algunos para el que ella tiene poca o ninguna afinidad como tirosina (Edens, Goins, Dooley & Henson, 1999; Shin & Lee, 2000).
1.5.5.1. Estructura físico-química
Estas oxidasas multicobre son generalmente glicoproteínas monoméricas que contienen aproximadamente 500 aminoácidos dispuestos en 3 dominios tipo β-barril ensambladas para modelar tres distintos sitios de unión catalíticos espectroscópicamente distintos (Ferraroni et al., 2007).
Generalmente las lacasas contienen un centro mononuclear tipo-1 (T1) de cobre que se encarga de la oxidación del sustrato, un centro tipo-2 (T2) y dos centros tipo-3 (T3) con Cu2 y Cu3 dispuestos en un centro trinuclear, el cual se encarga de reducir el oxígeno molecular (Claus, 2004; Baldrain, 2006)
17
La diferencia entre ambas se presenta en la carente absorción alrededor de 610 nm de las lacasas amarillas/blancas que siempre se encuentra en las azules, también, lacasas amarillas/blancas oxidan sustratos no fenólicos en ausencia de moléculas mediadoras que se requieren en casos de lacasas azules. Por lo tanto, muchos autores afirman que las lacasas amarillas/blancas, son mejores biocatalizadores que las azules (Kumar, Lata & Kumar, 2013).
1.5.5.2. Mecanismo de acción
La teoría de Messerschmidt (1997) señala que al oxidarse los sustratos por el cobre T1, los electrones extraídos se transfieren, probablemente a través de un motivo tripéptido fuertemente conservado His-Cis-His hacia al sitio T2/T3, para que el oxígeno molecular sea reducido a agua (Figura 1).
18
Figura 1. Ciclo catalítico de la lacasa, tomada de Baldrian, 2006.
Los sustratos fenólicos que presentan grupos funcionales metoxilo (-O-CH3), al ser oxidados por lacasas, catalizan la remoción del átomo de hidrógeno del grupo hidroxilo del monofenol sustituido con metoxilos (Giardina et al., 2010). Generalmente, 2,6 - dimetoxifenol sufre la oxidación de un solo electrón y
produce especies de para-radicales de
2,6-dimetoxi-fenoxilo; entonces, se produce una recombinación de dos
19
Mientras que en la oxidación del 4,4’-[azinobis (metanilalidina)]bis(2,6- dimetoxifenol) (siringaldazina) a su correspondiente quinona, 4,4’- [azinobis(metanilalidina)] bis(2,6-dimetoxiciclohexa- 2,5 dien-1-uno), se observa su capacidad de reorganizar sistemas electrónicos conjugados (Figura 2–B).
20
II. MATERIALES Y MÉTODOS
2.1. Materiales
2.1.1. Material biológico
Las cepas bacterianas termófilas estudiadas fueron aisladas de los Geiseres de Calientes ubicados a 4300 msnm en la provincia de Candarave, departamento de Tacna; por el grupo técnico del Laboratorio de Bioquímica de la Facultad de Ciencias, Universidad Nacional Jorge Basadre Grohmann.
2.1.2. Reactivos
2-metoxifenol (2-MP o guayacol)
2,6 - dimetoxifenol ( 2,6 – DMP o Siringol)
2,2'- azinobis - bis-(3-etillbenzotiazolinosulfanato) (ABTS)
3,5-dimetoxi-4-hidroxibenzalazino (Siringaldazina)
Acetato de sodio
Ácido acético glacial
Agar base
Alcohol etílico de 96°
Azul brillante de remazol R (RBBR)
Azul de toluidina
Cristal violeta
Fosfato dibásico de sodio anhidro (Na2H2PO4)
Fosfato monobásico de sodio anhidro (NaH2PO4)
21
2.1.3. Material de laboratorio
Algodón hidrofílico
Asa de Kolle metálica con mango de baquelita
Caja para puntas de plástico de 100 ul
Caja para puntas de plástico de 1000 ul
Cámara de conteo Petroff Haussen
Espátula doble
Fiolas de vidrio fusible de 25 ml y 50 ml
Frascos de polietileno con tapa rosca
Gradilla de polipropileno para tubos de ensayo, 15 ml
Gradilla de polipropileno para microtubos de base cónica de 2 y 1,5 ml
Guantes de látex
Mascarilla N90 desechable
Matraces de vidrio Erlenmeyer de 50, 100 y 250 ml
Mechero bunsen
Micropipetas de volumen variable de 5 a 50 ul
Micropipetas de volumen variable de 100 a 1000 ul
22
Membrana de ultrafiltración PM 10
Rollo de polietileno aislante
Papel aluminio
Placas Petri
Probetas de vidrio graduadas de 20, 50 y 100 ml
Puntas de plástico para micropipetas de 10 ul
Puntas de plástico para micropipetas de 100 ul
Puntas de plástico para micropipetas de 1000 ul
Táperes de plástico cuadrado de 1,8 L
Táperes de plástico rectangular de 3 L
Tubos cónicos de centrífuga de 15 ml y 50 ml
Tubos de ensayo de 13 x 100 mm
2.1.4. Materiales de aseo y limpieza
Detergente líquido
Desinfectante de ácido fosfórico
Escobillas
Jabón bacteriológico
Lejía (Hipoclorito de sodio)
Papel toalla
2.1.5. Material y útiles de oficina
Marcadores permanentes
Cintas masking tape (24 mm x 40 m)
Cuaderno de notas
23 2.1.6. Equipos
Agitador magnético
Autoclave
Balanza analítica, precisión 0,001 gramos
Cámara de recuento Petroff Haussen, HAUSSER SCIENTIFI, Modelo 3900- 3298S22
Centrífuga para tubos de 15 ml
Espectrofotómetro UV – Vis, UNICO Modelo 2102
Estereoscopio con aumento 10X WF
Horno esterilizador, GEMMY Modelo YCO-010
Incubadora bacteriológica, GEMMY Modelo IN – 010
Microcentrífuga EPPENDORF 5418
Microscopio óptico
Microondas
ph-metro digital de bolsillo
Refrigeradora
Vortex Mixer LABNET
2.2. Métodos
2.2.1. Ubicación y delimitación del área de estudio
24 2.2.2. Población y muestra
2.2.2.1. Población
La población la constituye las 120 cepas bacterianas termófilas aisladas en los Géiseres de Calientes, Candarave – Tacna, en los años 2014 y 2015 que pertenecen al cepario del Laboratorio de Bioquímica de la Facultad de Ciencias. De estas cepas se obtuvieron 12 cultivos que mostraron actividad tipo lacasa con las que se trabajó en la presente tesis.
2.2.2.2. Muestra
Es una investigación descriptiva sin técnica de muestreo, por lo que no se define una muestra estadística.
La muestra quedará representada por las 11 cepas bacterianas termófilas que han mostrado tener actividad tipo lacasa sobre los sustratos utilizados en el presente estudio.
25 2.2.3. Diseño de la investigación
En el presente trabajo se realizó una investigación básica – descriptiva para llevar a cabo los objetivos específicos planteados, en la cual cada cultivo bacteriano termófilo corresponde a una unidad experimental de la cual se evaluó como respuesta la biodecoloración de tintes sintéticos (Tabla 1).
Tabla 1. Operacionalización de las variables
26
concentraciones de tinta diferentes empleando un diseño completamente al azar y se determinó si existe diferencia significativa entre los tratamientos. Los tres tratamientos se aplicaron a nueve unidades experimentales, de tal forma que a tres unidades experimentales les correspondió un tipo de tratamiento, siendo la variable respuesta a medir la decoloración del tinte.
La hipótesis nula (H0) fue que los efectos de las concentraciones de tinta (tratamientos, β) son todos iguales, mientras que la hipótesis alterna (H1) planteó que hay al menos un efecto de tratamiento que es diferente a los demás.
Lo que se expresó como:
H0: β1= β2 = β3 H1: β1 β2 β3
2.2.4. Evaluación de la actividad enzimática tipo lacasa de las bacterias termófilas
2.2.4.1. Reactivación de las bacterias termófilas del cepario del Laboratorio de Bioquímica
27
Bertani (10 g de peptona, 5 g levadura y 5 g de cloruro de sodio en 1 L de agua destilada), se incubaron durante 18 horas a 60 °C.
2.2.4.2. Caracterización microscópica y macroscópica de las bacterias termófilas
Las bacterias termófilas reactivadas en caldo Luria Bertani fueron caracterizados microscópicamente, para lo cual se realizó tinción Gram registrando el carácter tintorial, la morfología y la disposición de cada una de las bacterias reactivadas por observación en el microscopio con aceite de inmersión con aumento de 1000X.
28
Luego las bacterias fueron sembradas en viales con agar LB inducido sulfato de cobre 0.15 mM para su
conservación bajo refrigeración a - 4 °C.
2.2.4.3. Evaluación de la actividad enzimática tipo lacasa en medios sólidos
Los ensayos de placa son una determinación rápida de la producción de la enzima lacasa en los microorganismos, por lo cual, se siguió el método de Sheiki, Ardakani, Naeimeh & Rodriguez-Couto (2012), el cual consistió en sembrar por estriado las bacterias termófilas en agar Luria Bertani con 0.08 % v/v de guayacol (2-metoxifenol o 2-MP) y sulfato de cobre (Cu2SO4, 0.25 mM). Después de 48 horas de incubación a 60 °C en cámara húmeda, se evaluó la coloración de las colonias registrándose la coloración marrón oscuro como resultado positivo, el que fue valorizado en una escala cualitativa (alta, intermedia y baja).
29
vertió sobre las colonias, una solución de tampón fosfato 100 mM con 0,2 % v/v de siringol a pH 7. Luego de 20 minutos de reacción, se registró como resultado positivo a todas las colonias que revelaron coloración anaranjada y se valorizó la intensidad de la coloración en una escala de alta actividad enzimática tipo lacasa (4 y 5), intermedia (3), baja (1 y 2) o nula (0).
Además los cultivos bacterianos termófilos de la escala alta fueron evaluados en la oxidación de ABTS (1,
2, 2'-azino bis (3-etilbenzotiazolina-6-ácido sulfónico)) y
siringaldazina (3,5-Dimetoxi-4-hidroxibenzalazino), para ello según la metodología de Nazareno, Bucsinszky,
Tournier, Cabello & Arambarri (2000). Se añadieron 250
mg de ABTS por litro del medio de cultivo Luria Bertani luego de la esterilización; y se evaluó la intensidad de la
coloración del medio con la aparición de halos verdes (oxidación de ABTS). Mientras que el ensayo con
siringaldazina se realizó modificando el protocolo del 2-6
30
2.2.5. Selección del cultivo bacteriano termófilo con mayor potencial para la decoloración de tintes sintéticos
Se evaluó la capacidad de decoloración de 5 tintes sintéticos puros (rojo de Congo, azul brillante de remazol R, azul de toluidina, verde malaquita y cristal violeta) junto a 4 tintas de impresión Epson color negro, amarillo, magenta y ciano; la clasificación y estructura química de cada uno, se da a conocer en la tabla 2.
Se utilizó caldo cerebro-corazón (Brain heart Infusion, BHI,
Merck Millipore, 10 g/l tejido animal digerido enzimáticamente,
17.5 g/l extracto cerebro-corazón, 2 g/l D(+)-Glucosa, 5 g/l NaCl,
Na2HPO4, anhidro 2.5 g/l) inducido con 0,25 mM de MnSO4.5H2O
y 0,25 mM de CuSO4 al cual se le añadió cada tinte sintético a
0,025 % v/v luego de la esterilización a 1 atm y 120 °C por 20
minutos.
El medio de cultivo fue distribuido en condiciones estériles
en tubos de ensayo para cada cultivo bacteriano
preseleccionado (CB-13, CB-25, FT-6 y TM-12), los cuales
previamente fueron reactivados en caldo Luria Bertani por 24
horas y se inocularon al 10 % v/v en el BHI modificado e
incubaron a 60 °C, registrando las observaciones del crecimiento
31
Tabla 2. Tintes sintéticos del ensayo del potencial de decoloración Tinte sintético Clasificación Estructura química Rojo de Congo diazoico
Azul brillante de Remazol R
antraquinónico
Azul de
toluidina
fenotiazina
Verde malaquita
trifenilmetano
Cristal violeta trifenilmetano
Tinta magenta (Epson)
monoazoico Ej: Litol rojo
Tinta cian (Epson)
ftalocianina
32
2.2.6. Caracterización bioquímica e identificación molecular del cultivo seleccionado
2.2.6.1. Caracterización bioquímica
Se utilizó el micrométodo cualitativo RapIDTM SRT System (Remel, Oxoid), especializado en la identificación de estreptococos de importancia médica y otras bacterias Gram positivas relacionadas. Las pruebas bioquímicas de este sistema se basan en la degradación microbiana de sustratos específicos detectados por varios indicadores, que se describen en la tabla 3.
33
2.2.6.2. Identificación molecular
La cepa seleccionada fue cultivada en placa Petri con agar Luria Bertani y luego de 24 horas de incubación a 60 °C utilizando una asa de Drigralsky se lavaron las colonias bacterianas con solución salina fisiológica, para luego conservar la suspensión celular en crioviales con glicerol al 30% v/v a – 20 °C para su posterior envío a la empresa Macrogen Inc. en Seúl - Corea del Sur, la cual realizó el servicio de extracción del ADN genómico, la amplificación por PCR del ARN ribosomal 16S y la secuenciación del ADN, producto del PCR, por el método de Sanger, Nicklen & Coulson (1977).
Posteriormente para analizar la similitud de la secuencia de nucleótidos obtenidos, se utilizó la herramienta básica de búsqueda de alineación local (BLAST) frente a secuencias de referencia disponibles en
el National Center for Biotechnology Information
34
Tabla 3. Principios y componentes del sistema RapID STR
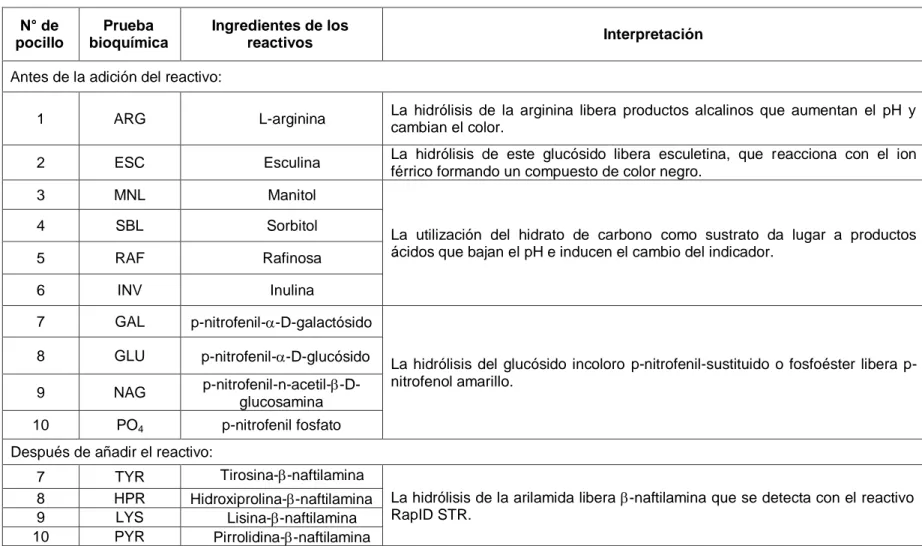
Fuente: Manual RapID System, REMEL, OXOID N° de
Antes de la adición del reactivo:
1 ARG L-arginina La hidrólisis de la arginina libera productos alcalinos que aumentan el pH y
cambian el color.
2 ESC Esculina La hidrólisis de este glucósido libera esculetina, que reacciona con el ion
férrico formando un compuesto de color negro.
3 MNL Manitol
La utilización del hidrato de carbono como sustrato da lugar a productos ácidos que bajan el pH e inducen el cambio del indicador.
4 SBL Sorbitol
5 RAF Rafinosa
6 INV Inulina
7 GAL p-nitrofenil--D-galactósido
La hidrólisis del glucósido incoloro nitrofenil-sustituido o fosfoéster libera p-nitrofenol amarillo.
8 GLU p-nitrofenil--D-glucósido
9 NAG p-nitrofenil-n-acetil-
-D-glucosamina
10 PO4 p-nitrofenil fosfato
Después de añadir el reactivo:
7 TYR Tirosina--naftilamina
La hidrólisis de la arilamida libera -naftilamina que se detecta con el reactivo
RapID STR.
8 HPR Hidroxiprolina--naftilamina
9 LYS Lisina--naftilamina
35
2.2.7. Determinación de las cinéticas de decoloración de cada tinte sintético durante el tratamiento con la bacteria termófila seleccionada
En matraces Erlenmeyer de 250 mL se prepararon 50 ml de caldo cerebro corazón autoclavado a 1 atm, 121 ° C durante 20 min que luego fue inducido con 0,25 mM de Sulfato de manganeso (MnSO4.5H2O) y 0,25 mM de sulfato de cobre (CuSO4.5H2O), y finalmente se le añadió cada tinte sintético según la tabla 4, por triplicado.
36
La inoculación se realizó al 10 % (v/v), empleando 5 ml de cultivo bacteriano termófilo TM-12 reactivado en caldo BHI por 18 horas con una absorbancia aproximada de 0,4 a 600 nm. La incubación se llevó a cabo a 60 °C en estático. El tiempo de incubación e intervalos de muestreo varían según el tinte sintético utilizado tal como se ha indicado en la tabla 4.
Todos los tratamientos biológicos se realizaron por triplicado a acompañados de un control abiótico, que mantenía las mismas condiciones en el medio de cultivo, porcentaje de tinte e incubación.
El control abiótico se utilizó además para calcular la longitud de absorbancia máxima de cada uno de los tintes sintéticos empleados realizando un barrido espectofotométrico desde 200 a 900 nm con intervalos de 12 nm de longitud de onda utilizando el espectrofotómetro de luz UV-visible UNICO 2102.
Luego de ocho horas de incubación, se iniciaron los muestreos tomando alícuotas de 1,5 ml en microtubos estériles, los que se centrifugaron por 10 min a 10 000 rpm y el sobrenadante se traspasó a nuevos microtubos.
2.2.7.1. Curvas de remoción
37
horas y se graficó la curva de remoción de cada tinte sintético tratado para conocer el tiempo de la decoloración.
2.2.7.2. Espectro de absorbancia
Además con cada sobrenadante obtenido en los periodos de tiempo determinado también se realizó un barrido espectrofotométrico desde 200 a 900 nm con intervalos de 12 nm de longitud de onda para comprobar los cambios en la estructura química en las alícuotas.
2.2.7.3. Porcentajes de decoloración
El porcentaje de decoloración se determina espectrofotométricamente como la disminución relativa en la absorbancia a la longitud de onda de absorbancia máxima de cada tinte sintético utilizado calculado de acuerdo a la siguiente ecuación:
Decoloración (%) = (A0 - At)
(A0) x 100 Donde:
At = absorbancia del tinte de la muestra medido a una hora específica
38
2.2.8. Determinación de la cinética de decoloración del efluente simulado durante el tratamiento con la bacteria termófila seleccionada
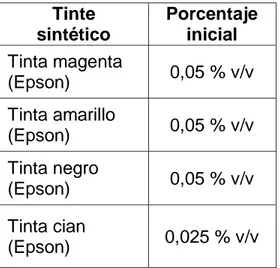
Se siguió la misma metodología que el tratamiento de tintes sintéticos puros, solo que se combinó las cuatro tintas de impresión (magenta, amarillo, negro y ciano) según la tabla 5. Del mismo modo se realizó la inoculación al 10 % (v/v) del cultivo bacteriano TM-12 reactivado y la incubación se llevó a cabo a 60 °C en estático por 24 horas.
Tabla 5. Porcentajes del tinte sintético utilizado Tinte
39
suspensión bacteriana. La excavación mide 0,02 mm (1/50 mm) y está dividida en 25 cuadrados grandes, subdivididos a su vez en 16 pequeños, con un área total de 1 mm2 y un volumen total de 0,02 mm3.
Por lo tanto, se aplicó la siguiente fórmula para calcular el número de células por ml de muestra:
Número de células/ml = N° de células x 25 x 50 x 103
Para ello se tomó una alícuota de 500 l de cada medio de cultivo al inicio y cada cuatro horas hasta la formación de la biopelícula. De las alícuotas muestreadas se utilizaron 2 L para el recuento de bacterias utilizando la micropipeta graduable de hasta 5 L. Se realizó el recuento consideraron las cuatro celdas de las esquinas y la central, realizando diluciones de 10-1, 10-2 o 10-3 cuando la cantidad de bacterias por cuadrantes era mayor a 20.
Luego se realizó el monitoreo del espectro de absorción
40
III. RESULTADOS
3.1 Evaluación de la actividad enzimática tipo lacasa de las bacterias termófilas del cepario del Laboratorio de Bioquímica
3.1.1. Reactivación de las bacterias termófilas
La reactivación de las 11 bacterias termófilas aisladas y seleccionadas en el Laboratorio de Bioquímica se logró exitosamente, elaborando un nuevo cepario codificado con fecha del 18 de enero del 2016, el cual se mantuvo bajo refrigeración a 4 °C para los ensayos posteriores.
3.1.2. Caracterización de las bacterias termófilas
Las características microscópicas observadas se dan a conocer en la tabla 6. El 100 % de las bacterias termófilas reactivadas fueron Gram positivos y su morfología corresponde a bacilos de diferentes longitudes con presencia de esporas terminales deformantes o ausencia de ellas. Además, se observó agrupaciones en forma de cadenas rectas y cortas o filamentosas largas y ondulados según la cepa evaluada.
41
Tabla 6. Tinción Gram de las bacterias termófilas con potencial para la decoloración de tintes sintético
Fuente: Elaboración propia
Bacteria Gram Características morfológicas
CB-13 Positivo Bacilos cortos, delgados, algunos forman cadenas y se observa espora terminal deformante. CB-16 Positivo Bacilos medianos, algunos forman filamentos y se
observa espora terminal deformante.
CB-25 Positivo Bacilos largos, delgados, forman filamentos y no se aprecia formación de esporas.
BT-16 Positivo Bacilos medianos y cortos, gruesos, algunos en parejas, sin espora.
CTB-13 Positivo Bacilos medianos y cortos, gruesos, algunos con esporas terminal deformantes.
CTB-16 Positivo Bacilos medianos y cortos, delgados, algunos con espora terminal deformante.
CTB-19 Positivo Bacilos largos, gruesos, algunos forman cadena, forman esporas terminales deformante, CTB-21 Positivo Bacilos cortos y medianos, delgados, forman
cadenas y algunos con espora terminal deformante. FT-6 Positivo Bacilos cortos y medianos, delgados, algunos
presentan espora terminal.
FT-9 Positivo Bacilos medianos, algunos en parejas y tienen espora terminal deformante.
42
Los resultados de la caracterización macroscópica se describen en la tabla 7, luego de 24 horas de incubación a 60 °C las colonias fueron observadas en estereoscopio con aumento 10X; las dos formas predominantes fueron circulares e irregulares, junto al borde, la elevación y las demás observaciones registradas como un halo o punto central, se logró distinguir cada bacteria termófila como una cepa diferente.
3.1.3. Evaluación de la actividad enzimática tipo lacasa de las bacterias termófilas en medio sólido
Se evaluó la capacidad de 11 bacterias termófilas para la actividad enzimática tipo lacasas sobre el guayacol (2-metoxifenol), siringol (2,6-di(2-metoxifenol), ABTS y sirigaldazina; en medio sólido, logrando valorizar cualitativamente la actividad enzimática por la intensidad de las coloraciones de las colonias, correspondientes a la oxidación de cada sustrato empleado. Los resultados se dan a conocer en la tabla 8 y el anexo 3.
43
Tabla 7. Características macroscópicas de las colonias de bacterias termófilas seleccionadas
Bacteria Forma Borde Elevación Consistencia Color Observaciones Tamaño
(mm) CB-13 Irregular Irregular Elevada Cremosa Crema Halo gris en el centro de la
colonia
3 – 5 CB-16 Irregular Ondulado Elevada Cremosa Crema Superficie con elevaciones
irregulares como verrugas
5 CB-25 Irregular Entero Elevada Cremosa Crema Borde y punto en el centro más
oscuros
FT-6 Irregular Entero Convexa Cremosa Crema Superficie lisa con punto central
1
FT-9 Circular Irregular Plana Cremosa Crema Superficie lisa 4
44
Tabla 8. Actividad enzimática tipo lacasa de bacterias termófilas en medio sólido
Leyenda: Alta=4 y 5, Intermedia=3, Baja=1 y 2, Reacción negativa=0 y No se evaluó= –
Fuente: Elaboración propia
A las bacterias CB-13, CB-16, BT-16, CTB-13 y TM-12 se les asignaron el mismo puntaje en la valorización para guayacol y siringol; sin embargo, el resto de bacterias tienen mayor puntaje en el ensayo con siringol (2,6-DMP), ya que se observó un aumento en la intensidad de la coloración.
45
Figura 3. Gráfico de porcentajes de las categorías de la evaluación de la actividad enzimática tipo lacasa en medio sólido
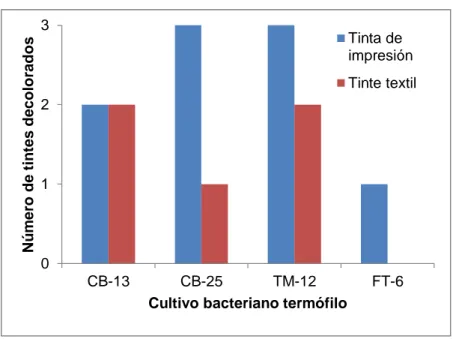
Según los criterios de cribado para la detección de la actividad enzimática tipo lacasa en medio sólido con diferentes sustratos fueron elegidas para los posteriores estudios de decoloración de tinte sintéticos en pruebas de tubos de ensayo las bacterias termófilas CB-13, CB-25, TM-12 y FT-6
3.2 Selección del cultivo bacteriano termófilo con mayor potencial para la decoloración de tintes sintéticos
Se evaluó la capacidad de decoloración de los cuatro cultivos
bacterianos previamente seleccionados (CB-13, CB-25, FT-6 y
TM-12) frente a cinco tintes textiles puros: rojo de Congo, azul brillante de remazol (RBBR), azul de toluidina, verde malaquita y
Alta 37%
46
cristal violeta y cuatro tintas de impresión de color magenta,
amarillo, ciano y negro en caldo BHI. Los resultados obtenidos del
potencial de decoloración a las 24 horas se dan a conocer en la
Leyenda: El número de cruces (+ a +++) indica la intensidad de la decoloración; (C) denota crecimiento sin cambio de color; (V) indica variables en los resultados; (CI) denota inhibición en el crecimiento.
47
Al evaluar la capacidad para decolorar tintes sintéticos puros,
la bacteria termófila TM-12 decoloró totalmente el rojo de Congo en
24 horas seguida de CB-13 y CB-25, las cuales, decoloraron con
menor intensidad observándose un color anaranjado (Anexo 4.1).
En los ensayos de las bacteria termófilas CB-13 y TM-12 con
azul brillante de remazol R, se observó disminución en el color
inicial se mantuvo; por lo tanto, no hubo decoloración (Anexo 4.3).
En las pruebas con los otros tintes sintéticos, como cristal violeta y
verde de malaquita, el crecimiento microbiano fue inhibido.
Los tres cultivos bacterianos termófilos, CB-13, CB-25 y TM-12, lograron decolorar completamente los medios de cultivo con
tinta de impresión magenta y amarillo a las 24 horas (Anexo 4.4 y
4.5); mientras que para el medio de cultivo con tinta negra, sólo la
bacteria CB-25 alcanzó la decoloración completa, seguida de
TM-12 a las 48 horas (Anexo 4.6). Sin embargo, ninguna de las
bacterias decoloró completamente el medio con tinta ciano, por lo
tanto, estas dos cepas son las que muestran mayor capacidad para
decolorar tintas de impresión.
48
Figura 4. Gráfico de barras de la selección del cultivo bacteriano termófilo con mayor potencial de decoloración de tintes sintéticos.
3.3 Caracterización bioquímica e identificación bacteriana
3.3.1 Caracterización bioquímica
Se logró examinar la reactividad de los pocillos de reacción del sistema RapID STR observándose el desarrollo del color y su interpretación según las indicaciones del manual, cuyos resultados se muestran en la Tabla 10.
Adicionalmente, la prueba de la catalasa dio como resultado positivo, indicando la liberación del O2 que comprueba la presencia de la enzima.
49
Tabla 10. Resultados del sistema RapID STR para la bacteria termófila TM-12
Prueba bioquímica Resultado Interpretación
ARG Amarillo Negativo
ESC Crema Negativo
MNL Rojo guinda Negativo SBL Rojo guinda Negativo RAF Rojo guinda Positivo
INV Guinda Positivo
Gal Amarillo Positivo Glu Amarillo Positivo Nag Amarillo Positivo PO4 Amarillo Positivo
TYR Morado Positivo
HPR Transparente Negativo
LYS Rosado Negativo
PYR Transparente Negativo Fuente: Elaboración propia
Por lo tanto la bacteria termófila TM12, es capaz de utilizar como fuentes de hidratos de carbono a la rafinosa y la inulina, además presenta las enzimas -galactosidasa y -glucosidasa para hidrólisis de los glucósidos y la enzima tirosina hidrolasa para oxidar a la tirosina.
3.3.2 Identificación molecular
El algoritmo BLAST se utilizó para recuperar las
50
16S de 1518 nucleótidos obtenida de la bacteria termófila TM-12. El aislamiento bacteriano reveló un 99 % de identidad con cuatro especies del género Geobacillus. Estas fueron G. kaustophilus, G. thermoparaffinivorans, G.
thermoleovorans y G. stearothermophilus (Tabla 11).
La identificación microbiana basada en las
características morfológicas, bioquímicas y moleculares,
permitió que el aislamiento fuera identificado como una cepa del género Geobacillus.
3.4 Cinéticas de decoloración de los tintes sintéticos durante el tratamiento con la bacteria termófila seleccionada
Para determinar las cinéticas de remoción de los tintes sintéticos durante el tratamiento con la bacteria termófila TM-12, se obtuvo primero el espectro de absorbancia del control abiótico de cada tinte sintético para conocer la longitud de onda con máxima absorbancia, lo que permitió graficar las curvas de remoción y determinar los porcentajes de decoloración bajo condiciones controladas.
51
Tabla 11. Resultados del reporte del BlastN para el secuenciamiento del ARN 16S de la bacteria termófila TM-12
Espécimen (Descripción) Código de acceso
Identidad
Igualdad Total Pct (%)
Geobacillus kaustophilus cepa BGSC 90A1 gen ARN ribosomal 16S, secuencia complete
NR_115285.1 1514 1518 99
Geobacillus kaustophilus HTA426 cepa HTA426 90A1 gen ARN ribosomal 16S, secuencia completa
NR_074989.1 1513 1518 99
Geobacillus kaustophilus cepa G2 gen ARN ribosomal 16S, secuencia parcial
JX522539.1 1509 1512 99 G. thermoparaffinivorans cepa IT-12, gen
ARN ribosomal 16S, secuencia parcial
EU214615.1 1514 1518 99 G. thermoleovorans cepa CCB_US3_UF5,
genoma completo
CP003125.1 1512 1518 99
G. stearothermophilus cepa BGSC 9A19 gen ARN ribosomal 16S, secuencia parcial
52 3.4.1 Curvas de remoción
Los resultados obtenidos se grafican en la curva de
remoción del rojo de Congo (Figura 5) que demuestra el
avance de la disminución de la absorbancia a 500 nm cada
12 horas.
La decoloración de la tinta de impresión magenta se monitoreó a partir de las 8 horas de incubación a 60 °C cada dos horas; la decoloración se completó a las 14 horas observándose el color inicial del caldo cerebro-corazón, dicha cinética se representa en la curva de remoción de la figura 6.
Figura 5. Curva de remoción del tratamiento biológico con la bacteria termófila TM-12 para rojo de Congo.
53
Figura 6. Curva de remoción del tratamiento biológico con la bacteria termófila TM-12 para la tinta de impresión magenta.
Del mismo modo se monitoreó la decoloración de la tinta de impresión de color negro, la cual, demoró 16 horas, luego de este tiempo se observó la desaparición completa del color en el medio de cultivo; la curva de remoción se grafica en la figura 7.
54
Figura 7. Curva de remoción del tratamiento biológico con la bacteria termófila TM-12 para la tinta de impresión negra.
55
Tabla 12. Análisis de varianza de los tres tratamientos para la decoloración de la tinta ciano por la bacteria prueba F a un nivel de 0,05 de probabilidad, para la variable concentración de tinta de impresión, se observa que el valor-P de la prueba-F es menor que 0,05; por lo tanto, existe una diferencia estadísticamente significativa entre las medias de la decoloración de la tinta de impresión ciano entre una concentración y otra, con un nivel de confianza del 95 %. Por lo que se rechaza la hipótesis nula y se acepta la alterna, es decir, que en al menos una de las tres concentraciones de tinta de impresión tiene un efecto diferente en la decoloración del tinte durante el tratamiento con la bacteria TM-12.
56
Tabla 13. Pruebas de múltiples rangos para las concentraciones de tinta de impresión ciano según el método de Fisher.
Tratamiento Casos Media Grupos Homogéneos
1 3 33.6667 X
2 3 45.0 X
3 3 58.6667 X
Fuente: Elaboración propia
En la tabla 13 se aplica un procedimiento de comparación múltiple para determinar cuáles medias son significativamente diferentes de otras. Se han identificado tres grupos homogéneos según la alineación de las X's en columna empleando el procedimiento de diferencia mínima significativa de Fisher.
Con este método hay un riesgo del 5.0% al decir que cada par de medias es significativamente diferente, cuando la diferencia real es igual a 0.
57 3.4.2 Espectros de absorbancia
Con el fin de obtener más datos que permitieran afirmar
que efectivamente los tintes sintéticos estaban sufriendo
cambios químicos a causa del tratamiento biológico a los
que se sometieron con la bacteria termófila TM-12, se midió
el espectro de absorción de los tintes tratados en cada
intervalo de muestreo.
El espectro de absorción del rojo de Congo a las 0
horas presenta un pico elevado entre los 500 nm que se
mantiene a las 12 horas pero desaparece a las 24 horas
junto a la disminución de todo el rango de absorbancias
desde los 400 a 600 nm (Figura 9). Durante el tratamiento
con TM-12 para la tinta de impresión magenta su espectro
de absorción también presentó cambios; se observó como
este disminuyó progresivamente llegando a un mínimo a las 14 horas (Figura 10).
De la misma manera, el espectro de absorción de la
tinta de impresión negra presentó cambios en cuanto a la
desaparición total de los picos máximos de absorción entre
58
Figura 9. Espectros de absorción del tratamiento biológico con la bacteria termófila TM-12 para el rojo de Congo.
Figura 10. Espectros de absorción del tratamiento biológico con la bacteria termófila TM-12 para la tinta de
200 300 400 500 600 700 800 900
Un
200 300 400 500 600 700 800 900
59
Figura 11. Espectros de absorción del tratamiento biológico con la bacteria termófila TM-12 para la tinta de impresión negra.
La tinta de impresión ciano presentó una disminución
constante en las unidades de absorción del rango visible,
con una máxima disminución a las 36 horas. Sin embargo no
se presentaron cambios en el espectro UV para las
concentraciones de 0,1 y 0,05 % v/v, sólo a 0,025 % v/v
desaparición el pico de absorbancia. (Figura 12). Sin
embargo, este resultado podría deberse a un proceso de
adsorción del tinte por las paredes de las bacterias cuyas
biopelículas presentaron color azulado. 0,00
200 300 400 500 600 700 800 900
60
Figura 12. Espectros de absorción del tratamiento biológico con la bacteria termófila TM-12 para la tinta de
200 300 400 500 600 700 800 900 1000
Un
200 300 400 500 600 700 800 900 1000
Un
200 300 400 500 600 700 800 900 1000
61 3.4.3 Porcentajes de decoloración
Según los resultados obtenidos se aprecia que los tratamientos para el rojo de Congo y la tinta de impresión de color negro fueron totalmente efectivos con porcentajes de decoloración cercanos al 80 %, cuya absorbancia final corresponde al color amarillo inicial del medio de cultivo cerebro-corazón, demostrando la capacidad de la bacteria termófila TM-12 para la degradación de estos tintes sintéticos.
62
3.5 Cinética de remoción del efluente simulado durante el tratamiento con la bacteria termófila seleccionada
3.5.1 Recuento de bacterias
Se monitoreó el crecimiento bacteriano hasta la formación de una biopelícula sobre el medio de cultivo, los resultados se muestran en la figura 13. Hasta las 8 horas de incubación se alcanzó una concentración aproximada de 2,17x108 células/ml.
Figura 13. Recuento de la bacteria termófila TM-12 durante el tratamiento biológico para el efluente simulado de un destintado.
El recuento bacteriano permitió conocer que el crecimiento bacteriano se realizaba con normalidad y que no se presentó ningún factor de inhibición.
63 3.5.2 Curva de remoción
A 560 nm, se registraron las más altas unidades de absorbancia en el tiempo inicial (1,019) y durante el monitoreo a partir de las 10 horas, se pudo observar que la absorbancia se mantiene constante alrededor de la unidad, hasta las 16 horas que disminuyó hasta 0,412 (Figura 14).
Figura 14. Curva de remoción del tratamiento biológico con la bacteria termófila TM-12 para el efluente simulado de un destintado.
El gráfico de la curva de remoción permite diferenciar el avance continuo de la decoloración en periodos de 2 horas hasta que se observó la desaparición total del color en el medio de cultivo entre las 14 y 16 horas.
64 3.5.3 Espectro de absorbancia
A partir de las 10 horas del tratamiento biológico con la bacteria termófila TM-12 a 60 °C, se monitoreó la absorbancia a diferentes longitudes de ondas cada 2 horas hasta la remoción del color.
El espectro de absorción grafica curvas de unidades de absorbancia iguales desde el inicio (0 horas) hasta las 14 horas, seguido de la disminución brusca que se muestra en líneas punteadas celestes de la figura 15. Los resultados del espectro de absorción no concuerdan con los cambios progresivos del color, el cual, disminuyó constantemente hasta las 14 horas llegando a observarse finalmente un color verde olivo claro.
Figura 15. Espectros de absorción del tratamiento biológico con la bacteria termófila TM-12 para el efluente
200 300 400 500 600 700 800 900 1000
65 3.5.4 Porcentaje de decoloración
El resultado obtenido del tratamiento biológico con la bacteria termófila TM-12 del efluente simulado de un destintado con un aproximado 60 % del porcentaje de decoloración (Tabla 15) concuerda con los datos antes mencionados en la decoloración de tintes sintéticos, incluso la presencia de la tinta de impresión ciano, no impide que se decolore el resto de tintas de impresión.
Tabla 15. Resultados de remoción del efluente mixto simulado por la bacteria termófila TM-12.
66
IV. DISCUSIÓN
Caracterización microscópica y macroscópica de los cultivos bacterianos estudiados
La tinción Gram permitió diferenciar a las bacterias termófilas estudiadas clasificándolas en el grupo de bacterias Gram positivas, por lo que posiblemente compartan las propiedades estructurales atribuidas a este grupo, una pared celular gruesa con elevado contenido de mureína. Coincidiendo con otros estudios realizados sobre la diversidad de bacterias cultivables aisladas de fuentes termales en Turquía (Adiguzel et al., 2009) o en Manikaran, India (Kumar et al., 2013).
67
El tamaño de las bacterias no se registró, ya que no se cuenta con un micrómetro, sin embargo, se aproxima de 5 a 8 µm de largo por 1,5 µm de ancho para los bacilos.
Al respecto de la caracterización macroscópica, existe variedad en la descripción de las colonias bacterianas, siendo la forma irregular y circular dominante y el color crema; sin embargo estos dos caracteres pueden cambiar según la composición del medio de cultivo empleado, lo que se debe tener en cuenta para ensayos posteriores. Resalta también la consistencia viscosa de CTB-13 y la observación de puntos centrales en BT-16, FT-6 y CTB-13.
Esta caracterización microscópica y macroscópica nos sirvió como base de datos para próximos ensayos y se tuvo en cuenta para la búsqueda y elección de metodologías sobre bacterias productoras de lacasas de similar origen y características. Asimismo, es muy importante para confirmar la pureza de los ceparios y poder conservar las cepas aisladas libres de contaminantes ambientales o del cruce de cepas.
Evaluación de la actividad enzimática tipo lacasa