Estudio de minerales refractarios argentíferos marginales para la cuantificación de plata mediante el proceso de tostación y post cianuración en el Distrito del Madrigal – Caylloma – Arequipa
Texto completo
(2) PRESENTACIÓN. SEÑOR DECANO DE LA FACULTAD DE INGENIERÍA DE PROCESOS SEÑOR DIRECTOR DE LA ESCUELA PROFESIONAL DE INGENIERÍA QUÍMICA SEÑORES MIEMBROS DEL JURADO:. De acuerdo con las disposiciones de Reglamentos de Grados y Títulos de la Facultad de Ingeniería de Procesos, Escuela Profesional de Ingeniería Química, pongo a vuestra disposición la presente investigación que lleva por título:. “ESTUDIO DE MINERALES REFRACTARIOS ARGENTÍFEROS MARGINALES PARA LA CUANTIFICACIÓN DE PLATA MEDIANTE EL PROCESO DE TOSTACIÓN Y POST CIANURACIÓN EN EL DISTRITO DEL MADRIGAL – CAYLLOMA – AREQUIPA”. Que previo dictamen favorable nos permitirá optar el Título Profesional de Ingeniero Químico.. BACH. JAN JOSEPH MOSCOSO CARDENAS BACH. EDUARDO ALONSO HUANCA BACA. I.
(3) AGRADECIMIENTOS. El presente trabajo de investigación es gracias a Dios, por ser inspirador y dador de fuerzas para continuar en este proceso de obtención de uno de los anhelos más deseados. Jan Joseph A mi padre José por enseñarme a ser perseverante, a mi madre Maura por la incansable motivación, a mis hermanas Jovanna, Rosa, Daysi y mi hermano Juan José† por sus consejos, valores y por haber formado en mí una persona de bien y a Leslie por la paciencia, cariño y apoyo. Este triunfo también es de ustedes. Eduardo A mi padre Efraín por ser mi pilar fundamental y haberme apoyado incondicionalmente, pese a las adversidades e inconvenientes que se presentaron. También está dedicado a mi madre Betzabeth†, quien me enseñó que incluso la tarea más grande se puede lograr si se hace un paso a la vez. A mi tía Marisol, por su apoyo incondicional, por acompañarme en los buenos y malos momentos, gracias a ella por su bondad y comprensión. A mi familia, a mis amigos, que de una u otra manera me brindaron su colaboración y se involucraron en esta investigación. Agradecemos a la UNIVERSIDAD NACIONAL DE SAN AGUSTÍN, ESCUELA DE INGENIERÍA QUÍMICA por habernos brindado formación profesional; a todos nuestros excelentes catedráticos por la dedicación, tiempo, conocimientos y experiencias brindadas. Un agradecimiento especial al Ing. Roberto Huamani por su incansable apoyo y consejos en las pruebas experimentales. Muchas Gracias.. II.
(4) INTRODUCCIÓN Ciertos minerales denominados marginales (relaves), contienen cantidades aceptables de plata a pesar de ser marginales, los cuales son producto de la explotación de yacimientos mineros. La mayoría de las veces, la cianuración de minerales refractarios argentíferos requieren largos periodos de lixiviación y desafortunadamente se alcanza bajas recuperaciones. (Coronado, Encinas , Leyva, Valenzuela, & Munive, 2012) El presente trabajo de tesis tiene como finalidad recuperar el mayor porcentaje de plata asociada a los minerales sulfurosos por medio de la tostación para posterior aumento de recuperación durante una cianuración convencional. Esto se realiza oxidando los sulfuros a óxidos o sulfatos, o reduciendo los silicatos y óxidos a un estado metálico crudo, con el propósito de cambiar los compuestos metálicos insolubles en otros que sean solubles en el agente lixiviante; así como para volatilizar ciertas impurezas solubles que pudieran contaminar la solución cargada. También es útil para volver porosos los compuestos metálicos, y hacerlos de esta forma más fácilmente accesibles al disolvente de la lixiviación. (Coronado, Encinas , Leyva, Valenzuela, & Munive, 2012) Para la cianuración de la plata se ha elegido el proceso de cianuración convencional, por ser uno de los métodos de disolución más utilizado en el mundo, debido a la elevada velocidad de reacción y las altas recuperaciones de metal valioso. (Romero & Flores , 2010) Para evitar la generación de gas cianhídrico (gas toxico), pérdida de cianuro en el proceso de lixiviación y para mantener neutro los ácidos del mineral marginal, el pH en cianuración debe estar entre 10 y 11, esto con ayuda de cal. (Nava Alonso, Elorza Rodríguez, Uribe Salas, & Pérez Garibay, 2007). III.
(5) NOMENCLATURA. Eh. Potencial de Oxidación. g. Gramos. g/L. Gramos por Litro. Hrs - H. Horas. Kg/m3. Kilogramo por Metro Cúbico. Km. Kilómetros. Km2. Kilómetros cuadrados. L. Litro. Min. Minutos. ml. Mililitro. mg. Miligramos. msnm. Metros sobre el nivel del mar. ppm. Partes por millón. pH. Potencial de hidrógeno. pK. Fuerza de disociación de moléculas. rpm. Revoluciones por minuto. TM. Tonelada métrica. US$/Oz. Dólar por Onza. um. Micrómetros. WGS. World geodetic system. %. Porcentaje. °C. Grados centígrados. °F. Grados Fahrenheit. IV.
(6) RESUMEN. En este trabajo se presenta un estudio para mejorar el porcentaje de recuperación de plata para poder tener una mayor cuantificación del metal en soluciones cianuradas a partir de minerales argentíferos refractarios marginales del distrito de Madrigal. El mineral marginal paso por un acondicionamiento de molienda para luego pasar por un proceso de pre tratamiento de tostación seguido del proceso de cianuración, todo esto para la liberación de azufre y eliminación de refractariedad del mismo, variando los parámetros de temperatura, tiempo de tostación y granulometría, teniendo como resultado la recuperación más baja del 36.01% a 300°C, en 1 hora y (P80)en malla #100; y recuperación más alta del 66.84% a una temperatura de tostación de 600°C por un tiempo de 2 horas y con tamaño de partícula (P80) pasante malla 100. Respecto al porcentaje de liberación de azufre durante la tostación, la temperatura es la variable de mayor significancia, teniendo la máxima liberación de azufre del 81.76% a 600°C con dos horas de tostación. La prueba de cianuración convencional por agitación se dio a pH 11, con 304 rpm y 30% solidos; se le realizo la prueba de cianuro libre y a partir de esta se calculó el consumo de cianuro, dándonos como resultado el consumo de cianuro en pruebas a 300°C con bajo porcentaje de recuperación de plata mientras que el consumo de cianuro más bajo se da a 600°C con 2 horas de tostación y los porcentajes más altos de recuperación de plata. Palabras clave: Cianuración, mineral argentífero, refractariedad, relave, tostación.. V.
(7) ABSTRACT. This paper presents a study to improve the recovery percentage of silver in order to have a greater quantification of the metal in cyanide solutions from marginal refractory Argentinean minerals from the Madrigal district. The marginal mineral underwent a milling conditioning and then undergo a process of preroasting treatment followed by the cyanidation process, all this for the release of sulfur and elimination of refractoriness thereof, varying the parameters of temperature, roasting time and granulometry, resulting in the lowest recovery of 36.01% at 300 ° C, in 1 hour and (P80) in # 100 mesh; and highest recovery of 66.84% at a roasting temperature of 600 ° C for a time of 2 hours and with particle size (P80) through 100 mesh. Regarding the percentage of sulfur release during roasting, the temperature is the variable of greatest significance, having the maximum sulfur release of 81.76% at 600 ° C with two hours of roasting. The conventional cyanidation test by stirring was given at pH 11, with 304 rpm and 30% solids; the free cyanide test was performed and from this the cyanide consumption was calculated, resulting in the consumption of cyanide in tests at 300 ° C with a low percentage of silver recovery while the lowest cyanide consumption is given to 600 ° C with 2 hours of roasting and the highest percentages of silver recovery. Keywords: Cyanidation, Argentine ore, refractoriness, tailings, roasting.. VI.
(8) UNIVERSIDAD NACIONAL DE SAN AGUSTÍN DE AREQUIPA FACULTAD DE INGENIERÍA DE PROCESOS ESCUELA PROFESIONAL DE INGENIERÍA QUÍMICA. Bachiller(es):. MOSCOSO CARDENAS, JAN JOSEPH HUANCA BACA, EDUARDO ALONSO. TESIS: “ESTUDIO DE MINERALES REFRACTARIOS ARGENTÍFEROS MARGINALES PARA LA CUANTIFICACIÓN DE PLATA MEDIANTE EL PROCESO DE TOSTACIÓN Y POST CIANURACIÓN EN EL DISTRITO DEL MADRIGAL – CAYLLOMA – AREQUIPA”. Dr. Victor Álvarez Tohalino PRESIDENTE. Dr. Hugo Jiménez Pacheco MIEMBRO. VII. Mg. Javier Villegas Aragón MIEMBRO.
(9) ÍNDICE GENERAL PRESENTACIÓN .......................................................................................................................... I AGRADECIMIENTOS ............................................................................................................... II INTRODUCCIÓN ...................................................................................................................... III NOMENCLATURA ................................................................................................................... IV RESUMEN.....................................................................................................................................V ABSTRACT ................................................................................................................................. VI ÍNDICE GENERAL ................................................................................................................ VIII ÍNDICE DE FIGURAS.................................................................................................................X ÍNDICE DE TABLAS............................................................................................................... XII CAPITULO I ................................................................................................................................. 1 CONSIDERACIONES GENERALES ....................................................................................... 1 1.1. DEFINICIÓN DEL PROBLEMA ................................................................................... 1 1.2. OBJETIVO ........................................................................................................................ 1 1.2.1.. Objetivo general ...................................................................................................... 1. 1.2.2.. Objetivos específicos ............................................................................................... 1. 1.3. HIPÓTESIS ....................................................................................................................... 2 1.4. JUSTIFICACIÓN ............................................................................................................. 2 1.4.1.. Justificación Ambiental .......................................................................................... 2. 1.4.2.. Justificación tecnológica ......................................................................................... 3. 1.4.3.. Justificación Económica ......................................................................................... 3. 1.5. VARIABLES ..................................................................................................................... 3 1.5.1.. Variables Independientes ....................................................................................... 3. 1.5.2.. Variables Dependientes .......................................................................................... 3. 1.5.3.. Parámetros............................................................................................................... 3. CAPITULO II ............................................................................................................................... 4 MARCO TEORICO ..................................................................................................................... 4 2.1. ANTECEDENTES ............................................................................................................ 4 2.2. DISTRITO DE MADRIGAL ........................................................................................... 5 2.2.1.. Denominación .......................................................................................................... 5. 2.2.2.. Ubicación Geográfica.............................................................................................. 5. 2.2.3.. Limites...................................................................................................................... 6. 2.2.4.. Clima ........................................................................................................................ 7. 2.2.5.. Accesibilidad............................................................................................................ 7 VIII.
(10) 2.2.6.. Mina Madrigal ........................................................................................................ 7. 2.2.7.. Pasivo Madrigal .................................................................................................... 10. 2.3. PLATA ............................................................................................................................. 12 2.3.1.. Definición ............................................................................................................... 12. 2.3.2.. Propiedades Físicas ............................................................................................... 12. 2.3.3.. Propiedades Químicas .......................................................................................... 13. 2.3.4.. Usos......................................................................................................................... 13. 2.3.5.. Producción de Plata en el Perú ............................................................................ 14. 2.4. TOSTACIÓN ................................................................................................................... 18 2.4.1.. Consideraciones..................................................................................................... 18. 2.4.2.. Minerales Refractarios ......................................................................................... 18. 2.4.3.. Tostación Oxidante ............................................................................................... 19. 2.5. LIXIVIACIÓN DE PLATA ........................................................................................... 20 2.5.1.. Cianuración de plata............................................................................................. 21. 2.5.2.. Cianuro .................................................................................................................. 26. 2.5.3.. Efecto de la alcalinidad......................................................................................... 28. 2.5.4.. Lixiviación de sólidos dispersos ........................................................................... 29. 2.5.5.. Tanques Agitados .................................................................................................. 30. CAPITULO III ............................................................................................................................ 37 PROCEDIMIENTO EXPERIMENTAL .................................................................................. 37 3.1. METODOLOGÍA DE LA INVESTIGACIÓN ............................................................ 37 3.2. DESARROLLO EXPERIMENTAL ............................................................................. 39 3.2.1.. Mineral argentífero refractario marginal .......................................................... 39. 3.2.2.. Obtención de muestras ......................................................................................... 43. 3.2.3.. Molienda de mineral marginal ............................................................................ 46. 3.2.4.. Tostación de mineral............................................................................................. 51. 3.2.5.. Cianuración del mineral tostado ......................................................................... 54. CAPITULO IV ............................................................................................................................ 61 RESULTADOS E INTERPRETACIÓN DE RESULTADOS ............................................... 61 CONCLUSIONES....................................................................................................................... 93 RECOMENDACIONES ............................................................................................................ 95 BIBLIOGRAFIA......................................................................................................................... 96 ANEXOS ...................................................................................................................................... 99. IX.
(11) ÍNDICE DE FIGURAS FIGURA 1 DISTRITO MADRIGAL. ...................................................................................................... 6 FIGURA 2 LÍMITES DEL DISTRITO DE MADRIGAL. ............................................................................. 6 FIGURA 3 MAPA METALOGENÉTICO. ............................................................................................... 8 FIGURA 4 INSTALACIONES DE LA MINA MADRIGAL ......................................................................... 9 FIGURA 5 UBICACIÓN DE LA MINA MADRIGAL Y SU PASIVO MINERO. ............................................ 10 FIGURA 6 PASIVO MADRIGAL. ....................................................................................................... 11 FIGURA 7 PASIVO MADRIGAL IN SITU. ........................................................................................... 11 FIGURA 8 PRODUCCIÓN MINERA MENSUAL 2018-2019. ................................................................ 16 FIGURA 9 PRINCIPALES EMPRESAS PRODUCTORAS DE PLATA 2018. ............................................... 17 FIGURA 10 PRINCIPALES EMPRESAS PRODUCTORAS DE PLATA ABRIL 2019. .................................. 17 FIGURA 11 COTIZACIÓN DE LA PLATA 2018-2019. ........................................................................ 17 FIGURA 12 POTENCIAL - PH DIAGRAMA PARA AG-H2O Y AG-H2O-CN TEMPERATURA 25°C. ..... 22 FIGURA 13 POTENCIAL-PH DIAGRAMA PARA EL SISTEMA AG-H2O TEMPERATURA 25°C. ............ 23 FIGURA 14 POTENCIA PARA VARIAS REACCIONES DISUELTAS DE PLATA EN CIANURO ACUOSO TEMPERATURA 25°C. ......................................................................................................... 25 FIGURA 15 POTENCIAL-PH DIAGRAMA PARA EL SISTEMA AG-H2O-CN TEMPERATURA 25°C....... 25 FIGURA 16 FORMACIÓN DE HCN Y CN EN SOLUCIONES ACUOSAS EN FUNCIÓN DEL PH. ............... 27 FIGURA 17 POTENCIAL-PH DIAGRAMA PARA EL SISTEMA CN-H2O TEMPERATURA 25°C. ............ 28 FIGURA 18 TANQUE DE AGITADO SENCILLO. .................................................................................. 31 FIGURA 19 MODELO DE FLUJO PARA UN AGITADOR HÉLICE........................................................... 32 FIGURA 20 MODELO DE FLUJO CON ROTOR DE TURBINA. ............................................................... 32 FIGURA 21 TIPOS DE AGITADORES. ................................................................................................ 33 FIGURA 22 MODELOS DE FLUJO. .................................................................................................... 35 FIGURA 23 DIAGRAMA DE BLOQUES DE LA METODOLOGÍA DE LA INVESTIGACIÓN ....................... 38 FIGURA 24 PUENTE CAMINO AL PASIVO MADRIGAL. ..................................................................... 43 FIGURA 25 UBICACIÓN DE LA ZONA DE MUESTREO. ...................................................................... 44 FIGURA 26 SECTORIZACIÓN DE LA ZONA DE MUESTREO ............................................................... 45 FIGURA 27 ZONA DE MUESTREO. ................................................................................................... 46 FIGURA 28 ROTOR DEL MOLINO DE BOLAS. .................................................................................... 47 FIGURA 29 TAMBOR DEL MOLINO DE BOLAS. ................................................................................. 48 FIGURA 30 TAMIZADOR RETSCH. ................................................................................................ 49 FIGURA 31 FACHADA DEL LABORATORIO DE TECNOLOGÍA DE MATERIALES NO FERROSOS. ........ 51 FIGURA 32 LABORATORIO DE TECNOLOGÍA DE MATERIALES NO FERROSOS. ................................ 51 IGURA 33 HORNO MUFLA DEL LABORATORIO DE TECNOLOGÍA DE MATERIALES NO FERROSOS ...... 52 FIGURA 34 MINERAL MARGINAL TOSTADO. .................................................................................. 54 FIGURA 35 LABORATORIO DE CONCENTRACIÓN DE MINERALES. .................................................. 55 FIGURA 36 TANQUE CON AGITACIÓN MECÁNICA. ........................................................................... 56 FIGURA 37 PRUEBA DE CIANURACIÓN. .......................................................................................... 59. X.
(12) FIGURA 38 GRÁFICA DE LÍNEA AJUSTADA LOGARÍTMICA PARA MINERAL MARGINAL SIN MOLIENDA. ........................................................................................................................................... 63 FIGURA 39 GRÁFICA DE PORCENTAJE RETENIDO VS NUMERO DE MALLA 80% PASANTE. .............. 65 FIGURA 40 DIAGRAMA DE FLUJO DEL PROCESO DE TOSTACIÓN. ..................................................... 66 FIGURA 41 GRÁFICA DE PÉRDIDA DE PESO (%) VS. NUMERO DE CORRIDA. .................................... 68 FIGURA 42 GRÁFICA DE LIBERACIÓN DE AZUFRE (%) VS. NUMERO DE CORRIDA. .......................... 70 FIGURA 43 GRÁFICA DE PÉRDIDA DE PESO (%), LIBERACIÓN DE AZUFRE (%) VS. NÚMERO DE CORRIDA. ........................................................................................................................... 71 FIGURA 44 GRÁFICA NORMAL DE EFECTOS ESTANDARIZADOS PARA LA LIBERACIÓN DE AZUFRE (%). .................................................................................................................................... 72 FIGURA 45 DIAGRAMA DE PARETO DE EFECTOS ESTANDARIZADOS PARA LA LIBERACIÓN DE AZUFRE (%). .................................................................................................................................... 73 FIGURA 46 DIAGRAMA DE FLUJO PARA EL PROCESO DE CIANURACIÓN. ......................................... 74 FIGURA 47 GRÁFICA DE RECUPERACIÓN DE PLATA (%) VS. NUMERO DE CORRIDA. ....................... 79 FIGURA 48 GRÁFICA DE RECUPERACIÓN DE PLATA (%), LIBERACIÓN DE AZUFRE (%) VS. NÚMERO DE CORRIDA. ...................................................................................................................... 80 FIGURA 49 GRÁFICA DE CUBOS (MEDIAS AJUSTADAS) DE RECUPERACIÓN DE PLATA (%). ............. 81 FIGURA 50 GRÁFICA NORMAL DE EFECTOS ESTANDARIZADOS PARA LA RECUPERACIÓN DE PLATA (%). .................................................................................................................................... 82 FIGURA 51 DIAGRAMA DE PARETO DE EFECTOS ESTANDARIZADOS PARA LA RECUPERACIÓN DE PLATA (%). ......................................................................................................................... 82 FIGURA 52 GRÁFICA DE EFECTOS PRINCIPALES PARA RECUPERACIÓN DE PLATA (%). .................... 83 FIGURA 53 GRÁFICA DE GASTO DE NITRATO DE PLATA VS. TIEMPO. ............................................. 86 FIGURA 54 CONSUMO ACUMULADO DE CIANURO VS. TIEMPO. ....................................................... 88 FIGURA 55 GRÁFICA DE REPOSICIÓN DE CIANURO VS. NUMERO DE CORRIDA................................. 88 FIGURA 56 GRÁFICA DE CONSUMO DE CIANURO (G) VS. NUMERO DE CORRIDA.............................. 89 FIGURA 57 GRÁFICA DE CONSUMO DE CIANURO (G), RECUPERACIÓN DE PLATA (%) VS. NUMERO DE CORRIDA. ........................................................................................................................... 90. XI.
(13) ÍNDICE DE TABLAS TABLA 1 COORDENADAS UTM DEL DISTRITO DE MADRIGAL. ......................................................... 5 TABLA 2 LÍMITES DEL DISTRITO DE MADRIGAL. .............................................................................. 6 TABLA 3 ACCESIBILIDAD AL DISTRITO DE MADRIGAL. .................................................................... 7 TABLA 4 PROPIEDADES FÍSICAS DE LA PLATA. .............................................................................. 13 TABLA 5 PRODUCCIÓN MINERA PERÚ 2018. .................................................................................. 15 TABLA 6 PRODUCCIÓN MINERA PERÚ ABRIL 2019. ....................................................................... 15 TABLA 7 VARIABLES Y NIVELES DEL DISEÑO EXPERIMENTAL. ..................................................... 40 TABLA 8 DISEÑO FACTORIAL DE LA EXPERIMENTACIÓN. .............................................................. 42 TABLA 9 ANÁLISIS GRANULOMÉTRICO DEL MINERAL MARGINAL. ................................................. 62 TABLA 10 DETERMINACIÓN DEL NÚMERO DE MALLA. ................................................................... 64 TABLA 11 CONDICIONES PARA LAS PRUEBAS DE TOSTACIÓN. ........................................................ 65 TABLA 12 BALANCE DE PÉRDIDA DE PESO. .................................................................................... 67 TABLA 13 LIBERACIÓN DE AZUFRE EN LAS PRUEBAS DE TOSTACIÓN. ............................................ 69 TABLA 14 PORCENTAJE DE LIBERACIÓN DE AZUFRE. .................................................................... 71 TABLA 15 CONDICIONES PARA LAS PRUEBAS DE CIANURACIÓN. .................................................... 74 TABLA 16 PORCENTAJE DE RECUPERACIÓN DE PLATA PRUEBA 1 (#100, 300°C, 1HORA). ............. 75 TABLA 17 PORCENTAJE DE RECUPERACIÓN DE PLATA PRUEBA 2 (#200, 300°C, 1HORA). ............. 75 TABLA 18 PORCENTAJE DE RECUPERACIÓN DE PLATA PRUEBA 3 (#100, 600°C, 1HORA). ............. 75 TABLA 19 PORCENTAJE DE RECUPERACIÓN DE PLATA PRUEBA 4 (#200, 600°C, 1HORA). ............. 76 TABLA 20 PORCENTAJE DE RECUPERACIÓN DE PLATA PRUEBA 5 (#100, 300°C, 2HORAS) . .......... 76 TABLA 21 PORCENTAJE DE RECUPERACIÓN DE PLATA PRUEBA 6 (#100, 300°C, 2HORAS) . .......... 76 TABLA 22 PORCENTAJE DE RECUPERACIÓN DE PLATA PRUEBA 7 (#100, 600°C, 2HORAS) . .......... 76 TABLA 23 PORCENTAJE DE RECUPERACIÓN DE PLATA PRUEBA 8 (#200, 600°C, 2HORAS) . .......... 76 TABLA 24 PORCENTAJE DE RECUPERACIÓN DE PLATA PRUEBA 9, 10, 11 (#170, 450°C, 1.5HORAS) ............................................................................................................................................... 77 TABLA 25 MATRIZ DEL DISEÑO EXPERIMENTAL DE RECUPERACIÓN DE PLATA. ............................. 77 TABLA 26 ECUACIÓN DE REGRESIÓN EN UNIDADES NO CODIFICADAS. ........................................... 84 TABLA 27 CIANURO LIBRE EN LAS PRUEBAS DE CIANURACIÓN. ..................................................... 85 TABLA 28 CONSUMO DE CIANURO EN LAS PRUEBAS DE CIANURACIÓN. ......................................... 87 TABLA 29 CONDICIONES DEL MAYOR PORCENTAJE DE RECUPERACIÓN DE PLATA.......................... 91 TABLA 30 EFICIENCIA EN LA CIANURACIÓN. .................................................................................. 92. XII.
(14) CAPITULO I CONSIDERACIONES GENERALES. 1.1. DEFINICIÓN DEL PROBLEMA En el Perú se encuentran muchas empresas mineras de explotación de minerales valiosos, algunas en actual actividad y otras que han cesado su explotación, estas mineras generan y han generado con el pasar de los años relaves que en su composición poseen una baja ley de plata, el cual no se ha podido extraer más por el elevado costo que esto ocasionaría. Este es el caso de los relaves del distrito de Madrigal, de la minera El Madrigal en la provincia de Caylloma, donde la plata se encuentra acompañada de minerales sulfurados que presentan resistencia a la recuperación del metal valioso debido a que los elementos se encuentran diseminados dentro del mineral. Esto requiere una mayor liberación para obtener una buena recuperación, y para esto es necesario un pre tratamiento que permita recuperar la plata.. 1.2. OBJETIVO 1.2.1. Objetivo general Mejorar la recuperación de plata a partir de minerales argentíferos refractarios del tipo marginal, del distrito de Madrigal-Arequipa mediante la realización del pre tratamiento de tostación oxidante para la realización posterior de la cianuración convencional.. 1.2.2. Objetivos específicos •. Evaluar la recuperación de plata en minerales argentíferos refractarios marginal mediante pre tratamiento utilizando el proceso de tostación.. 1.
(15) •. Mejorar la recuperación de plata de los minerales argentíferos refractarios mediante el proceso de cianuración.. •. Evaluar la liberación de Azufre del mineral marginal mediante proceso piro metalúrgico.. •. Determinar la eficiencia del proceso, según las condiciones propuestas en el estudio, para |la recuperación de plata del mineral argentífero refractario.. 1.3. HIPÓTESIS Al aplicar el pre tratamiento de tostación oxidante para el mineral refractario argentífero marginal del distrito de Madrigal se conseguirá mayor porcentaje de recuperación de plata a ser disuelta en la siguiente etapa de cianuración convencional mediante agitación.. 1.4. JUSTIFICACIÓN La presente investigación se justifica porque se trata de mejorar la recuperación de plata contenido en minerales marginales (relaves), que va a permitir elevar los resultados de la cuantificación de la plata, reduciendo costos y dando aporte al cuidado del medio ambiente. 1.4.1. Justificación Ambiental La realización de esta investigación se justifica en la medida que se proponga una alternativa para un adecuado acondicionamiento de los relaves minerales en el distrito de Madrigal, ya que estos vienen generando contaminación de suelo por metales pesados; principalmente hierro; a través de las partículas en suspensión y drenaje acido; así también contaminación del agua del canal que llega a la población; a través de la formación de sedimentos en la profundidad de este, afectando no solo la flora y fauna, sino también en parte a la población. 2.
(16) 1.4.2. Justificación tecnológica El presente trabajo de investigación es un aporte científico – tecnológico, base para el desarrollo de una aplicación de tecnología alterna, para ser aplicados en la recuperación de elementos metálicos de los relaves del distrito de Madrigal.. 1.4.3. Justificación Económica El presente trabajo pretende dar un valor agregado de los relaves mediante la recuperación del metal de interés a partir de minerales marginales para su posterior tratamiento a nivel industrial y generar dinámicas comerciales de mayores ingresos económicos.. 1.5. VARIABLES 1.5.1. Variables Independientes •. Granulometría ((P80)#malla). •. Temperatura de tostación (°C). •. Tiempo de tostación (Hrs.). 1.5.2. Variables Dependientes •. Recuperación de plata (%). •. Liberación de azufre (%). 1.5.3. Parámetros •. pH de cianuración. •. Concentración de cianuro (%). •. Tiempo de lixiviación (Hrs.). 3.
(17) CAPITULO II MARCO TEORICO. 2.1. ANTECEDENTES En el distrito de Madrigal existen terrenos ocupados por pasivos de la actividad Minerometalúrgico de la Mina Madrigal en actual abandono que contienen mineral refractario argentífero marginal. El pasivo Madrigal se encuentra ubicada en la margen derecha del río Colca en el Departamento de Arequipa, Provincia de Caylloma, Distrito Madrigal (15º35´14” de latitud sur y 71º50´14” de longitud oeste, 3400 msnm), se realizaba la explotación minera de Hierro y Plata utilizando el sistema de boca mina o socavón y como producto del procesamiento por concentración eliminaron sus relaves a las quebradas adyacentes a la zona. Teniendo resultados de investigación de concentración de metales del pasivo (Anexo 15). (Martinez Manchego , 2018) Algunos minerales de oro de Arabia Saudita, como el de la mina Al-Amar, sufren una baja eficiencia de lixiviación mediante el proceso de cianuración tóxica, generando relaves con 4.3ppm de Ag, para poder liberar el metal precioso le realizaron un pre tratamiento de tostación a 400 ° C, durante 2 h, para liberar cantidades de plata diseminados para que puedan extraerse durante la lixiviación alcanzando aproximadamente el 50% de recuperación. (Mahmoud, Award, & Altalhi, 2018) En otra investigación se evaluó el tostado como pre tratamiento de recuperación en temperatura de 700°C en 2 horas, alcanzando 67.57%, de recuperación de plata (Abdollahi, Karimi, Amini, & Akcil , 2015). 4.
(18) 2.2. DISTRITO DE MADRIGAL 2.2.1. Denominación El distrito de Madrigal es uno de los veinte distritos que conforman la provincia de Caylloma, en el departamento de Arequipa, creado durante los primeros años de la República. Según el último censo nacional del 2017, el distrito de Madrigal tiene una población rural de 648 habitantes, que se ubican en 634 viviendas. (Instituto Nacional de Estadística e Informática (INEI), 2017) Es considerado un distrito en pobreza extrema, dedicándose principalmente a las actividades económicas como la ganadería, donde hay criadores de ganado vacuno y ovino, además desarrollan la agricultura como otra de sus principales actividades.. 2.2.2. Ubicación Geográfica El distrito de Madrigal se ubica en la parte Sur de la Provincia de Caylloma; a la margen derecha del Río Colca; a una altura de 3360 msnm. Se encuentra rodeado por grandes nevados, como Sabancaya, Ampato y Chotoney. La ubicación está delimitada por las siguientes coordenadas Tabla 1: Tabla 1 Coordenadas UTM del distrito de Madrigal. Hemisferio Sur Zona 19 Datum WGS 84 Coordenadas 178000, 8260000; 216000, 8280000 Fuente: Evaluación geodinámica y modelamiento geotécnico del deslizamiento de Madrigal –Arequipa, Gómez Avalos J. C., 2017, Universidad Nacional Mayor de San Marcos. El distrito de Madrigal tiene una superficie de 160.1 Km2 y su extensión se muestra en la Figura 1.. 5.
(19) Figura 1 Distrito Madrigal. Fuente: Google Maps. 2.2.3. Limites Los límites del distrito de Madrigal se presentan en la Tabla 2 y en la Figura 2:. Tabla 2 Límites del distrito de Madrigal. Norte Sur Este Oeste. Caylloma Rio Colca Lari Tapay. Fuente: Propia. Figura 2 Límites del distrito de Madrigal. Fuente: Google Maps. 6.
(20) 2.2.4. Clima Según la clasificación climática de Thornthwaite, la zona presenta un clima regional del tipo semi-seco a frío, la estación seca comprende los meses de abril a noviembre, correspondiente al otoño e invierno Austral, con una humedad relativa baja y temperaturas máximas de 16°C (60°F) y temperaturas mínimas de 3°C (37°F) aproximadamente. La temporada de lluvias corresponde a los meses de diciembre a marzo (verano austral). (SENAMHI, 2014). 2.2.5. Accesibilidad La accesibilidad al distrito de Madrigal se presenta en la Tabla 3, donde se mide la distancia desde Arequipa, el estado de carreteras y el tiempo aproximado de llegada.. Vía. Tabla 3 Accesibilidad al distrito de Madrigal. Distancia Estado Tiempo Aproximado. Arequipa – Yura. 36.5 km. Asfaltada. 50 min. Yura – Chivay. 155.5 km. Afirmada. 2 h 30 min. Chivay – Madrigal. 20 km. Afirmada. 1h. Fuente: Evaluación geodinámica y modelamiento geotécnico del deslizamiento de Madrigal –Arequipa, Gómez Avalos J. C., 2017, Universidad Nacional Mayor de San Marcos. 2.2.6.. Mina Madrigal. Las operaciones Minero-Metalúrgicas, están paralizadas desde 1991. La Mina Madrigal se ubica en la provincia de Caylloma del departamento de Arequipa sobre una altitud de 3000 msnm. La mineralización en Madrigal es polimetálica: Cu-Ag-Zn-Pb. Se consideran dos eventos de mineralización, el primero corresponde a Cu-Ag con abundante cuarzo lechoso y el segundo por Pb-Zn con cuarzo lechoso y carbonatos. (Acosta & Huanacuni, 2008) La base geológica de la mina y pasivo Madrigal se muestra en la Figura 3: 7.
(21) Figura 3 Mapa Metalogenético. Fuente: Chira J., Vargas L., Vásquez R., Palomino C., (2011), Geoquímica Ambiental de la Cuenca del Rio Camaná - Majes Colca, (p 130), Lima, Instituto Geológico Minero y Metalúrgico (INGEMMET). 8.
(22) Las instalaciones donde se realizaba las operaciones de la Mina Madrigal se muestran en la Figura 4:. Figura 4 Instalaciones de la Mina Madrigal. Fuente: Chira J., Vargas L., Vásquez R., Palomino C., (2011), Geoquímica Ambiental de la Cuenca del Rio Camaná - Majes - Colca, (p 130), Lima, Instituto Geológico Minero y Metalúrgico (INGEMMET). La mina realizaba el método de minado corte y relleno ascendente con posterior método de flotación selectiva de cobre, plomo y zinc respectivamente. Los residuos finales provenientes de la última flotación selectiva (zinc) eran conducidos por gravedad a través de una tubería de fierro de 6 pulgadas, hacia una presa ubicada al sur de la planta de beneficio, las ubicaciones se muestran en la Figura 5.. 9.
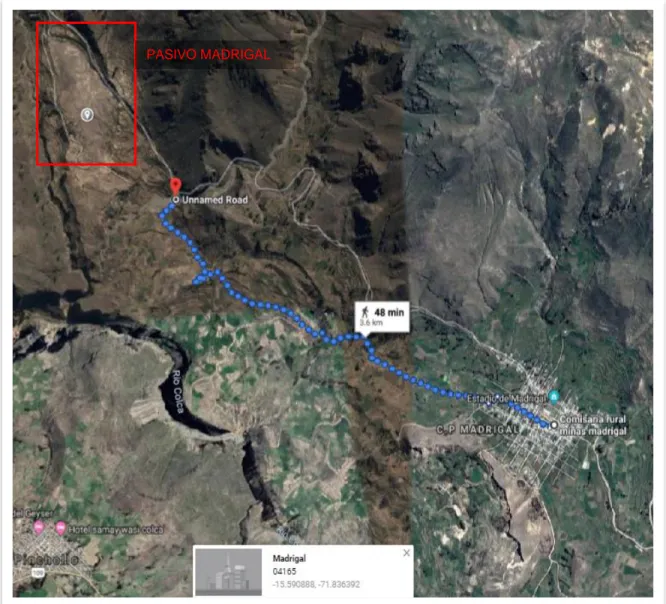
(23) Figura 5 Ubicación de la mina Madrigal y su pasivo minero. Fuente: Guillen N., Vásquez R., (2013), Caracterización geoquímica de sedimentos de quebrada en los alrededores del yacimiento minero Madrigal (Chivay Arequipa), (p.160), Boletín de la Sociedad Geológica del Perú, INGEMMET. 2.2.7. Pasivo Madrigal El relave acumulado en 18 años de operación se estima en 3155000 metros cúbicos. De acuerdo a información obtenida el relave acumulado desde el año 1972 a 1981 es de 1409150 metros cúbicos. (Minaya Lizárraga, 2006) El pasivo minero fue depositado en un ambiente natural sin construcción de muros de contención como se muestran en la Figura 6, este pasivo está ubicado aproximadamente 75 metros del margen izquierdo del río Cahuira que es una de las fuentes de riego de cultivos aledaños y es uno de los afluentes del río Colca.. 10.
(24) Figura 6 Pasivo Madrigal. Fuente: Propia. Las lluvias que generalmente se dan entre diciembre y marzo han generado un manto de tierra encima de los relaves del pasivo minero, esto por arrastre de agua, y esto ha originado el crecimiento de plantas como se muestra en la Figura 7.. Figura 7 Pasivo Madrigal in situ. Fuente propia. 11.
(25) 2.3. PLATA La plata es sinónimo de riqueza, abundancia, brillo, blancura, maleabilidad, pureza y perfección. (Pastor , 2010). Las minas de Potosí proveyeron casi la totalidad de la plata del virreinato de Perú en el siglo XVI y más de 68% en el XVII. (Gil Montero, 2014). 2.3.1. Definición La plata es un elemento químico, del grupo de los metales de transición, que tiene como símbolo químico Ag, el cual proviene de la abreviación de su nombre en latín argentum, que significa blanco y brillante. La plata es un metal escaso en la corteza terrestre, sin embargo es el más abundante y menos costoso de los metales preciosos (oro, plata, paladio y platino). (Morones Ramirez, 2010). 2.3.2. Propiedades Físicas Se presenta bajo la forma de un metal perfectamente blanco característico: después del oro puede decirse que la plata es el metal más maleable y dúctil que se conoce, supuesto que puede reducirse a láminas de un espesor de 1/500 de milímetros. La plata es un metal inoxidable en circunstancias ordinarias, cualidad que la hace muy útil para las transacciones sociales. (Muñoz de Luna, 1877) La plata tiene 10.5 de densidad y por el laminado alcanza 10.6. Cristaliza en el sistema regular. Su peso atómico y número atómico es de 107.88 y 47 respectivamente. La temperatura de fusión de la plata es de 960.5°C y la temperatura de ebullición es de 1955°C. Sin embargo la plata empieza a desprender vapores a más baja temperatura, los que se hacen sensibles entre 1200 a 1500°C. La plata es conductor de la electricidad más perfecto comparada con otros metales. La plata es menos 12.
(26) maleable que el estaño, plomo, zinc y oro, pero más maleable que el cobre, aluminio, hierro y platino. (Vargas Gallardo , Metalurgia del oro y la plata, 1990) Las propiedades físicas de la plata se presentan en la Tabla 4. Tabla 4 Propiedades Físicas de la Plata. PROPIEDAD VALOR Numero Atomico. 47. Peso Atomico. 107.88. Densidad. 10.5 – 10.6 g/cm3. Punto de Fusion. 960.5°C. Punto de Ebullicion. 1955°C. Fuente: Juan Vargas Gallardo, 1990, Metalurgia del oro y la plata, San Marcos. 2.3.3. Propiedades Químicas La plata no se oxida por el aire seco o húmedo, el oxígeno y el agua , y muy ligeramente cuando sube la temperatura. El hidrógeno sulfurado ennegrece la plata, debido a la formación de sulfuro de plata. Los álcalis cáusticos, carbonatos alcalinos y el clorato de potasio, no atacan a la plata. La plata metálica es poco atacada por el ácido clorhídrico y el sulfúrico diluido, aún en ebullición. El ácido sulfúrico disuelve la plata sólo cuando es concentrado y caliente y el ácido nítrico aún diluido, disuelve con mucha facilidad. (Vargas Gallardo , Metalurgia del oro y la plata , 1990). 2.3.4. Usos La plata como es muy resistente al ácido acético, es usado en la industria del ácido acético, el vinagre, la sidra y la cerveza se utilizan recipientes de plata. También se emplea en las barras colectoras y devanados de plantas eléctricas, en soldadores de plata, amalgamas dentales, baterías. 13.
(27) de gran capacidad, cojinetes de motores, objetos de plata de ley y pinturas cerámicas. Otras aplicaciones son las aleaciones de bronce soldadura y el plateado de cuentas de vidrio. La plata se utiliza para la fabricación del formaldehído acetaldehído y aldehídos superiores por deshidrogenación catalítica de los alcoholes primarios correspondientes. En muchas instalaciones, el catalizador consiste en una capa fina de plata cristalina de muy alta pureza. Un uso importante de la plata es en la fotografía. La reacción única e instantánea de los haluros de plata al exponerlos a la luz es lo que hace que este metal sea prácticamente indispensable en películas, placas y papel de impresión fotográfica. (Nordberg, 2012) En la medicina los metálicos compuestos de plata y la plata se usa ampliamente en dispositivos médicos y productos de cuidado de la salud para proporcionar una acción antibacteriana y antifúngica. Desde la década de 1940 los lápices de plata (Nitrato de plata) fueron utilizados para eliminar las verrugas feas, granulaciones y callosidades piel, la plata ha sido una opción antibióticos (0.1-0.5%) para el tratamiento de infecciones de la piel y las infecciones bacterianas y fúngicas asociada con la enfermedad respiratoria, cirugías óseas y articulares, prótesis, cardíacodispositivos, lesiones oculares y la cirugía de trasplante; la sulfadiazina de plata representa una segunda generación de antibióticos de plata. Desarrollado por Charles Fox en 1968, este complejo combina las propiedades antibióticas de plata con una sulfonamida. (Lansdown, 2006). 2.3.5. Producción de Plata en el Perú Para inicio del año 2019, las regiones de Arequipa, La Libertad, Junín y Ancash mantienen el liderazgo en la producción nacional de cobre, oro, plata y plomo. Junín se sitúo como líder en la producción de concentrado de plata con el 16.8%, Ancash se ubica en segundo lugar con una. 14.
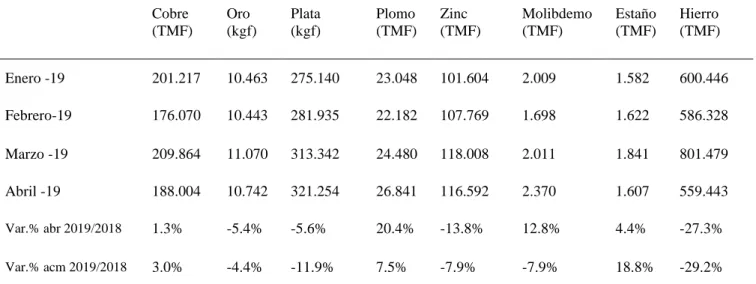
(28) producción de 16.4%, mientas que Lima se ubica en tercer lugar con un 15.8%. (Sociedad Nacional de Minería Petróleo y Energía, 2019) La producción de plata en el Perú para el año 2018 fue de 4.162658 Miles de TMF, la producción mensual se muestra en la Tabla 5. %. (Sociedad Nacional de Minería y Petróleo, 2019) Tabla 5 Producción Minera Perú 2018. Cobre (TMF). Oro (kgf). Plata (kgf). Plomo (TMF). Zinc (TMF). Molibdemo (TMF). Estaño (TMF). Hierro (TMF). Enero -18. 188.033. 11.549. 320.042. 21.615. 110.231. 2.221. 1.314. 985.955. Febrero-18. 178.510. 10.692. 342.581. 22.778. 118.169. 1.982. 1.327. 942.042. Marzo -18. 200.482. 11.101. 349.263. 23.163. 118.534. 2.482. 1.421. 900.047. Abril -18. 185.604. 11.354. 340.221. 22.295. 135.269. 2.100. 1.540. 769.945. Mayo -18. 2014.141. 12.441. 362.330. 22.855. 137.519. 2.040. 1.632. 816.647. Junio -18. 206.924. 12.340. 353.058. 23.399. 123.936. 2.244. 1.647. 615.830. Julio -18. 195.584. 12.432. 374.093. 26.167. 124.416. 1.957. 1.623. 687.600. Agosto – 18. 207.161. 12.573. 364.255. 26.534. 136.688. 2.585. 1.632. 981.568. Setiembre -18. 209.830. 11.991. 351.363. 24.619. 120.075. 3.048. 1.622. 908.393. Octubre -18. 206.171. 12.474. 332.282. 23.498. 116.652. 2.807. 1.550. 460.687. Noviembre -18. 214.253. 11.800. 332.927. 23.908. 112.983. 2.174. 1.597. 569.214. Diciembre -18. 230.258. 11.897. 340.243. 28.364. 120.202. 2.393. 1.696. 895.943. Total 2018. 2,436.951. 142.643. 4,162.658. 289.195. 1,474.674. 28.034. 18.601. 9,533.871. Fuente: Sociedad Nacional de Minería Petróleo y Energía, (2019), Boletín Estadístico Mensual Minero / Diciembre 2018. Para finales del mes de abril del 2019 la producción de plata en el Perú fue de 1.191671 Miles de TMF, la producción mensual se muestra en la Tabla 6.. Tabla 6 Producción Minera Perú Abril 2019.. 15.
(29) Cobre (TMF). Oro (kgf). Plata (kgf). Plomo (TMF). Zinc (TMF). Molibdemo (TMF). Estaño (TMF). Hierro (TMF). Enero -19. 201.217. 10.463. 275.140. 23.048. 101.604. 2.009. 1.582. 600.446. Febrero-19. 176.070. 10.443. 281.935. 22.182. 107.769. 1.698. 1.622. 586.328. Marzo -19. 209.864. 11.070. 313.342. 24.480. 118.008. 2.011. 1.841. 801.479. Abril -19. 188.004. 10.742. 321.254. 26.841. 116.592. 2.370. 1.607. 559.443. Var.% abr 2019/2018. 1.3%. -5.4%. -5.6%. 20.4%. -13.8%. 12.8%. 4.4%. -27.3%. Var.% acm 2019/2018. 3.0%. -4.4%. -11.9%. 7.5%. -7.9%. -7.9%. 18.8%. -29.2%. Fuente: Sociedad Nacional de Minería Petróleo y Energía, (2019), Boletín Estadístico Mensual Minero / Abril 2019. La producción de Abril del presente año cayó en un 5.6% respecto a la producción de abril del 2018 y creció en 2.5% respecto al mes de marzo del 2019, esto se grafica en la Figura 8.. Figura 8 Producción Minera Mensual 2018-2019. Fuente: Sociedad Nacional de Minería Petróleo y Energía, (2019), Boletín Estadístico Mensual Minero / Abril 2019. Las principales empresas y su participación en la producción de plata del año 2018 se muestran en la Figura 9.. 16.
(30) Figura 9 Principales empresas productoras de Plata 2018. Fuente: Sociedad Nacional de Mineria Petróleo y Energía, (2019), Reporte Estadístico Minero Energético 2018. Las principales empresas y su participación en la producción de plata hasta finales de abril del año 2019 se muestran en la Figura 10.. Figura 10 Principales empresas productoras de plata Abril 2019. Fuente: Sociedad Nacional de Minería Petróleo y Energía, (2019), Boletín Estadístico Mensual Minero / Abril 2019. La cotización de la plata ha sufrido una ligera caída a comparación de la cotización iniciado el año 2019, como se muestra en la Figura 11.. Figura 11 Cotización de la Plata 2018-2019. Fuente: Sociedad Nacional de Minería Petróleo y Energía, (2019), Boletín Estadístico Mensual Minero / Abril 2019. 17.
(31) 2.4. TOSTACIÓN 2.4.1. Consideraciones La oxidación de sulfuros refractarios y constituyentes carbonáceos de minerales y concentrados se puede lograr por tostación en presencia de un gas oxidante como aire u oxígeno. El objetivo es producir una calcina porosa de óxidos para facilitar el mejor contacto con soluciones lixiviantes minimizando, al mismo tiempo el consumo de reactivo. (Hinojosa C., 2002) 2.4.2. Minerales Refractarios Los minerales refractarios son menas no oxidadas o parcialmente oxidadas que contienen principalmente materiales carbonáceos, sulfuros y/o teluros. Se puede distinguir entre una refractariedad química y física. La refractariedad química es relativamente rara y se resume en tres condiciones: a) Teluros. b) Componentes de la mena que pueden reaccionar o descomponer con cianuro. c) Componentes que consumen oxígeno. Físicamente se distinguen cinco tipos de minerales refractarios: (Vargas Gallardo , Metalurgia del oro y la plata , 1990) a) Los que contienen oro unido o encapsulado a la matriz, siendo ésta de carbón, pirita, arsenopirita o silicatos. b) Los que contienen aleaciones con antimonio o plomo. c) Los que tienen mineral revestido de mineral; estas capas de mineral pueden ser óxidos de hierro, cloruro de plata, compuestos de manganeso, antimonio y plomo. Dichas capas o películas se forman en el tratamiento de la mena.. 18.
(32) d) Los que contienen materiales absorbentes, carbonatos y/o arcillas, los cuales retienen al metal preciosos y no dejan que pase a la disolución de lixiviación. e) Los que sufren descomposición de la matriz: o Sulfuros que pueden descomponer y formar cianicidas. o Sulfuros, tiosulfatos, arseniuros y compuestos de hierro que pueden consumir oxigeno. o Acido húmico. Los minerales sulfurados son aquellas especies de minerales que además de su contenido de azufre en la forma de sulfuro con valencia 2-, tienen la particularidad de estar exentos de oxígeno en la especie mineralógica propiamente tal. (Portal Minero S.A., 2006). 2.4.3. Tostación Oxidante La tostación Oxidante tiene como objeto liberar las partículas del mineral precioso ocluidas o unidas a los sulfuros, arsenopiritas o carbón y destruir el material carbonáceo y cualquier cianicida potencial, obteniéndose un calcinado oxidado y poroso, en el cual el mineral precioso está más liberado y por lo tanto más fácilmente accesible para el agente de lixiviación. Es uno de los tratamientos más utilizados, pues consigue eliminar As, S, Sb y otras sustancias volátiles una vez oxidadas, también oxida teluros y metales bases. (Vargas Gallardo , Metalurgia del oro y la plata, 1990) Consiste en la oxidación parcial de los sulfuros del concentrado y en la eliminación parcial del azufre de éste como SO2 y ocurre según reacciones sólido-gaseosas, a temperaturas del orden de 500 a 800ºC. La temperatura se elige dependiendo de los productos que se deseen obtener.. 19.
(33) La fase gaseosa contiene normalmente O2 y SO2 en la alimentación y productos y cantidades menores de gases SO3 y S2 dependiendo según las reacciones de oxidación[1a][1b]. (Portal Minero S.A., 2006) S2 + 2O2 = 2SO2. [1a]. 2SO2 + O2 = 2SO3. [1b]. Las reacciones sólido-gaseosas de oxidación pueden representarse por la relación general[2]. Σr <Reactivos> +r1 [O2] + r2[SO2] = Σp <Productos> + p1[O2] + p2 [SO2]. [2]. con r1 > p1 y r2 < p2. La reacción química general de la tostación es[3]: MS + 1.5O2 = MO + SO2. [3]. Donde M= Metal divalente. 2.5. LIXIVIACIÓN DE PLATA Alrededor de 1840, Elkington obtuvo una patente por el uso de soluciones de cianuro de potasio para galvanoplastiar oro y plata. Elsner lideró la evaluación del papel del oxígeno en la disolución del oro mediante soluciones de cianuro. (Logsdon, Hagelstein, & Mudder, 2001) Los procesos de lixiviación utilizados para recuperar valores de oro y plata se empezaron a usar en la década que se inicio en 1860. El proceso de Von Patera en el cual se disolvía valores de oro y plata con hiposulfito de sodio y se precipitaba con sulfuro de calcio, éste tratamiento no dio resultado porque la plata estaba en forma de sulfosales e incluida en sulfuros de plomo y cobre. (Procesos Hidrometalurgicos en la Minería de oro, (s.f.)). 20.
(34) Las patentes formalizadas por McArthur y los hermanos Forrest en 1887 y 1888 efectivamente establecieron el proceso vigente de cianuración, el uso de la disolución del cianuro y la precipitación por medio del zinc. Sin embargo, existían patentes anteriores en los Estados Unidos relacionadas con la lixiviación con cianuro (Rae en 1869) y la recuperación a partir de soluciones cloradas utilizando carbón vegetal (Davis en 1880). La primera planta de cianuración a escala comercial comenzó a funcionar en la Mina Crown en Nueva Zelanda en 1889, y hacia 1904 los procesos de cianuración también estaban en marcha en Sudáfrica, Australia, Estados Unidos, México y Francia. (Logsdon, Hagelstein, & Mudder, 2001) El proceso hidrometalúrgico más utilizado actualmente en la recuperación de metales preciosos, es la cianuración, donde el metal es disuelto mediante soluciones alcalinas cianuradas, en presencia de oxígeno.. 2.5.1. Cianuración de plata Ha sido propuesta la siguiente reacción. [4],. la plata disuelve en soluciones con presencia de. cianuro oxígeno:. 4Ag + 8CN- + O2 + 2H2O = 4Ag(CN)2- + 4OH-. [4]. Una ecuación general similar fue sugerida por primera vez para el oro. Luego se propuso una reacción similar pero se sugirió que se llevara en dos pasos [5a][5b] : 2Ag + 4CN- + O2 + 2H2O = 2Ag (CN)2- + 2OH- + H2O2. [5a]. 2Ag + 4CN- + H2O2 = 2Ag(CN)2- + 2OH-. [5b]. Luego:. Por otro lado se sugirió que la disolución de oro puede ocurrir con la liberación de hidrógeno en lugar de oxígeno[6], siendo así:. 21.
(35) 2Ag + 4CN- + 2H2O = 2Ag(CN)2- + 2OH- + H2. [6]. Todas las reacciones representan oxidación reducción y se pueden resolver en los componentes de oxidación y reducción de forma separada. El paso de oxidación implica la formación del ión argentocianuro y es el mismo para todas las reacciones [7], es decir : Ag + 2CN- = Ag(CN)2- + e Sin embargo las siguientes reacciones. [7]. [7a][7b][7c][7d] son. diferentes en la naturaleza de los pasos. de reducción que son: (Deitz & Halpern, 1953). O2 + H2O + 4e = 4OH-. [7a]. O2 + 2H2O + 2e = H2O2 + 2OH-. [7b]. H2O2 + 2e = 2OH-. [7c]. 2H2O + 2e = 2OH- + H2. [7d]. Figura 12 Potencial - pH Diagrama para Ag-H2O y Ag-H2O-CN Temperatura 25°C. Fuente: Deitz G. y Halpern J. (1953) Reaction of silver with aqueous solutions of cyanide and oxygen, (p.1109-1116), The Journal of The Minerals JOM. 22.
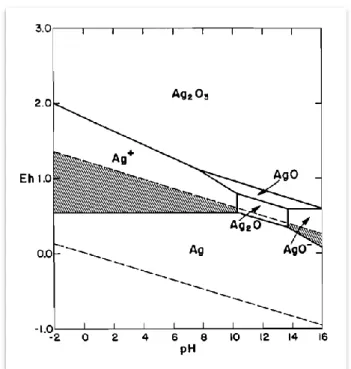
(36) En la Figura 12 se muestran los potenciales correspondientes a las reacciones en funcion del pH y total de concentración de cianuro en solución. Los cálculos fueron hechos y los resultados trazados de acuerdo al Método de Pourbaix(Figura 13) cuyo diagrama para el sistema Ag-H20 se ha ampliado para incluir el efecto de CN-. (Deitz & Halpern, 1953). Figura 13 Potencial-pH Diagrama para el sistema Ag-H2O Temperatura 25°C. Fuente: Hiskey, J., Atluri, V., (1988), Dissolution Chemistry of Gold, (p.95), Arizona, Mineral Processingand Extractive Metallurgy. Un diagrama de Pourbaix es una representación gráfica del potencial eléctrico en función del pH para un metal bajo condiciones termodinámicas estándar. Este diagrama tiene como base los equilibrios químicos y electroquímicos y define el dominio de la estabilidad del electrolito, el metal y sus compuestos relacionados en proceso electrolítico. (Pourbaix , 1974) La Figura 13 muestra el comportamiento de Eh-pH para plata pura a 25 ° C. El diagrama fue construido para especies de plata disueltas que tienen concentraciones iguales a 10 - 4 M. La plata, como el oro, son metales muy nobles que cubren una gran porción del dominio de la estabilidad del agua. La plata metálica es totalmente estable en ausencia de agentes oxidantes. Sin embargo, 23.
(37) la plata se puede disolver en condiciones oxidantes en ácido a moderadamente en soluciones alcalinas para producir Ag+ y en soluciones fuertemente alcalinas produce AgO- Las áreas sombreadas en la Figura 13 indican las regiones respectivas para estas especies a 10 - 4 m. (Hiskey & Atluri, 1988) Para la Figura 12 sólo la plata y sus compuestos monovalentes han sido considerados. Los potenciales mostrados para la reducción de oxígeno y agua corresponde a presiones de 1 atm de O2 y 10-6 atm de H2 respectivamente, y para una concentración de H202 de 10-6 mol por litro. Los potenciales para la oxidación de Ag y el equilibrio entre Ag+y Ag2O corresponden al diluir las soluciones de plata, la concentración total disuelto la plata (incluidos Ag. +. y Ag (CN) 2-) se. toma arbitrariamente como 10-6 mol por litro de acuerdo con la convención de Pourbaix. (Deitz & Halpern, 1953) En la Figura 12 se muestra que en ausencia de cianuro la solubilidad de Ag+ supera los 10-6 mol por litro en valores de pH por debajo de 12.3. A un pH más alto se forma Ag2O El potencial de equilibrio entre Ag y Ag + es 0.446 v. El cianuro reduce la concentración de ión Ag + libre. [8]. (correspondiente a una dada. concentración total de plata de 10-6 mol por litro a través de la formación del complejo argentocianuro). Ag+ + 2CN- = Ag(CN)2. [8]. Esto da lugar a la desaparición de la fase Ag20 y en el descenso del potencial Ag-Ag +. Estos resultados se resumen en la Figura 14, donde las diferencias entre los potenciales para las diversas reacciones de reducción y oxidación se representan como funciones del pH, en las condiciones indicadas arriba para una concentración total de cianuro (incluyendo CN- y HCN) de 10-2 mol por litro. Estas figuras muestran las ecuaciones de la cinética de reacción [7a][7b] y [7c] que 24.
(38) corresponden a potenciales positivos (es decir, en la disminución de energía libre) y por lo tanto son termodinámicamente factibles. La reacción. [7c] corresponde. a un potencial negativo y, por lo. tanto, es termodinámicamente improbable en estas condiciones. (Deitz & Halpern, 1953). Figura 14 Potencia para varias reacciones disueltas de plata en cianuro acuoso Temperatura 25°C. Fuente: Deitz G. y Halpern J. (1953) Reaction of silver with aqueous solutions of cyanide and oxygen, (p.11091116), The Journal of The Minerals JOM. Figura 15 Potencial-pH Diagrama para el sistema Ag-H2O-CN Temperatura 25°C. Fuente: Hiskey, J., Atluri, V., (1988), Dissolution Chemistry of Gold, (p.95), Arizona, Mineral Processingand Extractive Metallurgy. 25.
(39) La Figura 15 muestra el comportamiento Eh-pH de la plata donde se aprecia la especie estable de la plata en solución acuosa de cianuro y las condiciones necesarias para obtenerlas a 25°C. Las regiones sombreadas muestran cuando la plata es soluble en el dominio de estabilidad al agua.. 2.5.2. Cianuro Los cianuros mas importantes que se usan en este procedimiento son el de potasio y el de sodio. Siendo este último el más comercial. Una solución de cianuro alcalino en agua se hidroliza como sigue [9]: NaCN + H2O = HCN + NaOH. [9]. La extensión hasta donde prosigue esta hidrólisis en las soluciones de cianuros comerciales en agua, depende de la cantidad de álcali libre en el cianuro. Si este álcali es apreciable, entonces la descomposición del cianuro podría ser despreciable. En ausencia del álcali libre apreciable, la hidrólisis puede retardarse mediante la adición de cal. La adición de cal a la pulpa con cianuro es una práctica universal no solamente para evitar pérdidas de cianuro por hidrólisis sino también para neutralizar cualquier constituyente ácido del mineral, que de otra manera liberaría ácido cianhidrico. (Vargas Gallardo , Metalurgia del oro y la plata, 1990) En la Figura 16 se puede observar la extensión de esta reacción de equilibrio como una función del pH. A un valor de pH = 9.3 la mitad del cianuro total existe como HCN y la otra mitad como ión CN-. Del mismo modo, a pH mayores que 10.2, más del 90% del cianuro total se encuentra como ión CN-, y a pH menores que 8.4, como HCN. (Pérez Domínguez & Higuera Cobos, 2008) Es importante tener en cuenta que el cianuro de hidrógeno tiene una presión de vapor relativamente alta, 100 kPa a 26°C, por lo cual se volatiliza con rapidez en superficie líquida a 26.
(40) condiciones ambientales, causando un decrecimiento de la concentración de cianuro en la solución. La velocidad de volatilización depende entonces de la concentración de HCN, en función de la concentración de cianuro total, del pH, del área superficial, de la profundidad de la solución, la temperatura y de los fenómenos de transporte asociados con la mezcla.. Figura 16 Formación de HCN y CN en soluciones acuosas en función del pH. Fuente: Domínguez J., Higuera O., (2008), Comportamiento Electroquímico del Cianuro, Revista Científica Ingeniería y Desarrollo. Por consiguiente, se prefiere que los sistemas de lixiviación con cianuro sean operados a pH que minimicen las pérdidas de cianuro, manteniéndose si es posible por encima de 10; esto es un factor importante a considerar en los procesos de recuperación de metales. (Pérez Domínguez & Higuera Cobos, 2008) La Figura 17 muestra el comportamiento de Eh-pH para el cianuro en agua a 25 ° C donde se observa que el cianuro termodinámicamente no presenta estabilidad en agua, pero si puede estar en ella ya que la reacción de oxidación le toma mucho tiempo. Por otra parte, se tiene que tanto el cianuro de hidrógeno como el cianuro libre pueden oxidarse formando cianato en presencia de oxígeno y bajo condiciones oxidantes adecuadas. (Pérez Domínguez & Higuera Cobos, 2008). 27.
(41) Figura 17 Potencial-pH Diagrama para el sistema CN-H2O Temperatura 25°C. Fuente: Domínguez J., Higuera O., (2008), Comportamiento Electroquímico del Cianuro, Revista Científica Ingeniería y Desarrollo. El ácido carbónico que es mas fuerte que el cianhidrico descompone las soluciones de cianuros alcalinos, de acuerdo con la siguiente reacción química [10]: (Vargas Gallardo , Metalurgia del oro y la plata, 1990) NACN + H2CO3 = HCN + NaHCO3. [10]. Esta reacción también puede evitarse con el uso de la cal. 2.5.3. Efecto de la alcalinidad Las funciones del óxido de calcio en la cianuración son las siguientes (Vargas Gallardo , Metalurgia del oro y la plata, 1990): •. Evitar pérdidas de cianuro por hidrólisis.. •. Prevenir pérdidas de cianuro por acción del anhídrido carbónico del aire.. •. Neutralizar los componentes ácidos tales como sales ferrosas, férricas y el sulfato de magnesio contenidos en el agua, antes de agregar al circuito de cianuración.. •. Descomponer los bicarbonatos del agua antes de uso en la cianuración [11] [12]. HCO- 3+ Ca+2 = H+ + CaCO3. 28. [11].
(42) HCO-3 + H+ = H2O + CO2 •. [12]. Neutralizar la acidez de los constituyentes de la mena [13] [14] [15] [16].. FeSO4 + Ca(OH)2 = CaSO4 + Fe(OH)2. [13]. (con aire mínimo) 4Feso4 + 4Ca(OH)2 + 2H2O = 4Fe(OH)3 + 4CaSO4. [14]. (con aire en exceso). •. 2Fe2O3SO3 + Ca(OH)2 + 5H2O = 4Fe(OH)3 + CaSO4. [15]. MgSO4 + Ca(OH)2 = Mg(OH)2 + CaSO4. [16]. Facilitar el asentamiento de las partículas finas de modo que pueda separarse la solución rica clara de la mena cianurada.. •. Prevenir la pérdida de cianuros por la acción del dióxido de carbono en el aire [17]. 2NaCN + CO2 + H2O = 2HCN + Na2CO3. [17]. Se adiciona lo necesario para mantener la concentración de CaO libre en la solución por encima de 100 gr/m3. Es muy importante señalar que debido al valor tan grande de la constante de estabilidad (pK=9.36) del HCN el pH debe estar entre 10 y 11.. 2.5.4. Lixiviación de sólidos dispersos Los sólidos que forman lechos impermeables, bien antes o durante la lixiviación, se tratan dispersándolos en el disolvente mediante agitación mecánica en un tanque o mezclador de flujo. El residuo lixiviado se separa después de la solución concentrada por sedimentación o filtración. (MacCabe, Smith, & Harriott, 2007). 29.
(43) Este método es usado en mineral con tamaño de partícula reducida debido a la baja velocidad de sedimentación de las partículas y a su gran superficie las operaciones posteriores de separación y lavado resultan mas difíciles para los materiales de tamaño reducido. La agitación puede conseguirse bien sea utilizando un agitador mecánico o por medio de aire comprimido. Si se utiliza un agitador de paletas, deben tomarse precauciones para evitar que todo el líquido en conjunto forme un vórtice, con lo que habría poco movimiento relativo entre los sólidos y el líquido. (Coulson, Richardson, Backhurst, & Harker, 1981). 2.5.5. Tanques Agitados Con frecuencia se confunde, la agitación y mezcla. La agitación se refiere al movimiento inducido de un material en una manera específica, normalmente en un patrón circulatorio dentro de algún tipo de contenedor. La mezcla es una distribución aleatoria, dentro y a través una de otra, de dos o más fases inicialmente separadas. Un material homogéneo simple, tal como un tanque lleno con agua fría, puede ser agitado, pero no puede ser mezclado mientras se le adhiere algún otro material (tal como una cantidad de agua caliente o un sólido en polvo). Los líquidos se agitan con más frecuencia en algún tipo de tanque o recipiente, por lo general de forma cilíndrica y provisto de un eje vertical. La parte superior del tanque puede estar abierta al aire; pero generalmente está cerrada. Las proporciones del tanque varían bastante, dependiendo de la naturaleza del problema de agitación. El fondo del tanque es redondeado, no plano, para eliminar las esquinas o regiones agudas en las que no penetrarían las corrientes de fluido. La profundidad (o altura) del líquido es aproximadamente igual al diámetro del tanque. El eje es accionado por un motor, a veces directamente conectado al eje, pero es más común que se encuentre conectado a éste, a través de una caja reductora de velocidad (MacCabe, Smith, & Harriott, 2007). 30.
(44) El agitador se sitúa a menudo en el interior de un tubo central disponiéndose las paletas de manera que el líquido ascienda hacia arriba a lo largo del mismo; el líquido se descarga entonces en la parte superior y fluye hacia abajo por el exterior del tubo proporcionando así una circulación continua como se muestra en la Figura 18. (Coulson, Richardson, Backhurst, & Harker, 1981). Figura 18 Tanque de agitado sencillo. Fuente: Coulson J, Richardson J., Backhurst J, Harker J, (1981), Lixiviación, Ingeniería Química, Reverté. 2.5.5.1. Impulsores (Agitadores) Los agitadores de impulsor o rodete se dividen en dos clases. Los que generan corrientes paralelas al eje del impulsor se llaman impulsores de flujo axial; y aquellos que generan corrientes en dirección radial o tangencial se llaman impulsores de flujo radial. Los tres principales tipos de impulsores para líquidos de baja a moderada viscosidad son las hélices, turbinas e impulsores de alta eficiencia. a) Hélices Una hélice es un impulsor de flujo axial y alta velocidad que se utiliza para líquidos de baja viscosidad, en la Figura 21a se muestra una hélice típica. La dirección de la rotación se elige generalmente para impulsar el líquido a descender, y las corrientes de flujo que salen del impulsor continúan a través del líquido en una dirección determinada hasta que chocan con el fondo del tanque, como se muestra en la Figura 19. La columna altamente turbulenta de remolinos de líquido 31.
(45) que abandona el agitador, arrastra al moverse el líquido estancado, probablemente en mayor proporción que una columna equivalente de una boquilla estacionaria. Las palas de la hélice cortan o cizallan vigorosamente el líquido. Debido a la persistencia de las corrientes de flujo, los agitadores de hélice son eficaces en tanques muy grandes. (MacCabe, Smith, & Harriott, 2007). Figura 19 Modelo de flujo para un agitador Hélice. Fuente: Coulson J, Richardson J., Backhurst J, Harker J, (1981), Lixiviación, Ingeniería Química, Reverté. b) Turbinas La hélice puede ser substituida por una turbina, que puede ser abierta o cerrada; estas ultimas son mucho mas caras. El modelo de flujo correspondiente a una turbina, mostrado en la Figura 20 es completamente diferente al obtenido con una hélice. Las turbinas pueden utilizarse para materiales bastante más viscosos que lo adecuados para las hélices. (Coulson, Richardson, Backhurst, & Harker, 1981). Figura 20 Modelo de flujo con rotor de Turbina. Fuente: Coulson J, Richardson J., Backhurst J, Harker J, (1981), Lixiviación, Ingeniería Química, Reverté. 32.
(46) Figura 21 Tipos de agitadores. Fuente: MacCabe W, Smith J, Harriott P, (2007), Agitación y mezcla de líquidos, Operaciones Unitarias en Ingeniería Química, McGraw-Hill Interamericana. En la Figura 21 se representan cuatro tipos de agitadores de turbina. En la Figura 21.b se muestra la turbina sencilla de palas rectas, que empuja al líquido en forma radial y tangencial, casi sin movimiento vertical al agitador. Las corrientes que genera se desplazan hacia fuera hasta la pared del tanque y entonces fluyen hacia arriba o hacia abajo. Tales agitadores son llamados a veces paletas. En los tanques de proceso, los agitadores industriales típicos de paletas giran a velocidades comprendidas entre 20 y 150 rpm. La turbina de disco, con palas múltiples rectas instaladas en un disco horizontal (Figura 21c), como el agitador de pala recta, crea zonas de alta velocidad de corte. Esta turbina es especialmente útil para la dispersión de un gas en un líquido. La turbina de disco de pala cóncava CD-6 mostrada en la Figura 21d también se utiliza con frecuencia para la dispersión de gas. Una turbina de pala inclinada (Figura 21e) se emplea cuando la circulación global es importante. (MacCabe, Smith, & Harriott, 2007). 33.
Figure




Outline
Documento similar
En junio de 1980, el Departamento de Literatura Española de la Universi- dad de Sevilla, tras consultar con diversos estudiosos del poeta, decidió propo- ner al Claustro de la
Entre nosotros anda un escritor de cosas de filología, paisano de Costa, que no deja de tener ingenio y garbo; pero cuyas obras tienen de todo menos de ciencia, y aun
E Clamades andaua sienpre sobre el caua- 11o de madera, y en poco tienpo fue tan lexos, que el no sabia en donde estaña; pero el tomo muy gran esfuergo en si, y pensó yendo assi
The part I assessment is coordinated involving all MSCs and led by the RMS who prepares a draft assessment report, sends the request for information (RFI) with considerations,
o Si dispone en su establecimiento de alguna silla de ruedas Jazz S50 o 708D cuyo nº de serie figura en el anexo 1 de esta nota informativa, consulte la nota de aviso de la
Proporcione esta nota de seguridad y las copias de la versión para pacientes junto con el documento Preguntas frecuentes sobre contraindicaciones y
De hecho, este sometimiento periódico al voto, esta decisión periódica de los electores sobre la gestión ha sido uno de los componentes teóricos más interesantes de la
Las manifestaciones musicales y su organización institucional a lo largo de los siglos XVI al XVIII son aspectos poco conocidos de la cultura alicantina. Analizar el alcance y