Recuperación de hidróxido de zinc, sulfuro de manganeso y oxido de plata a partir de pilas (Alcalinas D 2, Ácidas AAA, y pilas de botón)
Texto completo
(2) DEDICATORIA Gracias a Dios por permitirnos concluir esta fase de nuestra vida, por darnos la energía suficiente para luchar día a día. A nuestros padres por el apoyo incondicional que nos han brindado, por enseñarnos que no hay límites, que lo que nos propongamos podemos lograrlo y que solo depende de nosotras, por apoyarnos en todas y cada una de nuestras decisiones que hemos tomado, así como sus palabras de aliento y de cariño..
(3) AGRADECIMIENTOS. Primero y antes que nada, queremos agradecer a Dios, por estar con nosotras en cada paso que damos, por fortalecer nuestro corazón e iluminar nuestra mente y por permitirnos llegar hasta este momento tan importante de nuestra vida. A la universidad Nacional de San Agustín, nuestra amada y respetada alma mater, forjadora de profesionales con calidad científica, humanística y tecnológica. A la Facultad de Ciencias Naturales y Formales, a la Escuela Profesional de Química, por permitirnos ser parte de esa gran familia. A los Docentes de la Escuela Profesional de Química quienes nos guiaron durante nuestra formación profesional. A nuestro Asesor Mg. Rodríguez Romero, Juan por el apoyo y su asesoría constante para la realización de la presente investigación compartiendo sus conocimientos e inspirar en nosotras mucha admiración. A las personas que nos apoyaron desinteresadamente en el desarrollo del presente trabajo.. Muy agradecidas.
(4) INDICE GENERAL DEDICATORIA AGRADECIMIENTOS INDICE RESUMEN. ............................................................................................ 1. ABSTRACT. ............................................................................................ 2. INTRODUCCION. ............................................................................................ 3. FORMULACION DEL PROBLEMA ...................................................................... 5 OBJETIVOS General. .................................................................................................... 5 .................................................................................................... 5. Específicos .................................................................................................... 5 HIPOTESIS. .................................................................................................... 6. General. .................................................................................................... 6. Especificas .................................................................................................... 6 VARIABLES. .................................................................................................... 6. Variables Dependientes ................................................................................. 6 Variables Independientes ............................................................................... 6 APORTE CIENTIFICO.......................................................................................... 6 ALCANCES Y LIMITACIONES DE LA INVESTIGACION .................................... 7 CAPITULO I: MARCO TEORICO 1.1 Generalidades sobre las pilas ......................................................................... 8 1.1.1 Pilas, tipos, características y funcionamiento .............................................. 9 1.1.1.1 Concepto De Pila y Batería. .................................................................... 9 1.1.1.2. Clasificación de pilas ............................................................................... 10.
(5) 1.1.1.2.1Celdas Primarias o Pilas ......................................................................... 11 1.1.1.3 Funcionamiento de una celda ................................................................. 12 1.1.1.3.1 Descarga ........................................................................................... 12 1.1.1.3.2 Carga ............................................................................................... 13 1.1.1.4. Características de las pilas primarias .................................................... 14. 1.1.1.5. Tipos de pilas primarias ........................................................................ 15. a) Pila de Zinc-Carbono(Zn2+/C) .................................................................... 15 b) Pila alcalina de Zinc / Anhídrido manganoso(Zn2+/MnO2) ......................... 15 c) Pila de Zinc / Óxido mercúrico (Zn2+/HgO)................................................. 16 d) Pila Zinc / Óxido de Plata(Zn2+/Ag2O) ........................................................ 16 1.1.1.6 Composición de las pilas alcalinas ........................................................... 16 1.1.1.7 Diferentes tamaños y diseño de las pilas ................................................. 19 1.1.1.7.1 Pilas Redondas o Cilíndricas ............................................................. 19 1.1.1.7.2 Pilas de Tipo Botón ........................................................................... 20 1.2 Procesos de reciclado de pilas ....................................................................... 23 1.2.1 Proceso pirometalúrgico .......................................................................... 23 1.2.2 Proceso hidrometalúrgico ........................................................................ 23 1.3 Problemas del uso de las pilas ....................................................................... 25 1.4 Las pilas como elementos contaminantes ...................................................... 27 1.4.1 Cadmio .................................................................................................... 27 1.4.2 Mercurio .................................................................................................. 27 1.4.3 Plomo .................................................................................................... 28 1.4.4 Cromo .................................................................................................... 29.
(6) 1.5 Tratamiento específico que deben recibir las pilas ......................................... 29 a) Recogido Selectivo de Pilas ......................................................................... 29 b) Depósito Transitorio de Residuos Peligrosos ............................................... 29 c) Vacío Periódico de los contenedores ........................................................... 30 d) Reciclado .................................................................................................... 30 1.6 Agentes neutralizantes ................................................................................... 31 1.6.1 Agente Neutralizador de Plomo ............................................................... 31 1.6.2 Agente Neutralizador de ácido sulfúrico (H2SO4) .................................... 31 1.6.3 Agente Neutralizador de Cadmio ............................................................ 31 1.6.4 Agente Neutralizador de Mercurio ........................................................... 32 1.7 Cristalización .................................................................................................. 32 1.7.1 Sistemas Cristalinos .............................................................................. 33 1.7.2 Pureza ................................................................................................... 35. CAPITULO II: METODOLOGIA EXPERIMENTAL. 2.1 Recolección de pilas .................................................................................... 36 2.1.1 Cuarteo de las muestras ........................................................................ 36 2.2 Apertura de las pilas .................................................................................... 37 2.2.1 Para las pilas alcalinas D-2 y acidas AAA ............................................... 38 2.2.2 Para las pilas de botón ........................................................................... 38 2.3 Reactivos, materiales y equipos .................................................................. 39 2.3.1Reactivos .................................................................................................. 39 2.3.1Materiales ................................................................................................ 40.
(7) 2.3.2Equipos utilizados ................................................................................... 40 2.4 Métodos. .................................................................................................... 41. 2.4.1 Síntesis del óxido de plata (Ag2O) ............................................................. 41 2.4.1.1 Fundamento del método ......................................................................... 43 2.4.1.2 Determinación de la pureza por espectrofotometría de adsorción Atómica. .................................................................................................... 43. 2.4.2 Síntesis del hidróxido de zinc (Zn(OH)2) y sulfuro de manganeso(MnS) ..... 45 2.4.2.1 Fundamento del método .......................................................................... 46 2.4.2.2 Recuperación del electrolito .................................................................... 46 2.4.2.3 Lixiviación del contenido con ácido sulfúrico (H2SO4)............................... 46 2.4.2.4 Recuperación del hidróxido de zinc (Zn(OH)2) y sulfuro de manganeso (MnS). .................................................................................................... 47. 2.4.3 Determinación de la pureza por microscopia de barrido ............................. 48. CAPITULO III: RESULTADOS Y DISCUSION. 3.1 Para las pilas de botón .................................................................................. 50 3.1.1Interpretación de los datos obtenidos de la pureza del óxido de plata (Ag2O)51 3.1.2 Rendimiento del óxido de plata (Ag2O)........................................................ 51 3.1.3 Rentabilidad de la metodología para las pilas de botón ............................. 52 3.2 Para las pilas alcalinas D-2 y acidas AAA ...................................................... 53 3.2.1 Interpretación de los datos obtenidos de la pureza del hidróxido de zinc (Zn(OH)2) y del sulfuro de manganeso (MnS) ...................................................... 54 3.2.1.1Prueba t de Student para el hidróxido de zinc (Zn(OH)2) .......................... 55.
(8) 3.2.2.1 Prueba t de Student para el sulfuro de manganeso (MnS) ....................... 56 3.3 Rendimiento de las pilas alcalinas D-2 y acidas AAA ..................................... 57 3.3.1Rendimiento para el hidróxido de zinc (Zn(OH)2) ......................................... 57 3.3.2 Rendimiento para el sulfuro de manganeso (MnS)...................................... 58 3.3.3 Rentabilidad para la metodología para las pilas alcalinas D-2 y acidas AAA59 3.4 Porcentaje de abundancia de los subproductos ............................................ 59 3.4.1 Interpretación de los datos obtenidos de los subproductos ......................... 60 3.4.2. Prueba t de Student para el sulfuro de sodio (Na2S) ................................. 61 3.4.3 Prueba t de Student para el cloruro de potasio (KCl) .................................. 61 3.4.4 Interpretación de la prueba t de Student...................................................... 62 CONCLUSIONES ................................................................................................. 63 RECOMENDACIONES......................................................................................... 64 BIBLIOGRAFIA .................................................................................................... 65 ANEXOS. .................................................................................................... 70.
(9) INDICE TABLAS Tabla 1: Principales sustancias contenidas en las pilas ....................................... 22 Tabla 2: Resultados de la pureza del óxido de plata (Ag2O) ................................ 50 Tabla 3: Análisis de la varianza de la pureza del óxido de plata (Ag2O) .............. 51 Tabla 4: Rentabilidad de las pilas de botón ......................................................... 52 Tabla 5: Resultados de pureza del hidróxido de zinc (Zn(OH)2) y sulfuro de manganeso (MnS) ................................................................................................ 53 Tabla 6: Análisis de varianza para el hidróxido de zinc (Zn(OH)2)........................ 54 Tabla 7: Análisis de varianza para el sulfuro de manganeso (MnS) ..................... 54 Tabla 8: Prueba t de Student entre el detector SE y el detector BSE para el hidróxido de zinc (Zn(OH)2).................................................................................................. 55 Tabla 9: Prueba t de Student entre el detector SE y el detector BSE para el sulfuro de manganeso (MnS) ........................................................................................... 56 Tabla 10: Rentabilidad de las pilas alcalinas D-2 y acidas AAA ........................... 59 Tabla 11: Resultados de los subproductos ........................................................... 60 Tabla 12: Prueba t de Student entre el detector SE y BSE para el sulfuro de sodio (Na2S). .................................................................................................... 61. Tabla 13: Prueba t de Student entre el detector SE y BSE para el cloruro de potasio (KCl). .................................................................................................... 62.
(10) INDICE GRAFICOS Gráfico 1: Cuarteo de muestras ........................................................................... 37 Gráfico 2: Diseño experimental de las pilas de botón .......................................... 42 Gráfico 3: Diagrama de flujo para las pilas de botón ........................................... 44 Gráfico 4.Diseño experimental de las pilas alcalinas D-2 y acidas AAA ............... 45 Gráfico 5.Diagrama de flujo para las pilas alcalinas D-2 y acidas AAA ................ 49.
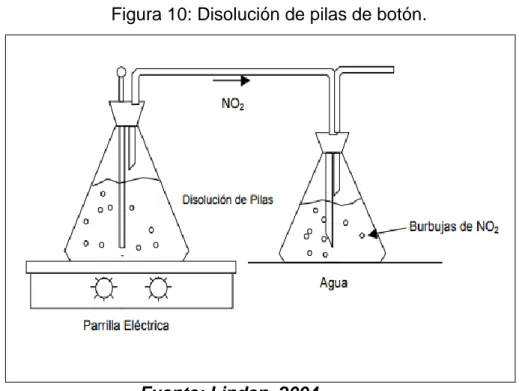
(11) INDICE FIGURAS Figura 1. Esquema de una celda electroquímica .................................................. 10 Figura 2. Descarga de una celda en una operación electroquímica ..................... 12 Figura 3. Carga de una celda en una operación electroquímica .......................... 14 Figura 4. Esquema de una pila alcalina ................................................................ 17 Figura 5. Comparación de diferentes diseños de celdas cilíndricas ..................... 20 Figura 6. Corte transversal de una celda de tipo botón ........................................ 21 Figura 7. Sistemas cristalinos (Redes de Bravais) ............................................... 34 Figura 8. Imagen de las pilas abiertas ................................................................. 38 Figura 9. Componentes internos de las pilas de botón ......................................... 39 Figura 10. Disolución de las pilas de botón .......................................................... 43.
(12) RESUMEN En el presente trabajo de tesis se realizó la recuperación del hidróxido de zinc (Zn(OH)2), sulfuro de manganeso (MnS) y óxido de plata (Ag2O) a partir de pilas alcalinas D-2, ácidas AAA y pilas de botón. La metodología usada para la recuperación del hidróxido de zinc (Zn(OH)2) y sulfuro de manganeso (MnS) fue el lavado del material activo con agua destilada, luego se procedió a cristalizar la solución a la cual se le adicionó ácido clorhídrico (HCl) para recuperar el cloruro de potasio (KCl). El filtrado se lixivió con ácido sulfúrico (H2SO4) 2Molar con una agitación de 2 horas, a partir de la cual se obtuvo carbón precipitado. A la solución se le añadió hidróxido de sodio (NaOH) en medio básico para la precipitación de hidróxido férrico (Fe(OH)3); posteriormente a la solución filtrada se le agregó ácido sulfúrico (H2SO4) 2Molar a un pH de 7 que permitió la precipitación de hidróxido de zinc (Zn(OH)2) con un rendimiento del 27,24%; de la solución resultante se precipitó sulfuro de manganeso (MnS) mediante la adición de sulfuro de amonio ((NH4)2S) con un rendimiento de 70,81%. La pureza se determinó por microscopía de barrido. Se recuperaron 48,40g de hidróxido de zinc (Zn(OH)2) con una pureza 93,1%. Se recuperaron 172,592g de sulfuro de manganeso (MnS) con una pureza de 94,1%; es un proceso rentable en grandes cantidades de muestra. En relación a los subproductos obtenidos tales como el cloruro de potasio (KCl), sulfuro de sodio (Na2S) y carbón (C) se encontraron porcentajes en abundancia de 0,72%, 23,92% y 5,02% respectivamente. Para la recuperación del óxido de plata (Ag2O) el material activo se trató con agua regia en un sistema cerrado para evitar la liberación de óxido nítrico (NO2) con agitación constante a temperatura de 50°C durante 4 horas, se filtró y la solución se analizó por espectroscopía de absorción atómica que determinó una pureza de 96,10±0,21 % y el rendimiento de este proceso es 25,91% y es rentable. Palabras Clave: Pilas, lixiviación, zinc, manganeso, plata, espectroscopía, microscopía.. Pág.1.
(13) ABSTRACT The present thesis work the recovery was made of zinc hydroxide (Zn(OH)2), manganese sulphide (MnS) and silver oxide (Ag2O) from alkaline batteries D-2, acid AAA and button batteries . The methodology used for the recovery of zinc hydroxide (Zn(OH)2) and manganese sulphide (MnS) was the result of a wash of active material with discarded water, then the solution was crystallized. Added hydrochloric acid (HCl) to recover potassium chloride (KCl). The filtrate is filtered with sulfuric acid (H2SO4) 2Molar with stirring for 2 hours, from which the precipitated carbon is obtained. A solution for sodium hydroxide (NaOH) in the basic medium for the application of thermal hydroxide (Fe(OH)3); Subsequently, sulfuric acid (H2SO4) 2Molar was added to the filtered solution at a pH of 7, which at the same time was zinc hydroxide (Zn(OH)2) with a yield of 27,24%; from the resulting solution, manganese sulphide (MnS) was precipitated by the addition of ammonium sulphide ((NH4)2S) in a yield of 70,81%. The purity was determined by scanning microscopy 48,40 g of zinc hydroxide (Zn(OH)2) were recovered with a purity of 93,1%. 172,592 g of manganese sulphide (MnS) with a purity of 94,2% were recovered, It is a profitable process in a lot of sample. In relation to the byproducts stories such as potassium chloride (KCl), sodium sulfide (Na2S) and coal (C) are found in abundance percentages of 0,72%, 23,92% and 5,02% respectively. For the recovery of silver oxide (Ag2O) the active material is related to water regulated in a closed system to prevent the release of nitric oxide (NO2) with constant stirring at a temperature of 50 °C for 4 hours, filtered and The solution was analyzed by atomic absorption spectroscopy which determined a purity of 96,10 ± 0,21% and the yield of this process is 25,91% and is profitable.. Keywords: Piles, leaching, zinc, manganese, silver, spectroscopy, microscopy.. Pág.2.
(14) INTRODUCCIÓN El presente trabajo de investigación surge como consecuencia de la problemática real que presenta el Perú, en cuanto a la disposición final de las pilas en desuso, las cuales representan uno de los mayores problemas en residuos sólidos peligrosos; ya que son generados como desechos domésticos y no son considerados de gran riesgo dado el uso común en la población. Actualmente no existe una política de reciclaje de pilas usadas, a pesar que estas representan un porcentaje considerable dentro de los desechos sólidos urbanos y dada la toxicidad que representan es necesaria una implementación de métodos de reciclaje de los mismos. Según José del Corral, gerente general de la Organización No Gubernamental (ONG) Recíclame de Kimberly-Clark, declaró para el diario el correo que de acuerdo a cifras oficiales del Ministerio del Ambiente, tomando como base lo que recogen las municipalidades, en el Perú se generan más de 19 mil toneladas de residuos sólidos cada día de los cuales el papel representa el 4,8%; el vidrio 3,2%; el tetra pack 0,6% y el plástico 10,10%. Precisó que del 100% de los residuos sólidos municipales, solo el 14,7% es reciclado. El porcentaje restante de 85,3% representa a los residuos no reciclables como bolsas de basura, jebes, desechos urbanos dentro de los cuales se encuentran las pilas. (Flores, 2014) El manejo incorrecto de estos residuos es un problema socio ambiental con efectos mundiales. Una vez concluida su vida útil, llegan a los botaderos comunes sin ningún tratamiento; esto pone en riesgo a los ecosistemas y a la población aledaña debido al contenido de metales pesados que contaminan el agua, la atmósfera y el suelo. (Greenpeace, 2004). En países en vías de desarrollo como el nuestro, todavía el concepto de disposición final y procesos de recuperación de las pilas, son temas que vienen siendo asimilados por nuestra población de una forma pasiva, lo que lleva a que este concepto ocupe solamente un marco teórico muy pobre, ya que en la actualidad no se hacen los esfuerzos por parte de las autoridades de internalizar este concepto en la población y de hacer entender el rol importante que tiene en el manejo adecuado de los residuos sólidos domiciliarios. Los metales contenidos en una sola pila son suficientes para contaminar 40L de agua durante 50 años. (Greenpeace, 2004) Pág.3.
(15) De aquí surge la necesidad de recuperar sus componentes para otorgarles una segunda vida útil. De hecho, el reciclaje de una tonelada de pilas usadas permite la obtención de 600000 g de metales pesados, incluidos, por ejemplo 300000 a 350000 g de zinc, 20000 g de níquel y 2000 g de mercurio. (Greenpeace, 2004) Para el siguiente trabajo se consideraron los siguientes antecedentes: La tecnología nos brinda diferentes alternativas para la disposición final y/o tratamiento de las pilas como por ejemplo rellenos sanitarios de seguridad, estabilización, incineración o reciclado (Bernardes et al., 2004). En los últimos años varias tecnologías para el reciclado de pilas y baterías han sido desarrolladas en muchos países, entre ellas está la pirometalurgia, hidrometalurgia (lixiviación ácida, lixiviación alcalina, lixiviación ácidoreductora, extracción por solvente, electrólisis y precipitación química) (Sayilgan et al., 2009; Moscardini et al., 2008; De Souza y Tenório, 2004). A continuación se enuncia la cantidad de metales en toneladas por año en la Unión Europea, que dejarían de ser dispuestos en rellenos sanitarios y/o incineradores si son reciclados: Manganeso: 20,000 t/año, Zinc: 20,000 t/año, Hierro: 15,000 t/año, Plomo: 7,500 t/año, Níquel: 2,000 t/año, Cadmio: 1,500 t/año y Mercurio: 28 t/año. (Evaluación de impacto ampliada de la batería de la Unión Europea, 2003) El uso de metales reciclados en la producción de baterías en lugar de metales vírgenes, tiene un impacto ambiental positivo. Para el zinc, por ejemplo, la relación entre la energía necesaria para su reciclaje y la requerida para la extracción del metal virgen es 2,2 a 8. Además, la producción primaria de metales es la responsable de aproximadamente el 10% de las emisiones globales de anhídrido carbónico (CO2) (Evaluación de impacto ampliada de la batería de la Unión Europea, 2003) La Red Panamericana de Manejo Ambiental de Residuos (Repamar) realizó un estudio analizando las experiencias de los países: Argentina, Brasil, Colombia, Ecuador y México con el tema pilas. Según el estudio, Argentina es el único país de la región que cuenta con una planta formal, a escala comercial para el tratamiento y/o reciclaje de pilas. Esta empresa, ingeniería de Montajes (IDM). (Ortez y Parada, 2008) Las pilas se someten a un proceso de termodestrucción en hornos rotativos a 1100°C. Las cenizas resultantes son vitrificadas. El níquel y el cadmio se recuperan a través de Pág.4.
(16) fusión y destilación. Sin embargo según el estudio su operación no es rentable. (Ortez y Parada, 2008) El Centro Coordinador Regional del Convenio de Basilea para América Latina y Caribe, con sede Uruguay, destaca la existencia básicamente de dos tipos de tecnologías para la recuperación de metales: (a) método hidrometalúrgico y (b) pirometalúrgico (o combinación de ambas). Los procesos utilizados hoy en día requieren de una etapa previa de separación, dado que no existe un método universal para todo tipo de pilas. (Martínez, 2005) FORMULACION DEL PROBLEMA El presente trabajo de investigación pretende dar a conocer un tratamiento para la recuperación de las sales de metales a partir de pilas; se plantea la siguiente pregunta de investigación ¿Es posible recuperar el. hidróxido de zinc (Zn(OH)2), sulfuro de. manganeso (MnS) y óxido de plata (Ag2O) como sales cristalizadas a partir de pilas alcalinas D-2, ácidas AAA y pilas de botón? OBJETIVOS GENERALES 1 Recuperación de hidróxido de zinc (Zn(OH)2), sulfuro de manganeso (MnS) y óxido de plata (Ag2O) mediante la cristalización de las mismas a partir de pilas alcalinas D-2, ácidas AAA y pilas de botón. ESPECIFICOS 1.1 Determinar la pureza de las sales (hidróxido de zinc (Zn(OH)2), sulfuro de manganeso (MnS) y óxido de plata (Ag2O) ). 1.2 Calcular del rendimiento del proceso. 1.3 Determinar la rentabilidad del proceso. 1.4 Analizar los cristales de subproductos recuperados como cloruro de potasio (KCl) sulfuro de sodio (Na2S) y carbono (C).. Pág.5.
(17) HIPOTESIS GENERALES H1: Las metodologías propuestas permitirán la recuperación de hidróxido de zinc (Zn(OH)2), sulfuro de manganeso (MnS) y óxido de plata (Ag2O) HO: Las metodologías propuestas no permitirán la recuperación de hidróxido de zinc (Zn(OH)2), sulfuro de manganeso (MnS) y óxido de plata (Ag2O) ESPECIFICAS H2: La temperatura de reacción influye en la pureza del óxido de plata (Ag2O) HO: La temperatura de reacción no influye en la pureza del óxido de plata (Ag2O) H3: El tiempo de reacción no influye en la pureza del hidróxido de zinc (Zn(OH)2) HO: El tiempo de reacción influye en la pureza del hidróxido de zinc (Zn(OH)2) H4: El tiempo de reacción influye en la pureza del sulfuro de manganeso (MnS) HO: El tiempo de reacción influye en la pureza del sulfuro de manganeso (MnS) VARIABLES Variables dependientes: Concentración. Variables independientes: Tiempo de reacción (1hora, 2horas para las pilas alcalinas D-2 y acidas AAA) 2horas, 4horas para las pilas de botón y Temperatura (25°C y 50°C). APORTE CIENTIFICO La importancia de esta investigación. es el aporte de dos metodologías para el. tratamiento de pilas alcalinas D-2, acidas AAA y pilas de botón ya que en el Perú hay una mala disposición final de estas pilas, que trae consigo la contaminación del suelo (lixiviados) y contaminación de agua.. Pág.6.
(18) ALCANCES Y LIMITACIONES DE LA INVESTIGACION . En el presente trabajo se han recuperado sustancias químicas que se encuentran en mayor proporción en las pilas alcalinas y ácidas para el caso del hidróxido de zinc (Zn(OH)2) y sulfuro de manganeso (MnS) así también la recuperación de óxido de plata (Ag2O) que solo es posible a partir de las pilas de botón.. . Los residuos generados por el proceso está constituido por cloruro de potasio, sulfuro de sodio y carbono en el caso de los dos primeros cristalizados y en el caso del tercero debidamente neutralizado.. Como limitaciones podemos establecer las siguientes: . No se ha abarcado la totalidad de tipos de pilas comerciales ya que muchas de ellas no se encuentran en el ámbito doméstico; las que se encuentran son las pilas alcalinas principalmente de marca DURACELL y las ácidas de marca TOSHIBA.. . Poca información acerca del tratamiento de pilas.. . No existe un protocolo para el desmantelamiento de pilas.. En este trabajo de investigación se desarrollaron tres capítulos los cuales son: -CAPITULO I: Marco teórico donde se presenta la información bibliográfica reunida sobre el tema. -CAPITULO II: Metodología experimental donde se presenta la metodología usada para la obtención de hidróxido de zinc, sulfuro de manganeso y óxido de plata. -CAPITULO III: Resultados y discusión. Pág.7.
(19) CAPITULO I MARCO TEORICO 1.1. Generalidades sobre las pilas. Una pila eléctrica es un dispositivo que convierte energía química en energía eléctrica por un proceso químico transitorio, tras lo cual cesa su actividad y han de renovarse sus elementos constituyentes, puesto que sus características resultan alteradas durante el mismo. Se trata de un generador primario. Esta energía resulta accesible mediante dos terminales que tiene la pila, llamados polos, electrodos o bornes. Uno de ellos es el polo positivo o ánodo y el otro es el polo negativo o cátodo. (Linden, 2004) Se denomina pila a aquel sistema que transforma la energía producida en una reacción química, en energía eléctrica. Este cambio se da ya que la reacción química permite generar electrones, los cuales fluyen desde un polo (cátodo) en oxidación que los libera, hasta otro inmerso en un compuesto (ánodo) que los captura. (Hernández, Torres y Gasca, 2014) Las pilas o celdas galvánicas, producen energía eléctrica a partir de ciertas reacciones químicas. Esta celda está formada por dos electrodos y, al igual que en la celda electrolítica, la reducción ocurre en el cátodo y la oxidación en el ánodo, pero difiere de ella, en que el cátodo y el ánodo están, cada uno, en soluciones diferentes, ya que esta celda la solución de iones zinc (Zn2+), se encuentra separada de la solución que contiene iones cobre (Cu2+), por medio de una barrera porosa a través de la cual pueden difundirse los iones. Esta separación se hace, porque de esta forma es que se obtendrá la electricidad. (Kiehne, 2003) La reacción se lleva a cabo hasta que se cierra el interruptor que se encuentra en un circuito externo. La electricidad que se produce es suficiente para encender una lámpara. (Linden, 2004) El electrodo de zinc metálico (Zn0) pierde electrones, convirtiéndolo en ánodo y ocurriendo la oxidación. El electrodo de cobre metálico (Cu0) se convierte en cátodo debido a que gana electrones, ocurriendo la reducción. (Linden, 2004) Pág.8.
(20) La sustancia conductora es llamada electrolito. A su vez, cada semicelda está constituida por un electrodo metálico y una solución de una de las sales del metal. (Kiehne, 2003) 1.1.1 Pilas, tipos, características y funcionamiento. 1.1.1.1. Concepto de pila y batería. Una pila es un dispositivo que convierte la energía química contenida en sus materiales activos directamente en energía eléctrica por medio de una reacción electroquímica de oxidación-reducción (REDOX) (Kiehne, 2003). En el caso de un sistema recargable, la pila se recarga a través de una inversión del proceso. (Kiehne, 2003). Este tipo de reacción implica la transferencia de electrones de un material a otro a través de un circuito eléctrico. (Linden, 2004) Las pilas, por lo tanto, son capaces de tener mayores eficiencias de conversión de energía. Mientras que el término de “batería” se utiliza a menudo, la unidad electroquímica básica que se refiere es ''celda''. Una batería se compone de uno o más de estas celdas, conectadas en serie o en paralelo o ambas, dependiendo del voltaje de salida deseada y la capacidad. (Kiehne, 2003) En una celda el agente reductor pierde electrones, por tanto se oxida; el electrodo en donde se verifica la oxidación se llama ánodo. En el otro electrodo la sustancia oxidante gana electrones y por tanto se reduce; el electrodo en que se verifica la reducción se llama cátodo. (Farhat, 2005) La corriente eléctrica fluye del ánodo al cátodo porque hay una diferencia de energía potencial entre los electrodos. La diferencia de potencial eléctrico entre el ánodo y el cátodo se mide en forma experimental con un voltímetro, donde la lectura es el voltaje de la celda. (Kiehne, 2003) El diseño constructivo en una pila determina que cada una de estas dos semirreacciones transcurra en "compartimentos" independientes llamados electrodos y el medio que posibilita el transporte interno de carga eléctrica entre ambos, es una sustancia conductora llamada electrolito. (Linden, 2004) Pág.9.
(21) Para obtener energía eléctrica es necesario conectar los electrodos de la pila, al aparato que se desee hacer funcionar mediante conductores eléctricos externos. En estas condiciones la pila descarga externamente su energía como se muestra en la Figura: (Linden, 2004) Figura 1. Esquema de una celda electroquímica.. Cu2+ (ac) + 2e- Cu0(s). Zn0(s) Zn2+ (ac) + 2e-. Fuente: Kiehne, 2003. Las pilas y baterías domésticas son artículos ampliamente utilizados por la sociedad actual como fuentes de energía para equipos eléctricos portátiles y/o de bajo consumo. Su uso, ampliamente extendido, así como su corto ciclo de vida, conduce a que su consumo y su velocidad de reposición sean elevados, con la consiguiente necesidad de su eliminación en forma de residuos (Meseguer, Perales y Lozano, 1995). 1.1.1.2. Clasificación de las pilas. Actualmente en el mercado existe una gran diversidad de pilas y baterías primarias y secundarias, variando la naturaleza de sus componentes activos, su geometría y tamaño. Cada sistema tiene su propia combinación de materiales que determinan la capacidad, voltaje y vida útil. (Pool, 2012). Pág.10.
(22) Existen varios criterios de clasificación: . Por la posibilidad de carga (no recargables y recargables). Por tipo de electrodo (según su cátodo y en algunos casos según el ánodo). Por la forma de uso (portátiles y estacionarias). Por el tipo de electrolito (acuoso y no acuoso, alcalinas, acidas). Por su tamaño (desde nanowatts (nWh) hasta megawats (MWh)). Por sus aplicaciones (arranque, tracción, nivelación de picos). (Pool, 2012). Las pilas pueden clasificarse de una forma general como: - Pila primaria: Pila basada en una reacción química irreversible, y por lo tanto, no recargable (posee un sólo ciclo de vida). - Pila secundaria: Pila basada en una reacción química reversible y, por lo tanto, recargable. Se pueden regenerar sus elementos activos pasando una corriente eléctrica en sentido contrario al de descarga, por lo que posee ciclos de vida múltiples (Pool, 2012) Esto depende de su capacidad de ser eléctricamente recargadas. Dentro de esta clasificación, otras clasificaciones se utilizan para identificar las estructuras o diseños de las pilas, como se desarrolla a continuación. 1.1.1.2.1 Las celdas primarias o pilas. Estas pilas no son capaces de hacer fácilmente una recarga eléctrica a las mismas y, por tanto, se descargan una vez y deben desecharse. Muchas celdas primarias en las que el electrolito está contenido en un material absorbente o de separación (líquido electrolito no libre) se denominan “celdas secas”. La celda primaria, proporciona una fuente de poder de peso ligero envasada para dispositivos portátiles electrónicos y eléctricos, iluminación, equipos de fotografía, juguetes, copia de seguridad de la memoria, y una multitud de otras aplicaciones. Las ventajas generales de las celdas primarias son: conservación de sus propiedades, alta densidad de energía en bajas tasas de uso, no requiere de mantenimiento y fácil de usar. La mayoría de las celdas primarias son la celda cilíndrica singular y las pilas planas de botón de uso netamente familiar. (Linden, 2004) Pág.11.
(23) 1.1.1.3. Funcionamiento de una celda. El funcionamiento de una celda se resume en dos operaciones generales: a) Carga de la celda. b) Descarga de la celda. A continuación se detalla cada una de dichas operaciones. 1.1.1.3.1. Descarga. La operación de una celda durante la descarga también se muestra esquemáticamente en la Figura 2. Cuando la celda se conecta a una carga externa, los electrones fluyen del ánodo, que se oxida, a través de la carga externa hacia el cátodo, donde se aceptan los electrones y el material del cátodo se reduce. El circuito eléctrico se completa en el electrolito por el flujo de aniones (iones negativos) y cationes (iones positivos) hacia el cátodo y el ánodo, respectivamente. (Farhat, 2005) Figura 2. Descarga de una celda en una operación electroquímica.. Fuente: Farhat, 2005. Pág.12.
(24) La reacción de descarga puede ser escrita, partiendo de un metal, en este caso el zinc (Zn) como material del ánodo y como cátodo utilizando un material como el cloro (Cl 2), como sigue a continuación: (Farhat, 2005) Electrodo negativo: Reacción anódica (oxidación, pérdida de electrones). Zn0(s) Zn2+ +2eElectrodo positivo: La reacción catódica (reducción, ganancia de electrones). Cl2(g) + 2e- 2ClLa reacción general (descarga): Zn0(s) + Cl2(g) Zn2+ + 2Cl1.1.1.3.2. Carga. Durante la carga de una pila recargable o acumulador, el flujo de corriente se revierte y la oxidación tiene lugar en el electrodo positivo y la reducción en el electrodo negativo, como se muestra en la Figura. 3. En el ánodo es por definición, el electrodo en el que se produce la oxidación y el cátodo es aquel en el que se lleva a cabo la reducción, el electrodo positivo es ahora el ánodo y el negativo el cátodo. En el ejemplo de la celda iones zinc y cloro molecular (Zn2+/Cl2) la reacción de carga puede ser escrita como sigue: (Farhat, 2005) Electrodo negativo: Reacción catódica (reducción, ganancia de electrones). Zn2+ + 2e- Zn0(s) Electrodo positivo: La reacción anódica (oxidación, pérdida de electrones). 2Cl- Cl2(g) + 2eLa reacción general (CARGA): Zn2+ + 2Cl- Zn0(s) + Cl2(g). Pág.13.
(25) Figura 3. Carga de una celda en una operación electroquímica.. Fuente: Linden, 2004. 1.1.1.4. Características de las pilas primarias. Aunque una serie de combinaciones de ánodo-cátodo se pueden utilizar como sistemas de pilas primarias, relativamente pocos han logrado éxito en la práctica. El Zinc ha sido por mucho el material del ánodo más popular para las pilas primarias, debido a su buen comportamiento electroquímico, la compatibilidad con electrolitos acuosos, la vida útil razonablemente buena, además de su bajo costo. Ahora está siendo considerado el Aluminio mecánicamente recargable en pilas de aire y en los sistemas de pila de reserva. Las propiedades eléctricas del Magnesio, también tienen atractivo por ser de bajo costo y se ha utilizado con éxito en una pila primaria, en particular para aplicaciones militares, debido a su alta densidad de energía y buena conservación. (Kiehne, 2003) El interés comercial ha sido limitado. El Magnesio también es popular como ánodo en las pilas de reserva. Ahora hay un creciente interés en el Litio, que tiene la mayor densidad de energía y el potencial gravimétrico estándar de todos los metales. Los sistemas de pilas de ánodo de Litio, utilizando un número de diferentes electrolitos no acuosos en la que el Litio es estable y diferentes materiales catódicos, ofrecen la oportunidad de densidad de energía superior y otros avances en las características de funcionamiento de los sistemas de pilas primarias.(Kiehne, 2003). Pág.14.
(26) 1.1.1.5. Tipos de pilas primarias. Entre los diferentes tipos de pilas primarias tenemos las de mayor significancia como se desarrollan a continuación: a) Pila de Zinc-Carbono (Zn2+/C) La pila de celda seca de Leclanché o de Zinc-Carbono (Zn2+/C) ha existido por más de 100 años y había sido la más utilizada de todas las pilas secas debido a su bajo costo, el rendimiento relativamente bueno, y disponibilidad inmediata. El bajo costo de la pila de Leclanché es una atracción importante, pero ha perdido cuota de mercado considerable en los últimos años, salvo en los países en desarrollo, debido a las nuevas pilas primarias con características de rendimiento superior. (Linden, 2004) Las pilas y baterías de muchos tamaños y características han sido fabricados para cumplir con los requisitos de una amplia variedad de aplicaciones. Mejoras significativas en la capacidad y vida útil se hicieron con este sistema depila en el período comprendido entre 1945 y 1965 a través de la utilización de nuevos materiales (como el óxido Mangánico (Mn2O3) electrolítico y cloruro de zinc (ZnCl2) y diseños de celdas (como el papel revestido de la celda). (Linden, 2004) b) Pila alcalina de Zinc / anhídrido manganoso (Zn2+ / MnO2) En la última década, una porción creciente del mercado de la pila primaria se ha desplazado a la pila alcalina zinc/ anhídrido manganoso (Zn2+ / MnO2). Este sistema se ha convertido en la pila de elección debido a su rendimiento de corriente superior a bajas temperaturas y de su mejor vida útil. Si bien es más cara que la pila de Leclanché, es más rentable para aquellas aplicaciones que requieren de alta velocidad o de baja capacidad de temperatura, donde la pila alcalina puede superar a la pila de Leclanché por un factor de 2 a 10. Además, la vida útil de la pila alcalina, con frecuencia es la característica seleccionada para aplicaciones en las que la pila se usa de forma intermitente y expuesta a condiciones de almacenamiento no controlados. La mayoría de los avances recientes han sido el diseño de las pilas que proporcionen un mejor rendimiento de alta velocidad para su uso en cámaras y otros equipos electrónicos que requieren de esta capacidad de alta potencia. (Linden, 2004) Pág.15.
(27) c) Pila de Zinc / Óxido Mercúrico (Zn2+/HgO) La pila de Zinc /Óxido Mercúrico (Zn2+/HgO) es otro sistema primario de ánodo de Zinc. Esta pila se desarrolló durante la Segunda Guerra Mundial para aplicaciones de comunicaciones militares, debido a su buena conservación y de alta densidad de energía. (Linden, 2004) En el período de la posguerra, fue utilizado como fuente de energía en los relojes electrónicos, calculadoras, audífonos, equipos fotográficos, y aplicaciones similares que requieren una fiabilidad a largo plazo en una fuente miniatura de corriente. (Linden, 2004). En la última década, el uso de la pila de Óxido mercúrico(HgO) tiene su. disminución, debido principalmente a los problemas ambientales asociados con el Mercurio y su sustitución por otros sistemas de pilas, tales como el Zinc / Aire y pilas de Litio, que tienen un rendimiento superior para muchas aplicaciones. (Linden, 2004) d) Pila Zinc / Óxido de Plata(Zn2+/Ag2O) La pila de Zinc / Óxido de Plata (Zn2+/Ag2O) es similar en diseño a la pila de botón de Zinc / Óxido mercúrico (HgO), pero tiene una densidad de energía mayor (en función del peso) y un mejor rendimiento a bajas temperaturas. (Linden, 2004) .Estas características hacen de este sistema de pila conveniente para el uso en aparatos auditivos, aplicaciones fotográficas y relojes electrónicos. Sin embargo, debido a su alto costo y el desarrollo de sistemas de pilas, el uso de este sistema de pilas, como una pila primaria, se ha limitado principalmente a aplicaciones como pila de tipo botón donde se justifica el costo más elevado. (Linden, 2004) 1.1.1.6. Composición de las pilas alcalinas. El ánodo de las pilas alcalinas contiene Zinc (Zn2+) en polvo con una sustancia inhibidora de la corrosión y el compacto cátodo de anhídrido manganoso (MnO2) está mezclado con carbón grafito y negro de acetileno. El anhídrido manganoso (MnO2) obtenido por medios electrolíticos es el que provee capacidad y mayor reactividad a las pilas alcalinas en comparación con las pilas Zinc-Carbón (Zn2+/C)las cuales emplean anhídrido manganoso de los minerales naturales, como se puede visualizar. (Linden, 2004).. Pág.16.
(28) Figura 4. Esquema de una pila alcalina.. Fuente: Linden, 2004. Con un contenido de Mercurio que ronda el 0,1% de su peso total. Es una versión mejorada de la pila Zinc / Carbono (Zn2+/C) en la que se ha sustituido el conductor iónico Cloruro de Amonio (NH4Cl) por Hidróxido Potásico (KOH) (de ahí su nombre de alcalina). (Linden, 2004) El recipiente de la pila es de Acero y la disposición del Zinc y del anhídrido Manganoso (MnO2) es la contraria, situándose el Zinc, ahora en polvo, en el centro. La cantidad de Mercurio empleada para regularizar la descarga es mayor. Esto le confiere mayor duración, más constancia en el tiempo y mejor rendimiento. (Kiehne, 2003) En contra su precio es más elevado. También suministra una fuerza electromotriz de 1,5 V. Se utiliza en aparatos de mayor consumo como: grabadoras portátiles, juguetes con motor, flashes electrónicos. (Kiehne, 2003) El ánodo es de Zinc amalgamado y el cátodo es un material despolarizador que es en base al anhídrido manganoso(MnO2), Óxido mercúrico(HgO) mezclado íntimamente con grafito y en casos extraños Óxido de Plata(Ag2O) (estos dos últimos son de uso muy costoso, peligrosos y tóxicos) reducen su resistividad eléctrica. (Kiehne, 2003). Pág.17.
(29) El electrolito es una solución de Hidróxido de Potasio (KOH), el cual presenta una resistencia interna bajísima, lo que permite que no se tengan descargas internas y la energía pueda ser acumulada durante mucho tiempo. Este electrolito en las pilas comerciales es endurecido con gelatinas o derivados de la celulosa. (Kiehne, 2003) Dentro de las reacciones que se presentan en la pila alcalina se tienen: La reacción en el ánodo es: Zn0(s) +2OH- ↔ Zn(OH)2(s) + 2eLa reacción del cátodo es: 2MnO2(s) + 2e- + H2O(l) ↔ Mn2O3(s) + 2(OH)Existe cierta innovación en las pilas alcalinas que dentro de unos años estará en el mercado que es la pila de aire, cuya reacción en el cátodo es: O2(g) + H2O(l) + 4e- ↔ 2(OH)Este tipo de pila se fabrica de la siguiente forma: el ánodo consta de una tira de Zinc corrugada devanada en espiral de 0,000051 a 0,00013 m de espesor que se amalgama después de armarla. (Kiehne, 2003) Hay dos tiras de papel absorbente resistente a los álcalis sobresalientes con la tira de papel de Zinc, de modo que el Zinc sobresalga por la parte superior y el papel por la parte inferior. (Kiehne, 2003) El ánodo está aislado de la caja metálica con un manguito de poliestireno. La parte superior de la pila es de Cobre metálico (Cu0) y hace contacto con la tira de Zinc (Zn2+) para formar la terminal negativa de la pila. La pila está sellada con un ojillo o anillo aislante hecho de neopreno. La envoltura de la pila es químicamente inerte a los ingredientes y forma el electrodo positivo. (Kiehne, 2003) Durante la descarga de la pila, sus componentes primarios sufren transformaciones que se representan de una manera sencilla a través de una reacción química global que ha sido comúnmente aceptada. (Kiehne, 2003) Zn0+ MnO2(s) Mn2++ ZnO(s). Pág.18.
(30) Esta resulta ser la reacción más probable pero en muchos casos los productos cambian debido a las condiciones de descarga. (Kiehne, 2003) El Zinc en polvo empleado en las pilas alcalinas debe ser de alta pureza (99,85- 99%) y generalmente se produce por electrólisis. En estas condiciones se esperaría que el 100% del Zinc activo se emplee en la aplicación final, pero este no es el caso ya que solo el 30% del Zinc se usa para generar la capacidad eléctrica de la pila. (Linden, 2004) El Zinc es un recurso limitado en la Tierra, datos de la “US Bureau of Mines” informan que los suministros naturales de Zinc se agotarán dentro de 20 a 40 años. (De Souza, 2004). Existen múltiples posibilidades para el tratamiento o disposición de pilas agotadas que varían en cuanto a su requerimiento energético, nivel de reducción del impacto ambiental y costo principalmente. (Linden, 2004) 1.1.1.7. Diferentes tamaños y diseño de las pilas. Las pilas primarias y las. secundarias se. producen. en diversos. diseños,. fundamentalmente, entre los cuales se pueden distinguir: a) Redondas o cilíndricas. b) Pilas de tipo de botón. A continuación se describen de forma detallada los diferentes tipos de diseños de las pilas. (Linden, 2004) 1.1.1.7.1. Pilas redondas o cilíndricas.. Son caracterizadas por dimensiones de diámetro (D) y altura (H) para H>D. (Ullmann, 2004) .Son en su mayoría celdas primarias como Níquel-Cadmio, Níquel-Hidruro de metal, y baterías de ión Litio. (Ullmann, 2004). Pág.19.
(31) En la Figura se muestran los diferentes diseños que pueden llegar a tener una pila cilíndrica. Figura 5. Comparación de diferentes diseños de celdas cilíndricas.. Fuente: Kiehne, 2003. 1.1.1.7.2 Pilas de tipo botón. Son llamadas así, por ser pilas de tamaño reducido, de forma chata y redonda. Tiene amplios usos como en pilas primarias de Níquel/Cadmio (Ni2+/Cd2+), Níquel- Hidruro de metal y baterías de Litio. (Ullmann, 2004) El mercado de artículos electrónicos requiere cada vez más de ellas. Son imprescindibles para audífonos, marcapasos, relojes, calculadoras y aparatos médicos de precisión. Aunque hay de varios tipos las más frecuentes son las pilas botón de Mercurio, que son las que contienen más Mercurio por unidad. (Ullmann, 2004) Las pilas botón de Litio, en cambio, no contienen ni Mercurio ni Cadmio, o sea que son una alternativa interesante para evitar el consumo de las pilas tipo botón de Mercurio. (Ullmann, 2004). Pág.20.
(32) En la Figura se muestra la construcción de una pila de tipo botón. Figura 6. Corte transversal de una celda tipo botón.. Fuente: Kiehne, 2003. Pág.21.
(33) En la tabla se muestran los principales componentes según el tipo de pila. Tabla 1. Principales sustancias contenidas en las pilas. Elemento. Barro. Barro. Barro. Barro. Barro. Barro. pila. pila. pila. pila. pila. pila. alcalina. alcalina. alcalina. Zn-C. %p/p. %p/p. %p/p. %p/p. alcalina alcalina %p/p. %p/p. Barro pila ZnC %p/p. Barro. Barro. mezcla. mezcla. pilas. pilas. alcalinas alcalinas y Zn-C. y Zn-C. %p/p. %p/p. Zn. 21,00. 12-21. 19,56. 17,05. 24,56. 28,30. 19,85. 15,46. 14,84. Mn. 45,00. 26-33. 31,10. 36,53. 38,73. 26,30. 22,26. 33,59. 31,82. K. 4,70. 7,25. 4,53. -. -. -. 3,26. -. Fe. 0,36. 0,17. 0,174. 0,07. 2,35. 3,40. -. 0,50. -. Pb. 0,03. 0,005. 0,005. -. 0,0064. -. -. -. -. Hg. 1,00. -. 0,015. <0,002. 0,00001. -. 0,00002. -. 0,00001. Cr. -. -. -. -. -. -. -. 0,19. -. Cd. 0,06. -. -. -. 0,0006. -. -. -. -. Na. -. -. 0,10. 0,13. -. -. -. ,. -. Al. -. -. -. -. -. -. -. 0,36. -. Cl. -. -. -. -. -. -. -. 0,38. -. Ti. -. -. -. -. -. -. -. 0,27. -. Si. -. -. -. -. -. -. -. 0,49. -. Ni. -. 0,010. -. -. -. -. -. -. -. C. -. -. -. -. 8,69. -. -. -. -. Otros. 30,00. -. 41,80. 41,69. -. 21,60. -. -. -. Veloso. Tesis. Peng. Tesis. et al.. Falco. et al.. Falco. (2005). (2013). (2008). (2013). De Souza Referencia. & Tenorio (2004). 5,507,30. De Souza. Salgado. et al.. et al.. (2001). (2003). De Michelis et al. (2007). Fuente: Kiehne y Cardoso Subieta, 2003. Pág.22. Tesis Falco (2013).
(34) 1.2 Procesos de reciclado de pilas Los procesos de reciclado de baterías son muy variados, pero todos están basados en un proceso pirometalúrgico, un proceso hidrometalúrgico o una combinación de ambos procesos. A continuación, se describe con más detalle ambos procesos: 1.2.1 Proceso Pirometalúrgico El proceso pirometalúrgico que actualmente se emplea en mayor medida fue patentado por una empresa de recuperación de metales cuyo principal objetivo del proceso es la recuperación de cobalto y litio en las baterías de iones de litio, y la recuperación de níquel en las baterías de níquel-metal hidruro. El proceso de reciclado consiste básicamente en cinco etapas o subprocesos: (Georgi- Maschlera et al., 2012) Etapa 1: Fundido con valorización energética. Etapa 2: Refinado. Etapa 3: Purificado de metales. Etapa 4: Oxidación de cloruro cobaltoso (CoCl2) a oxido cobáltico (Co2O3). Etapa 5: Producción de óxido de litio metálico (Li2O) para nuevas baterías. (Georgi- Maschlera et al., 2012) 1.2.2 Proceso Hidrometalúrgico El proceso hidrometalúrgico lo desarrolló Toxco que es una empresa de origen canadiense con el objetivo de reciclar cualquier tipo de batería agotada. Surge por la obligación que tienen las grandes marcas de automóviles de reciclar las baterías por motivos legales. El objetivo de este proceso es la recuperación del litio, y teniendo en cuenta el precio del litio en el mercado y los altos costes de operación del proceso, hace que no sea un proceso de elevada rentabilidad sino un proceso para solventar un problema. (Georgi- Maschlera et al., 2012) En el proceso hidrometalúrgico de Toxco se hace una distinción entre el procesado de baterías de Ni-MH y las de Li-ión (Li+) ya que la naturaleza de ambas es muy distinta. En el primer caso los materiales de electrodo son relativamente estables a la Pág.23.
(35) temperatura de trabajo, pero con las baterías de Li-ión (Li+) no ocurre lo mismo ya que los materiales que la componen tienen una gran reactividad pudiendo afectar a la seguridad del proceso. El proceso cuenta fundamentalmente de cinco etapas. (GeorgiMaschlera et al., 2012) • Etapa 1: Recolección de las baterías. • Etapa 2: Criogenización. • Etapa 3: Proceso mecánico. • Etapa 4: Reacción. • Etapa 5: Separación de sales. (Georgi- Maschlera et al., 2012) Entre otros procesos también destaca la vitrificación que según la guía para el ciudadano sobre vitrificación, es un proceso que atrapa, en forma permanente, los químicos nocivos en un bloque sólido de material similar al vidrio, y así impide que los mismos escapen al medio ambiente. La vitrificación puede llevarse a cabo bajo tierra o en la superficie. El proceso de vitrificación utiliza energía eléctrica para producir el calor necesario para fundir el suelo. Se implantan varillas, denominadas electrodos, en el área contaminada. La vitrificación es un método bastante seguro cuando se lo utiliza adecuadamente. La cubierta para los gases debe ser lo suficientemente amplia como para cubrir toda el área contaminada, de manera que pueda capturar todos los químicos liberados por del suelo. Antes que nada se deben secar los suelos húmedos para evitar la formación de vapor. La emisión de vapor puede causar salpicaduras en la superficie de material fundido a alta temperatura. (Georgi- Maschlera et al., 2012) Además, la cubierta también evita salpicaduras a los trabajadores en el sitio. El bloque vitrificado se deja en el lugar en forma permanente, y no implica peligro alguno para las personas. Sin embargo, la Agencia de Protección Ambiental (EPA) puede limitar la construcción en el terreno a fin de evitar que se dañe el bloque. La Agencia de Protección Ambiental (EPA) también realiza análisis del suelo y el agua subterránea cercanos al bloque vitrificado para asegurar que no se liberen químicos. La aplicación de la vitrificación para el tratamiento de las pilas no estaba en estaba incluida en los planes originales, ya que su uso original era para el tratamiento de residuos nucleares, que Pág.24.
(36) derivó en un método alternativo para aislar de la naturaleza a los elementos tóxicos que contiene las pilas comunes desechadas (Georgi-Maschlera et al., 2012) 1.3. Problemas del uso de las pilas. La mala disposición de las pilas usadas tiene como consecuencia diversos efectos negativos sobre la salud y el medio ambiente. La introducción de estos elementos a diversos ecosistemas ha tenido consecuencias devastadoras, y si no se detiene su mala disposición tienen el potencial de arrasar con especies enteras. En los últimos cincuenta años se han liberado al ambiente toneladas de estos componentes, y los estudios de consumo indican que esta situación empeorará con el tiempo debido al incremento en el uso de pilas portátiles. Los sistemas de confinamiento actuales son insuficientes y no permiten la reutilización de los materiales que constituyen a las pilas. Además, solamente se cuenta con programas de recolección basados únicamente en la conciencia social de los consumidores, que también se sabe es poca en la actualidad (Castro y Díaz, 2004) Existen tres problemas importantes como resultado directo de su utilización: . El despilfarro económico que su uso implica que la corriente eléctrica generada por las pilas es 450 veces más cara que la de red.. . Inutilización de aparatos debido a su supuración causa que una pila abandonada en un aparato que no usamos, corre peligro de derramar las sustancias químicas de su interior, con lo que el aparato que las contiene puede deteriorarse seriamente. Aunque se ha desarrollado el blindaje de las pilas para evitar este problema, lo cierto es que su eficacia no es absoluta y su aplicación no está universalmente extendida.. . Eliminación cuando se agotan es el principal problema a resolver. (Ortez y Parada, 2008). Cuando las pilas se agotan, suelen ser transportadas en la bolsa de basura a vertederos no específicamente preparados, donde son abandonadas o incineradas. Es decir, en los vertederos ocurre precisamente aquello que prohíben las instrucciones de los envoltorios. Si se acumulan en los vertederos, con el paso del tiempo, las pilas pierden la carcasa y se vierte su contenido, compuesto principalmente por metales pesados Pág.25.
(37) como el Mercurio y el Cadmio. Estos metales, infiltrados desde el vertedero, acabarán contaminando las aguas subterráneas y con ello se introducirán en las cadenas alimentarias naturales, de las que se nutre el hombre. Si se incineran, las emanaciones resultantes darán lugar a elementos tóxicos volátiles, las plantas industriales que asumen este cometido y los vertederos controlados que las almacenan no están exentos de peligro, pues se ha demostrado repetidamente a través de la historia, que estas instalaciones no garantizan la neutralización de las substancias tóxicas. (Ortez y Parada, 2008) Hoy, la enorme mayoría de las pilas y baterías son depositados en rellenos sanitarios comunes y basurales junto con el resto de los Residuos Sólidos Urbanos (RSU). Al depositarse los residuos en los rellenos, comienzan a descomponerse mediante una serie de procesos químicos complejos. Los productos principales de la descomposición son los líquidos lixiviados y los gases. Tanto los líquidos como los gases pueden afectar la salud de las poblaciones de los alrededores (Agencia de Protección Ambiental de Estados Unidos, 2008). Los líquidos lixiviados se forman mediante el percolado de líquidos (por ejemplo, agua de lluvia) a través de sustancias en proceso de descomposición. El líquido, al fluir, disuelve algunas sustancias y arrastra partículas con otros compuestos químicos. Los ácidos orgánicos formados en ciertas etapas de la descomposición de contenidos en el lixiviado (como ácido acético (CH3COOH), láctico (H3C-CH(OH)-COOH) o fórmico(HCHO)) disuelven los metales contenidos en los residuos, transportándolos con el lixiviado. Es así como los metales que se encuentran en los residuos depositados en los rellenos, debido al carácter ácido de los líquidos lixiviados, son disueltos y transportados. (Greenpeace, 2004). Las pilas pueden sufrir la corrosión de sus carcazas, las cuales pueden ser afectadas internamente por sus componentes y externamente por la acción climática y por el proceso de descomposición de los residuos sólidos urbanos, si se encuentran mezclados con este tipo de residuos. Cuando se produce el derrame de electrolitos internos de las pilas, se pueden arrastrar los metales pesados en forma de ánodo de pilas. Estos metales pueden lixiviar los suelos y fluir por cursos de agua y acuíferos, contaminando el ambiente en general (Greenpeace, 2010). Pág.26.
(38) 1.4. Las pilas como elementos contaminantes. Los principales problemas para el medio ambiente derivados del consumo de pilas pueden resumirse en: . Deterioro producido por la toxicidad de sus componentes.. . Agotamiento progresivo de las materias primas utilizadas en su fabricación.. . Peligro potencial de los componentes de las pilas.. Todas las pilas contienen cierta cantidad de metales pesados como cadmio, mercurio, plomo estas son sustancias nocivas que representan un peligro potencial para la salud y el medio ambiente. (Organización Planes y estrategias del Medio Ambiente, 2007) 1.4.1 Cadmio: Este metal es sumamente tóxico, además de cancerígeno. Los efectos tóxicos de este metal a bajas concentraciones se comprobaron hace quince años. El organismo humano puede asimilar el 6% de la dosis que absorbe, el resto puede acumularse en los riñones a lo largo de toda la vida, lo que puede producirles lesiones graves e irreversibles. También produce hipertensión arterial, con riesgo de infarto de miocardio y arteriosclerosis. En madres expuestas al Cadmio produce serias afecciones con lesiones para el embarazo, presencia de proteína en la orina, etc. (Cardoso y Rivero 2003) Tanto el cadmio como el mercurio, cuando se infiltran desde los vertederos (en el caso de que éstos no estén perfectamente ubicados e impermeabilizados), o por las pilas que encontramos abandonadas en diferentes grados de descomposición dentro de las cavidades, acabarán contaminando las fuentes de agua potable para consumo humano o para riego agrícola. (Cardoso y Rivero 2003) 1.4.2 Mercurio: Es el metal pesado contaminante más extendido en todo el planeta. Transformado por ciertas bacterias y en condiciones favorables, se convierte en un elemento muy tóxico. La exposición al nivel local del Mercurio ocasiona irritación de la piel, mucosa y es sensibilizante de la piel. (Organización Mundial de la Salud, 2017) En intoxicaciones crónicas y a dosis bajas produce debilidad, pérdida de peso, diarrea, inflamación de encías, fatiga, sabor metálico, insomnio, indigestión, trastornos visuales y temblores. La exposición generalizada al Mercurio en casos de intoxicaciones agudas fuertes, produce una intensa irritación en las vías respiratorias, es productor de Pág.27.
(39) bronquitis, neumonías, bronquiolitis, etc. En intoxicaciones crónicas y a dosis altas produce: irritabilidad, alucinaciones, llanto, excitabilidad, depresiones, tristeza, psicosis, crisis. En casos de exposición a altas dosis en forma oral, colapsa el aparato digestivo, siendo mortal en horas (Organización Mundial de la Salud, 2017). Pero una vez ingerido por los seres humanos, que son animales de sangre caliente, el mercurio se libera de esta fijación y recupera toda su toxicidad. En contacto con el agua el mercurio de las pilas forma una substancia llamada metil-mercurio, un compuesto muy tóxico que se encuentra y concentra en las cadenas alimenticias y provoca en el hombre, como hemos visto; graves desórdenes del sistema nervioso. (Organización Mundial de la Salud, 2017). Esto puede provocar, como ha sucedido en la fauna piscícola y fluvial de las regiones del norte de Europa, que el mercurio sea asimilado por los peces, manteniéndose fijado gracias a un enlace proteínico a sus tejidos, sin afectarles los órganos vitales. El mercurio se nos acumula sobretodo en la médula ósea y en el cerebro, estropeando los tejidos cerebrales y el sistema nerviosos central, todo esto de medio a largo plazo. Recordemos el caso de 120 japoneses afectados por un síndrome paralítico después de haber consumido pez contaminado por metil de mercurio. Las pilas alcalinas aunque indiquen un 0% de mercurio, contienen un 0,5% de esta substancia, además de otros productos menos contaminantes. Las pilas botón contienen hasta un 30% de mercurio. En España se venden unos 10 millones de pilas botón al año, y sólo en la comunidad de Madrid se tiran más de 250,000 pilas botón a la basura. (Organización Mundial de la Salud, 2017) 1.4.3 Plomo: El concepto de intoxicación por plomo (saturnismo, plumbosis o plombemia) se define con base en la evidencia científica de los efectos tóxicos del plomo en concentraciones de 10 microgramos/decilitros (µg/dL) o más en adultos y de 5 microgramos/decilitros (µg/dL) o más en niños; puede originar afectación renal y ósea, convulsiones, edema cerebral y finalmente la muerte. Se ha reportado que en niños y adultos, tras la exposición crónica, promueve una disminución del coeficiente intelectual (IQ), hiperactividad y conducta antisocial. El plomo no tiene ninguna función conocida en el cuerpo humano pero puede competir con el metabolismo del calcio y del hierro. Por lo tanto, de manera más estricta, la Organización Mundial de la Salud sugiere que no Pág.28.
(40) existen concentraciones de plomo que puedan considerarse seguras. En la actualidad el diagnóstico y el tratamiento están definidos; sin embargo, recientemente se ha tomado en consideración la implementación de medidas específicas en cada población. (Azcona, Vicente y Ramírez, 2015) 1.4.4 Cromo: El Cromo se absorbe por vía oral, respiratoria o dérmica. Se distribuye a nivel de médula ósea, pulmones, ganglios linfáticos, bazo, riñón, e hígado. La absorción del catión crómico (Cr3+) es menor que la del anión crómico (Cr6+). El ion cromo (Cr3+) no atraviesa las membranas celulares, uniéndose directamente a la transferrina. El anión crómico (Cr6+) es rápidamente tomado por los eritrocitos e integrado a otras células por el sistema transportador de sulfatos (Cuberos, Rodríguez y Prieto, 2009). 1.5 Tratamiento específico que deben recibir las pilas Someter repetidamente una materia a un mismo ciclo para ampliar o incrementar los efectos de éste es el reciclaje. (Gobierno de España, 2007-2015) La metodología que se debe seguir para llevar a cabo adecuadamente este proceso es: a) Recogida selectiva de pilas: Es una medida adecuada siempre que se tome las precauciones de cuál va a ser el destino de estos residuos. Una forma adecuada de llevar adelante su recolección, es que los mismos centros de ventas de pilas (relojerías, bazares de electrónica, jugueterías, tiendas de fotografía, etc.), actúen como receptor de estos residuos. (Gobierno de España, 2007-2015). b) Depósito transitorio de residuos peligrosos: Estos depósitos, son contenedores específicos donde serán depositadas es una instalación de uso permanente, en donde estos residuos esperan su destino final, con medidas de seguridad para evitar fugas al ambiente de sustancias contaminantes. (Gobierno de España, 2007-2015). Pág.29.
(41) c) Vaciado periódico de los contenedores: Organismos colaboradores, se encargan de vaciar, con periodicidad establecida, estos contenedores en otros de mayor capacidad y de almacenar estos últimos, preparados para su traslado de las pilas botón y de las pilas convencionales. (Gobierno de España, 2007-2015). d) Reciclado: Ante esta realidad es importante dar un tratamiento a estos residuos peligrosos; por ello no pueden seguir el mismo camino que la mayoría de los residuos urbanos. Los problemas que trae aparejado el consumo de pilas no han llegado a la sociedad en forma masiva, una vez que éstas se han convertido en desechos que hay que tirar. Es importante, la reutilización de los elementos y la eliminación de todo peligro futuro de contaminación. (Gobierno de España, 2007-2015). Para cumplir estas premisas meto las pilas en bolsas de plástico e introduzco un agente químico estabilizador que elimina, por medio de una reacción, las características peligrosas de los componentes de cualquier tipo de pila. (Gobierno de España, 20072015). Una vez colocado el estabilizador, las bolsas son termoselladas y depositadas en un molde para la fabricación de bloques intertrabados para la realización de pisos, en espacios al aire libre (caminos, paseos, plazas, etc.) o para la obtención de pavimentos articulados en playas o calles. Este lugar donde se colocan las bolsas termoselladas, será el adecuado para que limite totalmente la posible migración de contaminantes, de esta manera, los aislará y eliminará su posible exposición a la lixiviación. (Gobierno de España, 2007-2015) Este repositorio se ubicará al Norte del núcleo urbano en zona de bardas. El lugar será convenientemente señalizado. El proceso asegura el perfecto sellado de los elementos y evita mediante tres barreras de seguridad su posible filtración y contaminación, prestando al mismo tiempo una gran utilidad a la sociedad. Las bolsas termoselladas, y con el estabilizador, serán colocadas en un repositorio especialmente acondicionado. (Gobierno de España, 2007-2015) Pág.30.
(42) Describiendo el proceso más detalladamente: Las pilas o baterías y micropilas, son colocadas en bolsas de plástico de 1x10-4 metros (m) de espesor y de 0,005 x 0,020 x 0,020 metros (m) de dimensiones máximas. Se le incorpora, previo a su extracción de aire y posterior sellado, tres agentes químicos estabilizadores que neutralizan los componentes peligrosos de los distintos tipos de pilas o baterías que se comercializan. Las reacciones químicas que producen estos estabilizadores, reducen notablemente su solubilidad y movilidad y eliminan prácticamente su toxicidad. (Gobierno de España, 2007-2015). 1.6. Agentes neutralizantes. Los agentes neutralizantes son el ion plumboso (Pb2+), ion mercurio (Hg2+), ácido sulfúrico (H2SO4) y el ion cadmio (Cd2+). (Greenpeace, 2010). 1.6.1 Agente neutralizador del plomo Para el plomo actúa como neutralizador el sulfuro de sodio (Na2S), y el hidróxido de calcio Ca(OH)2. (Greenpeace, 2010) Obteniéndose las siguientes reacciones químicas: Na2S(S) + Pb2+(ac) PbS(S) + 2Na+(ac) Ca(OH)2(S) + Pb2+(ac) Pb(OH)2(S) + Ca2+(ac). 1.6.2 Agente neutralizador del ácido sulfúrico (H2SO4) Se utiliza como agente estabilizador el hidróxido de Sodio (NaOH). (Greenpeace, 2010) Obteniéndose así, la siguiente reacción química: H2SO4(ac) + 2NaOH(S) Na2SO4(ac) + 2H2O(l). 1.6.3 Agente neutralizador del cadmio Para el cadmio, el agente de estabilización que se utiliza, es el carbonato de sodio (Na2CO3). (Greenpeace, 2010). Pág.31.
Figure




Documento similar
Debido al riesgo de producir malformaciones congénitas graves, en la Unión Europea se han establecido una serie de requisitos para su prescripción y dispensación con un Plan
Como medida de precaución, puesto que talidomida se encuentra en el semen, todos los pacientes varones deben usar preservativos durante el tratamiento, durante la interrupción
que hasta que llegue el tiempo en que su regia planta ; | pise el hispano suelo... que hasta que el
Abstract: This paper reviews the dialogue and controversies between the paratexts of a corpus of collections of short novels –and romances– publi- shed from 1624 to 1637:
Por lo tanto, en base a su perfil de eficacia y seguridad, ofatumumab debe considerarse una alternativa de tratamiento para pacientes con EMRR o EMSP con enfermedad activa
The part I assessment is coordinated involving all MSCs and led by the RMS who prepares a draft assessment report, sends the request for information (RFI) with considerations,
Pero antes hay que responder a una encuesta (puedes intentar saltarte este paso, a veces funciona). ¡Haz clic aquí!.. En el segundo punto, hay que seleccionar “Sección de titulaciones
El contar con el financiamiento institucional a través de las cátedras ha significado para los grupos de profesores, el poder centrarse en estudios sobre áreas de interés