Inducción de la embriogénesis somática en Crinum x powellii "album" (Amaryllidaceae)
Texto completo
(2) INDUCCIÓN DE LA EMBRIOGÉNESIS SOMÁTICA EN Crinum x powellii “album” (Amaryllidaceae).. CAROLINA BEDOYA PERDOMO CÓDIGO: 1088244228 ANYELA MARCELA RÍOS RÍOS CÓDIGO: 42163368. TRABAJO DE GRADO Requisito parcial para optar al título de Químico Industrial. DIRECTOR DEL PROYECTO JAIME NIÑO OSORIO. Profesor Titular Universidad Tecnológica de Pereira. UNIVERSIDAD TECNOLÓGICA DE PEREIRA FACULTAD DE TECNOLOGÍA ESCUELA DE TECNOLOGÍA QUÍMICA PEREIRA 2010.
(3) TABLA DE CONTENIDO. RESUMEN ................................................................................................ ................................ ............................................. 12 ABSTRACT ................................................................................................ ................................ ............................................ 14 1.. INTRODUCCIÓN ................................................................ ............................................................ 17. 2.. MARCO TEÓRICO ................................................................ ......................................................... 19 2.1. FAMILIA AMARYLLIDACEAE ................................................................ ................................. 19. 2.1.1. Descripción morfológica ................................................................ ................................... 19. 2.1.2. Taxonomía de la familia Amaryllidaceae .......................................... ................................ 20. 2.1.3. Distribución geográfica de la familia Amaryllidaceae Amaryllidaceae........................ 21. 2.2. GÉNERO CRINUM ................................................................ .................................................. 21. 2.2.1. Descripción morfológica ................................................................ ................................... 21. 2.2.2. Taxonomía del género Crinum ......................................................... ................................ 23. 2.2.3. Distribución geográfica del género Crinum ....................................... ................................ 24. 2.3. CULTIVO IN VITRO ................................................................ ................................................. 25. 2.4. EMBRIOGÉNESIS SOMÁTICA (ES) ....................................................... ................................ 25. 2.4.1. Generalidades ................................................................ .................................................. 25. 2.4.2. Factores que afectan el cultivo de tejidos vía embriogénesis somática (ES) ................................................................ ................................................... 27. 2.4.2.1 Esterilización del material utilizado (Asepsia) ............................... 27 2.4.2.2 Genotipo y estado de desarrollo del explante ............................... 29 2.4.2.3 Medio de cultivo ................................................................ ............................................ 29 2.4.2.4 Luz, temperatura y humedad ........................................................ ................................ 32 2.4.2.5 Reguladores de crecimiento ......................................................... ................................ 32 2.4.2.5.1 Auxinas ................................................................ ........................................................... 34 2.4.2.5.2 Citoquininas ................................................................ .................................................... 37.
(4) 2.4.3. Aspectos morfológicos y fisiológicos de la embriogénesis somática (ES) y de los embriones somáticos (ESs) ......................... 38. 2.4.4. Etapas de la embriogénesis somática indirecta (ESI) ...................... 40. 2.4.4.1 Inducción y cultivo de callos ......................................................... ................................ 40 2.4.4.2 Inducción de embriones somáticos (ESs) ..................................... ................................ 42 2.4.4.3 Proliferación de embriones somáticos (E (ESs) Ss) ................................ 44 2.4.4.4 Maduración de los embriones somáticos ...................................... ................................ 45 2.4.4.5 Germinación Germi y conversión en planta ............................................. ................................ 46 2.4.5. Cultivo de tejido in vitro en Amaryllidaceae ...................................... ................................ 47. 3.. JUSTIFICACIÓN................................................................ ............................................................. 51. 4.. OBJETIVOS................................................................................................ ................................ .................................... 53. 5.. 4.1. OBJETIVO GENERAL ................................................................ ............................................. 53. 4.2. OBJETIVOS ESPECÍFICOS ................................................................ .................................... 53. SECCIÓN EXPERIMENTAL ................................................................ ........................................... 54 5.1. 5.1.1. Reactivos ................................................................ .......................................................... 54. 5.1.2. Materiales y equipos................................................................ ......................................... 54. 5.1.3. Material vegetal ................................................................ ................................................ 55. 5.2. MÉTODOS ................................................................ .............................................................. 55. 5.2.1. Procedimiento de desinfección ......................................................... ................................ 55. 5.2.2. Obtención de explantes ................................................................ .................................... 56. 5.2.3. Inducción de callos ................................................................ ........................................... 57. 5.2.4. Inducción de los embriones somáticos (ESs) ................................... ................................ 60. 5.2.5. Proliferación de los embriones somático somáticoss (ESs) .............................. 61. 5.2.6. Maduración de los embriones somáticos (ESs)................................ (ESs) 62. 5.2.7. Germinación y conversión en planta ................................................ ................................ 63. 5.3 6.. MATERIALES ................................................................ .......................................................... 54. TOMA DE DATOS Y ANÁLISIS ESTADÍSTICO ....................................... ................................ 65. RESULTADOS Y DISCUSI DISCUSION ................................................................ ....................................... 66.
(5) 6.1. DESINFECCIÓN DE BULBOS DE CRINUM X POWELLII “ALBUM” ................ 66. 6.2. INDUCCIÓN DE CALLOS ................................................................ ........................................ 67. 6.2.1. Determinación del tipo de explante óptimo óptimo para la inducción de. callos. ................................ ................................................................................................ ......................................... 68. 6.2.2. Efecto del 2,4-D D en ausencia de citoquinina durante la inducción de callos ................................................................ ........................................... 69. 6.2.3. Efecto del tratamiento con antioxidantes en el medio de cultivo durante la inducción de callos .......................................................... ................................ 71. 6.2.4. Efecto del 2,4 2,4-D en combinación con 6--BAP durante la inducción de callos ................................................................ ........................................... 74. 6.2.5. Efecto del 2,4-D 2,4 D en combinación con kinetina durante la inducción de callos ................................................................ ........................................... 78. 6.3. INDUCCIÓN DE EMBRIONES SOMÁTICOS (ESS) ................................ 84. 6.4. PROLIFERACIÓN DE EMBRIONES SOMÁTICOS (ESS) ....................... 88. 6.5. MADURACIÓN DE LOS EMBRIONES SOMÁTICOS (ESS) .................... 91. 6.6. GERMINACIÓN Y CONVERSIÓN EN PLÁNTULA .................................. ................................ 94. 7.. CONCLUSIONES ................................................................ ......................................................... 104. 8.. RECOMENDACIONES ................................................................ ................................................. 106. 9.. BIBLIOGRAFÍA ................................................................ ............................................................. 107. ANEXOS ................................................................................................ ................................ .............................................. 122.
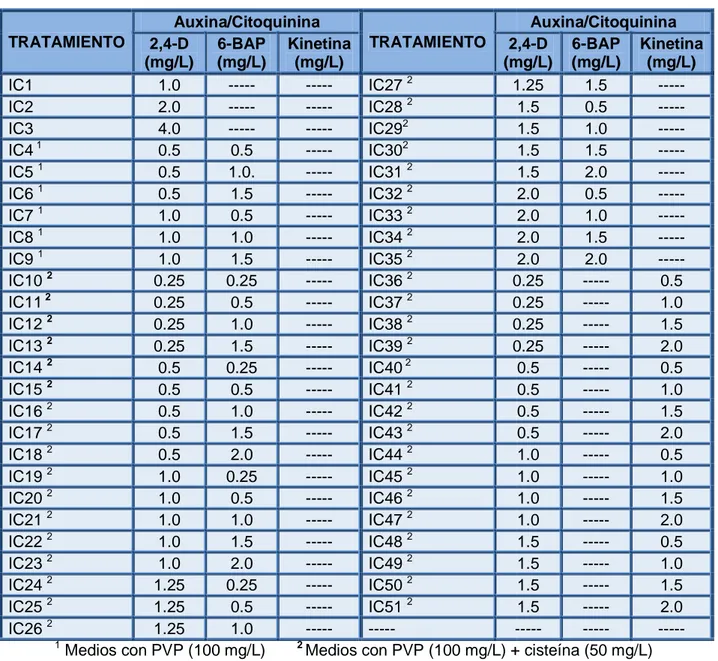
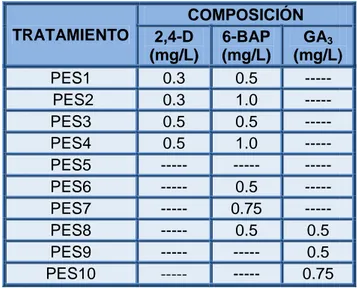
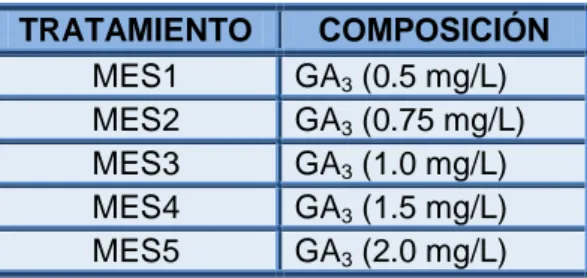
(6) INDICE DE TABLAS. Tabla 1. Algunos elementos importantes para la nutrición de plantas y su importancia fisiológica (Kyte and Kleyn, 1996). ............................................ ................................ 30 Tabla 2. Resumen de las principales fitohormonas empleadas en el cultivo de tejidos y sus principales efectos (González, ( 2001). ................................ 33 Tabla 3. Concentración de los reguladores de crecimiento utilizados en los medios MS para la inducción de callos de C. x powellii “album”. “album” .................. 58 Tabla 4. Concentración de los reguladores de crecimiento empleados para la proliferación de ESs de C. x powellii “album”. ............................................... ................................ 62 Tabla 5. Concentración de los reguladores de crecimiento evaluados para la maduración de los ESs de C. x powellii “album”. .......................................... ................................ 63 Tabla 6. Concentración de los reguladores de crecimiento empleados para la germinación de los ESs de C. x powellii “album”. ......................................... ................................ 64 Tabla 7. Porcentaje de contaminación de los explantes de Crinum x powellii “album” a los 14 días de iniciado el experimento. ......................................... ................................ 67 Tabla 8. Número de ESs obtenidos con los diferentes medios de crecimiento evaluados con la combinación de 2,4 2,4-D y 6-BAP. ........................................ ................................ 86 Tabla 9: Número de ESs desarrollados en los diferentes medios de crecimiento evaluados con 2,4 2,4-D y kinetina. ................................................. ................................ 87 Tabla 10. Estructuras formadas a partir de embriones somáticos (ESs) de C. x powellii “album” durante su maduración. .................................................... ................................ 94.
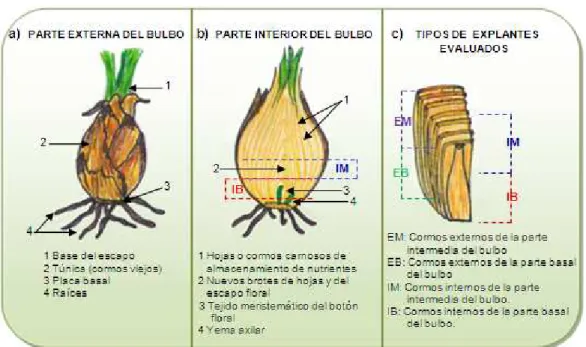
(7) INDICE DE FIGURAS. Figura 1. Crinum x powellii “album”: a) Flor. b) Hojas. c) Bulbo. d) Planta joven sin inflorescencias. ................................................................ .............................................. 22 Figura 2. Estructuras de algunos reguladores de crecimiento (Soberón et al., 2005). ................................................................................................ ................................ ............................................ 35 Figura 3. Obtención de explantes del bulbo de C. x powellii “album” para la inducción de callos................................................................. ....................................................... 56 Figura 4. Características del bulbo de Crinum x powellii “album” y tipos de explantes evaluados evaluados. a) y b) Partes externas e internas, respectivamente del bulbo de las especies de la familia Amaryllidaceae. c) Tipo de explantes evaluados durante la fase de inducción de callos. ........................................ ................................ 59 Figura 5. Etapas desarrolladas durante la inducción de la embriogénesis somática (ES) en Crinum x powellii “album” (ESs: embriones somáticos) .... 66 Figua 6. Porcentaje de crecimiento de callos a los 34 días de iniciado el experimento con los medios que contenían 2,4-D 2,4 D en combinación con 6-BAP, 6 considerando los diferentes tipos de explante empleados. ........................... 68 Figura 7.. Efecto de los tratamientos IC1 - IC3 en los explantes de Crinum x powellii “album”:: a) Explantes a los tres días de iniciado el cultivo. b) Cambio en la coloración del medio de cultivo a los 5 días de iniciado el experimento. c) Callo friable oxidado. d) Callos necrosados después de dos meses de cultivo. ................................................................................................ ................................ ........................................... 70 Figua 8. Porcentaje de oxidación a los 19 días de iniciado el experimento con los medios que contenían antioxidante. Medios IC4 - IC9: PVP (100 mg/L); medios IC15 - IC17 e IC20 - IC22: PVP (100 mg/L) + cisteína (50 mg/L). ................................................................................................ ................................ ............................................ 72.
(8) Figura 9. Explantes con desarrollo de abultamientos (A) y callos friables después de 63 días de iniciado el experimento en los medios MS suplementados con 2,4 2,4-D (0.5, 1.0 y 1.25 mg/L) y 6-BAP BAP (0.25 - 1.5 mg/L). 75 Figura 10. Clasificación de los tratamientos evaluados utilizando 2,4-D 2,4 (0.25, 0.5, 1.0, 1.25, 1.5 y 2.0 mg/L) en combinación con 6-BAP 6 BAP (0.25, 0.5, 1.0, 1.5 y 2.0 mg/L) según el porcentaje porcentaje de crecimiento obtenido a los 34 días de iniciado. el. experimento. (las. concentraciones. de. 2,4-D 2,4. y. 6-BAP. correspondientes a cada tratamiento se presentan en la tabla 3)................. 3) 76 Figua 11. Porcentaje de crecimiento de callos obtenido a los 34 días de iniciado el experimento con los medios incluidos en el conglomerado 1. ..... 77 Figura 12. Tipo de tejido desarrollado en los medios MS suplementados con 2,4-D D (1.0 mg/L) y kinetina (1.0 y 1.5 mg/L) para la inducción de callo después de 34 días de cultivo cultivo.. a) Abultamiento (A) desarrollado en más del 70% del explante. b) Elongación del explante (CE). c) Callo friable en la base del explante (CF). d) Explantes con: abultamiento del tejido superficial (derecha) y formación de callo friable (izquierda). e) Explante con callo friable y abultamiento. f) Callo algodonoso (CA) y friable. ....................................... ................................ 79 Figura 13. Porcentaje de crecimiento crecimiento de los diferentes tipos de tejido desarrollados en los diferentes medios de inducción MS con 2,4-D 2,4 y kinetina (tratamientos IC44, IC45, IC46, IC48, IC49 e IC50)...................................... ................................ 80 Figua 14. Clasificación de los tratamientos evaluados utilizando 2,4 2,4-D (0.5 – 1.5 mg/L) en combinación con kinetina (0.5 – 2.0 mg/L) según el porcentaje de crecimiento de callos obtenido a los 34 días de iniciado el experimento. 81 Figua 15. Porcentaje de crecimiento de callos obtenido a los 34 días de iniciado el experimento con los tratamientos incluidos en el conglomerado 1 (IC45, IC46, IC48 e IC49). ................................................................ ............................................ 81.
(9) Figura 16. Apariencia de los callos obtenidos después de 41 días de iniciado el experimento con los medios MS suplementados con 2,4-D 2,4 y kinetina. a) y b) proliferación de callo. c – f) Callo friable con la formación de embriones somáticos (ESs) en su superficie. ................................................................ ................................. 82 Figura 17. Estructuras embriogénicas obtenidas en los diferentes medios evaluados durante la inducción de embriones somáticos (ESs). (ESs) a y b) ESs desarrollados en medio semi-líquido semi en presencia de 2,4-D D y 6-BAP. 6 c y d) ESs desarrollados en medio sólido en presencia de 2,4-D 2,4 D y kinetina. e y f) Protuberancias de color verde claro y crema en los callos obtenidos del tejido meristemático dell botón floral (con 2,4-D 2,4 y kinetina). ................................... ................................ 85 Figura 18. Estructuras embriogénicas obtenidas en los diferentes medios evaluados durante la etapa de proliferación de los embriones somáticos (ESs). a y b) Embriogénesis repetitiva en los medios que contenían 2,4 2,4-D únicamente y en combinación con 6-BAP. 6 BAP. c y d) ESs desarrollados en presencia de GA3. e y f) Proliferación de ESs en el medio libre de hormonas de crecimiento............................................................................................... ................................ .............................. 89 Figura 19. Embriones somáticos (ESs) que evolucionaron hasta formar estructuras alargadas en medio MS suplementado con GA3 (vistos a través de un estereoscopio con 10X) durante la etapa de maduración. .................. 92 Figura 20 Estructuras formadas a partir de ESs cultivados en medio MS suplementado con GA3 durante la etapa de maduración: raíces (R), brote globular alargado (BGA), brote alargado con ápice (BAA), brote globular (BG) y masas pro-embriogénicas embriogénicas (MPE). .............................................................. .............................. 92 Figura 21. Estructuras formadas a partir de embriones somáticos (ESs) (ESs de C. x powellii “album” cultivados en los diferentes medios de germinación. germinación a, b y c) Formación de raíces de diferentes formas y espesor. d) Formación de estructuras alargadas, algunas de las cuales se convirtieron en raíces.
(10) posteriormente. e) Callos y masas pro-embriogénicas embriogénicas con formación de callo algodonoso en su superficie. f) Callo friable formado a partir de ESs........... 95 Figura 22. Esquema para la inducción de la embriogénesis somática en C. x powellii “álbum (MS: Murashige y Skoog (1962); ESs: embriones somáticos). ................................................................................................ ................................ .................................................... 103.
(11) INDICE DE ANEXOS Anexo1. Protocolo para la desinfección de los bulbos de Crinum x powellii “album” ................................................................................................ ................................ ........................................ 122 Anexo 2. Soluciones stock para la preparación el medio de cultivo Murashige y Skoog (1962) (MS) ................................................................ ................................................... 123 Anexo 3. Diagrama de flujo para preparar 1 litro de medio de cultivo Murashige y Skoog (1962) ................................................................ .......................................... 124 Anexo 4. Tabla para la toma de datos durante el seguimiento a cada experimento realizado................................................................ ................................................. 125 Anexo 5. Conglomerados obtenidos al evaluar el porcentaje de crecimiento total en la etapa de inducción de callo con los tratamientos que contenían 2,4-D en combinación binación con 6-BAP 6 (IC18 – IC35)................................. ........................................ 126 Anexo 6. Resultados del análisis de varianza (ANOVA) realizado a los tratamientos evaluados durante la etapa de inducción de callo que contenían 2,4-D D en combinación con 6 6-BAP BAP para determinar si existían diferencias significativas al comparar el porcentaje promedi promedio o de crecimiento en cada uno de ellos. ................................................................................................ ................................ ...................................... 126 Anexo 7. Conglomerados obtenidos al evaluar el porcentaje de crecimiento total en la etapa pa de inducción de callo con los tratamientos que contenían 2,4-D D en combinación con kinetina (IC36 – IC51)....................................... ................................ 128 Anexo 8. Resultados del análisis de varianza (ANOVA) realizado a los tratamientos evaluados durante la etapa de de inducción de callo que contenían 2,4-D D en combinación con kinetina para determinar si existían diferencias significativas al comparar el porcentaje promedio promedio de crecimiento en cada uno de ellos. ................................................................ .................................................. 128.
(12) RESUMEN. Existen especies vegetales que proporcionan gran cantidad de alcaloides con actividades biológicas entre las cuales se encuentran las pertenecientes a la familia Amaryllidaceae. En esta familia el género Crinum se destaca por la producción abundante de licorina, licorina, la cual presenta marcada actividad citotóxica contra varias líneas celulares de tumores humanos. Sin embargo, la tasa de multiplicación de dicho género es bastante baja (alrededor de cinco bulbilos a partir de un bulbo adulto por año), por lo cual la l micropropagación in vitro ofrece una alternativa para aumentar esa tasa y la biomasa en un periodo relativamente corto de tiempo.. Se indujo la embriogénesis somática indirecta a partir de explantes provenientes de los cormos internos de la parte basal de los bulbos de Crinum x powellii “album”. La inducción y proliferación de callos friables se logró en el medio Murashige y Skoog (MS) (1962) suplementado con ácido 2,4-diclorofenoxiacético diclorofenoxiacético. (2,4-D) D). en. combinación. con. diferentes. concentraciones de 6-benzilaminopurina 6 (6-BAP) BAP) y kinetina, obteniendo la mayor tasa de crecimiento y la posterior formación de embriones somáticos (ESs) con 1 mg/L de 2,4-D 2,4 y 1.0 a 1.5 mg/L kinetina,, aunque la inducción de dichos embriones aumentó significativamente al disminuir la concentración de 2,4-D y kinetina en un 60 y 75% respectivamente, siendo la combinación más efectiva 0.4 mg/L de 2,4 2,4-D y 0.375 mg/L de kinetina. kinetina Los callos embriogénicos proliferaron al ser transferidos al medio MS libre de reguladores de crecimiento.. Posteriormente, osteriormente, los ESs fueron transferidos al medio MS suplementado con diferentes concentraciones de GA3 (0.5, 0.75, 1.0, 1.5 y 2.0 mg/L), sobre el cual se encontraba un disco de papel filtro estéril para evitar el contacto directo del material vegetal co con n el medio y estimular su desecación. desecación Al cabo.
(13) de una semana,, se retiró el disco de papel y los embriones fueron reubicados sobre el medio de cultivo para su maduración; siendo los medios más efectivos los que contenían 1.0, 1.5 y 2.0 mg/L de GA3; en los cuales, algunos de los ESs alcanzaron la fase escutelar. Sin embargo, no se logró la germinación de dichos embriones; en lugar de desarrollar plántulas, plántula se produjo gran cantidad de raíces y algunos ESs perdieron su capacidad embriogénica formando nuevamente nuevament callo friable.. Palabras. clave:. ácido. 2,4-diclorofenoxiacético,. ácido. giberélico,. 6-. benzilaminopurina, callo, embriones somáticos, kinetina, reguladores de crecimiento..
(14) ABSTRACT. There here are plant species that provide a large amount of alkaloids with biological activities which among them are those belonging to the Amaryllidaceae family. family In this family, the genus Crinum is characterized by the abundant production of licorina, which has high cytotoxic activity against several human tumor cell lines. However, the rate of growth of this genus is rather low (around five bulbils from bulb adult per year), that is why the in-vitro micropropagation offers an alternative to increase the rate and biomass in a relatively short period of time.. Indirect somatic embryogenesis was induced by explants from internal corms of the bulbs of Crinum x powellii "album" basal part. Induction and proliferation of friable callus was achieved on MS medium (Murashige and Skoog, 1962) supplemented with 2,4-dichlorophenoxyacetic dichlorophenoxyacetic acid (2,4-D) (2,4 in combination with different concentrations of 6-benzylaminopurine 6 benzylaminopurine (6-BAP) (6 and kinetin, obtaining the highest growth rate and the subsequent subse production of somatic embryos (SEs) with 2,4-D (1 mg/L) and kinetin (1.0 to 1.5 mg/L), although the induction of such embryos increased significantly by decreasing the 2,4-D D and kinetin concentration at 60 and 75% respectively, being the most st effective combination 0.4 mg/L of 2,4 2,4-D D and 0.375 mg/L mg/ of kinetin. The embryogenic calluss proliferated when they were transferred to MS medium free of growth regulators.. Subsequently, the SEs were transferred to MS medium, supplemented with different concentrations of GA3 (0.5, 0.75, 1.0, 1.5 and 2.0 mg/L), they on wich stood on a sterile filter filter paper disk to avoid direct contact of the vegetable material with the medium to encourage its drying. After a week, week the paper disc was with drew and the embryos were relocated on the culture medium for maturation, being the most effective medium those with concentration of 1.0,.
(15) 1.5 and 2.0 mg/L L of GA3, in which some SEs reached the scutellar stage. However, germination was not achieved such embryos,, instead developing seedlings, there produced a lots of roots and some lost their embryogenic ability form again friable callus. callus. Keywords: 6-benzylaminopurine benzylaminopurine, callus, 2,4-dichlorophenoxyacetic dichlorophenoxyacetic acid, gibberellic acid, growth regulators, regulators kinetin, somatic embryos. embryos.
(16) AGRADECIMIENTOS. A nuestros padres por su guía, co comprensión mprensión y apoyo incondicional durante el transcurso de nuestra carrera.. A nuestros amigos del laboratorio de Biotecnología – Productos Naturales (GB-PN), PN), por animarnos cuando los resultados no eran satisfactorios, especialmente a Luz Adriana Ramirez y a Jorge Andres Idarraga por ayudarnos a encontrar soluciones cuando más las necesitábamos.. A los profesores Jaime Niño Osorio, Oscar Marino Mosquera y Janeth Milena Correa, por sus consejos, enseñanzas y paciencia durante la realización de este proyecto; además, por permitirnos ser parte de la familia del GB-PN.. Al Profesor José Rubiel Bedoya por su colaboración en la realización del análisis estadístico de los datos obtenidos en este trabajo.. A la Universidad Tecnológica de Pereira a través de la Vicerrectoría Vicerr de Investigaciones, por la financiación aportada para realizar este proyecto..
(17) 1. INTRODUCCIÓN. Diversos estudios fitoquímicos y farmacológicos han permitido el desarrollo de varios compuestos con actividades biológicas; una amplia variedad de drogas usadas en la medicina moderna han sido aisladas directamente de plantas o son obtenidas mediante hemisíntesis de compuestos de origen natural. Una de las familias de plantas que ha sido estudiada ampliamente por la importancia de sus alc alcaloides aloides es la Amaryllidaceae (Elgorashi et al., 2002); en ésta, el género Crinum se destaca por la producción abundante de licorina, la cual presenta marcada actividad citotóxica contra varias líneas celulares de tumores humanos (Cabezas et al., 2007).. La a multiplicación vegetativa en especies de la familia Amaryllidaceae está asegurada a través de sus bulbos; sin embargo, su tasa de propagación es bastante baja (alrededor de cinco bulbilos bulbilos a partir de un bulbo adulto por año) y varias de ellas son estériles, estéril este es el caso de Crinum x powellii “album”, de la cual se ha logrado aislar diversos compuestos, encontrando como alcaloide principal licorina (Niño et al., 2005). Por esto, hay que recurrir a nuevas técnicas de propagación ación para preservar los recursos genéticos vegetales de interés farmacológico, entre las cuales se encuentra el cultivo in vitro de células vegetales (Verpoorte et al., 2002; Morán et al., 2003). 2003. Por otra parte, la industrialización y el urbanismo acelerado os han llevado a la sobreexplotación y la pérdida de valiosos recursos naturales, incluidas las plantas de interés farmacológico, como lo son las especies del género Crinum,, las cuales han sido utilizadas en el tratamiento de varias enfermedades y molestias físicas (Okpo et al., 2001; Ode et al., 2006). Hay muchas especies de plantas medicinales medicinales en peligro de extinción y su germoplasma debe ser conservado, multiplicado y mejorado mejorado (Chand and Sahrawat, 2002)..
(18) Entre las técnicas de cultivo in vitro de tejidos, la embriogénesis somática representa un método eficiente para la regeneración de plántulas pl y se ha preferido entre otros métodos, porque puede ser usada en el mejoramiento genético de especies vegetales, debido principalmente a la dificultad que existe para regenerar tejidos por otras vías, como la organogénesis (Chand ( and Sahrawat, 2002 2002; Huang et al., 2005; von Arnold, 2008).. Los niveles de co competencia mpetencia embriogénica, la morfología potencial de explantes y el establecimiento de cultivos embriogénicos proliferantes dependen del material vegetal utilizado. Las variedades de una especie difieren tanto en su respuesta a las condiciones de maduración como en el tiempo requerido para la diferenciación de embriones somáticos. Por lo tanto, cada. fase. de. la. embriogénesis. somática. debe. ser. determinada. experimentalmente para cada especie vegetal (von on Arnold, 2008)..
(19) 2. MARCO TEÓRICO. 2.1 FAMILIA AMARYLLIDACEAE 2.1.1 Descripción morfológica La familia Amaryllidaceae está conformada por un grupo de plantas herbáceas, en gran parte provistas de bulbo con rizomas o con raíces fasciculadas; presentan hojas simples, generalmente sésiles y lineales o en e forma de tiras, lanza, lanceoladas hasta ampliamente elípticas de forma plana o cóncava. Las raíces son adventicias y se originan de la placa basal del bulbo (Meerow et al al., 1999; López and Espejo, 2002).. Las flores son hermafroditas, actinomorfas (de simetría radial), generalmente son grandes y atractivas, compuestas de 6 tép tépalos dispuestos en dos conjuntos de 3 piezas iezas con la misma morfología, libres entre sí o soldados en la base formando un tubo corto o largo, con 6 estambres y un ovario ínfero; se hallan solitarias o dispuestas en inflorescencias o en umbela. Los tépalos pueden ser de color verde, verde y blanco, blanco puro, o alguna combinación de crema, amarillo, rojo, rosa, púrpura o marrón, muy raramente rara azules (Vigneron, 2003).. La multiplicación vegetativa en las especies de Amaryllidaceae está asegurada a través de los bulbos que éstas presentan. Como ocurre en otras plantas bulbosas,, un solo individuo, aún en aislamiento, puede multiplicarse indefinidamente a través del tiempo en forma asexual gracias a estas estructuras. Así mismo, varias especies de Amaryllidaceae son estériles, por lo que la reproducción vegetativa es la única alternativa reproductiva que poseen. Las flores vistosas de las especies Amaryllidaceae son polinizadas. 19.
(20) por abejas, avispas, mariposas, polillas y pájaros (Watson Watson and Dallwitz, 1992).. 2.1.2 Taxonomía de la familia Amaryllidaceae Las as plantas de la familia Amaryllidaceae son monocotiledóneas y taxonómicamente se clasifican como:. División: Magnolliophyta Clase: Liliopsida Subclase: Liliidae Orden: Asparagales Familia: Amaryllidac aceae. Hasta la fecha, los análisis filogenéticos de las monocotiledóneas, basados en la morfología y matrices de secuencias de genes, genes, han permitido clasificar 31. familias. pertenecientes. al. orden. Asparagales,,. incluyendo. la. Amaryllidaceae, las cuales debido a que han desarrollado muchos rasgos en paralelo con Liliales iales se encontraban catalogadas erróneamente entre este orden. La a relación de la familia Amaryllidaceae con otros Asparagales había sido o difícil de demostrar; sin emb embargo, al utilizar datos moleculares se encontró que las familias Amaryllidaceae, Agapanthaceae aceae y Alliaceae, forman un grupo monofilético estrechamente relacionado con las familias Hyacinthaceae s.s. y Themidaceae del orden Asparagales sparagales (Meerow et al., 1999).. Las especies de la familia Amaryllidaceae se enc encuentran uentran agrupadas en 15 tribus:. Amaryllideae,. Eucharideae,. Calostemmateae,. Eustephieae,. Galantheae,. Clinanteae, linanteae,. Cyrtantheae,. Gethyllideae,. Haemantheae,. Hippeastreae, Hymenocallideae, Lycorideae, Narcisseae, Pancratieae, y Stenomesseae (Meerow et al., 1999; Meerow et al., 2000).. 20.
(21) 2.1.3 Distribución ión geográfica de la familia Amaryllidaceae La familia Amaryllidaceae consta de 59 géneros y 860 especies, especies siendo los principales incipales centros de diversi diversidad América del Sur (28 géneros) y Sudáfrica (18 géneros). La región Mediterránea cuenta con ocho géneros, mientras que Australia solo tiene tres géneros. África del Sur tiene 210 especies endémicas de Amaryllidaceae; Amaryl en las regiones de Namaqualand y del Cabo se encuentran 111 especies, de las cuales el 77% son endémicas de estas dos regiones. La familia Amaryllidaceae puede ocupar hábitats diferentes: lugares estacionalmente secos, el sotobosque de las selvas tropicales y las riveras de los ríos (Snijman, 2004).. De acuerdo con Motomi et al., (1999), al secuenciar el gen matk localizado en el genoma de cloroplastos, cloroplastos, en 31 especies representativas de los 59 géneros de la familia Amaryllidaceae, permitió determinar que el centro de origen de ésta familia evolucionó desde el África y subsecuentemente se expandió hacia otros continentes. Otras líneas de eviden evidencia cia permiten deducir que Suramérica fue el centro de diversificación secundaria.. 2.2 GÉNERO CRINUM Es un género de plantas bulbosas perteneciente a la familia amilia Amaryllidaceae con flores vistosas parecidas a las de los lirios (Lilium). ). El nombre Crinum deriva. del. griego. ""krinon". que. significa. lirio. o. azucena azucena.. Incluye. aproximadamente 120 especies que se distribuyen a lo largo de lagos y fuentes de agua en regiones tropicales y subtropicales de todo el mundo.. 2.2.1 Descripción morfológica El género Crinum está constituido por plantas herbáceas perennes que crecen a partir de bulbos gruesos de hasta 15 cm de diámetro. Las hojas son. 21.
(22) planas, muy largas y arrosetadas. Las flores son actinomorfas, hermafroditas, sumamente vistosas. El perigonio es infundibuliforme o rotado, compuesto de 6 tépalos unidos en su parte basal, formando un tubo cilíndrico o abierto. El androceo está compuesto por 6 estambres,, los cuales pueden ser más cortos o más largos que los tépalos. Los estambres presentan filamentos filiformes y anteras versátiles, dorsifijas. El gineceo está compuesto por un ovario ínfero, trilocular, con los lóculos pauci o pluriovulados, en ocasiones uniovulados. El estilo es filiforme y el estigma es subcapitado. El fruto es una cápsula.. Las flores se hallan dispuestas en umbelas plurifloras en la extremidad de un largo escapo macizo y sin hojas (López and Espejo, 2002; Archer, 2004).. Figura 1. Crinum x powellii “album”: a) Flor. b) Hojas. c) Bulbo. d) Planta joven sin inflorescencias. Crinum × powellii presenta un bulbo globoso, de 7 cm de diámetro, provisto de un cuello corto. Las hojas son numerosas, arrosetadas, de 9 a 12 dm de largo por 7 - 10 cm de ancho, lisas, de color verde brillante, muy decorativas. Las flores son pedunculadas, blancas o rosas, con un tubo de 7 cm de largo y los segmentos lineal lineal-oblongos oblongos algo más largos. Las flores están dispuestas. 22.
(23) en umbelas de 6 a 9 flores, en la extremidad de un largo escapo macizo, verde claro comprimido y sin hojas de 6 dm de altura. Florece en verano y puede alcanzar una altura de 0.8 – 1.2 m dependiendo de la especie (Christman, 2006).. Se considera que Crinum × powellii es el resultado del cruce cru interespecífico entre Crinum bulbispermum por Crinum moorei;; fue descrita a partir de una planta del jardín particular de Sir W. Bowman, Jolwynds, Dorking (Inglaterra), en julio de 1887. Se diferencia de sus progenitores porque C. moorei presenta 12 - 15 hojas de 0 0.5 – 0.9 m de longitud y flores rosadas; C. bulbispermum, 5 - 8 hojas de 0.6 – 2.0 m de longitud y flores blancas con tintes rojizos (Hurrell and Delucchi, 2007).. 2.2.2 Taxonomía del género Crinum División: Magnolliophyta Clase: Liliopsida Subclase: Liliidae Orden: Asparagales Familia: Amaryllidaceae Subfamilia: ia: Amarylloideae Tribu: Amaryllideae Subtribu: Crininae. El género Crinum fue establecido por Linneaus (1753) y Herbert (1837), además separaron el género en dos secciones basados en el grado de manifestación de los pétalos; Baker (1881) lo dividió en tres subgéneros: Stenaster, Platyaster y Codonocrinum; posteriormente él mismo eliminó el subgénero Plateaster y lo clasificó dentro de Stenaster, el cual debe ser llamado subgénero Crinum puesto que contiene el tipo de especies, C. americanum L. (Meerow et al., 2003).. 23.
(24) La distribución de este género es más significativa en el África subsahariana y su afinidad taxonómica con un grupo de géneros endémicos de África permite que sea incluido en la tribu Amaryllideae;; la cual está muy bien determinada por numerosas semejanzas morfológicas, con fibras de tejidos extensible en las hojas, óvulos comúnmente numerosos y ricos en agua. Es el género más grande en la subtribu Crininae y el único capaz de dispersarse fuera de África (Meerow and Snijman, 2001).. Se han producido confusiones en la nomenclatura de las especies del género Crinum,, debido a búsquedas búsqueda inadecuadas,, fallas en la asignación de códigos botánicos,. información. insuficiente. o. una. mala. interpretación. y. reconocimiento del material vegetal, debido a las similitudes morfológicas que presentan algunas especies. En el caso del híbrido Crinum x powellii “album”,, se presenta confusión en una de las especies que participó en el cruce interespecífico; interespecífico es claro que una de ellas es Crinum moorei, moorei pero la otra suele confundirse con C. longifolium y C. bulbispermum (Hannibal, 2001).. 2.2.3 Distribución geográfica del género Crinum El género Crinum L. es el único género pantropical de la Amaryllidaceae, Amaryllidaceae con especies que se encuentran en África, América, Asia y Australia. Las semillas de Crinum se han adaptado a la dispersión oceánica; Koshimizu (1930), consideró que ue este factor es el responsable de la distribución amplia y de la presencia en regiones fuera del continente africano de este género; el punto de dispersión se originó en África y se extendió hacia América y Australia; lo anterior explica las similitudes de las especies americanas de Crinum con las del norte de África tropical (Meerow et al., 2003).. 24.
(25) 2.3 CULTIVO IN VITRO El cultivo in vitro de tejidos vegetales, consiste en aislar una parte de la planta (semillas, embriones, tejidos, células), para cultivarla en un medio nutritivo y en condiciones asépticas controladas; se caracteriza por la multiplicación rápida de explantes provenientes de una planta donante, abriendo briendo la posibilidad de obtener gran cantidad de individuos viables. Dentro de éste se encuentra el cultivo de: semillas, órganos y células aisladas, protoplastos, suspensiones celulares y callos (Ayerbe, 1990).. Los primeros trabajos trabaj sobre cultivo in vitro fueron realizados en 1838 por Schwann y Schleiden; quienes postularon la teoría de la totipotencia, totipotencia la cual establece que cada célula viva de un organismo multicelular es totipotente y está en capacidad de desarrollarse y regenerarr una planta completa, completa siempre y cuando se les proporcionen las condiciones necesarias para su crecimiento (Montoya, 1991).. Muchas especies de plantas han desarrollado desarrollado diferentes métodos asexuales, asexuales incluyendo la embriogénesis somática (ES), para superar diversos factores ambientales y genétic genéticos que impiden la fertilización. Además, La ES puede ser práctica para todas las especies de plantas, siempre y cuando el explante sea competente y el medio de cultivo y las condiciones del medio ambiente empleadas sean an adecuadas (von ( Arnold, 2008).. 2.4 EMBRIOGÉNESIS SOMÁTICA (ES) 2.4.1 Generalidades Es una técnica biotecnológica de propagación de plantas que permite obtener embriones a partir de células somáticas (no sexuales) desde cualquier tipo de tejido, haciendo más eficiente la producción masiva de. 25.
(26) plantas in vitro,, debido a la naturaleza bipola bipolarr del embrión y sus altos coeficientes de multiplicación en períodos de tiempo cortos; cortos sus desventajas radican en el desconocimiento que existe sobre los parámetros que regulan este proceso, siendo aún limitado limitado el número de especies en las la cuales se reporta una ES eficiente efic y que permita el uso repetible del método para el beneficio biotecnológico (Barranco et al., 2003; Quiroz et al., 2006). 2006. La ES incluye diferentes fases: inducción, proliferación, maduración de los embriones somáticos (ESs), germinación y conversión en plántulas; pl cada una depende del genotipo de la planta progenitora, del tipo y del estado fisiológico del explante, explante de los reguladores de crecimiento y de las condiciones del cultivo, entre otros factores (Jiménez, Jiménez, 2001; González, 2003).. Existen dos tipos de ES in vitro:: directa e indirecta. La vía directa, involucra la formación de embriones somáticos (ESs) en un segmento del explante a partir de células embriogénicas pre-determinadas pre sin la formación formació previa de callos; puesto que las células dentro de un embrión cigótico son de por sí s embriogénicas, es posible inducirlas y posteriormente promover pro su división para formar ESs (Parrott, 2002).. La forma indirecta implica una fase intermedia de callo en la que las células cambian su competencia genética a la expresión embriogénica induciendo la formación de pro-embriones embriones al utilizar altas concentraciones de auxinas en el medio de cultivo, los cuales, posteriormente evolucionan a ESs al ser transferidos a un medio de cultivo con menores menores concentraciones de reguladores de crecimiento (von Arnold et al., 2002).. La ES indirecta puede ser de baja y de alta frecuencia; en la primera, aparecen ESs entre las 12 - 14 semanas de cultivo, aislados o en pequeños. 26.
(27) grupos que se desarrollan completamente compl pasando ndo por las diferentes etapas embriogénicas,, el número de callos con ESs es alto, aunque se forman pocos embriones por callo; en la segunda, los ESs aparecen entre las 16 - 20 semanas de cultivo, agrupados en un número mucho mayor, aunque aparecen ecen en una menor cantidad de callos (Artola, 2004).. Desde el punto de vista práctico, el proceso de la embriogénesis en medio sólido es muy laborioso, debido a la necesidad de realizar transferencias frecuentes a medios medio frescos. Mientras ientras que en medio líquido líq hay mayor disponibilidad de nutrientes, los metabolitos excretados por los tejidos se difunden mejor y se puede reemplazar por medios medio frescos con más facilidad; sin embargo, se pueden presentar problemas de aireación induciendo fenómenos de vitrificación vitrificac de los tejidos (Celestino et al., 2005).. La ES facilita la multiplicación vegetativa a gran escala, debido a la posibilidad de ampliar la propagación de embriones somáticos (ESs) mediante el uso de biorreactores; además, en la mayoría de los casos, los embriones pueden ser criopreservados, lo que permitiría permit establecer bancos de germopalsma (Gahan Gahan and George, 2008).. 2.4.2 Factores que afectan el cultivo de tejidos vía embriogénesis somática (ES) 2.4.2.1 Esterilización del material utilizado (Asepsia) ( Este aspecto está á relacionado con el material vegetal, medios nutritivos, recipientes de siembra siembra,, cuartos de incubación y herramientas con las que se lleva a cabo la manipulación y mantenimiento de los cultivos. Con la esterilización de los medios de cultivo se elimin eliminan an los micro-organismos micro presentes en las sustancias utilizadas para su preparación; este proceso por lo general se lleva a cabo en autoclaves, siendo menos frecuente el empleo. 27.
(28) de radiación y la filtración. El material vegetal puede ser contaminado por el medio nutritivo, la planta o el explante como tal, el ambiente del área de trabajo y el operador. La desinfección de los explantes se lleva a cabo utilizando sustancias químicas tales como: etanol (70%), hipoclorito de sodio o de calcio (20 - 30%), entre otros; la elección depende del tipo y origen del material vegetal utilizado (Rosell and Villalobos, 1990).. En el caso de las as especies de la familia A Amaryllidaceae, maryllidaceae, es necesario realizar un proceso exhaustivo de esterilización del material vegetal empleado para el establecimiento o de cultivos in vitro, puesto que se ven afectadas por insectos, hongos y bacterias que deterioran los bulbos bulbos,, hojas y flores de las plantas, producen deformación en el crecimiento,, estimulan la propagación de virus y causan daños e en el follaje por la succión de líquidos de la planta (Black, 2000).. Por ejemplo, las especies del género Amaryllis son atacadas por uno o más hongos, tales como Pythium spp., Sclerotium rolfsii y Stagonospora curtisii, curtisii que causan principalmente podredumbre en la raíz y el bulbo (Black, 2000). El hongo Stagonospora curtisii también afecta a las especies del género Narcisus produciendo lesiones en el bulbo, hojas, e inflorescencias (Pertuit, ( 1995).. En diferentes especies del género Crinum se ha observado una enfermedad inducida. por. el. hongo. Hyphomycetes. perteneciente. al. género. Pseudocercosporella Deighton, que puede producir la muerte m de toda la lámina foliar (Gutiérrez and Cabrera, 2007). 2007). En Crinum zeylanicum se han identificado varias especies de hongos (Cladosporium Cladosporium oxysporum oxysporum, Colletotrichum gloeosporioides, gloeosporioides C. dematium y Phoma sp.);; mientras que Crinum sp., es atacado por: Alternaria alternata, alternata. 28.
(29) Alternaria sp., A. tenuissima, tenuissima Cercospora sp.,C. C. longissima, longissima Cladosporium oxysporum, Colletotrichum dematium, dematium Memnoniella echinata, echinata Periconia byssoides y P. lateralis, lateralis produciendo generalmente manchas carmelitas en las puntas de las hojas, que avanzan hacia su interior interior y necrosan todo el tejido (Bonilla et al., 2003) 2003).. 2.4.2.2 Genotipo y estado de desarrollo del explante El desarrollo del cultivo in vitro depende considerablemente del tipo de material vegetal utilizado, utilizado puesto que existen notables diferencias entre las células y los diferentes tipos de órganos en cuanto a su capacidad regenerativa en el cultivo de tejidos in vitro; además, la potencialidad de la división celular y regeneración, entre plantas de una misma familia difiere notablemente (KrishnaRaj KrishnaRaj and Vasil, 1995).. El estado de desarrollo de la planta madre, la edad fisiológica del explante y el tamaño, son de gran influencia en el éxito del cultivo in vitro; se ha determinado que entre más pequeño sea el explante, menor es su capacidad de supervivencia, debido a que un número reducido de células totipotentes asumirían el crecimiento, aunque el riesgo de contaminación sería menor comparado con el de un explante de mayor tamaño. En general, se s tiende a utilizar material procedente de plantas jóvenes, debido a su alta capacidad regenerativa (Pérez, 1998).. 2.4.2.3 Medio de cultivo El medio de cultivo constituye constituye un elemento fundamental para el cultivo in vitro de células, tejidos, protoplastos, anteras y para lograr el desarrollo de embriones, la organogénesis, la micropropagación, etc. Existen E respuestas diferentes de las plantas a cada medio específico, lo cual pone de manifiesto los requisitos particulares nutricionales y hormonales de una especie vegetal. 29.
(30) determinada (González, 2001). Los minerales son esenciales para la vida de una planta y cumplen funciones específicas durante su desarrollo (tabla 1) (Kyte and Kleyn, 1996). 1996). Tabla 1. Algunos elementos importantes para la nutrición de plantas y su importancia fisiológica (Kyte and Kleyn, 1996). ELEMENTO Nitrógeno Potasio. Calcio. Magnesio Fósforo Azufre Cloro Hierro Manganeso Cobalto Cobre Zinc Molibdeno. IMPORTANCIA Componente de proteínas, ácidos nucléicos, aminoácidos, vitaminas y algunas coenzimas Regula el potencial osmótico, es el catión inorgánico principal Componente integral de la pared celular, participa en el control de la permeabilidad y facilita el movimiento de carbohidratos y aminoácidos a través de la planta. planta Modula la acción de todas las hormonas vegetales, regulando la germinación, el crecimiento y la senescencia. El calcio citoplasmático se une a proteínas receptoras (calmodulinas), que al ser activadas pueden modificar enzimas constitutivas Cofactor enzimático, componente de la clorofila Intervienen en la transferencia de energía, es componente de intermediarios en la respiración y fotosíntesis Presente en varios aminoácidos y algunos cofactores; promueve el desarrollo de raíces y follaje verde Estimula la fotosíntesis Participa en la conversión de energía durante la fotosíntesis Cofactor enzimático Componente de varias vitaminas, permite la fijación de nitrógeno Cofactor enzimático, interviene en reacciones de transferencia de electrones Cofactor enzimático, involucrado en la biosíntesis de la clorofila Cofactor enzimático, ayuda en la fijación de nitrógeno y su conversión a amonio. Los carbohidratos son utilizados como fuente de energía y como reguladores osmóticos; los más usados son: sacarosa, glucosa, maltosa, rafinosa, fructosa, sa, galactosa, manosa y lactosa; aunque se ha demostrado que la manosa osa al 3% inhibe la inducción de embriones somáticos (ESs) a partir de embriones cigóticos os inmaduros de plantas de paraíso paraí (Melia Melia azedarach L.), mientras que la glucosa favorece la formación de éstos (Vila la et al., 2003). 2003). 30.
(31) Para obtener un mejor crecimiento de los tejidos vegetales, es importante adicionar al medio de cultivo una o más vitaminas y aminoácidos; la tiamina (vitamina B1) ha sido catalogada como ingrediente esencial; otras vitaminas como: piridoxina xina (vitamina B6), ácido nicotínico (vitamina B3) e inositol (nutriente del complejo de la vitamina B), son empleadass para mejorar el crecimiento del material vegetal en condiciones in vitro;; glicina, arginina, asparagina, ácido aspártico, aspá alanina, ácido glutámico, mico, glutamina y prolina, son los aminoácidos más empleados. Además de los componentes antes mencionados,, es necesario adicionar una o más hormonas de crecimiento, como auxinas y citoquininas para inducir el crecimiento de los órganos y tejidos (Kyte and Kleyn, Kleyn 1996).. El medio de cultivo puede p ser líquido o tener un soporte sólido; sólido entre las sustancias más utilizadas para proporcionar el soporte sólido, se encuentra el agar, el cual forma un complejo coloidal con poder de retención iónica débil, pero ofrece una aireación insuficiente que puede afectar el crecimiento de algunos tejidos; sin embargo, su composición es variable y en ocasiones mal definida, por lo cual puede aportar oligoelementos que actúan favorablemente en el crecimiento de los explantes (González, 2001).. En algunos medios de cult cultivo ivo se añade carbón activado (0.5 – 5.0 g/L), por su capacidad de adsorción de sustancias inhibidoras del crecimiento excretadas por el explante o presentes en ell medio de cultivo, cultivo aunque también puede adsorber adsor los reguladores de crecimiento aportados al medio, afectando el desarrollo de la planta (González, 2001). El E medio basal se puede complementar omplementar con caseína caseína hidrolizada, agua de coco, bajos niveles de citoquininas,, etc., los cuales pueden mejorar jorar la eficiencia en la formación de callos embriogénicos y la regeneración de la planta (Krishna KrishnaRaj and Vasil, 1995).. 31.
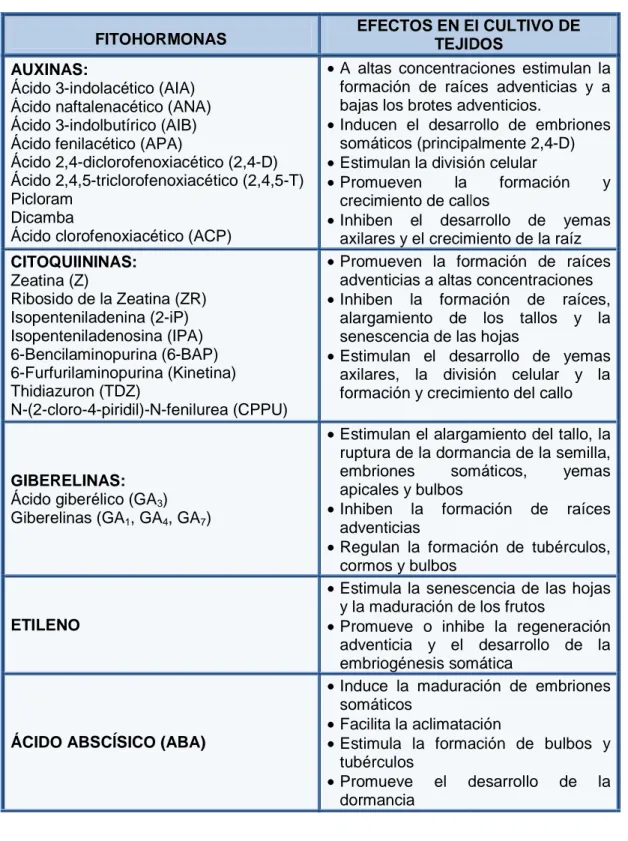
(32) 2.4.2.4 Luz, temperatura y humedad La temperatura influye directamente sobre la regulación del metabolismo primario o secundario de tejidos vegetales cultivados in vitro, vitro debido a que influye en el desarrollo de los procesos fisiológicos. Se debe tener en cuenta la relación entre esta variable y eventos como la morfogénesis, la concentración y la acción de los reguladores de crecimiento (Palomares et al., 2003).. Cada especie tiene un intervalo específico de temperatura en el cual se produce su desarrollo y crecimiento óptimo que puede variar en función del genotipo, del órgano donador del explante, de la época del año, de la edad y el estado fisiológico lógico de la planta donadora (Ángel et al., 2003). Por ejemplo, para especies bulbosas la temperatura sugerida es de 18ºC, 18ºC mientras que para las especies tropicales ésta se encuentra entre 28 - 29 °C (Palomares et al., 2003).. Se e ha observado que al cultivar tejidos a temperaturas bajas (0 - 5°C), aumentan los periodos de dormancia de algunas plantas, mientras que a temperaturas constantes comunes de los cuartos de cultivo (20°C), inducen los. procesos. morfogenéticos,. tales. como. la. organogénesis. y. la l. embriogénesis somática (ES) (Palomares et al., 2003).. 2.4.2.5 Reguladores de crecimiento Son hormonas que intervienen en la fisiología de la planta, modulan las funciones de multiplicación y elongación de las células, la floración y el crecimiento;; no obstante, obstante, cada una de ellas presenta diferentes efectos sobre el tejido vegetal cultivado (tabla 2). 2). 32.
(33) Tabla 2. Resumen de las principales fitohormonas empleadas en el cultivo de tejidos y sus principales efectos (González, 2001). FITOHORMONAS AUXINAS: Ácido 3-indolacético (AIA) Ácido naftalenacético (ANA) Ácido 3-indolbutírico (AIB) Ácido fenilacético (APA APA) Ácido 2,4-diclorofenoxiacético diclorofenoxiacético (2,4-D) Ácido 2,4,5-triclorofenoxiacético triclorofenoxiacético (2,4,5-T) Picloram Dicamba Ácido clorofenoxiacético (ACP). •. CITOQUIININAS: Zeatina (Z) Ribosido de la Zeatina (ZR) Isopenteniladenina (2-iP) (2 Isopenteniladenosina sopenteniladenosina (IPA) 6-Bencilaminopurina (6-BAP) 6-Furfurilaminopurina urfurilaminopurina (Kinetina) Thidiazuron (TDZ) N-(2-cloro-4-piridil)-N N-fenilurea (CPPU). •. • • • •. • •. EFECTOS EN El CULTIVO DE TEJIDOS A altas concentraciones estimulan la formación ormación de raíces adventicias y a bajas los brotes adventicios adventicios. Inducen el desarrollo de embriones somáticos (principalmente 2,4-D) 2,4 Estimulan la división ivisión celular Promueven la fformación y crecimiento de callos Inhiben el desarrollo de yemas axilares y el crecimiento de la raíz Promueven la formación ormación de raíces adventicias a altas concentraciones Inhiben la formación de raíces, alargamiento de los tallos y la senescencia de las s hojas Estimulan el desarrollo de yemas axilares, la división ivisión celular y la formación ormación y crecimiento del callo. • Estimulan el alargamiento del tallo, tallo la ruptura uptura de la dormancia de la semilla, embriones somáticos, yemas apicales y bulbos • Inhiben la formación de raíces adventicias • Regulan la formación de tubérculos, cormos y bulbos • Estimula la senescencia de las hojas y la maduración de los frutos • Promueve o inhibe la regeneración adventicia y el desarrollo de la embriogénesis somática • Induce la maduración aduración de embriones somáticos • Facilita la aclimatación • Estimula la formación ormación de bulbos y tubérculos • Promueve el desarrollo de la dormancia. GIBERELINAS: Ácido giberélico (GA3) Giberelinas (GA1, GA4, GA7). ETILENO. ÁCIDO ABSCÍSICO (ABA). 33.
(34) Continuación Tabla 2. FITOHORMONAS POLIAMINAS: Putrescina Espermidina Espermina ACIDO JASMÓNICO NICO (JA) Metiljasmonato (MeJa MeJa) BRASINOESTEROIDES: BRASINOESTEROIDES Análogos Biobras 6 Biobras 16 OLIGOSACARINAS: OLIGOSACARINAS Pectimorf: oligogalacturónido DPS (12(12 14). EFECTOS EN El CULTIVO DE TEJIDOS • Promueven la formación de raíces adventicias, la embriogénesis somática y la formación de brotes • Promueve la formación de bulbos y tubérculos • Estimula la formación de meristemos • Estimulan el desarrollo de callos de caña de azúcar • Favorecen la recuperación de callos sometidos a estrés • Estimulan el desarrollo de callos de caña de azúcar y de brotes en cítricos. vitro, los reguladores más importantes son las auxinas y las En el cultivo in vitro, citoquininas; es necesario un balance adecuado entre éstas en el medio de cultivo, para la formación de plántulas a partir de cualquier tejido vegetal. Dicho balance está determinado por las concentraciones ciones endógenas de auxinas y citoquininas presentes en el tejido, las cuales dependen de la especie, del tipo y naturaleza del explante. En la práctica no es posible establecer una concentración particular para ser utilizada con todas las especies, esto se e determina analizan analizando do la fisiología de cada planta (Pérez, 1998).. 2.4.2.5.1 Auxinas Generalmente estimulan o reprimen la expresión de los genes, producen elongación celular y expansión de los tejidos, división celular (formación de callo), formación de raíces adventicias y usualmente embriogénesis somática (ES) en los cultivos en suspensión. Las auxinas: auxinas ácido 3-indolacético indolacético (AIA), ácido naftalenacético (ANA), ácido 3-indolbutírico (AIB) o ácido 2,4diclorofenoxiacético (2,4 (2,4-D), se añaden frecuentemente a los medios. 34.
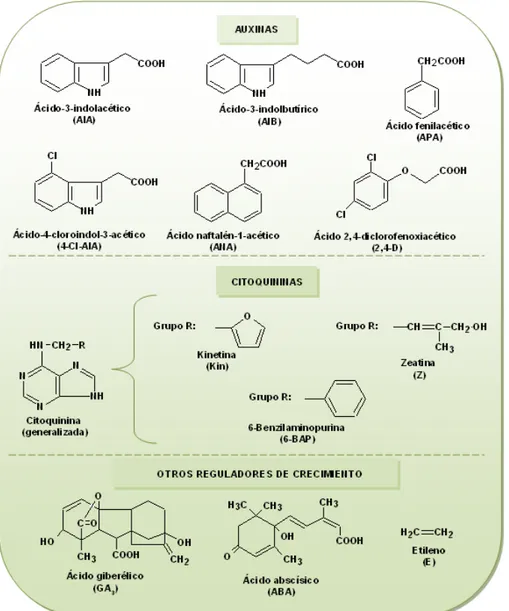
(35) nutritivos; el AIA se produce de forma natural en las plantas, pero las otras tres son sintéticas y relativamente más activas (figura 2).. La utilización del 2,4-D D es muy efectiva para la inducción y crecimiento de callos; call sin embargo, el uso prolongado de 2,4 2,4-D para algunas especies es problemático debido a la inducción de la variación somaclonal y/o una fase de callo extensa (von Arnold, 2008).. Figura 2. Estructuras de algunos algun reguladores de crecimiento (Soberón et al., 2005).. 35.
(36) Las auxinas naturales como el AIA se enlazan a un receptor de naturaleza proteica,, formando un complejo receptor - hormona de carácter reversible, específico, con alta afinidad y saturable; e este ste complejo activa un promotor que controla la expresión de los genes que codifican la síntesis de las enzimas que catalizan cataliza los compuestos de la pared celular. Durante la elongación celular inducida por la auxina se considera que actúan actúa por medio de un efecto rápido sobre el mecanismo de la bomba de protones p ATPasa (subconjunto de enzimas que producen la desfosforilación del ATP) en la membrana plasmática y un efecto secundario mediado por la síntesis de enzimas (Soberón et al., 2005).. Aunque las auxinas se encuentran en toda la planta, las las concentraciones más altas se localizan en las regiones meristemáticas,, siendo éste el sitio de síntesis.. Presentan fuerte polaridad debida a su transporte a través de la planta. La auxina es transportada por medio del parénquima que rodea los haces vasculares, sin penetrar en los tubos cribosos; su u movimiento es lento y basípeto, alejándose desde el punto apical de la planta planta hacia su base, aún en la raíz (requiere equiere energía energía).. Este flujo de auxina reprime el desarrollo de brotes axilares laterales a lo largo del tallo, manteniendo de esta forma la dominancia apical; las auxinas sintéticas, aplicadas en altas concentraciones, se trasladan por el floema, junto con los fotoasimilados ados (Soberón et al., 2005).. Se considera que las auxinas juegan un doble rol, en un caso donde el nivel endógeno de la auxina produce pr la polaridad de las masas embriogénicas indispensable para la inducción de la ES; mientras que las auxinas exógenas exógena pueden en difundirse dentro de las masas embriogénicas y cancelar dicha polaridad (Nomura and Komamine, 1995).. 36.
(37) 2.4.2.5.2 Citoquininas Son un grupo de fito-hormonas fito hormonas naturales particularmente abundantes en los granos, frutas y raíces; participan en la regulación de la división celular e intervienen al igual que las auxinas, auxinas en el crecimiento y el desarrollo de las plántulas. Promueven romueven la formación de yemas axiales, puesto que disminuyen la dominancia apical; están implicadas en la diferenciación de cloroplastos, el metabolismo de nutrientes y el retardo de la senescencia de las hojas (Werner et al., 2001).. Son producidas por los órganos en crecimiento y en los meristemos de la raíz. Se sintetizan a partir del isopentenil adenosina fosfato fosfato (derivado de la ruta del ácido mevalónico) que por perdida de un fosfato, la eliminación hidrolítica de la ribosa y oxidación de un protón origina la zeatina, una citoquinina nina natural que se encuentra en el maíz (Zea Zea mays L.) L. (Soberón et al., 2005).. Las citoquininas son derivados de la adenina, como la 6-bencilaminopurina 6 bencilaminopurina (6-BAP), BAP), algunas de estas hormonas se han encontrado en forma natural en las plantas y otras como la kinetina son sintéticas (figura 2) (Werner et al., 2001).. Como derivan de una purina se unen a la cromatina del núcleo, núcleo presentando un efecto fecto promotor en la transcripción y traducción del mensaje genético, estimulan stimulan el estado de transición del estado G2 en la mitosis mitosis, actúan en la traducción del ARN e incrementan ncrementan la rapidez de síntesis sínte de proteínas (Soberón et al., 2005) 2005).. El papel de las citoquininas no es claro en la inducción de embriones somáticos (ESs),, aunque normalmente el medio de cultivo incluye una de ellas, mientras que su presencia en el medio de proliferación podría. 37.
(38) promover la división celular. Su incorporación al medio de cultivo durante la histodiferenciación compensa el efecto negativo induc inducido ido por las auxinas sobre el desarrollo de los meristemos y suelen ser esenciales para la maduración y germinación de los ESs (Merkle et al., 1995).. 2.4.3 Aspectos morfológicos y fisiológicos de la embriogénesis somática (ES) y de los embriones somáticos (ESs) Las células embriogénicas se desarrollan sólo cuando se modifican las condiciones de cultivo; generalmente, general se forman al reducir las cantidades de auxina y citoquinina o al eliminar la auxina; estos tejidos evolucionan hasta constituir masas conocidas com como: masas pro-embriogénicas embriogénicas o callos embriogénicos (Halperin Halperin, 1995; Jiménez, 2001).. El callo embriogénico se caracteriza porque sus células son poco voluminosas, tienen gran cantidad de ribosomas, compuestas por un citoplasma muy pequeño no vacuolado, vacu un nucleolo olo agrandado, agrandado con alto contenido de almidón y lípidos; en general, general se agrupan variando en tamaño y número y su desarrollo no está sincronizado. Estas células son capaces de dividirse o de transformarse en embriones somáticos (ESs) según las condiciones del medio de cultivo. cultivo Un callo embriogénico puede ser compacto, organizado, generalmente de color blanco y de crecimiento lento (Yeung, 1995).. Desde el punto de vista de ssu origen,, los callos embriogénicos pueden ser unicelulares o pluricelulares; pluricelular en el caso de iniciarse a partir de una célula, las células embriogénicas se aíslan unas de otras por una modificación importante en su pared celular, en particular por la gelificación de la laminilla media; dicha célula, rodeada por un polisacárido polisacárido mucilaginoso, sufre divisiones polarizadas formando un embrión globular (embrión somático), somático) en donde pueden diferenciarse deposiciones de almidón en una etapa previa a. 38.
(39) su polarización; posteriormente, posteriormente ocurre la formación de la epidermis y adquiere re simetría bilateral; sucesivamente se observa el crecimiento de uno o más cotiledones, el desarrollo de los tejidos provasculares, la iniciación de los ápices radicales y del de tallo y una acumulación progresiva de sustancias del tipo almidón, lípidos y proteínas pr (Radice, 2004). Los ESs son estructuras bipolares con un eje radical – apical (raíz y brote); los cuales se constituyen constituy en nuevos individuos capaces de originar una planta completa, con autonomía frente al tejido generador; histológicamente se considera que no tienen tiene conexión vascular con el tejido que les le dio origen, por lo que pueden ser separados de éste ést (Barranco, 2003)... Contrariamente a los embriones cigóticos, los ESs no son el producto de la fusión de gametos y poseen la misma combinación genética de la planta fuente del explante. Pueden ser obtenidos mediante la ES a partir de explantes provenientes de varios tejidos como hojas jóvenes o inmaduras e inflorescencias; la respuesta del explante frente a la ES está determinada por su competencia embriogénica, su edad y por la concentración de los reguladores de crecimiento empleados. Se ha establecido o una correlación fuerte entre el estado de desarrollo del explante inicial y la concentración de 2,4-D D en el proceso de inducción y desarrollo de ESs (Kallerhoff and Alibert, 2003).. Durante la formación de un ESs vía ES, ocurre una serie de eventos fuertemente influenciados influenciad por los reguladores de crecimiento presentes en el medio de cultivo. Inicialmente, p por la presencia de auxina en el medio, la célula competente aislada forma los agregados celulares ulares embriogénicos por divisiones continuas, continuas los cuales ganan competencia embriogénica para el desarrollo de ESs cuando la auxina se elimina del medio, dando lugar al estado 1 del agregado celula celular (fase 0). A continuación, al transferir los. 39.
(40) agregados celulares en estado 1 a un medio libre de auxina; éstos proliferan lentamente y aparentemente sin diferenciación (fase 1); posteriormente, posteriormente ocurre curre una división celular rápida en ciertas partes del agregado agregado, producto de la polarización por la síntesis de ADN, originando el embrión globular y un suspensor en la zona en que no ocurrió división (fase 2). 2) Finalmente, continúa el desarrollo del embrión pasando por diferentes etapas de desarrollo embrionario: globular, escutelar y coleoptilar (en el caso de especies monocotiledóneas) (Rybczynski and Mikula, 2006), 2006) hasta formar plántulas con las mismas características de la planta fuente del explante (fase 3) (Pérez, 1998; 1998 Jiménez, 2001).. 2.4.4 Etapas de la embriogénesis embriogén somática indirecta (ESI) (ES 2.4.4.1 Inducción y cultivo de callos Esta etapa es necesaria al desarrollar desarro una ESI, en la que se inducen embriones somáticos (ESs) a partir de callos. Un callo es el crecimiento desorganizado de diferentes tipos de células que conservan la capacidad de dividirse y son obtenidas a partir de un tejido determinado; determinado su formación comienza con el aislamiento de órganos o tejidos diferenciados, los cuales posteriormente desdiferencian ante la presencia de auxinas auxina exógenas en el medio de e cultivo. En las células se presenta proliferación continua, acelerad acelerada y de apariencia desorganizada desorganizada, la cual da origen a una masa amorfa de tejidos; de manera general, cualquier tipo de órgano (raíz, tallo, hoja, flor, etc.) o tejido puede ser utilizado como material inicial para la inducción de callos (Perez, 1998).. Desde el punto de vista morfogénico lo más importante del callo es la totipotencia de sus células, puesto que con un manejo adecuado de las condiciones nutricionales, hormonales y ambiental ambientales, puede adquirir la capacidad. de. desarrollar. brotes,. 40. raíces. y. ESs. dependiendo.
Figure


Outline
Documento similar
Para recibir todos los números de referencia en un solo correo electrónico, es necesario que las solicitudes estén cumplimentadas y sean todos los datos válidos, incluido el
Entre nosotros anda un escritor de cosas de filología, paisano de Costa, que no deja de tener ingenio y garbo; pero cuyas obras tienen de todo menos de ciencia, y aun
Ciaurriz quien, durante su primer arlo de estancia en Loyola 40 , catalogó sus fondos siguiendo la división previa a la que nos hemos referido; y si esta labor fue de
Se partió de la hipótesis de que la formación de embriones somáticos en explantes de embriones cigóticos inmaduros de cocotero es promovida por el uso de ácido abscísico
Figura 1. Embriogénesis somática indirecta en C. A) formación de embriones somáticos a partir de callos embriogénicos, B) embriones somáticos en etapa globular, C) embriones
Las manifestaciones musicales y su organización institucional a lo largo de los siglos XVI al XVIII son aspectos poco conocidos de la cultura alicantina. Analizar el alcance y
Este acercamiento entre Roma y la Gran Bretaña lo atribuía Azara al Padre Ricci, general de los jesuítas (1758-73), quien, siempre ateniéndonos al juicio del agente, había
En la parte central de la línea, entre los planes de gobierno o dirección política, en el extremo izquierdo, y los planes reguladores del uso del suelo (urbanísticos y