FACULTAD DEAGRONÓMIA
ESCUELA DE FORMACION PROFESIONAL DE AGRONOMÍA
“PROPAGACIÓN BOTANICA DE
Annona muricata L.
“Guanabana” BAJO CUATRO SUSTRATOS EN IQUITOS -
PERÚ”
T E S I S
Para Optar el Título Profesional de
INGENIERO AGRONOMO
Presentado por
HILDA SOPLIN TRIGOSO
Bachiller en Ciencias Agronómicas
Iquitos – Perú
UNIVERSIDAD NACIONAL DE LA AMAZONIA PERUANA FACULTAD DE AGRONOMIA
TESIS APROBADA EN SUSTENTACION PÚBLICA, EL DIA 14 DE FEBRERO DEL 2015, POR EL JURADO AD-HOC NOMBRADO POR LA ESCUELA DE FORMACION PROFESIONAL DE AGRONOMIA, PARA OPTAR EL TITULO DE:
INGENIERO AGRONOMO
JURADOS:
___________________________________________ Ing. JOSÉ FRANCISCO RAMIREZ CHUNG, M.Sc.
PRESIDENTE
___________________________________________ Ing. JULIO ABEL MANRIQUE DEL AGUILA, M.Sc.
MIEMBRO
___________________________________________ Ing. MANUEL CALIXTO AVILA FUCUS
MIEMBRO
__________________________________________ Ing. RONALD YALTA VEGA, M.Sc.
ASESOR
__________________________________________ Ing. JUAN IMERIO URRELO CORREA, M.Sc.
A mi amado hijo, Diego Ysaac tu afecto y tu cariño son la razón que me levanta cada día para esforzarme por el presente y el mañana. Aun a tu corta edad, me has enseñado y me sigues enseñando muchas cosas de la vida fuiste mi motivación más grande para concluir este proyecto de tesis. Gracias Hijo.
A mis queridos padres, Roberto y Esther, por haberme dado la vida, apoyado y criado de la mejor manera posible, a ellos mi eterna gratitud.
AGRADECIMIENTO
El presente Trabajo de Investigación, no hubiera sido realizarlo sin el apoyo brindado por personas e instituciones que contribuyeron de una u otra manera la culminación y publicación correspondiente.
A DIOS por darme la vida y haberme permitido llegar hasta la culminación del presente Trabajode Tesis.
Un agradecimiento especial al Ing. Jorge Ysaac Villacrés Vallejo, por su apoyo incondicional einvalorable en el desarrollo de la investigación.
A los Docentes de la Facultad de Agronomía que en este andar por la vida, influyeron con susconocimientos y experiencias en mi formación profesional, a todos y a cada uno de ellos.
Al Instituto de Medicina Tradicional – ESSALUD (IMET), por haberme dado las facilidades de susINDICE DE CUADROS ... 07
INDICE DE GRAFICOS ... 08
INDICE DE CUADROS DEL ANEXO ... 08
INDICE DE IMÁGENES DE ANEXO ... 09
INTRODUCCION ... 10
CAPITULOI: PLANTEAMIENTO DEL PROBLEMA ... 11
1.1 PROBLEMA, HIPÓTESIS Y VARIABLES ... 11
1.1.1. Problema ... 11
1.1.2. Hipótesis ... 11
1.1.2.1 Hipótesis general ... 11
1.1.2.2 Hipótesis especificas ... 12
1.1.3 Variables ... 12
1.1.3.1 Variables dependiente... 12
1.1.3.2 Variables independiente ... 12
1.2 OBJETIVOS DE LA INVESTIGACIÓN ... 13
1.2.1 Objetivo general ... 13
1.2.2 Objetivos específicos ... 13
1.3 JUSTIFICACIÓN E IMPORTANCIA ... 13
1.3.1 Justificación ... 13
1.3.2 Importancia ... 14
CAPITULO II: METODOLOGIA ... 15
2.1 MATERIALES Y METODOS ... 15
2.1.1 Materiales ... 15
2.1.2 Métodos ... 17
2.1.3 Características del Área Experimental ... 18
2.1.4 De la conducción del experimento ... 19
CAPITULO III: REVISION DE LITERATURA... 24
3.1 MARCO TEÓRICO ... 24
3.1.1 Origen y Distribución Geográfica ... 24
3.1.2 Taxonomía ... 24
3.1.4 Valor Nutricional ... 27
3.1.5 Condiciones climáticas ... 28
3.1.6 Condiciones del suelo ... 28
3.1.7 Propagación ... 28
CAPITULO IV: ANÁLISIS Y PRESENTACIÓN DE LOS RESULTADOS ... 48
4.1 DE LOS SUSTRATOS EN ESTUDIO... 48
4.1.1 Suelo agrícola ... 48
4.1.2 Suelo agrícola + gallinaza ... 49
4.1.3 Tierra negra ... 50
4.1.4 Tierra negra + gallinaza ... 50
4.2 SOBRE LAS VARIABLES EN ESTUDIO ... 51
4.2.1 Porcentaje de germinación ... 51
4.2.2 Altura de plantas (cm.) ... 53
4.2.8 Peso fresco promedio de raíces (gr.) de plántulas de guanábana ... 62
4.2.9 Peso seco promedio de raíces (gr.) ... 64
CAPÍTULO V. DISCUSION ... 66
5.1 PORCENTAJE DE GERMINACIÓN ... 66
5.2 ALTURA DE PLANTA (cm) ... 67
5.3 NÚMERO DE HOJAS/PLANTA ... 68
5.4 PESO FRESCO PROMEDIO DE HOJAS ... 68
5.5 PESO SECO PROMEDIO DE HOJAS ... 69
5.6 PESO FRESCO PROMEDIO DE TALLOS ... 69
5.7 PESO SECO PROMEDIO DE TALLOS ... 70
6.2 RECOMENDACIONES ... 72
BIBLIOGRAFIAS ... 73
ANEXOS ... 77
INDICE DE CUADROS
Pág. Cuadro Nº 01. Aleatorización de los tratamientos ... 17Cuadro Nº 02. Clave, descripción y tratamientos ... 18
Cuadro Nº 03. Análisis de varianza ... 18
Cuadro Nº 04. Taxonomía del cultivo de Annona muricata L. “guanábana” ... 25
Cuadro Nº 05. Composición nutricional del fruto de guanábana/100 gr de fruta fresca ... 27
Cuadro Nº 06. Propiedades medicinales de la graviola demostradas con pruebas de laboratorio ... 38
Cuadro Nº 07. Análisis de varianza del porcentaje de germinación de guanábana ... 52
Cuadro Nº 08. Prueba de DUNCAN del porcentaje de germinación de semillas de guanábana ... 52
Cuadro Nº 09. Análisis de varianza de la altura promedio de plántulas (cm.) de guanábana ... 53
Cuadro Nº 10. Prueba de DUNCAN de altura promedio de plántulas (cm.) de guanábana ... 54
Cuadro Nº 11. Análisis de varianza del N° de hojas promedio en plántulas de guanábana ... 55
Cuadro Nº 12. Prueba de DUNCAN de N° de hojas promedio en plántulas de guanábana ... 55
Cuadro Nº 13. Análisis de varianza del peso fresco promedio de hojas (gr.) de plántulas guanábana ... 56
Cuadro Nº 14. Prueba de DUNCAN del peso fresco (gr) promedio de hojas de plántulas de guanábana ... 57
Cuadro Nº 15. Análisis de varianza del peso seco promedio de hojas(gr.) de plántulas de guanábana ... 58
Cuadro Nº 16. Prueba de DUNCAN del peso seco promedio de hojas gr de plántulas de guanábana ... 58
Cuadro Nº 17. Análisis de varianza del peso fresco de tallos de plántulas de guanábana ... 59
Cuadro Nº 19. Análisis de varianza del peso promedio de tallos (gr.) en plántulas de
guanábana ... 61
Cuadro Nº 20. Prueba de DUNCAN del peso promedio de tallos de plántulas de guanábana ... 61
Cuadro Nº 21. Análisis de varianza del peso fresco promedio de raíces de plántulas de guanábana ... 62
Cuadro Nº 22. Prueba de DUNCAN del peso fresco promedio de raíces (gr.) ... 63
Cuadro Nº 23. Peso seco promedio de raíces (gr.) de plántulas guanábana ... 64
Cuadro Nº 24. Prueba de DUNCAN del peso seco promedio de raíces (gr.) de plántulas de guanábana ... 64
INDICE DE GRAFICOS
Pág. Grafico Nº 01 Histograma del porcentaje de germinación de semillas de guanábana... 53Grafico Nº 02 Histograma de altura promedio de plántulas (cm.) ... 54
Grafico Nº 03 Histograma del número de hojas/planta ... 56
Grafico Nº 04 Histograma del peso fresco promedio hojas (gr.) ... 57
Grafico Nº 05 Histograma del peso seco promedio hojas (gr.) ... 59
Grafico Nº 06 Histograma del peso fresco promedio tallos (gr.) ... 60
Grafico Nº 07 Histograma del peso seco promedio tallos (gr.) ... 62
Grafico Nº 08 Histograma del peso fresco promedio raíces (gr.) ... 63
Grafico Nº 09 Histograma del peso seco promedio raíces (gr.) ... 65
INDICE DE CUADROS DE ANEXOS
Pág. Cuadro Nº 25: Datos climatológicos mensuales en el periodo experimental ... 79Cuadro Nº 26: Análisis de caracterización del suelo del área experimental ... 80
Cuadro Nº 27: Composición química de la gallinaza ... 81
Cuadro Nº 28: Croquis del experimento ... 82
Cuadro Nº 29: Distribución de las plantula en macetas ... 83
Cuadro Nº 30: Datos originales del % de germinación de semillas de guanábana ... 84
Cuadro Nº 35: Datos originales del peso fresco promedio de hojas en el cultivo de guanábana 85
Cuadro Nº 36: Datos originales del peso seco promedio de hojas en el cultivo de guanábana ... 85
Cuadro Nº 37: Datos originales del peso fresco promedio de tallos en el cultivo de guanábana ... 86
Cuadro Nº 38: Datos originales del peso fresco promedio de tallos en el cultivo de guanábana ... 86
Cuadro Nº 39: Datos originales del peso fresco promedio de raíces en el cultivo de guanábana . 86 Cuadro Nº 40: Datos originales del peso seco promedio de raices en el cultivo de guanábana .... 87
Cuadro Nº 41: Prueba de homogeneidad de LAVENE (MODIFICADO) ... 87
Cuadro Nº 42: Prueba de normalidad LAVENE (MODIFICADO) ... 88
INDICE DE IMAGENES DE ANEXOS
Pág. Imagen 01: Recolección del fruto de Guanábana. ... 89Imagen 02: Obtención de las semillas a partir del fruto ... 89
Imagen 03: Semillas limpias de Annona muricata L. ... 90
Imagen 04: Distribución de los tratamientos para las pruebas de germinación ... 90
Imagen 05: Siembra de semillas de Annona muricata. ... 91
Imagen 06: Germinación epigea de semillas Annona muricata. ... 91
Imagen 07: Formación de las primeras hojas de Annona muricata ... 92
Imagen 08: Distribución de plántulas en diferentes tratamientos ... 92
Imagen 09: Distyribución de los cuatro tratamientos ... 93
Imagen 10: Evaluación final de de las plántulas de Annona muricata L ... 93
Imagen 11: Tratamiento tierra negra mostrando mejor desarrollo ... 94
Imagen 12: Toma de datos del peso de tallos ... 94
Imagen 13: Toma de datos del peso de hojas ... 95
INTRODUCCION
En nuestra zona la especie Annona muricata L. “guanábana”, es muy popular por presentar frutos para consumo en fresco, así como para preparar refrescos, helados entre otros. Esta pulpa según el análisis químico y bromatológico indica que es una fuente razonable de carbohidratos, calcio, fósforo y vitamina C, FLORES (1997). También sus hojas poseen propiedades medicinales cuya principal cualidad es la capacidad que posee para eliminar las células cancerígenas, sin causar daño al resto de células sanas, hecho que sitúa su potencial, como tratamiento alternativo ante el cáncer.
Sin embargo su producción y rendimiento se muestra restringido debido: Baja productividad por limitaciones naturales en la polinización; alta susceptibilidad al ataque de plagas y enfermedades; fragilidad del fruto maduro al manipuleo de cosecha y de transporte y perecibilidad del fruto, FLORES (1997).
CAPITULO I
PLANTEAMIENTO DEL PROBLEMA
1.1 PROBLEMA, HIPOTESIS Y VARIABLES
1.1.1 Problema
En Amazonia Peruana existe desconocimiento de aspectos agronómicos básicos de diversas especies frutales, por ello desde hace mucho tiempo se viene poniendo en práctica muchas técnicas, métodos de germinación y propagación de plántulas de especies especialmente perennes para su aprovechamiento, debido fundamentalmente a la variabilidad de ecosistemas, variabilidad genética de las especies, el origen del material vegetal, los volúmenes y disponibilidad de materia prima; está restringiendo las oportunidades para el desarrollo de diversas actividades de producción y de trabajos de investigación en diversas áreas, dificultando de esta manera el desarrollo sostenible de nuestro potencial de la agro biodiversidad amazónica.
En los viveros frutícolas para la especie Annona muricata L. “Guanábana”, existe una serie de dificultades en la germinación, viabilidad, crecimiento, entre otros aspectos que no permiten la producción rápida de plantas de calidad, por lo que no se puede garantizar el establecimiento de plantaciones perennes a mediana y gran escala.
Estos aspectos nos han permitido plantear la realización de este trabajo de investigación, con el fin de poder determinar el efecto de diversos sustratos en la germinación y crecimiento inicial, entre otras variables en la propagación de botánica de Annona muricata L.
1.1.2 Hipótesis
1.1.2.1 Hipótesis General
[12]
1.1.2.2 Hipótesis Específicas
Al menos un sustrato tiene influencia en la germinación de Annona muricata “guanábana”.
Al menos un sustrato tiene influencia en el desarrollo inicial de Annona muricata “guanábana”.
1.1.3 Variables
1.1.3.1 Identificación de Variables
a. Variables independientes (X)
X Sustratos.
b. Variables dependientes (Y) Explicada Y1 Germinación.
Y2 Crecimiento inicial de la guanábana.
1.1.3.2 Operacionalidad de las variables
Indicadores:
Parámetros de crecimiento en el desarrollo inicial Y 2, 1: Altura de planta.
1.2 OBJETIVOS DE LA INVESTIGACION
1.2.1 Objetivo General
Evaluar la germinación y crecimiento inicial de la Annona muricata “guanábana” bajo
la influencia de cuatro sustratos.
1.2.2 Objetivos Específicos
Evaluar los parámetros de germinación en la Annona muricata “guanábana”.
Evaluar el crecimiento inicial de Annona muricata “guanábana”.
1.3 JUSTIFICACIÓN E IMPORTANCIA
1.3.1 Justificación
[14]
Con los resultados que se obtuvieron en este ensayo específicamente, se está contribuyendo en la producción de conocimientos básicos de sustratos, que por ser de origen orgánico, pueden inducir y/o facilitar la germinación, mejorar la energía germinativa e incrementar el crecimiento de las plantas a nivel de vivero en el cultivo de Annona muricata L. “Guanábana”.
Asimismo servirá como antecedente importante para posteriores investigaciones en el crecimiento, producción y productividad en el cultivo de Annona muricata L. “guanábana” por cuanto la información existente es insuficiente en la actualidad, razón por la cual asumimos el reto de estudiar cuatro (04) insumos orgánicos que son fáciles de encontrar en la zona y ver su efecto como sustratos a nivel de vivero.
1.3.2 Importancia
En este cultivo la obtención de plantas de calidad considerando un tamaño uniforme, buen número de hojas y un diámetro adecuado que soporten condiciones adversas al ser llevadas a campo definitivo, se inicia con un adecuado manejo a nivel de vivero sometiendo a las semillas botánicas a condiciones ideales de germinación, es decir sustratos que les proporcionen humedad, oxígeno, pH adecuado, y otros aspectos químicos y biológicos adecuados, por eso es de vital importancia solucionar estos problemas desde la etapa inicial de vivero.
CAPITULO II
METODOLOGIA
2.1 MATERIALES Y METODOS
2.1.1 Materiales
a. Herramientas de trabajo
- Wincha - Carretilla - Palas
- Bolsas almacigueras
b. Insumos
- Tierra negra - Suelo agrícola - Gallinaza - Semillas - Benomil al 0.1%
c. Ubicación del campo experimental
El presente trabajo se realizó en el vivero del Instituto de Medicina Tradicional (IMET) ESSALUD, ubicado en el Pasaje San Lorenzo Nº 205 Distrito de San Juan, según el Instituto Nacional Geográfico, dicho terreno se encuentra ubicado a una altitud de 122.4 msnm, la misma que está ubicada en las siguientes coordenadas geográficas: Latitud : 03° 47° 12” S
[16]
d. Características medio ambiente
SENAMHI. La precipitación anual varía entre 2,400 y 3,400 mm, en verano alcanza 200 a 350 mm por mes (de Julio a Octubre) y en “invierno” (épocas de lluvias entre Diciembre y Marzo) con 150 a 350 mm por mes; no existiendo una estación seca definida. El clima es relativamente uniforme, con temperatura medias anual entre 25º y 27ºC, y con bruscos descensos en los días de friaje de San Juan (Junio – Julio) y de Santa Rosa (Agosto - Setiembre). La variación diaria es menor de 8 – 10ºC y la diferencia entre la temperatura diurna y nocturna es mayor que la de verano (Marzo, 25ºC) y la de “invierno” (Setiembre – Diciembre, 27.4ºC – 26.9ºC).
e. Material experimental
El material en estudio es el cultivo de Annona muricata L. “Guanábana”.
e.1 Características agronómicas de la especie:
Forma de los frutos: ovoide o elipsoidal
Tamaño promedio del fruto: 15-20 cm de largo y de 10-12 cm de diámetro.
Color del fruto: Verde oscuro.
Forma de semilla: Oblonga.
Color de semilla: Marrón.
Procedencia: Fundo “La coruña” – Distrito San Juan Bautista.
f. Materiales para sustrato
Los sustratos utilizados en el trabajo experimental fueron los siguientes:
f.2. Suelo agrícola + gallinaza (3:1), procedente del jardín botánico del Instituto de Medicina Tradicional (IMET) - Essalud.
f.3. Tierra negra, procedente del jardín botánico del Instituto de Medicina Tradicional (IMET) - Essalud.
f.4. Tierra negra + gallinaza (3:1), procedente del jardín botánico del Instituto de Medicina Tradicional (IMET) - Essalud.
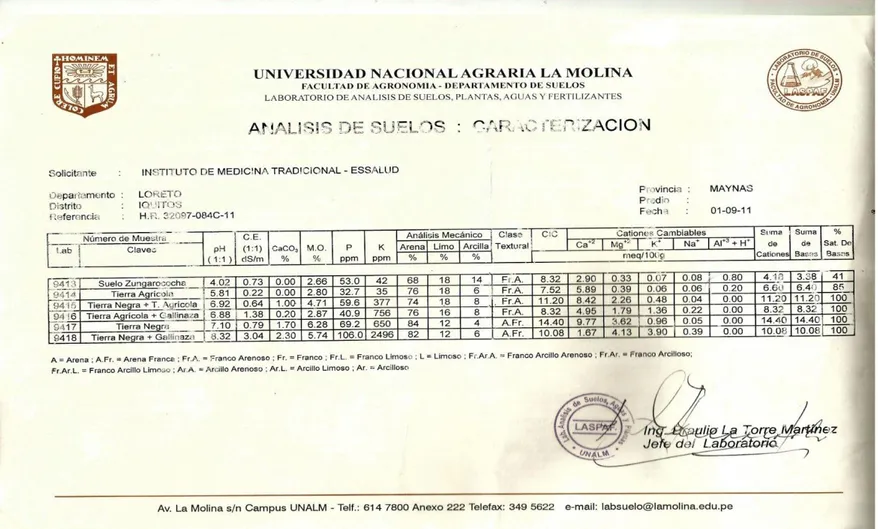
El suelo y los diversos sustratos usados en el experimento fueron analizados en el laboratorio de Análisis de suelos de la Universidad Nacional Agraria “La Molina”.
2.1.2 Métodos
a. Tipo de investigación: Experimental. b. Diseño experimental
A nivel de germinación y crecimiento el Diseño utilizado fue Completo al Azar (DCA) con cuatro tratamientos y tres repeticiones, teniendo en cuenta que la mayoría de factores estarán controlados.
CUADRO N° 01. ALEATORIZACIÓN DE LOS TRATAMIENTOS
[18]
c. Tratamientos estudiados
CUADRO N° 02. CLAVE, DESCRIPCIÓN Y TRATAMIENTOS
d. Estadística empleada
d.1 Estadística descriptiva
Se calculó las medias de los tratamientos y en función a cada uno de los indicadores de las variables independiente y dependiente y la elaboración de los gráficos para representar los resultados obtenidos para su mejor interpretación. Las fuentes de variabilidad con la que se analizó los resultados obtenidos fueron los siguientes:
CUADRO N° 03. ANÁLISIS DE VARIANZA
F.V Grados de libertad
2.1.3 Características del Área Experimental
a.2. De los tratamientos para evaluar germinación a.3. De los tratamientos para desarrollo inicial
- N° Tratamientos 4 - N° repeticiones 5 - N° macetas por Tratamiento 20 - N° macetas por repetición 60 - N° total de bolsas 240 a.4. Croquis del campo experimental y del vivero
El croquis del campo experimental se detalla en el Cuadro N° 28.
2.1.4 De la conducción del experimento
El presente trabajo se instaló en setiembre del 2012 en las instalaciones del vivero del (IMET), Instituto de Medicina
Tradicional-ESSALUD. Cuyas actividades realizadas fueron las siguientes.
a. Instalación del vivero
[20]
a.1 Obtención de semillas del material experimental
Los frutos de Annona muricata L. “Guanábana” fueron recolectadas en el Fundo La Coruña, ubicada en la carretera Iquitos -Santa Clara, en el distrito de San Juan Bautista, provincia de Maynas, departamento de Loreto. Para la extracción de las semillas se tuvo en cuenta lo siguiente:
Se seleccionó frutos maduros de plantas selectas de guanábana, siendo éstos de tamaño uniforme y maduro. Se despulpo la fruta manualmente, partiéndolas por la mitad y se separó las semillas en un recipiente. Seguidamente se dejó fermentar las semillas por 24 horas, luego se lavó con abundante agua.
Las semillas libre de mucilagos se colocó esparcidas en una bandeja de plástico para el respectivo secado a temperatura ambiente por espacio de tres días.
Las semillas limpias y secas fueron colocadas en un recipiente herméticamente cerrado.
a.2. Bandejas germinadoras de Plástico
a.3. Preparación de los Sustratos:
Los sustratos que se usaron fueron: Suelo agrícola, Tierra negra, Suelo agrícola + gallinaza (3:1) y Tierra negra + gallinaza (3:1), todos éstos materiales fueron respectivamente tamizados antes de ser llenados tanto a las bandejas como las macetas plásticas y luego se identificaron con un cartel cada uno de los tratamientos.
a.4. Análisis de sustrato
De cada sustrato se tomó 4 muestras de 500 gramos de cada uno, luego secado, envasado y enviado al laboratorio de suelos de la Universidad Nacional Agraria La Molina en el Cuadro N° 26.
a.5. Riego
Consistió en aplicar agua sobre las bandejas y macetas con las semillas y plántulas respectivamente por un periodo de 4 meses luego del trasplante.
a.6. Control fitosanitario
Las semillas fueron desinfestadas con una aplicación de Benomil al 0.1 % en inmersión por 5 minutos y luego oreadas por una hora y luego sembradas en los diversos sustratos.
a.7. Evaluaciones iniciales
[22]
a.8 Evaluación final del experimento:
Se registraron los datos hasta el 16 de marzo del 2013.
b. Variables evaluadas
b.1 Germinación
a. Porcentaje de germinación (%)
Se procedió a tomar los datos de las semillas germinadas cada día una vez iniciada la misma obteniendo el porcentaje de germinación, utilizando el método propuesto por PINEDO (1989), cuya fórmula es la siguiente:
%G = Semillas germinadas X 100
Fuente: PIDINICO, citado por DELGADO, 1996
b.2 Desarrollo Inicial:
Elección de las plantas
a. Altura de la planta: Comprendida desde el cuello de la planta hasta el ápice de la yema terminal.
b. Número de Hojas/Planta: Es el número total de hojas formadas y completas por planta.
c. Peso fresco: Se obtuvo de las plantas luego de su extracción de las bolsas de plástico, se consideró la parte foliar y sistema radicular.
CAPITULO III
REVISION DE LITERATURA
3.1 MARCO TEORICO
3.1.1 Origen y Distribución Geográfica
La guanábana es oriunda del Perú y se cultiva en la mayor parte de América tropical, en Colombia cuenta con pocas áreas sembradas, siendo muy escasos los cultivos tecnificados. Sin embargo, se puede mencionar cultivos en el Valle del cauca, Santander, Huila y en el Caribe colombiano. La Annona muricata, guanábana o graviola, es un árbol endémico del Caribe, México, Centro y Sudamérica, estrechamente relacionado con la chirimoya, Sierra (2010), en la selva peruana, se cultiva en los Departamentos de Loreto, San Martin y Ucayali, Flores (1997).
La zona de producción en el Perú es la Selva central de Chanchamayo. Su fruto se encuentra representado con frecuencia en la cerámica precolombina de la costa peruana, conforme lo testimonia la existencia de varias piezas de cerámica de la Cultura Chimú en la que está representada con exactitud. articulos.infojardin.com/.../guanabanas-guanabano-catuche-annona-muricata.
3.1.2 Taxonomía
[26]
c. La hoja
La guanábana posee hojas alternas y sin estípulas; lamina subcoracea, obovada, subovabada u oblongo elíptica de 5-18 cm de largo y 2-7 cm de ancho, márgenes enteros, ápice cortamente acuminados, base subcuneada, aguda u obusta; haz verde oscuro, brillante y glabro, envés verde amarillento y opaco, pinnatinerve; peciolo hasta 0.8 cm de largo, Flores (1996).
d. La flor
Las flores son bisexuales solitarias o en pares en tallitos cortos que brotan da las ramas viejas. Cáliz con 3 sépalos diminutos e inconspicuos de color verde. Corola con 6 pétalos amarillo pálido; 3 pétalos exteriores acorazonados, grandes, gruesos y 3 pélalos interiores más pequeños y más delgados. Estambres y ovarios numerosos, Flores (1996).
e. Frutos
El fruto es una baya colectiva o sin carpo, ampliamente ovoide o elipsoide, verde de 15-40 cm de largo en la base debido a la polinización deficiente, está recubierta por espinas suaves carnosas que miden de 0.3-0,5 cm de largo y están volteadas hacia el ápice; la cascara es delgada y coriácea y la pulpa es blanca, cremosa, carnosa, jugosa y subácida,Flores (1996).
e. Semillas
Heijden y Bouman, 1988; Grau et al, 1992, citados por Meza y Bautista, (2004).
refieren que las envolturas seminales son medianamente gruesas, con paredes fibrosas, resistentes y duras. El endospermo es blanquecino, de textura medianamente dura y ligeramente aceitoso; en la medida que éste se va desarrollando llena toda la cavidad seminal, tornándose ruminado de tipo espiniformes, cuyas ramificaciones penetran de adentro hacia fuera, el integumento interior.
f. Raíz
La raíz es pivotante con un anclaje ramificado y fuerte. El sistema radical es poco profundo y bastante fibroso. El mayor porcentaje de raíces, se encuentra en los primeros 30 cm de profundidad y están distribuidas alrededor del tronco tallo.
www.ecured.cu/index.php/Guanábana.
3.1.4 Valor Nutricional
Composición nutricional: 100 gramos de parte comestible tienen la siguiente composición:
CUADRO N° 05. COMPOSICIÓN NUTRICIONAL DEL FRUTO DE GUANÁBANA/ 100 gr DE FRUTA FRESCA.
[28]
3.1.5 Condiciones Climáticas
La guanábana se desarrolla bien entre los 500 y 1200 m.s.n.m. La temperatura ideal puede estar entre los 25-28°C. Se comporta muy bien en zonas donde la precipitación está entre los 800-1000 mm por año. La humedad relativa debe estar por encima del 80%.
La humedad relativa alta, aumenta la propensión a la Antracnosis. Una humedad relativa demasiado baja, dificulta la polinización, afectando, por esta vía, los niveles de producción.
articulos.infojardin.com/.../guanabanas-guanabano-catuche-annona-muri.
3.1.6 Condiciones de Suelo
Los suelos recomendados para la siembra de guanábana deben ser terrenos no inundables; es bastantes exigentes en suelos profundos, de textura franca, ligeramente ácidos, ricos en materia orgánica y de mediana a elevada fertilidad, Flores (1997).
3.1.7 Propagación
a. Sexual
Tacán (2007), estudio la caracterización e identificación de zonas de las dos especies, siendo para Annona muricata los meses de Abril y Mayo una época con mayor presencia de frutos y para Annona. cherimola los meses de Agosto y Septiembre.
Lobo et al (2007), estudiaron la latencia y germinación de semillas de guanábana y chirimoya con el fin de categorizar la latencia de las simientes y desarrollar un protocolo de rompimiento de ésta; No se detectó latencia exógena, a través de la imbibición obtenida por las semillas. Se encontró, a través de pruebas de viabilidad, con tetrazolio, que en cada uno de los taxa existe alrededor de un 20% de unidades no viables en el conjunto de semillas aparentemente normales. A partir de los resultados se clasificó el bloqueo de la germinación de las semillas de las dos especies, como latencia morfofisiológica simple, no profunda. La caracterización definida, junto con el protocolo de remoción, apoyan el establecimiento de un duplicado de seguridad de la colección de campo, por la vía de semilla, con un concepto dinámico que se esboza en este escrito.
Yamarteet al (2006), estudiaron las características de crecimiento vegetativo y reproductivo del guanábano. Las variables estudiadas fueron brotes vegetativos (BV), brotes florales (BFL) y épocas de ocurrencia estos. La ocurrencia de la brotación coincidió con las épocas de precipitación (Enero- Mayo, Julio-Diciembre). La ramificación es acrótona y el crecimiento es plagiotrópico.
[30]
remojo) iniciaron simultáneamente la emergencia a los 17, 66 d, mientras que la iniciación tardía ocurrió con el tratamiento de remojó en ácido sulfúrico a los 19,33 d, de 2 a 1 min diario. Los dos tratamientos de remojo en agua caliente a 90ºC, fueron letales para la semilla por cuanto no hubo germinación. La emergencia total promedio presentó diferencias significativas, variando su valor entre 77,33% para el tratamiento de escarificación en ácido sulfúrico durante 1 min y el remojo de agua de 24 h, mientras que el testigo mostró un 70,66%. La germinación y emergencia se caracterizó a lo largo de 6 estados secuenciales, por ser epígea y criptocotilar, por cuanto las envolturas seminales se levantan junto con los cotiledones al momento de la emergencia.
Hayat, 1963; Hayat y Canright, 1965; Finneseth et al., 1998, citados por Meza y
Bautista, (2004), indicaron que el embrión es relativamente pequeño en relación al tamaño de la semilla y ocupa sólo la quinta o sexta parte de la longitud de ésta, característica muy frecuente en la familia Annonaceae.
Flores (1999); refiere que la semilla es el sitio de parcial desarrollo del nuevo esporofito (embrión) y el lazo de unión entre generaciones sucesivas. Es además, la estructura que permite supervivencia y dispersión en condiciones ambientales, así como una subsiguiente germinación exitosa.
renueva continuamente mientras dura su actividad; Zonas de células más o menos jóvenes, que crecen por aumento de su tamaño y zona de células viejas, que ya no aumentan de tamaño.
Baskin (1998), reporto que la propagación por semilla de la guanábana resulta difícil y errática por cuanto la germinación y emergencia ocurre de manera desigual e irregular a la largo de un período de tiempo prolongado. Este patrón de germinación es atribuido a la presencia de latencia, mediante la cual, las semillas van a germinar bajo condiciones medioambientales óptimas, garantizándoles a las plántulas protección natural y mayores oportunidades de supervivencia.
Las envolturas seminales de las semillas de Annona muricata “guanábana” son medianamente gruesas, con paredes fibrosas, resistentes y duras. El endospermo es blanquecino, de textura medianamente dura y ligeramente aceitoso; en la medida que éste se va desarrollando llena toda la cavidad seminal, tornándose ruminado de tipo espiniformes, cuyas ramificaciones penetran de adentro hacia fuera, el integumento interior, Grau et al., 1992; Heijden y Bouman (1998).
Flores (1997), reporto que la propagación por semilla botánica, es el método corriente más utilizado. Las semillas procedentes de frutos maduros de plantas superiores, se lavan hasta eliminar todo residuo de la pulpa y se orean por 24 horas bajo sombra y se trata con fungicida. Se almacenan en ambiente fresco.
[32]
endospermo, y tejidos de endospermo. Se consideraron cuatro etapas de desarrollo de la semilla: muy tierna, tierna, juvenil y madura. Las porciones se realizaron de aproximadamente 5 m de espesor. Las porciones de las secciones transversales de la cubierta de la semilla mostraron la transversal y fibras oblicuas de este tejido, que constituye una capa impermeable en la semilla. Mediano longitudinales secciones mostraron la distribución del tejido rumiado y se observó el tapón micropilar y la cavidad hilio redondeado por el collarete. Esta cavidad es la única estructura que permite la difusión de agua a través de la semilla. Encontrándose que la cavidad hilio se comunica alendorpermo a través de pequeñas grietas que se forman por el tejido rumiado no vascular. El embrión en miniatura, que está integrado por el endospermo, está rodeado por el tejido rumiado. La composición química cualitativa del endospermo maduro mostró la distribución de las proteínas, almidón, lípidos y contenido de azúcar. Se detectó un alto contenido de lípidos en estas semillas (33%) utilizando el método de extracción soxlhet.
Rojas (1991), afirmaron que el inicio de la germinación, expresa el tiempo transcurrido entre la siembra y la germinación de la primera semilla. Para que la semilla inicie su germinación es necesario que haya superado cualquier barrera o bloqueo, sin lo cual por muy vivo que éste y por muy adecuado que este el ambiente, la germinación no se realizará.
que los valores de porcentaje de germinación deben indicar en elemento de tiempo, indicando el número de plantas producidas en un lapso específico.
Las semillas contienen el embrión y la sustancia de reserva, el embrión es una planta en miniatura en estado de vida latente, en el embrión pueden reconocerse algunas de las estructuras que van a dar lugar a las distintas partes de la planta adulta, así es posible encontrar a la plúmula o gémula que producirá las primeras hojas; la radícula que formará la raíz primaria y el talluelo que dará lugar al tallo de la planta. (http://www.porquebiotecnologia.com.ar/educacion/cuaderno/ec_109.asp?cuade
rno=109).
La germinación de las semillas tiene lugar cuando se da determinadas condiciones, en general es preciso disponer de un pH, texturas y estructuras adecuadas, oxígeno, humedad, temperatura e insolación y otros parámetros como la fertilización y drenaje adecuados. Cuando el embrión empieza a desarrollarse se alimenta de las reservas contenidas en los cotiledones, recibiendo el alimento después a través de las primeras hojas que produzca, éste embrión o planta incipiente se denomina plántula. http://www.natureduca.con/agro_reprod_semillas1.php.
Los factores que afectan a la germinación lo podemos dividir en Factores internos (intrínsecos); que son propios de la semilla, madurez y viabilidad de las semillas; y factores externos (extrínsecos); dependen del ambiente, agua, temperatura y gases. http://www.euita.upv.es/varios/biologia/temas/temas_17.htm.
[34]
reservas. A su vez la división y el alargamiento celular en el embrión provoca la rotura de las cubiertas seminales, que generalmente se produce por la emergencia de la radícula. http://www.euita.upv.es/varios/biologia/temas/temas_17.htm.
Se llama germinación al acto por el cual la semilla en estado de vida latente entra de pronto en actividad y origina una nueva planta. www.botanica.cnba.uba.ar/Trabprac/.../Lagerminacion.html.
b. Asexual
La propagación por injerto contempla la producción de los arbolitos patrones y las yemas. Las yemas se deben tomar de árboles con muy buena producción, tanto en cantidad como en calidad. Como patrón se puede utilizar cualquier tipo de anona de la zona o la misma guanábana. Los mayores porcentajes de prendimiento del injerto, se han obtenido mediante las técnicas de injerto de enchape lateral y el de yema.
3.1.8 Etapas fenológicas
3.1.9 Plagas
La guanábana (Annona muricata), es una fruta tropical con gran potencial económico, dado su valor comercial y la demanda en el mercado externo. En Costa Rica, en los últimos años, debido al incremento del área de producción técnica que se le ha dado al cultivo, varios insectos plagas han incrementado sus poblaciones, ocasionando una disminución del rendimiento y de la calidad de la fruta, Coto (2001).
a) La broca del fruto (Cerconota annonella)
Son mariposas que ovopositan sobre las flores y frutos, las larvas rosadas de 2 cm de longitud, perforan el fruto y se alimentan de la pulpa y de las semillas; los frutos se retuercen, ennegrecen y caen. Flores (1997).
b) La broca del tronco y las ramas (Cratosomus bombina)
Estos insectos ovopositan en troncos y ramas de hasta 2 cm de diámetro. Las larvas emergidas, penetran en la madera formando galerías y propiciando la exudación de savia ennegrecida. Empupa en cámaras que construyen las larvas. Flores (1997).
c) El perforador del fruto y la semilla (Bephrata maculicollis Cameron). Himenóptera, cuyas larvas se alimentan de las semillas. Flores (1997).
d) Mosca de la fruta (Ceratitis capitata)
[36]
e) Chinche de encaje Corythucagossipii (Hemiptera: Tingidae)
Los adultos y jóvenes de este chinche se localizan en el envés de las hojas y se alimentan de la savia que chupan.
3.1.10 Enfermedades
a) Antracnósis
Esta enfermedad es causada por el hongo Colletotrichum gloeosporioides Penzig; ocasiona la caída de flores y frutos jóvenes y la podredumbre negra del fruto. Flores (1997).
b) Diplodia diplodia sp. Esta enfermedad es de poca importancia en este cultivo. Ocasiona necrosis en las ramas terminales y posteriormente secamiento de las mismas.
c) Scolecotrichum sp.
Invade las hojas y producen manchas de color rojizo que se convierten en numerosas áreas necróticas.
Estas dos enfermedades, diplodia y Scolecotrichum, son consideradas de poca importancia económica.
3.1.11 Usos
La pulpa del fruto es comestible. Se consume al estado fresco, tiene agradable aroma, textura suave, fibrosa, sabor dulce, agridulce y sabores combinados según variedades. Flores (1997).
Fruta procesada: Se comercializa la pulpa de guanábana natural o congelada, concentrado, mermelada, néctar, jaleas y puré. La fruta es muy apreciada para bebidas, y los países productores exportan jugo en presentaciones industriales o en latas para consumo final. Esta fruta exótica se consume principalmente en jugo, además se preparan helados, batidos y una variedad de dulces y postres. Es un buen ingrediente para ensaladas de frutas y vegetales además de variados platos gourmet, FAO (2006).
Medicinales: Por lo que más destaca entre las propiedades medicinales es que es anticancerígena, por contener en sus hojas unos compuestos naturales esencial para combatir el cáncer sin causar daño al resto de células sanas. Hecho que sitúa su potencial, como tratamiento alternativo ante el cáncer, muy por encima de los convencionales con quimioterapia. Seguido de un sinnúmero de otras bondades que nos brinda como ser antiparasitario, vasodilatador, antiespasmódico, antidiabético.
Y lo mejor es que cada una de sus propiedades las podemos adquirir de todas las partes de la planta tales como la pulpa, corteza, hojas, tallo, y raíces, en fin todo lo que tiene la guanábana es sumamente necesario, aportando el bienestar para nuestra salud por ser un tratamiento natural.
[38]
CUADRO N° 06. PROPIEDADES MEDICINALES DE LA GRAVIOLA DEMOSTRADAS CON
PRUEBAS DE LABORATORIO
3.1.12De los sustratos
Un sustrato es todo material sólido distinto del suelo, natural, de síntesis o residual, mineral u orgánico, que, colocado en un contenedor, en forma pura o en mezcla, permite el anclaje del sistema radicular de la planta, desempeñando, por tanto, un papel de soporte para la planta. El sustrato puede intervenir o no en el complejo proceso de la nutrición mineral de la planta.
http://www.infoagro.com/industria_auxiliar/tipo_sustratos2.htm.(2012).
Para obtener buenos resultados durante la germinación, el enraizamiento y el crecimiento de las plantas, se requieren las siguientes características del medio de cultivo:
a) Propiedades físicas:
Elevada capacidad de retención de agua fácilmente disponible. Suficiente suministro de aire.
Elevada porosidad.
Estructura estable, que impida la contracción (o hinchazón del medio).
b) Propiedades químicas:
Baja o apreciable capacidad de intercambio catiónico, dependiendo de que la fertilización se aplique permanentemente o de modo intermitente, respectivamente.
Suficiente nivel de nutrientes asimilables. Baja salinidad.
Elevada capacidad tampón y capacidad para mantener constante el pH. Mínima velocidad de descomposición.
Cuando se añade un material rico en materia orgánica a un suelo que tiene plantas (la rizosfera), suele haber cierta modificación en las raíces como respuesta a este fenómeno. Esta respuesta puede manifestarse en un acortamiento o destrucción parcial de las mismas, un descenso en el metabolismo de la planta, e incluso, afectar al crecimiento de la misma (si la materia orgánica contiene compuestos que puedan ser dañinos). Este efecto no suele ser irreversible y en poco tiempo, la planta vuelve a los niveles anteriores o incluso superiores si la materia orgánica tiene un efecto fertilizante. De esta manera, conocer el efecto de la naturaleza de la materia orgánica en el desarrollo radicular nos daría información sobre su estado de estabilidad o madurez, ya que como ya sabemos, la materia orgánica durante el compostaje cambia por la acción microbiológica.
[40]
como fertilizante, mejora las propiedades físicas, químicas y biológicas del suelo, suprime patógenos y plagas del suelo. Webmaster, (2009).
Respecto a la composición de la gallinaza, es una tarea realmente complicada debido a la variabilidad con la que se pueden presentar los residuos de excrementos de animales. Gran parte del nitrógeno, fósforo y potasio que son ingeridos por los animales estarán presenten en sus residuos. Así mismo los problemas que los residuos de gallinaza causan a los suelos son: variación de pH, efectos depresivos, salinidad, metales pesados, patógenos, exceso de nitratos y nitritos, retención de agua.https://aguasresiduales.wordpress.com/.../tratamiento-de-residuos-organic, (2008).
Las excretas de aves (EA), presentan contenidos elevados de proteína cruda y son fuente de minerales, pero tienen algunas limitantes como son presencia de objetos extraños y residuos tóxicos, elevado contenido de minerales y nivel de humedad, emisión de olores, etc. El uso de EA mejora la rentabilidad del sistema de producción al reducir costos de producción. Ríos et al (2005).
Proyecto VIFINEX (2002), estudiaron que el estiércol no es recomendado como fuente de materia orgánica para preparar medios de cultivo. La materia orgánica en el estiércol es alta en proteínas y otros compuestos nitrogenados que con facilidad, son convertidos en amonio y nitritos. Este proceso de conservación, que comienza tan pronto es producido el estiércol, continúa a un ritmo rápido después que es mezclado con el sustrato. Asimismo desde el punto de vista de estandarización del medio de cultivo, los estiércoles varían considerablemente en composición y textura. El tipo de animal, su edad, condición y la alimentación que consume afecta la calidad del estiércol siempre como el caso de la gallinaza, el contenido de amonio es muy alto y causa pudrición y daño al follaje. Una acumulación de nitrógeno amoniacal contribuyendo al contenido total de sales del sustrato.
Montenegro (2001), indica que la incorporación de gallinaza aumenta las interacciones biológicas del suelo, que conlleva mayor abundancia de microflora y micro fauna, las cuales son esenciales para mantener un equilibrio biológico de sus componentes y disminuir el número de ciertos patógenos que atacan al cultivo.
[42]
Chávez, (1990), menciono que el sustrato es la tierra en la cual se cría las plántulas; que pueden ser:
Substrato Natural: Como sustrato natural se puede aprovechar la tierra suelta o arenosa de color cenizo a negro, que contiene los elementos necesarios en proporciones naturales para un desarrollo normal de la planta.
Sustrato especial: Es la mezcla de tierra, arena y abono en proporciones reguladas por la mano del hombre para satisfacer en forma óptima las necesidades de la planta.
Para optimizar los resultados, es conveniente que antes de su uso, las EA sean sometidas a un procesamiento previo, que puede ser importante para la eliminación de cuerpos extraños, destrucción de patógenos, mejorar el almacenamiento, características de manejo y mantenimiento, así como para incrementar la palatabilidad y reducir los olores (Fontenot, 1983; McCaskey y Anthony (1979).
Cualquier residuo vegetal o animal es materia orgánica, y su descomposición lo transforma en materiales importantes en la composición del suelo y en la producción de plantas. La materia orgánica bruta es descompuesta por microorganismos y transformada en materia adecuada para el crecimiento de las plantas y que se conoce como humus. Mejora las condiciones físicas, químicas y biológicas de los suelos. Los suaviza; permite una aireación adecuada; aumenta la porosidad y la infiltración de agua, entre otros. Es una fuente importante de nutrientes, a través de los procesos de descomposición con la participación de bacterias y hongos, especialmente. Absorbe nutrientes disponibles, los fija y los pone a disposición de las plantas. Fija especialmente nitrógeno (NO3, NH4), fósforo (P04), calcio (Ca), magnesio (Mg), potasio (K), sodio (Na) y otros.
Según BURGES, RAW (1991), las bacterias son los más numerosos microorganismos que viven libremente en el suelo. Tomados colectivamente, su serie de capacidades autotróficas y heterotróficas no es igualada por ningún otro de los grupos principales de seres vivientes del suelo. El número de bacterias presentes en un gramo de suelo abarca desde un millón o menos hasta varios miles de millones, esto debido a las grandes diferencias que existen entre los suelos y los beneficios de las bacterias para los cultivos se relacionan con un incremento en la cantidad de raíces y un aporte importante de elementos básicos para el desarrollo y producción.
Según ACUÑA et al (2006), la función básica de los hongos es la descomposición y mineralización de los residuos orgánicos frescos o recién incorporados al suelo, por esto se les conoce como descomponedores primarios que mediante su metabolismo libera gran cantidad de enzimas capaces de destruir compuestos de estructuras complejas, para así obtener su fuente energética y alimenticia. Los beneficios de los hongos para los cultivos se relacionan con un incremento en la cantidad de raíces, una protección al ataque de Fito patógenos y un aporte importante de elementos básicos para el desarrollo y producción.
3.2 MARCO CONCEPTUAL
Semilla: Es la unidad de reproducción sexual de las plantas y tienen la función de multiplicar y perpetuar la especie a la que pertenecen. Además es uno de los elementos eficaces para que la especie se disperse, tanto en el tiempo como en el espacio.http://www.euita.upv.es/varios/biologia/temas/tema_17htm.
[44] condiciones óptimas para su germinación, no germinan. CAMACHO, (1994).
Germinación Epigea. En las plántulas denominadas epígeas, los cotiledones emergen del suelo debido a un considerable crecimiento del hipocotílo (porción comprendida entre la radícula y el punto de inserción de los cotiledones). Posteriormente, en los cotiledones se diferencian cloroplastos, transformándolos en órganos fotosintéticos y actuando como si fueran hojas. Presentan este tipo de germinación la semilla de cebolla, ricino, judía, lechuga, mostaza blanca, etc.http://www.euita.upv.es/varios/biología/temas/tema_17.htm.
Germinación hipógea. En las plántulas hipogeas, los cotiledones permanecen enterrados, únicamente la plúmula atraviesa el suelo. El hipocotilo es muy corto, prácticamente nulo. A continuación el epicotilo se alarga, apareciendo las hojas verdaderas, que son, en este caso, los primeros órganos fotosintetizadores de la plántula. Este tipo de germinación lo presentan las semillas de los cereales (trigo, maíz, cebada, etc.), guisante, haba, roble, etc.http://www.euita.upv.es/varios/biología/temas/tema_17.htm.
Plántula. El término plántula no ha sido bien definido y su conceptualización varía de un autor a otro. Flores (1999), define Plántula como el estadío más joven del nuevo esporofito, desde la protrusión de la radícula hasta la total liberación de las estructuras protectoras, la abscisión de los cotiledones y el alcance de una altura de 50 cm.
Porcentaje de Germinación:
PIDINICO, (1981) citado por DELGADO (1996), nos dice que el porcentaje (%) de germinación, es el porcentaje de semillas germinadas al término de una prueba de germinación.
Energía germinativa
PIDINICO (1981), citado por DELGADO (1996), nos dice que es la velocidad en la que tiene lugar la germinación de las semillas en sucesivas fracciones de tiempo.
Índice de Vigor o Vigor de las semillas
PERRY (1976), es un término común, usado para describir un amplio rango de características de las semillas. Al respecto AGRAWAL (1980), opinó que, las pruebas de vigor de semillas predicen el potencial de resistencia a varias condiciones de tiempo.
Periodo de Latencia
Delgado, (1984), es un estado de vida en el que la semilla reduce sus funciones vitales al mínimo, es decir que no se desarrolla pero respira fundamentalmente de manera que se puede conservar el poder germinativo durante más tiempo. El estado latente debido a la resistencia al agua (dureza de la cubierta seminal) puede durar varios años, hasta que suficiente agua haya penetrado a la parte interior de la semilla para que germine.
Variable. Una variable es una característica, propiedad ò atributo, con respecto a la cual los elementos de una población difieren de alguna forma y para denotar a una cierta variable se utilizan letras mayúsculas y se hace referencia a un valor en particular observable en un elemento de la población, a que se le suele llamar dato. Di Rienzo (2008).
Experimento. Se define como la acción de aplicar uno o más tratamientos a un conjunto de unidades experimentales para valorar sus respuestas. Di Rienzo (2008).
[46]
Tratamiento. Se denomina tratamiento al conjunto de acciones que se aplican a las unidades experimentales con la finalidad de observar cómo responden a éstas. Di Rienzo (2008).
Repetición. Se llama así a cada realización de un tratamiento. Di Rienzo (2008).
ANVA. Es un método estadístico cuya finalidad es probar hipótesis referidas a los parámetros de posición de dos o más poblaciones en estudio. Di Rienzo (2008).
Parámetro. Es un valor fijo que rara vez conocemos. Los parámetros son estimados a partir de la muestras. Little (1989).
Prueba de Duncan. Se usa para comparar cada promedio de tratamiento, con cada uno de los otros promedios, es una prueba de rango múltiple.
http://books.google.com/books?que+es+la+prueba+de+duncan.
Riego. Consiste en aportar agua al suelo para que los vegetales tengan el suministro que necesitan favoreciendo así su crecimiento. Se utiliza en la agricultura y en jardinería, htp:/www.wiquipedia.org (2013).
Gallinaza. son excretas de aves ponedoras, en etapas de producción, son las mezcladoras con otros materiales, htp:/www.wiquipedia.org (2013).
Trasplante. Esta labor consiste en extraer las plántulas del almacigo para colocarlas en el terreno definitivo, donde van a completar su periodo productivo, Cerna (2007).
Siembra. Consiste como una labor o conjunto de labores por la que se ubica la semilla en la cama del suelo o del sustrato en condiciones favorables para que germine y de nacimiento a la plántula que se desee cultivar, Cerna (2012).
Diseño experimental. Técnica estadística que permite identificar y cuantificar las causas de un efecto dentro de un estudio experimental, htp:/www.wiquipedia.org (2013).
Vivero. Conjunto de instalaciones agronómicas en el cual se planta, germinan, maduran u endurecen todo de plantas.
htp:/www.wiquipedia.org (2013).
Control fitosanitario. Uso de sustancias destinados a prevenir, atraer, repeler o controlar cualquier plaga de origen animal o vegetal durante la producción, almacenamiento, transporte, distribución y elaboración de productos y sus derivados. htp:/www.wiquipedia.org (2013).
Análisis de varianza. Técnica descubierta por Fisher, es un procedimiento aritmético para descomponer una suma de cuadros total y demás componentes asociados con reconocidas fuentes de variación, AREVALO (2013).
Coeficiente de variación. Es una medida de variabilidad relativo que indica el porcentaje de la medida correspondiente a la variabilidad de los datos, AREVALO (2013).
Tierra negra. Otros nombres que se emplean como sinónimo de “tierra negra”, con “tierra vegetal” o “tierra de cultivo”. Puede comprarse embolsada o en grandes cantidades que se transportan frecuentemente en camiones volcadores.
www.jardineria.pro/varios/tierra-negra-para-el-jardin(2010).
CAPITULO IV
ANALISIS Y PRESENTACIÓN DE LOS RESULTADOS
4.1 SOBRE LOS SUSTRATOS EN ESTUDIADO
El análisis de suelo se realizó en el laboratorio de análisis de suelos, plantas, aguas y fertilizantes, de la UNIVERSIDAD NACIONAL AGRARIA LA MOLINA, y su interpretación dio como resultado lo siguiente:
4.1.1 Suelo agrícola
El sustrato presenta un pH de5.81 Moles de H+/It de solución, lo cual indica un pH moderadamente acido, existiendo problemas de toxicidad de H, Fe y Mn.
La Conductividad eléctrica es de 0.22 ds/m-1, indicando que hay problemas muy ligeros de salinidad.
No hay presencia de Carbonatos de calcio, porque su concentración es de 0.00%. La concentración de materia orgánica es de 2.80%, que indica un porcentaje medio.
En relación al fosforo disponible, presenta una concentración de 32.7 ppm, indicando alta concentración de este elemento.
En relación al potasio disponible, presenta una concentración de 35 ppm, indicando baja concentración de este elemento.
La Capacidad de Intercambio Cationoco(CIC),es de 7.52 meq/100g. de suelo, lo cual indica que tiene una capacidad de absorción de nutrientes en términos medio.
En relación al magnesio, su concentración es de adsorbente de los colides del suelo es de 0.39 meq/100g. de suelo, indicando una baja concentración de este elemento.
La clase textural. Es Franco arenoso, con una textura moderadamente gruesa lo cual indica que el suelo es muy suelto, permeable, oxidable y muy lixiviable, debido a su alta concentración de arena ((60%).
4.1.2 Suelo agrícola + gallinaza
El sustrato presenta un pH de 6.88 Moles de H+/It de solución, lo cual indica un pH moderadamente acido, existiendo problemas de toxicidad de H, Fe y Mn.
La Conductividad eléctrica es de 1.38 ds/m-1, indicando que hay problemas muy ligeros de salinidad.
Hay presencia de Carbonatos de calcio, porque su concentración es de 0.20%. La concentración de materia orgánica es de 2.87%, que indica un porcentaje medio.
En relación al fosforo disponible, presenta una concentración de 40.9 ppm, indicando alta concentración de este elemento.
En relación al potasio disponible, presenta una concentración de 7.56 ppm, indicando baja concentración de este elemento.
La Capacidad de Intercambio Cationoco (CIC), es de 8.32 meq/100g. de suelo, lo cual indica que tiene una capacidad de absorción de nutrientes en términos medio.
La concentración de elementos calcio es de 4.95 meq/100g. de suelo, que indica un nivel bajo. En relación al magnesio, su concentración es de adsorbente de los colides del suelo es de 1.79 meq/100g. de suelo, indicando una baja concentración de este elemento.
[50]
4.1.3 Tierra negra
El sustrato presenta un pH de 7.10 Moles de H+/It de solución, lo cual indica un pH ligeramente alcalino, por su alta demanda de calcio o inhabilidad para tolerar aluminio y selenio. La Conductividad eléctrica es de 0.79 ds/m-1, indicando que hay problemas muy ligero de salinidad.
Hay presencia de Carbonatos de calcio, porque su concentración es de 1.70%. La concentración de materia orgánica es de 6.28%, que indica un porcentaje alto.
En relación al fosforo disponible, presenta una concentración de 69.2 ppm, indicando alto concentración de este elemento.
En relación al potasio disponible, presenta una concentración de 6.50ppm, indicando baja concentración de este elemento
La Capacidad de Intercambio Catiónico (CIC), es de 14.40meq/100g.de suelo, lo cual indica que tiene una capacidad de absorción de nutrientes en términos medio.
La concentración de elementos calcio es de 9.77 meq/100g. de suelo, que indica un nivel bajo. En relación al magnesio, su concentración es de adsorbente de los colides del suelo es de 3.62 meq/100g.de suelo, indicando una baja concentración de este elemento.
La clase textural. Es Arena Franca, textura gruesa lo cual indica que el suelo es muy suelto, permeable, oxidable y muy lixiviable, debido a su alta concentración de arena (80%).
4.1.4 Tierra negra + gallinaza
El sustrato presenta un pH de 8.32 Moles de H+/It de solución, lo cual indica un pH moderadamente alcalino, existiendo la posibilidad de problemas con la solución del agua por las raíces de la planta y toxicidad de nitrógeno.
La Conductividad eléctrica es de 3. 04 ds/m-1, indicando que hay problemas ligeros de salinidad.
La concentración de materia orgánica es de 5.74%, que indica un porcentaje alto.
En relación al fosforo disponible, presenta una concentración de 106.0 ppm, indicando alta concentración de este elemento.
En relación potasio disponible, presenta una concentración de 249.6 ppm, indicando alta concentración de este elemento.
La Capacidad de Intercambio Catiónico CIC), (es de 10.08meq/100g. de suelo, lo cual indica que tiene una capacidad de absorción de nutrientes en términos medio.
La concentración de elementos calcio es de 1.67 meq/100g. de suelo, que indica un nivel bajo. En relación al magnesio, su concentración es de adsorbente de los colides del suelo es de 4.13 meq/100g. de suelo, indicando una baja concentración de este elemento.
La clase textural. Es Arena Franca, textura gruesa lo cual indica que el suelo es muy suelto, permeable, oxidable y muy lixiviable, debido a su alta concentración de arena (70%).
4.2 SOBRE LAS VARIABLES EN ESTUDIO
Antes de realizar los análisis estadísticos de las variables se efectuó la prueba de homogenidad de variancias según Lavene (Cuadro N° 40. del Anexo) y prueba de distribución normal según Shápiro - Wilks (Cuadro N° 41 del Anexo), encontrando homogenidad de variancias y distribución normal respectivamente.
4.2.1 Porcentaje de germinación
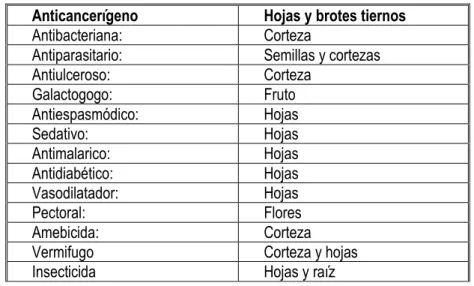
[52]
CUADRO Nº 07. ANÁLISIS DE VARIANZA DEL PORCENTAJE DE GERMINACIÓN DE
GUANABANA
FV GL SC CM FC 0.05 FT 0.01
Tratamientos 3 654.96 2.18.32 21.79** 3.24 5.29 Error 16 160.37 10.02
Total 19 815.33
**Alta diferencia estadística significativa al 1% de probabilidad CV = 4.95%
Para mejor interpretación de los resultados, se hizo la prueba de rangos múltiples de Duncan que se indican en el cuadro siguiente:
CUADRO N° 08. PRUEBA DE DUNCAN DEL PORCENTAJE DE GERMINACIÓN DE SEMILLAS DE
GUANÁBANA.
OM Clave Tratamientos Descripción Promedio Significación (*)
1 T3 Tierra negra 76.79 A
2 T1 Suelo agrícola 67.52 B
3 T4 Tierra negra + gallinaza 58.38 C 4 T2 Suelo agrícola + gallinaza 51.80 D *Promedios con letras diferentes son discrepantes estadísticamente.
GRAFICO N° 01. HISTOGRAMA DEL PORCENTAJE DE GERMINACIÓN DE SEMILLAS DE
GUANÁBANA.
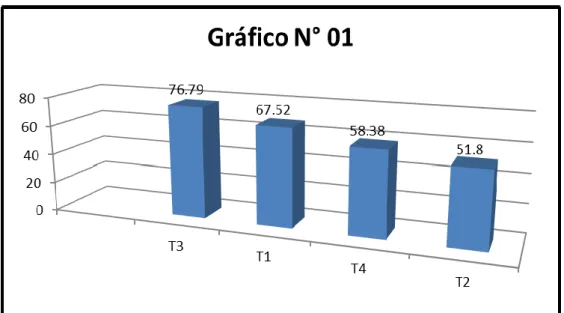
4.2.2 Altura de Planta (cm)
En el cuadro N° 09, se reporta el análisis de varianza de la altura de planta (cm), donde se observa una alta diferencia estadística en la fuente de variación tratamientos, el coeficiente de variación es de 5.17% indicando confianza experimental de los resultados obtenidos.
CUADRO N° 09. ANÁLISIS DE VARIANZA DE LA ALTURA PROMEDIO DE PLÁNTULAS (cm) DE
GUANÁBANA
FV GL SC CM FC 0.05 FT 0.01
Tratamientos 3 270.84 90.28 16.78** 3.24 5.29 Error 16 86.16 5.38
Total 19 357.00
**Alta diferencia estadística significativa al 1% de probabilidad. CV = 5.17%
[54]
0 50 100
T3 T4 T1 T2
50.36 45.52 42.88 40.44
Gráfico N° 02
CUADRO N° 10. PRUEBA DE DUNCAN DE LA ALTURA PROMEDIO DE PLÁNTULAS (cm) DE
GUANÁBANA.
OM Clave Tratamientos Descripción Promedio (cm) Significación (*)
1 T3 Tierra negra 50.36 A
2 T4 Tierra negra + gallinaza 45.52 B
3 T1 Suelo agrícola 42.88 BC
4 T2 Suelo agrícola + gallinaza 40.44 C *Promedios con letras iguales no difieren estadísticamente.
Según el cuadro N° 10 y gráfico N° 02, se observa la presencia de dos grupos estadísticamente homogéneos, donde el tratamiento T3 ocupó el 1° lugar del orden de mérito con promedio de altura de planta igual a 50.36 (cm) superando estadísticamente a los demás tratamientos, donde T2 ocupó el último lugar del orden de mérito con promedio de 40.44 cm respectivamente.
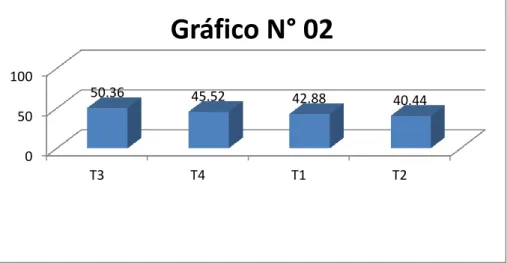
4.2.3 Número de hojas/planta
Según el cuadro N° 11, se indica el Análisis de Varianza del número de hojas, se observa alta diferencia estadística para la fuente de variación tratamientos; el coeficiente de variación de 17.62% nos está informando que los datos sometidos a prueba tienen confianza experimental.
CUADRO N° 11. ANÁLISIS DE VARIANZA DEL N° DE HOJAS PROMEDIO EN PLÁNTULAS DE
GUANÁBANA
Para mejor interpretación de los resultados obtenidos, se hizo la prueba de rangos múltiples de Duncan que se indican en el cuadro siguiente:
CUADRO N° 12. PRUEBA DE DUNCAN DE N° DE HOJAS PROMEDIO DE PLÁNTULAS DE
GUANÁBANA.
OM Clave Tratamientos Descripción Promedio Significación (*)
1 T3 Tierra negra 53 A
2 T4 Tierra negra + gallinaza 50 AB
3 T1 Suelo agrícola 41 B
4 T2 Suelo agrícola + gallinaza 39 B *Promedios con letras iguales no se diferencian estadísticamente.
[56]
GRÁFICO N° 03. HISTOGRAMA DEL NÚMERO DE HOJAS/PLANTAS
4.2.4 Peso fresco promedio de hojas (gr.)
En el cuadro Nº 13, se reporta el análisis de varianza del peso promedio fresco de hojas, se observa alta diferencia estadística significativa para la fuente de variación tratamientos, asimismo el coeficiente de variación de 11.46%, indica confianza experimental de los resultados obtenidos en este experimento.
CUADRO Nº 13. ANÁLISIS DE VARIANZA DEL PESO FRESCO PROMEDIO DE HOJAS (gr.) DE
PLÁNTULAS DE GUANÁBANA.
FV GL SC CM FC 0.05 Ft 0.01
Tratamientos 3 81.62 27.21 6.74** 3.24 5.29 Error 16 64.71 4.04
Total 19 146.33
** Alta diferencia estadística altamente significativa al 1% de probabilidad. C.V: 11.46%
CUADRO Nº 14. PRUEBA DE DUNCAN DEL PESO FRESCO (gr.) PROMEDIO DE HOJAS DE
PLÁNTULAS DE GUANABANA.
O.M Clave Tratamientos Descripción Promedio (gr.) Significación (*)
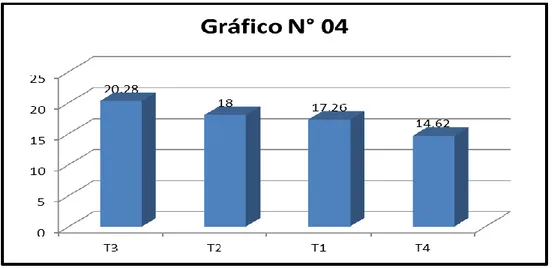
1 T3 Tierra negra 20.28 A
2 T2 Suelo agrícola + gallinaza 18.00 AB 3 T1 Suelo agrícola 17.26 BC 4 T4 Tierra negra + gallinaza 14.62 C *Promedios con letras iguales no difieren estadísticamente.
El cuadro Nº 14 y gráfico N° 04, se reporta la presencia de tres (3) grupos estadísticamente homogéneos entre sí, donde T3 (Tierra negra) ocupó el 1° lugar del orden de mérito con 20.28 g de peso fresco promedio de hojas, siendo estadísticamente igual a T2 (suelo agrícola + gallinaza) quien ocupó el 2° lugar con promedio de 18.00 g superando estadísticamente a los demás tratamientos. El T4 (Tierra agrícola + gallinaza), ocupó el último lugar con promedio de 14.62 g de peso fresco promedio de hojas, respectivamente.
[58]
4.2.5 Peso Seco promedio de hojas (gr).
En el cuadro Nº 15, Se indica el análisis de varianza del peso seco promedio de hojas, se observa que no existe diferencia estadística significativa en la fuente de variación tratamientos, asimismo el coeficiente de variación de 19.22%, indica confianza experimental de los resultados obtenidos en este experimento.
CUADRO Nº 15. ANÁLISIS DE VARIANZA DEL PESO SECO PROMEDIO DE HOJAS (gr.) DE
PLÁNTULAS DE GUANÁBANA.
Para mejor interpretación de los resultados, se hizo la Prueba de Duncan, que se indican en el cuadro siguiente:
CUADRO Nº 16. PRUEBA DE DUNCAN DEL PESO SECO PROMEDIO DE HOJAS (gr.) DE
PLÁNTULAS DE GUANÁBANA.
O.M Clave Tratamientos Descripción Promedio Significación (*)
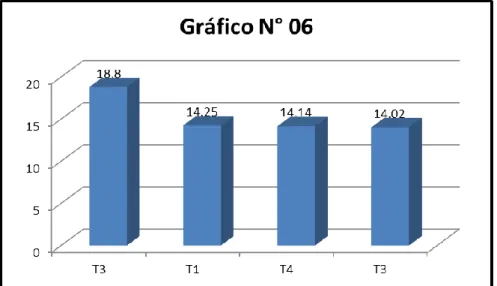
1 T3 Tierra negra 5.70 A
2 T4 Tierra negra + gallinaza 4.90 A
3 T1 Suelo agrícola 4.22 A
4 T2 Suelo agrícola + gallinaza 4.14 A *Promedio con letras iguales no difieren estadísticamente
GRÁFICO N° 05. HISTOGRAMA DEL PESO SECO DE HOJAS (gr.)
4.2.6 Peso fresco promedio de tallos (gr.)
En el cuadro Nº 17, se reporta el Análisis de Varianza del peso fresco de tallos en el cultivo de guanábana, se observa alta diferencia estadística significativa en la fuente de variación tratamientos; el coeficiente de variación fue de 12.39%, que indica que hay confianza experimental de los resultados obtenidos.
CUADRO Nº 17. ANÁLISIS DE VARIANZA DEL PESO FRESCO DE TALLOS DE PLÁNTULAS DE
GUANÁBANA.
FV GL SC CM Fc 0.05 Ft 0.01
Tratamientos 3 81.37 27.12 7.53** 3.24 5.29
Error 16 57.57 3.60
Total 19 138.94
** Alta diferencia estadística significativa. C.V:12.39%