Anemia infecciosa equina (fiebre de los pantanos)
Texto completo
(2) ..v. CORTESIA. Los autores agradecen la colaboración prestada para el logro de este trabajo a la Señorita aL GA MARlfiJO, Bacterióloga del LlMV, al Señor JAIME MEJIA ESCOBAR, Presidente de la Asociación Nacional de Caballos de Paso Colombiano y Fomento Equino, y de una manera especial al Doctor JAIME CADENA SANTOS, M. V.Z. del ICA, quien con su interés y dedicación llevó a feliz término esta publicación..
(3) - - - - - - - - CONTENIDO PRESENTACION. l. 1. 2.. ETIOLOG lA. 2.1.. 2.2.. Caraeter isticas del vIrus ReSIStencia. 1 2. 3.. EPIOEMIOLOGIA. 3. 4. 4.1.. INFECCION . . . . . . . . . . . . . ••. 5. 5. 4.3.. Infecci6n Natural ... Infección Artificial Otros Animales ... .. 5.. DISTRIBUCION DEL VIRUS EN LOSORGANOS. 8. 6.. INMUNIOAD. 9. 7.. MECANISMOS DE PRODUCCION DE LA ANEMIA. 9. 8.. OIAGNOSTICO CLlNICO E HISTOPATOLOGICO. 10. 8.1. B.2.. S;nlCft1 .. \..ulOn8t MacfOl'.bplan. 8.3.. L~on.,. 10 11 12. 4.2.. •. INTRODUCCION. 9. 9.1.. 9 .2. 93. 9.4. 9.5. 96. 9 .7 9.7.1.. . . ... .. 7 7. MlcroK6pn;.a.. PRUEBAS DE LABORATORIO PARA DIAGNOSTICAR ANEMIA INFECCIOSA EQUINA Hemograma . . . . . Autohemoaglutinaci6n. Prueba de la velocidad de. ~dlmentaci6n. .. Hematocrito . . . . . . . .. . Investigación de los cuerpos de Heinz Investigación de los Sideroci tos .. Pruebas Serológ icas . .. . . Pruebas no espec ¡tieas . .. ... . . 1. Pruebe de Mclagan .2. Prueba de Hanger para el colesterol. .3. Reacción de Bennet-Fulton .4. Reacción del formol-l eucogeliflC;aci6n .5. Prueba de la Dehldrogenase h\ctlca 9.7.2. Pruebas Espedficas .1. Fijación del complemento _ . .. ,. SeronlfUttbhlDOOn. .3. H.rnotghHlrutc:16n. PtI.! lva. O c:ondJcionadit •. -4 AnlleultPQl "uorlllc:aMel ..5. ~neoi()nt!11:M' PrlClP1tklOn. .6. InmunocM" .. bf\ O PMJ~ba (le eoggln... 10.. MUESTRAS PARA El LABORATORIO. 11.. RECOMENDACIONES GENERALES SOBRE CONTROL.. 12.. Ol8LIOGRAFIA. 16 16 17. 17 lB lB 19 19 19. 19 20 20 20 20 20 20 21 21 21 22 22.
(4) Por un error involuntario en la armada de la carátula de este boletín, se citan los autores de la obra en el orden que no corresponde; el orden correcto es el que aparece en la página 1, o sea: Omar Hincepi', MoV., M.S. Otto S6nchez, MoVo, M.S. Gustavo Manrique, M.V., PhoO. Guillermo MltaUI, M.V., Ph.O..
(5) PRESENTACION. El presente trabajo es una recopilación de datos bibliográficos y experiencias personales de los autores, relacionadas con la Anemia Infecciosa Equina (AlE); presentado por los Programas de Microbiología, Patología y Parasitología del Departamento de Ciencias Veterinarias dellCA y verificado en las diferentes regiones del país, como una contrtbución para el mejoramiento de la industria pecuaria nacional. La Anemia Infecciosa es un azote mundial para la industria equina. Su distribución en el pafs aumenta día a día y produce graves pérdidas económicas en la ganaderfa nacional, por lo que debe recibir la atención que merece, tanto del Médico Veterinario, como de las Asociaciones de Criadores de Caballos, de los ganaderos en general, y desde luego de los estamentos oficiales ligados al desarrollo pecuario del país. Es importante recalcar que hasta ahora no existen vacunas ni tratamientos curativos para esta enfermedad; por consiguiente el control se debe limitar a reducir las posibilidades de infección de los animales así: 1. Eliminar los animales portadores de la enfermedad en los sitios donde haya equinos. 2. Reducir los vectores. En el intento de disminuir la distribución de la enfermedad, se debe hacer énfasis, en que un equino jamás debe recibir una inyección con una aguja que se ha utilizado para inyectar a otro sin antes lavarla y esterilizarla, porque esto constituye la mejor forma de transmisión de la enfermedad; se debe además combatir los insectos transmisores en los sitios donde se encuentren concentrados los equinos, especialmente en potreros fangosos o en establos sucios. Como este trabajo es recopilación de varios autores, puede faltar homogeneidad en el estilo, así como en algunas ocasiones haber opiniones aparentemente contradictorias de las cuales, sin embargo, está plagada la literatura mundial al respecto, por tanto se considera deben quedar consignadas. Se espera que el lector encuentre útil la información que aquí se presenta.. RICARDO OCHOA O. M.V.Z., Ph.D. Director Departamento. Ciencias Vetennarias.
(6) a. •. la losa •. eqUina. Omar Hincapié, M. V., M.S. Otto Sánchez, M.V., M.S. Gustavo Manrique, M.V., Ph.D. Guillermo Mateus, M.V .• Ph.D.·. (F iebre de los pantanos). l. INTRODUCCION La Anemia Infecciosa Equina (AlE), es una enfermedad causada por virus y transmitida generalmente por ¡"nsectos picadores y hematófagos. Está ampliamente diseminada en el mundo y produce pérdidas considerables en la población equina en casi todos los continentes. La AlE o Fiebre de los Pantanos, se conoció por primera vez en Francia en 1843. Inicialmente se creyó que era causada por una deficiencia nutricional. En 1859 Anginiard la reconoció como enfermedad infecciosa; desde entonces se comprobó en Francia, Suiza, Alemania, Japón, Estados Unidos y Canadá. En 1904 Vallée y Carré demostraron experimentalmente que la enfermedad era producida por el virus Trifur equorum. 2. ETIOLOGIA 2.1. Características del Virus. La Anemia Infecciosa Equina es una enfermedad producida por virus cuyo agente etiológico era desconocido hasta hace poco, debido a las dificultades para cultivarlo y para aislarlo. Al principio la comprobación del virus se obten ía mediante inoculaciones en animales susceptibles, posible solamente en animales del género Equus. Estas inoculaciones resultaban muy costosas y a veces no se presentaba ningún síntoma clínico que permitiera dar el diagnóstico como Anemia Infecciosa Equina. Kobayashi (13) en 1967, ideó el cultivo del virus en leucocitos de equino lo cual dió origen a la técnica para el estudio del mismo virus. Antes de encontrar esta técnica, se trató de cultivarlo en otro tipo de células, tales como riñón, bazo, h fgado y otros órganos de equino sin ningún resultado. -_._._, Médicos Veterinarios. Laboratorio Investigaciones Médico Veterinarias ICA. Ciudad Universitaria, Apartado A~reo 29743, Bogotá. O.E..
(7) A pesar de estos adelantos, aún no se conocen bien las características del virus, debido especialmente a que es difícil purificarlo después de que se tia cultivado en leucocitos de equino. Esta dificultad es la causa de que aún no se tenga definido qué tipo de ácido nucléico posee, para incluirlo en un grupo determinado de la clasificación viral. Actualmente se incluye en el grupo de los virus no clasificados; sin embargo, Moore et al (20) lo ha incluido dentro de los virus pequeños, y Nakajima et al (27) lo ha colocado entre los Myxovirus. En cuanto se refiere al ácido nucléico, surgieron las escuelas Americana, Francesa y Japonesa. Los investigadores americanos dicen que el ácido nucléico del virus es el Desoxiribonucleico (DN A), los franceses y los japoneses opinan que el virus posee ácido Ribonucleico (RNA). (6), basándose en la acción de la Ribonucleasa y la Goret et al Desoxiribonucleasa, dicen que la acción demostrada por estas enzimas sobre el ácido nucléico del virus de la Anemia Infecciosa Equina no los autoriza para emitir un concepto que dé alguna conclusión del verdadero tipo de ácido nucléico que posee este virus. Debido a las dificultades en la purificación del virus, no ha sido posible obtener datos más o menos directos de la forma que posee la partícula viral, y el tamaño de la misma. Se han dado medidas para ese virus desde 18 hasta 140 nanómetros, pero según los últimos estudios hechos con el microscopio electrónico parece que el verdadero lamafio está entre los 80 y 140 nanómetros; también en los mismos estudios se ha encontrado una forma esférica; se dice además que el virus posee cubierta y algunas proyecciones sobre ésta. Se ha comprobado que el virus es destruido en cinco minutos cuando se coloca en presencia de éter u otro solvente de lípidos, lo que demuestra la presencia de estos compuestos en su estructura. 2.2. Resistencia. La resistencia al calor parece que varía de acuerdo con el medio o diluyente en que se encuentre suspendido el virus. Cuando se halla en el suero se cree que es inactivado a 56 grados centígrados en 30 minutos y pierde su efectividad corr,pletamente cuando se calienta a la misma temperatura por 60 minutos. También se ha comprobado su resistencia a la tripsina. No se ha demostrado últimamente actividad hemoaglutinante; algunos autores e investigadores estuvieron de acuerdo en que aglu tinaba glóbulos rojos humanos tipo 0, pero esta teoría fue desvirtuada más tarde. El virus muestra considerable resistencia a los desinfectantes, al calor y al frfo, pero es sensible a la luz solar y a algunas sustancias químicas. Sin embargo, mantiene su virulencia por varios meses en sangre desecada y en tejid~s congelados. En la sangre y los órganos que contienen virus conservan su viabilidad hasta por un año a temperaturas de 20 grados centígrados. 2.
(8) l. Estos materiales virales pierden actividad, cuando se someten a 60 grados centígrados durante una hora. El virus de la AlE en suero sanguíneo mucre en una hora en presencia de fenal a concentraciones del dos por ciento, pero en concentraciones del medio por ciento y a temperaturas de 10 a 15 grados cenllgrados se conserva hasta por 90 días. A temperatura ambiente el virus en suero con fenal al medio por ciento, permanece virulento, sin cambio, durante cinco meses, virulencia que se reduce después de siete meses. El virus de la AlE se inactiva en suero, guardado a 37 grados cenllgrados durante tres días a una concentración de fenal al medio por ciento. En suero desecado el virus muere en cinco minutos en una concentración de formol al dos por ciento. En suero líquido, en concentraciones de uno a dos por ciento de formol y conservado a cinco grados centígrados, muere después de 33 días. El cloruro de mercurio al 1:500 mata el virus en 30 minutos.. 3. EPIDEMIOLOGIA. l I. Como fenómeno característico, se observa que en los lugares en donde la enfermedad es enzoótica, la naturaleza de la AlE es cada vez menos intensa, ya sea porque los caballos han adquirido una resistencia mayor a consecuencia de infecciones subclínicas repetidas o porq uc los animales con infecciones graves han muerto. Con la disminución de la población caballar en todo el mundo, los brotes de Anemia Infecciosa Equina consccuencialmente han disminuido. La AlE se ha comprobado en Bulgaria, Yugoeslavia, Suiza, Panamá, Uruguay, Checoeslovaquia, Africa, Canadá, México, USA, Brasil, Colombia, Venezuela, Formosa, India, Indonesia, Japón. Corea, Vietnam. La enfermedad no ha sido comprobada en Gran Bretalla ni cn Nueva Zelandia. En Colombia la AlE era considerada como una enfermedad exótica y poco conocida (1948-1953); fue reportada por primera vez en 1948, en el departamento del Magdalena (Corregimiento de Buena Vista); se sospechó en Bolivar. donde hubo una mortalidad del 60 por ciento, y fue comprobada y estudiada por primera vez por Morales (25). quien sostiene que probablemente entró por Venezuela y existió en el país desde hace mucho tiempo, pero confundida con la Tripanosomiasis y Nutaliosis. En Colombia esta enfermedad no ha sido suficientemente estudiada a pesar de la elevada mortalidad que causa en la población equina. En 1965 el ICA estudió un brote en caballos de la sabana de Bogotá el cual se comprobó mediante transmisión experimental. En forma natural el virus solamente infecta al género Equus sin diferencia de raza, sexo edad (Figura 1). Aunque se han hecho ensayos de transmisión. °.
(9) experimental en cerdos, ovejas y ratas, no se ha logrado saber si el virus los parasita en forma natural.. FIGURA 1. El virus de la Anemia Infecciosa Equina en forma natural solamente infecta al género Equus.. La enfermedad se puede transmitir experimentalmente con facilidad al caballo al inyectarle por vía intravenosa, intradérrnica, subcutánea o intramuscular pequeñas cantidades de sangre o suero sanguíneo infectados. El virus causante de la enfermedad permanece por largo tiempo en la sangre del caballo infectado. Un caballo que aparentemente se recobró, permaneció con el virus durante 18 años. Caballos con infección subcllnica son portadores inaparentes. La forma activa de la enfermedad puede ser transmitida a caballos susceptibles al inyectar sangre de aquellos en uno o dos pasajes seriados. En animales portadores por largos períodos, parece haber una disminución progresiva en el grado de virulencia de la sangre, pero un caballo que desarrolle la enfermedad en forma de portador, puede no mostrar síntomas activos ¡ior varios años y finalmente morir de un ataque ag·J do. Un pequeño porcentaje de portadores se pueden reponer totalmente de la enfermedad con la desaparición del virus de la sangre. De tres casos, dos fueron de nuevo susceptibles y uno inmune. 4.
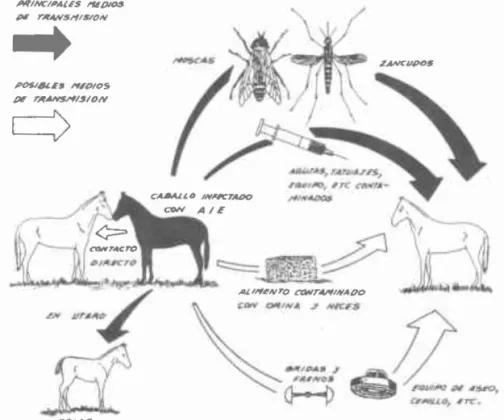
(10) Los equinos portadores recobrados clínicamente y los afectados en la forma subclínica de la enfermedad, son generalmente resistentes a la reinfección;estos animales están en el estado de premunición.Los intentos de provocar un nuevo ataque por inoculación, con cantidades. moderadas de la misma cepa de virus con la cual inicialmente fueron infectados, producen generalmente poca o ninguna reacción. En estado febril, el virus se encuentra en la sangre altamente concentrado y disminuye gradualmente durante el estado afebril; también se encuentra en la médula ósea, bazo, hígado, ganglios linfáticos de la cavidad abdominal, en el sudor, leche, secreción nasal, saliva, lágrimas y en el semen. No se ha comprobado transmisión de la infección por el coito. Durante el período agudo, se ha encontrado en la materia fecal y en la orina durante el estado febril. El virus es capaz de atravesar la placenta; también se ha encontrado que potros nacidos de animales infectados, adquieren la enfermedad con el calostro.. 4. INFECCION 4.1. Natural. La infección se puede llevar a cabo por los siguientes medios (Figura 2): MINC/A4US N/JItU PI. rAAlV511I$/ON. ~AI. ""DlOS. P#. rA~/'I()N. ..w.-....-..,_...,.._!-~'==j~~~~ Ai,1I"ILN'D t:'OIIIrAJ'llfINAOO. CON 0If''''~. ." I't'Kn. t:IfIA~. FIGURA 2. Trantmi,¡6n de '. Anet'I'Iil 'nfeccto. EquIN.. s.
(11) Por la picadura de insectos hematófagos. Por via oral o subcutánea. A través del aparato respiratorio o de la placenta. Por agujas hipodérmicas infectadas. Los insectos de la familia Tabanidae juegan un papel importan te en la infección de la AlE. Otras especies de insectos tales como el Aedes fogo;;. Anophe/es maculipensis. Psurophora co/umbiae y Sfomoxys ca/cifrans también son vectores y transmisores de la enfermedad (Figuras 3 y 4). FIGURA 3 Los insectos del género Aedes son vectores de la Anemia InfecCIO-. sa Equina. FIGURA 4. Los insectos del gén ero Anophele$ también son vec-. tores de la Anemia Infecciosa Equina.. 6. -.
(12) 4.2. Artificial. Pequei'las dosis del virus pueden producir la infección artificial en caballos por vía subcutánea, o al introducirse por la cámara anterior del ojo, o a través de la piel erosionada. Es difícil la infección a través de la piel intacta.. 4.3. Otros Animales. Se ha llevado a cabo un gran número de experimentos para infectar animales diferentes al género Equus. Hasta la fecha no se ha presentado infección en ninguna de las especies utilizadas. Las especies animales empleadas fueron: ratas, gatos, bovinos, cabras, curies, hamster, ratones, monos, ovejas, cerdos, pollos, patos, palomas, ranas y conejos. Se han publicado ensayos experimentales en ovejas, cuyos resultados al tercer pase fueron negativos. Se han citado casos de la enfermedad en el hombre, con los siguientes síntomas principales: fiébre, anemia, diarrea sanguinolenta, dolor de cabeza, debilidad, enflaquecimiento y erupciones cutáneas. La sangre de un hombre que durante dos años padecía la enfermedad se inyectó a un caballo, el cual presentó la infección 40 días después de inoculado (10). En el Japón donde la AlE es enzoótica, no se han reportado casos en trabajadores de laboratorio. Un modo probable de infección puede ser el suero antidiftérico u otro producto biológico derivado de caballos (10). Los brotes de la enfermedad se presentan generalmente en forma esporádica y lenta, aunque también se han descrito formas epizootiológicas que afectan a gran cantidad de equinos. En Colombia se presentaron dos brotes especialmente después de la introducción de portadores. El período de incubación de la forma natural de la AlE es prolongado. En el caso de la infección artificial, el per(odo febril se observa de 10 d (as a tres semanas después de la inoculación subcutánea, pero es prolongado si hay poco virus. Algunos animales inoculados solamente presentan infección subcJínica y pueden permanecer corr,o portadores. La enfermedad se presenta especialmente en tierras pantanosas y donde hay abundancia de arbustos, mosquitos e insectos hematófagos. Después de que el virus ha penetrado en el organismo se localiza en la sangre, en donde se multiplica y produce gran destrucción de glóbulos rojos y lesiones de las células endoteliales de los vasos sangu (neos. Como consecuencia, los órganos más afectados son los encargados de la formación de glóbulos rojos: medula ósea, bazo e hígado. Después de infectados el virus se detecta a partir del quinto día por medio de la prueba de los anticuerpos fluorescentes (9). La morbilidad es muy alta. La mortalidad también es muy alta y en la forma aguda puede llegar hasta el 80 por ciento; ningún animal afectado se recupera completamente y aquellos que aparentemente lo hacen, se convierten en portadores crónicos del virus, constituyéndose por lo tanto en una fuente muy peligrosa de difusión continua de la enfermedad. Esta forma INACTIVA se puede volver ACTIVA, debido a que la producción de 7.
(13) anticuerpos con el virus de la AlE no es tan eficiente como con otros virus. No se han obtenido resultados satisfactorios en experimentos de inmunización con varias clases de materiales virosos . . El control de la AlE es difícil debido a la falta de métodos seguros y específicos para su diagnó,tico ; se reconoce por los síntomas y por las pruebas de laboratorio que complementan el diagnóstico clínico. Ultimamente se usan nuevas técnicas tales como, fijación del complemento , prueba de los anticuerpos fluorescentes, precipitación de Coggins y an ticuerpos neu tra Iizan tes.. s.. D1STRIBUCION DEL VIRUS EN LOS ORCANOS. Desde 1949 se ha intentado hacer una determinación exacta del órgano u órganos en los cuales se encuentra la mayor cantidad de virus en animales en estado crónico de la enfermedad , lo mismo que en animales antes y después de la aparición de la fiebre. Quedó demostrado que en estados crónicos la mayor cantidad de virus se encuentra en la medula ósea, sitio predilecto para la multiplicación del microorganismo. Otros autores no están de acuerdo con ello y ponen en duda la importancia de la medula ósea como sitio de multiplicación viral. En estudios recientes realizados-en cultivos de leucocitos, se constató viremia entre los dos y siete días anteriores a la aparición del primer acceso febril. En estudios hechos con la técnica de anticuerpos fluorescentes se detectó el virus en los leucocitos desde el quinto día hasta siete años depués de infectado el animal; también se encuentra en animales que tienen altos títulos de anticuerpos tanto neutralizantes como precipitantes (9). Esto hace suponer que el virus persiste en esos casos posiblemente en dos formas: 1. Dentro del leucocito, el cual se divide llevando consigo el virus en su interior, lugar al que no tienen acceso los anticuerpos.. 2. En la formación del complejo antígeno-anticuerpo, el virus no es destruido por los últimos, sino envuelto hasta que el anticuerpo es degradado al quedar libre la partícula viral que va a continuar su replicación en las células. En los órganos se encuentra un alto título del virus durante la fase febril que desciende cuando desaparece la fiebre. Durante el período de incubación se han encontrado títulos de virus un poco altos en el hígado, más que en el suero, lo cual indica la importancia de este órgano en la replicación del virus en el organismo. En los casos crónicos, el virus se detectó en el suero, hígado, bazo, riñones, medula ósea y nódulos linfáticos (10). 8.
(14) 6. INMUNIDAD. Desde hace muchos años se ha intentado producir vacuna a partir del suero, plasma o de emulsiones de bazo, hígado, riñones, nódulos linfáticos y medula ósea, recogidos de animales infectados, inactivando el virus con formol o fenal; todo sin resultados satisfactorios. Los animales inoculados con virus apatógenos, pasados 50 a 60 veces en leucocitos, fueron reinoculados a los 175 y 235 días después de iniciada la vacunación con varias dosis del mismo virus patógeno. Los animales controles mostraron todos los síntomas de la enfermedad y desarrollaron anticuerpos fijadores del complemento y anticuerpos neutralizantes. Sin embargo los animales vacunados no presentaron ningún signo de enfermedad, pero tampoco mostraron ninguna respuesta inmunológica después de la descarga. También se observó que cuando estos mismos animales fueron inoculados con virus virulento heterólogo después de la primera descarga, desarrollaron síntomas clínicos y anticuerpos neutralizantes que eran indiferenciables de los controles; esto indica que hay variación inmunológica dentro de las mismas cepas d¿ virus. Este experimento sirvió para demostrar que hay diferencias antigénicas en las cepas de Anemia Infecciosa Equina y así se teme que es difícil producir una vacuna para ser usada en forma general en toda la población equina; serIa entonces necesario preparar una vacuna para cada región con la cepa respectiva.. 7. MECANISMOS DE PRODUCCION DE LA ANEMIA La anemia que aparece en los casos de la enfermedad (AlE), no es producida por acción directa del virus sobre los eritrocitos, sino que se debe a la actividad de las células reticuloendoteliales por el estímulo del virus de la AlE que las habilita para fagocitar eritrocitos, producir hemorragias en los órganos y la aparición transitoria de una sustancia productora de la anemia. Esta sustancia que ha sido encontrada en el suero de animales infectados con el virus y durante el estado febril, tiene acción sobre los nervios vasomotores, produciendo una parálisis del bazo, hfgado y otros órganos que da como resultado una anemia transitoria en ellos (11). Otros autores opinan que los eritrocitos de los caballos infectados tienen menos tiempo de subsistencia durante el período febril, por tanto se produce una destrucción marcada y masiva de los mismos en el hígado y los pulmones, se sugiere que la anemia puede ser del tipo hemolltico debido a la destrucción de los eritrocitos. También se dice que la anemia se debe a una destrucción masiva de glóbulos rojos y disminución de la actividad hematopoy~tica de la medula ósea (11 ). 9.
(15) 8. DIAGNOSTICO CLlNICO E HISTOPATOLOGlCO 8.1. Síntomas. Clínicamente la enfermedad presenta estados agudos, subagudos, crónicos y latentes. El desarrollo y los síntomas de la AlE varían notablemente de acuerdo con su evolución. Los síntomas más sobresalientes son: fiebre alta e intermitente, anemia progresiva, hemoglobinuria, edema en regiones corporales bajas, decaimiento y enflaquecimiento (Fi¡1;ura 5).. I. J. FIGURA 5. Fiebre alta e intermitente, anemia progresiva, hemoglubinuria. edema de las regiones corporales bajas, decaimiento y enflaquecimiento. son entre otros, sCntomas de Anemia Infecciosa Equina.. Las lesiones macroscoplcas de los órganos son variables, se pueden presentar en otras enfermedades, por tanto, tienen poco valor para el diagnóstico. Las lesiones microscópicas son muy características y afectan especialmente el corazón, hígado, bazo, riñón, ganglios linfáticos y medula ósea (12). La semejanza de los síntomas clínicos de esta enfermedad con otras entidades patológicas especialmente con afecciones causadas por hematozoarios, hace difícil su diagnóstico y control. 10.
(16) En la forma aguda de la enfermedad, la temperatura asciende repentinamente a 41-42 grados centfgrados o más; el animal presenta fi~bre continua o ataques febriles frecuentes e intermitentes que rápidamente pueden causar la muerte. Más comúnmente los ataques febriles disminuyen en frecuencia e intensidad lo cual conduce a las formas subagudas o crónicas de la enfermedad. Después de los ataques febriles e intermitentes que duran de tres a cinco días, la temperatura regresa a la normalidad, el animal se encuentra aparentemente sano pero se puede demostrar la anemia. Ocasionalmente el ataque febril inicial persiste hasta la muerte. Otros síntomas que se pueden observar durante la fase aguda son: inapetencia, pulso acelerado, depresión marcada, incoordinación, debilidad del tren posterior, cambios frecuentes de posición de los miembros locomotores, micción frecuente, heces sanguinolentas, congestión y coloración amarillenta de la conjuntiva, petequias sublinguales y nasales, descenso exagerado del número de glóbulos rojos y del hematocrito y algunas veces secreción nasal seroso-sanguinolenta. Además, el animal permanece por largo tiempo en la misma posición con la cabeza baja y muestra indiferencia total a todo lo que le rodea (10). En la forma subaguda, la temperatura corporal se eleva hasta 41-42 grados centígrados y permanece así durante varios días antes de regresar ' a la normal. Estos ataques febriles son recurrentes y mientras más frecuentes sean, más grave será el estado del animal. Esta recurrencia febril puede conducir a la muerte o gradualmente hacia la fase crónica. Los demás síntomas clínicos que se presentan en esta fase son similares a los observados durante la etapa aguda pero más benignos. Sin embargo, es notoria la ex trema debilidad y pérdida de fuerza después de la fiebre, anemia intensa, edema en las regiones ventrales torácica y abdominal, pulso acelerado, pérdida del apetito, ictericia de las mucosas, albuminuria y heces sanguinolentas. En la mayoría de los casos crónicos de Anemia Infecciosa Equina, se observa fiebre recurrente a intervalos variables de tres a seis meses; los síntomas más importantes son: edemas, depresión, debilidad marcada, incoordinación y anemia intensa. En la forma latente los equinos no presentan síntomas durante años y se conocen como portadores clínicamente sanos. Pueden eliminar el virus con las excreciones corporales. Esta forma inactiva de la enfermedad, puede sin embargo volverse activa en cualquier momento y presentar todas las características de las formas aguda o subaguda debido a la influencia de otras enfermedades o infecciones bacterianas. 8.2. Lesiones Macroscópicas. Macroscópicamente las lesiones encontradas en la necropsia varían de acuerdo con la virulencia del agente causal, la resistencia individual, la forma de la enfermedad, el número de ataques febriles, etc. Para fines de 11.
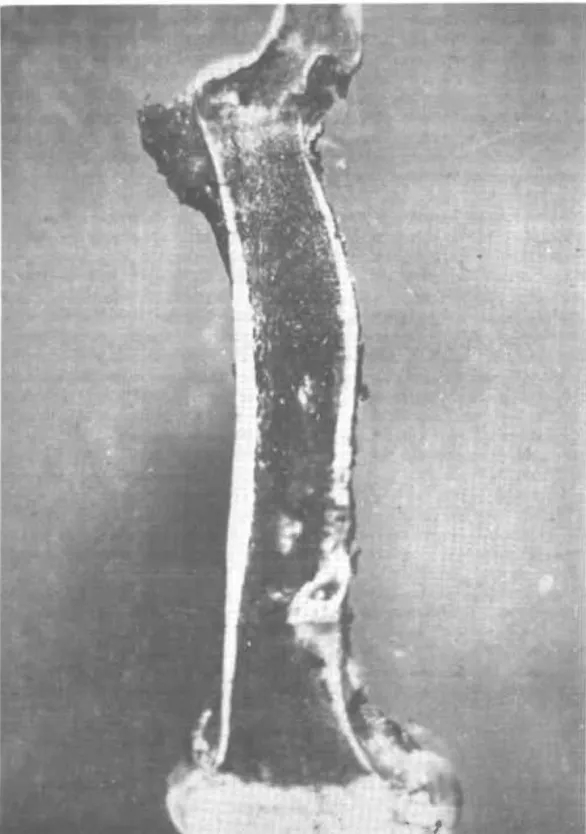
(17) diagnóstico, las lesiones macroscópicas observadas tienen valor relativo ya que en general son de tipo septicémico y por tanto comunes a otras enfermedades del caballo. En general las lesiones anatómicas son: anemia, emaciación, ictericia, edemas subcutáneos de las regiones ventrales del cuerpo, región inguinal, extremidades y en las cápsulas de algunos órganos internos. Son constantes las hemorragias petequiales y equimóticas de la superficie de casi todos los órganos internos, membranas serosas y mucosas. El corazón se aumenta de tamaño y los ventrículos se dilatan. El miocardio es de color pálido, el líquido pericárdico aparece abundante y de color claro, amarillento o sanguinolento. También son frecuentes las hemorragias petequiales y equimóticas en el pericardio, subepicardio y subendocardio. El higado se presenta aumentado de tamaiio durante las formas aguda y subaguda ; en la fase crónica de la enfermedad se presenta atrófico de color rojizo oscuro, de consistencia dura y friable; también se observan pequeños focos blanquecinos diseminados en el parénquima y pequeñas hemorragias cen trolobulillares El bazo aumenta casi dos veces su tamaño, es de color púrpura rojizo u oscuro, la pulpa está muy friablc, con focos hcmorrágicos diseminados en todo el órgano. Las trabéculas y fol ículos no son muy prominentes y la cápsula puede mostrar abundantes petequias. En la forma crónica el bazo está atrófico, la cápsula se engruesa y las trabéculas y folículos son fácilmente identificables. Los riñones aparecen edematosos, con hemorragias en la cápsula, a lo largo de los vasos sanguíneos, de la corteza y la medula. Las diáfisis de los huesos largos contienen áreas grandes de medula ósea roja edematosa con focos activos de hematopoyesis (Figura 6). Algunos autores han reportado lesiones del sistema nervioso central caracterizadas por una mcningoencefalomielitis. 8.3. Lesiones Microscópicas. Las lesiones histopatológicas que se observan en la Anemia Infecciosa Equina, son más características que los cambios macroscópicos. No se han reportado en ninguna otra enfermedad de los equinos. Se considera que el virus causa una reacción reticuloendotelial generalizada y alteraciones de los vasos sanguíneos, que potencialmente afecta a la mayoría de los tejidos y órganos. Como consecuencia de esto se encuentra hiperplasia del sistema reticuloendotelial, infiltración de células mononucleares y hemosiderosis en varios órganos; hay presencia de siderocitos en el torrente sangu íneo y hemorragias y edemas debidos a la alteración de la permeabilidad vascular. Los órganos que más frecuentemente muestran lesiones microscópicas en caballos infectados natural o experimentalmente son: hígado, bazo, riñones, corazón , pulmón, medula ósea y sistema nervioso central. 12. 1..
(18) • .~. FIGURA 6. Macroscóplcamente se observan en las diáfiSIS de los huesos largos áreas grandes de medula O!.e.J rOla edemato!KI con focos activos de hf!malopoyesls 13.
(19) En las formas aguda y subaguda de la enfermedad, la cápsula de Glisson del hígado, está generalmente infiltrada de linfocitos, células plasmáticas y algunos histiocitos. También se observa degeneración grasa, atrofia y necrosis de las células de los cordones hepáticos. Además, es frecuente encontrar necrosis, colapso o desaparición de las células hepáticas alrededor de las venas centrales. Estas muestran hiperplasia endotelial, trombos ocasionales, edema, hemorragia e infiltración de células mononucleares en y alrededor de sus paredes. Los sinusoides hepáticos se hallan dilatados y contienen gran cantidad de linfocitos, células plasmáticas, monocitos y macrófagos con hemosiderina, las células de Kupffer están hiperplásicas y contienen hemosiderina. En los sinusoides también se encuentran pequeños nódulos de células reticuloendoteliales hiperplásicas. Esta hiperplasia puede ser focal, difusa, ligera o muy notoria, de acuerdo con los diferentes estados de la enfermedad. Las áreas portales están fuertemente infiltradas por linfocitos, monocitos y a veces por macrófagos con hemosiderina. Durante las formas agudas y subagudas de la Anemia Infecciosa Equina la pu Ipa roja del bazo permanece hemorrágica, congestionada y muy aumentada de volumen; este aumento se debe a la hiperplasia de las células reticuloendoteliales, a la infiltración de la sinusoides y de los cordones de Bilroth con células mononucleares. En los corpúsculos de Malpighi que están constituidos por linfoblastos y células reticulares, especialmente abundantes alrededor de las arterias centrales, se observa eritrofagocitosis y muestran reducción de su tamaño. Algunos investigadores consideran que la presencia de hemosiderina está disminuida, mientras que otros sostienen que es muy prominente. En la forma crónica también hay hiperplasia de las células linforreticulares, especialmente en los cordones de Bilroth y alrededor de las arterias centrales. La hemosiderina se halla presente en los macrófagos pero no está aumentada. Los cambios microscópicos de los ganglios linfáticos son similares a los del bazo; los riñones presentan infiltración mononuclear del tejido intersticial de las zonas· cortical y medular, principalmente alrededor de los vasos sanguíneos y glomérulos. Es frecuente observar glomerulitis, la cual se manifiesta por aumento anormal de las células debido a proliferación endotelial y por adhesión de las láminas visceral y parietal de la cápsula de Bowman. En la fase crónica los riñones muestran considerable infiltración linfoide del tejido intersticial y de las arteriolas. Se ha reportado miocarditis intersticial en las formas aguda y subaguda, menos frecuente en la forma crónica. La miocarditis se caracteriza por infiltración focal de células mononucleares a lo largo de los vasos sangu ineos y, puede haber degeneración hialina y granular de las fibras cardiacas. Algunos autores coinciden en que las lesiones más comunes de la medula ósea son hemorragia, edema y hemosiderosis en las formas aguda y subaguda, e hiperplasia hematopoyética en la forma crónica. Sin embargo, difieren notablemente en cuanto a la disminución o aumento de los '4. •.
(20) elementos celulares como también sobre eritropoyesis y granulopoyesis. Es así como varios de los investigadores encontraron disminución de los normoblastos obtenidos por punción de la medula ósea en caballos infectados, mientras que otros autores conceptúan que los normoblastos se encuen tran en proporciones normales. Las células reticulares están aumentadas en número; algunos autores reportan aumento de los elementos mieloides, eritropoyesis y granulopoyesis y otros, disminución de estos elementos. Los cambios patológicos que se presentan en el sistema nervioso central en animales infectados con Anemia Infecciosa, han sido estudiados en Alemania y Japón y más recientemente en los Estados Unidos. Las lesiones que se encuentran corresponden a una meningoencefalomielitis y son consideradas como una extensión de la reacción general del organismo hacia la enfermedad y no como una manifestación de neurotropismo viral específico. La lesión predominante es una infiltración perivascular por células mononucleares en las meninges y tejido nervioso del cerebro y de la medula espinal. Se ha reportado también una infiltración mononuclear focal o difusa subependimal, que incluye linfocitos y células de microglia, denominada Ependimitis Granular. Algunas de las lesiones focales subependimales presentan gran celularidad con infiltración de linfocitos, macrófagos y proliferación de varios elementos g/iales, que recibe el nombre de Granuloma Ependimal. En el ganglio de Gasser se ha observado infiltración de linfocitos e histiocitos con o sin implicación del tejido nervioso. Además de las lesiones descritas, se ha reportado degeneración y corpúsculos de inclusión en las células de Purkinge y múltiples áreas pequeñas de necrosis de licuefacción, hiperemia, hemorragia y edema en el cerebro. Infiltraciones focales mononucleares y cambios degenerativos y prohferativos se han encontrado en los pulmones, ovarios, testículos y glándulas endocrinas. Se han realizado numerosos estudios hematol6gicos de la Anemia Infecciosa Equina, que muestran grandes discrepancias, debido tal vez, a las fluctuaciones de los valores sanguíneos durante las diferentes formas de la enfermedad y posiblemente por la presencia de otras entidades patológicas simultáneas con la afección. En t,odas las fases se presenta anemia severa durante y después de los ataques febriles, con marcado descenso en tiempo realmente corto del número de eritrocitos por millmetro cúbico. Esta anemia es debida posiblemente a la combinación de varios factores como hemorragia ósea, aumento de la eritrofagocitosis y a la presencia probable de una sustancia indeterminada que ha sido detectada en el suero sangu Ineo de caballos infectados. Parece que ésta actúa sobre los nervios vasomotores y hace que los eritrocitos sean retenidos en los vasos sanguíneos de los órganos internos. Se habla de otras alteraciones hematológicas en esta enfermedad y es así como durante los primeros ataques febriles agudos, hay leucopenia que afecta principalmente los linfocitos, que da la impresión de 15.
(21) ). J que existe una neu trofilia relativa. A medida que la enfermedad progresa hacia la forma crónica, se invierten estos valores y entonces se observa linfocitosis constante (11). Simultáneamente con la anemia, se presenta una monocitosis que oscila del 12 al 15 por ciento. En el torrente circulatorio de animales con síntomas marcados, se detecta por largo tiempo la presencia de siderosilos que son células macrófagas cargadas de hemosiderina a las cuales algunos au tares, especialmente en el Japón, dan cierto valor diagnóstico. Los valores de hematocrito descienden durante los ataques febriles, especialmente en las fases aguda y subaguda. El control y er.adicación de la Anemia Infecciosa Equina en el mundo ha sido dificil debido a la falta de métodos seguros y e,pecíficos para su diagnóstico. El reconocimiento de la enfermedad se ha basado casi exclusivamente en los síntomas clínicos, pero como estos varían de acuerdo con la evolución, el diagnóstico clínico presenta fallas, es inseguro y de valor relativo. Es necesario recurrir a métodos más confiables y es así como en las últimas décadas se han desarrollado nuevas técnicas serológicas, hematológicas, clínicas, químicas e histopatológicas. Estos nuevos sistemas incluyen pruebas de fijación de complemento. hemoaglutinación, anticuerpos Ouorescentes, neutralización . demostración de hemolisinas, sustancias no específicas en la sangre y pruebas alérgicas. También se han empleado otros métodos de diagnóstico como la presencia de petequias sublinguales y nasales, estudios histopatológicos de biopsias de hígado, bazo y medula ósea, demostración de sideroleucocitos en la sangre y más recientemente la prueba de la precipitina. 9. PRUEBAS DE LABORATORIO PARA DIAGNOSTICAR ANEMIA INFECCIOSA EQUINA Debido a que las formas de presentación c1(nica de la Anemia Infecciosa Equina son muy variables y además a que la enfermedad persiste en ausencia de signos clínicos, se han ensayado varias pruebas en el laboratorio y otras en forma experimental con el fin de llegar a un diagnóstico seguro. Se describe a continuación cada una de las pruebas desarrolladas hasta ahora, así como también se hacen algunos comentarios a cada una de ellas. 9. \. Hemograma. La primera prueba utilizada para diagnosticar la Anemia Infecciosa Equina fue la del hemograma; se daba el caso como positivo cuando los síntomas cHnicos eran asociados a los resultados de laboratorio, en donde los glóbulos rojos daban un promedio de 2 a 2.5 millones por mL. La experiencia ha demostrado que esta prueba no es segura como diagnóstico de la enfermedad, ya que hay otros agentes patológicos que producen una 16.
(22) anemia muy similar al cuadro presentado por la AlE; hoy día tal prueba se ha abandonado como diagnóstiw de la enfermedad. Algunos autores están de acuerdo en que los cambios hematológicos aunque no son patonogmónicos de la enfermedad, sí podrían dar alguna luz en el diagnóstic~ si se hace un estudio sistemático y repetido del caso, es decir, SI se efectuan hemogramas diarios wn el fin de observar las variaciones O la forma como se está presentando la anemia. En general la anemia se empieza a observar desde el primer día de fiebre, y el hematocrito continúa descendiendo mientras haya temperatura anormal y puede persistir de cuatro a cinco d ras despu~s de que la temperatura ha vuelto a su punto normal, momento en el cual el hematocrito vuelve a ascender. pero sin llegar a los IlIveles originales. La anemia de los caballos con AlE es normocítka-normocrómica. La hcmólisis es rara, se presenta en aquellos casos en los ~uales la enfermedad es de curso sobreagudo (6). 9.2. Autohemoaglutinación. Otra prueba hem"tica que se ha usado para el diagnóstico de la AlE es la aUlOhemoaglutinadón de los eritrocitos que se conoce en '" práctIca como Prueba del Plato: ésta consiste en colocar en un plato o una lámina un poco de sangre del animal en!"ermo. En caso de AnemIa Infecciosa Equina, los hematíes tralan de aglutinarse y el suero corre libremenk por entre los grumos que se han formado. La positividad de esta prueba no tiene mucho val"l diagnóstico; sirve para tener una sospecha de la enfermedad, porque se sabe que los glóbulos rojos especialmente de los equinos, se pueden autoaglutinar fuera de los vasos. sanguíneos (6).. 9,3. Prueba de la. elucidad de Sedimenta ión. Olrn prueba hemjtl.:3 u~dd para L1iar.noSll~'3r eSla enkrmcdJd es la vdo.;idall .le Id sed.lmentacl6n De ésta <1.' han usado tres técnicas. la de Ce!tllri, la d.e T1úcry-Goret y la de Westergrccn (61.. _1 Tticlllcu d~ e"m,i La tccnio'J! de CCS.lrJ da do~ resull.IUO'. por un. parle, indice de -,(1.IImenl.lclon que sc~.un cM. técniCl normJhnentc es ¡k 50 PI". ~l. (JcnlO mlcntra. que en el .alallo J"cclado de Amm1la InfeCCIOsa tequmll rued~ .Ilcan7.3r '10. 80 ~ 90 por CIento, lo que qU,lere ,Icel. que la ",um1cnlación es ca. I ,.mplet.l ...l filial de los pnmeros ,remLJ mlllutu>U utro dato que sumlOi'tr;l la t':c"i~.1 de (CSiln e\ el (",he.: volumétnco, que da unu Ide;¡ ca'l p.e .. a dd I1Ulllcr" Ú~ hematie pur lO1iimclUl ,ÜbICO y al mi'lI1<l tiempo el grado de anemia preo;enlc. Este dalo ':' d~ OJO,¡ ,0.50 par. ""b.Illo\ <IIno\ y ~n los cnkrm~'''' .le An~n1Ía lnfcccl0S<1 I::qum~ ,,\1;\ pur d~baJu d~ 30; pu~tlc l1~ar ha\(¡( 0. 15 o menos ( 6 ).. °. 17.
(23) .2. Técnica de Thiery y Goret. Esta técnica permite una lectura rápida y directa de la sedimentación. En los caballos normales estos valores están entre el cinco y el ocho por ciento, pero en caballos anémicos este resultado puede variar del 15 al 30 y hasta el 50 por ciento. Goret et al (6) han desarrollado otra técnica para medir la sedimentación globular. En esta técnica, la lectura se hace primero a los 10 minutos, al mismo tiempo que permite una apreciación de la viscosidad del plasma en porcentajes. La segunda lectura, a los 30 minutos, permite apreciar el volumen globular correspondiente a la sangre total. .3. Técnica de Westergreen. Esta prueba se usa corrientemente en medicina humana. Por medio de ella se obtienen valores para equinos normales, de 7 mm a los 10 minutos y de 26 mm a los 20 minutos. Es de anotar que estos valores que se dan aquí, nunca se han visto incluso en animales normales, pues siempre se han encontrado sedimentaciones bastante altas a los 20 minutos, lo que precisamente ayuda a obtener los leucocitos en cultivos de estas células. En casos agudos y sobreagudos de anemia, esta sedimentación es de 25 a 30 mm en 10 minutos y de 70 a 90 mm en 20 minutos. La interpretación diagnóstica de las pruebas de sedimentación no es específica, ya que la rata de sedimentación puede estar aumentada en otras afecciones como sucede en la gurma, neumonía contagiosa, supuraciones y en todas las anemias por hematozoarios. Además, el coeficiente de sedimentación no se modifica en las formas crónicas de la anemia Infecciosa Equina o en las formas inaparentes de la misma (6). 9.4. Hematocrito. Otra prueba utilizada para diagnosticar esta enfermedad es el hematocrito. Usando el hematocrito de Wintrobe o el microhematocrito y centrifugando a 3.000 rpm se puede conocer rápidamente el porcentaje de elementos figurados para la sangre total, el cual es de 40 por ciento para el caballo normal. Disminuye en casos de enfermedad por debajo del 25 por ciento y puede llegar hasta el 7 por ciento. La disminución no se nota en los periodos en los cuales la Anemia Infecciosa Equina cede en intensidad (6). Esta prueba como las anteriores, tampoco permite hacer la diferenciación de anemias producidas por hematozoarios u otras causas. También se ha usado para diagnóstico la fórmula leucocitaria pero tampoco tiene mucho valor diagnóstico. 9.5. Investigación de los Cuerpos de Heinz. . Los cuerpos de Heinz son granulaciones de más o men.0s una mIcra de diámetro, redondeadas, poco numerosas, visibles por ~edlO de. co~orantes vitales en el interior de los hematíes, especialmente haCia la penfena de los mismos. h 11 En la Anemia Infecciosa aguda se consideran como sospec osos a,que os casos donde se encuentran de 30 a 50 cuerpos por cada 100 hematles; por 18.
(24) encima de 50 se consideran como positivos. Por debajo de 30, negativos (6). 9.6. Investigación de los Siderocitos. En animales con Anemia Infecciosa Equina, se encuentran elementos sanguíneos de la línea blanca tales como neutrófilos, monocitos y macrófagos que tienen como característica común la presencia de hemosiderina en el citoplasma. Estas formas han sido llamadas Siderocitos o Sideroleucocitos. En el animal sano se encuentran muy pocos de estos elementos, pero en anemias de tipo hemolítico, se aumenta el número de Sideroleucocitos. La hemosiderosis (inclusiones de hierro) que llega a ser característica en el hígado y el bazo se debe a la acumulación de sideroleucocitos que han sido fagocitados. Según Abara y Tabuchi, citado por Ishitani (11), la concentración de hierro se empieza a incrementar en el hígado desde las primeras manifestaciones clínicas de la AlE. La técnica se basa en la tinción de las inclusiones con colorantes especiales. Una prueba se considera positiva cuando se encuentran siete o más siderocitos por cada 100.000 leucocitos, según algunos autores; para otros, el criterio para dar un resultado positivo es la presencia de 40 o más siderocitos por cada 100.000 leucocitos. La especificidad de esta prueba no es absoluta, ya que es posible encontrar un pequeño número de siderocitos en la sangre periférica de animales que están afectados por babesiosis o tripanosomiasis; pero según Goret et al (6), en estas enfermedades nunca será tan alto el número de siderocitos como en los casos de Anemia Infecciosa Equina. Una prueba positiva solamente sirve para tener una idea de la presencia de la enfermedad, porque entre las crisis el número de siderocitos disminuye lentamente hasta llegar a desaparecer por completo, por tanto estas células no se encuentran en enfermos latentes. 9.7. Pruebas Serológicas. Se dividen en dos grupos: no específicas y específicas. 9.7.1. Pruebas no Específicas. Entre las pruebas no específicas las más importantes son: .1. Prueba de Mclagan (6). Esta prueba se basa en la presencia de turbidez en una solución tamponada de timol de pH 7.8, cuando se adiciona una gota de suero sospechoso de Anemia Infecciosa Equina. Esta prueba se lee en un espectrofotómetro o colorímetro. En un caballo normal, las cifras varían entre 7 y 11; en un caballo afectado de Anemia Infecciosa Equina son más altas. 19.
(25) .2. Reacción de Hanger para el Colesterol (6). La reacción de Hanger para la Cefalina-Colesterol se basa en la presencia de una floculación producida en el suero por una solución stock de cefalina colesterol. Si se presenta floculación total con líquido sobrenadante claro, indica una reacción positiva . .3. Reacción de Bennet-Fulton (6). Consiste en la aparición de turbidez y precipitado, cuando se agrega suero equino infectado con Anemia [nrecciosa Equina a una solución de bicloruro de mercurio al 1:20.000 hasta [: 100.000. La presencia de turbidez o precipitado hasta las diluciones 1: 50.000 es considerada sin ningún significado. Se consideran reacciones sospechosas entre 1:50.000 hasta 1:60.000 y pOSitivas cuando hay presencia de turbidez y precipitación de esta dilución en adelan te . . 4. Reacción del Formol-Leucogelificación (6). La prueba del Formol-Leucogelificación o Reacción de Gates y Papacostas, se basa en la presencia de opacidad y, coagulación del suero sospechoso de Anemia Infecciosa Equina cuando se agrega formalina comercial a un centímetro cúbico del mismo . .5. Prueba de la Dehidrogenasa Láctica. Esta se realiza también con el suero y se basa en un aumento de esta enzima en los casos de Anemia. En el caballo sano se encuentra un promedio de 330 unidades por centímetro cúbico de suero. En el animal infectado de Anemia [nfecciosa Equina la cantidad de Dehidrogenasa láctica puede llegar desde 2.000 hasta 20.000 unidades en el curso de una crisis. Cuando la crisis pasa, la enzima vuelve a los niveles normales. Como se ve, esta prueba no sirve para detectar los portadores crónicos o aquellos animales cuya crisis ha pasado. Todas las reacciones anteriores como su nombre lo indica, son pruebas inespecíficas, porque varias de ellas son positivas en ciertas afecciones, hepáticas y otras enfermedades, habiendo necesidad de combinar los resultados de estas pruebas y el examen cllnico además de otros ensayos como en el caso de los hemoparásitos. 9.7.2. Pruebas Específicas. Las pruebas serológicas específicas son: .1. Prueba de Fijación del.Complemento. Esta prueba fue iniciada por Altara, Serra y Guannl, al utIlizar como antígeno, bazo tratado con alcohol. Luego K~no y Kobayashi (17, 18) la aplicaron nuevamente, pero Usaron como antlgeno, VITUS cultIvado en leucocitos. Los resultados que obtuvieron los pnmeros autores fueron muy imprecisos. En la actualidad se encuentra práctIcamente abandonada, debido a la falta de especificidad de la misma. 20.
(26) Kono y Kobayashi emplearon sueros de animales infectados y sanos; los resultados fueron positivos en animales infectados y negativos en los controles; basados en estas pruebas concluyeron que la técnica era específica para la Anemia Infecciosa Equina. El problema con esta prueba radica en que los anticuerpos fijadores del complemento, no se sabe exactamente cuando aparecen en el animal infectado, así como pueden aparecer a los 1S días, pueden hacerlo hasta los 2S días; además, la duración de la presencia de los anticuerpos es muy incierta, ya que desaparecen rápidamente del torrente circulatorio, persistiendo solo dos o tres días después de su aparición y no se vuelve a detectar nunca más aún después de hacer otra inoculación del mismo virus utilizado. Por las razones expuestas, eón esta prueba no se pueden detectar los portadores en el campo; además, la experiencia que se tiene con esta prueba indica que los resultados son muy inconstantes, lo que no permite tener confianza en los datos que se obtienen.. (. .2. Prueba de la SeroneutralizaciÓn.Esta prueba ha dado buenos resultados para detectar portadores, ya que los anticuerpos neulralizantes aparecen aproximadamente un mes después del primer acceso febril; no obstante, debido a diferencias antigénicas, se pueden presentar casos en los cuales los anticuerpos neutralizantes de \ln determinado caso no neutralicen el virus para el cual se prueban los anticuerpos . .3. Prueba de la liemoaglutinaciÓn Pasiva o Condicionada. La prueba de la hemoaglutinación pasiva o condicionada ha sido usada con glóbulos rojos de ratón, los cuales se cree que se combinan con la fracción globulínica 19S proveniente del suero de un animal infectado con Anemia Infecciosa Equina. En esta prueba, primero se sensibilizan los glóbulos y luego se enfrentan al suero del animal problema, previamente inactivado a 56 grados centígrados por 30 minutos. Si el virus está presente en el suero, se producirá una aglutinación de los glóbulos . .4. Prueba de los Anticuerpos Fluorescenres. Esta técnica también ha sido utilizada para el diagnóstico de la enfermedad. Se basa en cultivos de leucocitos del animal sospechoso, coloreados con conjugados fluorescentes. La misma técnica ha sido utilizada para diagnóstico postmorten con excelentes resultados (9). Esta prueba tiene algunos inconvenientes: los leucocitos de algunos animales no se pueden cultivar, ya que se degeneran rápidamente cuando se trata de hacerlos crecer in vitro y para esta técnica se requiere que el leucocito sobreviva al menos durante cinco días. Además, cuando el animal tiene hipertermia aunque solo sea de un grado Fahrenheit, los leucocitos tampoco se pueden cultivar in vitro. El cultivo solo se puede hacer hasta dos días después de que la fiebre ha desaparecido (9). 21.
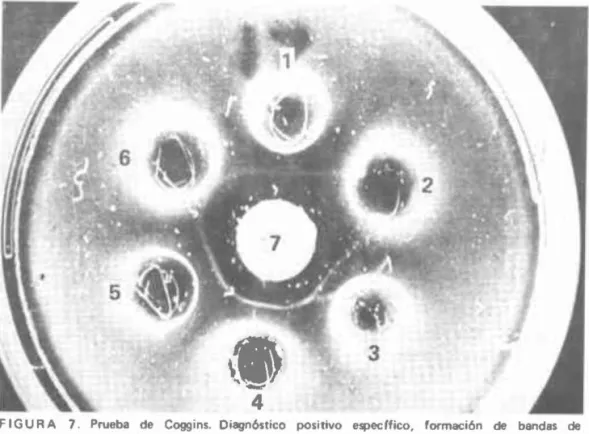
(27) Algunas veces es diffcil obtener un buen conjugado para trabajar, debido a que éste se prepara a partir del suero de un caballo que ha resistido varios ataques y varias inoculaciones del virus patógeno (9) .. .5. Reacciones de Precipitación. Las reacciones de precipitación fueron iniciadas por Saxer en Venezuela -citado por Coggins y Norcross (2)- quien hizo los primeros estudios usando como material antigénico páncreas de equino infectado, pero los resultados no fueron muy satisfactorios, además tampoco menciona cuándo tomó este material para la prueba. Luego Moore (21, 22) desarrolló lo qll" se llamó la Prueba de las precipitinas. Para verificar esta prueba se dec ía que en los animales infectados con Anemia Infecciosa Equina, aparece en la sangre una proteína anormal. También es posible obtener esta proteína en los cultivos de leucocitos inoculados con el virus de AlE en cuestión, o en cultivos de las mismas células provenientes de animales infectados.. •. •. •. J. Se preparó un anticuerpo precipitante al inmunizar conejos y cabras con la proteína anormal ; se presum ía que ésta absorbía los glóbulos rojos de los animales infectados y que estaba en el sobrenadan te de los cultivos de leucocitos infectados. Moore dijo que cuando este anticuerpo reaccionaba con suero proveniente de un animal infectado y a ciertos intervalos de tiempo, se presentaba una precipitación que variaba de acuerdo con la severidad del caso. Más tarde se demostró que esta prueba era inespecífica , ya que se presentaban reacciones positivas en sueros de animales sanos ; por tal motivo se abandonó la reacción .. .6. Prueba de la Inmunudifusió/J O Prueba de Coggins. Es la prueba más moderna de diagnóstico. En 1969, Coggins y Norcross (2) desarrolló una prueba para el diagnóstico de la enfermedad, que se basa en la técnica de la inmunodifusión. Utilizó para ello antígeno preparado en caballo. para lo cual usó el bazo de un animal infectado que había desarrollado la enfermedad en forma sobreaguda. En esta prueba el material empleado para el diagnóstico es suero sanguíneo. Los anticuerpos precipitantes aparecen a partir del día 16 después de que el animal ha sido infectado y persisten por tiempo indefinido. Se conoce el caso de un animal infectado que dió reacción fuertemente positiva siete años después. La reacción se puede leer 24 horas después de montada y en casos de ser negativa en este tiempo, la lectura se hace nuevamente a las 48 horas. La prueba se ha enfren tado a antisueros de otras enfermedades que se encuentran normalmente en el caballo y no ha dado ninguna reacción cruzada con ellas; esto garantiza su especificidad (Figura 7). 22. J.
(28) l. FIGURA. 7. Prueba de Coggins.Oiagn6stico positivo especffico, formación de bandas de. precipitaci6n. 1. 3, 5 control positivo. 2 Diagn6stico negativo. 4 Diagnóstico positivo. 6 Diagn6stico sospechoso, 7 Ant/geno.. 10. MUESTRAS PARA EL LABORATORIO La Anemia Infecciosa Equina se puede diagnosticar en el laboratorio principalmente por los métodos histopatológico y serológico. El método histopatológico, es utilizado en los animales que mueren por sospecha de haber padecido la enfermedad. Para este tipo de exámenes se debe enviar al laboratorio de diagnóstico pequeilas porciones de bazo, hígado, riñones, corazón y ganglios linfáticos, conservadas en formol al 10 por ciento. Para el diagnóstico serológico, es necesario enviar rápidamente, al laboratorio del ICA, mínimo 10 mL. de sangre completa, recogida en forma acéptica y sin anticoagulante. Las muestras deben ser tomadas por el Médico Veterinario, y debidamente identificadas y empacadas se remitirán al laboratorio, acompañadas de la historia del caso, lo más completa posible. Es necesario tener en cuenta que si la muestra de sangre se toma durante el acceso febril, es posible que el resultado sea negativo por que puede ser el primer ataque que padece el animal, por lo cual no se detectan los 23.
(29) anticuerpos, ya que como se dijo en otra parte de este boletín, éstos solo aparecen después del décimo sexto día de infectado el animal. En estos casos se recomienda tomar una segunda muestra 20 días después de iniciado el acceso febril y otra 30 días después del mismo. Cuando se encuentre un resultado positivo en la muestra tomada durante la fase febril indica que el animal se infectó tiempo atrás y que los ataques anteriores pasaron desapercibidos razón por la cual se detectan los anticuerpos respectivos en la sangre. Las consultas al respecto se deben dirigir al Laboratorio de Investigaciones Médicas Veterinarias (LlMV) del ICA en Bogotá o al Centro de Diagnóstico dellCA en Medellín, en donde serán resueltas.. 11. RECOMENDACIONES GENERALES SOBRE CONTROL El virus de la Anemia Infecciosa Equina es transmitido por la picadura de mosquitos (Anopheles, PsorophoraJ y otros insectos hematófagos como Slomoxys calcitrans (mosca de los establos) y tábanos. La AlE también se puede transmitir mecánicamente por pequeñas cantidades de sangre que de caballos infectados pasan a caballos sanos a través de instrumental o equipo contaminado como bisturíes, pinzas, agujas hipodérmicas sin esterilizar y agujas para tatuaje, tijeras para balonar, dientes de almohazas o de cualquier elemento para alisar o cortar el pelo o la crin de los caballos; descalladorcs, escofinas, etc, durante la ejecución de las diversas prácticas de manejo de los equinos ejecutadas en serie, tales como castración , vacunación, marcas, tatuajes, arreglo del casco para el herraje, etc. La enfermedad también se puede transmitir a través de atalajes y arneses contaminados (sillas, jaquimones, cinchas, pretales, baticolas, enjalmas, bocado del freno, etc.) o por las espuelas utilizadas por los jinetes para aguijonear los caballos. Como anteriormente se anotó, pequeñísimas cantidades de sangre infectada son suficientes para transmitir la Anemia Infecciosa a otros equinos sanos. Cualquiera de los elementos cortopunzantcs antes mencionados pueden estar impregnados de sangre infectada y mecánicamente transmitir la enfermedad de un animal a otro si prevIamente no han sido esterilizados . . La sangre infectada aunque esté seca pero protegida de la luz solar, conserva su poder infectante durante varios meses. Las transfusiones y la hemoterapia son medios altamente eficaces en la transmisión de la Anemia Infecciosa Equina. Es de advertir que la enfermedad no se transmite por simple contacto directo. Las siguientes medidas profilácticas se recomiendan para controlar la AlE: \. Evitar el uso de atalajes o arneses que por defectos en su construcción produzcan depilaciones, laceraciones o heridas en la piel y otros tejidos incluyendo las mucosas. 24. • •.
(30) 2. Evitar el uso en común para distintos animales de aquellos atalajes y arneses defectuosos. 3. No trabajar caballos con heridas, úlceras o laceraciones. 4. Evitar las prácticas colectivas de castración, vacunación, etc. En caso necesario, tomar las medidas indispensables para la desinfección y esterilización del equipo e instrumental quirúrgico que se utilice. 5. Tener especial cuidado durante las vacunaciones, en las cuales se debe utilizar una aguja lavada, limpia y estéril para cada animal. 6: Evitar el uso de las transfusiones y la hemoterapia, a menos que se identifique el caballo donador como libre de la enfermedad. 7. Recoger las camas usadas y materias fecales de los caballos y depositarlas en estercoleros a prueba de insectos. 8. Desinfectar periódicamente las paredes de las pesebreras y caballerizas con formol y tratarlas también con aspersiones de insecticidas como el DDT. 9. Tratar los caballos periódicamente cada 15 ó 20 dCas con aspersiones de insecticidas, preferiblemente con los siguientes productos: Lindane al 0.06 por ciento (en Ethion al 1:400 (en Gamatox al 1:800 (en Coopertox al I : 200 (en Dursban al I :600 (en. aspersión) aspersión) aspersión) aspersión) aspersión). 10. Detectar la enfermedad mediante exámenes clCnicos y de laboratorio, para eliminar los animales portadores, con el fin de evitar la transmisión a otros sanos, pues hasta la fecha no se han encontrado ni vacuna ni tratamiento curativo para la Anemia Infecciosa Equina. t 2. BIBLlOGRAFIA 1. BlOOO, O.C. and HENDERSON. 1961. Veterinarv Medicine 2nd. Editioo. The Williams and Wilkins Co. BBltimore. pp. 559·562. 2. COGGINS. L. and N.L. NORCROSS. 1970. Inmunodiffusion' Reaction in Equine Infectious Anemia. Cornell Vet.60:330-334. 3. ----; N.L NORCROSS and S.A. NUSBAUN. 1972. Diagnosis of Equine Infectious Anemia bv Inmunodiffusion test. Am. Jour Veto Res. 33:11·18.. 25.
(31) 4. DIERCE. K.R. and E.L. STARR. 1966. Correlation of Pathology and Precipitin test results in Horses Experimentally or Naturally Infected with Equine Infectious AnemIa. The Southwestern Veterinarian. 19: 223·231 5. DITCHFIELD, W. J B. 1969. Equine Infectious Anemia: Clrculating tissue antigens in Normal and Infected Horses. Am Jour. Veto Med. Assoc. 155:349-351. 6 . GORET. P.; M. CLAUOE el. T. BERNARD. 1968. L'anemie Infectieuse des Equides IMalladie de Vallée) pp. 117·131. 7. HAGAN. W.A. and D.W. BRUNER. 1961. The Infectious Diseases of Domestic Animals. 4th. Ed. Comstock Publishing Associates. Cornell University Press. Ithaca, N.Y. pp. 939-944.. 8. HENSON. J.B.: J.R. GORHAM; K. KOBAYASHI and J.C. McGUIAE. 1969. Inmunity in Equine Infectious Anemia. Jour. Am. Veto Med Assoc. 155:336·343. 9. HINCAPIE, O. 1971. Detection of Equine Infectious Anemia Virus by Inmunofluorescente in Leucocyte cultures from Infected Horses. CorneU Univenity . Tesis. 10. ISHIL, S. 1963. Equine Infectious Anemia or Samp Fever. Adv . in Veto Sci. 8:263-298. 11. ISHITANI, A. 1970. Equine Infectious Anemia. Mat. Inst. Anim. Hlth. Ouart. 10: 1-28. 12. JUBO. K.V.F. and P.C . KENNEDY. 1963. Prest. N.Y. 1:239-244.. Path~ogy 01. Oomestic Animals. 1st. Ed. Academic. 13. KOBAYASHI, K. 1961. Propagation of the virus of EIA in horse leucocvte culture. 111 Virus " :249.. 14. ----, and Y. KONO. 1962. Propagation of several strains of eqUlne Inlectious Anemia in Horse Leucocvte culture. Jap. J. Veto Sci. 24:376. 15 . ----o 1967. Serial passages of Equine Infectious Anemia Virus in Horse ltucocyte culture. Nat. Inst. Anim Hlth. Quart. 7: 1·7. 16. - ---o 1967. Propagatlon and titratlon of Equine Infectiou$ Anemia Virus in horse leucocyte culture. Nat. Inst. Anim. Hlth. Quart. 7:8-20 17. KONO , Y. and KOBAYASHI, E, 1966. COlTlplement Fixation TeS[ of Equine Infectious Anemia. 1. Specificitv of the Test Nat. Ins1. Anim. Hlth. Quart. 6:194-203. 18. ----o 1969. Viremie and Inmunological Responses in Horses infected with Equine Infectious Anemia Virus. Nat . Inst. Anim. HJth . Quart. 7:138. 19. LlVINGSTON, Jr., C.W.; R.W. MOORE and H.E.A. REOMOND. 1966. Diagnostic precipitin Test for Equine Infectious Anemia, Southw. Veto 19:221-222. 20. MOORE, R.W.; C.W, LlVINGSTON and H.E. REDMONO. 1966. Studies on Equine Infectious Anemia. I Studies o( A Precipitin Test for Equlne tnfectious Anemia. Southw, Vet. 19:187-190. 21. ----o 1966. Equine Infectious Anemia: IV. Nature of the Precipitinogen Found in Horses with Equine Infectious Anemia . Southw. Veto 19:217. 22. ----o 1969. The Inmunologic Properties Associated with Equine Infectlous Anemia : Aecent Findings. Am. Jour. Veto Med . Assoc. 155:331-335. 23. ----; H.E. REDMOND; M. KATAOA and M. WALLACE. 1970. Growth of Equine Infectious Anemia Virus in a ContinuoU$ Passage HOrse leucocyte Culture . Am . Jour. Vet o Res. 37:1569·1575.. 26.
(32) 24. - - - , M. KATAOA and H.E. REOMONO.1970.A Method lor the continuous culture of periferial horse leucocvtes. Amer. Jour. Veto Res. 31:463-468.. 25. MORALES, e.E. 1953. Anemia Infecciosa Equina en Colombia. Re\!. Fac. Med. Ver. Zootec. Bogot~.. pp. 147-170.. 26. MOREMAN, D.E. and H.A. SMITH. 1966. Review of Equine Infectious. Anemia. The Southw Ve!. No. 19.-183-186. 27. NAKAJIMA. H.Y., KONO and C. USHIMI. 1971. Characterrzation of Preclpitating Antibody in Equina Infectious Anemia. J. Imm. 107:889-894. 28.. , 29.. - - - - and C. USHIMI. 1971. Inmunodiffusion of Purified Equine Virus. Inf. Imm. 3:373-377.. ---o. Infectious. AnemIa. 1972. Oetection of Precipitating Antibodv in Equine Infectious Anemia by Concentrated Virus Antlgen. Nat. Inst. Anim. Hlth. Quart. 12:47-53.. 30. RUNNELLS. R.A .. N.S. MONLUX and A.W .. MONLUX. 1960. Principies 01 Vere,ina,y Pathology. 6th. Ed. The lowa State Universitv Press. Ames,lowa. pp. 378-379. 31. RUSSEL, L.H. Jr, C.w. LlVINGSTON, Jr.; R.W. MOORE and J.N. BEASLEY. 1966. Equine Infectious Anemia. 11. Evaluation of a Precipitln Test. The Southw. Veto 19:192-206.. 32. SCHALM. O.W. 1965. Veterinarv Hematology. 2nd. Ed. Lea & Febiger. Philadelphia. J98.403. 33. SMITH,. H.A. and T.C. JONES. 1966. Vetermarv Philadelphia. pp. 398-403.. 34.. SQUIRE, R.A. 1968. Equine Diseast. Btoad. 32:157·169.. Infectious. Pathology. 3rd. Anemia:. A. Ed. Lea. pp. Feblger. Model Inmunoproliferati\le. 35. STEIN. C.D. 1963. EQUine Infectious Anemia. Equine Medicine and $urgery . In-Bone. J.F. Catcon. E.J. y colaboradores. 1st. Ed. American Veterinarv Publications lne. Santa Bárbara. California. pp. 147·152. 36. ----o. L.O. MOTT and O,w. GATES. 1955. Some obserllatlons on Carriers of Equine Infectious Anemia Am. Jour. Veto Med. AssQC. 126:277-287.. 27.
(33)
Figure



Documento similar
o esperar la resolución expresa" (artículo 94 de la Ley de procedimiento administrativo). Luego si opta por esperar la resolución expresa, todo queda supeditado a que se
Las características del trabajo con grupos que se debería llevar a cabo en los Servicios Sociales de Atención Primaria (SSAP), en términos de variabilidad o estabilidad
Parece, por ejemplo, que actualmente el consejero más influyente en la White House Office con Clinton es el republicano David Gergen, Communications Director (encargado de la
En cuarto lugar, se establecen unos medios para la actuación de re- fuerzo de la Cohesión (conducción y coordinación de las políticas eco- nómicas nacionales, políticas y acciones
Volviendo a la jurisprudencia del Tribunal de Justicia, conviene recor- dar que, con el tiempo, este órgano se vio en la necesidad de determinar si los actos de los Estados
A partir de los resultados de este análisis en los que la entrevistadora es la protagonista frente a los entrevistados, la información política veraz, que se supone que
En los tiempos
Se repre- sentabasu cacería por ser la época más propicia para ello según los payeses catalanes que creían firmemente hace unos años, que los lobos se casaban en Carnaval y que por