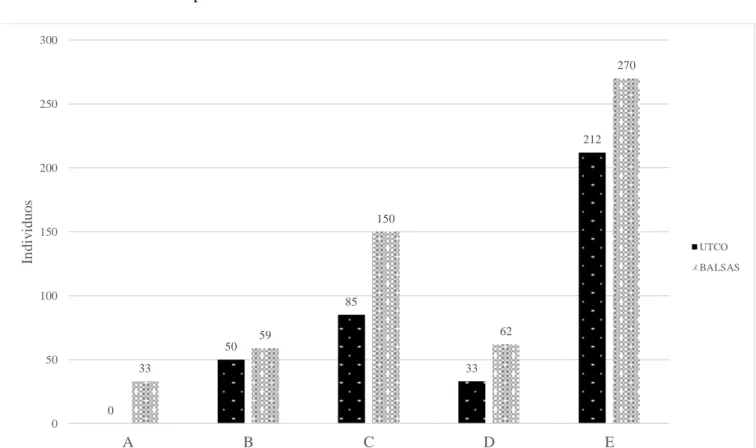
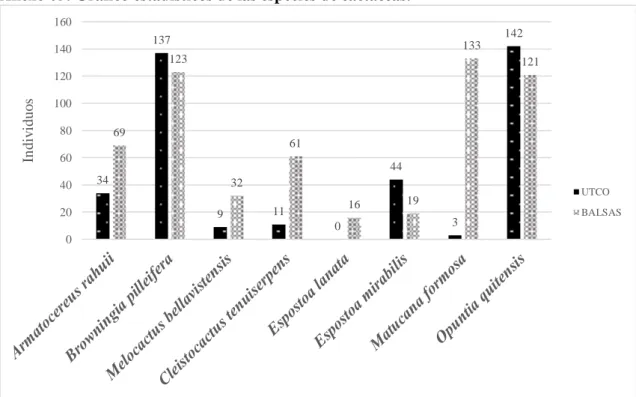
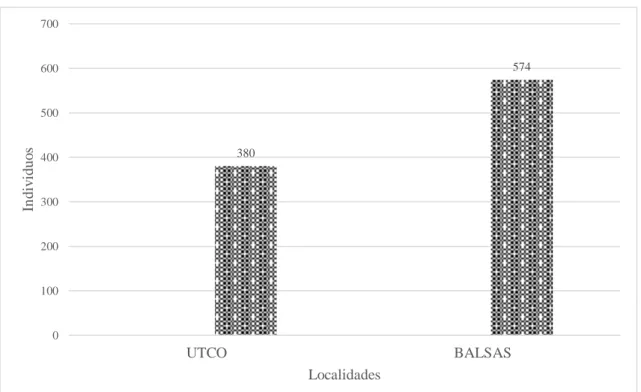
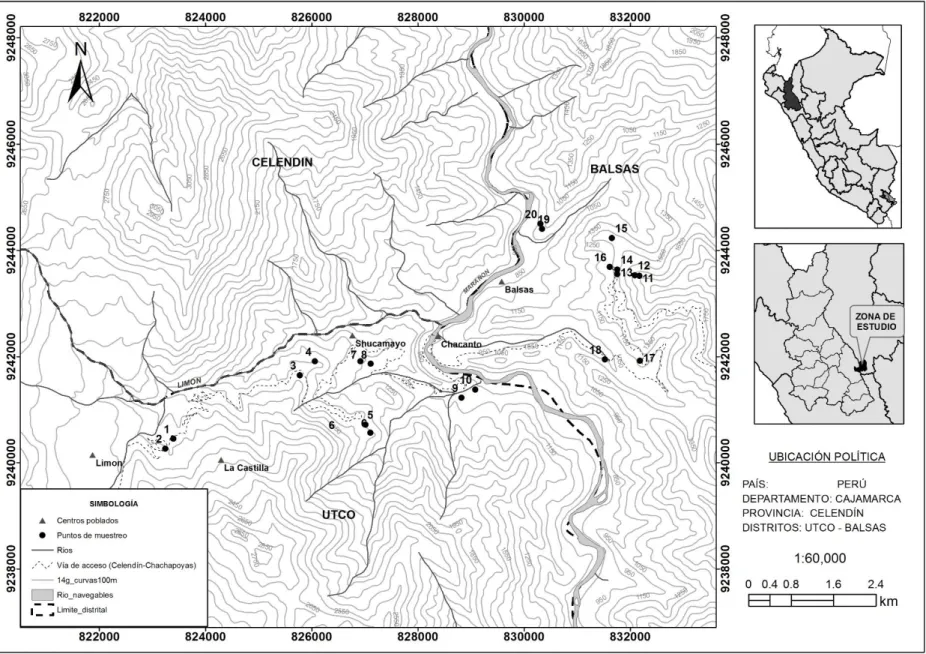
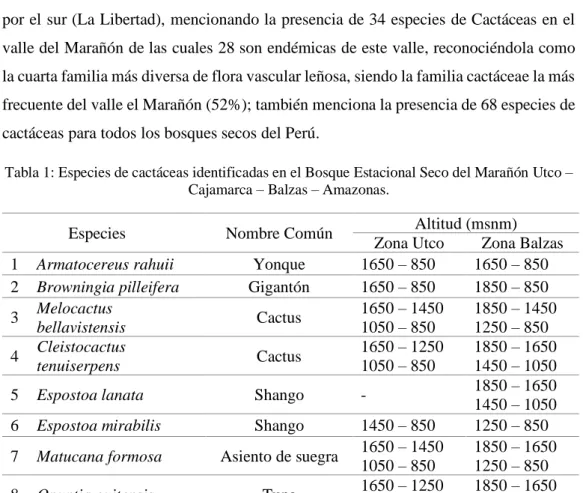
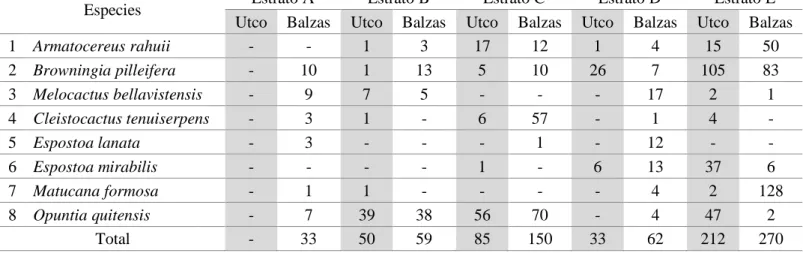
Caracterización de las cactáceas del bosque estacional seco del Marañón, Utco Cajamarca Balzas Amazonas
Texto completo
Figure
Documento similar
En este ensayo de 24 semanas, las exacerbaciones del asma (definidas por el aumento temporal de la dosis administrada de corticosteroide oral durante un mínimo de 3 días) se
En un estudio clínico en niños y adolescentes de 10-24 años de edad con diabetes mellitus tipo 2, 39 pacientes fueron aleatorizados a dapagliflozina 10 mg y 33 a placebo,
• Descripción de los riesgos importantes de enfermedad pulmonar intersticial/neumonitis asociados al uso de trastuzumab deruxtecán. • Descripción de los principales signos
E Clamades andaua sienpre sobre el caua- 11o de madera, y en poco tienpo fue tan lexos, que el no sabia en donde estaña; pero el tomo muy gran esfuergo en si, y pensó yendo assi
[r]
SVP, EXECUTIVE CREATIVE DIRECTOR JACK MORTON
Social Media, Email Marketing, Workflows, Smart CTA’s, Video Marketing. Blog, Social Media, SEO, SEM, Mobile Marketing,
• For patients with severe asthma and who are on oral corticosteroids or for patients with severe asthma and co-morbid moderate-to-severe atopic dermatitis or adults with