UNIVERSIDAD NACIONAL
“PEDRO RUIZ GALLO”
FACULTAD DE AGRONOMÍA
TESIS
“LEPIDOPTEROS DEL FOLLAJE Y
PANOJA EN CINCO VARIEDADES DEL
CULTIVO DE QUINUA (
Chenopodium
quinoa
Willd.) EN LA PARTE BAJA DEL
VALLE CHANCAY - LAMBAYEQUE”
AUTORES:
Bachiller ALAMO SANTAMARIA JULIO CÉSAR
Bachiller MEDINA LA TORRE NOLLY BERLY
ASESOR:
Dr. SAAVEDRA DIAZ JORGE LUIS
LAMBAYEQUE - PERÚ
2
TESIS
“LEPIDOPTEROS DEL FOLLAJE Y PANOJA EN CINCO
VARIEDADES DEL CULTIVO DE QUINUA
(
Chenopodium quinoa
Willd.) EN LA PARTE BAJA DEL
VALLE CHANCAY – LAMBAYEQUE”
PARA OPTAR EL TÍTULO DE:
INGENIERO AGRÓNOMO
Sustentada y aprobada por el siguiente jurado:
ING. M.SC. MANUEL BRAVO CALDERÓN Presidente.
ING. M.SC. GUILLERMO ANTON AMAYA Secretario
Dr. FRANCISCO REGALADO DIAZ Vocal
3
DEDICATORIA
A Dios, mis padres,
hermanos, por su continuo
apoyo.
N. Medina
A mis padres y hermanos, por
confiar en mí y apoyarme
siempre.
4
AGRADECIMIENTO
… Primer lugar siempre a Dios, por guiar nuestro camino,
bendecirnos con fuerza y paciencia, para seguir
Batallando día a día.
A todos los maestros, que han compartido sus conocimientos y
sabiduría durante nuestra formación
profesional.
Nuestro eterno agradecimiento al Doctor Jorge L. Saavedra Díaz, Asesor
del presente trabajo, por sus comentarios y sugerencias en la conducción
de la investigación y revisión del informe.
Al Ingeniero Fernando Montero, Responsable de la EEAVF INIA, por su
apoyo y aportes en la realización de este trabajo;
y al SENASA Lambayeque por la voluntad de
apoyarnos en la investigación.
A nuestros amigos: Kreimer Domínguez, Elmer Linares, Víctor Becerra por
ayudarnos en paralelo a culminar este trabajo.
…A ellos, muchas gracias.
5
ÍNDICE DE CONTENIDO
Pág.
I. INTRODUCCIÓN ...14
II. REVISIÓN LITERARIA ...16
2.1. Sobre el cultivo de quinua ... 16
2.2. Sobre las plagas en el cultivo de quinua... 17
III. MATERIALES Y MÉTODOS ...20
3.1. Ubicación ... 20
3.2. Condiciones climáticas durante el desarrollo del experimento. ... 20
3.3. Características del Área experimental. ... 22
3.4. Métodos ... 24
3.4.1. Metodología para la fase de laboratorio ... 24
3.4.1.1. Obtención y acondicionamiento de las especies encontradas. ... 24
3.4.1.2. Identificación de las especies ... 25
3.4.1.3. Estudio de las principales características morfo – biológicas ... 25
3.4.1.3.1. Para la biología ... 25
3.4.1.3.2. Para la morfología ... 26
3.4.2. Metodología para la fase campo... 27
3.4.2.1. Descripción de variedades de quinua utilizadas ... 27
3.4.2.1.1. Altiplano – INIA ... 27
3.4.2.1.2. Salcedo – INIA ... 27
3.4.2.1.3. Illpa – INIA ... 27
3.4.2.1.4. Pasankalla – INIA ... 28
3.4.2.1.5. Negra Collana – INIA ... 28
3.4.2.2. Fenología de la quinua ... 29
3.4.2.3. Instalación del experimento ... 29
3.4.2.4. Sistema de evaluación ... 30
3.4.2.5. Análisis estadístico ... 30
IV. RESULTADOS Y DISCUSIÓN ...31
4.1. Identificación y ubicación taxonómica de las especies encontradas alimentándose del follaje y panoja ... 31
4.2. Eurysacca melanocampta... 31
4.2.1. Características morfo – biológicas importantes ... 31
6
4.3.1. Características morfo – biológicas importantes ... 45
4.3.1.1. Huevo ... 45
4.4.1. Características morfo – biológicas importantes ... 57
7
4.5.1. Características morfo – biológicas importantes ... 72
4.5.1.1. Huevo ... 72
4.6. Susceptibilidad de 5 variedades de quinua a cada una de las especies de lepidópteros. ... 85
4.6.1. Eurysaccamelanocampta ... 85
4.6.1.1. Fluctuación de la densidad de larvasa través del desarrollo fenológico de la quinua. 85 4.6.1.2. Grado de susceptibilidad de las variedades en estudio. ... 92
4.6.2. Spoladea recurvalis ... 93
4.6.2.1. Fluctuación de la densidad de larvas a través del periodo fenológico. ... 93
4.6.2.2. Grado de susceptibilidad de las variedades en estudio. ... 99
4.6.3. Heliothis spp ... 100
4.6.3.1. Fluctuación de la densidad de larvasa través del desarrollo fenológico de la quinua. 100 4.6.3.2. Grado de susceptibilidad de las variedades en estudio. ... 105
4.6.4. Spodoptera eridania ... 106
4.6.4.1. Fluctuación de la densidad de larvasa través del desarrollo fenológico de la quinua. 106 4.6.4.2. Grado de susceptibilidad de las variedades en estudio. ... 110
V. CONCLUSIONES ... 111
5.1 Eurysacca melanocampta ... 111
5.2 Spoladea recurvalis ... 111
5.3 Heliothis spp. ... 112
5.4 Spodoptera eridania ... 113
5.5 Susceptibilidad de las variedades ... 113
VI. RECOMENDACIONES ... 113
8 VIII. REFERENCIAS BIBLIOGRÁFICAS ... 117
9
ÍNDICE DE CUADROS
Pág.
Cuadro 1. Promedios mensuales de temperatura y humedad relativa, en el laboratorio y en campo; durante el estudio de la morfo - biología de lepidópteros encontrados. Lambayeque, 2014. ... 20
Cuadro 2. Etapas fenológicas del cultivo de quinua (Chenopodium quino Willd.) según la UNALM, 2012. 29 Cuadro 3. Número de órganos evaluados por planta de acuerdo a sus etapas fenológicas ... 30
Cuadro 4. Ubicación taxonómica de las especies de lepidópteros encontradas alimentándose del follaje y de las panojas. ... 31
Cuadro 5. Resumen de las dimensiones (mm) de los diferente estados biológicos de Eurysacca melanocampta, en las 5 variedades de quinua (20 especímenes), en condiciones de laboratorio. Octubre, 2014 ... 40
Cuadro 6. Resumen de la duración en días de los estados biológicos de Eurysacca melanocampta, en las 5 variedades de quinua (20 especímenes), en condiciones de laboratorio. Octubre, 2014... 40
Cuadro 7. Resumen de las dimensiones (mm) de los diferente estados biológicos de Spoladea recurvalis, en las 5 variedades de quinua (20 especímenes), en condiciones de laboratorio. Octubre, 2014. . 52
Cuadro 8. Resumen de la duración en días de los estados biológicos de Spoladea recurvalis, en las 5 variedades de quinua (20 especímenes), en condiciones de laboratorio. Octubre, 2014... 52
Cuadro 9. Resumen de las dimensiones (mm) de los diferente estados biológicos de Heliothis spp., en las 5 variedades de quinua (20 especímenes), en condiciones de laboratorio. Octubre, 2014... 67
Cuadro 10. Resumen de la duración en días de los estados biológicos de Heliothis spp., en las 5 variedades de quinua (20 especímenes), en condiciones de laboratorio. Octubre, 2014. ... 67
Cuadro 11. Resumen de las dimensiones (mm) de los diferente estados biológicos de Spodoptera eridania, en las 5 variedades de quinua (20 especímenes), en condiciones de laboratorio. Octubre, 2014. ... 80
Cuadro 12. Resumen de la duración en días de los estados biológicos de Spodoptera eridania, en las 5 variedades de quinua (20 especímenes), en condiciones de laboratorio. Octubre, 2014... 80
Cuadro 13. Número promedio de larvas de Eurysacca melanocampta por planta en cada variedad de quinua. ... 88
Cuadro 14. Densidad de larvas de Eurysacca melanocampta presentes en el follaje y panoja, en cinco variedades de quinua (Chenopodium quinoa). Lambayeque, 2014. ... 92 Cuadro 15. Promedio de larvas de Spoladea recurvalis por planta, en cada variedad de quinua
(Chenopodium quinoa). Lambayeque, 2014. ... 97 Cuadro 16. Densidad de larvas de Spoladea recurvalis presentes en el follaje y panoja, en cinco variedades
de quinua (Chenopodium quinoa). Lambayeque, 2014. ... 99 Cuadro 17. Promedio de larvas de Heliothis spp. por planta, en cada variedad de quinua (Chenopodium
quinoa). Lambayeque, 2014. ... 103 Cuadro 18. Densidad de larvas de Heliothis spp presentes en la panoja, en cinco variedades de quinua
(Chenopodium quinoa). Lambayeque, 2014. ... 105 Cuadro 19. Promedio de larvas de Spodoptera eridania por planta, en cada variedad de quinua
(Chenopodium quinoa). Lambayeque, 2014. ... 108 Cuadro 20. Densidad de larvas de Spodoptera eridania presentes en el follaje, en cinco variedades de
quinua (Chenopodium quinoa). Lambayeque, 2014. ... 110 Cuadro 21. Registro diario de temperatura y humedad relativa (máxima, mínima y promedio) en el
10 Cuadro 22. Registro diario de temperatura y humedad relativa (máxima, mínima y promedio) en el Laboratorio de Entomología – UNPRG, durante el estudio de identificación de lepidópteros. Lambayeque, Junio del 2014. ... 122
Cuadro 23. Registro diario de temperatura y humedad relativa (máxima, mínima y promedio) en el Laboratorio de Entomología – UNPRG, durante el estudio de identificación de lepidópteros. Lambayeque, Julio del 2014. ... 123
Cuadro 24. Registro diario de temperatura y humedad relativa (máxima, mínima y promedio) en el Laboratorio de Entomología – UNPRG, durante el estudio de identificación de lepidópteros. Lambayeque, Agosto del 2014. ... 124
Cuadro 25. Registro diario de temperatura y humedad relativa (máxima, mínima y promedio) en el Laboratorio de Entomología – UNPRG, durante el estudio de identificación de lepidópteros. Lambayeque, Setiembre del 2014. ... 125
Cuadro 26. Registro diario de temperatura y humedad relativa (máxima, mínima y promedio) en el Laboratorio de Entomología – UNPRG, durante el estudio de identificación de lepidópteros. Lambayeque, Octubre del 2014. ... 126
Cuadro 27. Registro diario de temperatura y humedad relativa (máxima, mínima y promedio) en el Laboratorio de Entomología – UNPRG, durante el estudio de identificación de lepidópteros. Lambayeque, Noviembre del 2014. ... 127
Cuadro 28. Registro diario de temperatura: máxima, mínima y promedio, humedad relativa promedio, en campo, durante el estudio de identificación de lepidópteros. Lambayeque, Mayo – Junio del 2014. ... 128
Cuadro 29. Registro diario de temperatura: máxima, mínima y promedio, humedad relativa promedio, en campo, durante el estudio de identificación de lepidópteros. Lambayeque, Julio - Agosto del 2014. ... 129
Cuadro 30. Registro diario de temperatura: máxima, mínima y promedio, humedad relativa promedio, en campo, durante el estudio de identificación de lepidópteros. Lambayeque, Setiembre - Octubre del 2014. ... 130
Cuadro 31. Registro diario de temperatura: máxima, mínima y promedio, humedad relativa promedio, en campo, durante el estudio de identificación de lepidópteros. Lambayeque, Noviembre del 2014. ... 131
Cuadro 32. Descripción general de las 05 variedades de quinua utilizadas (tallo, hoja, panoja, granos), fenología, reacción a factores bióticos y abióticos, y características bromatológicas. ... 133
Cuadro 33. Duración en días de diferentes estados biológicos de Eurysacca melanocampta, alimentadas con quinua (Chenopodium quinoa), bajo condiciones de laboratorio. Lambayeque, Octubre - Noviembre del 2014. ... 137
Cuadro 34. Duración en días de diferentes estados biológicos de Spoladea recurvalis, alimentadas con quinua (Chenopodium quinoa), bajo condiciones de laboratorio. Lambayeque, Setiembre - Noviembre del 2014. ... 138
Cuadro 35. Duración en días de diferentes estados biológicos de Heliothis spp., alimentadas con quinua (Chenopodium quinoa), bajo condiciones de laboratorio. Lambayeque, Agosto – Octubre del 2014. ... 139
Cuadro 36. Duración en días de diferentes estados biológicos de Spodoptera eridania, alimentadas con quinua (Chenopodium quinoa), bajo condiciones de laboratorio. Lambayeque, Setiembre - Noviembre del 2014. ... 140
Cuadro 37. Dimensiones en mm de diferentes estados biológicos de Eurysacca melanocampta, alimentadas con quinua (Chenopodium quinoa), bajo condiciones de laboratorio. Lambayeque, 2014. ... 141 Cuadro 38. Dimensiones en mm de diferentes estados biológicos de Spoladea recurvalis, alimentadas con
11 Cuadro 39. Dimensiones en mm de diferentes estados biológicos de Heliothis spp., alimentadas con quinua (Chenopodium quinoa), bajo condiciones de laboratorio. Lambayeque, 2014... 143 Cuadro 40. Dimensiones en mm de diferentes estados biológicos de Spodoptera eridania, alimentadas con
quinua (Chenopodium quinoa), bajo condiciones de laboratorio. Lambayeque, 2014... 144 Cuadro 41. Periodos de pre-oviposición, oviposición y post-oviposición en días; N° de huevos/hembra/día;
total de huevos/hembra y porcentaje de viabilidad de huevos de Eurysacca melanocampta, en quinua, bajo condiciones de laboratorio, Lambayeque. 2014. ... 145
Cuadro 42. Periodos de pre-oviposición, oviposición y post-oviposición en días; N° de huevos/hembra/día; total de huevos/hembra y porcentaje de viabilidad de huevos de Spoladea recurvalis, en quinua, bajo condiciones de laboratorio, Lambayeque. 2014. ... 146
Cuadro 43. Periodos de pre-oviposición, oviposición y post-oviposición en días; N° de huevos/hembra/día; total de huevos/hembra y porcentaje de viabilidad de huevos de Heliothis spp., en quinua, bajo condiciones de laboratorio, Lambayeque. 2014. ... 147
Cuadro 44. Periodos de pre-oviposición, oviposición y post-oviposición en días; N° de huevos/hembra/día; total de huevos/hembra y porcentaje de viabilidad de huevos de Spodoptera eridania, en quinua, bajo condiciones de laboratorio, Lambayeque. 2014. ... 148
Cuadro 45. Promedio de larvas de Eurysacca melanocampta por follaje y panoja en cada una de las variedades de quinua (Chenopodium quinoa) registradas través de todas las evaluaciones. Lambayeque, 2014. ... 150
Cuadro 46. Promedio de larvas de Spoladea recurvalis por follaje y panoja en cada una de las variedades de quinua (Chenopodium quinoa) registradas través de todas las evaluaciones. Lambayeque, 2014. ... 151
Cuadro 47. Promedio de larvas de Heliothis zea por follaje y panoja en cada una de las variedades de quinua (Chenopodium quinoa) registradas través de todas las evaluaciones. Lambayeque, 2014. ... 152 Cuadro 48. Promedio de larvas de Spodoptera eridania por follaje y panoja en cada una de las variedades
12
ÍNDICE DE FIGURAS
Pág.
Figura 1. Promedios mensuales de la temperatura (°C) y humedad relativa (%), en el laboratorio, durante el estudio de la biología de las especies de lepidópteros encontrados. Lambayeque, 2014. ... 21
Figura 2. Promedios mensuales de la temperatura (°C) y humedad relativa (%), en campo, durante el estudio de la biología de las especies de lepidópteros encontrados. Lambayeque, 2014. ... 21
Figura 3. A) Ubicación geográfica del área experimental; B) Croquis del área experimental. ... 23
Figura 4. Eurysacca melanocampta: A) Huevos recién ovipositados; B) Larva de primer estadio; C) Larva de segundo estadio; D) Larva de tercer estadio; E) Larva de cuarto estadio; F) Larva de quinto estadio. ... 35
Figura 5. Eurysacca melanocampta: A) Pre pupa; B) Pupa; C) Adulto. ... 39 Figura 6. Daños de Eursysacca melanocampta: A. Larvas recién emergidas penetrando el parénquima de la
hoja; B. Larva de último estadío esqueletizando la hoja; C. Daño intenso de larvas en plantas de quinua recién emergidas; D. Larva raspando las hojas y tallos; E. Presencia de larvas en la panoja recién formada. ... 44
Figura 7. Spoladea recurvalis: A) Huevos recién ovipositados; B) Larva de primer estadio; C) Larva de segundo estadio; D) Larva de tercer estadio; E) Larva de cuarto estadio; F) Larva de quinto estadio. ... 48
Figura 8. Spoladea recurvalis: A) Pre pupa; B) Pupa C) Adulto... 51 Figura 9. Daño de Spoladea recurvalis: A. Larva alimentándose del follaje; B. Daño de S. recurvalis, pegando
hojas; C. Daño parecido a un capullo donde la larva se encuentra en medio de las hojas pegadas; D. Presencia de adultos. ... 57
Figura 10. Heliothis spp: A) Huevos recién ovipositados; B) Larva de primer estadio; C) Larva de segundo estadio; D) Larva de tercer estadio; E) Larva de cuarto estadio; F) Larva de quinto estadio; G) Larva de sexto estadio. ... 62
Figura 11. Heliothis spp: A) Pre pupa; B) Pupa C) Adulto Macho; D) Adulto Hembra ... 66 Figura 12. Daño de Heliothis spp.: A. Larvas prefieren los granos de las panojas que las hojas; B y C. Larvas
de último estadío color café y verde alimentándose de la panoja; D. Larva de último estadío color café más pequeña que las anteriores; E. Presencia de adultos. ... 71
Figura 13. Spodoptera eridania: A) Huevos; B) Larva de primer estadio; C) Larva de segundo estadio; D) Larva de tercer estadio; E) Larva de cuarto estadio; F) Larva de quinto estadio; G) Larva de sexto estadio. ... 76
Figura 14. Spodoptera eridania: A) Pre pupa; B) Pupa C) Adulto ... 79 Figura 15. Daños de Spodoptera eridania: A y B. Emergencia de larvas y el daño conocido que provoca en
las hojas, esqueletización; C. Posturas en masa, al cual se le hizo el seguimiento hasta la emergencia; D. Reporte de daños, indicador de la presencia de larvas. ... 84
Figura 16. Fluctuación poblacional (promedio) de larvas de Eurysacca melanocampta por planta, en cada una de las cinco variedades de quinua (Chenopodium quinoa). Lambayeque, 2014 ... 90 Figura 17. Densidad de larvas de Eurysacca melanocampta presentes en el follaje y panoja, en cinco
variedades de quinua (Chenopodium quinoa). Lambayeque, 2014. ... 92 Figura 18. Fluctuación poblacional (promedio) de larvas de Spoladea recurvalis por planta, en cada una de
las cinco variedades de quinua (Chenopodiumquinoa). Lambayeque, 2014. ... 98 Figura 19. Densidad de larvas de Spoladea recurvalis presentes en el follaje y panoja, en cinco variedades
13 Figura 20. Fluctuación poblacional (promedio) de larvas de Heliothis spp. por planta, en cada una de las cinco variedades de quinua (Chenopodium quinoa). Lambayeque, 2014. ... 104
Figura 21. Promedio de larvas de Heliothis spp. en la panoja, en cinco variedades de quinua (Chenopodium quinoa). Lambayeque, 2014. ... 105 Figura 22. Fluctuación poblacional (promedio) de larvas de Spodoptera eridania por planta, en cada una de
las cinco variedades de quinua (Chenopodiumquinoa). Lambayeque, 2014. ... 109 Figura 23. Promedio de larvas de Spodoptera eridania en follaje, en cinco variedades de quinua
14
I. INTRODUCCIÓN
El cultivo de quinua (Chenopodium Quinoa Willd.), es una de las especies domesticadas y cultivadas en el Perú desde épocas prehispánicas, es el grano que en la actualidad presenta mejores potencialidades para la Agroexportación que otros cereales porque posee un alto nivel de proteínas.
El Perú se caracteriza por ser un país con un gran potencial agrícola, gracias a la diversidad de climas y suelos que posee. Estas características logran que nuestro país obtenga ventajas comparativas en varios productos agroindustriales como la quinua que por su alto valor alimenticio y nutritivo y su adaptación a diferentes pisos agroecológicos y suelos, ha generado gran interés entre los agricultores, empresas agroindustriales, instituciones públicas y privadas, nacionales e internacionales, tal como lo menciona MINAGRI (2014).
La Quinua es un nuevo cultivo que se está instalando en toda la costa peruana como Arequipa, Lambayeque, La Libertad, Piura, Tacna, etc., y desde el nivel del mar hasta los 4000 msnm (Jacobsen y Mujica. 1999). En la Región Lambayeque, en la campaña agrícola 2012 – 2013 se sembró 58 hectáreas de quinua, y 375 hectáreas entre agosto (2013) – Mayo (2014); la cual se produjo 139 toneladas hasta mayo del 2014, con un rendimiento promedio de 2937 kg/ha (MINAGRI, 2014).
La problemática de este cultivo radica mayormente en el punto de vista fitosanitario es que en su proceso de desarrollo es afectado por diferentes tipos de insectos fitófagos, desde la etapa de emergencia de plántulas hasta la maduración del cultivo, en su mayoría de la orden lepidóptera, que provocan daños, como defoliación y destrucción de granos. Esto lleva por consecuencia mermas en la producción y reducción de la calidad del producto, generando considerables pérdidas económicas, estimándose que las pérdidas de producción que ocasionan los insectos fitófagos son alrededor del 35% (León, 2003).
15 condiciones de laboratorio y campo; teniendo como base la formulación y desarrollo de los siguientes objetivos:
Determinar las principales características morfo – biológicas de las especies de lepidópteros que afectan el follaje y panojaen condiciones de laboratorio, acompañado con observaciones de campo.
Determinar la densidad poblacional de las especies de lepidópteros que
16
II. REVISIÓN LITERARIA
2.1. Sobre el cultivo de quinua
Canahua (1997); menciona que actualmente existe gran cantidad de variedades y cultivares utilizados comercialmente en la producción de quinua. Entre estas tenemos principalmente de Perú, Bolivia, Ecuador, Argentina, Colombia, Chile, México, Holanda, Inglaterra y Dinamarca.
En el Perú, tenemos: Amarilla Maranganí, Kancolla, Blanca de Juli, Cheweca, Witulla, Salcedo-INIA, Quillahuaman-INIA, Camacani I, Camacani II, Huariponcho, Chullpi, Roja de Coporaque, Ayacuchana-INIA, Huancayo, Hualhuas, Mantaro, Huacataz, Huacariz, Rosada de Yanamango, Namora.
Jacobsen y Mujica (1999); hacen referencia que los requerimientos importantes del cultivo quinua para una adecuada producción son: suelo, pH del suelo, clima, agua, precipitación, temperatura, radiación y altura.
En lo referente al suelo la quinua prefiere un suelo franco, con buen drenaje y alto contenido de materia orgánica, con pendientes moderadas y un contenido medio de nutrientes, puesto que la planta es exigente en nitrógeno y calcio, moderadamente en fósforo y poco de potasio. También puede adaptarse a suelos franco arenosos o franco arcillosos.
En cuanto al pH la quinua tiene un amplio rango de crecimiento y producción a diferentes pH del suelo, se ha observado que da producciones buenas en suelos de acidez de 4.5 (Cajamarca-Perú) hasta 9 de pH, en los salares de Bolivia, así mismo el cultivo se desarrolla en un clima que va desde el nivel del mar hasta los 4000 msnm, desde zonas áridas hasta zonas húmedas y tropicales. Desde zonas frías hasta templadas y cálidas; por ello es necesario conocer que genotipos son adecuados para cada una de las condiciones climáticas.
17
2.2. Sobre las plagas en el cultivo de quinua
Alata (1973);señala que durante el ciclo vegetativo del cultivo quinua se registra de 15 a 22 insectos fitófagos, estos ocasionan daños en forma directa cortando plantas tiernas, masticando y defoliando hojas, picando-raspando y succionando la savia vegetal, minando hojas y barrenando tallos, destruyendo panojas y granos e indirectamente viabilizan infecciones secundarias por microorganismos patógenos.
Blanco (1994), determinó que el Umbral de Daño Económico (UDE) para Eurysacca
en quinua es de cinco a seis larvas por panoja.
Chacón (1962); hace mención que el lepidóptero Scrobipalpula sp (Kcona – kcona),
antes Gnorimoschema de la familia Gelechiidae es probablemente la plaga más importante de la quinua. Un ataque intenso de esta plaga puede reducir a cero la producción de grano. Su nombre común “kcona - kcona” se refiere al hecho de moler el grano como resultado de un ataque intenso.
Investigaciones recientes en Puno y en el altiplano de Bolivia, indican que Ia kcona-kcona es una plaga de primer orden del cultivo de la quinua. Las variaciones de quinuas dulces y blancas son relativamente las preferidas de esta plaga, habiéndose encontrado hasta 150 larvas en una sola planta.
El ataque de estos insectos es más intenso en las épocas de sequía y "veranillos". Las larvas de la primera generación (noviembre-diciembre) minan y destruyen las hojas e inflorescencias en formación, pegan las hojas tiernas, enrollándolas y alimentándose en el interior del parénquima. En ataques severos, las plantas aparecen arrepolladas y en pocos días se puede destruir el cultivo. Las larvas de la segunda generación (marzo-mayo) atacan a las plantas en estado de maduración (grano pastoso y seco), localizándose en el interior de las panojas donde comen el grano. En infestaciones severas aparece un polvo blanco alrededor de la base de la planta, producto de la destrucción del grano y de las deyecciones de la larva, situación que puede prolongarse en las parvas durante el secado. Estas larvas de la segunda generación ocasionan los mayores daños a los cultivos de la quinua.
18
Gnorimoschema sp.; después fue citada como Scrobipalpula sp., y desde 1986 como Eurysacca melanocampta (Meyrick). La otra especie, Eurysacca quinoae, fue descrita por primera vez en La Paz (Bolivia) e identificada como nueva plaga de la quinua (POVOLNÝ 1997).
Chambilla (2009); destaca que el complejo ticonas está conformado por lo menos de cuatro géneros: Copitarsia, Heliothis, Feltia, y Spodoptera. La población de ticonas tiene su pico más alto en la etapa de grano pastoso.
Graña y Aguilera (1977); indica que en Puno, Perú se han observado los lepidópteros Gnorimoschema sp. (Gelechiidae), y Zinckenia fascialis Cramer [Hymenia recurvalis (F.)], los que se conocen genéricamente como polillas de la quinua u orugas de las hojas e inflorescencias.
INIA (2014); refiera a Spoladea recurvalis (Pyralidae) como una plaga cosmopolita de distribución mundial en trópicos y subtrópicos, es polífago actuando como barrenador y comedor de hojas en todas las etapas del cultivo hasta la cosecha.
PROINPA (2010); reporta que uno de los factores que influye negativamente en la producción del cultivo de la quinua es la incidencia de una gran variedad de insectos plaga como el llamado “complejo ticona” integrado por varias especies de mariposas nocturnas como Copitarsia incommoda, Helicoverpa gelotopoeon y
Agrotis andina, y la polilla de la quinua Eurysacca quinoae.
Quispe (2002); enfatiza que en el altiplano, la polilla de la quinua (Eurysacca melanocampta Meyrick), conocida como kcona kcona, y el complejo de ticonas o ticuchis (Heliothis titicaquensis, Copitarsia p., Feltia sp. y Spodoptera sp.) son consideradas las plagas de mayor importancia económica, por los daños que causan al cultivo de la quinua.
Rasmussen et al., (2003); describe a los estadíos de las larvas I – III de Eurysacca melanocampta que se alimentan de hojas produciendo galerías y las larvas de los siguientes estadíos se alimentan de granos en desarrollo y granos maduros.
Saravia y Quispe (2003); cita que el cultivo de la quinua (Chenopodium quinoa
19 insectiles se tiene a la polilla de la quinua Eurysacca quinoae Povolny comúnmente llamada “kcona kcona” y el complejo “ticona”: Copitarsia incommoda Walker,
Helicoverpa gelotopoeon Dyar, Helicoverpa atacamae Hardwick y Dargida acanthus Herrich-Schäffer, las cuales son consideradas plagas de importancia económica por los daños que causan al cultivo, ya sea en su panoja o en sus hojas y tallo en formación de la planta.
Tapia (1990); refiere que las plagas están muy relacionadas a la ocurrencia de sequias o veranillos, que se presentan normalmente en las partes altas de los andes, sobre todo en el centro y sur del Perú, durante la época de crecimiento de la planta. Las plagas de la quinua se pueden agrupar según el daño y los insectos causantes: cortadores de plantas tiernas (Feltia experta, Spodoptera sp, Copitarsia turbata, Agrotis ipsilon); minadores y destructores de grano (Scrobipalpula sp, Liriomyza absoluta, Hymenia recurvalis, Pachyzancla bipunctalis, Perisoma
sordescens); masticadores y defoliadores (Epicauta latitarsis, Epicauta willei, Epitrix subcrinita); picadores y chupadores (Myzus persicae, Macrosiphum euphorbiae, Bergallia sp, Frankliniella tuberosi).
Valda (1998); menciona que las larvas de Eurysacca quinoae pasan por cinco estadíos larvales; del primer al tercer estadío se comportan como minadores de tallos, hojas y brotes tiernos de quinua, y del cuarto al quinto estadío pegan las hojas donde se refugian durante el día y comienzan a salir al ocaso del sol para devorar los granos en formación.
Zanabria y Mujica (1977); reportan que existen especies de lepidópteros que se alimentan del parénquima de las hojas, panojas y tallos: Scrobipalpula sp o
Gnorimoschema (Gelechiidae), Hymenia recurvalis y Pachyzancia bipunctalis
20
III. MATERIALES Y MÉTODOS
3.1. Ubicación
El presente trabajo de investigación fue realizado en dos fases en paralelo: laboratorio y campo. La fase de laboratorio fue realizado en el laboratorio de Entomología de la Facultad de Agronomía de la Universidad Nacional Pedro Ruíz Gallo – Lambayeque (Latitud Sur: 06º43'34", Longitud Oeste: 79°46'49 y Altitud: 30 m.s.n.m.). La fase de campo en la ESTACIÓN EXPERIMENTAL AGRARIA VISTA FLORIDA – INIA, ubicada en el Departamento de Lambayeque, Provincia de
Sede física: Carretera Chiclayo – Ferreñafe. km. 8
3.2. Condiciones climáticas durante el desarrollo del experimento.
Cuadro 1. Promedios mensuales de temperatura y humedad relativa, en el laboratorio y en campo; durante el estudio de la morfo - biología de lepidópteros encontrados. Lambayeque, 2014.
Mes
Laboratorio Campo *
Temperatura (°C) Humedad relativa (%) Temperatura (°C) HR (%) Max. Min. Prom. Max. Min. Prom. Max. Min. Prom. Prom.
*Fuente: Estación Meteorológica de la Universidad Nacional Pedro Ruíz Gallo - Lambayeque.
21 Figura 1. Promedios mensuales de la temperatura (°C) y humedad relativa (%), en el laboratorio, durante el estudio de la biología de las especies de lepidópteros encontrados. Lambayeque, 2014.
Figura 2. Promedios mensuales de la temperatura (°C) y humedad relativa (%), en campo, durante elestudio de la biología de las especies de lepidópteros encontrados. Lambayeque, 2014.
Fuente: Estación Meteorológica de la Universidad Nacional Pedro Ruíz Gallo - Lambayeque.
50
Mayo Junio Julio Agosto Septiembre Octubre Noviembre
H
Mayo Junio Julio Agosto Septiembre Octubre Noviembre
22
3.3. Características del Área experimental.
Área total de experimento: 1000 m2
Número total de parcelas: 20
Longitud de parcela: 5 m
Ancho de parcela: 7.5 m
Área de parcela: 37.5 m2
Distancia entre surco (cinta): 1.5 m
Distancia entre repeticiones: 1 m
Sistema de riego por goteo Surco mellizo
Numero de cintas por parcela: 5
Numero de repeticiones: 4
Numero de variedades: 5
1. Altiplano - INIA 2. Salcedo - INIA 3. Illpa - INIA
4. Pasankalla - INIA 5. Negra Collana – INIA
Diseño estadístico: Bloque completamente randomizado (BCR).
24
3.4. Métodos
3.4.1. Metodología para la fase de laboratorio
Esta fase se llevó a cabo en la sala de crianza del Laboratorio de Entomología de la Universidad Nacional Pedro Ruíz Gallo de Lambayeque, donde se realizó la crianza de las especies de lepidópteros encontradas así como la identificación y sus principales características morfo – biológicas. En esta etapa incluye:
3.4.1.1. Obtención y acondicionamiento de las especies encontradas.
Durante las primeras evaluaciones en el área experimental se colectó material biológico consistente en estados larvales y pupales de las especies de lepidópteros, las cuales fueron trasladadas en reposteros plásticos a la sala de crianza del laboratorio de entomología, donde fueron criadas bajo condiciones ambientales no controladas.
Previamente, en el laboratorio, se realizó una desinfección del ambiente y del material, con hipoclorito de sodio (lejía al 5%), luego el material biológico que previamente colectado fue acondicionado en forma individual en reposteros de plástico de 250cc.
Como alimento se proveyó diariamente hojas y panojas de quinua hasta la obtención de las pupas, las cuales fueron sexadas y acondicionadas en el mismo repostero para la obtención de los estados adultos, con los cuales se inició la toma de datos; el alimento fue acompañado de una pequeña porción de algodón humedecido en agua destilada para evitar el secamiento de las muestras en crianza.
25
3.4.1.2. Identificación de las especies
Se enviaron 10 adultos por cada especie lepidóptera encontrada al laboratorio del Servicio Nacional de Sanidad Agraria (SENASA) en Lima para su posterior identificación.
Así mismo, para una descripción más detallada de las especies encontradas, sobre todo de las nuevas, se guió de la tesis desarrollada en paralelo por el Bach. Kreimer
Domínguez López, titulada: “CARACTERISTICAS MORFOLÓGICAS Y
BIOLÓGICAS DEL PEGADOR DE HOJAS Y BROTES (Lepidóptera: Pyralidae) DE
LA QUINUA (Chenopodium quinoa Willd.) EN LAMBAYEQUE”; también con
publicaciones específicas y tesis desarrolladas relacionadas las especies encontradas.
3.4.1.3. Estudio de las principales características morfo – biológicas
3.4.1.3.1. Para la biología
Esta etapa se inició a partir de las posturas obtenidas de las especies en estudio en el laboratorio. Después de la eclosión, con ayuda de un fino pincel se procedió a individualizar las larvas recién emergidas, 20 por especie, cada una en un repostero pequeño de plástico de 4x7 cm. Se les proveyó hojas tiernas de quinua de la variedad Salcedo INIA (variedad más sembrada en dicha institución) que previamente fueron desinfectadas con solución de lejía al 2%.
Se realizaron observaciones diarias con la finalidad de detectar la cápsula cefálica el cual nos indicara el proceso de muda que ha sufrida cada larva.
Ya en la fase pupal, se determinó el sexo de cada una 24 horas después de haber sido formada, luego fueron acondicionadas por parejas en un envase de 1000cc, a esto se le añadió un trozo de algodón humedecido diariamente en agua destilada con el fin de evitar su secamiento.
26 Con las observaciones diarias resultantes de la crianza, nos brindó la siguiente información:
Duración de cada estadio larval (días). Duración de toda la fase larval (días). Duración de la fase pupa por sexo (días). Longevidad de adultos, hembra y macho (días).
Periodo de pre oviposición (días): emergencia de hembra a primera postura. Periodo de oviposición (días): tiempo entre primera y última postura.
Periodo de post-oviposición (días): tiempo entre última postura y la muerte del insecto hembra.
Capacidad de oviposición total e individual. Viabilidad de huevos (porcentaje).
Estos parámetros fueron evaluados de 20 individuos por cada especie, que fueron codificados desde el momento de emergencia de la larva. Si alguna muestra muere por diferente causa, se reemplazó por otros que tienen la misma de fecha de emergencia.
3.4.1.3.2. Para la morfología
Se realizó el estudio de las características morfológicas, en las diferentes especies, de los 20 especímenes con los que se trabajó la biología.
Las características morfológicas evaluadas fueron: Diámetro de huevos.
Longitud de cada estadio larval.
Diámetro de capsula cefálica del último estadio larval. Longitud de pupas machos y hembras.
Ancho de pupas machos y hembras.
Expansión alar de adultos machos y hembras Longitud del cuerpo de adultos machos y hembras.
27 Para la descripción de las principales características morfológicas, se hizo uso de microscopio estéreo Motic SMZ-168.
3.4.2. Metodología para la fase campo
3.4.2.1. Descripción de variedades de quinua utilizadas
3.4.2.1.1. Altiplano – INIA
La variedad de quinua INIA - 431 ALTIPLANO, es una cruza recíproca (A x B y B x A) de las variedades ILLPA INIA (004) (A) x Salcedo INIA (001) (B), realizada por el Programa Nacional de Innovación Agraria de Cultivos Andinos del Instituto Nacional de Innovación Agraria - INIA, en 1997 en la ciudad de Salcedo, de la Región Puno.
Liberada en el año 2013, es una quinua de grano blanco y dulce, grande, con contenido de saponina de 0,03% y mayor contenido de proteína (16,9%), resistente a sequía y a Peronospora farinosa f.sp chenopodii (Mildiu). Esta variedad tiene buen potencial de rendimiento en campo de agricultores, tolerancia a enfermedades, así como a sequía Estas características atribuyen a la variedad una capacidad amplia de adaptación que va del altiplano a la costa peruana.
3.4.2.1.2. Salcedo – INIA
Es una variedad obtenida del cruce de las variedades “Real Boliviana” por “Sajama”, en 1995, y tiene como características: grano grande (2.0 mm de diámetro), grano dulce, precocidad (150 días de periodo vegetativo), panoja glomerulada compacta, buen potencial de rendimiento, tolerante a mildiu (Peronospora farinosa f.sp chenopodii), y un contenido de saponina 0.014%, (grano dulce). También tiene tolerancia a heladas y sequías, mayor contenido de proteínas (14.5%). Esta variedad es la más requerida por la agroindustria y mercado exterior.
3.4.2.1.3. Illpa – INIA
28
3.4.2.1.4. Pasankalla – INIA
Variedad obtenida en el 2006 por selección planta surco de ecotipos de la localidad de Caritamaya, distrito de Ácora, provincia de Puno. El proceso de mejoramiento se realizó entre los años 2000 al 2005, en el ámbito de la Estación Experimental Agraria (EEA) Illpa-Puno, por el Programa Nacional de Investigación en Cultivos Andinos. Su mejor desarrollo se logra en la zona agroecológica Suni del altiplano entre los 3.815 y 3.900 m.s.n.m. y soporta un clima frío seco, precipitaciones pluviales de 400 a 550 mm, y temperatura de 4°C a 15°C. Es una variedad óptima para la agroindustria, con alta productividad (rendimiento potencial de 4.5 t/ha) y buena calidad de grano.
3.4.2.1.5. Negra Collana – INIA
29
3.4.2.2. Fenología de la quinua
El desarrollo de la fenología del cultivo se siguió en base a la guía técnica titulada: “MANEJO AGRONÓMICO DEL CULTIVO DE LA QUINUA” publicada por la Universidad Nacional Agraria La Molina (UNALM) en el 2012.
Cuadro 2. Etapas fenológicas del cultivo de quinua (Chenopodium quino Willd.) según la UNALM, 2012.
CODIGO ETAPA FENOLÓGICA CARACTERISTICA
X1 Pre - Emergencia Hay desplazamiento de la radícula y la plúmula
X2 Emergencia La plántula sale del suelo, se observa las hojas
cotiledonales
X3 Dos hojas verdaderas Se observa 2 hojas verdaderas encima de las cotiledonales
X4 Cuatro a seis hojas
verdaderas
Se observa 2 a 3 pares de hojas verdaderas, las cotiledonales se vuelven amarillentas
X5 Ramificación Se observa 8 hojas, las cotiledonales se caen.
X6 Inicio de panoja En el ápice la inflorescencia va saliendo, el tallo se
comienza a estirase y engrosar
X7 Panojamiento Se observa la inflorescencia por completo
X8 Inicio de floración Se observa la flor hermafrodita abierta con estambres
separados
X9 Floración Se observa hasta un 5% de flores abiertas en el medio día
X10 Grano lechoso Se observa un líquido blanquecino del fruto al ser
presionado
X11 Grano pastoso Al ser presionado el fruto la consistencia es pastosa
X12 Madurez fisiológica Hay una resistencia al ser presionado por la uña, cambio
de color de la planta
*Fuente: Guía técnica Manejo agronómico del cultivo de quinua, UNALM.
3.4.2.3. Instalación del experimento
Las 5 variedades de quinua se sembraron, de tal manera como señala el croquis del área experimental.
30 máximo que provocó la población de las especies fluctuantes o la susceptibilidad de las variedades de quinua al ataque de los insectos plagas que se presentaron.
3.4.2.4. Sistema de evaluación
Se efectuaron evaluaciones periódicas, con un intervalo de 2 veces por semana durante todas las etapas fenológicas, desde la germinación hasta su maduración fisiológica, para determinar la susceptibilidad de las 5 variedades de quinua al ataque de las especies de lepidópteros encontradas.
Hasta antes de la labor del deshaije, el método de evaluación consistió en contar el número de plantas por metro lineal y el total de estados larvales de lepidópteros que se encuentren en dicho metro lineal.
Posteriormente después del deshaije, se registraron 10 plantas de cada variedad, por cada repetición y por cada bloque. De cada planta se evaluaron 5 hojas del tercio inferior, 5 hojas del tercio superior y 3 panojas entre ella la principal.
Para cada evaluación se registró en cuadros preparados para cada una de las especies de lepidópteros encontrados y así obtener el porcentaje de densidad poblacional.
Cuadro 3. Número de órganos evaluados por planta de acuerdo a sus etapas fenológicas
ETAPA N° DE ÓRGANOS EVALUADOS POR PLANTA
X1 - X12 Toda la planta
X6 - X7 Toda la panoja, 5 hojas del tercio inferior, 5 hojas del tercio superior.
X8 - X10 3 panojas (entre ellas la principal), 5 hojas del tercio inferior, 5 hojas del tercio
medio, 5 hojas del tercio superior.
X11 - X12 3 panojas (entre ellas la principal), 10 hojas
3.4.2.5. Análisis estadístico
Al final de todas las evaluaciones se realizó el análisis de variancia (ANAVA) y la
31
IV. RESULTADOS Y DISCUSIÓN
4.1. Identificación y ubicación taxonómica de las especies encontradas
alimentándose del follaje y panoja
Se encontraron cinco especies de lepidópteros en el área experimental que se alimentan del follaje y de la panoja, cuya identificación fue realizada por el Servicio Nacional de Sanidad Agraria (SENASA) – Lima.
Las especies encontradas fueron:
Especie 01: Gelechiidae: Eurysacca melanocampta (Meyrick, 1917) Especie 02: Crambidae: Spoladea recurvalis (Fabricius, 1775) Especie 03: Noctuidae: Helicoverpa zea (Boddie, 1850) Especie 04: Noctuidae: Heliothis virescens
Especie 05: Noctuidae: Spodoptera eridania (Cramer, 1782)
Cuadro 4. Ubicación taxonómica de las especies de lepidópteros encontradas alimentándose del follaje y de las panojas.
Especies encontradas
Ítem (1) (2) (3) (4) (5)
Familia Gelechiidae Crambidae Noctuidae Noctuidae Noctuidae
Género Eurysacca Spoladea Heliothis Heliothis Spodoptera
Especie Eurysacca
4.2. Eurysacca melanocampta
4.2.1. Características morfo – biológicas importantes
4.2.1.1. Huevo
(Figura 4 (A); Cuadros 5 y 6)
32 El periodo de incubación promedio fue de 3.00 ± 0.001 días, durante los meses de Julio (24.13 °C y 60.76 % HR) y Agosto (23.76 °C y 58.47 % HR).
4.2.1.2. Estado larval
(Figura 4; Cuadros 5 y 6)
Las larvas son de tipo eruciforme, con 5 pares de patas abdominales, cuerpo de aspecto cilíndrico, que pasan por cinco estadíos. Presentan una coloración amarillo cremoso, verde cremoso, marrón clara y marrón cremoso, con manchas difusas de color marrón oscuro o rojizo, que se disponen en la región notal, dando el aspecto de bandas o venaciones lineales características.
A continuación se hace una descripción morfológica de la larva en base al quinto estadío.
La cabeza es relativamente pequeña, glabra, quitinosa, brillante, de coloración marrón clara o marrón oscura, con pelos táctiles aislados; vértex amplio, dividido por la frente que termina en punta; antenas vestigiales; ocelos en número de 6, dispuestos en dos grupos; uno superior con 4 y otros inferior con 2; poderosas mandíbulas con los márgenes internos dentados; maxilas netas y fuertes; palpos labiales menos desarrollados que los maxilares, los que son inarticulados; mentum igualmente prolongado y robusto. El protórax presenta un pronotum quitinoso, de color marrón claro o marrón obscuro. Las patas son inarticuladas, terminando en poderosas uñas y garfios. El mesotórax y el metatórax así como los segmentos abdominales son membranosos y carnosos. Las falsas patas abdominales presentan una doble hilera de ganchos interrumpidos y dispuestos en forma de círculo, mientras que en las falsas patas anales estos ganchos se disponen en forma elíptica; tal como lo describe Chacón (1962)
La duración promedio del estadio larval fue de 10.44 ± 0.651 días durante los meses de Julio (24.13 °C y 60.76 % HR) y Agosto (23.76 °C y 58.47 % HR).
4.2.1.2.1. Larva I
(Figura 4 (B); Cuadros 5 y 6)
33 Recién eclosionada es de color verde amarillento translúcido, la cabeza y la placa torácica de color marrón oscuro, a medida que se alimenta va tornándose un color más amarillento.
La duración promedio de este estadío fue de 2.85 ± 0.366 días durante los meses de Julio y Agosto (23.95 °C y 59.62 % HR)
4.2.1.2.2. Larva II
(Figura 4 (C); Cuadros 5 y 6)
Tienen una longitud promedio de 2.23 ± 0.265mm.
Es del mismo color que el estadío anterior, con la diferencia que en este estadío predomina más el amarillo cremoso con la cabeza y el escudo protoráxico marrón.
La duración promedio de este estadío fue de 2.00 ± 0.001 días durante los meses de Julio y Agosto (23.95 °C y 59.62 % HR).
4.2.1.2.3. Larva III
(Figura 4 (D); Cuadros 5 y 6)
Tienen una longitud promedio de 4.48 ± 0.294 mm.
Es de un color cremoso amarillento, donde se van acentuando unas manchas de color marrón claro o naranja oscuro; con la cabeza y el escudo protoráxico de color marrón oscuro; La duración promedio de este estadío fue de 2.00 ± 0.001 días durante los meses de Julio y Agosto (23.95 °C y 59.62 % HR).
4.2.1.2.4. Larva IV
(Figura 4 (E); Cuadros 5 y 6)
Tienen una longitud promedio de 8.10 ± 0.327 mm.
Presenta un color cremoso con las manchas más notorias dispuestas en todos los segmentos del cuerpo, de color más opaco que el estadío anterior. La cabeza mantiene la misma tonalidad de marrón oscuro.
34
4.2.1.2.5. Larva V
(Figura 4 (F); Cuadros 5 y 6
Tienen una longitud promedio de 11.78 ± 0.446 mm.
Una descripción más amplia y detallada de este estadío ha sido explicada al comenzar el estudio morfológico de la larva.
35
Figura 4. Eurysacca melanocampta: A) Huevos recién ovipositados; B) Larva de primer estadio; C) Larva de segundo estadio; D) Larva de tercer estadio; E) Larva de cuarto estadio; F) Larva de quinto estadio.
A B C
36
4.2.1.3. Pre-pupa
(Figura 5 (A); Cuadro 6)
Al finalizar el desarrollo del quinto estadío, las larvas dejan de alimentarse y muestran un acortamiento de tamaño debido a la contracción de cada segmento, y adquieren un color cremoso muy variable en los diferentes individuos, y va desde cremoso claro a cremoso oscuro.
La duración promedio de este estadío fue de 2.20 ± 0.408 días durante los meses de Julio y Agosto (23.95 °C y 59.62 % HR).
4.2.1.4. Pupa
(Figura 5 (B); Cuadros 5 y 6)
Tienen una longitud promedio de 5.23 ± 0.243 mm., con un ancho promedio de 1.41 ± 0.035 mm., para los machos y una longitud promedio de 5.32 ± 0.217 mm., con un ancho promedio de 1.33 ± 0.098 mm., para las hembras.
De aspecto similar a otros Gelechiidae, son de forma elíptica, de aspecto quitinoso, de coloración marrón clara a marrón oscura, aguda en la parte posterior, redondeada en la parte anterior, comprimido dorso ventralmente en la región cefálica e intersticial, ojos subcirculares, primer par de podotecas más pequeños que los palpos labiales. Las podotecas, ceratotecas y pterotecas sobrepasan la mitad del quinto segmento abdominal en los machos y el sexto segmento abdominal en las hembras. Extremo caudal dilatado, cremaster indiferenciable que podrían estar sustituido por numerosas cerdas alargadas; que concuerda con lo descrito por Rosa Ochoa & José Franco (2013).
Exteriormente pueden distinguirse: la cabeza, el labro, el clipeo, las mandíbulas, las antenas, las patas, así como los segmentos toráxicos y los urómeros.
La duración de este estado biológico en los meses de Julio y Agosto (23.95 °C y 59.62 % HR) y fue: 8.64 ± 0.842 días en el macho y 9.00 ± 0.775 días en la hembra.
4.2.1.5. Adulto
37 El macho tiene una longitud promedio de 5.05 ± 0.414 mm y la expansión alar un promedio de 13.89 ± 0.624 mm.
La hembra tiene una longitud promedio de 5.16 ± 0.198 mm y la expansión alar un promedio de 14.55 ± 0.522.
Los adultos son polillas de color gris parduzco o amarillo pajizo. Tienen la cabeza relativamente pequeña, cubierta de abundantes escamas en la cara, frente, vértex; ojos compuestos, grandes y laterales; antenas filiformes que sobrepasan la mitad del cuerpo, recubiertas por finísimas escamas; palpos labiales anchos, curvados hacia adelante y luego arriba, bastante desarrollados; palpos maxilares sumamente pequeños y también recubiertos por escamas.
El protórax en su región notal está recubierta por escamas dispuestas en forma de un penacho, justamente en la base de la inserción de las alas anteriores, que le dan un aspecto característico.
Los restantes segmentos toráxicos y abdominales, recubiertos por finísima escamas de color plata. Cada segmento toráxico lleva un par de patas, siendo el desarrollo de las metatoráxicas bastante considerable, las que presentan en el borde anterior de la tibia y de la articulación tibio-tarsiana un par de "espuelas tibiales"; así mismo presentan 5 pares de "espinas tarsales". Todas las patas terminan en fuertes uñas, siendo también considerable el desarrollo femoral, estando recubiertas por abundantes escamas.
38 insertados en el borde costal del ala, que le dan un aspecto plumoso característico al insecto.
La longevidad del adulto macho, durante los meses de Julio y Agosto (23.95 °C y 59.62 % HR) fue de 7.38 ± 0.518 días. Y la longevidad en el adulto hembra durante los mismos meses, fue de 9.25 ± 0.622 días.
4.2.1.6. Ciclo biológico completo
39 Figura 5. Eurysacca melanocampta: A) Pre pupa; B) Pupa; C) Adulto.
40
Cuadro 6. Resumen de la duración en días de los estados biológicos de Eurysacca melanocampta, en las 5 variedades de quinua (20 especímenes), en condiciones de laboratorio. Octubre, 2014.
Capacidad Oviposición 114 201 151.33 25.060
* E.A = Expansión alar, parámetro usado para los adultos. A.C.U.E = Ancho cefálico del último estadío.
41
4.2.2. Comportamiento
4.2.2.1. Adulto
El proceso de emergencia del adulto, se da cuando la pupa ha completado su desarrollo y ha tomado un color oscuro, momento en que los segmentos abdominales se ponen erectos y se dilatan; realiza repentinos movimientos de atrás hacia adelante, los que se hacen más frecuentes, permitiendo que el adulto rompa la envoltura pupal a nivel del tórax y la cabeza, facilitando primero la salida de la cabeza y las antenas, seguido de las patas, alas y finalmente el abdomen.
Se mueven por toda la base y toda la parte del repostero plástico, son muy activas aun cuando no son perturbadas.
Las hembras colocan sus huevos en los glomérulos tiernos y axilas de las inflorescencias de la quinua. Estos huevos son colocados individualmente o en grupos de 2 y de 3, los que permanecen unidos por una sustancia mucilaginosa.
Esta especie tiene una actividad nocturna.
El periodo de pre-oviposición fue de 3.25 ± 0.452 días.
El periodo de oviposición fue de 5.17 ± 0.718 días.
El número total de huevos por hembra es variable: siendo de 114 a 201 huevos/hembra, con un promedio de 151.33 ± 25.065 huevos/hembra. Se observa que en el segundo y tercer día de oviposición, el número promedio de huevos es mayor que los demás días; siendo en el segundo día de oviposición 41.17 huevos/hembra, en el tercer día 35.75 huevos/hembra; en el sexto día de oviposición el número de huevos por hembra desciende hasta 8.25 huevos/hembra.
El periodo de post-oviposición fue de 0.83 ± 0.718 días.
4.2.2.2. Huevo
(Cuadro 43)
42 En laboratorio, el huevo presenta una coloración verde amarillento translúcido tornándose opaco hasta antes de emerger. Son microscópicas por lo que con la ayuda de un estéreo se pudo comprobar que las hembras colocan sus huevos en los glomérulos tiernos y axilas de las inflorescencias de la quinua.
El porcentaje de viabilidad fue 89.35 ± 7.408
4.2.2.3. Estadíos larvales
En laboratorio cuando las larvas de los primeros estadíos fueron alimentadas con hojas tiernas de quinua e inflorescencia, estas empezaron a alimentarse del parénquima de las hojas y destruyendo el ovario de las flores junto con los granos recién formados de las panojas en desarrollo.
Las larvas de los últimos estadíos anidan en el limbo foliar, en los brotes, en los botones, o dentro de los glomérulos de las inflorescencias, formando una especie de estuche sedoso, blanquecino y pegajoso, donde permanece la mayor parte de tiempo de su desarrollo.
Las larvas de E. melanocampta son muy activas, cuando se les perturba mueven la parte caudal del abdomen varias veces, dando la sensación que son irritables.
Al finalizar su desarrollo larval, el último estadio forma un cocón con hilos de seda y restos biológicos, en el mismo lugar donde se estuvo alimentado dejando de movilizarse; y en el campo, ocurre de la misma forma, dentro de las panojas.
4.2.2.4. Pupa
La pupa se encuentra protegida por un cocón que es elaborado con hilos de seda y restos biológicos de la panoja.
En laboratorio se observó que las larvas empuparon en el mismo sitio donde últimamente se alimentaron, es decir dentro de las panojas secas, para luego de unas horas desprenderse a la base del repostero y allí mantenerse hasta la emergencia del estado adulto.
43 el suelo para empupar dentro de las grietas o terrones, son muy pocas las que se mantuvieron dentro de las panojas.
4.2.3. Daños
(Figura 6)
Es probablemente la plaga más importante de la quinua (Chacón, 1962). Un ataque intenso de esta plaga puede reducir a cero la producción de grano. Las variedades de quinuas dulces y blancas son relativamente las preferidas, habiéndose reportado hasta 150 larvas por planta. Su nombre común se refiere al hecho de moler el grano como resultado de un ataque intenso.
Se observó, que las larvas de los primeros estadíos minan y destruyen las hojas e inflorescencias en formación, pegan las hojas tiernas, enrollándolas y alimentándose en el interior del parénquima. En ataques severos, las plantas aparecen en forma arrepolladas.
Las larvas de los últimos estadíos, ya no se concentran tanto en el follaje sino de lleno se alimentan de la panoja en maduración (grano pastoso y lechoso), localizándose en el interior de las panojas donde se alimentan del grano. En ataques severos, cuando es manipulada la panoja, aparece un polvo blanquecino, que también aparece en la base de las plantas, producto de la demolición de los granos y los excrementos de las larvas.
44
C D
E
A B
C D
E
45
4.3. Spoladearecurvalis
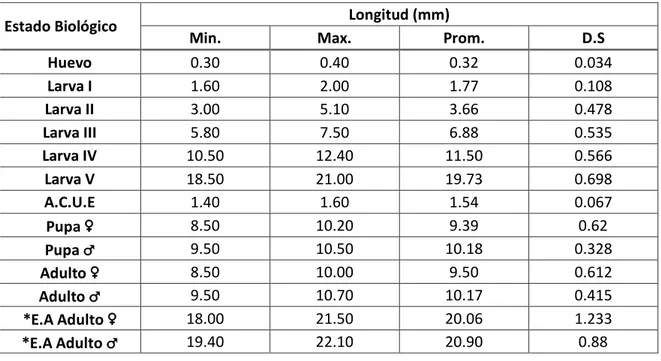
4.3.1. Características morfo – biológicas importantes
4.3.1.1. Huevo
(Figura 7 (A); Cuadros 7 y 8)
Es diminuto, tienen un diámetro promedio de 0.32 ± 0.034 mm. Es de forma ovalada, con la superficie aplanada, de coloración blanco translucido y de apariencia brillante cuando son recién ovipositados, tornándose de amarillo a amarillo cremoso claro cuando ya están por eclosionar.
El periodo de incubación promedio fue de 3.00 ± 0.000 días, durante los meses de Junio y Julio (25.19 °C y 61.42 % HR).
4.3.1.2. Estado larval
(Figura 7; Cuadro 8)
Las larvas son de tipo eruciforme, con 5 pares de patas abdominales, cuerpo de aspecto cilíndrico, crecen rápidamente desde su emergencia y pasan por cinco estadíos. Presentan una coloración marrón verdosa, con franja dorsal delgada color verde oscuro y la parte ventral de la larva verde amarillento, como lo describe la Universidad Estatal de Lowa (2000).
A continuación se hace una descripción morfológica de la larva en base al quinto estadío.
La cabeza está bien delimitada en posición hipognata, de forma algo triangular, igual que los estadios anteriores, constituida por una o capsula cefálica esclerotizada; es de color marrón claro con una tonalidad amarillenta, además se observa varias puntuaciones de color marrón oscuro, de las que se desprenden setas blancas, finas y desarrolladas.
46 En el mesotórax se observan claramente dos maculas de color negro intenso ubicadas en la parte dorsal.
De la parte ventral de cada segmento torácico se desprenden un par de patas torácicas o patas verdaderas formadas por sus respectivos artejos y que terminan en una uña o garra quitinizada, son de color marrón claro.
El abdomen en su parte ventral presenta cinco pares de patas abdominales o patas falsas de color amarillo claro. Cuatro pares de patas ventrales ubicadas en los segmentos 3, 4, 5 y 6; y un par de patas anales ubicadas en el último segmento.
La duración promedio del estadio larval fue de 10.45 ± 0.605días durante los meses de Junio y Julio (25.19 °C y 61.42 % HR).
4.3.1.2.1. Larva I
(Figura 7 (B); Cuadros 7 y 8)
Tiene una longitud promedio de 0.32 ± 0.034 mm.
Recién eclosionada es de color amarillo claro translucido, la cabeza redondeada más ancha que el cuerpo de color marrón claro, la placa torácica de color verde amarillento translucido, el protórax un poco más ancho cerca de la cabeza, el meso y el metatórax son iguales. A medida que se alimenta va tornándose un color verde amarillento translúcido más contrastado.
La duración promedio de este estadío fue de 2.00 ± 0.000 días durante los meses de Junio y Julio (25.19 °C y 61.42 % HR).
4.3.1.2.2. Larva II
(Figura 7 (C); Cuadros 7 y 8)
Tienen una longitud promedio de 3.66 ± 0.478mm.
En este estadío la larva tiene una coloración similar al estadío anterior. La cabeza es de la misma forma pero ahora es más pequeña que el cuerpo, de color marrón claro. La placa toráxica presenta tres segmento iguales y es del mismo color que el estado anterior.
47
4.3.1.2.3. Larva III
(Figura 7 (D); Cuadros 7 y 8)
Tienen una longitud promedio de 3.66 ± 0.478 mm.
Mantiene el color del estadío anterior (verde amarillento claro) pero con una tonalidad translúcida. La cabeza y el escudo protoráxico también conservan el color y forma del estadío anterior. La capsula presenta manchas de color gris de las cuales se origina una seta de por cada puntuación. En este estadío se manifiesta claramente el sistema digestivo como una banda longitudinal en la parte dorsal color verde claro.
La duración promedio de este estadío fue de 2.00 ± 0.000 días durante los meses de Junio y Julio (25.19 °C y 61.42 % HR).
4.3.1.2.4. Larva IV
(Figura 7 (E); Cuadros 7 y 8)
Tienen una longitud promedio de 11.50 ± 0.566 mm.
La coloración de la larva, la cabeza y de la placa toráxica aún se conservan del estadío anterior, con la diferencia que las manchas en toda la capsula cefálica son de color marrón oscuro, y las puntuaciones son más definidas y visibles.
La duración promedio de este estadío fue de 2.20 ± 0.410 días durante los meses de Junio y Julio (25.19 °C y 61.42 % HR).
4.3.1.2.5. Larva V
(Figura 7 (F); Cuadros 7 y 8)
Tienen una longitud promedio de 19.73 ± 0.698 mm.
Una descripción más amplia y detallada de este estadío ha sido explicada al comenzar el estudio morfológico de la larva.
48 Figura 7. Spoladea recurvalis: A) Huevos recién ovipositados; B) Larva de primer estadio; C) Larva de segundo estadio; D) Larva de tercer estadio; E) Larva
de cuarto estadio; F) Larva de quinto estadio.
A B C
49
4.3.1.3. Pre-pupa
(Figura 8 (A); Cuadro 8)
Al finalizar el desarrollo del quinto estadío, las larvas dejan de alimentarse y muestran un acortamiento de tamaño debido a la contracción de cada segmento, adquiriendo diferente tonalidades en el color. Primero se vuelve de un color verde amarillento con tonalidad anaranjada, luego se torna de un color rosado para finalmente quedarse de un color blanco cremoso, de forma rechoncha.
La duración promedio de este estadío fue de 2.20 ± 0.410 días durante los meses de Junio y Julio (25.19 °C y 61.42 % HR).
4.3.1.4. Pupa
(Figura 8 (B); Cuadros 7 y 8)
Las pupas de los machos ligeramente son de mayor tamaño que de las hembras. Teniendo una longitud promedio de 10.18 ± 0.328 mm., con un ancho promedio de 2.50 ± 0.063 mm., para los machos y una longitud promedio de 9.39 ± 0.620 mm., con un ancho promedio de 2.61 ± 0.083 mm., para las hembras.
Es de tipo obtecta o momificada, de aspecto fusiforme. Recién formada es de color verde limón, luego toma un color amarillo mostaza para finalmente cambiar de marrón claro a marrón oscuro; es ahusada en la parte posterior y redondeada en la parte anterior.
La duración de este estado biológico en los meses de Junio y Julio (25.19 °C y 61.42 % HR) fue: 8.58 ± 0.900 días en el macho y 8.88 ± 0.835 días en la hembra.
4.3.1.5. Adulto
(Figura 8 (C); Cuadros 7 y 8)
Los adultos machos son un poco más grandes que los adultos hembras. El macho alcanza una longitud promedio de 10.17 ± 0.415 mm y la expansión alar un promedio de 20.90 ± 0.880 mm. La hembra tiene una longitud promedio de 9.50 ± 0.612 mm y la expansión alar un promedio de 20.06 ± 1.233 mm.
50 ojos compuestos semiesféricos de color marrón oscuro, cubierta de escamas de color blanco cremoso; antenas filiformes tanto el macho como en la hembra.
El protórax presenta una forma de collar cubierta de escamas blanco amarillentas, y escamas largas y planas de color marrón. En el mesotórax y metatórax la región dorsal, está cubierto de escamas cortas de color marrón, y escamas largas y aplanadas del mismo color que se prolongan sobre la base de las alas hasta la base del primer segmento abdominal.
Las alas anteriores son de forma triangular, escamosas de color marrón, con dos bandas anchas medianas cubiertas de escamas blancas; el contorno de las bandas delimitado de escamas color marrón oscuro. Las alas posteriores también de forma triangular, más anchas que las alas anteriores, recubiertas de escamas color marrón, con banda ancha mediana cubierta de escamas blancas. El margen externo del ala presenta flecos igual que el ala anterior, el margen interno y venas anales están recubiertas por finas y largas escamas de color pardo amarillentas (Universidad Estatal de Iowa, 2000).
El abdomen está recubierto de escamas cortas y delgadas; en la región dorsal las escamas son de color marrón – marrón gris; y una hilera de escamas blancas al final de cada segmento, a excepción del último.
La longevidad del adulto macho, durante los meses de Junio y Julio (25.19 °C y 61.42 % HR) fue de 9.92 ± 0.793 días, la longevidad en el adulto hembra durante los mismos meses, fue de 11.75 ± 0.707 días.
4.3.1.6. Ciclo biológico completo
51 Figura 8. Spoladea recurvalis: A) Pre pupa; B) Pupa C) Adulto.
A
B