Evaluación de parámetros seminales de jóvenes Universitarios de la ciudad de Lima – Perú
Texto completo
Figure

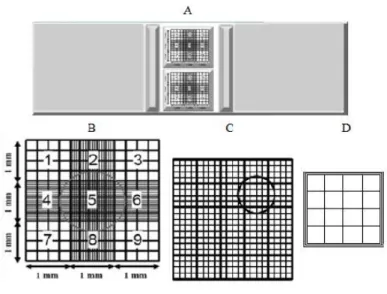
Documento similar
Debido al riesgo de producir malformaciones congénitas graves, en la Unión Europea se han establecido una serie de requisitos para su prescripción y dispensación con un Plan
Como medida de precaución, puesto que talidomida se encuentra en el semen, todos los pacientes varones deben usar preservativos durante el tratamiento, durante la interrupción
dente: algunas decían que doña Leonor, "con muy grand rescelo e miedo que avía del rey don Pedro que nueva- mente regnaba, e de la reyna doña María, su madre del dicho rey,
Colaboradores Teresa Castilla Mesa y Servicio de Orientación de Ciencias de la Educación Destinatarios Alumnos/as de todos los grados. Lugar Facultad de Ciencias de
Fuente de emisión secundaria que afecta a la estación: Combustión en sector residencial y comercial Distancia a la primera vía de tráfico: 3 metros (15 m de ancho)..
Esta U.D.A. de Podología nace con la voluntad de dar respuesta a la necesidad de contribuir a la integración de conocimiento, actitudes y habilidades en la formación de
De la Salud de la Universidad de Málaga y comienza el primer curso de Grado en Podología, el cual ofrece una formación generalista y profesionalizadora que contempla
La campaña ha consistido en la revisión del etiquetado e instrucciones de uso de todos los ter- mómetros digitales comunicados, así como de la documentación técnica adicional de