Detección inmunohistoquímica de los virus del complejo respiratorio bovino
Texto completo
(2) LI. corp. Centro de Docvmentodófl. CEISA. DETECCION INMUNOHISTOQUIHICA DE LOS VIRUS DEL COMPLEJO RESPIRATORIO BOVINO. CJ.ELICTECA A GOPEcO)}. '999. LINA MARCELA AREVALO GONZALEZ ERIMA LUCIA PELAEZ BALLESTAS. PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS DEPARTAMENTO DE HICROBIOLOGIA CARRERA DE BACTERIOLOGIA Santafé de Bogotá. D.C., Mayo de 1995. di.
(3) ecorpokG Centro de Documentación CEISA. DETECCION INMUNOHISTOQUIMICÁ DE LOS VIRUS DEL COMPLEJO RESPIRATORIO BOVINO. LINA MARCELA AREVÁLO GONZÁLEZ ERII(A LUCIA PELAEZ BALLESTAS. DR. RAFAEL REIRÁ RAIRAN. DR. ¡OSE DA. M.V. M.Sc.. M.V.Z. M.Sc. Director. Codirector. (5. NI. aliguorLrCA mPROPECUARIA. "' ' DRA. ALBA LUCIA HERNÁNDEZ. 29 FNF jqg. Bacteriologa. M.Sc. Codirectora. PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS DEPARTAMENTO DE MICROBIOLOGIA CARRERA DE BACTERIOLOGIA SantaFé de Bogotá. D.C., Mayo de 1995. nl.
(4) u. DETECCION INMUNOHISTOQUIMICA DE LOS VIRUS DEL COMPLEJO RESPIRATORIO BOVINO. LINA MARCELA AREVALO GONZALEZ ERIKA LUCIA PELAEZ BALLESTAS. D A. M JURADO. JORGE ALMANZA. 11. LANCHEROS. JURADO. PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS DEPARTAMENTO DE MICROBIOLOGIA CARRERA DE BACTERIOLOGIA Santafé de Bogotá, D.C.. Mayo de 1995. ji!. lv.
(5) II. DETECCION INMUNOHISTOQUIHICA DE LOS VIRUS DEL COMPLEJO RESPIRATORIO BOVINO. LINA MARCELA AREVALO GONZÁLEZ ERIKA LUCIA PELAEZ BALLESTAS. DR. CARLOS CORREDOR DECANO ACADEMICO FACULTAD DE CIENCIAS. DRA. NELLY S. RUEDA A. DIRECTORA CARRERA DE BACTERIOLOGIA. PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS DEPARTAMENTO DE MICROBIOLOGIA CARRERA DE BACTERIOLOGIA Santafé de Bogotá. D.C.. Mayo de 1995. y L1.
(6) Santafé de Bogotá. Mayo de 1995 DOCTOR CARLOS CORREDOR PEREIRA, PhD. DECANO ACADEMICO FACULTAD DE CIENCIAS PONTIFICIA UNIVERSIDAD JAVERIANA E. S. D.. Apreciado Doctor:. Solicito a usted, analizar y considerar el trabajo "Detección inmunohistc,química de los virus del Complejo Respiratorio Bovino" elaborado por las alumnas LINA MARCELA ARE VALO GONZÁLEZ y ERIKÁ LUCIA PELAEZ BALLESTAS, como requisito parcial para optar el título de Bacteriólogas, el cual personalmente en calidad de Director, dirigí, corregí y aprobé a entera satisfacción.. Atentamente,. JOSE DARlO MOGOLLON GALVIS M.V.Z., MSc., Ph.D. Líder del Proyecto de Medicina Porcina Corpoica-Ceisa. 0 VI ii.
(7) AGRADECIMIENTOS. Las autoras expresan sus agradecimientos:. A la CORPORACION COLOMBIANA DE INVESTIGACIONES EN SALUD Y PRODUCCION ANIMAL, por prestarnos sus instalaciones y suministros de reactivos para el desarrollo de este proyecto.. Al Dr. RAFAEL NEIRA, que sin su ayuda logística no hubiera sido posible la realización de esta investigación.. A la Dra. ALBA LUCIA HERNÁNDEZ, por su orientación en el Laboratorio de Virología Bovina.. Al Dr. JOSE DARlO HOGOLLON GALVIS, que con sus invaluables ensefíanzas supo dirigir nuestro trabajo de grado.. A la Dra. JANETH ARIAS, por no permitir que desistieramos en los momentos difíciles.. Al Sr. ANCIZAR FERNÁNDEZ, por la colaboración prestada.. VII.
(8) Y a todas aquellas personas que de una u otra forma, colaboraron. en la realización de este trabajo.. VIII.
(9) Repasando mi vocabulario se me escapó una palabra que perdí un día de usarla tanto, esa palabra es Gracias.. A mi madre, a Papa T y a Mamá Ana que han sido los pilares de mi vida. Lina Marcela.
(10) ç. CO r DOCUO. A mis padres. Esta es mi forma de agradecers la vida recién estrenada que me habéis regalada. A los que estuvisteis y a los que esteis. . Gracias. Erika. x.
(11) ADVERTENCIA. La PONTIFICIA UNIVERSIDAD JAVERIANA, no se hace responsable de los conceptos emitidos por los alumnos en su trabajo. Sólo velará porque el trabajo no tenga ataques personales y únicamente se vea en él, el anhelo de buscar la verdad y la justicia.. Artículo 23 de la Resolución No. 13 de Julio de 1946. 01.
(12) TABLA DE CONTENIDO. PÁG. RESUMEN INTRODUCCI OH. 1. 1. REVISION DE LITERATURA. 5. 1.1 AGENTES ASOCIADOS CON EL COMPLEJO RESPIRATORIO DE LOS BOVINOS. E. 1.2 VIRUS SINCITIAL RESPIRATORIO BOVINO (VRSB). 6. 1.2.1 Historia. 6. 1.2.2 Características generales. 7. 1.2.3 Clasificación. 8. 1.2.4 Características físicas y biológicas. 8. 1.2.5 Antígenos virales. 11. 1.2.6 Patogénesis. 12. 1.2.7 Inmunología. 15. 1.2.7.1 Inmunología humoral. 15. 1.2.7.2 Inmunología celular. 18. 1.2.8 Diagnóstico de laboratorio. 21. 1.2.8.1 Prueba de anticuerpos fluorescentes. 23. Ti.
(13) 1.2.8.2 Técnica de inmunoperoxidasa. 24. 1.2.8.3 Técnica de seroneutralización. 26. 1.2.8.4 Técnica de ELISA. 27. 1.2.8.5 Detección de ácido nucléico. 27. 1.2.9 Tratamiento. 28. 1 . 2 . 10 Epidemiología. 29. 1.2.11 Prevalencia. 30. 1.2.12 Transmisión. 31. 1.2.13 Control. 31. 1.3 RINOTRÁQUEITIS INFECCIOSA BOVINA (IBR). 32. 1.3.1 Historia. 32. 1.3.2 Generalidades. 33. 1.3.3 Clasificación. 34. 1.3.4 Etiología. 34. 1.3.5 Características físicas y biológicas. 35. 1.3.6 Antígenos virales. 36. 1.3.7 Patogénesis. 37. 1.3.7.1 Forma respiratoria. 38. 1.3.7.2 Forma genital. 38. 1.3.7.3 Forma conjuntival. 39. 1.3.7.4 Forma abortiva. 39. 1.3 7. 5 Forma encefálica. 40. 1.3.8 Inmunología. 42. 1.3.8.1 Inmunidad humoral. 42. XIII.
(14) 1.3.8.2 Imunidad celular. 43. 1.3.9 Diagnóstico de laboratorio. 43. 1.3.10 Tratamiento. 46. 1.3.11 Epidemiología. 46. 1.3.12 Prevalencia. 46. 1.3.13 Transmisión. 47. 1.3.14 Control. 47. 1.3.15 Prevención. 48. 1.3.15.1 Vacunas. 49. 1.4 VIRUS PARAINFLUENZA TIPO 3 (P13). 50. 1.4.1 Historia. 50. 1.4.2 Clasificación. 51. 1.4.3 Caracteísticas físicas y biológicas. 52. 1.4.4 Antígenos virales 1.4.5 Patogénesis. 54. 1.4.6 Inmunología. 56. 1.4.6.1 Inmunidad humoral. 56. 1.4.6.2 Inmunidad celular. 57. 1.4.7 Diagnóstico de laboratorio. 57. 1.4.8 Tratamiento. 59. 1.4.9 Epidemiología. 58. 1.4.10 Transmisión. 59. 1 .4 .11 Prevalencia. 60. 1.4.12 Control. 60. XIV.
(15) 1.4.13 Vacunas. 60. 2. MATERIALES Y HETODOS. 62. 2.1 DISEÑO EXPERIEMTNÁL. 62. 2.1.1 Area de estudio. 62. 2.1.2 Tamaío de la muestra. 63. 2.2 CEPAS VIRALES DE REFERNCIA. 63. 2.2.1 Cultivos celulares. 64. 2.2.2 Reactivación de las cepas virales. 65. 2.3 ESTANDARIZACION DE LA TECHICA DE INMUNOPEROXIDASA INDIRECTA. 65. 2.3.1 Titulación de antisueros y conjugados. 66. 2.3.2 Detección inmunohistoquí.mica de antígenos virales en los tejidos. 70. 3. RESULTADOS. 75. 3.1 SELECCION DE CASOS. 75. 3.2 CEPAS VIRALES DE REFERENCIA. 81. 3.3 ESTANDARIZACION DE LA TECNICA DE INMUNOPEROXIDASA INDIRECTA. 84. 3.3.1 Titulación de antisueros y conjugados. 84. 3.3.2 Detección iniuunihistoquímica de los antígenos virales en los tejidos. 91. 4. DISCUSION. 98. CONCLUSIONES Y RECOMENDACIONES. 103. BIBLIOGRAFIA. 105. ANEXO. 118.
(16) LISTA DE TABLAS. P1G. TABLA 1. Tipos de neumonías. 76. TABLA 2. Frecuencia de síntomas respiratorios. 81. TABLA 3. Detección y ubicación de los antígenos virales por inmunoperoxidasa indirecta. 91. XVI.
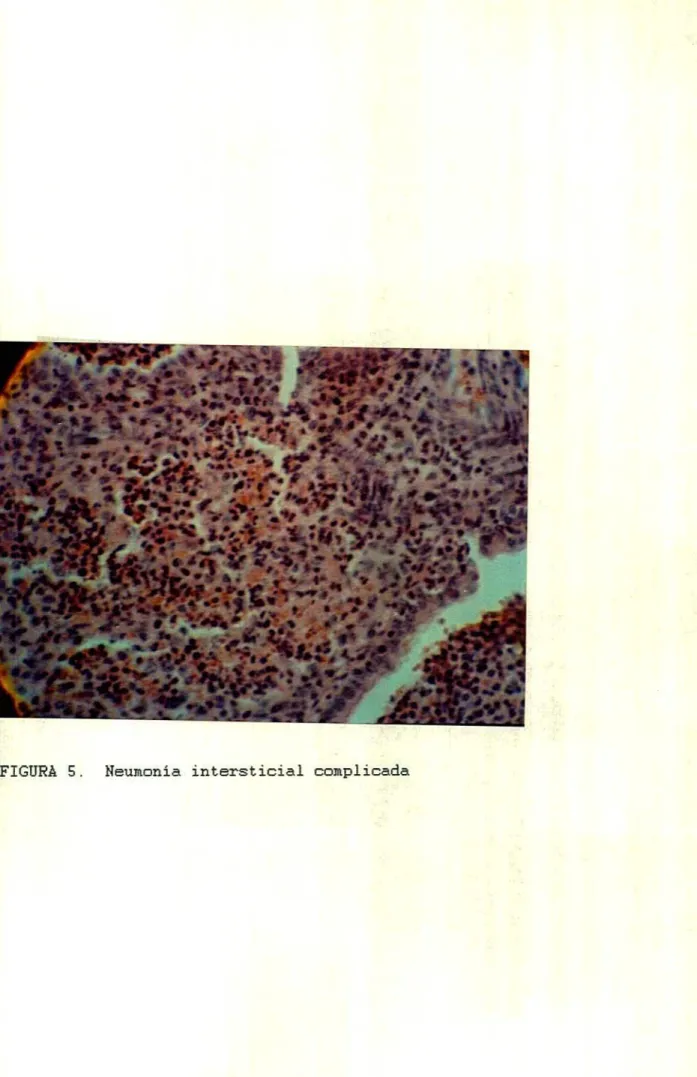
(17) LISTA DE FIGURAS PÁG FIGURA 1. Inmunoperoxidasa indirecta. 67. FIGURA 2. Inmunoperoxidasa indirecta complejo avidina biot ma. 68. FIGURA 3. Tipos de neumonía. 77. FIGURA 4. Neumonía intersticial simple hematoxilina eosina. 78. FIGURA S. Neumonía intersticial complicada. 79. FIGURA 6. Neumonía de células gigantes con sincitios. 80. FIGURA 7. Frecuencia de síntomas respiratorios FIGURA S. Cultivo celular P13 con efecto citopático y positividad para inmunoperoxidasa indirecta. 83. FIGURA 9. Cultivo celular IER con efecto citopático y positividad para inmunoperoxidasa indirecta. 85. FIGURA 10, Cultivo celular VRSB con efecto citopático y positividad para inmunoperoxidasa indirecta. 86. FIGURA 11. Inmunoperoxidasa indirecta negativa para VRSB en cultivo celular. 87. FIGURA 12. Control positivo de inmunofluorescencia indirecta para P13. 89. FIGURA 13. Control negativo de inmunofluorescencia indirecta para P13. 90. FIGURA 14. Inmunoperoxidasa positiva para P13 en tejido en células epiteliales bronquiales. 92. FIGURA 15. Inmunoperoxidasa positiva para IER en macrófagos t isulares. 94. XVII. e.
(18) FIGURA 16. Inmunoperoxidasa positiva para VRSB en el citoplasma de condrocitos. 9E. FIGURA 17. Inmunoperoxidasa negativa en tejido. 96. FIGURA 18. Detección y ubicación de los antígenos virales por inmunoperoxidasa indirecta. 97. XVIII.
(19) RESUMEN. Las afecciones del aparato respiratorio de los bovinos corresponden a una variada etiología, donde se encuentran implicados en forma directa virus, bacterias, hongos y protozoos. Entre los virus implicados se pueden mencionar Parainfluenza tipo 3 (PI 3 ), Rinotraqueítis infecciosa bovina (IBR), Virus Sincitial respiratorio bovino (VRSB), Diarrea Viral Bovina (DVB). Adenovirus y Reovirus entre otros. También se encuentran involucrados agentes bacterianos como Pasteurella sp. (Trigo. 1990). Un gran número de. técnicas han sido desarrolladas para el diagnóstico rápido de la infección viral, estas incluyen fijación de complemento, seroneutralización e inhibición de la hemaglutinación. Así mismo anticuerpos fluorescentes, cultivo de células y ELISA.. 1.
(20) El PI 3 e IBR crecen en cultivo celular HDBK, su crecimiento se evidencia entre las 48-72 horas. (Wyler, 1990). Para el VRSB se pueden utilizar líneas celulares HEp-2, KB o BTu. Entre dos y catorce días después de la inoculación de estos cultivos celulares se observan células gigantes características. (Dubovi, 1993). Recientemente se ha utilizado la técnica de inmunoperoxidasa que se basa en la detección de antígenos que se unen al anticuerpo específico es detectado indirectamente por la unión de un anticuerpo secundario y es revelado por la utilización de un substrato peróxido de hidrógeno y diaminobenzidina.. (Wyler.. 1990). Se realizaron cultivos celulares para los virus Parainfluenza tipo 3, virus de la Rinotraqueítis infecciosa bovina (IER) y Virus Sincitial respiratorio bovino (VRSB) para constatar su viabilidad y así poder realizar la titulación de los antisueros y conjugados obtenidos comercialmente.. Pósteriormente se realizó la prueba de inmunoperoxidasa indirecta sobre cortes de tejidos incluidos en parafina con los.
(21) antisueros de referencia y así identificar los antígenos de los virus en estudio..
(22) INTRODUCCION. En países en los que la industria pecuaria constituye uno de los pilares básicos de la economía, se han venido introduciendo y desarrollando constantemente nuevas tecnologías dentro de las que se destacan aquellas que buscan aumentar la rentabilidad de la explotación de los bovinos, incrementando genéticamente el potencial productor de los animales y aumentando la capacidad de carga de la tierra, al tener que competir con la agroindustria y con el desarrollo urbanístico en los llamados cinturones lecheros de las grandes ciudades.. Por esta razón, los productores se están viendo en la necesidad de hacer mucho más intensivas sus explotaciones, manteniendo en confinamiento los animales (establos, salacunas, terneriles) y creando, por lo tanto, ambientes propicios para la presentación o el incremento de ciertas patologías, especialmente en las relacionadas con el sistema respiratorio.. 1.
(23) Copea Centro de ccunient. CESA. En países altamente tecnificados como Estados Unidos y Canadá, las neumonías constituyen una de las limitantes que más pérdidas económicas produce en los bovinos en crecimiento. Al igual que la mayoría de las enfermedades, la mortalidad es la causa más obvia de las pérdidas económicas; sin embargo, se deben tener en cuenta además, los gastos médicos, los costos de tratamiento y prevención y principalmente el impacto negativo producido sobre el crecimiento y rendimiento de los animales recuperados.. Debido al componente etiolágico multifactorial, estas neumonías se conocen comúnmente como CoRplejo Respiratorio de los Bovinos, parte del cual se denomina Fiebre de E*barque cuando el transporte de los animales de los sitios de producción hacia los sitios de mercado, interviene como el principal factor desencadenante del problema respiratorio.. Cuando se descarta el transporte como principal desencadenante, se debe tener en cuenta un buen número de factores, entre los que se deben destacar las características anatómicas y fisiológicas del sistema respiratorio de los bovinos, el manejo y principalmente infecciones virales preexistentes que actúan como inmunosupresores del sistema respiratorio para que actúen agentes infecciosos determinantes, especialmente las Pasteurellas.. 2.
(24) Estos tipos de neumonías se conocen actualmente como Neumonía Enzoótica de los Terneros, de la cual se sabe que en Colombia su presentación es alta. El agente bacteriano más frecuentemente aislado es la Pasteurella sp, con la cual se han realizado estudios de serotipificación y en la mayoría de los casos se encuentran evidencias morfológicas de la participación de agentes virales entre los que sobresalen virus Sincitial respiratorio bovino, virus Parainfluenza tipo 3 y virus de la Rinotraqueítis infecciosa bovina, considerados en la actualidad como los causantes más importantes de las neumonías de los terneros en la mayoría de los países del mundo.. Debido a la situación anterior, el productor, en su afán de solucionar el problema de las neumonías está recurriendo, sin asesoría médica a la aplicación de inmunógenos polivalentes, correspondientes a etiologías aún no que van a crear confusiones futuras cuando se trate de establecer la situación etiológica real de su problema.. El propósito de la presente investigación fue estandarizar la técnica de inmunoperoxidasa indirecta para la detección de antígenos de los virus Parainfluenza tipo 3 (PI 3 ), de la Rinotraqueítis infecciosa bovina (IBR),. 3. Virus Sincitial.
(25) respiratorio bovino (VRSB) y luego aplicar la técnica mencionada para la detección de antígenos virales en cortes histológicos de muestras de pulmón de casos de campo comparando los hallazgos con controles positivos preparados con mono estratos de cultivos celulares infectados con los virus bajo estudio.. 4.
(26) 1. REVISION DE LITERATURA. 1.1 AGENTES ASOCIADOS CON EL COMPLEJO RESPIRATORIO DE LOS BOVINOS. En bovinos, la infección del tracto respiratorio por virus, como el Parainfluenza tipo 3 (P13), Virus de la Rinotraqueitis infecciosa bovina (Herpes Virus Tipo 1), Ádenovirus, virus de la Diarrea Viral Bovina (DBV) y el virus Sincitial respiratorio bovino (VRSB), se asocian con el complejo respiratorio. La inducción de este tipo de infecciones respiratorias están frecuentemente asociadas con una replicación viral inicial en las células epiteliales de la nasofaringe, seguida por una replicación viral sobre las células epiteliales alveolares tipo II y en los macrófagos alveolares, por lo cual el daño de estas células facilita la colonización pulmonar por algunas bacterias. (Trigo. 1990). La replicacián viral sobre las células epiteliales alveolares tipo II y macrófagos alveolares, cumple un papel importante en. Ri.
(27) la patogénesis de la neumonía viral.. (Birbestein y. colaboradores, 1971). Estos hechos se basaron en la identificación del antígeno viral o de las estructuras virales sobre las células epiteliales tipo II y los macrófagos durante el desarrollo de la neumonía y las evidencias del efecto citopático viral, como son las inclusiones virales citoplasmáticas y la formación de sincitios celulares en la luz alveolar. (ilkies y Shewen. 1988; Trigo, 1990; Castieman y colaboradores, 1991). Se encuentran también asociadas con el Coaplejo Respiratorio Bovino virus de menor importancia como Adenovirus. Reovirus y Rinovirus. Con relativa incidencia otro tipo de gérmenes como los Mycoplasmas. Actinomvces Dyogenes, Haemoohvlus sorn.mus y Clamydias .. (Merck, 1979; Castieman y colaboradores, 1991). 1.2 VIRUS SINCITIAL RESPIRATORIO BOVINO (VRSB). 1.2.1 Historia. El Virus Sincitial respiratorio fue aislado por primera vez en 1959 por Morris y colaboradores citados por.. 6.
(28) Sharma y Woldehiwet en 1991.. Luego Chanock aisló virus. similares de dos niíos enfermos de neumonía.. En 1970, investigadores reconocieron un virus similar al Virus Sincitial Respiratorio Humano que desarrollaba una enfermedad respiratoria en ganado vacuno. (Dubovi. 1993). En bovinos el virus fue recuperado por primera vez en Suiza de animales con signos de enfermedad respiratoria (Le Blanc y colaboradores. 1991; Smith y colaboradores, 1974). En Estados Unidos, el primer aislamiento del VRSB fue reportado en 1974 en Iowa y }fissouri por Rosenquist. (Rosenquist, 1974). 1.2.2 Características generales. El Virus Sincitial Respiratorio (VRS), fue denominado así por los efectos citopáticos que produce consistentes en la formación de sincitios. Un sincitio es una masa multinucleada de protoplasma producido por la unión o fusión de células. La formación de sincitios no se produce en todas las circunstancias, sino que depende de ciertos factores como el aislamiento viral, condiciones celulares, y tipo de células. Además, se ha reportado que el VRS puede producir cuerpos de inclusión eosinófilicos. (Pringle, 1985). 7.
(29) 1.2.3 Clasificación. El VRS inicialmente fue clasificado en la familia Paramixoviridae, pero después fue incluido en un nuevo género, los Pneumovirus (Westenbrink y colaboradores. 1985; Belknap y colaboradores. 1991). Esto debido a que los Paramixovirus tienen hemaglutinina y neuraminidasa, y este virus no posee dichas proteínas; además, las glicoproteínas y el nucleocapside del Virión del VRS son diferente los del Paramixovirus.. (Baker, 1991; Walravens y colaboradores, 1990;. Baker, 1993). 1.2.4 Características físicas y biológicas.. El VRS es un. virus RNÁ de cadena sencilla y polaridad negativa.. La. replicación se realiza en el citoplasma, se madura y se desarrolla en el límite de la membrana celular.. (Stott y. Taylor, 1985). El VRS mide entre 80 y 500 nm de diámetro. La gravedad especifica del mismo oscila entre 1.16 y 1.26 gramos por mililitro. (Maker y colaboradores, 1980; Pringle, 1985). El VRS es inactivado con éter, cloroformo, tripsina y desoxicolato de sodio. Es inactivado a un pH de 3. 0, pero recupere su estabilidad a un pH de 4,0. (Stott y Taylor, 1985). 8.
(30) El genoma del VRS está conformado por diez genes, dos de ellos codifican para dos glicoproteínas mayores: la glicoproteína G. cuyo peso aproximado es de 90K y la glicoproteína F. una proteína de fusión sintetizada a partir de una molécula precursora FO de 70K con adherimiento proteolítico dentro del puente disulf uro 48 K (Fi) y 23 1< (F2). Esta adición es un prerrequisito para la actividad de fusión y es llevada afuera por las proteasas celulares. (Walravens y colaboradores. 1990). Las proteínas mas importantes en el desarrollo viral son las glicoproteínas G y F involucradas directamente en la producción de la inmunidad. (Westenbrink y colaboradores. 1989; Connors y colaboradores. 1991). El VRS tiene una densidad de 1,23 gramos por mililitro en CsCl2 y su efectividad puede ser destruida a 56 C por treinta minutos. (Martin. 1978). La infectividad del VRSB puede ser estabilizada para el transporte al laboratorio, adicionando Mg, Ca. Glucosa o Sucrosa al medio de transporte (Martin. 1978). Sin embargo, el VRSB solo se desarrolla específicamente en células bovinas. (Baker, 1993). 9.
(31) La estructura y forma de mutación del VRSB (VRSE) es muy similar al virus Sincitial Respiratorio Humano (VRSH). Ambos son similares morfológicamente pero con diferente estructura antigénica (Thomas. 1978). Cash y I(immo citados por Holzhauer en 1978, identificaron ocho polipéptidos virales en el VRSB con un peso molecular similar en humanos.. La diferencia específica entre los dos virus (humano y bovino) radica en las fracciones VF48 y VP10 cuyo peso específico es diferente. (Westenbrink y colaboradores. 1989; Sharma y Woldehiwet, 1991). Actualmente se pueden distinguir dos subgrupos de VRSH. La mayor diferencia antigénica está en la proteína G. Las cepas de VRSB pueden ser clasificadas en un grupo separado compartiendo epítopes con más proteínas de los dos subgrupos humanos, pero son distintos con respecto a los epítopes en la proteína G. (Westenbrink y colaboradores, 1989). El ganado bovino puede ser infectado por cepas bovinas y cepas humanas de VRS puesto que tienen un alto grado de reactividad cruzada. (Stewart y Gershwin, 1990). 10.
(32) 1.2.5. Antígenos virales. El VRSB posee ocho polipéptidos de. los cuales tres son glicosilados (G. Fi y F2) y cinco (N. L, P, M, 22K) son proteínas de membrana no glicosiladas. La secuencia de nucleótidos de los genes codifican la glicoproteína G (adhesión). glicoproteína F (fusión). fosfoproteína M (matriz) y proteína SH (hidrof óbica). (Connors y colaboradores. 1991,. Baker, 1993). Se considera que, la glicoproteína G es responsable de la unión de las partículas virales a la superficie celular. La glicoproteína F (fusión) promueve la entrada de las partículas virales dentro de las células y la propagación del virus entre células por fusión célula a célula.. (Westenbrink y. colaboradores, 1989; Tjeerd y Kimman. 1993). El virus ataca a las células susceptibles a través de la glicoproteína G, pero los receptores celulares específicos no han sido determinados.. A 37 C aproximadamente, el 60 del. virus es adsorvido por las células susceptibles. y para. completar su adsorción requiere de diez a doce horas. La replicación del virus ocurre en el citoplasma con el desarrollo del ciclo de infección. (Bohiender, 1982). 11.
(33) "ilcorp-ilca c Centro de Documentación CEISA. 1.2.6 Patogénesis. La infección inicial resulta de la multiplicación del virus en las células epiteliales de las vías respiratorias altas; luego se propaga a los bronquios, bronquiolos e incluso al parénquima pulmonar. Esta diseminación del virus al aparato respiratorio inferior, con la producción concomitante de enfermedades mas graves, se debe por lo menos en parte, a la ausencia de anticuerpos y a la falta de respuesta secundaria en terneros no infectados.. (Al Darraji y. colaboradores, 1982; Le Blanc y colaboradores, 1991) El ataque neumónico puede ser focal o difuso llegando a comprometer lóbulos completos de uno o ambos lados. Las zonas afectadas tienen color azul-rojo, aparecen congestionadas y subcrepitantes. Los pulmones suelen estar aumentados de peso. En la superficie de corte se puede apreciar un líquido rojo y espumoso, dado que la mayor parte de la reacción es intersticial y escapa poco exudado inflamatorio. La pleura es lisa y con poca frecuencia se advierte pleuritis o derrame pleural. (Bryson, 1993). Los macrófagos tienen la capacidad para soportar la replicación viral productiva. Esta replicación, tiene un importante papel en la patogénesis de la neumonía viral y sus secuelas, incluyendo la sobreinfección bacteriana. (Adair y Mc Nulty, 1992). 12.
(34) Se ha descrito un patrón bifásico en los signos clínicos de la enfermedad respiratoria producida por VRSE. Primero, aparece una leve enfermedad respiratoria, seguida por una recuperación. Luego, en algunos días o semanas se desarrolla una segunda fase, la cual se caracteriza por una disnea pronunciada, edema pulmonar y enfisema. (Ellen y Belknap, 1993) La entrada del agente infeccioso a los bronquiolos conlleva a una bronquiolitis marcada con erosiones locales de la mucosa (Eryson, 1993).. Los signos clínicos aparecen después del tercer al quinto día de incubación; en esta etapa de la infección es muy difícil la detección del virus. (Ellen y Belknap, 1993). Inicialmente, los bovinos con infección presentan una predominante secreción nasal y descargas oculares. En algunos estadios de la infección, se observa incremento de la temperatura rectal en un rango de 40 a 42,5 C.. (Ellen y. Belknap. 1993; Tjeerd y Kimman. 1993). Además, los animales infectados se observan frecuentemente cerca a los bebederos, aunque el consumo de agua puede disminuir debido a una disnea severa. Comúnmente estos animales están flacos y deshidratados. (Ellen y Eelknap, 1993). 13.
(35) Se tiene evidencia que la replicación viral en células epiteliales alveolares tipo II y en macráfogos alveolares, juegan un papel importante en la patogénesis de la neumonía viral. Histológicamente, el principal hallazgo de la enfermedad, en animales naturalmente infectados, es la presencia de células sincit jales en el epitelio bronquiolar y en el parénquima alveolar. Estas células contienen cuerpos de inclusión eosinófilicos intracitoplasmáticos. (Haines, 1989). Otros cambios histológicos importantes incluyen neumonía intersticial difusa con engrosamiento de las paredes alveolares, proliferación del epitelio bronquiolar, epitelización alveolar, formación de membranas hialinas y edema en los espacios alveolares. (Done y colaboradores. 1990). En terneros infectados experimentalmente se han encontrado rinitis focal degenerativa y bronquiclitis catarral; otros reportan lesiones histológicamente severas, consistentes en pérdida del epitelio, hiperpiasia y metaplasia del mismo, engrosamiento de los septos interalveolares y presencia de exudado en los alvéolos. (Le Blanc y colaboradores. 1991). 14.
(36) a-CorpokC Centro de Documentación. CEISA En casos no complicados, el examen postmortem revela escasas lesiones microscópicas. El aislamiento del virus en estos casos se puede hacer con muestras provenientes de secreción nasal, bronquios, tráquea y pulmón. (Lehmukulh y colaboradores. 1979). 1.2.7. Inaunología:. 1.2.7.1 Inunologia humoral. Existen varias investigaciones sobre la respuesta humoral de anticuerpos en terneros infectados natural o experimentalmente con VRSB, pero hay muy poca información sobre el papel de la respuesta inmune mediada por células.. Entre las pruebas serológicas utilizadas para el diagnóstico de la infección por VR5B se pueden mencionar pruebas de fijación de complemento, neutralización, inmunof luorescia indirecta, reducción de la formación de placas y ELISA. Estas pruebas han sido usadas para detectar anticuerpos contra VRSB en terneros. Los estudios han reportado que dichos anticuerpos pueden aparecer desde el tercer día post-infección, hasta después de 21 a 30 días. (Kumar y colaboradores. 1987). En suero, se detecta IgG2 y solo veintinueve días después IgH. La respuesta primaria se detecta en los 8-10 primeros días post-. 15.
(37) inoculación con VRSB, específicamente se desarrollan anticuerpos tipo Ig H, los cuales aparecen simultáneamente en fluídos de exudado nasal, a pocos días después de desarrollarse la IgA. Así mismo, transcurridos 13-17 días post-inoculación, aparece IgGl en suero, pero no en otros sitios. (Kimman y colaboradores. 1987). El papel de los anticuerpos séricos en la resistencia a la infección, no está bien definido. Parece que la presencia de anticuerpos neutralizantes no se correlaciona con la protección. Esto explica el hecho de que se presenten brotes frecuentes en la misma finca todos los aios. Además, altos títulos de anticuerpos en el calostro no protegen contra la infección, esto sugiere que la protección puede ser no necesariamente mediada por neutralización. (Birbestein y colaboradores. 1971). Thomas y Swam, citado por Davidson y colaboradores en 1981, demostraron que la inmunidad pasiva, adquirida por el calostro, ayuda a la protección contra las enfermedades respiratorias. Estudios recientes han comprobado que los anticuerpos maternales no previenen a los bovinos de la infección por VRSB, pero entre la incidencia y la severidad de la enfermedad existe una relación inversamente proporcional a los niveles específicos de. 16.
(38) anticuerpos maternales presentes en el suero (Kimman y colaboradores, 1988; Ames, 1993).. En un experimento se detectaron anticuerpos neutralizantes en secreciones nasales de cinco terneros criados convencionalmente, catorce días despues de la infección experimental. Las. inmunoglobulinas IgM e IgA se han detectado en secreciones nasales, lavados pulmonares y heces de terneros no calostrados e inoculados experimentalmente, ocho a diez días post-inoculación. Los terneros con anticuerpos neutralizantes en las secreciones resisten el desafío con VRSE mejor que los que presentan anticuerpos séricos.. (Ellis y colaboradores, 1992; Tjeerd y. Kimman, 1993). Se ha observado que después de la reinfección se desarrollan anticuerpos antagonistas de la glicoproteina G, la matriz protéica, la fosfoproteína y la proteína 22K. Entonces hay una mayor disminución de la inmunogenicidad para la glicoproteina G que para la F. La responsable de la disminución de la inmunogenicidad es el aumento del porcentaje de carbohidratos (65'.) de la glicoproteína G. (Cannors y colaboradores, 1991). Los bovinos pueden ser susceptibles a la reinfección experimental con VRSB con facilidad luego de tres semanas de. 17.
(39) haber transcurrido la infección inicial. Aunque la reinfección con VRSB a veces ocurre en el campo, esta no está acompa?ada por signos característicos. Dicha reinfección no es atribuible a una variación antigénica. (ICimman y colaboradores. 1987). Actualmente se reconoce que los anticuerpos tipo IgG son directamente antagonistas de los epítopes de las glicoproteínas F y G del VRSB que son capaces de neutralizar el virus in vitro. (Anderson y colaboradores, 1985). En los rumiantes se sabe que el paso transpiacentario de inmunoglobulinas es prevenido por la placentación epiteliocorial. (Kimman y colaboradores. 1989) Los terneros que nacen agammaglobul inémicos con anticuerpos derivados maternalmente para VRSE pueden ser controlados por la ingestión o no del calostro. (Belknap y colaboradores 1991) De otro lado, es claro que la IgG es la de mayor importancia en la protección de los terneros recién nacidos, contra la diarrea y la septicemia. Sin embargo, la relación entre concentraciones de IgG en el suero y la enfermedad respiratoria no ha sido bien establecida. (Davidson y colaboradores, 1981). 1.2.7.2 Inmunidad celular. El papel de la inmunidad mediada por células en infeciones respiratorias de terneros debidas a. 18.
(40) Ss. ,... Centro. 4.S•. d d 3 Document0c. CEISA. VRSB ha sido poco investigada. La prueba de transformación de linfocitos, la. inhibición. de la migración de leucocitos y la. liberación del cromo se han usado para probar respuesta inmune mediadas por células en niios, ratas y ratones. En terneros se ha evaluado la respuesta de transformación de linfocitos, la inhibicion de la migración de leucocitos y la prueba de hipersensibilidad retardada. (Adair y Mc Nulty, 1992). El antígeno del virus vivo induce la respuesta de los linfocitos T la cual se evidencia por una proliferación. No existe una correlación entre la respuesta proliferativa de linfocitos T y la formación de anticuerpos neutralizantes en el suero, pero si ha sido encontrada una relación entre la proliferación de linfocitos y el nivel de protección.. (Ellis y colaboradores,. 1992). Una posibilidad es que el virus solo o unido a anticuerpos puede interactuar con células para servir de mediador de inflamación y a la vez contribuir al proceso de la enfermedad. Se ha demostrado que el complejo antígeno-anticuerpo para VRSB estimula la producción de tromboxano en neutrófilos causando contracción del músculo liso. Recientemente se ha asociado la concentración de leucocinas C4. 19. (LTC4) en secreciones.
(41) respiratorias con bronquiclitis por VRSB. (2&nanaba y Anderson, 1991). En pulmones inoculados con VRSB se obtuvo una baja respuesta de linfocitos T activados por la fitohemaglutinina. El mecanismo de esta depresión todavía no se conoce, pero la reducción de la relación de linfocitos T ayudadores y linfocitos T supresores se ha descrito en bovinos inoculados y reinoculados. (Tjeerd y Kimman. 1993). En otro estudio reciente se observó una disminución del número de receptores Fc para IgG en macrófagos alveolares de ganado bovino durante una inoculación experimental con VRSB, esto hace pensar en una posible predisposición a una infección secundaria bacteriana. (Adair y Mc Nulty, 1992). Se han propuesto varios mecanismos para explicar la severidad de la enfermedad en brotes de campo. La neumonía intersticial atípica asociada con el VRSB se puede deber a reacciones de hipersensibilidad, las cuales se han asociado con la severidad de la segunda fase de la enfermedad. En esta fase se logra la recuperación clínica con el. uso de corticoides y. antihistamínicos. (Davidson y colaboradores, 1981). 20.
(42) En general se considera que las. infecciones. respiratorias. virales como es el caso de la producida por el Virus del género Influenza y los pertenecientes al género Senda¡, tienen la capacidad de suprimir las defensas pulmonares del huésped, causando alteraciones en las. funciones. de los macrófagos. alveolares. Numerosos experimentos in vitro han demostrado que los macrófagos alveolares bovinos son variablemente susceptibles a la infección con PI 3 , IER, BVDV y VRSE. (Castleman y colaboradores. 1991; Ádair y Mc Nulty, 1992). 1.2.8 Diagnóstico de laboratorio. Los problemas asociados con el aislamiento de los virus, siempre han estado por encima del uso de métodos tradicionales haciendo necesario la aparición de otros métodos alternativos como la inmunofluorescencia, la inmunoperoxidasa y pruebas inmunoenzimáticas. (Stott y Taylor, 1985). Para el diagnóstico es necesario el aislamiento del virus o la demostración de una elevación en el título de anticuerpos. En general, los métodos de diagnóstico serológicos son exactos y sencillos, bien sea utilizando la fijación de complemento o la seroneutralización. Sin embargo, los animales de corta edad pueden no producir un título de anticuerpo detectable, por lo que en estas circunstancias el diagnóstico de laboratorio tan. p. 21.
(43) solo puede llevarse a cabo mediante el aislamiento del virus. (Dubovi, 1993). Dado que el Virus Sincitial Respiratorio es extraordinariamente lábil, para su aislamiento se debe realizar un inóculo de secreciones nasales o faríngeas en cultivos de líneas celulares humanas continuas (HEp-2, KB) o en cultivos primarios de células renales de mono. Entre los dos y catorce días después de la inoculación viral en los cultivos celulares aparecen las células gigantes características. (Dubovi, 1993). La experiencia ha mostrado que las muestras de tejido que contienen altas concentraciones de antígeno de VRSB pocas veces pueden inducir infección en cultivos celulares. Las preparaciones de muestras de tejidos pueden contener anticuerpos neutralizantes los cuales interactúan con virus libres en la muestra. La muestra ideal para aislamiento de VRSB o algún patógeno respiratorio es obtenida de lavado traqueal o pulmonar, de tal forma que las muestras pueden servir para aislamiento de bacterias, mycoplasma, así como también de virus.. Las muestras se deben obtener en los estadios tempranos de la enfermedad y transportar dentro de las primeras veinticuatro horas al laboratorio. La colección de las muestras después de -. oís 22. rm-ff.
(44) pocos días de tratamiento, puede conllevar a resultados negativos. (Dubovi, 1993). Si las muestras de lavado traqueal no son factibles, los hisopos nasofaringeos también pueden ser utilizados, pero la calidad de las muestras es extremadamente importante para la obtención de resultados positivos. Los hisopos se pueden llevar en un medio de transporte viral y guardar durante la noche en nevera, pero no en congelación. (Dubovi, 1993). La congelación lenta da como resultado la pérdida del 90 al 994 de la capacidad infecciosa de la muestra, que desaparece por completo si se conserva durante unos días a temperaturas entre -15 y -25 C. (Baker y colaboradores, 1985). 1.2.8.1. Prueba de anticuerpos fluorescentes. La prueba de. anticuerpos fluorescentes es una técnica ideal para demostrar la presencia de VRSB y es una de las más rápidas, de mayor conf iabilidad y sensibilidad para el diagnóstico de infección común por VRSB. La confiabilidad de esta prueba depende de la especificidad de los anticuerpos utilizados. (Dubovi, 1993). Esta prueba consiste en marcar un suero específico con un componente fluorescente, el cual reacciona con el antígeno; si. 23.
(45) ocurre la unión antígeno-anticuerpo habrá una reacción de fluorescencia, la cual se observa en un microscopio adecuado. (Cook y colaboradores. 1972; Arnold y colaboradores, 1975; Stevens y colaboradores, 1985; Guzmán, 1986; Skilbeck, 1986). 1.2.8.2 Técnica de inRunoperoxidasa. La inmunohisto-química combina el análisis microscópico de histopatología con la identificación potencial del agente por técnicas inmunológicas (Hasson y colaboradores. 1993).. Es un método de diagnóstico inmunohistoquixaico con variadas aplicaciones.. (Mesa-Tejada y Pascal, 1977; Delellis y. colaboradores, 1979). En esta técnica los tejidos se pueden. fijar en formol e incluir en parafine. (Haines, 1989; Scanziani, 1991) El fundamento de la técnica tiene los mismos principios básicos de la inmunofluorescencia.. En el método directo un anticuerpo conjugado con peroxidasa tiene especificidad directa contra el antígeno en estudio (Nakane, 1975) y la adición de un sustrato hace posible la visualización de la reacción; previo a esta reacción se debe destruir la peroxidasa propia del tejido para que no haya interferencia con el marcado.. 24.
(46) En el método indirecto, el antisuero primario se aplica inicialmente contra el antígeno en estudio para el cual debe ser específico, seguido de una anti-IgG de la especie en la cual se produjo el anticuerpo primario. Esta anti IgG es producida en otra especie y luego se conjuga con peroxidasa; los demás pasos del procedimiento son similares a los del método directo.. Existen algunas variaciones en el método indirecto como son Feroxidasa Anti-Peroxidasa (PAF), Complejo Avidina-Biotina (ABC), triple sandwich. (Taylor. 1978) Los antígenos a investigar aparecen como depósitos cromógenos coloreados en el tejido, en los sitios de unión antígeno-conjugado, estos cromógenos son permanentes y visibles con microscopio común. Además, las secciones de los tejidos son marcadas con la coloración corriente de histoquíiaica y de esta forma, los detalles morfológicos del tejido se observan simultáneamente con la distribución del inmunomarcado.. (Tripathy y Hanson, 1974;. Haines y colaboradores, 1992). El método indirecto es más sensible que el directo y más versátil debido a la capacidad del antisuero secundario para reconocer las inmunoglobulinas del anticuerpo primario. (Taylor, 1978) Dentro de este método sensible se encuentra el del complejo Avidina-Biotina, el cual tiene como base la gran. 25.
(47) afinidad que tiene la molécula glicoprotéica de Avidina por la pequeía molécula de vitamina Biotina.. La unión entre la Avidina y la Biotina es un millón de veces más grande que la unión de los anticuerpos a muchos antígenos; además, la Avidina tiene cuatro sitios de unión para la Biotina o para muchas otras enzimas o anticuerpos; estos aspectos hacen que los complejos se agranden entre la Avidina y las enzimas Biotino-marcadas haciéndolas más sensibles.. Uno de los procedimientos de marcaje Complejo Avidina-Biotina (ABC) se basa en la unión del antígeno al anticuerpo primario y de este complejo al anticuerpo secundario Biotino marcado, al cual se le agrega Avidina natural no marcada y luego Biotina unida a Peroxidasa. En este procedimiento solo se nombran las diferencias de esta técnica con las otras. (Guesdon y colaboradores. 1979; Hsy y colaboradores, 1981). 1.2.8.3 Técnica de seroneutralización. La seroneutralizacián ha sido ampliamente utilizada para la detección de anticuerpos en varias entidades virales., siendo una prueba de gran utilidad y significado diagnóstico ya que los anticuerpos neutralizantes son los que generalmente inhiben la replicación del virus en el huésped. Por esta razón, las demás pruebas serolágicas como. 26.
(48) ELISA. fijación de complemento, iniaunodifusián e inhibición de la hemoaglutinación son estandarizadas y comparadas con la seroneutralización. (Dubovi, 1993). 1.2.8.4 Técnica de ELISA. La técnica de ELISA es un ensayo inmunoenzimático de tipo heterogéneo en el que se emplea generalmente un soporte sólido al cual se fija uno de los componentes de la reacción inmunológica (anticuerpo), poniendo luego el sistema en contacto con una fase fluida que contiene el reactivo complementario (antígeno a determinar). El complejo inmunológico aquí formada se enfrenta luego a un segundo anticuerpo o molécula capaz de reconocer el reactivo complementario (antígeno) de la fase fluida, éste va marcado con una enzima a la que se agrega un sustrato complementario. El producto se mide luego electrofo tomé tricamente y su calor es proporcional a la cantidad de sustancia a determinar. (Wstenbrink y colaboradores, 1985). 1.2.8.5 Detección de ácido nucléico. Con la delineación de la secuencia de ácidos nucléicos para VRSB es posible el uso, de pruebas de ácido nucléico para el diagnóstica de la infección. Estas piuebas se basan en la reacción de la polimerasa, que ha sido desarrollada para la detección de la secuencia de ácidos nucleicos del VRSE. Este procedimiento es rápido y específico. 27.
(49) para el diagnóstico y se puede utilizar como prueba de rutina en el laboratorio de diagnóstico. (Dubovi, 1993). 1.2.9 Tratamiento. Para la terapia de soporte es recomendado el aislamiento de los terneros afectados de dos a tres días para la identificación de animales anoréxicos. La deshidratación se puede corregir con la administración oral de fluidos y electrolitos. (Bohiender y colaboradores, 1982). En cuanto a los animales anoréxicos se les puede suministrar inyecciones de vitaminas pertenecientes al complejo B. (Baker. 1993). La neumonía bacteriana está comúnmente asociada a la infección por VRSB por lo tanto es necesario la selección de agentes antimicrobianos, dirigidos principalmente contra los tres agentes más importantes de la neumonía bacteriana como son: Pasteurella haemolytica. Pasteurella multocida. y Haemmothvlus somnus. (Baker, 1993). Los antimicrobianos efectivos contra los microorganismos Gram negativos mencionados, se pueden dar en ciertas dosis con una frecuencia determinada. El Ceftiofur sodium (Naxcel-Up John) y el Tilmicosin fosfato (micotil-Elanco Animal Health), son los. 28.
(50) antibióticos de elección, pero se debe tener en cuenta que estas drogas no pueden ser administradas en periodo de lactancia. (Baker, 1993). La infección por \TRSB, se puede tratar con corticoesteroides y antihistamínicos. Por los efectos inmunosupresores de los cort ¡caes teroides y su uso indiscriminado, no son recomendados para el tratamiento de la infección.. Unicamente los. corticosteroides no esteroidales utilizados como droga antinflamatoria, no causan inmunosupresión. (Bohlender, 1982) Las drogas antivirales no están aprobadas en el tratamiento de la infección con VRSB; sin embargo, el uso del Ribavirin si ha sido aprobado en niíos infectados por VRSH ya que es un antagonista del RNA y DNA viral. (Bean, 1992). 1.2.10. Epidemiología.. Las infecciones por VRSB ocurren a. diario en terneros y vacas adultas. (Belknap y colaboradores, 1991).. Estas pueden sufrir una infección respiratoria. únicamente o en combinación con bacterias y otros patógenos virales del Complejo respiratorio bovino. colaboradores, 1992; Ellen y Belknap, 1993). 29. (Ellis y.
(51) ha sido. Hasta el presente el virus Sincit ial respiratorio aislado del hombre, bovinos, ovinos y caprinos.. (Tjeerd y. Kimman, 1993). Actualmente el virus Sincitial respiratorio es reconocido como la causa más importante de enfermedad del tracto respiratorio en terneros, por las siguientes razones:. - El VRSB ha sido reconocido en recientes aíos como el mayor componente viral de enfermedad del CoRplejo Respiratorio Bovino.. - La incidencia de infecciones causadas por el virus Sincitial respiratorio bovino es alta, existe correlación entre la infección y la ocurrencia de la enfermedad respiratoria.. - El VRSB tiene una predilección por el tracto respiratorio bajo, y puede actuar sinérgicamente con bacterias causando neumonía.. 1.2.11 Prevalencia. La infección con VRSB es un evento común y esto ha sido comprobado por el porcentaje de bovinos con título de anticuerpos contra el VRSB en el suero. La prevalencia de anticuerpos reportada en Estados Unidos es del 65. 30.
(52) al 81 (Baker y colaboradores, 1985). En Inglaterra, el reporte de prevalencia de anticuerpos es del 94/ (Hartin, 1983), en Francia del 50% y en Canadá del 78,5% (Durham y Hassard, 1990).. 12.12 Transaisión. Los bovinos infectados transmiten el virus Sincitial respiratorio a los animales susceptibles, por medio de los aerosoles de las secreciones, las cuales penetran al tracto respiratorio de los bovinos susceptibles (Kahrs, 1981) . Esta es una de las causas por las cuales se puede aislar el VRSB tanto de animales asintomáticos, como de animales que han sido infectados siete meses antes.. (Lehmkuhl y. colaboradores, 1979). 1.2.13 Control. La enfermedad respiratoria bovina es un seria problema en los paises productores de ganado bovino. Esta enfermedad ocasiona grandes pérdidas económicas. Además la alta mortalidad y los altos castos de los tratamientos reducen los porcentajes de ganancia. (Kelling, 1993). Para el control de la enfermedad se utilizan das tipos de vacunas, la vacuna de virus vivo modificado (MLV) y la vacuna inactivada de VRSB (VV), ambas vacunas tienen similitudes y diferencias. (Ellis y colaboradores, 1992; Kelling, 1993). 31.
(53) Se conoce que los dos tipos de vacuna estimulan anticuerpos neutralizantes y una respuesta mediada por células T en terneros. (Westenbrink y colaboradores, 1989). El tiempo de vacunación es crucial porque la respuesta inmune para la vacuna de virus vivo modificado (MLV) puede ser interferida en terneros por títulos de anticuerpos maternales para VRSB, por lo tanto la vacunación depende de la desaparición de dichos anticuerpos. Algunos animales deben ser vacunados varias veces antes de encontrar un nivel de protección adecuado. (Kimman y Westenbrink. 1990; Kelling, 1993). 1.3 RINOTRAQUEITIS INFECCIOSA BOVINA (IBR). 1.3.1. Historia.. El herpes virus-1 bovino (HVB-1) fue. reconocido en la década de los cuarenta, como causante de infección respiratoria en Colorado (Estados Unidos).. La. Rinotraqueitis infecciosa bovina (IBR) se comprobó por primera vez en Estados Unidos, en 1956, proveniente de Europa.. (Van. Donkersgoed y Babiuk, 1991). En Colombia el virus IER fue aislado en 1976 por primera vez de ganado lechero de la Sabana de Bogotá, de animales con. 32.
(54) sintomatología respiratoria característica.. (Villate y. colaboradores. 1976). 1.3.2 Generalidades. El HVB-1 realiza su multiplicación en el núcleo produciendo corpúsculos de inclusión intranucleares en la célula huésped, tanto in vivo como in vitro. (Homan y Esasterday. 1980). La latencia viral es una característica común de los herpes virus. Este estado implica una completa o parcial inhibición de la expresión genética viral pero que es revertida en situaciones de estrés; presentando como resultado recidivas de la enfermedad. (Clements y Hay, 1977). El virus puede permanecer en este estado en las células epiteliales y en los tejidos nervioso y linfoide, dependiendo de la vía de entrada del virus al huésped. (Ackerman y colaboradores. 1990). Hasta el momento no se conoce el mecanismo mediante el cual el virus permanece en estado latente en estos tejidos. Algunos investigadores han sugerido que la respuesta de anticuerpos juega un papel importante en la modulación de este estado. (Homan y Easterday, 1980). 33.
(55) 1.3.3 Clasificación. El agente etiológico de la Rinotraqueitis infecciosa bovina (IER), pertenece a la familia Herpes viridae, sub familia Alphaherpesviridae, grupo herpes virus bovino tipo 1 (EHV-1). (Roizman, 1982). 1.3.4 Etiología. El herpes virus-1 (BHV-1) puede ser dividido en tres subtipos, subtipo-1 causa la infección respiratoria; subtipo-2 causa infección respiratoria y genital y el subtipo-3 causa primordialmente infección neurológica. (Kahrs, 1977; Van Donkersgoed y Babiuk. 1991). Ocasionalmente los casos aislados de IER son observados en animales vacunados, muchas veces siguiendo algún estrés, después de haber ocurrido una mezcla de animales. (hetstone y colaboradores, 1986). Los altos niveles de estrés pueden ser inmunosupresivos y exponen al animal a plétora de otros virus y bacterias. (Van Donkersgoed y Babiuk, 1991). La enfermedad ocurre en animales después de los seis meses de edad, probablemente por su alta exposición al virus (Brown y Shin, 1990). 34.
(56) Corporrn Centro d0 Documente.. CE. 15. Igualmente se sabe que la enfermedad aparece comúnmente en grandes grupos de bovinos confinados en establos y granjas. (Bloed y colaboradores. 1983). El virus ha sido aislado de casos de enteritis en bovino y de semen liofilizado. (Eleod y colaboradores. 1983). 1.3.5 Características físicas y biológicas. El EHV-1 posee un diámetro de 200 nm aproximadamente y está constituido por:. - El núcleo o core que contiene el ADN. (Wildy y colaboradores. 1960; Furlong y colaboradores. 1972). - Un capside icosaédrico de aproximadamente 100 nm de diámetro. (Wildy y colaboradores. 1960) - Una zona granular envolvente, formada por proteínas globulares y finalmente una envoltura fosfolipídica. (Roizman. 1982). El virus Herpes tipo 1 es sensible al éter, tripsina, detergentes, cambios extremos de pH y choques osmóticos. (HcNair Scott y Tokumaru, 1965) Además, tiene una estructura compleja, organizada en forma icosaedríca y compuesta por 162. 35.
(57) capsómeros. El ADN es lineal y de doble cadena.. (Furiong y. colaboradores. 1972). Hasta el presente se reconoce que el virión posee de 25-33 polipéptidos estructurales, un total de once de estos han sido identificados como glicoproteínas. Se sabe también que las principales glicoproteinas responsables de la respuesta inmune son GpI, GpIII, GpIV. (Clements y Hay, 1977). 1.3.6 Antígenos virales. Las proteínas de HVB-1 han sido denominadas como alfa, beta y gamma, dependiendo del orden temporal de síntesis y la progresión sucesiva de los procesos fisiológicos en las células infectadas. (Roizman. 1982). Las proteínas virales que conforman la estructura del virus herpes, se encuentran localizadas en la envoltura del mismo. Estas proteínas son de tipo glicoprotéico y juegan un papel muy importante, ya que son los blancos del sistema inmune y se expresan no solo en la envoltura del virián, sino también en la membrana de las células infectadas. Su función es de reconocimiento, unión y adsorción a las células y penetración del virus dentro de las células. (Little y Jofre, 1981). 36.
(58) Así mismo, estimulan la respuesta inmune del huésped a la infección representada por neutralización viral, lisis o destrucción de las células infectadas.. (Jhonson y Feenstra.. 1987). Debido a la gran cantidad de glicoproteínas que conforman el BHV-1 ha resultado difícil determinar la función específica de cada una de ellas en el virus. (Little y Jof re, 1981). 1.3.7 Patogénesis. La Rinotraqueítis infecciosa bovina es una enfermedad altamente infecciosa. En los animales enfermos se observa rinotraqueítis, conjuntivitis y fiebre; la evolución es corta con una alta tasa de recuperaciones. Otros síndromes que se pueden presentar son los de encefalitis, que es la forma sistémica de la enfermedad en los neonatos y Vulvovaginitis Pustulosa Infecciosa (VPI) ambos causados por el mismo virus. (Kahrs, 1977). Esta enfermedad presenta cinco formas clínicas: respiratoria, genital, conjuntival, inducción de aborto y forma encefálica. Las infecciones producidas por Vulvovaginitis Pustular Infecciosa (VPI) y la infección causada por el virus de la queratoconjuntivitis son idénticas a la infección producida por IBRV. (Elcod y colaboradores, 1983). 37.
(59) 1.3.7.1 Forma respiratoria. Los síntomas varían de inaparente a severos y se desarrollan en un período de incubación de cuatro a seis días. La infección es caracterizada por convulsiones y fiebre alta. (Dyer, 1981). Los animales afectados presentan anorexia, depresión, secreción nasal, salivación, hipernea y disnea. La mucosa nasal se encuentra severamente inflamada, dando un cuadro de nariz roja. (Kahrs, 1977). 1.3.7.2 Forza genital. Se define como Vulvovaginitis Pustular Infecciosa (VPI), está caracterizada por hiperemia de la mucosa vulvovaginal, con formación de pústulas. (Miller. 1991). La VPI se puede transmitir por monta natural o por inseminación artificial con semen contaminado. (Hare, 1982). Las pústulas pueden ser numerosas y confluentes en algunos casos. Esta forma puede predisponer al útero y los órganos genitales a infecciones bacterianas secundarias, causando metritis y un período transitorio de infertilidad. (Dyer, 1981). 38.
(60) En el macho esta forma de infección es llamada balanopostitis purulenta, con lesiones similares desarrolladas en el pene y en el prepucio. (Kahrs, 1977). 1.3.7.3 Forma conjuntival. Se evidencia una conjuntivitis severa con o sin queratitis. Ocurre un lagrimeo marcado. Estas manifestaciones pueden ocurrir solas o en combinación con la forma respiratoria.. 1.3.7.4. Forma abortiva. El virus puede ser transportado por. leucocitos periféricos a la placenta y transferido al feto para causar aborto. (Hare.. 1982). La infección en el último trimestre de gestación puede resultar en momificación, aborto, mortinatos o terneros débiles con lesiones usuales de la infección por IBRV, así como lesiones en el estómago e intestino. (Miller. 1991). La forma sistémica de la enfermedad en el recién nacido es caracterizada por una severa inflamación del tracto respiratorio y digestivo. Este síndrome se manifiesta por una erosión difusa y ulceración del tracto digestivo alto, incluyendo la cavidad oral. (Blood y colaboradores, 1983). 39.
(61) El aborto puede ocurrir durante las manifestaciones agudas de la infección o meses después del brote inicial. Se puede encontrar en animales sintomáticos o asintomáticos. (Dyer, 1981). El aborto, ocurre con mayor frecuencia en vacas con seis a ocho meses de gestación. Después del aborto no es rara la retención de placenta, pero carece de importancia la esterilidad residual. Después de inseminación con semen infectado, se puede producir endometritis y dificultad para la concepción. (Hare, 1982). 1.3.7.5 Forma encefálica. La meningoencefalitis producida por IER fue reportada por primera vez en Australia en 1962 y unos aíos más tarde se aisló el virus en Estados Unidos. (Davies y Duncan, 1974). La incidencia de esta enfermedad es muy baja, se presenta en bovinos de seis meses de edad, es caracterizada por ataxia, depresión y convulsiones, y en poco tiempo sobreviene la muerte. (Dyer, 1981). Las lesiones al examen post-mortem, incluyen hemorragia petequial, ulceración de la laringe y tráquea, y congestión de las membranas de los cornetes y de la mucosa nasal. Se observan pequeios focos de neumonía intersticial. (Dyer, 1981). 40.
(62) Algunos animales que se recuperan, quedan con respiración ruidosa persistente y engrosamiento de la mucosa nasal, que se acompaña de secreción abundante. (Davies y Duncan, 1974). Histopatológicamente,. las. lesiones. macroscópicas. quedan. restringidas a las fosas nasales y el morro, faringe, laringe y tráquea, para terminar en los grandes bronquios. Se puede encontrar enfisema pulmonar o bronconeumonía secundaria, pero en la mayor parte de los casos los pulmones están normales. En casos leves hay inflamación y congestión de mucosas, petequias y cantidad moderada de exudado catarral.. En los graves, la. inflamación es más intensa y el exudado es de tipo fibrinopurulento. Cuando se retira el exudado, la mucosa se halla intacta excepto por un pequeño número de focos necróticos en la mucosa nasal y denudación difusa del epitelio en la parte superior de la tráquea. Los ganglios linfáticos faríngeos y de la región cervical suelen estar inflamados y edematosos. Histológicamente se advierte inflamación catarral aguda de la mucosa. (Bloed y colaboradores, 1983). 41.
(63) 1.3.8 Inmunología:. 1.3.8.1 Inlftunidad humoral. La inmunidad para la Rinotraqueitis infecciosa bovina es compleja y consiste en la relación entre los anticuerpos sistémicos y locales, y la inmunidad mediada por células. (Blood y colaboradores. 1983) El nivel de inmunidad humoral ha sido usado como un indicador de previa infección y una medida indirecta de resistencia a la enfermedad clínica. (Blood y colaboradores. 1983). También se ha demostrado que después de una infección intranasal o del uso de una vacuna de IBRV vivo modificado intranasal se producen anticuerpos locales tipo IgÁ e interferón. El interferón aparece al tercer día y desaparece a los diez días.. La duración de la inmunidad calostral varía de uno a seis meses de edad y depende del nivel inicial, transmitido por la madre. (Guy y colaboradores. 1985). Durante la infección primaria con EHV-1 hay una respuesta de anticuerpos tipos IgL IgG-1 y durante la infección secundaria con BHV-1 hay una respuesta de anticuerpos tipo IgG-1 e IgG-2. (Guy y colaboradores, 1985). 4 42.
(64) En general, los títulos de anticuerpos son altos en casos de infección natural (1:256) aunque con cierta frecuencia se encuentran títulos de 1:8 y 1:64. (Guy y colaboradores, 1985). 1.3.8.2 InRunidad celular. Los linfocitos T citotóxicos (LTC) son producidos por el organismo durante el desarrollo de procesos virales, ya que poseen especificidad para lisar células histocompatibles. (Sissons y Oldstone, 1980). Estos LTC se encuentran en bazo o en sangre periférica, luego de una a dos semanas de ocurrida la infección viral. Dichos LTC son una gran ventaja cuando ocurre una reinfección, ya que su memoria se conserva durante un período prolongado. (Lawman y colaboradores, 1980). Se ha comprobado que cada una de las glicoproteinas mayores GpI, GFIII, GpIV de BHV-1 es capaz de estimular células T previamente expuestas a EHV-1. Se cree que estas proteínas poseen epitopes estimuladores de los LT ayudadores. (Leary y Spliter, 1990). 1.3.9 Diagnóstico de laboratorio. Un número de técnicas han sido desarrolladas para el diagnóstico rápido de la infección viral, estas incluyen anticuerpos fluorescentes, inmunoperoxidasa de células de raspado mucosal, cultivo de. 43.
(65) k_o Centro de Documentación. CEISA. células de tejido para aislamiento viral y ELISA con material colectado de lesiones o fluidos corporales. La ELISA ha sido particularmente usada en un diagnóstico rápido, ya que necesita poco tiempo y equipo, además los resultados son obtenidos en pocas horas. (Dyer, 1983; Collins y colaboradores, 1985). Se reconoce que el diagnóstico clínico es muy difícil, particularmente en la forma respiratoria. Para confirmar este diagnóstico se emplean diferentes técnicas de laboratorio, como son: aislamiento del virus, seroneutralizacián, prueba de seroconversión e histopatología. (Elcod y colaboradores, 1983). Las muestras utilizadas para la determinación pueden ser de muestra nasal, conjuntival, lavado vaginal y prepucial, tráquea y pulmón. (Eloed y colaboradores, 1983). El mejor método de diagnóstico de BHV-1 el aislamiento en cultivo celular. El diagnóstico es confirmado de veinticuatro a cuarenta y ocho horas. Recientemente se ha utilizado la técnica de inmunoperoxidasa en tejidos de pulmón fijados y se ha demostrado que es un método rápido y específico para el diagnóstico de IER. (Wyler y colaboradores. 1990). 44.
(66) La prueba serológica es el método de diagnóstico más conveniente, puede ser usada la fijación de complemento a la técnica de neutralización viral. (Dyer. 1983). La prueba de hemaglutinación indirecta evidencia títulos más altos que las pruebas de fijación del complemento. (Gómez y Delgado, 1990). Recientemente se ha incluida una nueva técnica la cual involucra la reacción de la polimerasa y ha sido usada para detectar pequeñas cantidades de virus en secreciones nasales y tejidas. Las ventajas de la reacción en cadena de polimerasa (PCR) son su sensibilidad, especificidad y rapidez.. (Gama y colaboradores.. 1989).. La máxima replicación del virus ocurre de tres a seis días después de la infección y es detectable transcurridos diez días. (Van Donkersgoed y Babiuk, 1991). Se recomienda usar hisopos de algodón y poliéster y no los de alginato de calcio, que son viricidas en un período de das horas.. 45.
(67) Se puede establecer un diagnóstico presuntivo por examen al microscopio electrónico de exudado nasal, a través del cual se evidencia la existencia de partículas vírales de tipo herpético. (Homan y Easterday, 1980). 1.3.10 Tratamiento. Se debe identificar el ganado enfermo, aislarlo y observarlo con frecuencia en busca de manifestaciones de traqueítis bacteriana secundaria y neumonía acompasada de anoxia y toxemia, para tratarlo según el caso.. Los corticoides estimulan la excreción del virus en animales infectados naturalmente y en animales experimentales, inoculados con vacunas y cepas de campo. (Dennet t y colaboradores, 1973). 1.3.11 Epidemiología. La transferencia de embriones es una de las formas de trasmisión de la enfermedad, el virus puede ser eliminado de la zona pelúcida del embrión mediante sucesivos lavados o concentraciones muy bajas de tripsina sin causar efecto adverso sobre ella. (Hare, 1982). 1.3.12 Prevalencia. Actualmente, la difusión de la enfermedad es a nivel mundial reportándose la siguiente prevalencia de anticuerpos en los siguientes países: Estados Unidos 32 (I<ahrs, 1977), Suraf rica 34v., Australia 30/., Brasil 34,. 46.
(68) Alemania Oriental 70/. (Healy y colaboradores. 1993). Austria 42%, Argentina 36-66 (Allen y colaboradores. 1992). En Europa únicamente Islandia se encuentra libre de la enfermedad. (Allen y colaboradores. 1992). 13.13 TransRisión. La enfermedad como tal, posee una alta morbilidad y una baja mortalidad. La forma de transmisión más común es la vía respiratoria, sin • embargo, el virus se puede transmitir por contacto y fómites.. 1.3.14 Control. El uso de vacunas con virus vivo modificado ha sido prohibido en varios países, ya que el virus vacunal puede inducir latencia viral o puede haber recombinación con las cepas de campo. (Brake y Sttudert, 1985). La investigación actual se centra en encontrar adyuvantes para ser utilizados en vacunas con virus muerto que favorezcan una buena respuesta y un nivel de protección más prolongado. (Homan y Easterday. 1980). Se ha sugerido establecer un programa nacional de erradicación de IBR, en aquellos países con dificultades producidas por esta enfermedad. Este programa está dividido en cuatro fases:. 47.
(69) - Prevención de la transmisión de la infección, evitando el transporte de animales con anticuerpos BHV-1.. - Eliminación de animales seropositivos.. - Detección y erradicación de futuros reservones de BHV-1.. - Un programa de monitoreo y acciones legales para mantener un control.. Este programa fue diseíado por investigadores en Suiza y podría ser un método de control efectivo en países en desarrollo con problemas de infección con IER.. (Ackerman y colaboradores,. 1990). 1.3.15 Prevención. Actualmente paises importadores de semen, exigen a los centros de inseminación de los países de origen, que cuenten con un stock de toros seronegativos y que se realicen pruebas de diagnóstico a nivel de semen. (Hare, 1982). Por otro lado, se requiere que los toros a los cuales se les congela el semen deberán ser inoculados con corticoides para reactivar el estado de latencia vinal, facilitando así su aislamiento de diferentes secreciones. (Darcel y Coulter, 1976). 48.
(70) ÇQOIÇa Cenfro de Documentación. CEISA. La investigación existente ha mostrado que para la prevención del IER se pueden utilizar los siguientes métodos:. - Inmunización activa con vacuna viva atenuada.. - Inmunización activa con cultivo celular viral, el cual ha sido inactivado con calor o aditivos químicos.. - Inmunización pasiva administrando calostro, sueros inmunes y preparación de gamma globulina.. - Administración de inductores específicos de interferón, para desarrollar una inhibición del efecto citopático.. - Uso inespecífico de inductores biológicos para desarrollar un status de parainmunidad.. - Quimioterapia, la cual inhibe la síntesis de macromoléculas y replicación del ADN viral, inhibiendo la replicación protéica. (Thielscher y Hutti, 1987). 1.3.15.1 Vacunas. Existen dos tipos de vacunas elaboradas con virus modificados disponibles a la fecha.. 49. Una es la de uso.
(71) intramuscular, elaborada generalmente con cultivos tisulares de rií'íón bovino, y la otra es la vacuna intranasal elaborada con cultivo tisular de conejo. Ambas estimulan la producción de anticuerpos humorales; la intranasal estimula la producción de interferón y anticuerpos locales de la mucosa nasal y es segura para su aplicación en vacas gestantes. (Blood y colaboradores. 1983). La técnica de ADN recombinante ha suministrado nuevos métodos para el desarrollo de vacunas más efectivas que contienen solo los componentes protectivos de BHV-1. (Baker y colaboradores. 1989). 1.4 VIRUS PMÁINFLUENZA TIPO 3 (P13). 1.4.1 Historia. Una de las infecciones virales más difundidas en el mundo, es causada por el virus PI 3 . Fue aislado inicialmente en el Reino Unido y Canadá (Hore. 1966); posteriormente en Australia (St. George, 1969). Argentina (Epstein. 1974) y en Estados Unidos (Lehmkuhl y Cutlip, 1982).. El virus fue reconocido en nil'íos con enfermedad respiratoria aguda a finales de 1950.. En 1959 el virus fue aislado en. 50.
(72) América de la mucosa nasal de ganado vacuno con signos clínicos de la fiebre de embarque. (Reisinger y colaboradores. 1959). Dos alas después un virus similar al Parainfluenza fue aislado de caballos en Canadá con enfermedad respiratoria aguda. (Reisinger y colaboradores. 1959; Berrios y colaboradores. 1990). La cepa prototipo del virus PI 3 , denominada SF-4 fue aislada por primera vez en los Estados Unidos, de bovinos que presentaban una enfermedad respiratoria aguda conocida como. fiebre de. e*barque. (Reisinger y colaboradores. 1959). 1.4.2 Clasificación.. Los mixovirus son clasificados de. acuerdo con su morfología, tamaño y características biológicas en ortomixovirus y paramixovirus. Los virus Parainf.Luenza (PIV) tipos 1-4, pertenece al género de paramixovirus y a la familia Paramyxoviridae (Kingsbury y colaboradores. 1978). El PIV-3 es el más común y causa enfermedades más severas que los otros tres tipos. (Rydbeck y colaboradores. 1987) El Parainfluenza tipo-3 puede ser denominado también virus hemadsorción-1 o SF4 bovino, por tener la capacidad de hemaglutinar glóbulos rojos de cobayos a 25 C. (Buxton y Fraser. 1977). 51.
(73) El PI 3 está asociado con infecciones del tracto respiratorio alto en humanos, ganado vacuno, cabras, caballos y ocasionalmente cerdos. (Rydbeck y colaboradores. 1987). 1.4.3 Características físicas y biológicas. El virus contiene partículas de ÁRN, tiene un diámetro promedio entre 100 y 300 nm; el componente helicoidal interno tiene un diámetro de 17 nm. (Castieman y colaboradores, 1991). El virus P1 3 , es sensible al éter y al ácido, es inactivado a 56 C por treinta minutos, sobrevive bien a -12 C. (Buxton y Fraser, 1977; Castleman y colaboradores. 1991). Las cepas de PI 3 producen una hemalisina que lisa los glóbulos rojos de cobayo y pollo, este efecto es inhibido por un ant isuero específico y es más activo a 39 C. (Ray y Compans, 1986). El PI 3 crece bien en líquido amniótico y se desarrolla en huevos con la formación de heraaglutininas en el fluido del huevo. El PI 3 no crece en saco alantoideo. Las cepas tipo 3 rara vez producen efecto citopático o hemaglutininas en cultivos primarios pero la actividad del virus es detectado en cultivos. 52.
Figure




Documento similar
List of mutations (SNPs and InDels) from variant analysis of sequenced HSV-1 original stock and isolated clones 1-5..
Pacientes con infecciones por virus herpes simple (excepto encefalitis herpética) o virus varicela zóster: dosis de 5 mg/kg, cada 8 horas.. Pacientes inmunocomprometidos
Caso de abuso sexual e infección por virus herpes tipo 2 en Atención PrimariaM. Centro de Salud
Se ha identificado el virus de la influenza aviar tipo A como virus de influenza aviar altamente patógeno (HPAI) y virus de la influenza aviar de baja incidencia patógena
No se observa en la película la evolución a largo plazo de la infección por virus Krippin, pero puede suponerse que los infectados permanecen vivos por mucho tiempo, incluso años..
Some of these pathogens are the Rift Valley fever virus (RVFV), dengue virus (DENV), West Nile virus (WNV), yellow fever virus (YFV), Ebola virus (EBOV), SARS- and MERS-CoV, zika
Chemokines and Chemokine Receptors Critical to Host Resistance following Genital Herpes Simplex Virus Type 2 (HSV-2) Infection.. Resistance to experimental
A novel protein expression strategy using recombinant bovine respiratory syncytial virus (BRSV): modifications of the peptide sequence between the two furin cleavage sites