Propagación por injerto de tamarindo, anón y mamoncillo Jornada Tecnológica Espinal (Colombia), 5 Jun 1998
Texto completo
(2) £9/'- 23y/9 PRONRTTR - SINTAP Ministerio de Agricultura, Desarrollo Rural. Copoica RsgInoI. !flLICTECÇ P.crJ4FM E CLOMA. Ç\\ V..". Jornada Tecnológica. Propagación por injerto de tamarindo, anón y mamoncillo. Col. Natoima, Espinal Ju.lo5de 1998. I.A. M.Sc. José Dairo Barreto Osorio I.A. M.Sc. Eduardo Barragán Quijano I.A. M.Sc. Diego Miranda Lasprilla I.A. Ph.D. José R. Cartagena V. A.
(3) G--< Corpoica. -Corporación Colombiana de Investigación Agropecuaria Regional 6. Vrograma. JOk?flRJJ1 TflOLÓIQ C.I. flataima, 5 de junio de 19g8 9:00 - 9:15 horas. Instalación Doctor Alvaro Bocanumenth Puerta Director Regional Seis (encargado) Objetivos del evento I.A. M.Sc. José Dairo Barreto Osorio Director del Proyecto. 9:15 - 9:45 horas. Importancia de la selección del material de propagación en la actividad frutícola I.A. Ph.D. José R. Cartagena V.. 9:45 - 10:05 horas. / Injertación en tamarindo (Tamarindus indica L.) I.A. M.Sc. Diego Miranda Lasprilla. 10:05 - 10:20 horas. Receso. 10:20 - 10:40 horas* /` Injertación en anón (Anuoniui squaniosa L.) I.A. Ph.D. José R. Cartagena V. 10:40 - 11:00 horas 11:00 - 13:30 horas. V. / Injertación en mamoncillo (Melicocca bijuga L) I.A. M.Sc. Eduardo Barragán Quijano Práctica de injertación I.A. M.Sc. José Dairo Barreto Osorio I.A. Ph.D. José R. Cartagena V. I.A. M.Sc. Diego Miranda Lasprilla I.A. M.Sc. Eduardo Barragán Quijano E.A. Luis Fernellv Sánchez Sánchez Señor Jesús María Valderrama D..
(4) ,^,1 ---^. _/ FRUTAS TROPICALES.. ASPECTOS FISIOLÓGICOS DE LA PROPAGACIÓN DE PLANTAS Por: José Régulo Cartagena V. 14J. INTRODUCCIÓN. La propagación de plantas es una ocupación fundamental de humanidad. Probablemente la civilización se inició cuando el hombre antiguo aprendió a sembrar y a cultivar ciertas plantas que satisfacían sus necesidades nutritivas y las de sus animales. El mejoramiento de las plantas de la época actual fue precedido por un gran progreso en la selección de las mismas. Las plantas cultivadas de hoy se originaron principalmente por tres métodos generales. Primero, algunas fueron seleccionadas directamente de especies silvestres pero, bajo el cuidado del hombre, evolucionaron a "tipos" que diferían por completo de sus ancestros silvestres (arroz, tomate, cebada). Segundo, otras que se originaron por hibridación entre especies, acompañadas de cambios en el número de cromosomas, estas plantas se conocen solo en formas cultivadas y no se han encontrado tipos silvestres de ellas (maíz, trigo, peral, ciruelo, tabaco). Tercero, otro grupo de plantas cuyas formas raras difieren de las demás de su especie y las cuales aunque inadaptadas a un ambiente natural, son útiles al hombre (repollo, col, brócoli). Sin embargo, este progreso en el mejoramiento de las plantas hubiera-carecido de importancia amenos que, simultáneamente se dispusiera de métodos para mantener en cultivo las formas mejoradas, lo cual originé la invención y el descubrimiento de las técnicas para la propagación de plantas. La mayor parte de las plantas cultivadas se perderían o reverterían a formas menos convenientes, a menos que se propaguen en condiciones controladas capaces de preservar las características que las hacen útiles. La propagación por medio de estacas de madera dura de la vid y el olivo ha sido una práctica milenaria. Las técnicas de injerto han sido la forma mas adecuada para cultivar la mayoría de las especies frutales que se consumen desde hace varias centu-. ? jIJé1. rías. La invención dd invernadero en el siglo XIX, hizo posible la propagación a través del enraizamiento de estacas con hojas. Mas recientemente, el descubrimiento de sustancias químicas que inducen la formación de raíces o tallos, o que sirven de fuente alimenticia en la propagación in vitro, han modificado sustancialmente muchos procedimientos de propagación. De manera similar el cultivo de plantas por semilla se ha revolucionado con el descubrimiento de principios genéticos conduscentes a la producción de semillas híbridas. Es probable que con el desarrollo de las técnicas que ofrece la ingeniería genética aplicadas a la producción de plantas transgénicas se de un nuevo paso. CONTROL BIOLÓGICO DE LA REPRODUCCIÓN. La propagación de plantas implica el control de dos tipos de ciclos biológicos de reproducción: el sexual y el asexual. La conservación de las características de una planta o de un grupo de plantas, depende de la transmisión de una generación a la siguienté de una combinación específica de genes presentes en los cromosomas de las células. El conjunto total de estos genes constituye el genotipo de las plantas. El genotipo en combinación con el medio ambiente, produce una planta con unas características externas específicas que constituyen el fenotipo. Por tanto, la función de cualquier técnica de propagación de plantas es preservar un genotipo específico o una combinación de genotipos que pro- duzca el tipo de planta específico. En el ciclo sexual se utiliza la propagación por semilla mediante la cual se logran nuevas plantas individuales con características que reflejan la contribución genética de ambos progenitores. Con este método se espera que se presente cierta variabilidad en las plantas hijas..
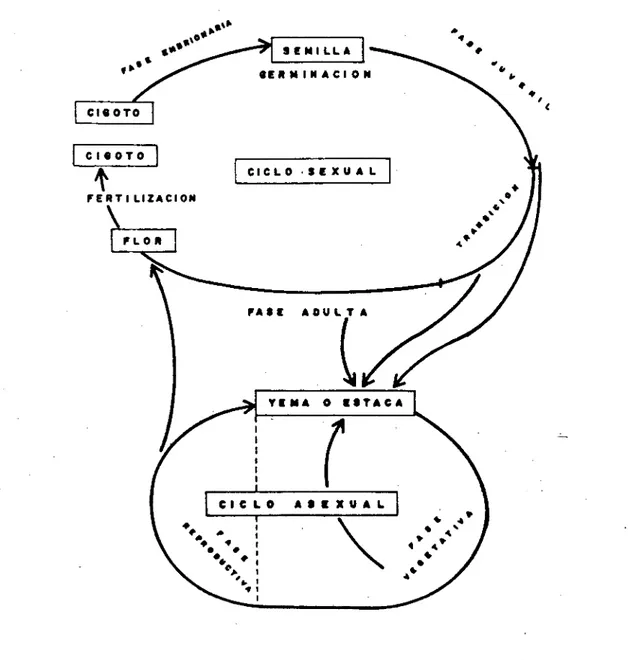
(5) FRUTAS TROPICALES. En el ciclo asexual se emplean métodos de propagación vegetativa (acodado, separación (bulbos, cormos), división (risomas, tubérculos) estacas, injerto, micropropagación (tejidos [banano), menstemos [clavel], embrioides [tabaco], embriones [orquídeas)), ingeniería genética (fusión de protoplastos, plantas trangénicas) 1. Mediante el empleo de estas técnicas, las características propias de cada planta se conservan en las plantas descendientes y además puede conservarse intacto el genotipo de la planta. El ciclo apomíctico es una excepción en el que el embrión se origina directamente de células de la planta madre por un proceso vegetativo o asexual y no se crea por medio de la unión de los gametos masculino y femenino. La apomixis ocurre en muchas especies de frutales (cítricos, mango (poliembronía es un tipo de apomixis)) y tiene en propagación doble importancia; por ejemplo, es un medio de asegurar uniformidad en propagación por semilla, ya que cualquier cultivar apomíctico es en realidad un tipo de clon. Por otra parte, muchas enfermedades virales no se transmiten por semilla, por lo tanto el cultivo de plantas apomícticas es un medio para rejuvenecer clones viejos que esten infectados por virus. CICLO SEXUAL. El crecimiento y desarrollo de una plántula ocurre en tres fases conduscentes a la producción de flores en la nueva planta con la formación de células sexuales para crear una nueva generación. La primera es la fase embrionaria que comienza con la unión de los gametos masculino y femenino en la flor para formar un cigoto unicelular. La segunda es la fase juvenil que comienza con la germinación de la semilla y comprende el crecimiento del embrión hasta formar una planta juvenil. Predomina el crecimiento vegetativo a medida que la planta aumenta en tamaño, mediante el alargamiento del tallo y de la raíz y el incremento del diámetro. Esta fase va acompañada por el desarrollo de características de crecimiento específicas de la planta: forma de la hoja, hábitos de crecimiento y en ocasiones presencia de espinas (cítricos). Fisioló-. ,' gicamente la planta juvenil puede presentar un incremento en la capacidad de regeneración, una propiedad de gran importancia en la propagación por estacas. La tercera fase es la adulta en ella predomina la reproducción por semilla, la planta alcanza su tamaño final y desarrolla flores en respuesta a señales del medio ambiente o de un estado interno fisiológico u hormonal. Se reconoce también una fase transitoria que marca la separación entre las fases juvenil y adulta. En ella la planta pierde gradualmente las características juveniles y adquiere las de planta madura. Este cambio esta marcado por modificaciones en el aspecto morfológico: forma de la hoja, hábito de crecimiento. reducción de espinas, pérdida de la capacidad de regenerarse vegetativamente e incremento en la capacidad de responder a estímulos que inducen floración. En algunas plantas los cambios ocurren con rapidez y repentinamente. En otras, puede presentarse en un período de muchos años y en otras pueden suceder al mismo tiempo. CICLO ASEXUAL. Un ciclo asexual puede iniciarse quitando una parte de la planta (yema, estaca, meristemo) y regenerando de ella una nueva planta. Cualquier parte de una plántula, en cualquier fase del ciclo de vida, juvenil, transitoria o adulta, puede seleccionarse como material inicial. Algunas plantas propagadas a partir de plantas en etapa juvenil o transitoria pueden continuar mostrando características juveniles. En tanto que una planta propagada a partir de otra en estado adulto puede no conservar ninguna característica juvenil o de transición y permanecer adulta desde el punto de vista biológico. En el ciclo asexual se distinguen dos fases. La vegetativa y la de floración. En la primera, la planta crece por alargamiento de las raíces y del tallo, el aumento de volumen y la expansión de las hojas. Si las plantas provienen de una planta madre en fase adulta pueden responder con facilidad a estímulos de floración. En la segunda fase, se suspende el alargamiento de los tallos y algunos de sus puntos de crecimiento se diferencian.
(6) FRUTAS TROPICALES. en yemas florales, que finalmente producen flores, frutos y semillas (Figura 1). REPRODUCCIÓN SEXUAL. La reproducción sexual implica la unión de las células masculinas y femeninas, la formación de las semillas y la creación de individuos con nuevos genotipos. La división celular ocurre en las células. sexuales y se llama meiosis e implica la división reductora de los cromosomas en la cual su número se reduce a la mitad. El número original de cromosomas se restablece durante la fertilización, resultando un nuevo individuo que contiene los cromosomas tanto del padre como de la madre. La meiosis ocurre en la antera (órgano masculino)y el pistilo (órgano femenino).. SEMILLA 4. #g en MINAcION. \ ,,. CtS OTO cisoro. 1. CICLO SEXUAL. 1. VER TI LIZACION. o. o. 4. •l ). FLOR. 4.. FASE ADULTA. 00^^!. •. 1. ••. YEMA. 0 1$. \. CICLO AIE XUA]. . • .. 44. 1 1 1. FIGURA 1. Reproducción en las plantas superiores por medio de los ocios sexual y asexual. Fuente: Hartmann, H.T. y D. E. Kester. 1975. Propagación de plantas, principios y prácticas. México.. 3..
(7) FRUTAS TROPICALES. Durante este proceso las células madres del polen y las células madres de las megasporas, ambas diploides, pasan por una división de reducción en la cual los cromosomas homólogos segregan células diferentes. Esto es seguido por una división mitótica, resultando cuatro células madres. En la fertilización, un gameto masculino se une con el huevo para producir el cigoto, en el cual se restablece el número diploide de cromosomas. Otro gameto masculino se une con los núcleos polares para dar origen al endospenno. REPRODUCCIÓN ASEXUAL La reproducción asexual es posible porque cada una de las células de la planta posee los genes necesarios para el crecimiento y desarrollo de la misma. A través de la división celular que ocurre durante la mitosis, los genes son replicados en las células hijas. Una característica de la mitosis es que los cromosomas se dividen longitudinalmente en partes idénticas y cada una de esas partes pasa a una célula hija. Esto da como resultado que, con algunas excepciones, en cada una de las células hijas se duplique en forma exacta el sistema cromosómico de las células individuales y por lo tanto la nueva planta se desarrolla con las mismas características de la planta madre. La mitosis ocurre en áreas específicas de la planta, estas son: el ápice de los tallos, el ápice de las raíces, el cambium y las zonas intercalares de las monocotiledoneas. También el callo que sirve de conexión entre los tejidos de una planta propagada por injerto, se forma por un proceso de mitosis. La mitosis por lo tanto es una actividad celular básica en la propagación vegetativa de plantas y que hace posible el empleo de técnicas como el injerto, el acodo, Ja separación y la división.. germinación el metabolismo celular se incrementa, el embrión reanuda su crecimiento activo, las cubiertas de la semilla se rompen y emerge la plántula. En este proceso de germinación se diferencian tres etapas o estadios: el primer estadio en el cual la semilla seca absorbe agua, la humedad aumenta con rapidez y luego se estabiliza. El segundo estadio en el cual se desarrollan reacciones de digestión y translocación. Las células se han activado, las proteínas funcionan para producir enzimas, materiales estructurales, ácidos nudeicos. El tercer estadio en el cual se tiene división celular en los puntos de crecimiento basal y apical del eje embrionario seguido de la expansión de las estructuras de la planta. Durante la imbibición se activan importantes organelos de la célula, tales como las mitocondrias indispensables para el suministro de energía, los ribosomas que tienen participación directa en síntesis de ARN, el núcleo donde se encuentran el nucleolo y los cromosomas, depositarios de toda la herencia genética de la nueva planta, las membranas responsables de regular la permeabilidad de las células y organelos y los glyoxysomas en los cuales se desarrollan importantes eventos metabólicos relacionados con la digestión de los lípidos.. Durante la digestión y translocación ocurre el metabolismo de los carbohidratos o glicólisis que se desarrolla en el citoplasma de la célula, el ciclo del ácido cítrico que se hace en la mitocondria y el metabolismo de los lipidos en los glyoxysomas. Ya que durante la fertilización se pasa información genética al nuevo embrión por medio del ADN contenido en los cromosomas, los genes existentes allí se activan y participan en la síntesis de proteínas estructurales y enzimas.. PROPAGACIÓN SEXUAL La semilla esta formada por un embrión y su pro- visión almacenada de alimento, rodeado por cubiertas protectoras. En la época en que la semilla se separa de la planta madre, su metabolismo se encuentra en un nivel bajo, y en ella no hay señales aparentes de actividad de crecimiento. Durante la. Un aspecto fundamental para que la germinación se realice sin inconvenientes es la respiración, proceso a través del cual las células degradan las sustancias de reserva, especialmente almidones para generar agua y energía, esta última indispensable para el adecuado desarrollo de las reacciones metabólicas que caracterizan la germinación..
(8) FRUTAS TROPICALES CONTROL HORMONAL DE LA GERMINACIÓN. El control de la germinación esta regulado por cuatro clases de hormonas vegetales (auxinas, giberelinas (GA), citoquininas y ácido abscisico (ABA)). Las giberelinas son las que tienen un papel mas directo. En la cebada por ejemplo, cuando la semilla embebe agua, se sintetiza giberelina en el embrión y se transioca a la aleurona (una capa de 3 o4 células de grosor que rodea al endospermo), donde ocasiona una nueva producción de a-amilasa. Esta enzima se desplaza al endospermo donde convierte el almidón en azúcar, el cual es translocado a los puntos decrecimiento del embrión para proporcionar energía. El ABA puede bloquear el estimulo de la giberelina para la germinación. Hay evidencias de que el ABA interfiere en el incremento de a- amilasa por GA mediante la inhibición de la síntesis de ARN. Las citoquininas son otras hormonas que controlan la germinación probablemente a nivel del sistema de transcripción de ADN a ARN. También -se considera que el etileno ejerce algún tipo de control sobre la germinación de algunas semillas. Muchos fisiólogos consideran que la germinación es regulada por un equilibrio entre promotores e inhibidores del crecimiento, siendo GA el principal ! promotor y ABA el principal inhibidor. La citoquinina se ha descrito que tiene un papel permisivo en cuanto a que anula la acción del ABA y permite que funcione el GA (Figura 2). PATRONES DE GERMINACIÓN. El creimiento inicial de la planta tiene dos patrones. En un tipo de germinación epígea, el hipocótilo se alarga y eleva los cotiledones sobre el nivel del suelo. EneI otro tipo, conocido como germinación hipógea, los cotiledones permanecen bajo tierra y solo emerge el epicótilo. FACTORES QUE INFLUYEN EN LA GERMINACIÓN. La velocidad de la emergencia de las plántulas en el semillero, esta influida principalmente por la disponibilidad de agua. Sin embargo, la necesidad de agua puede ser distinta para cada especie, diferenciandose 4 grupos, así: 1. semillas que germinan en suelos cora humedad desde el porcentaje de marchitez permanente hasta un conteni-. do de humedad mas alto que la capacidad de campo (patilla). 2. semillas que germinan en suelos con un contenido de humedad intermedio hasta una cantidad superior a la capacidad de campo (lechuga, remolacha). 3. semillas que germinan solo en suelos con humedad cercana a ¡a capacidad de campo (apio). 4. semillas que germinan bien en bajos contenidos de humedad e incluso bajan su porcentaje de germinación con humedad cercana a la capacidad de campo (espinaca). La temperatura es tal vez el factor ambiental individual de mayor importancia que regula la germinación y el crecimiento de las plantas. La semilla tiene un límite superior y otro inferior de temperatura para germinación. Se han definido tres temperaturas para la germinación de las semillas (mínima, óptima, máxima). La temperatura óptima es aquella mas favorable tanto para la germinación de la semilla - como para el crecimiento de la plántula. En las especies de frutas tropicales esta se encuentra en el rango de 26.5°C y 35°C. Mención especial requieren algunas especies de frutales de clima frío o zonas templadas que necesitan para su germinación dei almacenamiento por algún tiempo en temperaturas .bajas. ¡Los gases que en el medio de germinación pue' afectar a la germinación, son: el oxígeno, el dióden xido de carbono y posiblemente el etileno. El oxígeno es esencial para los procesos respiratorios que se efectúan en la germinación. EJ dióxido de carbono es un producto de la respiración que en condiciones de mala aireación puede acumularse y estimular el desarrollo de reacciones anaeróbicas que sintetizan productos tóxicos para la semilla. Este factor de aireación es especialmente importante, cuando hay un exceso de agua en el medio de germinación. Los semilleros mal drenados, en especial después de las lluvias o riegos abundantes, pueden tener los poros tapados y limitar la difusión del oxígeno para suplir las necesidades de la semilla..
(9) íi. 1. ivi. j ll1l-vvo. oo *z z * o u z w o. 1 IX'.J r. 1 t'LtZ. *IIOWQN -W019VnLt$. E. •0 .E E. u o E. o. 8. ti. 0.. 0. c.
(10) FRUTAS TROPICALES. La luz puede estimular o inhibir la germinación de las semillas de algunas plantas. El control de la germinación se hace por medio de una reacción fotoquímica en la que interviene un pigmento llamado fitocromo que responde a una longitud de onda específica. Esta reacción hace parte de los eventos conocidos como fotomorfogénesis y que tienen que ver con la influencia de la luz en el crecimiento y desarrollo de las plantas. El fitocromo es un pigmento proteínico que se encuentra localizado en la membrana de las células y que responde a dos longitudes de onda 660 nm y 730 nm, conocidos como fitocromo rojo y fitocromo rojo lejano, respectivamente). La exposición de la semilla a luz roja (660 nm) hace que el fitocromo rojo cambie a fitocromo rojo lejano y estimule la germinación. En cambio la exposición de la semilla a luz roja lejana que tiene una longitud de onda de 730 nm hace que el fitocromo rojo lejano cambie a fitocromo rojo e inhiba la germinación. En la luz natural del sol, las ondas en la longitud del rojo dominan sobre las del rojo lejano en proporción de 2:1 de modo que el fitocromo tiende a permanecer en la forma activa.. Además de las ventajas que ofrece la reproducción asexual para mantener las características de un don, ésta también es un método muy útil en la conservación de tejidos resultantes de mutaciones en ¡as células somáticas y que pueden ser de interés comercial. En las células vegetativas pueden ocurrir cambios genéticos y cromosómicos que pueden conducir a un cambio permanente en el don. En fruticultura son muy comunes las quimeras que son variaciones que afectan solo un segmento del meristnay dan origen a sectores o capas de tejido mutado. Un ejemplo son k cítricos de tipo vanegado, en estas plantas los plastidios de las células de parte de las hojas carecen de la capacidad de producir clorofila mientras que las células de la otra parte son normales. En la naranja "Washington Nave]" se observan con frecuencia frutos que desarrollan una mutación consistente en que una porción del fruto es de corteza gruesa y amarilla y el otro sector es de corteza dekjada y de color naranja. Hay varias dases de quimeras, estas pueden resultar dependiendo del tipo de tejido a queden origen en la nueva rama, pudiendo ser completa o sectorial y esta última dividirse en periclina] y mericlinal. PROPAGACIÓN POR ESTACAS. La germinación de la semilla también puede ser afectada por otras causas como la formación de cubiertas externas impermeables al agua y al oxígeno, la presencia de sustancias químicas en el pericarpio, en el jugo de los frutos carnosos, en el endosperrno o en el embrión. Otra causa es la presencia de embriones morfológicamente poco desarrollados, factor frecuente en palmas en donde el embrión al tiempo de maduración del fruto esta muy pequeño por lo que debe aumentar posteriormente su tamaño para poder germinar. PROPAGACIÓN ASEXUAL La propagación asexual consiste en la reproducción de individuos a partir de porciones vegetativas. La propagación asexual reproduce clones. Un clon es un material genéticamente uniforme derivado de un solo individuo y que se propaga de modo exclusivo por medios vegetativos como estacas, divisiones o injertos.. La propagación por estacas se emplea por lo general en plantas dicotiledóneas. Estas pueden ser utilizando como material vegetativo el tallo, las hojas o las raíces. En las estacas de tallo o de hoja solo es necesario que se forme un nuevo sistema radical, puesto que ya se tiene un sistema aéreo en potencia (la yema). En las estacas de raíz debe iniciarse un nuevo sistema foliar a partir de una yema adventicia. Las estacas de tallo se originan a partir de las zonas. meristemáticas localizadas en los haces vasculares de los tallos herbáceos jóvenes (clavel) o del floema secundario en los tallos leñosos jóvenes aunque también pueden originarse de otro tipo de tejidos como él cambium o la médula (ciruela) (Figura 3). Un gran número de especies de plantas tanto monocotiledóneas como dicotiledóneas, pueden ¡niciarse de estacas de hoja. Estas se desarrollan a partir de las zonas meristemáticas existentes en la lámina foliar. En ella se encuentran dos tipos de meristemos, el apical y el marginal. El uso de este mé-.
(11) r EPIDERMIS )ERMIS. ANILLO DE. ORTEZA. SITIO DE ORIGEN DE LAS INICIALES DE LA RAIZ. XI LEMA. MEDULA. CAMBIUM -. HAZ VASCULAR. SITIO DE ORIGEN DE LAS INICIALES DE LA RAIZ F LO E MA. I4ERSACEA JOVEN. FIGURA 3. Puntos de origen de las raíces adventicias en una planta dicotiledónea Fuente: Esau, K. 1976. Anatomy of seed plants. New York.. LEÑOSO JOVEN.
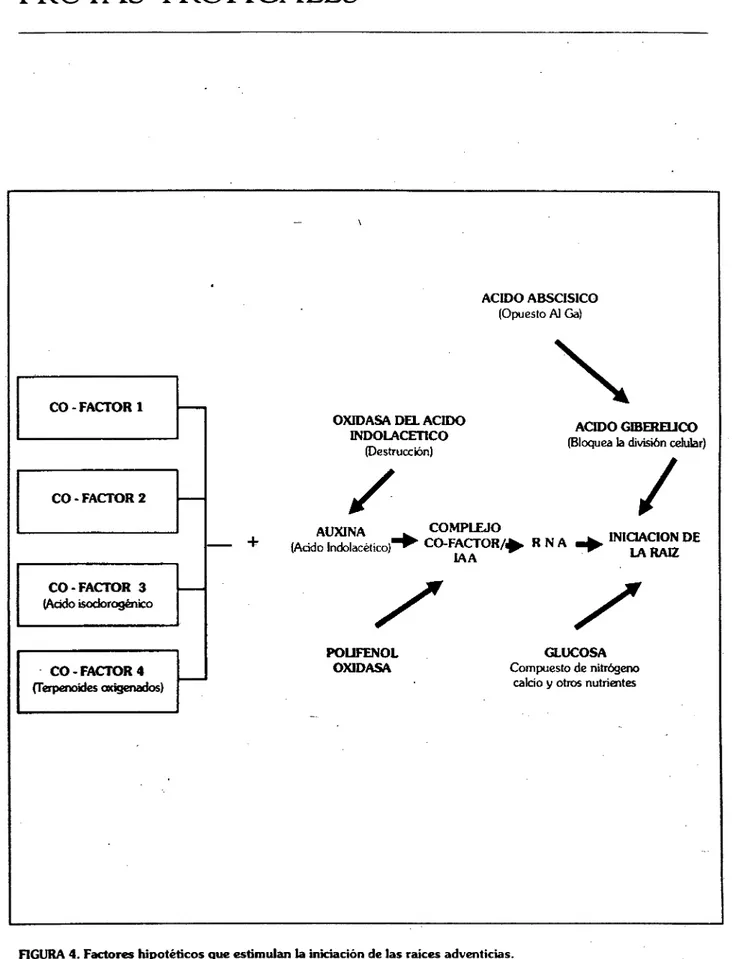
(12) FRUTAS TROPICALES. todo es muy común en la producción de plantas ornamentales (violeta).. hasta 15°C son las satisfactorias para el enraizamiento de estacas.. En las estacas de raíz las nuevas raíces se forman a partir del periciclo, cerca del cambium vascular.. La luz es indispensable para estimular el enraízamiento de estacas con hojas ya que es la fuente de energía para la fotosíntesis cuyos productos son indispensables para la iniciación y crecimiento de las raíces. En contraste algunas raíces que se inician a partir de estacas de tallo solo se forman si se encuentran en completa oscuridad.. Varias clases de reguladores de crecimiento, como auxinas, giberelinas, citoquininas e inhibidores como el ácido abscico y el etileno influyen sobre la iniciación de raíces. De ellos, las auxinas son las que mayor efecto tienen sobre la iniciación de raíces. En adición a las hormonas antes citadas, se ha evidenciado la existencia de otras sustancias de ocurrencia natural que participan en la iniciación de raíces. Algunos fisiólogos han propuesto la existencia hipotética de un compuesto al que han llamado Rizoca lina y que esta formado por tres componentes dos de ellos fenoles y que se consideran como cofactores de enraizamniento.. El pH del medio de enraizamiento también es un factor importante en la producción de raíces adven ticias. Se ha establecido que con un pH de 7.0 es que se consigue el mejor enraizamiento. La acidez en el medio inhibe la formación de raíces pero no en la proporción como ocurre en un pH bajo. PROPAGACIÓN POR INJERTO. Estos Son: Cofactor 1 que se transloca desde las hojas y que se ha caracterizado como un ortodihidroxifenol. Cofactor 2 no caracterizado que se encuentra en concentraciones muy bajas. Cof actor 3 que es una enzima específica localizada en las células de ciertos tejidos (como periciclo, floema y carnbium) que probablemente es una polifenol-oxidasa e identificado como ácido clorogénico. Hay un Cofactor 4 que representa a un grupo de sustancias activas llamadas terpenoides oxigenados. Estos cofactores junto con la auxina forman el complejo awdna-cofactor el cual estimula la síntesis de ARN y con la partipación de las giberelinas y otros compuestos promueven la iniciación de las raíces (Figura 4). Debido a que las estacas pierden gran cantidad de agua a través de las hojas durante el enraizamiento, una adecuada provisión de humedad es indispensable para evitar la muerte de la estaca antes de la formación de raíces. Una vez éstas se han diferenciado, el riesgo se reduce porque ya las nuevas estructuras radicales desarrollan la capacidad de absorber agua del medio. Se ha establecido también que una temperatura diurna del aire entre 21 y 27°C con bajas en la noche. La propagación por injerto es la mas común en nuestro medio. Injertar es el arte de unir plantas de tal manera que liguen y continúen su crecimiento como una sola planta. Hay varias razones para injertar una planta, a continuación se enumeran algunas de ellas: perpetuación de clones, especialmente aquellos que no se pueden reproducir con facilidad por estacas, acodado, división u otros medios asexuales. Muchas plantas no poseen un adecuado sistema radical o sus raíces son suceptibles a plagas, enfermedades o condiciones de humedad del suelo, y por lo tanto deben ser injertadas sobre otra planta que tenga un sistema radical que tolere las condiciones adversas a la copa. También es útil el injerto cuando se quiere cambiar un cultivar que ya no tiene demanda en el mercado, es improductivo o se ha vuelto susceptible a algún limitante fitosanitario. El injerto también puede acelerar el crecimiento de una planta y reducir la etapa juvenil la cual puede tardar muchos años. El injerto es un método adecuado en la caracterización de enfermedades virosas, las cuales se pueden detectar al injertar yemas de la planta sospechosa de estar infectada en un patrón muy susceptible, y así poder detectar rápidamente la enfermedad, ya que la infección por virus se transmite de planta a planta a través del injerto..
(13) FRUTAS TROPICALES. ACIDO ABSCISICO (Opuesto Al Ga). N. OXIDASA DEL ACIDO INDOLACETICO (Destrucción). +. AUXINA (Acido lndolacético). ACIDO GIBERELICO (Bloquea la división celular). COMPLEJO COFACT0R/* R N A _ [AA. INICIACION DE LA RAIZ. 7 7 POUFENOL OXIDASA. GLUCOSA Compuesto de nitrógeno calcio y otros nutrientes. FIGURA 4. Factores hipotéticos que estimulan la iniciación de las raíces adventicias. Fuente: Hartmann. H.T. y D. E. Kester. 1975. Propagación de plantas, principios y prácticas. México.. Y t, r.
(14) FRUTAS TROPICALES. La cicatrización de un injerto puede considerarse como la cicatrización de una herida. Una herida similar a la que se produce cuando se parte longitud¡nalmente una rama. La lesión en el injerto se cicatriza rápidamente si las dos partes cortadas se unen y se atan estrechamente. La proliferación de células en la región cambia] de ambas partes producen nuevas células de parénquima, formando callo,. o se diferencian para producir las conexiones de xilema y floerna entre las partes puestas en contacto (Figura 5). Varios factores influyen en la cicatrización de la unión de un injerto. Algunas plantas son mas difíciles que otras porque al hacer el corte segregan latex, sustanca que dificulta el prendimiento (mamey). La temperatura, la humedad y la disponibilidad de oxígeno,. RIDERMIS. ATR. A SECUNDARIA .EMA NUEVO (MA VIEJO. T. M811.004 Ll.O. o -. .. .. FIGURA S. Ilustración de la unión entre el patrón.y la variedad en un injerto de pua.. Fuente: Esau, K. 1976. Anatomy of seed plants John Wiley and Sons. New York..
(15) FRUTAS TROPICALES. tienen relación directa con las reacciones metabólicas que estimulan la formación del callo y la diferenciación de los tejidos de conducción. La adecuada actividad del patrón y la yema son también importantes para tener éxito en el injerto. Algunas prácticas culturales como anillamiento de las ramas de donde se van a tomar las yemas o aplicación de urea en bajas concentraciones a plantas madres y patrones, son técnicas que emplean los viveristas para mejorar el prendimiento de los injertos. La técnica de injertación también es importante, algunas especies solo pueden propagarse con determinado método, en tanto que un viverista puede tener mas éxito con una técnica que para otro es un completo fracaso. La presencia de virus puede reducir el porcentaje de prendimiento, también algunos insectos pueden afectar el injerto porque se alimentan del callo que se forma en el sitio de unión. También la presencia de hongos y bacterias en el sitio de contacto puede reducir considerablemente el número de plantas injertadas (caucho). Algunas sustancias tóxicas que se sintetizan durante la cicatrización, especialmente fenoles también afectan el desarrollo de callo en la unión del injerto. RELACIÓN PATRÓN - INJERTO La incapacidad de dos plantas diferentes injertadas entre si, para producir con éxito una unión y desarrollarse satisfactoriamente como una planta compuesta, se llama incompatibilidad. Se consideran dos tipos de incompatibiliad, la cual puede afectar el éxito en la unión de dos plantas. La incompatibilidad translocada y la incompatibilidad localizada. La .prijnera es cuando ésta no puede superarse con un injerto intermedio ya que alguna sustancia que es translocada desde alguna de las dos partes puestas en contacto hacia la otra, afecta el proceso de unión de las superficies adyacentes. En este caso las reacciones de incompatibilidad se limitan a la zona de contacto, fórmandose acumulaciones de tejido ya sea arriba de la unión o abajo de ésta. Este tipo de incompatibilidad puede ser perju-. &. dicial para el injerto o puede no ejercer aparentemente ningún efecto negativo para la planta. La segunda, depende aparentemente, del contacto mismo entre el patrón y el injerto, en este caso la zona de unión presenta una debilidad mecánica y se rompe la continuidad del cambium y de los tejidos vasculares; sinembargo, hay casos en que la unión es fuerte y los tejidos se unen de manera normal. Una forma de superar esta falta de afinidad histológica es mediante la inserción de un interinjerto compatible a los dos tejidos puestos en contacto. ORGANOGÉNESIS La micropropagación es la técnica para lograr el desarrollo de nuevas plantas en un medio artificial. En condiciones acépticas a partir de porciones muy pequeñas de plantas tales como embriones, semillas, tallos, áreas meristemáticas de ramas y raíces, callo, células individuales y granos de polen. En esta técnica se aplica el concepto de organogénesis que es la regeneración de órganos para hacer una nueva planta. En ella se fundamenta la técnica del cultivo de tejidos en la cual mediante metodologías adecuadas se estimula la formación de un órgano a partir de un tejido de la planta que aún no esta totalmente diferenciado, por ejemplo, un meristemo. Lo importante para destacar es que hay diversos factores que afectan la organogénesis, entre ellos el grado de ploidía, la edad del cultivo de tejidos en formación, el uso - de aditivos especiales para estimular diferenciación de flores o raíces, la relación entre auxinas y citoquifinas. De una adecuada proporción de estas hormonas depende la diferenciación de estructuras en un explante o su permanencia en el estado inicial. Es decir que entre todos los aspectos que tienen que ver con la propagación in vitro, uno que tiene particular importancia es la actividad hormonal. El futuro de la propagación de plantas es posible que se fundamente en las nuevas técnicas que cada día se descubren o mejoran a través de la ingeniería molecular. Una de ellas es la transmisión de información genética de una célula a otra usando como medio una bacteria. El descubrimiento de que la.
(16) FRUTAS TROPICALES. bacteria E. col¡ tiene piezas circulares de ADN que se llaman plasmidios facilitó su uso como portador de información genética. Con el uso de enzimas que cortan el ADN en sitios específicos y en estos sitios incorporar información genética se puede insertar un nuevo gen que puede empezar a manufacturar una nueva proteína. Con esta técnica se ha logrado la creación de plantas trasgénicas resistentes a herbicidas, plagas (lepidopteros) y algunos tipos de virus. Como conclusión general se puede afirmar que la multiplicación de plantas es una técnica milenaria que el hombre la ha ido mejorando con nuevos descubrimientos de los cuales los mas importantes son el conocimiento de las hormonas, la propagación masiva a través de las técnicas En vitro y la posibilidad de poder construir nuevas plantas mediante la manipulación del ADN.. BIBUOGRAFÍA 1. Esau, K. 1976. Anatomy of seed plants. John Willey and Sons, Inc., New York, New York. 2. Gardner, E. J. Principios de genética. Edit. Limusa, México. p. 113-114. 3. Hartmann, H. T. y D. E. Kester. 1975. Propagación de plantas, principios y prácticas. Edit. CECSA, México. 814 p. 4. Monsanto. 1990. Genetic engenieering, a natural science. Monsanto Company, San Louis, Missouri. 24 p. S. Weir, T. E., G. R. Stocking y M. C. Barbour. 1983. Botánica. Edit. Limusa, México. p.227-229.. /3.
(17) ^-^ ^/-/;2. PRONRITI - SINTRP. Corpoica. Ministerio de fivitura , Desarrollo ra. <7J6 -,3. /. R.gIenaI. ASPECTOS GENERALES SOBRE OBTENCIÓN DE PATRONES E INJERTACIÓN EN TAMARINDO (Tamarindus indica L.). Diego Miranda Lasprilla1 José Dairo Barreto 0-15 o rio RESUMEN. El proceso de propagación del Tamarindo se inició con la identificación y tipificación de cultivares existentes en las zonas productoras de donde se obtuvieron inicialmente 16 materiales. 1. SELECCIÓN DE SEMILLA, EMBOLSADO Y SIEMBRA. De los árboles identificados y caracterizados morfoagronómicamente, se obtuvo la semilla para iniciar el proceso de multiplicación de patrones a nivel de vivero. La selección se hizo inicialmente por sanidad, tamaño y peso de la semilla. El sustrato para el llenado de la bolsa estuvo compuesto por una mezcla de tres partes de lodo de canal, una parte de arena negra y una parte de cascarilla de arroz ( 3:1:1) La mejor profundidad de siembre entre las evaluadas fue a 1 cm y el tiempo transcurrido desde la siembra hasta germinación fue de 20 días en promedio. 2. DESARROLLO DEL PATRÓN OBTENCIÓN DE YEMAS E INJERTACIÓN. El desarrollo del patrón en la fase de vivero debe ir acompañado de algunas labores mínimas como, regulación de sombrío, suministro de riego, revisión sanitaria y de ser necesario de fertilización foliar. 'lngpuuo Agónuno MSc. Investigador Asosciado, Cospoi, Regional 6, C.L Nataima, El Espina! (1) Aio,no M.Sc. Investigador Asociado, Cospoica, Regional 6, Creced Norte Tolima, Ibagué (T). 2 Ingeniero. ¿it.
(18) El tiempo transcurrido de siembra e injertación está entre 180-240 días. Para este tiempo, el diámetro del patrón mide entre 0.45 - 0.65 cm; la altura ideal para la injertación está entre 25-35 cm; el diámetro de la púa entre 0.35 - 0.45 cm, con una longitud entre 8.5-10 cm y con 3 a 5 yemas para la púa. Desde la fase de vivero, se han venido evaluando diferentes tipos de injerto como son: El injerto de parche, de escudete sencillo, inglés sencillo, hendidura central y el de enchape lateral ( Veeneer), todos con bajos porcentajes de prendimiento, aunque este último ha presentado los mejores resultados. La labor de injertación incluye una serie de labores que buscan llevar un buen patrón, en condiciones de activo crecimiento hasta la injertación. Las yemas para injertar deben obtenerse de árboles madres seleccionados por sanidad, rendimiento y calidad de la fruta producida. Deben cortarse las varetas de ramas adultas y tener una longitud de 10-12 cm. Se prefiere cortarlas el mismo día en que se va a realizar la injertación; sino es posible se deben cortar y envolverlas en toallas húmedas y almacenarlas en recipientes de icopor. 3. PROCEDIMIENTO PARA EL INJERTO DE VEENEER • Se inicia con el deshoje del patrón, en la parte superior a la altura de injertación. El follaje inferior debe mantenerse. • De acuerdo con la altura de injertación seleccionada, unos 3 a 4 cm abajo de una de las yemas, se debe hacer una incisión en el patrón. • Luego unos 5 cm más arriba, se hace un corte hacia abajo que penetre la madera, y termine en la incisión hecha anteriormente. (corte para sacar la chapa del patrón). • Cortar la púa con unos 5 cm de largo y un diámetro similar al del patrón. De un lado de la yema se hace un corte sesgado, que comienza inmediatamente debajo de la yema terminal continuando hasta abajo (Ver Figura). • Del lado opuesto, en la base se hace un corte en chaflán para formar una cuña que se ajustara a la muesca hecha en el patrón, de manera que las.
(19) • superficies cortadas en ambas (patrón y púa) se coloquen cara a cara y se ajusten lo más perfectamente posible (Ver figura). • Una vez ensamblados (patrón y púa) se amarran el injerto con cinta plástica para lograr una perfecta unión. • Finalmente se corta el patrón por encima del injerto unos 10-15 cm y se cubre con una bolsa plástica. Es importante en este momento, una buena regulación de sombrío, para evitar desecamiento o muerte de la yema. Si esta labor no se hace se puede recubrir la bolsa plástica con una bolsa de papel que hará la regulación de la entrada de radiación. Se debe estar revisando mínimo cada 4 días para observan el prendimiento, que ocurre dentro de los 15 días siguientes, donde se procederá a cortar el resto del patrón, cicatrizar y cuidar el follaje de la nueva copa..
(20) / • TAMARINDO INSERTO. o. ¡. ¡. £NCt4APE LTERP1.. EtR. 1 :o•, C ii'o y OOS4O. on o d u u o r:1. °. 1 ljci. la. II .. b. Col te en el polo<¡". c. Ua.on pation-pua.
(21) o Corpoea Regional. PROPAGACIÓN POR INJERTO DEL ANÓN. Por: José R. Cartagena Valenzuela José Dairo Barreto Osorio. En la obtención de plantas injertadas de anón se utiliza como patrón la. Annona reticulata L., conocida con los nombres de anón pelón, anón. corazón o chirirnóyo y como copa o cultivar de importancia comercial, la Annona squamosa L. o anón común. Las semillas del primero, luego de extraerlas de frutos maduros y sanos, se siembran en camas formadas por un sustrato de partes iguales de arena negra y suelo (lodo de canal). La germinación se inicia a los 21 días y dura hasta los 60 días.. Entre los 6 y8 meses cuando las plántulas han alcanzado una altura mayor a los 40 cm y un grosor entre los 0.4 y 0.6 cm, se considera que están aptas para injertar. La plántula se corta 30 cm por encima del cuello de la raíz y se cicatriza la herida con un fungicida curativo. Las hojas existentes en el tallo se deben conservar. • Las yemas del segundo, es decir las tomadas del árbol madre o cultivar, se tornan de plantas adultas preferiblemente en producción. Las varetas que contienen varias yemas, se cortan a partir del segundo crecimiento, que se cuenta desde el ápice hacía el interior de la copa. Este segmento tiene la característica de tener un desarrollo intermedio entre la lignificación total y el aspecto tierno de los tejidos externos. Una vez desfolidas las varetas, se deben desinfectar sumergiéndolas por unos minutos, en una solución preparada con Captan y Benomil en proporción de 5 g y 1 g respectivamente, por litro de agua..
(22) A continuación en el patrón, 5 cm abajo del extremo y en el sitio donde brota una hoja que esta acompañada de una yema o punto de crecimiento, se hace el corte para retirar el escudete; la limpieza con la cual se hace esta operación, depende del uso de una navaja bien afilada. Luego afirmando la vareta contra el pecho del injertador, de manera que la parte más delgada sea la que este en contacto, se retira con la navaja la yema seleccionada para injertar. Esta debe tener un aspecto turgente, contener algo de leño en la cara inferior y ser de un tamaño igual al corte hecho en el patrón. Buena parte del éxito del injerto, medido éste como el número de yemas prendidas, depende de la correcta colocación de la yema y el amarre. La yema debe ponerse en contacto con el patrón, respetando la orientación que ésta tenía en la vareta y el amarre debe ser lo suficientemente fuerte, de manera que se facilite un íntimo contacto entre los tejidos de los dos componentes, esto ayudará a los procesos de cicatrización. Además al efectuar el amarre se debe tener el cuidado de no cubrir el punto de crecimiento del escudete. Realizado el injerto se cubre con una bolsa plástica, el prendimiento se evidenciará a partir de los 35 días. Durante esta etapa y si se tiene tiempo lluvioso se deben retirar las bolsas y aplicar en aspersión una mezcla similar a la ya indicada de Captan y Benomil. Una vez seque el producto, se tapan de nuevo, esta práctica se repite con regularidad dependiendo de los cambios de clima. Se advierte que las plantas para injertar deben crecer en un lugar sombreado y ventilado. Luego de brotadas todas las yemas estas se destapan y se continúa el cuidado de los nuevos árboles hasta cuando llegue el momento del transplante. El riego debe hacerse cada dos semanas, sin incurrir en excesos que faciliten el desarrollo de enfermedades. Es convenienté la aplicación de urea en razón de 3 g por bolsa con la misma frecuencia. La enfermedad mas común durante este periodo, es la antracnosis para lo cual el Oxicloruro de cobre 2 g/l alternado con Benomil 1 g/l, resulta efectivo. Algunas veces se presentan ataques de áfidos y chinches, en estos casos se recomienda la fumigación con Malation (1.5 cc/I); de aparecer ácaros, su contról se hace con Propargite + Tetradifon en proporciones de 0.75 cc y 2.5 cdl, respectivamente..
(23) wái rJÁ N. N. 0. 24. 3. asos para el injerto de escudete sencillo: (1) patrón o portainje 1A) escudete removido del patrón; (2) escudete removido de la van 3) escudete aplicado al patrón y amarrado con una cinta plástica.
(24) PRowaTm - $INTRP. COI"poiCa. R.g1onøI. MWd.rl. da Rgrkulturs y DasarroNo Rural. fl /. EVALUACIÓN DE LA GERMINACIÓN EN MAMONCILLO (Melicocca bijuga L.) POR EFECTO DE LA FORMA DE SEMILLA, MEDIO Y MODALIDAD DE SIEMBRA Eduardo Barragán Quijano 1 José Dairo Barreto Osorio2 Mary Isabel Barragán Alturo3 RESUMEN El mamoncillo es una planta nativa del Norte de Sur América y se encuentra semicultivado en la zona cálida árida del Norte y Sur del departamento del Tolima, donde tradicionalmente su reproducción se ha venido realizando por vía sexual, desconociéndose técnicas o prácticas que favorezcan el incremento en velocidad y porcentaje de germinación. Se evaluó el efecto de la forma de la semilla, medios germinativos y modalidades de siembra sobre la germinación de la semilla de mamoncillo. El experimento se realizó en el C.f. Nataima, Corpoica (El Espinal, Tolima). Como material propagativo se utilizaron semillas provenientes de árboles previamente caracterizados por adaptación, producción, calidad y sanidad del fruto. Como el fruto es una baya, se hizo necesario extraerle la semilla con el fin de seleccionarla y acondicionarla para su siembra. Se empleó el diseño experimental completamente al azar en arreglo factorial (2 x 3 x 2), correspondiéndole al primer factor la forma de la semilla (redonda y pacha); al segundo, el medio germinativo (cama con arena blanca, bolsa con arena blanca y bolsa con sustrato 3:1:1 (suelo + arena negra + cascarilla de arroz)), y el último factor la modalidad de siembra (sin y con tegumento); cada tratamiento consté de 100 semillas y cuatro repeticiones. Analizados los resultados los máximos valores de germinación se obtuvieron en su orden con los medios germinativos: bolsa con sustrato 3:1:1 y cama con arena blanca; y para la modalidad de siembra semilla sin tegumento, siendo esta la forma más práctica de producir patrones para su posterior injertación. Palabras claves: propagación, sustrato, mamón, quenepa, maco, muco, anoncillo, pachas. 'Ingeniero Agrónomo M.Sc. Investigador Asociado, Corpoica, Regional 6. C.I. Nataima, El Espinal (T) , ingeniero Agrónomo M.Sc. Investigador Asociado. Corpoica, Regional 6. Creced Norte ToIie Ibagué (1) 3 Ingeniero Agrónomo, El Espinal, (r).
(25) ^, 3 ^/? PROIIA1TR - SINTRP. <7,58 - 5. Corpoica. MWg.rlo de Rgric.Iture. , Desorroflo Rirel. R.gIoneI. INJERTACION EN MAMONCILLO. Eduardo Barragán Quijano1 José Dairo Barreto Osono2 • SELECCIÓN DE PATRONES.. Se recomienda utilizar plantas provenientes de semillas de arboles caracterizados por su sanidad y tolerancia a las principales condiciones adversas, entre otras como el déficit hídrico o baja fertilidad de los suelos. Los patrones deben cumplir ciertos requerimientos mínimos para estar en condiciones optimas para su injertación, sobresaliendo dentro de estas las siguientes: Para las condiciones de El Espinal (C.I. Nataima), la edad optima para ser injertados esta entre 6 y 8 meses después de sembrados tanto en bolsas como en cama de arena. El anterior valor debe coincidir con el de altura de la planta a injertación la cual debe oscilar entre 24 y 32 cm. , al igual que el diámetro del tallo debe estar entre 0.54 a 0.61 cm. i. INJERTO INGLES SENCILLO. El proceso para su desarrollo en mamoncillo es el siguiente: El día anterior al proceso de injertacion las plantas previamente seleccionadas como patrón, debe ser fumigadas con un fungicida. PREPARACION DEL PATRON. o. Se debe seleccionar plantas por características deseables.. 1 Ingeniero Agrónomo MSc. Investigador Asociado, Corpoica, Regional Seio, C.LNataima 2 ngeniero Agrónomo M.Sc.Iinvestigador Asociado, Co~, Regional Seis, Ibagué (T).
(26) • Se decapita el patrón en el sitio o punto terminal del tallo donde cambia color la planta ( promedio en altura de 25 cm y de diámetro del tallo de (0.57 cm). El decapitado del tallo de la planta patrón se debe realizar en lo posible con un tijera de podar y específicamente de un solo corte. Luego el patrón debe ser deshojado cerca a donde se va a hacer el injerto, eliminando también los chupones. Las hojas bajeras se dejan. PREPARACION DEL INJERTO (VARETA-PUA). • De arboles previamente seleccionados por producción y calidad del arilo y que su estado de desarrollo coincida con la etapa terminal de cosecha o siguiente a su culminación se escogerán las varetas. Es importante tener en cuenta que al seleccionar las varetas estas no se encuentren afectadas por el perforador del tallo. • Se recomienda cortar las varetas el día anterior al de injertacion o el mismo día y en lo posible en las primeras horas del mismo. • Las varetas deben presentar color café-claro y que posean yemas hinchadas, pero no abiertas en un numero no menor de dos. • Se procederá luego a cortar las hojas que tenga la vareta dejando 0.5 cm M pecíolo.. o La longitud promedio de la vareta debe oscilar entre 20 y 22 cm. • La vareta con la misma longitud antes descrita, serán divididas en dos partes cada una de mas o menos 10 cm de longitud, llamándose a la parte terminal puntera y a la siguiente secunciera. • Después de haber reunido el numero de varetas mayor en 30% de los patrones a injertar, se procederá a tratarse con Benlate (1 g.) + Orthocide (5 g.) en 5 litros de agua. • Las varetas serán colocadas sobre papel periódico y en la sombra para drenar los posibles excesos del fungicida. • La navaja a utilizar para los cortes debe estar espalmada y con un retoque al filo de la misma..
(27) CILLOI I. NJERTO A LA INGLESA (SIMPLE). A. . Corte uvIsvtado t,go en la A . icto Int 13 bas q. cQ )a varetas. b Corte covrepod 4 QAt ramd o (O(fl. vosQtc* 54. C-. LGi s. czJutun un* c on. co r. te, de tI.
(28) INJERTACION. Después de preparado el patrón y además la púa se procede a la injertacion (Ver Gráfico). • Es preferible y recomendable que el patrón y la vareta (púa) tengan el mismo diámetro. • Los cortes que se realicen en la punta del patrón y el que se haga en la base de la púa deben ser exactamente iguales. • Primero se hace el corte neto e inclinado de 2 a 3 cm. de largo. Los cortes mas largos se hacen cuando se trabaja con material mas grueso. De preferencia el corte debe hacerse de un solo tajo de la navaja, de modo que la superficie quede bien lisa. Los cortes ondulados y desiguales (patron-pua) no forman uniones satisfactorias. • Luego se procede a ensamblar el patrón con el injerto. Es de suma importancia que las capas de cambium coincidan. • El amarre se debe realizar con cinta trasparente y en el sentido de abajo hacia arriba, para luego terminar con un nudo suave de aseguramiento. . Cuando se trabaje con puas secunderas están se deben cubrir en su punta terminal con pasta de Benlate. • Después se colocara una bolsa plástica para recubrir el injerto. • Los injertos ya realizados se colocaran en la sombra mas no en la oscuridad. Este ultimo factor determinara el sobrecubnr la bolsa plástica con una de papel. • Ya terminado el paso siguiente es la evaluación de prendimiento, la cual se debe realizar hasta los 60 días después del injerto y 30 días después se pueden sembrar en el sitio definitivo. 2. INJERTO DE HENDIDURA CENTRAL.. El mismo procedimiento para preparar el patrón y la vareta seguido en el injerto ingles sencillo son los de hendidura central, los pasos diferentes son:.
(29) HAMIINCILLO Injerto de hendidura central: a) La base de la vareta se corta con una cuña de lados iguales. b) Se corta el patrón con una cuña similar y se inserta la vareta. c) Se amarra con cinta plástica.. la.
(30) • La vareta en su punta terminal tendrá doble bisel, con longitud entre 2 y 3 cm. • Sobre el patrón se procederá a cortar por la mitad el tallo hasta una profundidad igual o similar al bisel de la vareta. • Luego se procede a colocar la vareta dentro de la hendidura del patrón y ajustándolo lo mejor posible. • Se realiza luego el amarre de ajuste al igual que el injerto ingles sencillo. • Se colocara la bolsa plástica trasparente. • Y los demás pasos se siguen igual al injerto ingles sencillo..
(31)
Figure


Documento similar
"No porque las dos, que vinieron de Valencia, no merecieran ese favor, pues eran entrambas de tan grande espíritu […] La razón porque no vió Coronas para ellas, sería
que hasta que llegue el tiempo en que su regia planta ; | pise el hispano suelo... que hasta que el
Habiendo organizado un movimiento revolucionario en Valencia a principios de 1929 y persistido en las reuniones conspirativo-constitucionalistas desde entonces —cierto que a aquellas
`o deben` cauro, pon gue sm los compalíquida , ~. Y en querrsas cn las llagas, Je donde vienen gv- mro baya diaerencia, que si cho. élws lo mesen.. mcdadcs qm: ks vimrn duE
The part I assessment is coordinated involving all MSCs and led by the RMS who prepares a draft assessment report, sends the request for information (RFI) with considerations,
Volviendo a la jurisprudencia del Tribunal de Justicia, conviene recor- dar que, con el tiempo, este órgano se vio en la necesidad de determinar si los actos de los Estados
Un examen detenido del artículo 149, i, que enumera las compe- tencias exclusivas del Estado, nos enseña la diversa terminología que se emplea para referirse a aquellos supuestos en
Como asunto menor, puede recomendarse que los órganos de participación social autonómicos se utilicen como un excelente cam- po de experiencias para innovar en materia de cauces