Permeabilidad de Metales Contenidos en ácido de Reciclo en una Membrana de Difusión
Texto completo
(2) INSTITUTO TECNOLÓGICO Y DE ESTUDIOS SUPERIORES DE MONTERREY CAMPUS MONTERREY DIVISIÓN DE INGENIERÍA Y ARQUITECTURA PROGRAMA DE GRADUADOS EN INGENIERÍA. Los miembros del comité de tesis recomendamos que el presente proyecto de tesis presentado por el Ing. Tania Raquel Rojas Cuéllar sea aceptado como requisito parcial para obtener el grado académico de Maestro en Ciencias con especialidad en:. SISTEMAS AMBIENTALES. Comité de tesis:. Jorge H. García Orozco, Ph. D ASESOR. Belzahet Treviño, Ph. D. Alejandro Alvarez Guerra, M. Sc.. SINODAL. SINODAL. APROBADO. Federico Viramontes Brown Ph.D Director del Programa de Graduados en Ingeniería y Arquitectura. DICIEMBRE 2001.
(3) A mis padres; gracias por todo su amor y apoyo.. A mi esposo; te amo.. A mi familia..
(4) ÍNDICE 1. ANTECEDENTES 1.1 PLANTAMIENTO DEL PROBLEMA. 2. 1.2 OBJETIVOS DE LA INVESTIGACIÓN. 2. 1.3 JUSTIFICACIÓN DE LA INVESTIGACIÓN. 3. 2.. FUNDAMENTOS. 2.1 DESARROLLO DE LAS BATERÍAS DE PLOMO. 5. 2.1.1 COMPONENTES DE LAS BATERIAS. 6. 2.1.2 RESIDUOS DE LAS BATERÍAS. 7. 2.2 PROCESOS DE MEMBRANAS. 8. 2.2.1 MEMBRANAS DE INTERCABIO IÓNICO. 10. 2.2.2 DIFUSION-DIALISIS. 11. 2.3 TRANSFERENCIA DE MASA. 14. 2.3.1 MODELO DE TRANSFERENCIA DE MASA PARA DIFUSION-DIALISIS. 15. 2.4 CARACTERÍSTICAS DEL ACIDO PROVENIENTE DE BATERÍAS. 16. 2.5 IONES METÁLICOS Y SUS PROPIEDADES ELECTROQUÍMICAS 2.5.1 FACTORES QUE AFECTAN LA SOLUBILIDAD 2.5.1.1 ENTALPIA DE HIDRATACION. 17 20 21. 3. METODOLOGÍA 3.1 DESCRIPCIÓN DEL EQUIPO. 24. 3.2 MODELO MATEMÁTICO. 27. 3.3 DISEÑO DE LAS PRUEBAS. 29.
(5) 4.RESULTADOS 4.1 DESCRIPCIÓN DE RESULTADOS 4.1.1 RESULTADOS. 33. Y DISCUSIÓN DE LA PRIMERA ETAPA. 33. 4.1.2 RESULTADOS Y DISCUSIÓN DE LA SEGUNDA ETAPA. 40. 5.CONCLUSIONES APÉNDICE A BALANCE DE MASA. 57. APÉNDICE B COMPONENTES DEL MODELO DE TRANSFERENCIA DE MASA. 54. APÉNDICE C LINEALIZACION DEL MODELO DE TRANSFERENCIA DE MASA. 57. APÉNDICE D RESGRESION MULTIVARIABLE. APÉNDICE. 61. E. CONSTANTES FISICOQUÍMICAS. 83. BIBLIOGRAFÍA. ii.
(6) Capítulo 1. Antecedentes.. CAPITULO 1.. 1. ANTECEDENTES. Con anterioridad los procesos de difusión-diálisis han sido abordados por diferentes autores, por ejemplo el modelo de difusión propuesto por Lonsdale, Merten y Riley[3l que describe el transporte de soluto y solvente a través de las membranas en términos de las afinidades relativas de éstos por la membrana y su transporte difusivo por el interior de la fase de la membrana. Las fuerzas directoras para el transporte son las diferencias de potencial químico a través de la membrana, debido a las diferencias en concentración y presión. Las aplicaciones de difusión-diálisis para recuperara ácidos de los efluentes industriales, incluye (Jing-Wen, 1987): 1. Recuperación de ácido sulfúrico a partir de soluciones con contenido de sulfato de níquel o sulfato de cobre procedente de plantas metalúrgicas. 2. Recuperación de ácido sulfúrico a partir de soluciones con contenido de sulfato de aluminio procedentes de procesos de alúmina. 3. Recuperación de cromato de los efluentes de galvanoplastia. 4. Recuperación de ácido fluorhídrico y ácido fluorisilícico de los efluentes de procesos de titanio y plomo. 5. Recuperación de ácido clorhídrico de los líquidos de extracción o decapado. 6. Recuperación de ácido sulfúrico de los efluentes de decapado de hierro y acero.. Todas ellas utilizan las membranas de intercambio iónico. Las soluciones a tratar suelen ser una mezcla de ácidos, como sulfúrico, y sus sales de aluminio, níquel y hierro. El ácido tiene una mayor difusividad en las fases de la membrana que la sal, por lo cual el ácido pasa más rápidamente de las celdas de dializado a las celdas del difundido.. 1.
(7) Capítulo 1. Antecedentes.. Sridhar y Subramaniam (1989)[2] han investigado la aplicación de diñisión-diálisis para la recuperación de ácido sulfúrico del efluente de regeneración por intercambio catiónico, con un contenido de 1.48% de ácido sulfúrico libre. Estudiaron el efecto de los caudales del dializado y difundido sobre la cantidad de ácido recuperado, utilizando un equipo de difusión-diálisis modelo TSD-2-20 (Tokuyama Soda Co., Ltd) provisto de membranas de intercambio aniónico. Obteniéndose una recuperación del ácido de 89 a. 90%. /. / PLANTAMIENTO DEL PROBLEMA.. El presente trabajo se basa en una tesis anterior, "Evaluación de alternativas para recuperación de ácido sulfúrico proveniente de baterías automotrices"1'1. La intensión de Alvarez era determinar la forma técnica y económica, que permitiera eliminar el fierro presente en ácido sulfúrico proveniente de las baterías. Dentro de las múltiples alternativas que analizó se encontraba un equipo de difusión-diálisis. El cual a parte de resultar el más atractivo económicamente, generó un modelo de transferencia que incluye la influencia de los flujos de operación, específicamente el flujo de ácido contaminado y el de ácido recuperado, en la constante de transferencia comúnmente utilizada.. 1.2 OBJETIVOS DE LA INVESTIGACIÓN.. 1. Por ello inició la necesidad de comprobar que el modelo propuesto por Alvarez11] es efectivo dentro de un rango amplio de flujos comúnmente utilizados,. 2.
(8) Capítulo 1. Antecedentes.. 2. Además de verificar que los otros metales presentes en el electrolito siguen el mismo comportamiento que describió el fierro.. 1.3 JUSTIFICACIÓN DE LA INVESTIGACIÓN. El reciclamiento industrial interno no sólo es efectivo porque disminuye los requerimientos de suministros, sino también limita la descarga de contaminantes y facilita la recuperación de materiales útiles. Por ello; actualmente se esta considerando la utilización de las membranas para la recuperación de recursos y prevención contra la contaminación. Dicho proceso esta recibiendo mayor atención con los cambios en las regulaciones de las naciones industrializadas, que promueven tratamientos de final de línea hasta reducción de fuentes. Por razones económicas, las aplicaciones están todavía limitadas a los casos en que los contaminantes y/o agua pueden recuperarse para reciclado o reutilización, pero si se piensa en el costo que se tiene por disposición o confinamiento de dichos materiales, las perspectivas pueden cambiar. Los resultados obtenidos en esta investigación tienen valor teórico, ya que este modelo proporcionaría una. nueva herramienta que ayude a explicar el fenómeno. transferencia de masa dado en este proceso de difusión-diálisis y puede aplicarse a todos los sistemas que se gobiernan por un mecanismo de transferencia de masa, teniendo implícitas todas las variables de operación y una sola constante. Generando un modelo de remoción de metales, que permite optimizar el proceso de purificación de ácido sulfúrico, disminuyendo así una fuente contaminación ambiental y un gasto económico excesivo para la industria que los genera.. 3.
(9) Capítulo 1. Antecedentes.. Tabla 1.1 Principales usos industriales del H2SO4. Fertilizantes fosfatados Fertilizantes no fosfatados Petroquímica Metales no ferrosos Pigmentos (TiÜ2 ppal) Acidos(HCl ppal) Hierro y acero Otros (innumerables). 49 7. 6.5 4 4 2.5 1 26. Ya que el ácido sulfúrico se utiliza prácticamente en todos los procesos industriales; aunque frecuentemente no forma parte de los productos finales, como puede observarse en la tabla 1.1. 4.
(10) Capitulo!. Fundamentos.. CAPITULO 2. 2. FUNDAMENTOS.. Las baterías pueden clasificarse en: 1. Primarias que se utilizan sólo una vez, dado que las reacciones químicas que proporcionan la corriente son irreversibles, y 2. Secundarias, llamadas también acumuladores, se pueden utilizar, recargar y volver a utilizar. Estas últimas debido a su recargabilidad, han sido tradicionalmente las de mayor utilidad en las aplicaciones industriales y de automoción. Existen dos químicas de baterías recargable que han obtenido éxito comercial las de níquel-cadmio y las de plomo-ácido. El presente trabajo se desarrolla utilizando como base de trabajo ácido sulfúrico contaminado con metales pesados proveniente de baterías ácido-plomo.. 2.1 DESARROLLO DE LAS BATERÍAS DE PLOMO. En 1859, Gastón Planté^ desarrolló un sistema de baterías plomo-ácido enrolladas en espiral, separadas por hojas de goma y sumergidas en una solución diluida de ácido sulfúrico. Cuya capacidad de producción de energía eléctrica era extremadamente limitada, puesto que disponía de muy poco material activo para la reacción. Esta conformación sigue siendo, en nuestros días, un aspecto significativo de la fabricación actual de las baterías plomo-ácido. El siguiente desarrollo de influencia en la evolución de las baterías de plomo ácido fue la invención - por Charles Kettering en 1912[5] - del primer arranque automático práctico para automóviles. El cual fue rápidamente adoptado General Motors para su dispositivo de arranque, iluminación e ignición de sus automóviles.. 5.
(11) Capítulo!. Fundamentos.. El despunte en la fabricación de automóviles, trajo consigo un aumento en la fabricación y consumo de esto generadores de energía. Pero esta no es sólo la única fuente de consumo de baterías, pues actualmente son de utilidad en:. •. La energía de reserva: dentro de equipos de telecomunicaciones, sistemas de alarma de seguridad, iluminación, equipos médicos y cortadoras de césped.. •. Energía portátil: con electrodomésticos, juguetes, teléfonos celulares y. •. La energía. alternativa con los ordenadores,. electrónica de consumo e. instrumentación.. 2.1.1 COMPONENTES DE LAS BA TERIAS. La celda, es la unidad básica de la batería y consta de cuatro componentes principales como se muestra en la figura 2.1 Los cuatro componentes se alojan en un tanque o depósito.. •. El electrodo negativo: plomo metálico, ánodo durante las reacciones de descarga, suministra electrones al circuito cuando se oxida.. •. El electrodo positivo: dióxido de plomo (PbOi), cátodo durante las reacciones de descarga, acepta los electrones del circuito cuando se reduce.. •. Separador: una barrera que se utiliza normalmente para aislar eléctricamente los electrodos negativo y positivo, evitando su contacto eléctrico directo.. 6.
(12) Capítulo!. Fundamentos.. ctrodo Positnro. Electro. Electrodo Xttgvtnro. Figura 2.1 Descripción de la célula.. •. El electrolito', una solución diluida de ácido sulfúrico (t^SO-t) y agua, completa el circuito internamente, suministrando los iones necesarios para la conducción entre los electrodos positivo y negativo. En un electrolito ácido, los iones positivo (H+); se crean en el electrodo negativo y se absorben en el positivo.. 2.1.2 RESIDUOS DE LAS BA TERIAS. La mayoría de los componentes de las baterías son reciclados al terminar la vida útil de las mismas. El Plomo se funde para prepara nuevas rejillas y contenedores, el polipropileno se muele y se lava para la fabricación de cajas, tapas y otros componentes plásticos y el electrolito contiene impurezas metálicas que impiden que se reutilice directamente en la fabricación de nuevas baterías, por ello se neutraliza y los residuos sólidos generados se envían a confinamiento.. 7.
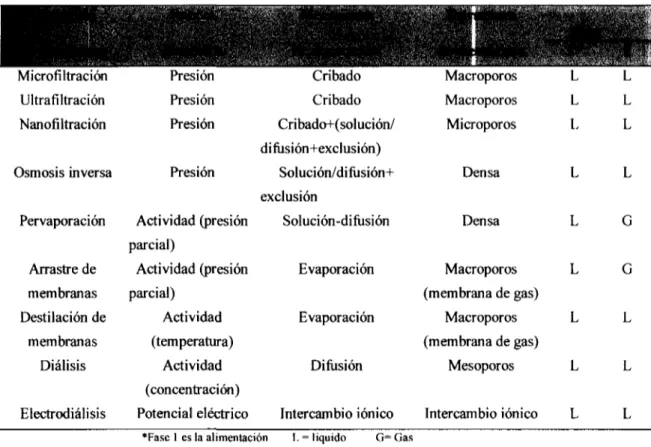
(13) Capítulo!. Fundamentos.. El confinamiento o disposición de estos desechos genera un gasto extra en la empresa; así que actualmente la industria ya utiliza procesos como extracción, difusióndiálisis, electrodiálisis o filtración, para la purificación y reciclamiento del ácido sulfúrico proveniente del electrolito. Con un porcentaje de recuperación de casi el 90% y disminuyendo considerablemente los residuos que deben ser colocados en confinamiento.. 2.2 PROCESOS DE MEMBRANAS. Desde el desarrollo de las membranas sintéticas en 1996^, el interés en este proceso para el tratamiento de agua y agua residual ha crecido rápidamente. La tecnología de las membranas es objeto de importante actividad comercial, en investigación y desarrollo a escala internacional. El crecimiento en el uso de las membranas para aplicaciones de ingeniería ambiental puede ser atribuido principalmente a dos factores: 1. Incremento en la presión jurídica por regular el tratamiento de aguas potables y residuales; 2. Incremento en la demanda de agua.. Una membrana semipermeable, es una lámina fina de material capaz de separar sustancias en función de sus propiedades físicas y químicas, cuando se aplica una fuerza directora a través de la misma. Las membranas pueden clasificarse por el tipo de sustancias separadas y por las fuerzas directoras empleadas, por ejemplo, la microfiltración y la osmosis inversa son dos procesos de membrana que utilizan la presión para transportar moléculas a través de la membrana. En la tabla 2.1 puede observarse la clasificación general de las operaciones de membrana.. 8.
(14) Capítulo!. Fundamentos.. Tabla 2.1 Operaciones básicas de membrana.. Microfiltración. Presión. Cribado. Macroporos. L. L. Ultrafíltración. Presión. Cribado. Macroporos. L. L. Nanofiltración. Presión. Cribado+(solución/. Microporos. L. L. Densa. L. L. Solución-difiísión. Densa. L. G. Evaporación. Macroporos. L. G. L. L. Mesoporos. L. L. Intercambio iónico. L. L. difusión+exclusión) Osmosis inversa. Presión. Solución/difusión+ exclusión. Pervaporación. Actividad (presión parcial). Arrastre de membranas. Actividad (presión parcial). Destilación de. Actividad. membranas. (temperatura). Diálisis. Actividad. (membrana de gas) Evaporación. Macroporos (membrana de gas). Difusión. (concentración) Electrodiálisis. Potencial eléctrico *Fase 1 es la alimentación. Intercambio iónico L = liquido. O= Gas. Entre las operaciones que existen para la separación118]de soluciones, las membranas ofrecen ventajas básicas como son: a) La separación tienen lugar a temperatura ambiente sin cambio de fases, b) sin acumulación de productos dentro de la membrana y c) no necesitan la adición de productos químicos. En la mayoría de los casos la concentración variará con la distancia a través de la membrana y a través de las capas límites en las dos caras o interfaces de la membrana. 9.
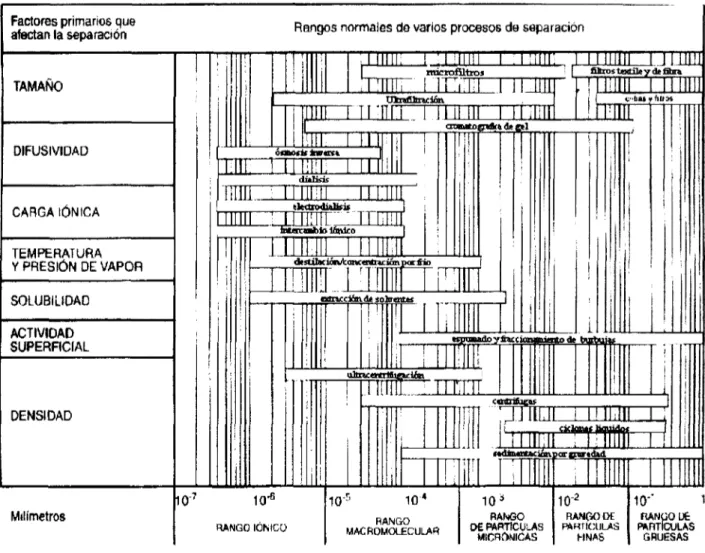
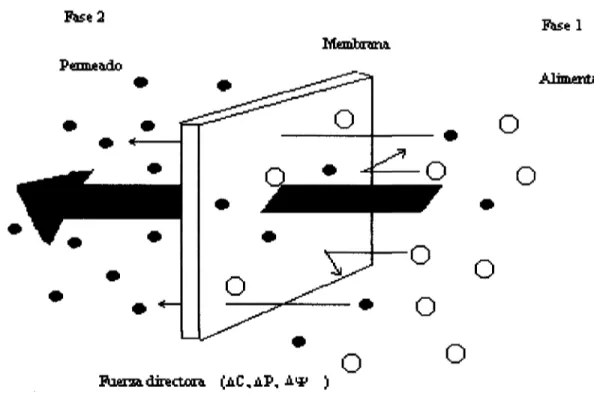
(15) Capítulo2. Fundamentos.. Pise 1 Alimentación. O. o. Fieras.directora. (AC,AP,. o. o o o o. Figura 2.2 Descripción de una membrana semipermeable.. 2.2.1 MEMBRANAS DE INTERCABIO IÓNICO.. Hay dos tipos básicos de membranas de intercambio catiónico e iónico son muy selectivas, las membranas de intercambio iónico son permeables a los cationes pero no a los aniones y viceversa. La naturaleza de la alimentación a tratar por el proceso de la membrana determinará cuál será la mejor para cada aplicación. Pero el éxito de la aplicación de la tecnología de membrana dependerá de la concentración, aislamiento o remoción del contaminante. Como se puede observar en la figura 2.3.. 10.
(16) Capítulo!. Fundamentos.. SSSfwSSSáí8. Ran9 s normales de varios. °. I TAMAÑO. _U muí. , | ||| ||;. imc rofiltros :. (rwr i. i. Procesos da separación. DIFUSIVIDAD. i. E I. i IIIMI. i. |. ¡. í. i. i. |. 1. 1. !. i. I. í. i i. 11. ; •. RANGO IÚMCO. ¡. io-r'. 10 4. RANGO MACROMOLECULAR. i. «xttrifiígas rJJ lll. II l'l. I. i. i. i. ¡ í t. Lijt U 45. ¡. espfflW'Hlf'V fhirr umankicntode N 1 j. atenicemtfiguiin. 1. | ¡|. í. lili i l l. i. Ji_. ! ll.lll. ! i lililí ;. i. illl III. «KUUMUJI nparcwi dad ^^. 103. RANGO DE PARTÍCULAS MICHÓNICAS. io-2. 10-'. RANOODE. R*Hrtc;uwt. UNAS. Figura 2.3 Rangos de separación en los procesos por membranas.. 2.2.2. i. ¡. '. i. Milímetros. ,. i. i. I. 1. i. 10"6. II!. i. ,. [. i. I. II. 1. eanccián. d* so eMJK. DENSIDAD. 10'7. N. 1 destÜKián/c ame ntraciónparfii10. i i. 1. fliai vhtlJí. j. f 1 1 '. ACTIVIDAD SUPERFICIAL. JiJ. í. irMí M| N. ;. SOLUBILIDAD. I.U1ÍI. I. UJJi'ÜL TTÍMT biurambio Único. !; i ,• íi. i. :. eleOrodidisis. i lililí. _. JIJi. t. :i. 111. TEMPERATURA Y PRESIÓN DE VAPOR. lili l'l. diálisis. m CARGA IÓNICA. :i;. i 1 1 muí. E filtros textile y dt Shra. li nuil i i Mi! i CTOHutDptftts de sel. T. tTtasfitairióm. lililí r mu ócnofii inrtrcí. i : i !¡ni¡. DIFUSION-DIALISIS. Muchos de los procesos químicos de uso industrial están basados en compuestos. como el hidróxido de sodio, amoníaco, ácido sulfúricos, ácido nítrico y sus sale; generando flujos residuales con altas concentraciones de sales disueltas, en algunos casos se desea que los flujos sean reutilizados en el proceso, pero la concentración de las sales lo impiden. En otras circunstancias las sales son las que generan interés y se busca su recuperación.. 11. RANGO DE PARTÍCULAS GRUESAS. 1.
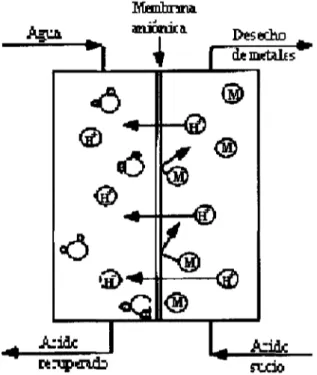
(17) Capítulo2. Fundamentos.. Las membranas de intercambio iónico se pueden dividir en dos grupos según su fuerza motriz: 1. Baterías electrolíticas, en las que el proceso es accionado por los gradientes del potencial eléctrico. 2. Baterías de difusión- diálisis, en la que el proceso es accionado totalmente por los gradientes de concentración a través de las membranas.. La difusión-diálisis se aplica a soluciones en las que el soluto es el que se transfiere a través de la membrana, existe un paso selectivo de los iones; la fuerza motriz es una diferencia de concentración a través de la membrana. Generalmente es utilizado para recuperar iones valiosos de soluciones diluidas, gracias al intercambio de iones del mismo signo de una solución concentrada que sea más barata que el material a recuperar. Los grupos funcionales cargados sobre la membrana atraen iones de carga opuesta generándose así la separación.. Manbnirui. Figura 2.4 Celda de Diíusón-Diálisis.. 12.
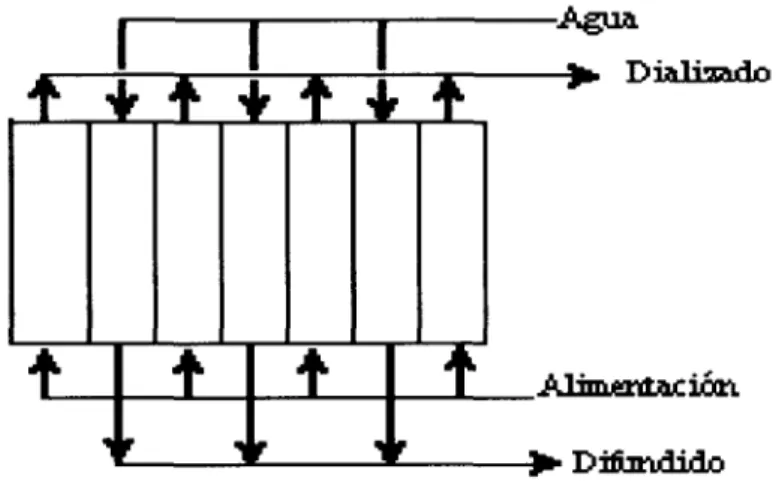
(18) Capítulo2. Fundamentos.. El equipo de difusión-diálisis se construye generalmente en una configuración de placas paralelas, incluyendo marcos,. en celdas alternas de dializado y difundido,. separadas por membranas de intercambio iónico. El. dializado es el fluido de. alimentación que contienen los iones a separar, mientras que el difundido es inicialmente agua pura en las que se dispersan los iones recuperados, formando la solución recuperada; ambos fluyendo siempre a contracorriente.. •í-if-Ul.. 1. 1. 1. t * * * * * *. t. t 1F. t. t 1r. i. ¿1-iiriatYt-ar-irivi h» rjTfiíKiílHHri. Figura 2.5 Diagrama de flujos en una batería típica de difusión-diálisis.. En consecuencia, las densidades del fluido de alimentación y de la corriente de la solución recuperada son más altas en el fondo de sus respectivas celdas, lo que evita la remezcla. La disposición de flujos a contracorriente maximiza los gradientes de concentración, lo que conduce a una mayor velocidad de transmisión de los componentes de difusión. La concentración del componente recuperado puede ser tan alta como el fluido de alimentación original.. 13.
(19) Capítulo!. Fundamentos.. Un diagrama esquemático del proceso de difiísión-diálisis se observa en la figura 2.6. Los solutos contenido en la solución y en el solvente, son. separados por la. membrana, esta transferencia obedece la ley de Fick, hasta que se establece un equilibrio químico entre la de la membrana y la solución.. Cao. Qb. Cb Cbo. Cbi. dA. Fig.2.6 Transferencia de solutos en el proceso de Difussió-Diálisis (Qa y Qb son constantes). 2.3 TRANSFERENCIA DE MASA. Los mecanismos de purificación se explican a través de relaciones termodinámicas de equilibrio, leyes de conservación y principios de transferencia de masa. Los fenómenos de transporte pueden ser descritos matemáticamente mediante la aplicación de tres leyes físicas fundamentales, independientemente de la naturaleza del fluido o sólido que interviene en el proceso. Estas tres leyes son: l)Conservación de masa, 2)la segunda ley del movimiento de Newton y 3)La primera ley de la termodinámica. La aplicación de estas leyes, en forma de balances de materiales, cantidad de movimiento y de energía, en un sistema o proceso, permite su formulación mediante ecuaciones.. 14.
(20) Capítulo!. Fundamentos.. Los mecanismos de transporte de masa o energía pueden ser de dos tipos: molecular y turbulento. El transporte molecular se caracteriza por el movimiento individual de las moléculas; el transporte turbulento resulta el movimiento de grandes grupos de moléculas (remolinos).. 2.3.1 MODELOS DE TRANSFERENCIA DE MASA PARA. DIFUSION-DIALISIS.. El modelo global de transferencia™ que se presenta el proceso de difusióndiálisis, ecuación (2.1), describe que el flujo del líquido permeado a través de la membrana es directamente proporcional al área de la membrana y a la diferencia media logarítmica de la concentración, que se ve afectado con los mecanismos de transferencia de masa que se presenten en ambos lado y dentro de la membrana.. (2.1). Ni=KAAC,n. Donde K es el coefciente globalde transferencia de masa, se sabe este coeficiente es un valor experimental que depende de las condiciones de operación y además de las características de la membrana, el tipo de ácido, el tipo de metal, concentraciones, etc. Utilizando estos antecedentes Alvarez propone un modelo en que la transferencia es una función del tiempo de contacto de las soluciones en ambos lados de la membrana, que a su vez se expresa como una función de los flujos[1].. (2.2). (Qr'Y. 605843. 15.
(21) Capítulo!. Fundamentos.. En donde t' es el tiempo de contacto de la solución del ácido contaminado con la membrana, t es el tiempo de contacto del agua con la membrana; m y n son constantes experimentales.. (Qr'Y. (2.3). Alvarez también sugirió el caso donde el flujo de agua desmineralizada es constante e integrando el coeficiente de transferencia se genera un nuevo modelo de transferencia de masa; donde K' es el producto de K*(Qa)m y que considera el efecto de los flujos en ambos lados de la membrana.. 2.4 CARACTERÍSTICAS DEL ACIDO PROVENIENTE DE BA TERIAS.. Como ya se menciono anteriormente una vez que las baterías ácido-plomo ha cumplido con su vida útil, la mayoría de sus componentes son reutilizados en la elaboración de nuevas baterías. Sin embrago el electrolito contiene una gran cantidad de metales pesados como son fierro, antimonio, cobre, cromo y níquel^, que impiden su reutilización sin un tratamiento de limpieza previo.. 16.
(22) Capítulo2. Fundamentos. Tabla 2.2 Cantidad de metal especificada y real contendida en el electrolito.. Fierro Antimonio Cobre Manganeso Níquel Zinc Cromo. 10 0.2 0.8 0.05 0.2 11 0.3. 250 11.9 13.8 1.28 3.89 10.4 5.50. Según las especificaciones de elaboración para baterías el metal que se encuentra en mayor abundancia es el fierro y cuya concentración máxima permisible es de 10 ppm.[1]Pero como puede verse en la tabla 2.2 el fierro y el resto de los metales contenidos en electrolito alcanzan concentraciones superiores a lo especificado.. Como se describió en el Capítulo 1 uno de los objetivos de este trabajo es verificar que los otros metales presentes en el electrolito siguen el mismo comportamiento que describió. Alvarez para el fierro. Teniendo esto en cuenta es. necesario considerar las diferencias electroquímicas y estructurales que existen entre los iones metálicos disueltos en la solución de estudio.. 2.5 IONES METÁLICOS Y SUS PROPIEDADES. ELECTROQUÍMICAS.. Los elementos definidos como metales se encuentran hacia la izquierda de la tabla periódica, este carácter metálico va disminuyendo conforme se avanza la derecha de ella. Según el modelo atómico, los metales están formados por átomos que tienen varios orbitales externos disponibles, pero sólo un pequeño número de electrones para. 17.
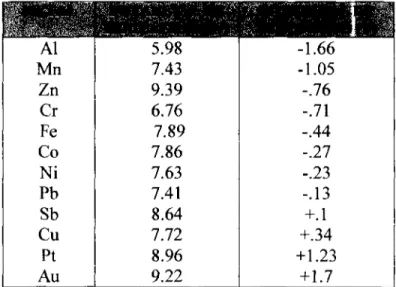
(23) Capítulo2. Fundamentos.. ocuparlos; es decir que la nube de carga electrónica alrededor del corazón del átomo del metal es elevada. Los metales son muy reactivos, debido a que su electronegatividad es pequeña y se mantienen enlazados con intensidad por la formación de un enlace con electrones compartidos. Cuando un átomo se encuentra en solución, libera electrones convirtiéndose en un ion. [25. \ la facilidad con que se produce ésta reacción se mide con dos propiedades la. atracción nuclear y el potencial de electrodo.. Tabla 2.3 Potencial de ionización y potencial de electrodo de algunos metales.. Al Mn Zn Cr Fe Co Ni Pb Sb Cu Pt Au. 5.98 7.43 9.39 6.76 7.89 7.86 7.63 7.41 8.64 7.72 8.96 9.22. -1.66 -1.05 -.76 -.71 -.44 -.27 -.23 -.13 +.1 +.34 +1.23 +1.7. 18.
(24) Capítulo!. Fundamentos.. Los compuestos iónicos. se conocen también como sales, la variación en su. carácter metálico indica la facilidad con que se pierde los electrones y la estabilidad de los iones formados. La facilidad con la que los metales pierden sus electrones aumenta conforme se desciende en el grupo. Las propiedades estructurales y electroquímicas de los compuestos cambian cuando se encuentran en solución, pues se crean nuevas interacciones entre las partículas del soluto que se distribuyen uniformemente dentro de volumen ocupado por las partículas del solventes. Cuando se forma una solución se requiere energía para romper los enlaces existentes y crear una nueva fuerza dipolo-ión, que haga estables a los iones en su nuevo ambiente. Este proceso se llama solvatación. La energía requerida se proveer en parte, por las nuevas fuerzas intermoleculares creadas entre el soluto y las partículas del solvente. Corno puede observarse en la figura. 2.7.. Fuerza solvente-solvente \}. i<$. -tb. Fuerza soluto-solvente. Figura 2.7 Interacciones entre las moléculas de soluto y solvente.. 19.
(25) Capítulo2. Fundamentos.. La solubilidad es una posición del equilibrio en una reacción y por lo tanto tienen un número infinito de valores dependiendo de las condiciones a la que se este llevando acabo dicha reacción. Mientras que el producto de la solubilidad (KpS)[30] por su parte, es una constante de equilibrio y tiene un sólo valor bajo ciertas circunstancias de temperatura.. 2.5.7. FACTORES QUE AFECTAN LA SOLUBILIDAD. Un gran número de factores deben tomarse en cuenta. para determinar la. solubilidad de un compuesto en un solvente, pues las condiciones bajo las cuales se lleva a cabo la reacción influyen mucho; por ejemplo una sal se disuelve mejor en un medio ácido, ya que el pH definitivamente puede afectar la solubilidad. Otro factor que puede influenciar en la solubilidad de un soluto es la temperatura, pero el efecto de ella no es siempre el mismo, ya que una solución exotérmica un aumento en la temperatura conduce a una disminución en la solubilidad; así que es necesario determinar su influencia de la temperatura de manera experimental. La solubilidad de un líquido en otro líquido depende en gran parte de la polaridad de las moléculas del soluto y el solvente. Los líquidos polares se disuelven en otros líquidos polares, porque las fuerzas intermoleculares entre el soluto y el solvente son muy fuertes, lo que los hace estables, sin embargo su unión con los líquidos no polares es muy débil facilitando su ruptura. Cuando los iones se encuentran unidos a un número indefinido de moléculas de solvente y este solvente es agua se dice que los iones están hidratados. Un ion hidratado se rodea por una envoltura molecular de agua, donde el extremo polar parcialmente negativo de la molécula de agua esta unido al catión y el extremo polar parcialmente. 20.
(26) Capítulo!. Fundamentos.. positivo se une al anión, como se muestra en figura 2.8. La energía de la hidratación de un catión depende de la carga, el radio iónico y electronegatividad del elemento, siguiendo la ley de Coulomb.. Catión hidratado. Anión hidratado. Figura 2.8 Estructura molecular del ion.. 2.5.1.1 ENTALPIA DE HIDRATACIÓN Como se describió anteriormente cuando los iones se disuelven en un solvente la ruptura de los enlaces existentes y la creación de los nuevos genera energía. Si el solvente fuera agua se le llama energía o entalpia de hidratación. Los cambios de la energía implicados en el proceso de disolución se resumen en la figura 2.9; el cual muestra la disolución de un sólido en un líquido. La energía necesaria para liberar las partículas del solvente se llama calor o energía de solvatación. Cuando el proceso de solvatación proporciona más energía de la necesaria para separar las partículas puras del soluto y del solvente, el calor de la solución. 21.
(27) Capítulo2. Fundamentos.. es negativo, y el proceso total de la disolución es exotérmico. La diferencia entre la energía requerida para la separación y el calor de solvatación se llama calor de la solución^2*.. o. o o». • «: 0 0. E N E R G I A. Separación de partículas desokonte. °cPQ. On °o 0° °0 ° Separación dtputioihí disoluto. feroce so Endotérmico. Proceso exotérmico. Figura 2.9 descripción de la formación de una solución y la energía necesaria para ello.. La interacción de los iones con las moléculas de agua altera la estructura intermolecular, cambiando el carácter de esas moléculas de agua que se ensamblan a los iones, así como el de los iones mismos. La energía de hidratación es más alta si la carga de los iones lo es. La energía de ionización y la energía de la hidratación se comportan de. 22.
(28) Capítulo!. Fundamentos.. manera paralela, pero la energía de hidratación es siempre 20 % menor que la de ionización^495.. Con esta información podemos asumir que la energía de hidratación puede influir en el coeficiente de transferencia de masa que describan los iones metálicos contenidos en el electrolito.. 23.
(29) Capítulo3. Metodología.. CAPITULO 3. 3. METODOLOGÍA.. Esta sección pretende introducirnos al diseño de las diferentes pruebas que se realizaron en la parte experimental de esta investigación y colocarnos en antecedentes de los materiales y los cálculos utilizados para ellas.. 3.1 DESCRIPCIÓN DEL EQUIPO.. Figura 3.1 Equipo de difiísión-diálisis.. El equipo utilizado en la realización de las pruebas en este trabajo fue el A J-5 de Puré Cycle Enviromental Technologies; Inc. El cual cuenta con un tanque de PVC para contener el ácido y otro para el agua desmineralizada con una capacidad de 13.5 galones'121 cada uno.. 24.
(30) Capítulo3. Metodología.. 0®. «3 30. tE>. 30. e® e® o®. 30 30. OE 0®. e. — ) Ion intercambiable móvil © Lugar de intercambio de carga positiva C a,dena. de p olietileno =3 Enlace de PVC Figura 3.2 Diagrama de membrana de intercambio catiónico.. El área total de la membrana utilizadas es de 0.77 m2 de PVC/Polietileno con grupos iónicos fijos, en este caso lo carga iónica esta generada por un grupo de aminas cuaternarias; que le permite ser selectiva con respecto al paso de los iones. Las cadenas del polímero están entrelazadas y tienen también enlaces cerrados en varios puntos. Los iones negativos se muestran dispersos libremente ene los huecos entre las cadenas. Sin embargo, las cargas positivas fijas de las cadenas repelen los iones positivos que tratan de penetrar en la membrana y los excluyen - Figura 3.2-. Así pues, a causa de las cargas positivas fijas, los iones positivos no pueden permear la membrana, pero los negativos si pueden hacerlo El módulo esta hecho de membranas de cara plana y placas - piezas que se muestran en la figura 3.3- Su diseño se deriva de un filtro prensa, la alimentación circula entre las membranas de dos placas adyacentes.. 25.
(31) CapítuloS. Metodología.. El espesor de la lámina líquida está en el rango de 0.5 y 3 mm, la densidad del compacto de las unidades de placa y bastidor es de cerca de 100 a 400 m2/m3. Las placas aseguran soporte mecánico de la membrana y al mismo tiempo, el drenaje del permeado.. Figura 3.3 Componente del equipo de diftisión-diálisis.. Las placas deben ser corrugadas en el lado de la alimentación para aumentar la transferencia de masa. Una vez que los flujos pasa a contracorriente a través del módulo, las salidas del ácido recuperado y de rechazo son regulados por dos bomba peristálticas 26.
(32) Capítulo3. Metodología.. colocadas a la salida de cada uno de ellos. La eficiencia del equipo se ve afectada por la transferencia de masa que se de a través y sobre la membrana.. Agua alimentada. Acido aumentad^. Marco. Membrana. Empaque. Separador. Figura 3.4.Esquema de un modelo de difusión-diálisis.. 3.2 MODELO MATEMÁTICO. A continuación se muestra un esquema del proceso donde se describe la nomenclatura que se utilizara para referirse a los flujos, concentraciones y componentes del mismo en las ecuaciones, para el calculo de la eficiencia.. 27.
(33) CapítuloS. Metodología.. Agua Qa: Flujo de agua Ca: conc . de metal «i agua. Acido rechazo QT* :Fhijo de acido de rechazo Cr1 : conceríraciónnKítal en acido rechazo. <3. -©. tíi:Fhijo de metal tmtsfendo (Sí---. gx. <. Acido re 051 erado Qr: Fhijo de acido re 051 erado Cr: Concentración de metal en acido 5 erado. —^. -<í2 ). Membrana ardórdca. Acido alimentado Qa':Fhijo de acido futió Ca': CoricentracioniMtal en acido. Figura 3.5 Notación del sistema de difusión-diálisis.. Como se dijo anteriormente se espera calcular en cada experimento la cantidad de ácido que se logra recuperar y la cantidad de metal que se rechazó durante el proceso, determinando así la eficiencia que se está generando en cada experimento.. Las ecuaciones que permitirán hacer esto son la 3.1 y 3.2 respectivamente. Donde pes la densidad y ¿yes la facción peso correspondiente a cada flujo.. 28.
(34) Capítulo3. Metodología.. Qrprcar Qa'pa'aa' Qr'Cr' Rechazo del metal = Qa'Ca' Recuperación de ácido =. (3.1) (3.2). Para determinar la coeficiente global de transferencia de masa K, se utilizara la ecuación 2.1 y posteriormente se calculara el coeficiente de transferencia de masa K*, utilizando el modelo de Alvarez, donde la transferencia es función del tiempo de contacto de las soluciones en ambos lados de la membrana, que a su vez se expresa como una función de los fiujos[1].. (3.3). (Qr')" Donde t' es el tiempo de contacto de la solución del ácido contaminado con la membrana, t es el tiempo de contacto del agua con la membrana; m y n son constantes experimentales; las cuales se espera también obtener.. 3.3 DISEÑO DE LAS PRUEBAS.. Las pruebas que se realicen en este trabajo pretenden comparar el coeficiente de transferencia de masa para un sistema de difusión-diálisis de los diferentes metales disueltos en electrolito, influenciado por los diferentes flujos de operación que se utilicen durante el procesos.. Para las pruebas se utilizarán 200 litros de ácido contaminado, que fue transportado en 5 porrones con capacidad de 60 litros cada uno; proveniente de la fosa de. 29.
(35) CapííuloS. Metodología.. desechos de una. empresa fabricante de baterías para automóviles localizada en la. comunidad. La experimentación pueden dividirse en dos etapas, la primera ocurre utilizando el equipo después de un largo y exhaustivo uso, acompañado de una falta de limpieza del sistema al cual le llamaremos etapa sucia. La segunda etapa llamada etapa limpia ocurre cuando se desmantela el equipo y las membranas fueron depositadas en un tanque que contenía una solución diluida de ácido sulfúrico 1:10 v/v, para ser lavadas.. Figura 3.6 Fotografía de la membrana utilizada. 30.
(36) Capítulo3. Metodología.. Las membranas se dejaron en reposo dentro de la solución por 24 horas, después fueron nuevamente colocadas en el módulo del equipo de difusión-diálisis. La figura 3.6 muestra la membrana utilizada en la experimentación, en esta figura puede observarse claramente el deterioro que ha sufrido la membrana, además de una coloración verdosa en el área de contacto que no es característico en ellas y la cual no pudo ser eliminada con el lavado que se realizó. Aunque la solución de ácido utilizado en el lavado mostraba clara evidencia de contaminación al cambiar de incolora a café claro y contener un precipitado ligero del mismo color. En la 1a etapa se hicieron tres corridas en las cuales se fijaba un flujo de agua (Qá) y se variaba el flujo de ácido contaminado (Qa'). Para la 2a etapa se fijo dos condiciones de flujo para Qa y tres diferentes Qa' para cada una de ellas.. Tabla 3.1 Descripción de los flujos utilizados en las corridas para la primera etapa.. Flujo de agua. Flujo de ácido. Qa. contaminado. (ml/min). Qa' (ml/min). 1. 7.5. 8.3. 2. 7.5. 12.5. 3. 7.5. 19.2. Experimento. Para realizar cada una de las pruebas se alimentaba el equipo utilizando una cubeta graduada de 12 litros; la velocidad de los flujos de recuperado y rechazo, fue determinada con una probeta graduada y un cronómetro. 31.
(37) CapítuloS. Metodología.. Cada experimento duró 24 horas y se registro la densidad y temperatura a la que se llevaron acabo. Una vez concluida la corrida se tomó muestra del ácido alimentado, el recuperado y el de rechazo, para ser analizados mediante absorción atómica y determinar la cantidad de fierro, antimonio, cobre, cromo, manganeso, níquel y zinc, presentes. La cantidad de ácido presente en los flujos del sistema fue determinada en el laboratorio mediante titulación con hidróxido de sodio 1N. Una vez terminada la corrida, se hacia pasar agua desmineralizada por ambos lados de la membrana esperando eliminar los residuos contenidos en ella, antes de realizar otra corrida.. Tabla 3.2 Descripción de los flujos utilizados en las corridas para la segunda etapa.. Experimentación. Flojo de agua. Flujo de ácido. Qa. contaminado. (ml/min). Qa' (ml/min). 4. 6.7. 10. 5. 6.7. 12.5. 6. 6.7. 14.2. 7. 9.2. 10.8. 8. 9.2. 12.5. 9. 9.2. 14.2. En la primera etapa el ácido alimentado se tomo directamente de los porrones en los que fue transportado, para la segunda etapa el equipo fue alimentado con una mezcla que contenía el ácido recolectado en los primeros tres experimentos y el ácido original restante. 32.
(38) Capítulo 4. Resultados. CAPITULO 4. 4. RESULTADOS.. Este capítulo presenta los resultados obtenidos en la parte experimental del trabajo, así como una discusión de ello. Debido a la metodología que se explico en el Capítulo 3 esta sección se presenta en dos partes, la primera etapa antes del lavado de las membranas y la segunda después de ella.. 4.1 DESCRIPCIÓN DE RESULTADOS.. El coeficiente de global transferencias se calculó utilizando la ecuación 2.1 y la cantidad de ácido que se logra recuperar y el metal que es rechazado se determina mediante las ecuaciones 3.1 y 3.2, respectivamente, en cada experimento. También se utilizo el modelo de Alvarez para determinar el coeficiente de masa para los diferentes metales contenidos en electrolito. Los valores obtenidos para el coeficiente de transferencia de masa se compararon con la energía de hidratación de los iones metálicos para buscar una influencia de esta propiedad en el coeficiente.. 4.1.1 RESULTADOS Y DISCUSIÓN DÉLA PRIMERA ETAPA. En esta etapa se realizaron 3 experimentos, utilizando un flujo de Qa=7.5 ml/min y tres diferentes flujos de Qr'; 7.9, 12.2 y 19. Los experimentos utilizaron ácido con. 33.
(39) Capítulo 4. Resultados. diferentes concentraciones iniciales, las diferencia existentes entre los ácidos alimentados al proceso se resumen en la tabla 4.1. Las diferencias entre las concentraciones eran pequeñas y se pudo deber a que para cada corrida se utilizo un porrón diferente para alimentar el sistema.. Tabla 4.1 Concentración inicial del ácido contaminado.. Compuesto (mg/L) [Sb] [Cu] [Cr] [Fe] [Mn] [Ni] Pn]. 1 14.4 13.7. Experimento 2 3 14.1 15.0. 10.3. 5.3 228. 5.1 195. 9.3 3.7 156. 1.20 3.74 10.6. 1.18 3.53 9.93. 0.84 2.59 7.75. Una vez concluidas las pruebas y analizadas las muestras tomadas, se calculó la cantidad de metal rechazado y la cantidad de ácido recuperado para determinar la eficiencia del proceso. Por los valores obtenidos se puede observar que existe un descenso en la recuperación del ácido conforme aumenta el flujo de Qr' y que se presenta el caso contrario en los metales; el rechazo se hace mayor conforme aumenta el flujo del ácido; esto se representa en la gráfica 4.1. 34.
(40) Capítulo 4. Resultados. También se puede apreciar. que el valor del porcentaje de rechazo para los. diferentes metales en la misma corrida es de orden similar.. Resultados de eficiencia para etapa 1 100 _ --90 2 --80 2 -- 7 0 | --60 -g. T. --50 o -•40 g --30 * --20 a -•10 ¿ -- O. 7.92. 12.16. 19. -árido -Sb -Cu -Cr -Fe •Mi. Qffml/min) -Zn. Gráfica 4.1 Eficiencia obtenida en la primera etapa.. El coeficiente global de transferencia de masa K=[cm/min] para cada uno de los metales contenidos en el electrolito se resumen en la tabla 4.2, como se observa el valor del coeficiente global disminuye conforme aumenta el rechazo del metal. Además el valor de K obtenido en el experimento 3, es el mismo para la mayoría de los iones metálicos contenidos en el ácido sulfúrico.. 35.
(41) Capítulo 4. Resultados Tabla 4.2 Coeficiente global de transferencia de masa para los metales del electrolito en la primera etapa.. Elemento. Sb Cu Cr Fe Mn Ni Zn. E.xperimento 1 2 3 0.0020 0.0009 0.0002 0.0090 0.0016 0.0002 0.0049 0.0012 0.0002 0.0011 0.0005 0.0002 0.0028 0.0015 0.0003 0.0024 0.0008 0.0002 0.0121 0.0025 0.0007. Hacemos una linealización de la ecuación (3.3) para calcular el coeficiente de transferencia de masa K*. Recordemos que en esta etapa se utilizó un sólo flujo de agua desmineralizada, por lo que se dice que Qa es constante, así que el parámetro m es suprimido del modelo, generándose la ecuación (4.1), que toma en cuenta el efecto de los flujos en ambos lados de la membrana.. ln. (4.1). Esta ecuación permite mediante un método gráfico obtener la coeficiente de transferencia de masa (K*\ para cada uno del metal / presente en el electrolito. La gráfica 4.2 muestra dos ejemplos de la figura utilizada para esto. Los valores de cada uno de los componentes de la ecuación 4.1 se muestran en el Apéndice B.. 36.
(42) Capítulo 4. Resultados. Lirealización de K" para Cr -5 0.60. 0.80. -9. Ln(O/Qa). y = -3.6028x-5.0758 F? = 0.9978. (A) Linealización del coeficiente de transferencia de masa para Cr. Linealizadón de IC para Sb. y=-2523&-600CE. (B) Linealización del coeficiente de transferencia de masa para Sb Gráfica 4.2 Obtención del coeficiente de transferencia del metal.. En esta figura se obtuvo la ecuación de la recta Y=-3.6028X+-5.0758 para (A) y Y=-2.5289X-6.0002 para (5); con la cual podemos observar que la n a diferencia de lo reportado por Alvarez no es la unidad , sino mayor a 2.. 37.
(43) Capítulo 4. Resultados. Tabla 4.3 Constante de transferencia de masa para los metales del electrolito en la primera etapa.. Metal Sb Cu Cr Fe Mn Ni Zn. K*(cm/min) 0.0025 0.0042 0.0062 0.0022 0.0039 0.0022 0.0047. R2 0.9760 0.6210 0.9978 0.6510 0.9344 0.7601 0.7560. n 2.53 2.59 3.60 2.70 2.74 1.01 3.20. Los valores obtenidos para Ki* se resumen en la tabla 4.3. Haciendo una comparación de los valores reportados en la bibliografía para los iones metálicos y los obtenidos en este trabajo, se observa que existe un orden de magnitud de diferencia entre unos y otros. La literatura reporta el valor del coeficiente de difusión en agua1[29]J de los iones Cu 2+ = 0.000432 cm/min y. Zn. =0.000426 cm/min; mientras que los calculados en. esta etapa son Cu2+ = 0.0042 cm/min y. Zn2+ =0.0047 cm/min.. Y aunque se comprueba que esta K* no depende del flujo de agua desmineralizada (Qá) y del ácido de rechazo ((>'); debido a las diferencias existentes entre los valores calculados y los reportados para los iones, se podría considerar la teoría de que el coeficiente de transferencia de masa se esta viendo afectado por las propiedades electroquímicas del ion.. 38.
(44) Capítulo 4. Resultados. Basados en el marco teórico comparamos el coeficiente de transferencia de masa con la energía de hidratación, buscando un patrón de influencia. Pero como puede verse en la gráfica 4.3; no existe ninguna tendencia que indique la influencia de esta propiedad sobre el coeficiente de transferencia de masa K*.. E. hidratación (kJ/mol. Energía de hidratación Vs coeficiente de transferencia. Mn 435. -44S.C 100 -455. 0 001. 0 00°. 0 003. *'. 0 004. Cr. '. 0 005. 0 00%. 0 Q07. p*. ¿CC. Aje.. -485 AQX,. 4Zn. I* *r^t L/Ui. crvc. K*ícrrVrrin). • primera etapa. Gráfica 4.3 Comparación de la energía de hidratación y la constante de transferencia de masa. En la tabla 4.4 se describe la concentración de cada metal dentro de los flujos de ácido recuperado y de rechazo. El balance de masa para el proceso se cumple; como puede observarse en el Apéndice A, pero se aprecia que el flujo del ácido recuperado contiene concentraciones muy parecidas a las del ácido original (ácido contaminado). Lo cual nos está indicando que la mayoría del metal no está siendo rechazado por la membrana, fenómeno no esperado; por ello se decidió hacer la limpieza de la. 39.
(45) Capítulo 4. Resultados. membrana descrita en el Capítulo 3, esperando que estas concentraciones en el recuperado cambien.. Tabla 4.4 Concentración del metal en Qr y Qr'. Experimento. Compuesto. 1 Recuperado. mg/L [Sb] [Cu] [Cr] [Fe] [Mn] [N¡] Pn]. 3. 2 Rechazo. Rechazo. Rechazo. Qr. Qr. Qr. Qr. Qr1. 13.9 13.1. 0.5 2.0 0.2. 12.3 11.3 4.5. 5.8 8.5 2.2. 5.5 4.9 1.9. 20.8. 164.4. 71.1. 0.0 0.1 1.4. 1.0 3.0 8.9. 0.5 1.5 4.6. 8.5 7.9 3.2 107 0.7 2.2 4.5. 10.3. 1. Recuperado. Qr. 5.3 201 1.2 3.7. 1. Recuperado. 97.5 0.5 1.4 6.0. 4.1.2 RESULTADOS Y DISCUSIÓN DE LA SEGUNDA ETAPA.. Al igual que en la primera etapa el ácido contaminado utilizado en las diferentes pruebas realizadas contenía concentraciones iniciales distintas, las cuales se muestran en la tabla 4.5. Como se describió en el Capítulo 3 el ácido utilizado en esta etapa era una mezcla de los efluentes generados en la primera etapa y el ácido original.. Como ya se menciono la segunda etapa ocurrió después de que fueron lavadas las membranas. Los experimentos 4, 5 y 6 utilizan un flujo de Qa= 6.7ml/min y flujo de. 40.
(46) Capítulo 4. Resultados. Qr'= 9.3, 12.1 y 13.5 ml/min; mientras que para el 7, 8 y 9 utiliza un Qa= 9.2 ml/min y tres flujos de Qr'= 10.2 , 12.2 y 13.6 ml/min.. Tabla 4.5 Concentraciones iniciales para los experimentos. Compuesto. (mg/L) [Sb] [Cu] [Cr] [Fe] [Mn] [Ni] [Zn]. 4 5.8 7.3 2.9 135 0.7 2 4.9. 5 5.8 7.5 2.9 138 0.7 2 6.1. Experí mentos 6 7 5.3 6.5 2.6 123 0.6 1.9 5.5. 4.9 3.8 1.6 127 0.5 1.3 4.7. 8 5.5 5.5 1.8 126 0.4 1.4 4.4. 9 5.3 5.1 1.9 116 0.5 1.5 4.2. Los porcentajes de recuperación y rechazo para los dos flujos de Qa se muestran en las gráficas 4.4 y 4.5 En las gráficas se puede observar que los porcentajes obtenidos presentan el mismo comportamiento que en la primera etapa, es decir, el rechazo de metal aumenta conforme lo hace el flujo de Qr' y la recuperación de ácido disminuye al aumenta Qr' A diferencia de los resultados obtenidos en la primera etapa; donde el valor del rechazo de metal es similar para todos los iones dentro del mismo experimento. En la segunda etapa sólo los experimentos 5 y 9 tienen esa tendencia; esta observación puede corroborase en la gráfica 4.6.. 41.
(47) Capítulo 4. Resultados. Porcentajes obtenidos para Qa = 6.7 mi/min. O). c -o. 0. 100 90 80. 100 90 80 70 60 50 40 30 20. ro o 70 'X oj ^ 60. g-^ra 50 |. o o> o:. 40 30 20 10 O. -Acido -Sb. —ffl—Cu. co. .c o. -Cr. UL. -Fe. <D. 10 fO. 9.33. 12.08. 13.5. —*-- Mn. •Ni. QrXml/min). -Zn. Gráfica 4.4 Porcentajes de recuperación de ácido y rechazo de metal. Porcentajes obtenidos para Qa = 9.2 ml/min u T3. 'o -ro 0) T3 C. :2 o fn 5 0). o. 3 o <D. o:. 100 co 90 Tu 80 E 70 <D. 100 90 80 70 60 50 40 30 20 10 t. 60 50 40. o J— •— 10.17. 30 20 10 0. 1. 12.67. T3 O N ^ O (U. Oí. 13.58. Qr"(ml/min). Gráfica 4.5 Porcentajes obtenidos utilizando Qa=9.2 ml/min. 42.
(48) Capítulo 4. Resultados. Resultados globales. 5. 6. 7. 8. Experimento |Zn Gráfica 4.6 Resultados de eficiencia en la segunda etapa.. Siguiendo con la metodología planteada se calculó el coeficiente global de transferencia de masa para cada metal; donde K tiene unidades de cm/min los resultados obtenidos - tabla 4.6 - muestran la misma tendencia de la primera etapa disminuyendo en valor conforme el porcentaje de rechazo se hace mayor. Los experimentos que se realizaron con un flujo de Qa = 6.7 ml/min obtienen mayores porcentajes de rechazo y por lo tanto menores coeficientes globales de transferencia. Mientras que para los que utilizaron. Qa = 9.2 ml/min se obtienen. porcentajes de rechazos similares para los diferentes iones y sus coeficientes tienen también valores similares.. 43.
(49) Capítulo 4. Resultados. Tabla 4.6 Coeficiente global de transferencia para la segunda etapa.. Elemento. Sb Cu Cr Fe Mn Ni Zn. 4 0.0014 0.0012 0.0027 0.0035 0.0021 0.0033 0.0012. ExpeíImento 6 7 0.0006 0.0016 0.0005 0.0029 0.00002 0.0028 0.0003 0.0067 0.0015 0.0002 0.0043 5 0.0009 0.0009 0.0014 0.0017. 0.0017 0.0009. 0.0004 0.0002. 0.0019. 0.0015. 8. 9. 0.0010 0.0017 0.0016 0.0045 0.0028 0.0011 0.0009. 0.0007 0.0006 0.0006 0.0007 0.0007 0.0006 0.0004. Partiendo de la ecuación 4.1, se calculo el coeficiente de transferencia de masa, los resultados obtenidos se muestran en la tabla 4.7. Se encontraron diferencias de magnitud entre los valores de K* para los diferentes iones metálicos. La gráfica 4.7 muestra un ejemplo del método gráfico utilizado para la obtención del coeficiente de transferencia en esta segunda etapa, donde nuevamente la n tiene un valor promedio mayor de 2. Como en esta segunda etapa se contaba con otro flujo de Qa se realizó una regresión multivariable para ver si. existe una influencia. importante de m en el. coeficiente de transferencia de masa. Esta regresión se llevo acabo mediante el programa computacional SPSS y los resultados obtenidos se muestran en el Apéndice D.. 44.
(50) Capítulo 4. Resultados. Tabla 4.7 Coeficiente de transferencia de masa para los experimentos de la segunda etapa.. Metal K*(cm/min) 0.0019 Sb 0.0037 Cu Cr 0.0123 Fe 0.0136 Mn 0.0084 0.0034 Ni Zn 0.0026. R¿ 0.8353 0.9403 0.5819 0.7987 0.7898 0.4162 0.6429. n 1.53 2.76 6.51 4.14 4.11 2.25 3.05. K* para Cu sengunda etapa. 0|9. ¡ * Qa=7ml/rnin ¡¡ ! • Qa=9ml/rnin i!. ^=-2.7551x-5.5913. Ln(QrVQa). R2 = 0.9403. Figura 4.7 Obtención de K* en la segunda etapa.. Una vez realizado este análisis se comprobó que no existe influencia del parámetro m en el coeficiente de transferencia. Así que se procedió a comparar los valores de K* con la energía de hidratación para verificar si es ella la que influye en la diferencia de valores obtenidos.. 45.
(51) Capítulo 4. Resultados.. Nuevamente no se pudo establecer relación alguna entre la entalpia de hidratacion y el coeficiente de transferencia K*, como lo muestra la gráfica 4.8.. Energía de hidratacion Vs coeficiente de transferencia. o. p. 11§. J ^£. ¿RR. C. 00. 0.002. 0.004. 0.006. 0.008. 0.010. 0.01¿ Cr. 0.014 ,. 0.016. p¿-. AKf^. 5 3 2 •Q £. IÜ. A~7Ci. Af{F\ 4QR fWi. Zn. +. -N¡ , *. *Cu. K*(cm/min). * Segunda etapa. Figura 4.8 Comparación de la energía de hidratacion y K*.. Sin embargo, haciendo una comparación de las eficiencias reportadas por Alvarez y las de este trabajo podemos decir que los porcentajes de rechazo del metal. y. recuperación de ácido tienen la misma tendencia, sólo que estos últimos son menores. Es decir Alvarez logra recuperar el 100% del ácido y los resultados de la parte experimental reportan una recuperación del 82% para la primera etapa y 70% en la segunda.. 46.
(52) Capítulo 4. Resultados. Pero definitivamente no es conveniente disminuir los flujos de operación, ya que el rechazo de metal se hace más pequeño y el ácido recuperado está altamente contaminado. En cuanto a K* Alvarez sólo reporto para Fe =0.000299cm/min; este valor es muy pequeño comparado con cualquiera de los obtenidos en este trabajo, ya que los más cercanos esta a un orden de magnitud. Lo que indica que el modelo de utilizado para el coeficiente de transferencia de masa es muy sensible; pues una correlación baja incrementa el valor de K*.. Sin embargo; comparando los valores del coeficiente global de transferencia (K), en la etapa sucia y limpia, observamos que en la etapa sucia tenemos valores más pequeños de K que en la etapa limpia, fenómeno contrario a lo esperado, pues después de la limpieza el coeficiente global de transferencia debería ser menor. Lo que hace suponer que existe un factor físico en la membrana que genera esta tendencia.. 47.
(53) Capítulo 5. Conclusiones. CAPITULO 5. 5. CONCLUSIONES. La eficiencia obtenida en este trabajo fue mayor en la primera etapa en la cual se lograr recupera el 82% del ácido; mientras que en la segunda el máximo porcentaje de recuperación es 70%. Estos valores siguen la tendencia reportada por Alvarez, sólo que son menores, pues él reporta el 100% de recuperación. Sin embargo no es conveniente disminuir los flujos de operación, ya que el rechazo de metal se hace más pequeño, recuperándose un ácido altamente contaminado. Cuando el rechazo de metal es grande el valor del el coeficiente global de transferencia de masa es pequeño, sin embargo, después de analizar los resultados de la etapa 2; se observa que la eficiencia del proceso mejora obteniéndose valores mayores de rechazo de metal. Pero K en la etapa sucia es más pequeña que en la etapa limpia, contrario a lo esperado, pues si los rechazos son mayores en la etapa limpia su coeficiente global de transferencia de masa debería ser menor. Con lo anterior podemos concluir que el coeficiente de transferencia de masa se está afectando por un factor físico en la membrana. Se sugiere la existencia de un ensuciamiento y/o saturación de las cargas de la membrana o el termino de la vida útil de la membrana.. 48.
(54) Capítulo 5. Conclusiones. flojo d* fluido. CONCENTRADO. PERNEADO. Figura 5.1 Acumulación de materiales sobre, en y cerca de la membrana.. En cuanto al coeficiente de transferencia de masa K*; Alvarez sólo reporto para Fe = 0.000299cm/min, utilizando un parámetro n igual a la unidad. Este valor es muy pequeño comparado con cualquiera de los obtenidos en este trabajo, ya que los más cercanos esta a un orden de magnitud con una n mayor a 2. Lo cual indica que este modelo es muy sensible y que una correlación baja puede llevar a un coeficiente de transferencia de masa grande. Debido a estas diferencias y comprobándose que los flujos de operación no influyen en el coeficiente de transferencia de masa; se realizó una comparación de los valores de K* y la energía de hidratación, pero no se pudo establecer relación consistente entre esta propiedad electroquímica del ion y el coeficiente de transferencia de masa.. 49.
(55) Capítulo 5. Conclusiones. Sin embargo; utilizando únicamente los valores de la primera etapa podemos decir que se cumple las hipótesis planteadas en el Capítulo 1, pues el modelo propuesto por Alvarez sigue siendo efectivo en un rango de flujo mayor y todos los metales contenidos en el electrolito siguen el mismo comportamiento descrito para el Fierro. Lo cual puede ser validado con los valores obtenidos para el coeficiente global de transferencia de masa. Por los datos obtenidos en este trabajo, se cree que sea conveniente extender el estudio en futuras investigaciones, para analizar la influencia de la saturación y/o ensuciamiento presente en la membrana sobre la transferencia de masa dada en el sistema, así como el patrón de selección para el rechazo de los iones con propiedades electroquímicas muy parecidas. Las acciones que se recomienda llevar acabo para obtener más información es corroborar experimentalmente que la vida útil de la membrana ha terminado, haciendo pruebas con diferentes mecanismos de limpieza. y comparar el coeficiente de. transferencia de masa obtenidos después de cada una de ellas. También se pudiera comparar el coeficiente de transferencia de masa para los diferentes iones con el producto de solubilidad para ver cual su influencia en el rechazo selectivo que lleva acabo la membrana.. 50.
(56) Apéndice A.. APÉNDICE A BALANCE DE MASA.. Primera etapa Datos: 1 Original 9000. -. 1350 fcm3. J. 227 0.0144 0.0137 0.0053 0.2280 0.0012 0.0037 0.0106. rechazo Pérdida. Original 9000. 9000 1330 210 0.0139 0.0131 0.0053 0.2010 0.0012 0.0037 0.0103. 9500 1053 38.7 0.0005 0.0020 0.0002 0.0208 0.00005 0.0001 0.0014. Recup.. rechazo Pérdida. 23000. 15000. 10000 (cm3). 3. 2 rechazo Original Recup. Pérdida 9000. Recup.. 500. -. 1053 38.7 0.0280 0.0008 0.0067 0.5464 0.0018 0.0063 0.0004. 1300 194.2 0.0141 0.0150 0.0051 0.1950 0.0012 0.0035 0.0099. 9000 1290 193.7 0.0123 0.0113 0.0045 0.1644 0.0010 0.0030 0.0089. 14600 1066 58.4 0.0058 0.0085 0.0022 0.0711 0.0005 0.0015 0.0046. 400. -. 1066 58.4 0.0392 0.0033 0.0091 1.0184 0.0012 0.0093 0.0038. 1150 188 0.0103 0.0093 0.0037 0.1560 0.0008 0.0026 0.0078. 9000 1110 186 0.0085 0.0079 0.0032 0.1070 0.0007 0.0022 0.0045. 22800 1050 86 0.0055 0.0049 0.0019 0.0975 0.0005 0.0014 0.0060. Resultados: CORIRIDA 1. (mg) Bal. Global Bal. Acido. Bal. Sb Bal. Cu. Bal. Cr Bal. Fe Bal. Mn Bal. Ni Bal. Zn. Entrada. >. /. *. Salida. Entrada. Salida. Entrada. Í. Salida. 22500000. 22500000. 28500000. 35450000. 34140000. 2913000. 27600000 2619300. 2270000 144. 2277000 144. 4324000. 3652000. 211.5. 211.5. 236.9. 225. 236.9 213.67. 137.00. 137.00. 225. 53.4. 53.4. 75.9. 213.67. 75.9. 85.79. 2280 12. 2280 12. 2925 17.7. 85.79. 2925. 3588. 3588. 17.7. 19.39. 19.39. 37.40. 37.40. 52.95. 52.95. 59.57. 5957. 106. 106. 148.95. 148.95. 178.25. 178.25. 51. 200. 1050 86 0.1739 0.1554 0.0697 2.0100 0.0127 0.0429 0.0041.
(57) Apéndice A.. Segunda etapa Datos para Qa= 6.7 ml/min: A\. Comp Acido. Original. • . aguaAlim. 8000. 6. Recup.. rechazo Pérdida. Original. Recup.. Original. rechazo. 8000. Pérdida. Recup.. rechazo. 8000. Pérdida. (cm3) 17000. 15000. 4caKm.(cm3). 12000. recotec.(cm3). -. 8000. 11200. 800. -. 8000. 14500. 500. -. 8000. 16200. 800. > p=mg/cm3. 1100. 1090. 1047. 1047. 1090. 1088. 1057. 1057. 1090. 1085. 1041. 1041. lH2SO4]mg/c. 84. 83. 16. 16. 84. 83. 20. 20. 84. 81. 41. 41. [. m3 [Sbjmg/cm3. 0.0058. 0.0047. 0.0026. 0.0035. 0.0058. 0.0046. 0.0031. 0.0036. 0.0053. 0.0024. 0.0043. 0.0011. ICu]mg/cm3. 0.0073. 0.0053. 0.0038. 0.0026. 0.0075. 0.0062. 0.0040. 0.0055. 0.0065. 0.0027. 0.0055. 0.0006. [Cr]mg/cm3. 0.0029. 0.0025. 0.0013. 0.0001. 0.0029. 0.0025. 0.0015. 0.0022. 0.0026. 0.0002. 0.0017. 0.0198. |Fe]mg/cm3. 0.1350. 0.1230. 0.0563. 0.0068. 0.1380. 0.1200. 0.0739. 0.0769. 0.1230. 0.0541. 0.0948. 0.1531. (Mn]mg/cm3. 0.0007. 0.0006. 0.0003. 0.0002. 0.0007. 0.0006. 0.0004. 0.0005. 0.0006. 0.0003. 0.0004. 0.0019. [Ni]mg/cm3. 0.0020. 0.0018. 0.0009. 0.0001. 0.0020. 0.0017. 0.0012. 0.0007. 0.0019. 0.0008. 0.0015. 0.0016. 0.0028. 00007. 0.0048. 0.0034. 0.0014. 0.0055. 0.0019. 0.0039. 0.0191. [Zn]mg/cm3. 0.0049. 0.0034. 0.0061. Resultados:. 4. CORIRIDA 5 Salida Entrada. (mg). Entrada. Salida. Bal. Global Bal. Acido Bal. Sb Bal. Cu Bal. Cr Bal. Fe Bal. Mn Bal. Ni Bal. Zn. 21200000. 21284000. 24350000. 1008000. 856000. 69.12. 69.12. 87.36. (5. Entrada. Salida. 24030500. 26530000. 25544200. 1260000. 964000. 1428000. 1345000. 87.15. 8715. 89.93. 89.93. 87.36. 112.8. 112.8. 111.18. 34.56. 34.56. 43.35. 43.35. 111.18 44.54. 1620. 1620. 2070. 2070. 2091. 2091. 8.27. 8.27. 10.53. 10.53. 10.61. 10.61. 24.24. 24.24. 30.6. 30.6. 31.96. 31.96. 59.28. 59.28. 91.05. 91.05. 93.16. 93.16. 44.54. 52.
(58) Apéndice A.. Datos para Qa= 9.2 ml/min:. i Comp i Acido. 7 Original Recup. 11000. 8 Pérdida. laguaAlim 1 (cm3) Ic*lm(cffi3). 13000. 1 recotec.I (cm3) 1100 Ip=mg/cm3 43.1 ÍBSO4]ing/c f m3 {Sbjmg/cm3 0.0049 [Cu]mg/cm3 0.0038 í{Cr]mg/cm3 0.0016 JFt]mg/cm3 0.1270 3P»nlfngtoii3 0.0005 JNilmgfcmS 0.0013 Pnjmg/cm3 0.0047. Original. rechazo. Recup.. rechazo Pérdida. 11000. 15000. Original 11000. 9 Recup.. rechazo Pérdida. 17000. 11000. 12200. 800. -. 11000. 14600. 400. -. 11000. 16300. 700. 1090. 1047. 1047. 1095. 1088. 1057. 1057. 1090. 1085. 1041. 1041. 36.5. 13.0. 13. 38.8. 35.9. 8.4. 8.4. 27.8. 188. 12.5. 12.5. 0.0039. 0.0014. 0.0047. 0.0055. 0.0044. 0.0022. 0.0002. 0.0053. 0.0022. 0.0041. 0.00004. 0.0030. 0.0014. 0.0003. 0.0055. 0.0035. 0.0001. 0.0051. 0.0021. 0.0039. 0.0021. 0.0013. 0.0005 0.0182. 0.0004. 0.0018. 0.0013. 0.0030 0.0009. 0.0006. 0.0019. 0.0015. 0.0001. 0.0675. 0.1260. 0.1200. 0.0375. 0.0013. 0.1160. 0.0008 0.0484. 00880. 0.0074. 0.0002. 0.00001. 0.0004. 0.0004. 0.0001. 0.00001. 0.0005. 0.0002. 0.0004. 0.0001. 0.0010. 0.0004. 0.0008. 0.0014. 0.0011. 0.0005. 0.0000. 0.0015. 0.0006. 0.0011. 0.0038. 0.0012. 0.0058. 0.0044. 0.0035. 0.0016. 0.0012. 0.0042. 0.0017. 0.0030. 0.0006 0.0064. 0.1250 0.0004. Resultados:. 7. CORFRIDA tí Entrada Salida. Entrada. Salida. íi. (9). Entrada. Salida. Bal. Global Bal. Acido Bal. Sb Bal. Cu Bal. Cr Bal. Fe Bal. Mn Bal. Ni Bal. Zn. 25300000. 24763400. 27425000. 27400200. 29530000. 29632000. 560690. 560100 63.31. 582000. 520788. 471750. 82.95. 90.78. 418719 90.78 87.04. 49.4. 49.4. 82.95 82.7. 82.6. 87.04. 20.28. 20.28. 26.7. 26.5. 32.5. 32.5. 1651. 1651. 1890. 1868. 1972. 1972. 63.31. 6.47. 6.47. 6.21. 6.10. 8.11. 8.11. 16.64. 16.64. 20.55. 19.55. 24.99. 24.99. 61.23. 61.23. 66.45. 61.57. 72.08. 72.08. 53.
(59) Apéndice B.. APÉNDICE B COMPONETES DEL MODELO DE TRANSFERENCIA DE MASA.. Primera etapa Para Sb:. Para Cu:. 8.26E-06 3.86E-02. 7.68E-06 3.35E-02. 2.14E-04. 2.29E-04. 6.38E-02. 5.93E-02. Para Cr:. Para Fe:. -06. 3.08E-06. 1.04E-04. 3.64E-03. 1.46E-02. 5.47E-01. 4.91E-03. 1.19E-03. 2.10E-04. 1.90E-04. 4.00E-02. 3.35E-02. 2.38E-02. 8.03E-01. 1.05E-03. Para Mn:. Para Ni:. 1.00E-06. 7.07E-07. 4.09E-04. 6.55E-04. 2.76E-03. 2.80E-03. 1.53E-03. 8.85E-03. 7.73E-03. 2.16E-06. 2.56E-04. 3.42E-03 8.49E-04. 9.18E-03 2.35E-04. 5.45E-03. 2.24E-02. 1.67E-02. Para Zn:. 4.412E-06 3.48E-03 2.49E-03. 6.004E-03 7.3493E-04. 6.69E-02. 3.4050E-02. Nota: La K presente en las tablas en el coeficiente global de tranferencia calculado con. M = KAAC,. 54.
(60) Apéndice B.. Segunda etapa: Para Sb: Elemento J(mg/cm2min). C O R R I D A 4. 5. 6. 7. 8. 9. 4.0278E-06. 5.6700E-06 5.75E-03. 2.3337E-06 4.00E-03. 4.6055E-06. 4.201 9E-06. 2.4452E-06. 2.82E-03. 4.25E-03. 5.8308E-04. 1.6349E-03. 2.8487E-03. 3.6287E-03 6.7384E-04. 1.8009E-02. 3.5541E-02. 3.2426E-02. 1.8870E-02. DCIn(mg/cm3) 2.9280E-03 k(cm/min). 1.3756E-03. Ni(mg/min). 3.1082E-02. 2.1446E-03 4.10E-02. 4. 5. 6. 7. 8. 9. 2.1522E-06. 1 .9879E-07. 1.5193E-06. 1 .4956E-06. 8.9024E-07. 1.4942E-03. 8.6775E-03. 5.3451 E-04. 9.1181E-04. 1.3759E-03. 1.4404E-03 1.6608E-02. 2.2909E-05 1.5341E-03. 2.8425E-03. 1.6403E-03. 6.4701 E-04. 1.1725E-02. 1.1542E-02. 6.8700E-03. Para Cr: Elemento. C O R R I D A. J(mg/cm2min) 2.1522E-06 DCIn(mg/cm3) 7.9025E-04 k(cm/m¡n) 2.7234E-03 1.6608E-02 Ni(mg/min) Para Mn:. C O R R I D A. Elemento. 4. 5. 6. 7. 8. 9. 6.0676E-07 3.5301 E-04. 4.2525E-07. 4.9141E-07. 1.0180E-03. 4.9735E-07 1.1687E-04. 1.60E-04. 1.1870E-08 3.4062E-04. 1.7188E-03 4.03E-03. 4.1775E-04. 4.2556E-03. 6.8181E-03. 3.4848E-05. 1.91E-03. 3.84E-03. 3.44E-03. 1.82E-03. 4. 5. 6. 7. 8. 9. 2.9560E-06. 5.2465E-06 4.53E-03. 1.2360E-06 1.0449E-02. 4.5224E-06. 5.2584E-06. 1 .4244E-06. 2.9878E-03. 4.70E-03. 5.21 11 E-03. 2.3054E-03 3.21E-02. 1.1829E-04. 1.5136E-03 3.49E-02. 4.0135E-03 3.24E-02. 2.7334E-04. J(mg/cm2min) 5.0736E-07 DCIn(mg/cm3) 2.4628E-04 k(cm/min) 2.0601 E-03 Ni(mg/min) 3.9153E-03 Para Zn:. C O R R I D A. Elemento J(mg/cm2min). DCIn(mg/cm3) 2.3740E-03 k(cm/mín) 1.2452E-03 Ni(mg/min) 2.281 1E-02. 1.25E-02. Para Cu: Elemento. 1 .60E-02. C O R R I D A 4. 5. J(mg/cm2min) DCIn(mg/cm3). 4.5500E-06 3.8109E-03. 5.6530E-06 5.96E-03. k(cm/min). 1.1939E-03. Ni(mg/m¡n). 3.5112E-02. 6. 7. 8. 9. 2.3267E-06. 3.5135E-06. 4.2019E-06. 2.4452E-06. 1 .2078E-03. 2.5054E-03. 4.3454E-03. 8.89E-04. 4.8831 E-03 4.7647E-04. 2.9089E-03. 1.6772E-03. 5.6270E-04. 4.09E-02. 1.7955E-02. 2.7114E-02. 3.2426E-02. 1 .8870E-02. Para Fe: Elemento. C O R R I D A. 4. 5. 6. 7. 8. 9. 1.0631 E-04. 1.0372E-04. 4.6760E-05. 1.4837E-04. 1.4481 E-04. 5.7450E-05. DCIn(mg/cm3) 3.0787E-02. 6.2477E-02. 1.3979E-01 3.3451 E-04. 2.2264E-02. 3.19E-02. 6.6642E-03. 4.46E-03. 8.071 6E-02 7.1176E-04. 3.6085E-01. 1.1450E+00. 1.10E+00. 4.4334E-01. J(mg/cm2min) k(cm/mln). 3.4532E-03. Ni(mg/min). 8.2041E-01. 1.6601 E-03 8.0040E-01. 55.
(61) Apéndice B.. Para Ni: Elemento. C O R R I D A 4. 5. 6. 7. 8. 9. 1.5731E-06. 1.7632E-06. 5.6181E-07. 1.1989E-06. 1.6262E-06. 4.1545E-08. DCIn(mg/cm3) 4.7180E-04 k(cm/min) 3.3342E-03. 8.7604E-04. 1.9197E-03 2.9265E-04. 6.2290E-04. 1.14E-03. 2.0127E-03. 1 9246E-03. 4.9357E-03. 1.2551E-03 3.3101E-05. 1.13E-02. 5.32E-03. 9.25E-03. 1.01E-02. 5.51E-03. J(mg/cm2min). Ni(mg/min). 1.2139E-02. 56.
(62) Apéndice C.. APÉNDICE C LINEALIZACION DEL MODELO DE TRANSFERENCIA DE MASA.. Primera etapa. iomda. 112. i3 1. Transformación para Sb: Ni Qa AACIn ACIn (ml/min) (mg/min) (mg/cm3) (mg/cm) 53.46 7.5 0.1043 0.0069 103.63 7.5 0.0923 0.0134 297.79 7.5 0.0638 0.0386. Ni/AACIn ln(Ni/AACIn). QrVQa Ln(Qr/Qa). (ml/min). (cm/min). 0.0020 0.0009 0.0002. Qr1. -6.24 -7.02 -8.45. 7.92 12.17 19. 1.06 1.62 2.53. 0.05 0.48 0.93. Transformación para Cu: Ni ACIn AACIn (ml/min) (mg/min) (mg/cm3) (mg/cm) 45.12 7.5 0.0983 0.0058 25.32 7.5 0.0848 0.0033 258.27 7.5 0.0593 0.0335. Qr QrYQa Ln(Qr/Qa) Ni/AACIn ln(Ni/AACIn) (ml/min) (cm/min) 0.0022 -6.13 7.92 1.06 0.05 0.0033 -5.70 12.17 1.62 0.48 0.0002 -8.38 19 2.53 0.93. Transformación para Cr: Ni ACIn AACIn (ml/min) (mg/min) (mg/cm i (mg/cm) 0.0400 0.0011 8.13 7.5 28.13 7.5 0.0335 0.0036 113.01 7.5 0.0238 0.0146. QrVQa Ln(Qr/Qa) Qr Ni/AACIn ln(Ni/AACIn) (ml/min) (cm/min) 0.0049 -5.32 7.92 1.06 0.05 0.0012 -6.73 12.17 1.62 0.48 0.0002 -8.47 2.53 0.93 19. Transformación para Fe: Ni Corrida Qa ACIn AACIn (ml/min) (mg/min) (mg/cm3) (mg/cm) 1 7.5 1.5675 0.1805 1392.75 2 7.5 1.3830 0.1126 868.59 3 7.5 0.8025 0.9618 7422.03. Qr1 QrVQa Ln(Qr/Qa) Ni/AACIn ln(Ni/AACIn) (mVmin) (cm/min) -6.79 0.0011 7.92 1.06 0.05 0.0016 -6.44 12.17 1.62 0.48 0.0001 -9.13 19 2.53 0.93. Corrida is«. 1- 1 1 2 f 3. Ponida. 1 2 3. Corrida. Qa. Qa. Transformación para Mn: Ni Qa ACIn (ml/min) (mg/min) (mg/cm3. 1. 1. AACIn (mg/cm). Ni/AACIn (cm/min). ln(Ni/AACIn). 3.16 5.05 21.27. 0.0028 0.0015 0.0003. -5.88 -6.48 -8.27. Qr1. QrVQa. Ln(Qr/Qa). 1.06 1.62 2.53. 0.05 0.48 0.93. (ml/min). ). 1 2 3. 7.5 7.5 7.5. 0.0089 0.0004 0.0077 0.0007 0.0055 0.0028. 7.92 12.17 19. 57.
(63) Apéndice C.. Transformación para Ni: Qa Ni ACIn 0.0274 0.0015 7.5 7.5 0.0224 0.0034 7.5 0.0167 0.0092. AACIn 11.44 26.40 70.81. Ni/AACIn 0.0024 0.0008 0.0002. ln(Ni/AACIn) -6.04 -7.07 -8.36. Qr1 7.92 12.17. Transformación para Zn: Qa Ni Corrida ACIn AACIn 1 0.0773 0.0008 6.37 7.5 2 7.5 0.0669 0.0035 26.87 3 7.5 0.0340 0.0289 223.08. Ni/AACIn 0.0121 0.0025 0.0002. ln(Ni/AACIn) -4.41 -6.00 -8.42. Qf 7.92 12.17. Corrida. 1 2 3. Metal Sb Cu Cr Fe Mn Ni Zn. ln(K*) -6.0002 -5.4672 -5.0758 -6.1345 -5.5347 -6.1268 -5.3657. K*(cm/min) 0.0025 0.0042 0.0062 0.0022 0.0039 0.0022 0.0047. R*. n. 0.9760 0.6210 0.9978 0.6510 0.9344 0.7601 0.7560. 2.53 2.59 3.60 2.70 2.74 1.01 3.20. 19. 19. QrVQa 1.06 1.62 2.53. Ln(Qr/Qa) 0.05 0.48 0.93. QrYQa 1.06 1.62 2.53. Ln(Qr/Qa) 0.05 0.48 0.93. 58.
(64) Apéndice C.. Segunda etapa:. para Sb: AACIn Ni/AACIn 22.60 0.0014 20.40 0.0021 30.89 0.0006 21.74 0.0016 11.38 0.0028 28.00 0.0007. ln(Ni/AACIn) -6.5889 -6.1448 -7.4472 -6.4161 -5.8609 -7.3025. Qr1 9.33 12.08 13.50 10.17 12.67 13.58. In(Qr-) 2.23 2.49 2.60 2.32 2.54 2.61. Ln(Qa) QrYQa 1.90 1.40 1.90 1.81 2.02 1.90 1.11 2.22 2.22 1.38 2.22 1.48 Nota: excluido. Ln(Qr/Qa) 0.34 0.59 0.71 0.10 0.32 0.39. Transformación para Cu: Ni ACIn AACIn Ni/AACIn 0.0351 0.0038 29.41 0.0012 0.0409 0.0060 28.71 0.0015 0.0180 0.0049 37.68 0.0005 0.0271 0.0012 9.32 0.0029 0.0324 0.0025 19.33 0.0017 0.0189 0.0043 33.53 0.0006. ln(Ni/AACIn) -6.7305 -6.4894 -7.6491 -5.8400 -6.3907 -7.4828. Qr1 9.33 12.08 13.50 10.17 12.67 13.58. In(Qr-) 2.23 2.49 2.60 2.32 2.54 2.61. Ln(Qa) 1.90 1.90 1.90 2.22 2.22 2.22. QrVQa 1.40 1.81 2.02 1.11 1.38 1.48. Ln(Qr/Qa) 0.34 0.59 0.71 0.10 0.32 0.39. Transformación Ni ACIn 0.0166 0.0008 0.0166 0.0015 0.0015 0.0087 0.0117 0.0005 0.0115 0.0009 0.0069 0.0014. para Cr: AACIn Ni/AACIn 6.10 0.0027 11.53 0.0014 66.96 0.0000 4,12 0.0028 7.04 0.0016 10.62 0.0006. ln(Ni/AACIn) -5.9059 -6.5428 -10.6840 -5.8631 -6.4129 -7.3432. Qr1 9.33 12.08 13.50 10.17 12.67 13.58. In(Qr-) 2.23 2.49 2.60 2.32 2.54 2.61. Ln(Qa) 1.90 1.90 1.90 2.22 2.22 2.22. QrVQa 1.40 1.81 2.02 1.11 1.38 1.48. Ln(Qr/Qa) 0.34 0.59 0.71 0.10 0.32 0.39. Transformación para Fe: Corrida Qa Ni ACIn AACIn Ni/AACIn 4 6.67 0.8204 0.0300 231.72 0.0035 5 6.67 0.8004 0.0457 352.73 0.0023 6 6.67 0.3608 0.1204 929.06 0.0004 7 9.17 1.1450 0.0223 171.81 0.0067 8 9.17 1 .0992 0.0319 118.09 0.0095 9 9.17 0.4433 0.0807 622.89 0.0007. ln(Ni/AACIn) -5.6435 -6.0884 -7.8535 -5.0110 -4.6603 -7.2478. Qr-. In(Qr-) 2.23 2.49 2.60 2.32 2.54 2.61. Ln(Qa) 1.90 1.90 1.90 2.22 2.22 2.22. QrVQa 1.40 1.81 2.02 1.11 1.38 1.48. Ln(Qr/Qa) 0.34 0.59 0.71 0.10 0.32 0.39. Corrida 4 5 6 7 8 9. Qa 6.67 6.67 6.67 9.17 9.17 9.17. Corrida Qa 4 6.67 5 6.67 6 6.67 7 9.17 9.17 8 9.17 9. Corrida 4 5 6 7 8 9. Qa 6.67 6.67 6.67 9.17 9.17 9.17. Transformación Ni ACIn 0.0311 0.0029 0.0410 0.0058 0.0180 0.0040 0.0355 0.0028 0.0324 0.0043 0.0189 0.0036. 9.33 12.08 13.50 10.17 12.67 13.58. 59.
Figure


Documento similar
"No porque las dos, que vinieron de Valencia, no merecieran ese favor, pues eran entrambas de tan grande espíritu […] La razón porque no vió Coronas para ellas, sería
Después de una descripción muy rápida de la optimización así como los problemas en los sistemas de fabricación, se presenta la integración de dos herramientas existentes
Tome el MacRm media libra de Manecca de puerca ,media Je Manmca de Bac media de A- yre Rolado ,media de Azeyre Violado, y re poMc'tn holla vi- driadaafuegommfo,paza que
The part I assessment is coordinated involving all MSCs and led by the RMS who prepares a draft assessment report, sends the request for information (RFI) with considerations,
La moral especial (o institucional, la M de G ARZÓN ) parece ofrecer de- masiados pretextos; terminaría por justificar cualquier tipo de acción requerida por ra- zones
Para recibir todos los números de referencia en un solo correo electrónico, es necesario que las solicitudes estén cumplimentadas y sean todos los datos válidos, incluido el
Ciaurriz quien, durante su primer arlo de estancia en Loyola 40 , catalogó sus fondos siguiendo la división previa a la que nos hemos referido; y si esta labor fue de
La Ley 20/2021 señala con carácter imperativo los procesos de selección. Para los procesos de estabilización del art. 2 opta directamente por el concurso-oposición y por determinar