TítuloDeterminación simultánea de metales con el ácido metiletilendiaminotetracético (AMEDT) por espectrofotometría UV VIS y espectrofotometría derivada
Texto completo
(2) UNIVERSIDADE DA CORUÑA. DEPARTAMENTO DE QUÍMICA ANALÍTICA. C^eterminación sirnultánea de rnetales con el ácido nnetiletilendinrnirtotetracético (AMEQT^ por espectrof otorinetría V V- V^I,S espectrof otornetría derivada.. ,. Memoria presentadn por: M° Mercedes del Coro Fernández Feal Para optar al grado de Doctora en Química Septiembre, 1.999. ^. y.
(3) ^.
(4) N. UNIVERSIDADE DA CORUNA DEPARTAMENTO DE QUÍMICA ANAIÍTICA Campus da Zapateira, s/n. 15071 A Coruña España - Spain Teléfono 981 16 70 00 Fax 981 16 70 65. Dña. SOLEDAD MUNIATEGUI LORENZO, Profesora Titular y Directora del Departamento de Quimica Analítica de la Universidade da Coruña,. AUTORIZA a Dña. M$ DE LAS MERCEDES DEL CORO FERNÁNDEZ FEAL a presentar el trabajo titulado "Determinación simultánea de metales con el ácido metiletilendiaminotetracético (A11^EDTj por espectrofotometri'a UY-VIS y espectrofotometr^'a derivada" para optar a1 grado de Doctora en Química.. A Coruña, 7 de septiembre de 19^9.
(5) i. ^.
(6) • N. UNIVERSIDADE DA CORUNA DEPARTAMENTO DE QUIMICA ANALITICA Escuela Universitaria Politécnica Ctra. Aneiros, s/n. Serantes 15405 Ferrol. España-Spain Teléfono - 34 - 81- 33 74 00 (3055) Fax-34-81-33 74 01. JOSÉ MARÍA FERNÁNDEZ SOLÍS Y JESÚS MANUEL CASTRO ROMERO, Profesor Titular de Universidad y Catedrático de Escuela Universitaria, respectivamente, pertenecientes al Departamento de Química Analítica de la Universidade da Coruña. . CERTIFICAN. Que la presente memoria titulada "Determinación simultánea de metales con el ácido metiletilendiaminotetraacético (AMEDT) por espectrofotometría UV-VIS y espectrofotometría derivada", ha sido realizada bajo su dirección en los Laboratorios de Química Analítica de la Escuela Universitaria Politécnica de la Universidade da Coruña.. Y para que así conste, a los efectos oportunos, firman la presente en Ferrol, Septiembre de mil novecientos noventa y nueve.. Fdo. José M. Fernández Solís. Fdo. J. Manuel Castro Romero.
(7) ^. t.
(8) AGRADECIMIENTOS. Quiero expresar mi agradecimiento a todos aquellos que de algún modo colaboraron o facilitaron el presente trabajo, pero quiero reflejar mi especial agradecimiento a:. ❖ Los Doctores Don J. Manuel Castro Romero y Don José Ma Fernández Solís, Directores de este trabaj o, por su gran apoyo y tremenda paciencia. Sin su ayuda no lo hubiera conseguido.. ❖ A la Escuela Universitaria Politécnica de Ferrol, en cuyo laboratorio del Departamento de Química Analítica se ha realizado el presente trabajo.. ❖ A la ESEPA, Escuela de Energía y Propulsión de la Armada, por su conflanza.. ❖ A todos mis compañeros y amigos, que con su continuo interés han hecho que yo no perdiera el mío.. ❖ A mi hermana, que siempre está dispuesta a prestar su apoyo de forma desinteresada y que al pertenecer a la misma profesión hace que este sea, si cabe, mucho más efectivo que lo esperado realmente.. ❖ A algunos de mis compañeros de Licenciatura, cuyos continuos éxitos han fomentado en mi que no muera el afán de superación..
(9) s. ♦. r. t^.
(10) A mis padres, pero sobre todo a mis hi jos, ellos han sido el motor y e I f reno de este traba jo ..
(11) t.
(12)
(13) r. e. r.
(14) Índice. 1.. INTRODUCCIÓN l.l. El AEDT ro iedades. Ol y compuestos enerales.. análogos: Historia. y. 1.2. El AMEDT como agente quelatante cromogénico.. 04. 08. • Aplicaciones a la Espectrofotometría Visible. • Aplicaciones a la Espectrofotometría Ultravioleta. • Aplicaciones a la Espectrofotometría de derivadas.. 13 16 18. 1.3. Espectrofotometría de Absorción.. 20. 1.4. Es ectrofotometría de derivadas.. 21. 1.4.1. Introducción.. 21. 1.4.2. Fundamento.. 25. 1.4.3. Tratamiento derivados. 1.4.4. Ventajas derivadas.. cuantitativo. de. la. de. los. espectros. Espectrofotometría. 1.4.5. Limitaciones y desventajas Es ectrofotometría derivada.. 31. de. 32. la. 34. de. 1.4.6. Instrumentos.. 35. 1.4.7. Método del punto de anulación Crossing Point". o"Zero-. 1.4. 8. Errores en el método del unto de anulación. 1-1. 36. 38.
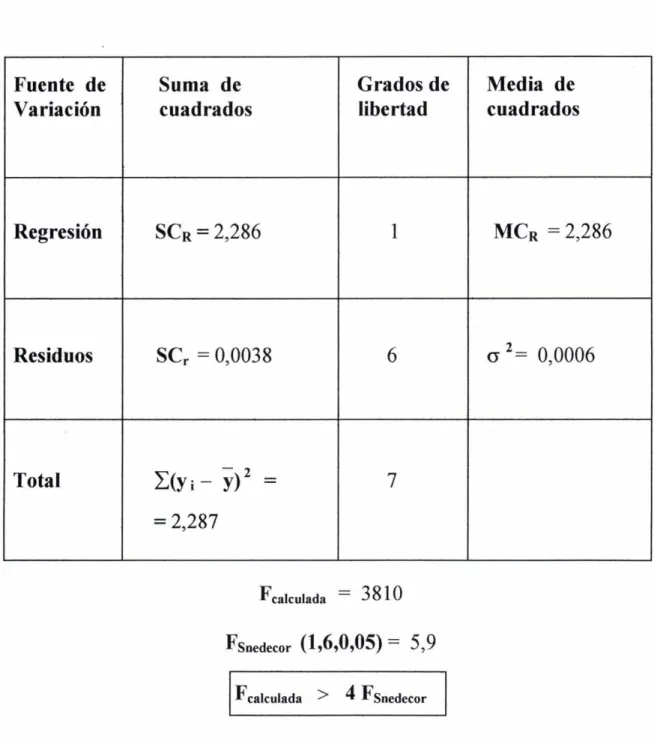
(15) Índice. 2.. PARTE EXPERIMENTAL.. 41. •. 43. Espectros de Absorción Individuales. Primera derivada del Espectro. Curvas de calibrado. ✓ Código de colores. 44. ■ Curva de calibrado del Cobre (II). ■ Curva de calibrado del Plomo (II).. 45 53. ■ ■. Curva de calibrado del Níquel (II). Curva de calibrado del Cromo (III).. 61 69. ■ Curva de calibrado del Cobalto (II .. 79. • Determinación simultánea de metales en mezclas de dos componentes mediante Espectrofotometría de Absorción y/o Espectrofotometría de derivadas. ■ Determinación simuttánea Cobre (II) y Plomo (II) con AMEDT.. 87. 89. ✓ Introducción.. 91. ✓ Aparatos. ✓ Reactivos.. 93 94. ✓ Espectro de Absorción y su primera derivada. 95. para el Cu(II)-AMEDT, para el Pb(II}AMEDT y para la mezcla de ambos. ✓ Influencia del pH. ✓ Influencia de la cantidad de reactivo. ✓ Influencia de la temperatura, tiempo de calentamiento y tiempo.. 99 101 103. ✓ Curva de calibrado para el Cu(II) en la mezcla.. 109. Análisis de la varianza de la regresión. ✓ Curva de calibrado para el Pb(II) en la mezcla. Análisis de la varianza de la regresión.. ll1. ✓ Reproducibilidad. Estudio estadístico.. 114. ✓ Interferencias. ✓ Método ro uesto. A licación.. 119 123. I-2.
(16) Índiee ■. Determinación simultánea de Plomo (II} y Ni uei II con AMEDT. ✓ Introducción. ✓ Aparatos. ✓ Reactivos. ✓ Espectro de Absorción su primera derivada para el Plomo(II)-AMEDT, para el Ni(II)-. 127 129 133 134 135. AMEDT y para la mezcla de ambos. ✓ Influencia del pH. ✓ Influencia de la cantidad de reactivo.. 13 9 142. ✓ Influencia de la temperatura, tiempo de. 145. calentamiento y tiempo.. ^ '. ✓ Curva de calibrado para el Plomo(II) en la mezcla. Análisis de la varianza de la regresión.. 152. ✓ Curva de calibrado para el Níquel(II) en la mezcla. Análisis de la varianza de la regresión. ✓ Reproducibilidad. Estudio estadístico. ✓ Interferencias. ✓ Método pro uesto. Aplicación. Determinaci^n ' simuItánea de ^obre (II) y Ni uei I con AMEDT. ✓ Introducción. ✓ Aparatos. ✓ Reactivos.. 155. 175 177 178. ✓ Espectro de Absorción y su primera derivada. 179. ✓ ✓ ✓ ✓ ✓ ✓ ✓ ✓. para el Cu(II)-AMEDT, para el Ni(II)AMEDT y para la mezcla de ambos. Influencia del pH. Influencia de la cantidad de reactivo. Influencia de la temperatura, tiempo de calentamiento y tiempo. Curva de calibrado para el Cu(II} en la mezcla. Análisis de la varianza de la regresión. Curva de calibrado para el Ni(II} en la mezcla. Análisis de la varianza de la regresión. Reproducibilidad. Estudio estadístico. Interferencias. Método propuesto. Aplicación. ^. 159 165 169 173. 183 185 189 195 198 202 208 212.
(17) Índiee ■. Determinación. simultánea. de. Cobre(II}. y. 215 ^^. Cramo III can AMEDT. ✓ ✓ ✓ ✓. ^^ Introducclon. Aparatos. Reactivos. Espectro de Absorción su primera derivada para el Cu(II)-AMEDT, para el Cr(III)AMEDT y para la mezcla de ambos. ✓ Influencia del pH.. 225. ✓ Influencia de la cantidad de reactivo.. 228. ✓ Influencia de la temperatura, tiempo de calentamiento y tiempo. ✓ Curva de calibrado para el Cu{II) en la mezcla. Análisis de la varianza de la regresión. ✓ Curva de calibrado para el Cr(III) en la mezcla.. 231. 217 219 220 221. 238 241. Análisis de la varianza de la regresión. ✓ Reproducibilidad. Estudio estadístico. ✓ Interferencias.. 247 256. ✓ Método ro uesto. A licación.. 260. ■ ^ ^ Determinación simultánea Cromo III con AMEDT. ✓ Introducción. ✓ Aparatos. ✓ Reactivos.. de ^^^^Plomo{II}. y. ✓ Espectro de Absorción y su primera derivada ✓ ✓ ✓ ✓ ✓. para el Cu(II)-AMEDT, para el Cr(III)AIVlEDT y para la mezcla de ambos. Influencia del pH. Influencia de la cantidad de reactivo. Influencia de la temperatura, tiempo de calentamiento y tiempo. Curva de calibrado para el Pb(II} en la mezcla. Análisis de la varianza de la regresión. Curva de calibrado para el Cr(III) en la mezcla.. 263 265 267 268. 269. 273 275 277 281 284. Análisis de la varianza de la regresión. ✓ Reproducibilidad. Estudio estadístico.. 290. ✓ Interferencias.. 299. ✓ Método propuesto. Aplicación.. 303.
(18) Índice. • Determinación simultánea de metales en mezclas de tres com onentes or Es ectrofotometria derivada. ■ Determinación simul^ánea de +^ol^re^II), ^1i u+^l IZ ,^^^n ^IEI^^T. P^omo : II ✓ Introducción ✓ Aparatos. ✓ Reactivos. ✓ Espectro de Absorción y su primera derivada para el Cu(II)-AMEDT, para el Pb(II)AlVlEDT, para el Ni(II)-AlVIEDT y para su mezcla. ✓ Influencia del pH.. 309 311 314 315 316. 321. ✓ Influencia de la cantidad de reactivo.. 325. ✓ Influencia de la temperatura, del tiempo de calentamiento y del tiempo. ✓ Curva de calibrado para el Cu(II) en la mezcla.. 327. Análisis de la varianza de la regresión. ✓ Curva de calibrado para el.Pb (II) en la mezcla. ✓ ✓ ✓ ✓. Análisis de la varianza de la regresión. Curva de calibrado para el Ni (II) en la mezcla. Análisis de la varianza de la regresión. Reproducibilidad. Estudio estadístico. Interferencias. Método propuesto. Aplicación.. ■ Determ^nación sin^ultánea de Piomo(II}, Cal^re Ii Cobalto (II) con A^N^EDT. ✓ Introducción. ✓ Aparatos. ✓ Reactivos. ✓ Espectro de Absorción y su primera y segunda derivada para el Pb(II)-AIVIEDT, el Cu(II)AMEDT, para e1 Co(II)-AMEDT y para su mezcla. ✓ Influencia del pH.. ✓ Influencia de la cantidad de reactivo. '. 307. ` ✓ Influencia de la temperatura, del tiempo de ^. calentamiento. del tiem o.. 332. 336 340 345 352 356. 359 361 364 365 366. 371. 374 3 76 '.
(19) .. Indice.. ✓ Curva de calibrado para el Pb(II) en la mezcla. Análisis de la varianza de la regresión. ✓ Curva de calibrado para el Cu(II) en la mezcla. Análisis de la varianza de la regresión.. 381. ✓ Curva de calibrado para el Co(II) en la mezcla. Análisis de la varianza de la regresión. ✓ Reproducibilidad. Estudio estadístico.. 395 407. ✓ Interferencias. ✓ Método propuesto. Aplicación.. 417 421. 388. 3. CONCLUSIONES.. 425. 4. ENSAYOS , DE HIPOTESIS Y TESTS ESTADISTICOS. • Ensayos de hipótesis.. 443. 5. 445. ■ Ensayo de compatibilidad de un valor observado con. 446. un valor estimado como verdadero. ■ Ensayo de hipótesis para el rechazo de medidas. ■ Regresión lineal. ■ Ensayos estadísticos.. 448 449 454. BIBLIOGRAFÍA.. 457.
(20) Índiee. ÍNDICE DE FIGURAS Figura 1 Figura 2. Figura 3. Forma de las derivadas 1 a y 2a de los Espectros de absorción .............. .................................... ............... Espectro de orden cero y la derivada de la mezcla 36 de dos com onentes-AMEDT .................................. Espectro de absorción y primera derivada del sistema Cu(II)-AMEDT . . ....... ........ ..... ............ . ....... 46,96,180, 222,318. Figura 4. Espectro de absorción y primera derivada del sistema Pb(II)-AMEDT .. ... .. .. ...... ....................... ..... Figura 5. 54,97,136, 270,317. Espectro de absorción y primera derivada del sistema Ni(II}-AMEDT ... .. .... .. .. .. .... . ..... .. ........ ........ 62,137,18 l, 319. Figura 6. Espectro de absorción y primera derivada del sistema Cr(II)-AMEDT . . . .. .. .. .. . . . . .. . . . . . . . . . . . . .. .. . . . . . . . . . .. Figura 7 Figura 8. Figura 9. 70,223,271. Espectro de absorción y primera derivada del sistema Co II -AMEDT .......................................... Espectro de absorción y primera derivada de la mezcla Pb(II)-AMEDT/Cu(II)-AMEDT ................ 98. Espectro de absorción y primera derivada de la. mezcla Pb II -AMEDT/Ni II -AMEDT ................. 138 Figura 10 Espectro de absorción y primera derivada de la 182 mezcla Cu(II)-AMEDT/Ni(II)-AlVlEDT...... Figura 11 Espectro de absorción y primera derivada de la. mezcla Cu II -AMEDT/Cr III -AMEDT ............... 224. Figura 12 Espectro de absorción y primera derivada de la. mezcla Pb(II)-AlV^DT/Cr(III)-AMEDT......^.......... 272 Figura 13 Espectro de absorción y primera derivada de la Pb(II)-AlV1EDT/Cu(II)-AMEDT/Ni(II)mezcla 320 AlV^DT .................................................................. Figura 14 Espectro de absorción, primera y segunda. derivada del Pb II -AMEDT..... ............................. . Figura 15 Espectro. de. absorción,. primera. y segunda. Figura 16 Espectro. de. absorción,. primera. y segunda. 367. derivada del Cu II -AMEDT .................................. 368 derivada del Co(II)-AMEDT .................................. 369. Figura 14 Espectro de absorción, primera y segunda derivada de la mezcla Pb(II)-A.N^DT, Cu(II)370 AMEDT Co II -AMEDT ....................................
(21) r. •. •. ^. •.
(22) Índice. ÍNDICE DE GRÁFICAS. COMPLEJOS DE UN SOLO METAL - AMEDT Gráflca 1 Gráflca 2 Gráfica 3-4 Gráfica 5-6-7 Gráfica 8-9. Recta de calibrado para el Cu(II)-AMEDT.......... Recta de calibrado ara el Pb(II)-AMEDT.......... Recta de calibrado ara el Ni(II)-AMEDT........... Recta de calibrado ara el Cr(III)-AMEDT......... Recta de calibrado ara el Co(II}-AMEDT........... so sg 6s ^3-74. 83. MEZCLA DE COMPLEJOS Pb(II) AMEDT y Cu (II) AMEDT Gráfica 10. Influencia del H ................................................... loo. Gráflca 11. Influencia de la cantidad de reactivo ..................... Gráfica 12 Gráfica 13. s Influencia del tiem o ............................................ Influencia de la tem eratura.... ............................. , to^. Gráfica 14 Gráflca 15. Recta de calibrado ara el Cu II en la mezcla..... l09 Recta de calibrado ara el Pb II en la mezcla..... 112. l02. MEZCLA DE COMPLEJOS Pb(II) AMEDT y Ni(II) AMEDT Gráfica 16-17. Influencia del pH .................................................... 140-141. Gráflca 18-19. Influencia de la cantidad de reactivo ..................... 143-144. Gráfica 20-21 Gráflca 22-23 Gráflca 24 Gráfica 25-26. Influencia del tiempo ............................................ 147-148 Influencia de la tem eratura . . . . .. .. .. .: . .. . :.. . .. .. . . .. .. .. .. 1 so-1 s i Recta de calibrado para el Pb(II) en la mezcla..... ls3 Rectas de calibrado para el Ni(II) en la mezcla.... 1 s6. MEZCLA DE COMPLEJOS Cu (II) AMED T y Ni (II) AMED T Gráfica 27-28 Gráfica 29-30 Gráflca 31-32 Gráfica 33-34 Gráfica 35. Influencia del H .................................................. 184-18s Influencia de la cantidad de reactivo .................... is^-18s Influencia del tiem o ............................................ 190 -191 Influencia de la tem eratura .................................. 193-194 Recta de calibrado ara el Cu II en la mezcla..... 196. Gráflca 36-37. Rectas de calibrado ara el Ni II en la mezcla..... 199.
(23) Índice. MEZCLA DE COMPLEJOS Cu (II) AMED T y Cr(III) AMED T. Gráfica 38-39 Gráflca 40-41. Influencia del H ................................................... 226-227 Influencia de la cantidad de reactivo .................... 229-230. Gráflca 42-43 Gráfica 44-45. Influencia del tiem o ............................................ Influencia de la temperatura ................................... Gráfica 46 Gráfica 47-4849. Recta de calibrado ara el Cu II) en la mezcla..... Rectas de calibrado para el Cr(III) en la mezcla.... 233-234 23s-236 237 239 242-243. MEZCLA DE COMPLEJOS Pb(II) AMEDT y Cr(III) AMEDT. Gráfica 50 Gráfica 51. Influencia del H ................................................... 274 Influencia de la cantidad de reactivo .................... 276. Gráfica 52 Gráflca 53 Gráflca 54 Gráfica 55-5657. Influencia del tiem o ............................................ Influencia de la tem eratura. ............................ ..... Recta de calibrado ara el Pb II en la mezcla..... Rectas de calibrado para el Cr(III) en la mezcla.... 27g 2go 2g2 2ss-286. MEZCLA DE COMPLEJOS Cu (II) AMED T, Pb(II)AMED T y Ni(II) AMEDT Gráfica 58-59 Gráflca 60-61 Gráfica 62 Gráflca 63 Gráfica 64 Gráflca 65. Influencia del H .................................................. 323-324 Influencia de la cantidad de reactivo .................... 326 Influencia del tiem o ............................................ 329 Influencia de la tem eratura .................................. 331 Recta de calibrado ara el Pb II en la mezcla..... 334 Recta de calibrado ara el Cu II en la mezcla..... 338. Gráflca 66. Recta de calibrado ara el Ni II en la mezcla...... 342. MEZCLA DE COMPLEJOS Cu (II) AMED T, Pb(II) AMED T y Co(II) AMEDT Gráflca 67 Gráfica 68 Gráfica 69 Gráfica 70. Influencia del H .................................................. 373 Influencia de la cantidad de reactivo .................... 37s Influencia del tiem o. ................................... ........ 37g . 3go Influencia de la tem eratura...
(24) Índice. Gráfica 71-7273-74-75-76-77. Rectas de calibrado para el Pb(II) en la mezcla.... Grá^ca 78-7980-81-82-83-84. Rectas de calibrado para el Cu(II) en la mezcla.... Grá^ca 85-8687-88-89-90-91. Rectas de calibrado para el Co(II) en la mezcla.... 383-384 38s 390-391. 392 397-398 399.
(25) y. s. a.
(26) Índice. ÍNDICE DE TABLAS. Comparación de la fuerza ácida de los sistemas. Tabla I. del AEDT ANIEDT ......................................... Características de los quelatos de AMEDT en la zona visible ........................................................... Características de los quelatos de AMEDT en la zona ultravioleta .................................................... Características métodos de los de es ectrofotometría derivada con AMEDT........... Relación entre el valor de "N" al obtener la derivada del es ectro el valor de 0^ . .................. Tabla II Tabla III Tabla IV Tabla V. g 15. 19 27. COMPLEJOS DE UN SOLO METAL - AMEDT Tabla VI. Calibrado para el Cu(II)-AMEDT ........................ 50. Tabla VII. ANOVA (272 nm , Cu(II)-AMEDT ..................... 51. Tabla VIII Tabla IX Tabla X Tabla XI Tabla XII Tabla XIII Tabla XIV Tabla XV Tabla XVI Tabla XVII Tabla XVIII Tabla XIX. Calibrado ara el Pb(II)-AMEDT .................. .. ANOVA (256 run , Pb(II)-AMEDT ..................... Calibrado ara el Ni(II)-AMEDT ......................... ANOVA (250 nm), Ni(II)-AMEDT ..................... ANOVA (3 80 nm}, Ni(II)-AMEDT ... ......... ......... Calibrado ara el Cr(III)-AMEDT. ..................... . ANOVA (302 rim), Cr(III)-AMEDT .................... ANOVA (409 nm), Cr(III)-AMEDT .................... ANOVA (576 nm), Cr(III)-AMEDT .................... Calibrado ara el Co(II)-AIVIEDT ........................ ANOVA (254 nm), Co(II)-AMEDT ..................... ANOVA (486 nm), Co(II)-A.MEDT ...................... 58 59 65 66 67 73 75 76 ^^ 83 84 gs. MEZCLA DE COMPLEJOS Pb(II) AMEDT y Cu (II) AMEDT Tabla XX. Influencia del H ................................................... 100. Tabla XXI Tabla XXII Tabla XXIII. Influencia de la cantidad de reactivo . .. ....... .. .... .... 102 Influencia del tiem o . ........ .............. ....... ........ . l os Influencia de la tem eratura .................................. 106. Tabla XXIV. Calibrado ara el Cu II en la mezcla ...... .. ...... .. .. 109 T-1.
(27) Índice. Tabla XXV. ANOVA (272 nm), Cu(II)-AMEDT ..................... 110. Tabla XXVI. Calibrado ara el Pb(II) en la mezcla .................... Tabla XXVII Tabla XXVIII. ANOVA (256 nm), Pb(II)-AMEDT ..................... 113 Re roducibilidad del método ................................ 115. Tabla XXIX. Interferencia de cationes ....................................... 121. Tabla XXX. Interferencia de aniones ........................................ 122. 112. MEZCLA DE COMPLEJOS Pb (II) AMED T y Ni (II) AMED T Tabla XXXI Tabla XXXII. Influencia del H ................................................... 140 Influencia de la cantidad de reactivo .................... 143. Tabla XXXIII Tabla XXXIV Tabla XXXV. Influencia del tiem o ............................................ 17 Influencia de la tem eratura .................................. 149 Calibrado ara el Pb(II en la mezcla .................. 153. Tabla XXXVI. ANOVA 250 nm , Pb(II -ANIEDT ...................... Tabla XXXVII. Calibrado ara el Ni (II en la mezcla ................... 156. Tabla XXXVIII Tabla XXXIX. ANOVA 256 nm , Ni II -AMEDT ..................... 157 ANOVA 380 nm , Ni II -AMEDT...... ............. .. 158. Tabla XL. Re roducibilidad del método ................................. Tabla XLI. Interferencia de cationes..... ................................. . 167. Tabla XLII. Interferencia de aniones.... ................................. ,... 154. 160-161 168. MEZCLA DE COMPLEJOS Cu (II) AMED T y Ni (II) AMED T 184 187. Tabla XLIII Tabla XLIV Tabla XLV Tabla XLVI Tabla XLVII Tabla XLVIII Tabla XLIX Tabla L Tabla LI. Influencia del H..... .............................................. Influencia de la cantidad de reactivo .................... Influencia del tiem o..... ................................... ,... Influencia de la tem eratura .................................. Calibrado ara el Cu(II) en la mezcla .................. ANOVA (250 nm), Cu(II)-AMEDT ..................... Calibrado ara el Ni (II) en la mezcla ................... ANOVA (272 nm), Ni(II)-ANiEDT ..................... ANOVA (3 80 nm), Ni(II)-AIVIEDT .. . . .. .. .. .. ...... .... Tabla LII. Re roducibilidad del método ................................ 203-204. Tabla LIII Tabla LIV. Interferencia de cationes .. ... ........ .. .... .. .... .. .. .. .... .. .. 21 ^ Interferencia de aniones ........................................ 211 T- 2. 190. 192 196. 197 199. 200 201.
(28) Índice. MEZCLA DE COMPLEJOS Cu(II) AMEDT y Cr(III) AMEDT Tabla LV. Influencia del pH ................................................... 226. Tabla LVI. Influencia de la cantidad de reactivo ................ Tabla LVII Tabla LVIII Tabla LIX. Influencia de1 tiempo ............................................ 233 Influencia de la tem eratura .................................. 235 Calibrado ara el Cu(II) en la mezcla ................... 239. Tabla LX Tabla LXI. ANOVA (302 nm), Cu(II)-AMEDT ..................... 240 Calibrado ara el Cr(III) en la mezcla ................. 242. Tabla LXII Tabla LXIII Tabla LXIV. ANOVA (272 nm), Cr(III}-AMEDT .................... 244 ANOVA (409 nm}, Cr(III)-AIVlEDT .................... 245 ANOVA (576 nm), Cr(III)-A,IVIEDT .................... 246. Tabla LXV. Re roducibilidad del método ................................ 248. Tabla LXVI Tabla LXVII. Interferencia de cationes..... ............................... ... 258 Interferencia de aniones ........................................ 259. . 22g. MEZCLA DE COMPLEJOS Pb(II) AMEDT y Cr(III) AMEDT Tabla LXVIII. Influencia del H ................................................... 274. Tabla LXIX Tabla LXX Tabla LXXI. Influencia de la cantidad de reactivo .................... 276 Influencia del tiem o ............................................ 278 Influencia de la tem eratura .................................. 279-280. Tabla LXXII Tabla LXXIII Tabla LXXIV Tabla LXXV Tabla LXXVI Tabla LXXVII Tabla LXXVIII Tabla LXXIX. Calibrado ara el Pb II en la mezcla ................... ANOVA 256 nm), Pb II -AIVIEDT ..................... Calibrado ara el Cr III en la mezcla ................. ANOVA 302 nm , Cr(III -AMEDT .................... ANOVA 409 nm), Cr III)-AMEDT .................... ANOVA 576 nm , Cr III)-AIVIEDT .................... Re roducibilidad del método ................................ Interferencia de cationes . . . . . . . . . . . . . . . .. .. . . . ... .. .... .. .. .. ... Tabla LXXX. Interferencia de aniones ........................................ 302. 282 283 2g5 287 288 2g9 291 301. MEZCLA DE COMPLEJOS Pb(II) AMEDT, Cu(II) AMEDT y Ni(II) AMEDT i Tabla LXXXI. Influencia del H ................................................... 323. Tabla LXXXII. Influencia de la cantidad de reactivo ..................... 326.
(29) Índice. Tabla LXXXIII Tabla LXXXIV. Influencia del tiem o .......................................... 329 Influencia de la tem eratura ............................... 330. Tabla LXXXV Tabla LXXXVI. Calibrado ara el Cu II en la mezcla ................. 334 ANOVA (256 nm), Cu(II -AMEDT ................... 335. Tabla LXXXVII Calibrado ara el Pb III en la mezcla ................ 338 Tabla LXXXVIII Tabla LXXXIX. ANOVA (272 nm), Pb(III}-AMEDT .................. 339. Tabla XC Tabla XCI. ANOVA ( 380 nm), Cr(III)-AMEDT .................. Reproducibilidad del método ............................... Tabla XCII Tabla XCIII. Interferencia de cationes ..................................... 354 Interferencia de aniones ...................................... 355. Calibrado ara el Ni(II)-AMEDT ................... . 342 343 346. MEZCLA DE COMPLEJOS Pb(II) AMEDT, Cu(II) AMEDT y Co(II) AMEDT Tabla XCIV Tabla XCV Tabla XCVI Tabla XCVII. Influencia del H ................................................ Influencia de la cantidad de reactivo .................. Influencia del tiem o .......................................... Influencia de la tem eratura. .......................... ..... 373. Tabla XCVIII. Calibrado ara el Pb II en la mezcla .................. 383. Tabla XCIX Tabla C. ANOVAS, Pb II)-AMEDT ................................. 386-387 Calibrado ara el Cu II} en la mezcla ................. 390. Tabla CI. ANOVAS, Cu II)-AMEDT ................................. Tabla CII Tabla CIII. Calibrado ara el Co II} en la mezcla ................. 397 ANOVAS, Co(II)-AMEDT ................................ 400-401. 375 37g 379. 393-394. 402. Tabla CIV Tabla CV Tabla CVI Tabla CVII Tabla CVIII. Re roducibilidad del método .............................. Interferencia de cationes ..................................... Interferencia de aniones ...................................... Valores de la "t" de Student ................................ Tabla ANOVA ..................................................... 408. Tabla CIX. Valores de la "F" de Snedecor ............................. 453. T-4. 419. 420 447. 452.
(30)
(31) N. i. i. i.
(32) Introducción. 1 : INTRODUCCIÓN. Las diferentes propiedades de los distintos complejos de los cationes metálicos con los agentes secuestrantes poliaminopolicarboxilados, hacen posible no sólo el reconocimiento de algunos elementos, sino que también permiten varias separaciones, a pesar de la presencia de elementos cuya previa eliminación es necesaria en los métodos clásicos.. La casi totalidad de las aplicaciones de los agentes secuestrantes poliaminopolicarboxilados se basan en su propiedad fundamental de formar complejos muy estables y solubles con la mayoría de los iones metálicos. La estabilidad de estos complejos depende de la [ H+] y[ OH -), de los productos de solubilidad de posibles sales coexistentes y de la fuerza iónica de la disolución, así como también de que el catión se encuentre sólo o en presencia de otros capaces de entrar a formar parte del complejo.. Los complejos de los cationes incoloros son también incoloros; los cationes coloreados dan invariablemente complejos de un color más intenso que el ión libre.. Los compuestos poliaminopolicarboxilados tienen como gran ventaj a a la hora de ser utilizados como agentes de enmascaramiento el hecho de que los complej os son formados, por lo general, casi instantáneamente y en proporciones estequiométricas. No hace falta, por tanto, usar un gran exceso de reactivo, como en el caso de otros usuales formadores de complej os como cianuros, tartratos, etc.. 3.
(33) ^ntroducción. 1.1.- EL AEDT Y COMPUESTOS ANÁLOGOS: HISTORIA Y PROPIEDADES GENERALES.. La importancia creciente de los compuestos complejos, en todas las ramas de la Química, ha seguido una marcha ascendente desde los últimos años del siglo pasado, en que WERNER propuso su teoría de coordinación para explicar el hecho de que las moléculas saturadas, aparentemente estables, se combinen para dar lugar a los llamados "complejos moleculares".. Por lo que respecta a la Química Analitica, la mayor importancia la han suscitado los complejos formados por iones metálicos y moléculas orgánicas. Y a pesar de que en un principio no fueron vistos con buenos oj os, ya que la realización de determinaciones inorgánicas con productos orgánicos era considerado una mala práctica, los reactivos orgánicos han invadido prácticamente todos los campos de la Química Analítica.. De entre todos los reactivos orgánicos utilizados cabe resaltar por su importancia los denominados " agentes quelatantes", designados por SCHWARZENBACH ( 1-6 ) con el nombre de "complexonas". Estas sustancias tienen numerosas aplicaciones en el análisis volumétrico, constituyen un grupo numeroso y se caracteri^an por contener en sus moléculas a- aminoácidos a cuyo átomo de nit^ógeno está unido además un g^upo metilca^boxílico; es decir, que tiene al menos un grupo - N(CH2 - COOH)2.. ^ CHZ - COOH. ^ CHZ - COOH. u_N. ru_3 _ rr ^ CH2 - COOH. ^ CHZ - COOH. 4.
(34) Introducción. Todos los "quelones" reaccionan de forma similar con los iones metálicos; forman complej os estables, solubles en agua y no solubles en disolventes orgánicos, siendo sus constantes de estabilidad muy elevadas.. Hasta la fecha se han propuesto bastantes métodos absorciométricos para la determinación de diferentes cationes metálicos con diversos "quelones", métodos en los que estos ácidos pueden cumplir una doble función: • Como agentes secuestrantes de otros cationes que pudieran interferir en el medio en que se desarrolla la determinación.. • Como agentes cromogénicos exaltando la intensidad luminosa de iones coloreados.. Estos compuestos poliaminopolicarboxilado son agentes complej antes universales, capaces de asociarse con los cationes de casi todos los metales, incluso con los cationes de los alcalinos y alcalinotérreos; aunque las valencias elevadas y los altos valores de pH favorecen la formación de los correspondientes quelatos.. Tales complej os tienen una composición muy sencilla y se forman mediante reacciones estequiométricas que pueden utilizarse para numerosas determinaciones volumétricas. Las propiedades de los iones metálicos comple^ jados de esta manera se alteran profundamente y no muestran de ninguna forma su comportamiento característico frente a los reactivos.. De todos estos ácidos, el más importante y conocido es el ácido etilendiaminotetraacético que se designa brevemente con las siglas AEDT {en inglés, EDTA) y que se formula de manera resumida como YH4. Este ácido, derivado del "ácido iminodiacético", forma una serie de sales mono, di, tri y tetrasódicas, de las cuales, la disódica es la más utilizada analíticamente.. s.
(35) Introducción. Los equilibrios de formación de los complej os originados por el AEDT se pueden formular así: Y-4 + Me +n H YMe n- 4 La constante de formación del los complej os antes formulados viene dada por la expresión : [ YMe n-`^ ] [Y^] [Me+p] La estabilidad de los complejos originados por los agentes quelatantes poliaminopolicarboxilados depende de varios factores:. • De la expresión de la constante de formación o de estabilidad, se deduce que la relación de metal complej ado a ión metálico, o ` ^rado de c^uelación" disminuirá a causa de cualc^uier.factor que ha^a disminuir la concentración de ligando libre, j Y^^. • Una variación de ^H de la disolución afecta a la e^cacia de los agentes secuestrantes poliaminopolicarboxilados porque un aumento de la concentración de protones provoca una disminución de la concentración del ión activo del agente. De esto se deduce también que estos agentes son más activos en disoluciones alcalinas, en las que existe un mayor número de Y-4 . • A pesar de haber dicho anteriormente que los agentes secuestrantes poliaminopolicarboxilados suelen ser más activos en disolución alcalina, hay que tener también presente que al aumentar el pH de la disolución aparece un segundo factor que afecta a su e^cacia; y este factor es la com^etencia c^ue se establece entre el número creciente de iones OH y los iones Y-4 para ligarse con los iones metálicos.. 6.
(36) Introducción. • Los a,^entes preci^itantes tales como oxalatos, carbonatos, etc., ejercen un efecto similar al ión OH -, en lo que se refiere a la interferencia en la formación del quelato, aumentada por el hecho de que los aniones precipitantes son ligandos que compíten con el anión del agente secuestrante para unirse al ión metálico. • Naturalmente, los valores de las constantes de quelación son influenciados también por la^uerza iónica de la disolución. • La estabilidad de los quelatos que forman los agentes secuestrantes poliaminopolicarboxilados depende también de otros factores, como son la carga y radio del ión metálico; creciendo al aumentar la carga iónica del catión y del agente secuestrante y aumentando también al disminuir el radio iónico del ión metálico.. Estos agentes poliaminopolicarboxilados, de los que el más representativo es el AEDT, al presentar los complej os "catión-complexona" bandas características en la región UV-VIS del espectro, han podido y son utilizados en métodos analíticos sencillos, rápidos, rutinarios y económicos para la determinación espectrofotométrica de cationes metálicos.. La mayor parte de las propiedades de estos complejos están determinadas por la naturaleza del agente quelatante orgánico que se combina con el ión metálico, las propiedades de los iones metálicos complej ados han sido alteradas por lo que no muestran su comportamiento característico frente a los reactivos, además estos iones metálicos, una vez que entran a formar parte del complejo, no pueden ser descubiertos por precipitación, se encuentran "secuestrados" o "enmascarados" .. Para una cierta configuración espacial favorable, los grupos carboxilicos y los átomos de nitrógeno básicos se ofrecen simultáneamente al catión para coordinarse, se trata de la formación de verdaderos quelatos.. ^.
(37) Introducción. 1.2.- EL AMEDT COMO AGENTE QUELATANTE CROMOGÉNICO.. E1 AMEDT, ácido metiletilendiaminotetraacético, es un agente quelatante análogo al AEDT, con la diferencia de que posee un átomo de carbono asimétrico (*) enlazado a un radical metilo:. HOOC - H2C ^. ^CH2 - COOH (*) N-CH-CH2-N. HOOC - H2C'. ^ CH3. ^ CH2 - COOH. Este ácido fue sintetizado por DWYER Y GARVAN (7) y es al igual que el AEDT, tetrabásico; aunque el radical metilo enlazado al carbono asimétrico le con^ere una fuerza ácida ligeramente inferior a la que le corresponde al AEDT como puede observarse en la TABLA I. TABLA I COMPARACIÓN DE LA FUERZA ÁCIDA DE LOS SISTEMAS DEL AEDT Y AMEDT SISTEMA YH4 H YH3 - + H+. pK AEDT 2, 00. pK AMEDT 2, 60. YH3 - H YH22- + H+. 2,67. 3,03. YH22^ H YH 3- + H+. 6,16. 6,20. YH 3- H Y 4^ + H+. 10,26. 10,84. g.
(38) Introducción. La capacidad complejante del AMEDT es del orden de la que presenta el AEDT y en algunos casos mayor, como se ha demostrado mediante estudios espectrofotométricos y curvas de valoración potenciométricas y conductométricas del ácido con disoluciones de hidróxidos alcalinotérreos (8).. Las constantes de estabilidad de los quelatos formados por el AMEDT con los iones de los metales alcalinotérreos han sido determinadas por GRIMES y col. (9) y son: log KM^. log Kça. log Ksr. log KBa. 10,29. 11,47. 9,61. 8,48. Las constantes de estabilidad de los complej os de AMEDT con los lantánidos y con los iones Hg2+, Cd2+ y Cu2+ han sido determinadas por IRVING y CONESA (10).. SUÁREZ CARDESO y GONZÁLEZ GARCÍA (11) aislaron los complej os sólidos del AMEDT con diversos cationes, entre Cr3+, Mg2+, Fe3+, Co3+, Co2+, Ni2+, Cu2+ y Fe2+, estudiando sus ellos: características y realizando un estudio detallado de las propiedades espectrales en el ultravioleta y visible, también estudiaron sus propiedades magnéticas. , VICENTE PEREZ y col. (12) estudiaron la reactividad de la sal disódica del AMEDT con los cationes más comunes en el análisis inorgánico, clasificando las reacciones producidas como: • Reacciones de precipitación. • Reacciones redox. • Reacciones de formación de complejos.. g.
(39) Introducción. Los mismos autores han realizado un estudio de las propiedades enmascarantes del AIV^DT sobre las reacciones de los cationes con distintos reactivos: hidróxido sódico y amónico, carbonato y sulfuro sódicos, cromato potásico, ácidos clorhídrico y sulfúrico, ferrocianuro, yoduro y sulfocianuro potásicos y agua oxígenada (13). Asimismo han realizado un estudio teórico sobre las condiciones de valoración del magnesio, calcio y bario con AMEDT usando negro de eriocromo T como indicador (14) y un estudio experimental sobre las valoraciones de calcio, estroncio y bario por adición de un exceso de AMEDT valorando por retroceso con magnesio patrón y empleando negro de eriocromo T como indicador (15).. HOLEY y col. (16) examinaron la influencia de 20 agentes formadores de complejos atendiendo exclusivamente a su acción enmascarante, sobre distintas reacciones de cationes en análisis cualitativo inorgánico. Entre ellos se encuentra el AMEDT.. BELCHER y CLOSE ( 17) emplearon el AlV^DT como reactivo volumétrico para la determinación del ión calcio, empleando negro S de alizarina como indicador.. MASAYUKI NAKAGAKI Y COL (18) realizaron un estudio sobre los efectos de diversos derivados del AEDT, entre los que se encuentra el AMEDT, en la reducción fotoinducida por metilviologen usando como sensibilizador 3,3 '- dioctadeciltiocarbociamina en una disolución micelar de un agente surfactivo no iónico, heptaetilenglicol monododecil éter.. GARGALLO ESTEBAN Y COL. (19) realizaron un estudio térmico comparativo de algunos agentes quelatantes, entre ellos el AMEDT y también hicieron un resumen del comportamiento cromatográflco del AMEDT y de sus sales de sodio {20).. lo.
(40) ^ntroducción. ROJAS HERNÁNDEZ y col. (21) propusieron un modelo para el estudio del fenómeno de polinucleación en sistemas con múltiple regulación y mezcla de complejos. Realizan el estudio de los sistemas Be(II)- H y Be(II) - AMEDT - H.. NAIQI YOU y ROLF NEEB (22) determinaron talio en presencia de plomo con AMEDT por medio de polarografía inversa por enmascaramiento electroquímico.. SUDMEIER y col. (23) estudiaron la formación de quelatos de los iones K+ y Rb+ por resonancia magnético nuclear, obteniendo para sus constantes de formación los valores 1,3 y 0,14 respectivamente.. Una de las técnicas que pueden usarse para la determinación de Fe (III) con AMEDT es la cromatografía en capa fina, HILLCOTTINGHAM (24) tabuló los valores de Rf para 23 agentes quelatantes y sus quelatos de Fe (III).. GONZÁLEZ VÍLCHEZ y (25) realizaron la col. caracterización y síntesis de los complejos de paladio con AlV1EDT. La valoración potenciométrica y el espectro infrarrojo muestra que el AMEDT actúa como ligando tridentado.. PINILLA y col. (26) hicieron un estudio potenciométrico de los complej os de V(III) con AMEDT de fórmula 1:1. Proponen un método para determinar vanadio por polarografía cíclica, obteniendo un error estándar menor de15% y un coe^ciente de variación menor del 3%. Los mismos autores realizaron un estudio polarográfico de los mismos complej os, en un intervalo de pH de entre 3, 0- 8, 5 y en otro intervalo de entre 10, 0- 11, 5; utilizaron como pH de trabaj o los valores de 5, 0 y 10, 0 respectivamente y obtuvieron un error estándar < 3% y una desviación estándar relativa <_ 3,8 % (27). 11.
(41) Introducción. NAIK y NIGAM (28) estudiaron las cinéticas del complej o formado por Ni (II) con AMEDT a pH comprendido entre 6, 5 y 11, 0.. hicieron un estudio (29) col. y HERNÁNDEZ electroquímico de los complej os de Bi (IH) con AMEDT, determinando parámetros cinéticos para las reacciones electrolíticas. También realizaron un estudio potenciométrico y voltamétrico de los tres complej os que forma el Cu (II} con AMEDT; proponen un método para la determinación polarográfica del Cu (II) ajustando el pH entre 4,0 y 12,0, obteniendo para concentraciones de Cu (II) comprendidas entre 10 -5 y 10 -3 M. Un error relativo menor del 2,5 % y una desviación estándar relativa <_ 3,0 %(30).. NORIMASA YOZA y col. (31) determinaron mediante el complej o Cu (II}-AMEDT por cromatografía. Cu (II). Actualmente algunos complej os de AMEDT se utilizan en ciertas mezclas como blanqueantes en el procesado del color de los haluros de plata en material fotográfico.. Las posibilidades espectrofotométrieas del AMEDT pueden clasificar de acuerdo con sus aplicaciones en:. • Aplicaciones a la Espectrofotometr^ia Visible. • Aplicaciones a la Espectt^ofotorraetria ^ltravioleta. • Aplicaciones a la Espectrofotomet^ia de derivadas.. IZ. se.
(42) Introducción. • APLICACIONES A LA ESPECTROFOTOMETRÍA VISIBLE.. FRAUSTO DA SILVA y col. (32) estudiaron el complejo que forma el AMEDT con el Cu (II), trabajando a pH 6,0, determinaron la absortividad molar que resulto ser 106 1 mol -1 cm -1^. PÉREZ hicieron un estudio VICENTE col. y espectrofotométrico (33) y polarográfico (34) del complejo V(V)-AMEDT, el complejo formado presenta dos máximos de absorción a 580 nm y 789 nm, se mantiene constante en un intervalo de pH de entre 2, 0 y 10, 0 y cumple la Ley de Beer entre 20 y 2500 µg ml -1 ^. Los mismos autores determinaron espectrofotométricamente Mn (III) con AMEDT a 490 nm y pH 3,0, cumpliéndose la Ley de Beer para concentraciones de Mn (III) inferiores a 70 µg ml -l (35). También estudiaron espectrofotométricamente los complejos que forman el Cu (II), Cr (III), Ni (II) y Co (II) con AMEDT, el Cu (II) a 730 nm y pH = 4,5, el Cr (III) a 390 nm y 540 nm a pH = 11 , el Ni (II) a 380 nm y 590 nm a pH = 4,5 y el Co (II) a 490 nm y pH = 2,0 (36).. Así mismo investigaron el sistema Co {III) - AMEDT a 380 y 540 nm, se forman dos complejos de cobalto , uno a pH ácido y el otro a pH básico, cumpliéndose la Ley de Beer desde 6,0 hasta 150 µg ml -1.. CASTRO ROMERO y col. (38) realizaron un estudio espectrofotométrico del complejo Fe (III) - AMEDT en la zona visible del espectro, proponiendo un nuevo método para la determinación de Fe (III) a 3 85 nm manteniendo el pH constante entre los valores de 1, 5 y 6, 5 y. 13.
(43) Introducción. eligiendo el valor de 3,0 como pH de trabajo. La ley de Beer se cumple en un intervalo de 2,0 a 175 µg ml -1 de Fe (III) y la absortividad molar es de 434 mol -1 cm -1.. Los mismos autores realizan un estudio espectrofotométrico del sistema Ti (V)-AMEDT en exceso de H2O2 a 366 nm y pH de 1,5 a 8,5 (las medidas fueron realizadas a pH 4,0), en un intervalo de concentración de Ti (V) de 2,0 a 100 µg ml -l. La absortividad molar obtenida fue de 4,91 10 -3 1 mol -1 cm -l y el error fotométrico 2,92 % (39).. También describen un método para la determinación de Fe (III) con AMEDT y H2O2 a 520 nm y pH 11,0, cumpliéndose la ley de Beer de 1 a 175 µg ml -1 y lo aplicaron al análisis del contenido de hierro en aguas naturales (40).. A continuación, en la tabla II se indican las caracteristicas de los quelatos que forma el AMEDT con los cationes metálicos citados en la zona visible del espectro.. 14.
(44) Introducción. TABLA II CARACTERÍSTICAS DE QUELATOS DE AMEDT EN LA ZONA VISIBLE.. Catión. Máximo Absorción. (nm). pH Óptimo. Intervalo Ley de Beer (µ m1-1). Absortividad molar (1 mol-' cm 1). Cu (II} V(V). 735 580. 6 2-10. --20-2500. 106 19. V(IV) Mn (III) Cu (II) Cr (III). 780 490 730 390. Z-10 3 4,5 11. 20-2500 1-70 10-800 10-500. 25 324 111 114. Cr (III) Ni (II) Ni (II) Co (II) Co (II). 540 380 590 490 380. 4,5 4,5 4,5 Z 4,5. 10-500 600-4800 600-4800 200-2400 6-150. 200 6 3 12 --. Co (III) Fe (III) Ti (IV)-H^02 Fe (III)-H2O2. 540 385 366 520. 9,5 1,5 - 6,5 1,5 - 8,5 10,5 -11,5. 6-150 2-175 2-100 1-175. 298 434 4905 548.
(45) Introducción. • APLICACIONES A LA ESPECTROFOTOMETRÍA U LTRAVIOLETA.. VICENTE PÉREZ y col. (41) realizaron un estudio espectrofotométrico del complejo V(V)-AMEDT a 210 nm y un pH comprendido entre 2 y 7, tomando como pH de trabajo 4,0. La ley de Beer se verifica en un intervalo de concentración de V(V} entre 1 y 12 µg ml -l. También determinaron V(V) a 260 nm a pH = 10.. Los mismos autores estudiaron el complejo Bi (III}-AMEDT a 267 nm en un intervalo de pH de entre 3 y 6, cumpliéndose la ley de Beer hasta 34 µg ml -1 (42). Realizaron así mismo un estudio polarográfico de este complej o y determinaron por un método amperométrico Bi (III) (43).. Estudiaron espectrofotométricamente el complejo Mo (V)AMEDT a 296 nm, con una razón molar de 2:1 y comprobaron que el complejo es estable en un intervalo de pH comprendido entre 2 y 9, la ley 1- 5 10 ^ M. Y la constante de de Beer se cumple para el intervalo formación del complejo es 6,0 10 -10 a 25° C(44).. FERNÁNDEZ SOLÍS y col. (45) estudiaron el complejo Fe (III)-AMEDT en la región U.V. del espectro y propusieron un método para la determinación espectrofotométrica de Fe (III) a 258 nm. El pH se mantiene constante entre 1,3 y 7,3 , cumpliéndose la ley de Beer para un intervalo de concentración de Fe (III) de entre 0,3 y 11,3 µg ml -1, siendo la absortividad molar 9,7 10 3 1 mol -1 cm -1 . Este procedimiento lo aplicaron a la determinación del hierro en talcos.. 16.
(46) Parte Experimental. HERNÁNDEZ y (46) realizaron un estudio col. espectrofotométrico y polarográfico del complej o Al (III)-AMEDT a 215 nm y pH 4,5 , siendo la estequiometría del complejo l:l y existiendo linealidad para las concentraciones de Al (III} comprendidas entre 10 -6 y 10 -`^ M. Estos autores proponen un método amperométrico para la determinación de este metal.. col. (47) realizaron en estudio SECO LAGO y espectrofotométrico del sistema Cu (II)-AMEDT a 265 nm, en un intervalo de pH que va desde 3,5 hasta 11,4, el complejo, l:l, tiene una constante de estabilidad de 1,12 10' , y una absortividad molar de 3,34 103 1 mol-1 cm-1. Proponen un método de determinación de Cu (II) para un intervalo de concentraciones del mismo entre 0, 51 y 3 5, 3 0 µg ml - l, trabaj ando a pH 8; dicho método lo aplicaron a la determinación de Cu (II) en muestras de sílice comercial.. CASTRO ROMERO y col. (49) investigaron el complejo formado por Pb (II) y AMEDT a 243 nm, para valores del pH comprendidos entre 7 y 12. Describen un método para determinación de Pb (II) en un intervalo de concentración de 1 a 40 µg ml -1 de metal y lo aplicaron a la determinación del contenido de Pb (II) en muestras de bronce. (50).. A continuación se relacionan las principales características de los complejos que forma el AlV1EDT con distintos cationes en la zona ultravioleta del espectro: Tabla III.. 1^.
(47) Introducción. TABLA III. , CARACTERISTICAS DE LOS QUELATOS DE AMEDT. EN LA ZONA ULTRAVIOLETA.. Catión. Máximo Absorción (nm). pH óptimo. Intervalo Ley de Beer (µ ml -' ). Absortividad molar (1 mol-' cm"1). V(V) V(V) Bi (III) Fe (III}. 210 260 267 258. 4 10 3-6 1,3-7,3. 1-12 1-12 0-34 0,3-11,3. 8000 3500 175 9700. Al (III) Mo (V} Cu (II) Pb (II). 215 296 265 243. 4, 5 2-9 3,5-11,4 7-12. 10-6-10^4 M 1-5 10^4 M 0,51-35,30 1-40. 74 -3338 8960. • APLICACIONES A LA ESPECTROFOTOMETRÍA DE DERIVADAS.. CASTRO ROMERO y col. (51) realizaron un estudio del sistema Fe (III)-AMEDT por espectrofotometría de derivadas de primero y segundo orden, en un intervalo de longitud de onda de entre 200 a 600 nm, a velocidad de 2400 nm min -', con una 0^, = 36 nm y 31,5 nm para la primera y segunda derivada, respectivamente, en un intervalo de pH de 1 a 6. Describen un método para la determinación de Fe (III) con AMEDT , cumpliéndose la ley de Beer de 30 a 60 µg ml -' para la primera derivada del espectro de absorción y de 20 a 50 µg ml -' para la segunda.. Ig.
(48) Introducción. Los mismos autores realizaron la determinación simultánea de Cu (II) y Co (II) en sus mezclas por espectrofotometría de derivadas de primer orden, en el intervalo de longitud de onda de 1000 a 300 nm, a una velocidad de 2400 nm min -i , con una 0^, = 72 nm, en un intervalo de pH de 3,0 a 4,8. El procedimiento resulta adecuado para concentraciones de Co (II) de entre 0,2 a 8,0 mg ml -1, así como para concentraciones de Cu (II) de entre 0,05 a 1,60 mg ml -1, pudiendo eliminarse la mayoría de las interferencias producidas por otros iones (52).. A continuación se relacionan algunas de las características de los métodos de espectrofotometría de derivadas propuestos que hacen uso del AMEDT como reactivo complejante: Tabla IV.. TABLA IV , , CARACTERISTICAS DE LOS METODOS DE ESPECTROFOTOMETRÍA DERIVADA CON AMEDT.. Catión. Fe (III) Fe (III) Cu (II) Co (III). Orden de derivada 1 2 1 1. Intervalo de trabaj o. 0^, (nm). (^) 200-600 200-600 550-850 400-550. 36 31, 5 72 72. 19. PH óptimo. Intervalo linealidad. 1-6 1-6 3-4,8 1,5-4,8. (µg ml 1) 30-60 20-5 0 50-1600 200-8000.
(49) Introducción. 1.3.- ESPECTROFOTOMETRÍA DE ABSORCIÚN. La absorciometría de la luz comprende el estudio de los métodos llamados comúnmente colorimétricos y espectrofotométricos que utili^an la p^oducción de absorciones provocadas por un haz de lu^ blanca, o de lu.^ monocromática de longitud de onda comp^endida entre los límites del espectro visible. De la intensidad de la absorción producida, se deduce la concentración de la disolución; desde el punto de vista del análisis inorgánico, los más importantes son los métodos que se re^eren a la parte del espectro comprendida entre Z00 y 1000 nm, que corresponden desde el U.V. al comienzo del I.R.. Ultravioleta le'ano o de vacío. Ultravioleta róximo o de cuarzo Visible. 10 - 200 nm 200 - 380 nm 380 - 800 nm. Los métodos absorciométricos se aplican tanto a la determinación de compuestos coloreados como incoloros, con la ventaja de que la mayor parte de los espectros de absorción en las regiones visible y ultravioleta tienen máximos lo su^cientemente anchos (50-80 nm) para que no puedan producirse errores usando espectrofotómetros.. Los métodos absorciométricos son útiles en Química Analitica Cualitativa para la caracterización de las sustancias por: la forma de sus espectros de absorción, las longitudes de onda a que se presentan sus máximos y mínimos, los valores de las absortividades molares o los cambios en los espectros de absorción y las constantes anteriores al cambiar el pH, el disolvente, la concentración, etc.. Los métodos absorciométricos pueden ser aplicados sobre un amplio intervalo de concentraciones, a menudo solamente con una sencilla curva de calibrado; los procedimientos absorciométricos encuentran también aplicaciones muy interesantes en el estudio de la composición. Zo.
(50) Iutroducción. de iones complej os en disolución y en la determinación de sus constantes de formación o de disociación, sin que, dada la naturaleza de estos procedimientos, se alteren en manera alguna los equilibrios estudiados.. Los métodos más utilizados para el estudio de la composición de los iones complejos son los de: 1) Las variaciones continuas (53). 2) La razón molar (54). 3) La razón de 1as pendientes (55).. Lo más frecuente es aplicar estos métodos al estudio de los complejos formados entre un catión metálico y un ligando orgánico.. 1.4.- ESPECTROFOTOMETRÍA DE DERIVADAS.. 1.4.1.- INTRODUCCIÓN.. La espectrofotometría de derivadas representa un aspecto analítico de la espectroscopía relativamente joven. A pesar de que fue introducida hace unos 40 años (56, 57, 58) y de que ha demostrado sus ventaj as en la resolución de problemas analíticos especiales, esta técnica se ha abierto camino con cierta di^cultad. La falta de aparatos de precio razonable y la limitación de esta técnica a la obtención de la primera derivada restringieron durante un tiempo la aplicación de la espectroscopía derivada a casos especiales. La introducción del principio de diferenciación electrónica ha hecho posible la obtención de derivadas de orden superior y. 21.
(51) Introducción. ha abierto a la espectroscopía de derivadas un amplio campo de aplicaciones a un precio razonable.. O'HAVER y GREEN ( 59, 60) han realizado un excelente estudio sobre los aspectos teóricos de esta técnica y sus múltiples posibilidades.. La espectrofotometría derivada se ha aplicado con preferencia a la región U.V.- VIS del espectro, pero también ha dado buenos resultados en la zona I.R. (61, 62) ; en la fotometría de absorción y de emisión de llama (63, 64) y en luminiscencia (65).. GIESE y FRENCH (66) demostraron la ventaj a de la primera derivada de la transmitancia respecto a la longitud de onda para resolver bandas solapadas.. VANDERBELT y col. (67) usaron un procedimiento de tanteo gráfico y construyeron curvas derivadas de bandas gaussianas solapadas de diferentes alturas, anchuras y separación, demostrando la utilidad teórica de la derivada para su resolución, incluso en los casos en los que las dos bandas aparecían como una sola.. MARTÍN (68) realizó uno de los primeros trabajos teóricos sobre el tema, discutió por medio de aproximaciones matemáticas el agudizamiento de las bandas debido a la diferenciación múltiple, llegó a la conclusión de que el ancho de banda se reduce de tres a cinco veces de la derivada segunda a la cuarta.. La espectrofotometría de derivadas no está limitada a unos pocos campos especiales, sino que puede ser utilizada con gran provecho en todos aquellos casos en que el tratamiento cuantitativo de los espectros. 22.
(52) Introducción. normales sea di^cil o incluso imposible, esta técnica permite resolver problemas que no pueden ser resueltos por la espectrofotometría clásica. Proporciona una mejor resolución de los espectros, pequeñas variaciones en los espectros normales son puestas de mani^esto de manera mucho más clara y también pueden ser evaluadas cuantitativamente.. El término espectroscopía derivada se re^ere a una técnica de medida espectral en la que se mide la pendiente del espectro, es decir, la razón entre la variación de la absorbancia con la longitud de onda.. • La primera derivada del espectro de absorción es el lugar geométrico de la pendiente del espectro en unidades de absorbancia por nanometro de longitud de onda. • La segunda derivada del espectro de absorción es la derivada del espectro derivado, mide la curvatura del espectro y tiene unidades de absorbancia por nm2.. Usando unidades arbitrarias, el espectro derivado obedece la misma relación con la concentración que el espectro "normal", es decir, cumple la Ley de Beer si el espectro normal lo hace (69).. A. A. Pico de absorción simétrico y su primera y segunda derivada. (Ejemplo teórico). 23.
(53) Introducción. La espectrofotometría derivada es un procedimiento por el cual se determinan y representan los sucesivos órdenes de las derivadas matemáticas de un espectro.. La técnica de la derivada es potencialmente aplicable a cualquier procedimiento espectrofotométrico o colorimétrico.. En el desarrollo de nuevos métodos en Química Analítica, uno de los objetivos que se plantean es la mejora en la selectividad de la medida o en los procesos de medida, el aumento de la selectividad de las medidas hace que disminuya la necesidad de realizar separaciones físicas o reacciones químicas previas a la determinación de los constituyentes. Uno de los métodos que mejoran dicha selectividad es la espectrofotometría derivada (70), la cual es insensible a algunas fuentes de error que afectan a la exactitud y precisión de las medidas espectrofotométricas.. 1.4.2. - FUNDAMENTO.. El espectro de derivada consiste en la representación grá^ca, en un intervalo determinado de longitudes de onda, del cociente diferencial dA/d^, para la primera derivada y d2A/d^,2 para la se^unda derivada, siendo A la Absorbancia y^, la longitud de onda.. La primera derivada de un espectro original se puede definir también como la representación gráfica de la pendiente de la curva de absorción a cada longitud de onda del intervalo medido. Las derivadas de orden superior son por lo general menos usadas en las aplicaciones analíticas normales, sin embargo la resolución aumenta a medida que lo hace el orden de la derivada.. 24.
(54) Introducción. Algunas características de las derivadas de los espectros son las siguientes:. • E1 punto máximo de absorción del espectro normal corresponde al punto en que la primera derivada se anula y a un mínimo en la segunda derivada. • Los picos máximo y mínimo de la primera derivada del espectro corresponden al punto en que la segunda derivada se hace cero y a los puntos de inflexión del espectro normal. • Los picos máximo y mínimo de la segunda derivada del espectro corresponden a los puntos de máxima curvatura en el espectro normal. • La derivada mide la pendiente espectral y por ello una meseta en el espectro de absorción no tiene efecto ni en la primera ni en la segunda derivada. • La anchura del pico central de la segunda derivada es ligeramente menor que la anchura en un espectro normal y la altura o amplitud de un espectro derivado depende no sólo de la altura del espectro normal, sino también de su anchura.. Todos los dispositivos para obtener la derivada de un espectro real deben de tantear la derivada de un rango de longitudes de onda, ^,R, definido. Ello es necesario debido a que la derivada exacta de un espectro se halla generalmente dominada por el ruido.. El valor de í^R debe de ser del orden de la amplitud de la anchura en la mitad del máximo (FWHM^ de los picos que el analista desea resolver o separar.. 2s.
(55) Introducción. Como norma general, cuando se usa la derivada para exaltar la resolución, el paso de banda espectral o ancho de rendija (d^,) debe de ser pegueño en relación con las anchuras de los picos individuales a resolver.. Así, el efecto del paso de banda será mayor sobre la derivada del espectro que sobre el espectro mismo. En generál:. 0^, = 2 ^,R - 2 FWHM.. La resolución y distinción de picos aumenta con el orden de derivada, mientras que la relación señal/ruido (S/N) decrece.. Cuando se usa la técnica derivada para resolver el solapamiento de las bandas adyacentes con relación a su separación y con la relación S/R del espectro de absorción:. ■. La la derivada es el orden óptimo sólo cuando el espectro de absorción es generalmente ruidoso.. ■. La 2a derivada proporciona mej or resolución, un rango característico más fácilmente identi^cable y la relación S/R satisfactoria.. Cuando la estructura es claramente apreciable en el espectro de absorción, la segunda derivada proporciona un buen compromiso entre la resolución y la relación S/R.. Cuando la estructura no es muy apreciable en el espectro de absorción, es necesario hacer la tercera o cuarta derivada para obtener una buena resolución.. 26.
(56) Introducción. TABLA V. Relation Between the Key Entry N and the Derivative Wavelength Difference t^A. Measuring wavelength range (nm). ñ ^. ó V N. Vy. ó y -s. ó. p^ (nm) lst order. 2nd order. 3rd order. 4th order. 1. 0. 8. 0. 7. 0. i. 0. 6. 2. 1. 6. 1. 4. 1. 4. 1. 2. 3. 2. 4. 2.1. 2.1. 1. 8. 4. 3. 2. 2. 8. 2. 8. 2. 4. 5. 4.0. 3.5. 3.5. 3_0. 6. 4. 8. 4. 2. 4. 2. 3. 6. 7. 5. 6. 4. 9. 4. 9. 4. 2. 8. 6. 4. 5. 6. 5. 6. 4. 8. 9. 7.2. 6.3. 6.3. 5.4. 5. 8. 0. 7. 0. 7. 0. 6. 0. 6. 9. 6. 8. 4. 8. 4. 7. 2. 7. 1 1. 2. 9. 8. 9. 8. 8. 4. 1 2. 0. 10. 5. 1 0. 5. 9. 0. 8. 12.8. 1 1.2. 1 1.2. 9.6. 9. 14. 4. 1 2. 6. 1 2. 6. 1 0. 8. 1 6. 0. 1 4. 0. 1 4. C^. 1 2. G. 2 0. 0^. 1 7. 5. 1-7. 5. 1 5. G. 6. 24.0. 21.0. 21.C^. 18.C^. ?. 28.0. 24.5. 24.5. 21.G. 8. 32.0. 28.0 ^. 28.C^. ?4.0. 9^. 36.0. 31.5. 31.^. 27.G. 40.0. 35.0. 35.C^. 30.G. 6. 48.0. 42.0. 42.C. :j6.C^. 7. 56.0. 49.0. 49.C. =2.C^. 8. 64.0. 56.0 ^. 56.C. 18.C. 9. 72.0. 63.0. 63.C. ^4.^^. v. p ^e. O -1. N. ^^. ^^. ^. O. ^. ^. ^. 1. 2 1 3. 4. 1. 2. 3. N 2 .. 4 5-". 3. 4 5. -. ^. 27.
(57) •. ^ Introduccián FORMA DE^ LAS DERIVADAS DE LOS ESPECTROS DE ABSORCIÓN. +i.sea. + G.2eG <AiOIV.). +6.00A 20.0<NM^OIV.). 208.6. NM 350.6. Espectro de absorción de orden cero. +e .6ea. .. a.266. <A^OIV. ). -6.60A ^. 260.8. ^. 20.6<NM^OIV.). N ti 3s0.6. Primera derivada del Espectro de absorción.. 2.veA 200 ..0. 2G.G<NMiOIV.). N t•t 35G.G. Segunda derivada del Espectro de absorción. Figura 1 2g.
(58) 1. Introducción. 1.4.3. - TRATAMIENTO CUANTITATIVO DE LOS ESPECTROS DERIVADOS.. . Para el tratamiento cuantitativo de los espectros derivados se usan generalmente los siguientes métodos:. ✓ Se puede medir el valo^ que tiene la derivada a una determinada longitud de onda, salvo en los puntos de anulación. Hay que tener en cuenta que la sensibilidad de la medida varía fuertemente con el lugar donde se efectúa.. ✓ Medida de separación entre picos, se refiere el espectro de la primera derivada. Se mide la separación entre un máximo y un minimo vecinos, característicos del compuesto en estudio. Este método es adecuado especialmente para una determinación en presencia de turbidez o cuando hay una absorción de fondo poca deflnida, pero el resultado puede resultar erróneo si la derivada no se anula en ningún punto de la zona de medida.. ✓ Método de la tangente, se reflere al espectro de la segunda derivada. Se traza la tangente entre dos máximos vecinos y se mide, en la dirección paralela al ej e de ordenadas, la distancia entre la tangente y el mínimo situado entre los dos máximos. Con este método se elimina o se rebaj a la influencia de la absorción de fondo.. En estos métodos (71) las unidades utilizadas son de longitud, pero se convierten en unidades de concentración mediante una curva de calibrado patrón (72) .. 29.
(59) Introducción. 1.4.4. - VENTAJAS DE LA ESPECTROFOTOMETRÍA DE DERIVADAS. ■ Medida exacta de la ^máx• La primera derivada del espectro es muy útil para determinar la posición exacta de los máximos de absorción del espectro normal. En éste, la posición del máximo, sobre todo para banda ancha, se ^ja sólo de manera aproximada, sin embargo en el espectro de la primera derivada, la ^máx, viene determinada exactamente por el paso de la curva por el valor cero. En la práctica puede ser necesario corregir un pequeño desplazamiento constante de ^, según las condiciones de registro utilizadas.. ■ ^Iejor resolución de los espectros. Una ventaja importante de la espectrofotometría de derivadas es la mejor resolución en que aparece la estructura fina que a veces es difícil de ver en un espectro normal. En este caso es más conveniente emplear la segunda derivada ya que los máximos y los mínimos del espectro normal y de la segunda derivada aparecen prácticamente a las mismas longitudes de onda y la estructura fina del espectro se pone mejor de mani^esto que en la primera derivada.. ■. Análisis de una muestra turbia. Las disoluciones turbias presentan, en general, un aumento continuo de absorbancia hacia longitudes de onda más cortas y no ocasionan ninguna variación espectral importante en la primera y segunda derivada. En el registro de espectros de derivadas en presencia de turbidez se elimina el efecto de la absorción de fondo debida a la misma.. ■ Determinaciones cuantitativas en sistemas de dos o más componentes, Es su aplicación más importante y extensa. Supongamos que el componente que se desea determinar sólo sea visible en el espectro total por un pequeño pico, estos picos sólo pueden ser. 30.
(60) Introducción. utilizados por la espectrofotometría "clásica" aceptando grandes errores sistemáticos. Sin embargo, la espectrofotometría derivada permite su análisis con errores sistemáticos pequeños o incluso despreciables. La obtención del espectro de la primera y segunda derivada permite resolver picos que se hallen muy próximos entre sí en el espectro normal, o que incluso estén solapados. Utilizando la primera derivada se comprueba que esta técnica produce la separación real de los picos incluso cuando hay un considerable solapamiento entre ellos.. En el análisis de mezclas de dos o más componentes la espectrofotometría de derivadas sigue siendo de gran interés sobre todo desde el punto de vista cualitativo y la exactitud de la medida depende de distintos parámetros como son: • La separación entre los máximos de absorción de dichos componentes. • La relación de la altura de banda que interfiere y la banda de interés analítico.. • Ídem de la anchura de la medida.. Se presentan condiciones más favorables cuando la banda de interés analítico es la principal.. Otras ventaj as que ofrece la espectrofotometría derivada es la reducción del efecto debido a una absorción elevada del blanco, la reducción del efecto debida a las interferencias espectrales producidas por otros grupos cromóforos con picos relativamente pequeños. Permite una simplificación de los métodos, al suprimir pasos como pueden ser los de extracción con disolventes, etc.. 31.
(61) Introducción. 1.4.5.- LIMITACIONES Y DESVENTAJAS DE LA ESPECTROFOTOMETRÍA DERIVADA.. El problema más importante con relación al empleo de la espectrofotometría de derivadas es el ruido de fondo inherente a toda medida experimental. Este fenómeno proviene generalmente de causas independientes como la variación de la intensidad de la fuente luminosa, la ampli^cación de la señal, etc. Su carácter aleatorio trae consigo la variación de la línea base en cada punto de medida.. La absorbancia del ruido es estadísticamente independiente de los puntos considerados y lo mismo ocurre para la diferencia entre dos puntos. Parece por lo tanto necesario aumentar el número de puntos para realizar la derivada del espectro y así obtener un valor óptimo en la relación S/R. No obstante, el aumento debe ser limitado ya que tiene dos inconvenientes: la pérdida en cada extremo de la curva de un cierto número de puntos utilizados para el cálculo y la distorsión del espectro.. Uno de los aspectos negativos del alisado en la forma de las curvas se debe a la deformación que introduce en el trazado de los picos, causando al mismo tiempo una disminución de la altura y un ensanchamiento de los mismos, lo que implica una reducción de la resolución espectral.. En análisis cuantitativo, la respuesta depende del número de productos, de su espectro y del objetivo perseguido: se aumenta el factor de alisamiento para obtener un ruido de fondo débil que dé una mej or reproducción de las medidas. Mientras que en el análisis cualitativo se limita el valor del alisamiento para poner en evidencia de forma más clara la estructura ^na de los espectros.. 32.
(62) Irctroducción. Otra desventaj a que hay que tener en cuenta en la espectrofotometría de derivadas es que los espectrofotómetros que las realizan requieren un registro de barrido y generalmente son de doble haz, de luz ultravioleta y visible, por lo que son más costosos que un simple colorímetro. Sin embargo esto podría ser evitado utilizando un monocromador de modulación de longitud de onda.. Además, lo mismo que en cualquier otra técnica de medida, es posible que un uso incorrecto de la espectrofotometría de derivadas introduzca errores mayores de los que se habrían producido sin su uso, por lo que es necesario un buen entendimiento del concepto de espectro derivado y poner un especial cuidado en su realización y aplicación.. 1.4.6.- INSTRUMENTUS.. Los espectros de derivadas se pueden obtener de dos maneras según el tipo de aparatos: a) Espectrofotómetros que utilizan la señal de salida que permite la derivada mediante: 1. - diferenciación electrónica. 2. - tacómetro mecánico. 3.- diferenciación numérica. b) Espectrofotómetros que utilizan el sistema óptico para lo cual debe de tratarse de: l.- aparatos que emplean dos longitudes de onda.. 2.- aparatos que utilizan la modulación de la longitud de onda.. 33. I.
(63) Introducción. La relación S/R en la modulación de la ^, es en general mayor que en el sistema de diferenciación electrónica.. En la práctica, se prefiere hoy el principio de doble longitud de onda y la diferenciación óptica, sin embargo estos aparatos de doble longitud de onda sólo proporcionan de manera directa el espectro de la primera derivada, la segunda derivada debe de ser obtenida por medios electrónicos. Los dispositivos de diferenciación electrónica proporcionan indistintamente los espectros de la primera y segunda derivada.. Los espectrofotómetros registradores normales pueden ser adaptados fácilmente para la espectrofotometría de derivadas intercalando un accesorio de diferenciación electrónica entre la salida y la entrada del registrador.. 1.4.7.- MÉTODO DEL PUNTO DE ANULACIÓN O "ZERO-CROSSING POINT". En el análisis cuantitativo de mezclas de dos o más componentes solapados por espectrofotometría de derivadas, se utiliza muchas veces el método del punto de anulación o"zero-crossing-point" en primera (73) o segunda derivada (74) que se basa en que a la longitud en la que se produce el máximo de absorción de un componente en el espectro de orden cero, se produce la anulación en el espectro de la primera derivada y así, en una me^cla la primera derivada a esa longitud de onda depende únicamente de la concentración del segundo componente.. 34.
Figure




Documento similar
Ciaurriz quien, durante su primer arlo de estancia en Loyola 40 , catalogó sus fondos siguiendo la división previa a la que nos hemos referido; y si esta labor fue de
E Clamades andaua sienpre sobre el caua- 11o de madera, y en poco tienpo fue tan lexos, que el no sabia en donde estaña; pero el tomo muy gran esfuergo en si, y pensó yendo assi
Social Media, Email Marketing, Workflows, Smart CTA’s, Video Marketing. Blog, Social Media, SEO, SEM, Mobile Marketing,
Habiendo organizado un movimiento revolucionario en Valencia a principios de 1929 y persistido en las reuniones conspirativo-constitucionalistas desde entonces —cierto que a aquellas
The part I assessment is coordinated involving all MSCs and led by the RMS who prepares a draft assessment report, sends the request for information (RFI) with considerations,
o Si dispone en su establecimiento de alguna silla de ruedas Jazz S50 o 708D cuyo nº de serie figura en el anexo 1 de esta nota informativa, consulte la nota de aviso de la
b) El Tribunal Constitucional se encuadra dentro de una organiza- ción jurídico constitucional que asume la supremacía de los dere- chos fundamentales y que reconoce la separación
En el presente informe se realizó la determinación de Plomo, Cadmio y Arsénico por espectrofotometría de absorción atómica en el agua del rio grande distrito de