Guía de laboratorio para el diagnóstico de sigatoka negra (Mycosphaerella fijiensis)
Texto completo
(2) 23. 293.Ç1 MINISTERIO DE AGRICULTURA 7 (C:O INSTITUTOLOMBIANOAGROUARIO. Li. c. SU8GERENCIA QE FOMENTO Y SERVICIOS. DIVISION DE SANIDAD VEGETAL. GUlA DE LABORATORIO PARA EL DIAGNOSTICO DE SIGATOKA NEGRA (Mycosphaerella fijiensis)*. Jorge Mateus G. Miguel Mayorga P. Bernardo Ramírez M.***.
(3) CONTENIDO Página 1.. INTRODUCCION. 1. 2.. FUNDAMENTOS DE DIAGNOSTICO. 3. 3.. SELECCION DE LA MUESTRA. 8. 4.. MANIPULACION. El. 5.. TECNICAS PARA EL MONTAJE. 15. 5.1. LA IMPRONTA. 15. 5.1.1. Materiales a utilizar. 15. 5.1.2. Procedimiento. 16. 5.2. MONTAJE DE RASPADURAS EN AGUA. 18. 5.3. CORTES DE TEJID O. 19. 5.3.1. Materiales a utilizar. 19. 5.3.2. Procedimiento. 19. 5.4. METODO DE TINCION DE HONGOS EN TEJIDOS AFECTADOS CON DECOLORACIONES DE LA HOJA. 21. 5.4.1. Materiales a utilizar. 21. 5.4.2. Procedimiento. 22.
(4) Página 5.5. MONTAJE A PARTIR DE CULTIVOS PUROS. 23. 5.5.1. Materiales a utilizar. 23. 5.5.2. Procedimiento. 23. REFERENCIAS BIBLIOGRAFICAS. 27.
(5) GUlA DE LABORATORIO PARA EL DIAGNOSTICO DE SIGATOKA NEGRA (Mycosphaerella fijiensis)* Jorge Mateus G.** Miguel Mayorga P. Bernardo Ramírez M.*. 1. INTRODUCCION El plátano y el banano son cultivos de gran importancia en Centro y Suramérica. El plátano constituye base de la dieta alimenticia en los países tropicales y como tal se cultiva ampliamente bajo diversas formas de explotación. El banano, aparte de su consumo local, es, dentro del sector primario, una de las más importantes fuentes de divisas para la economía de los países productores. La aparición en el mundo de patógenos que afectan el plátano y el banano son motivo de preocupación para el futuro agrícola de estas especies. Sigatoka amarilla, registrada desde comienzos de siglo y observada en Colombia desde 1937, ha sido la enfermedad más importante del cultivo; sin embargo, la aparición. *. Contribución del Instituto Colombiano Agropecuario, ICA.. **. I.A. Sanidad Vegetal y Sección Fitopatología CRI Tulenapa Carepa (Ant.) I.A. MSc. Sanidad Vegetal CNI Turipaná, Montería..
(6) de una especie de Sigatoka más agresiva que la anterior, conocida como "Sigatoka negra" que se encuentra atacando plantaciones desde México hasta Colombia y continúa extendiéndose a nuevas áreas, es actualmente el principal problema del cultivo (8).. La zona cafetera colombiana, fuente de producción del 80% del plátano de consumo domestico, es el área mis seriamente amenazada por la enfermedad; por consiguiente, cualquier tipo de medida que sirva para retardar su introducción o su propagación, permitirá aminorar el impacto económico. Conscientes de la necesidad de disponer de una guía de laboratorio para el diagnóstico adecuado y oportuno de esta enfermedad, se presenta a continuación un compendio de técnicas de laboratorio y una guía descriptiva de las características diferenciales de los patógenos Mycosphaerella que contribuirá a satisfacer los requerimientos para adelantar actividades de clínica y diagnosis.. 2.
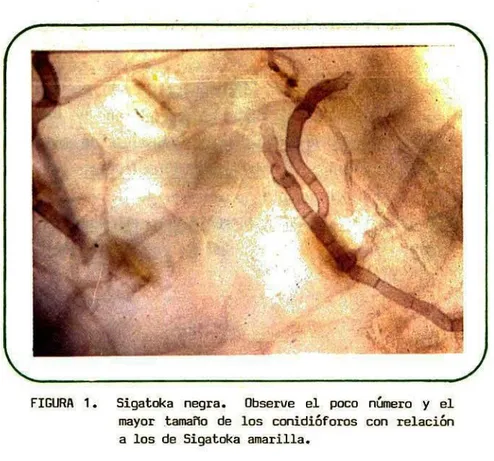
(7) 2. FUNDAMENTOS DE DIAGNOSTICO. Tres patógenos del género Mycosphaerella son los causantes de las manchas de Sigatoka en plátano y banano. El Mycosphaerella musicola Leach causante de la Sigatoka común o amarilla, Mycosphaerella fijiensis Morelet conocido como el agente causal de la Raya negra y el Mycosphaerella fijiensis Morelet var: difformis Mulder y Stover causante de la Sigatoka negra presente en Honduras (6).. Los tres patógenos Mycosphaerella son Ascomycetes de la familia Dothideaceae (1) en los cuales no se aprecian diferencias notables en su estado sexual. Las formas imperfectas de estos patógenos corresponden a especies del género Pseudocercospora y Paracercospora (2, 3) en los cuales las caracterTsticas de sus estructuras reproductivas permiten su diferenciación.. Paracercospora fijiensis y P. fijiensis var: difformis estados imperfectos de Mycosphaerella fijiensis y M. fijiensis var: difformis, respectivamente, producen con¡dióforos sencillos, septados, geniculados, solos o en grupos de 2 ó 5, con una ligera cicatriz en los sitios donde se hallaba adherido el conidio (3) (Figura 1). 3.
(8) 1. ' :.P. u :. FIGURA 1. Sigatoka negra. Observe el poco número y el mayor tama?o de los conidi6foros con relaci6n a los de Sigatoka amarilla.. El conidio es filiforme, ahusado, septado y con una cicatriz en la base o engrosamiento del hilum que permite diferenciar los conidios de los patógenos P. fijiensis de Pseudocercospora musae estado asexual de la Sigatoka amarilla (10) (Figura 3). Stover (13) estableció que existen pocas diferencias entre P. fijiensis y P. fijiensis var: difformis. Laúnica diferencia de P. fijiensis var: difformis con relación a P. fijiensis es la esporulación sobre esporodoquios producidos en las manchas jóvenes, aunque esta caracteristica se ha hechd menos frecuente con el tiempo. 4.
(9) FIGURA 2.. Sigatoka amarilla. Los conidi6oros son cortos, delgados, sin septas, sin geniculaciones. ni cicatriz. Se encuentran agrupados en esporodoquios en número superior a 50.. __HA. , J-'^ilW. 4. FIGURA 3.. '. Conidios de Sigatoka Negra. Observe el hiltin basal..
(10) Pseudocercospora musae Zimm. estado imperfecto de Mycosphaerella musicola, se caracteriza por producir sus conidios en un esporodoquio formado sobre síntomas avanzados de Sigatoka amarilla (2). Los conidióforos son cortos, rectos, hialinos, sin septas ni geniculaciones (Figura 2).. El conidio es filiforme, ahusado, septado. y no presenta cicatriz basa¡ como los patógenos sis (Figura 4).. H.. FIGURA 4. Conidios de Sigatoka amarilla. Los conidios son filiformes, redondeados en la base y no presentan hilun.. En la Tabla 1, se presenta un cuadro resumen de las principales caracteristicas morfológicas asexuales de los patógenos del genero Mycosphaerella que facilita su diferenciación. 6.
(11) TABLA 1.. Principales caracterTsticas morfológicas que diferencian la Sigatoka negra de la Sigatoka amarilla.. ESTRUCTURA. SIGATOKA NEGRA Paracercospora fiji ensis. SIGATOKA AMARILLA Pseudocercospora m usae. ESPORODOQUIO. Ausente. Presente. ESTROMA. Débil o ausente. Denso de color más oscuro. CONIDIOFORO. Largo, grueso, septado pigmentado, geniculado presencia de cicatriz. Solo o en grupos de 2 ó 5.. Corto, delgado, sin septas, hialino, sin geniculaciones ni cicatriz. Siempre se encuentra agrupado en esporodoquios en número superior a 50.. CONIDIO. Filiforme, septado. Engrosamiento del Hilum basal con cicatriz,. Filiforme, septado. No presenta engrosamiento del Hilum basal ni cicatriz.. MICELIO EPIFILICO Abundante. Emerge del Estoma. Escaso.
(12) 3. SELECCION DE LA MUESTRA. Para obtener un diagnóstico rápido de Sigatoka, la muestra ideal es aquella que presente síntomas con abundante producción de conidióforos y conidios. En Sigatoka negra, la máxima esporulación conidial ocurre en lesiones en estado de estría y mancha joven (Figura 5); mientras que en Sigatoka amarilla, la mayor esporu-. '. k. FIGURA S.. \\ Estado de Estrias de Sigatoka negra.. lación se observa sobre manchas adultas (Figura 8). No obstante, en ocasiones la presencia de conidios sobre las lesiones de Sigatoka negra puede ser baja o nula, puesto que éstas son fácilmente desprendidas por el viento y el agua. 8.
(13) ». :. 1 ,:. \\. FIGURA 6.. Estado de Estrías de Sigatoka amarilla.. -,,-• 2. •:. •. FIGURA 7. Estado de manchas de Sigatoka negra.. 9.
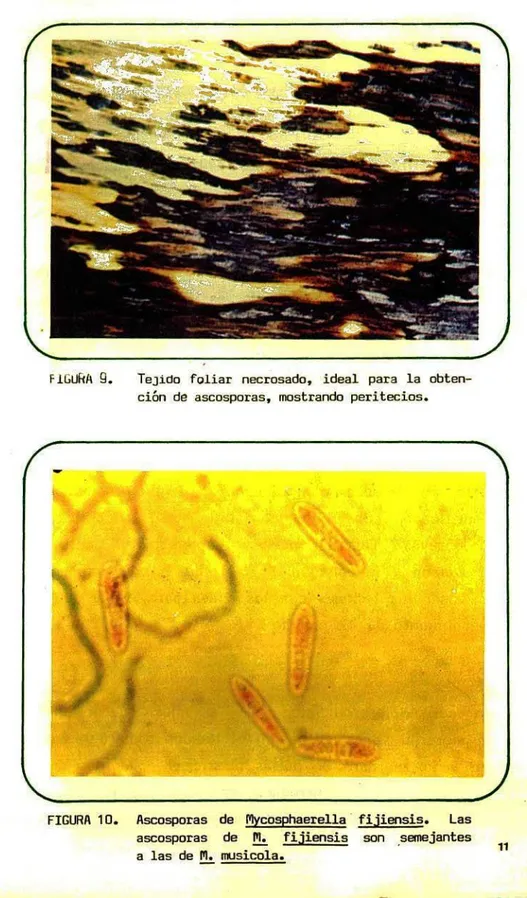
(14) Las horas más apropiadas para la recolección de las muestras son las más tempranas en la mañana. Para obtener cultivos puros del hongo a partir de ascosporas, se pueden emplear muestras de tejido necro-. FIGURA 8.. Estado de manchas de Sigatoka amarilla.. sado. Un diagnóstico posterior se hace sobre los con¡dios formados en el medio de cultivo. En este caso, la muestra óptima es aquella que presenta tejido foliar muerto por efecto de la infección sobre el cual, con la ayuda de una lupa, se observan los peritecios del hongo como puntos pequeños de color negro. (Figura o). 10.
(15) FlbLilffi 9.. Tejido foliar necrosado, ideal para la obtenci6n do ascosporas, mostrando peritecios.. 1. -ø. FIGURA 10. Ascosporas de Pycosphaere1la fijiensis. Las ascosporas de M. fijiensis son semejantes a las de M. nnisicola..
(16) 4. MANIPULACION. El propósito fundamental de la toma de muestras es el análisis de éstas en el laboratorio con fines de identificación o experimentación y no de diseminación. Por consiguiente, se deben extremar las precauciones y permitir que solamente los técnicos o personas adiestradas lo hagan. Para ello es necesario advertir a los agricultores que se debe informar y no enviar material vegetar a los laboratorios u oficinas de Extensión Agrícola.. Para el transporte de las muestras se recomienda hacerlo en frascos con alcohol del 70%, debidamente identificados con el lugar y la especie sobre la cual se obtuvo. También pueden emplearse el Lactofenol de Amann y la solución AF'A (Tabla 2). Es importante no tocar las lesiones con los dedos para evitar el desprendimiento de los conidios.. En caso imprescindible, para trabajos que requieran de material vegetal especial, el técnico tomaré la muestra y la guardaré en bolsas plásticas dobles, las cuales se deben sellar e introducir en bolsas de papel; éstas se sellan nuevamente y se llevan al laboratorio. 12.
(17) TABLA 2.. Sustancias utilizadas para la observación de hongos.. Producto A. Montaje sin Coloración - Lactofenol de Amann (11) Rienol Acido láctico Glicerina Agua destilada. Cantidad. 10 g 10 ml 20 g 10 ml. El phenol debe adicionarse de último. Guardar en frascos oscuros. B. Montaje en coloración - Lactofenol con azul de algodón (10) Se obtiene adicionando 0.1 a 0.5% de azul de algodón al lactofenol. - Azul de Trypano (7) Phenol Glicerina Acido láctico Azul de trypano Etanol (96%). 10 g 10 g 10 ml 0.03 g 15 ml. Es una ligera variación de lactofenol con azul de Trypano. C. Soluciones para aclaramiento - Lactofenol de Amann En ebullición se acelera la decoloración del tejido vegetal. - Solución de Hidrato de Cloral (7) Hidrato de Cloral Agua destilada. 5g 2m1 13.
(18) Continuación Tabla 2. Producto. antidad. D. Solución fijadora (7) Acido acético Glicerina Agua destilada. SmI 20m1 75m1. E. Medios de Cultivo - Mycophyl-Agar (14) Peptona. lOg. Dextrosa. lOg. Agar. 17g. La peptona se puede sustituir por decocción de 300 g. de soya para un litro de preparado. F. Solución AFA Alcohol (95%). 50 ml. Formaldehido. lOmi. Acido acético. 5ml. Agua. 14. 35m1.
(19) 5. TECNICAS PARA EL MONTAJE. Son varios los métodos para hacer montajes de tejidos que faciliten el diagnóstico de Sigatoka negra.. 5.1 LA IMPRONTA Consiste en aplicar y presionar sobre el envés de la muestra un trozo de cinta adhesiva transparente. Posteriormente la cinta se retira, se extiende sobre una placa impregnada con lactofenol y se observa al microscopio. La impronta se puede efectuar en el campo, con lo cual se evita la movilización de material vegetal; así mismo, el lactofenol de Amann (Ver Tabla 2) mata las estructuras adheridas a la cinta, brindando seguridad en la no diseminación del patógeno.. 5.1.1 Materiales a utilizar Laminas portaobjetos, laminas cubreobjetos, cinta adhesiva transparente, un frasco gotero que contenga solución colorante, lactofenol con azul de algodón, (Ver Tabla 2), bolsas plásticas dobles, una cuchilla de rasurar nueva y una caja portaobjetos. (Figura 11). 15.
(20) 1 III. 1 •. 1. FIGURA 11. Elementos utilizados para hacer Improntas.. 5.1.2 Procedimiento Con los elementos mencionados se va al lote enfermo o sospechoso, y se procede a tomar la muestra en la forma siguiente: .1. Seleccionar y cortar parte de la hoja. Por el envés extender un trozo de cinta adhesiva transparente sobre la mancha, presionar suficientemente con la uña o un lápiz de tal forma que no rompa la cinta y luego desprender cuidadosamente. (Figura 12). 16.
(21) FIGURA 12. Impronta-. .2.. Depositar una gota de solución colorante sobre una lámina portaobjeto y sobre esta extender la cinta adhesiva. Agregar otra gota de solución sobre la cinta y colocar una placa cubreobjeto. Rotular y empacar en la caja de portaobjetos. Por precaución se debe envolver la caja en una bolsa plástica doble.. .3.. Examinar al microscopio. 17.
(22) 5.2 MONTAJE DE RASPADURAS EN AGUA Este tipo de montaje es útil cuando se desean hacer preparaciones de estructuras que se desarrollan superficialmente en el material enfermo. Para realizarlo, deberá pasarse una aguja sobre la superficie de las lesiones (Figura 13) y transferir luego lo raspado a una placa portaobjetos a la cual previamente se le ha colocado una gota de agua destilada o de soluci6n para montajes.. FIGURA 13. Montaje de Raspaduras. 18.
(23) 5.3 CORTES DE TEJIDO La ejecución de cortes manuales es una de las técnicas más empleadas por el ICA en Urabá para el diagnóstico de M. fijiensis. Esta técnica es una adaptación y complemento a la propuesta por French y Hebert (5) para el diagnóstico de enfermedades. 5.3.1 Materiales a utilizar Agujas de disección, vaso de precipitados, cuchillas de rasurar, láminas portaobjetos, láminas cubreobjetos, solución solución clarificadora, lactofenol de Amann, colorante lactofenol con azul. le algodón, selladores. agua destilada (Ver Tabla 2).. 5.3.2 Procedimiento Para realizar la técnica del corte manual de tejidos, se deben seguir las indicaciones siguientes: .1.. Seleccionar el síntoma buscando que la muestra sea lo más delgada posible.. .2.. Si la muestra es gruesa, hacer un corte del tejido con la cuchilla de rasurar para separar el envés del resto de la muestra, que seré el material a utilizar (Figura 14). 19.
(24) •. •. wi, ig... -. •. FIGURA 14. Cortes de Tejido.. Despuntar o cortar el borde superior izquierdo para facilitar la identificación del envés. El corte ideal es aquel que provee una lámina del envés casi transparente, la cual no ha sido tocada con los dedos para no dañar las estructuras del hongo presentes en la superficie. .3.. Seleccionar los mejores cortes y con las agujas de disección transferir a un vaso de precipitados que contenga lactofenol.. .4.. Hervir la muestra durante 5 a 10 minutos. Con esto se procura la decoloración del tejido.. 20.
(25) .5.. Colocar una gota de solución colorante en una lámina portaobjetos y transferir la muestra teniendo en cuenta que el envés dé hacia el observador. Esto se logra al colocar el borde despuntado hacia su parte superior izquierda. Colocar una lámina cubreobjetos.. .6.. Observar al microscopio. Cuando se advierte la presencia de los conidióforos caracterTsticos y la cicatriz basa] en el conidio, el diagnóstico es positivo para M. fijiensis.. 5.4 METODO DE TINCION DE HONGOS EN TEJIDOS AFECTADOS CON DECOLORACION DE LA HOJA El método de la tinción de hongos en tejidos afectados con decoloración de la hoja utiliza varias soluciones entre colorantes y fijadoras, con las cuales primero se tiñe el hongo y posteriormente se clarifica el tejido de la hoja. Esta técnica fue recomendada recientemente por H. Lehrnann-Danzinger (7) con buenos resultados.. 5.4.1 Materiales a utilizar Frascos de vidrio, cuchillas de rasurar, laminas portaobjetos y cubreobjetos, selladores, solución colorante azul de trypano, solución clarificadora de hidrato de cloral, solución fijadora (Tabla 2). 21.
(26) 5.4.2 Procedimiento .1.. Cortar pedacitos de la muestra de un tamaño menor que el cubreobjeto procurando no tocar con los dedos la superficie de la hoja para evitar que se destruyan las estructuras del hongo localizadas externamente.. .2.. Colocar los trocitos en un frasco de vidrio que contenga 3 ml de solución colorante. Calentar hasta que aparezcan burbujas y mantener asT por unos 10 minutos.. .3.. Hacer dos lavados con agua después de la tinción cuidando no agitar demasiado.. .4.. Una vez vaciada el agua, agregar unos 5 ml de solución de hidrato de cloral y mantener durante 24 horas. En caso de que esta solución se vuelva muy oscura es necesario cambiarla y dejarla otras 24 horas.. .5.. Hacer los montajes con solución fijadora. Después de verificar que el lado con las estructuras del hongo se encuentra hacia arriba, sellar el cubreobjeto con esmalte de uñas o bálsamo de Canadá. También se pueden montar las muestras en los diversos líquidos de montaje disponible.. .6. Examinar al microscopio. 22.
(27) 5.5 MONTAJE A PARTIR DE CULTIVOS PUROS Los cultivos puros permiten una identificación sobre los conidios formados en un cultivo de P. fijiensis obtenido a partir de ascosporas del hongo provenientes de los peritecios presentes en el tejido necrosado. Esta técnica aunque es muy efectiva, tiene la desventaja que la colonia del hongo esporula pobremente y solo cuando esta joven, por lo cual en ocasiones es dispendioso observar los conidios. 5.5.1 Materiales a utilizar Agujas de disección, cajas de petri con medio agaragua, tubos de ensayo con medio mycophyl-agar, solución colorante de lactofenol inás azul de algodón, selladores, agua destilada. 5.5.2 Procedimiento Para obtener ascosporas de las muestras de tejido necrosado por efecto de la enfermedad, se procede de la forma siguiente: .1. Se cortan trocitos de hoja, aproximadamente 2 cm de lado, se humedecen durante 5 minutos en agua, se adhieren a un papel de filtro húmedo y se colocan en la tapa de una caja de petri. El envés de la hoja que normalmente posee más peritecios que el haz, se dirige hacia el medio del cultivo al tapar las cajas. (Figura 15). 23.
(28) FIGURA 15. Descarga de Ascosporas.. .2.. Una hora después de haber colocado los trozos de hoja a descargar, se observan las ascosporas sobre el medio del cultivo. Con una aguja de disección de punta triangular que facilita el corte del medio, se transfieren las ascosporas con una cantidad mínima de agar a tubos de ensayo con mycophyl-agar. (Figura 16).. .3.. Aproximadamente 10 días después de la, siembra en los tubos se pueden obtener conidios de la colonia desarrollada. Utilizando una aguja de disección se realiza un raspado suave de la colonia y se transfiere a una placa portaobjetos a la cual se le coloca una gota de lactofenol más azul de. 24. algodón..
(29) (Ç. 0. FIGURA 16. Siembra.. .4. Se observa al microscopio. Aunque cualquiera de las técnicas de diagnóstico descritas anteriormente produce buenos resultados, su elección dependerá de la disponibilidad de materiales, de la preferencia del técnico y de las necesidades de clí nica y diagnosis a que hubiere lugar.. 25.
(30) NOTA IMPORTANTE: Después de procesar y analizar las muestras en el laboratorio, éstas se deben esterilizar en autoclave a 15 libras de presión durante 20 minutos.. 26.
(31) REFERENCIAS BIBLIOGRAFICAS. 1.. ALEXOPOLUS, C.J. Introductory Mycology. Second edition. John Wiley & Sons Inc. U.S.A. 1962, 613 p.. 2.. DEIGI-ITON, F.C. Studies on Cercospora and Allied Genera VI. Pseudocercospora Speg. Pantosfora Cif and Cercoseptoria Petr. CM¡ Mycological paper 1976, N 2 140:148.. 3.. DEIGHTON, F.C. Studies Qn Cercospora and Allied Genera VII. New Species and redispositions. CMI Mycological paper 1979, N º 144:47-53.. 4.. DUPONT LATIN AMERICA. Sigatoka Negra y Amarilla, Técnicas Mejoradas e Identificación. Coral Glabes. Florida, 1984.. S. FRENCH, E.; HEBERT, T. Métodos de Investigación Fi t opa t o lógica.. Instituto Interamericano. de Cooperación para la Agricultura.. lIGA.. San José, Costa Rica. 1980, 289 p. 6. GONZALEZ, P.M.. Enfermedades del follaje en. el banano. Departamento de Investigaciones de Bandeco S.A. Guatemala. 1980, 9 p. (Mimeografiado).. 27.
(32) 7.. LEHMANN-DANZINGER, H. Métodos de tinción de hongos en hojas foliares con aclaramiento de las hojas.. In:. Curso Internacional sobre. Sigatoka Negra en Urabi, Colombia.. 1984,. 2pp (Mimeografiado). 8.. MAYORGA, P.M.H.; MATEUS, G.J. La diseminación de Sigatoka Negra en Urab. Ascolfi Informa 11:10-11, 1985.. 9.. MEREDITH, D.S.; LAWRENCE, J.S. Morphology of the conidial State of Mycosphaerella musicola in the Pacific Region. Trans. Br. Mycol. Soc. 1970, 54:265-281.. 10. MULDER, J.L.; STOVER, R.H.. Mycosphaerella. Species Causing Bananas Leaf Spot.. Trans.. Br. Mycol. Soc. 1976, 67:77-82. 11. SARASOLA, A. Fitopatología. Curso Moderno. Editorial Hemisferio Sur. Buenos Aires, Argentina, 1975. 12. STOVER, R.H. Banana Plantain and Abaca Diseases. Comm. Mycol. lnst. Kew. 1972. 13.. . Sigatoka Leaf Spots of Bananan and Plantains. In: Proceedings of Sigatoka Workshop. Edited D.T. Krigsvold and T.K. Wood, La Lima (Honduras), 1980.. 14. TUITE, J.. Plant Phatological Methods.. Publishing Company. U.S.A., 1969. 28. Burgess.
(33) Publicación del ¡CA Código. :. 05-06-041-87. Edición. :. l.A.M.Sc. Octavio Cardona García. Arte y Diagramación :. James Peñaloza Acosta. Impresión. Unidad de Impresión ¡CA Pasto. :. 29.
(34)
Figure



Documento similar
De hecho, este sometimiento periódico al voto, esta decisión periódica de los electores sobre la gestión ha sido uno de los componentes teóricos más interesantes de la
Ciaurriz quien, durante su primer arlo de estancia en Loyola 40 , catalogó sus fondos siguiendo la división previa a la que nos hemos referido; y si esta labor fue de
Las manifestaciones musicales y su organización institucional a lo largo de los siglos XVI al XVIII son aspectos poco conocidos de la cultura alicantina. Analizar el alcance y
Este acercamiento entre Roma y la Gran Bretaña lo atribuía Azara al Padre Ricci, general de los jesuítas (1758-73), quien, siempre ateniéndonos al juicio del agente, había
Para ello, trabajaremos con una colección de cartas redactadas desde allí, impresa en Évora en 1598 y otros documentos jesuitas: el Sumario de las cosas de Japón (1583),
dente: algunas decían que doña Leonor, "con muy grand rescelo e miedo que avía del rey don Pedro que nueva- mente regnaba, e de la reyna doña María, su madre del dicho rey,
Entre nosotros anda un escritor de cosas de filología, paisano de Costa, que no deja de tener ingenio y garbo; pero cuyas obras tienen de todo menos de ciencia, y aun
Habiendo organizado un movimiento revolucionario en Valencia a principios de 1929 y persistido en las reuniones conspirativo-constitucionalistas desde entonces —cierto que a aquellas