Efecto de la aplicación foliar de ácidos fúlvicos en conjunto con potasio, magnesio y boro en variedad cabernet sauvignon (vitis vinifera L )
Texto completo
(2) Agradecimientos. A la Pontificia Universidad Católica de Chile, por aceptarme a ser parte de esta gran y renombrada institución. Todos los agradecimientos a la empresa CBMG, en especial al Sr. Víctor Cárdenas, que sin su ayuda financiera y sus ganas de investigar más sobre este tema, esta investigación nunca hubiera sido posible. A la Dra. Claudia Bonomelli, por su ayuda incondicional, su paciencia infinita y sus ganas de seguir en esta investigación. A la Dra. Tania Zaviezo, por su ayuda, para presentar esta tesis. Al Dr. Alonso Pérez, por sus enseñanzas sobre viticultura. A mis padres, Profra. Nora Salazar Fernández, y Dr. Rubén López Cervantes, por nunca perder la fe en mí y en mi investigación. Por estar siempre para escucharme y enseñarme de la vida. A mi hermano, Dr. Rubén López Salazar, por todos los días de risas, ideas al aire y recuerdos infinitos. A mi sobrina, Nuyen Mussaret López Díaz, por ser la alegría de nuestras vidas. A todos los amigos que hice en este largo camino del estudio. Pero sobre todo, al largo y angosto país llamado Chile, por abrirme las puertas de par en par y enseñarme grandes lecciones de vida.. 2.
(3) A mis padres, a ustedes todo lo logrado.. 3.
(4) ÍNDICE. Abstract ....................................................................................................................... 5 Introducción ................................................................................................................ 6 Hipótesis .................................................................................................................... 19 Objetivo...................................................................................................................... 19 Objetivo Específico ................................................................................................... 19 Materiales y Métodos ................................................................................................ 20 Resultados y Discusión ............................................................................................ 28 Conclusiones............................................................................................................. 52 Resumen .................................................................................................................... 53 Referencias ................................................................................................................ 54 Anexos ....................................................................................................................... 65. 4.
(5) EFECTO DE LA APLICACIÓN FOLIAR DE ÁCIDOS FÚLVICOS EN CONJUNTO CON POTASIO, MAGNESIO Y BORO EN VARIEDAD CABERNET SAUVIGNON (Vitis vinifera L.). Nora Zulema López Salazar. Abstract. Efect of fulvic acids through foliar application in complement with potassium, magnesium and boron in Cabernet sauvignon (vitis vinifera L.) The main aim of this work was to evaluate the effect of the foliar application of fulvic acids in conjunction with mineral elements (K, Mg, B). The experiment was located in El Ñilhue, Catemu. The vegetative material used was vitis vinifera, in the vegetative cycle of the years 2014-2015. The experimental design used was random blocks with 5 treatments and a control, where the SAS package was used to obtain the analysis of variance using the Tukey test (p<0.05). Performance variables were measured as shoot length, number of bunches per plant and number of berries per bunch, as well as total weight of bunches per plant, and chemical measurements of the grape as: soluble solids (ºBrix), total acidity, pH of the juice, ending with evaluation of the percentage of dry matter of the fruit and concentration of elements. It is concluded that, the application of fulvic acids, separately and in complement with the elements, did not present significant statistical difference and did not increase the yield parameters, as well as the chemical parameters evaluated in the berries, because the supply of nutrients in the soil was at an adequate level and in some cases, above what is necessary. Key words: fulvic acids, foliar, Vitis vinifera, Cabernet sauvignon.. 5.
(6) Introducción El vocablo “humus”, tiene origen en el tiempo de los romanos, éste término fue utilizado para referirse al suelo. Sin embargo, después de un tiempo, esta misma palabra fue utilizada para denominar a la materia orgánica. La definición principal de humus, para utilizarla como referente a la materia orgánica, es empleada hasta 1761 (Stevenson, 1982).. De acuerdo con Stevenson (1994), la materia orgánica del suelo está formada por la totalidad de las substancias de tipo orgánico, mientras que Drozd et al. (1996) agregan que también se incluyen los restos de tejidos vegetales y animales inalterados, sus productos de descomposición parcial, biomasa del suelo, la fracción orgánica soluble en agua y la materia orgánica estabilizada: el humus.. Figura 1. Clasificación de materiales orgánicos del suelo. Drozd et al. (1996).. La materia orgánica, es el elemento principal de donde las substancias húmicas son extraídas, Burdon (2001), la define como una mezcla de plantas y de constituyentes. 6.
(7) microbianos en etapas de descomposición (plantas, mezclas microbianas de hidratos de carbono, proteínas, lípidos, taninos, melaninas y ligninas parcialmente degradadas). Son consideradas una categoría de materiales de origen natural encontrados o extraídos de los suelos, sedimentos y aguas naturales (Aiken et al, 1985; MacCarthy, 2001). Estas substancias las podemos encontrar en todos los ambientes terrestres y acuáticos (Thurman, 1985) y se han identificado varios componentes, tales como aminoácidos, azúcares y polisacáridos, que son co-aislados con el material húmico (MacCarthy, 2001).. Al ver a las substancias húmicas desde un punto de vista geológico, se dice que son productos químicos entre las plantas y los fósiles. Es inevitable que la naturaleza química de los suelos, lodos y sedimentos de donde se extraigan dichas substancias cambien, ya que a través de la conversión y la degradación de la materia orgánica, este cambio se da naturalmente (Ziechman, 1994). Sin embargo, varios autores mencionan que la composición elemental de las substancias húmicas (SH), son C, H, O, N y S; dichos elementos siempre están presentes independientemente de su origen, país o continente de donde se hayan extraído (Tan 2003, Kurková et al. 2004). Cooper (1999), menciona que dichas substancias, son esencialmente un componente de la materia orgánica (MO), y se pueden encontrar en ríos, lagos y en suelos que contengan un elevado nivel de MO. Una fuente muy común de SH, es la Leonardita y la turba.. Las SH, son el mayor componente de la MO (Halime et al. 2011), se distribuyen extensamente sobre la superficie de la tierra (Schnitzer et al. 1978) y su presencia en el medio ambiente ha sido reconocida (Kononova, 1966; Orlov, 1985). Stevenson (1982), define a las SH, como “una serie de substancias con peso molecular relativamente alto, que presentan coloración de marrón a negro, formadas por reacciones de síntesis secundaria”. Las SH pueden ser descritas como “creadas de forma natural, con alta descomposición de substancias orgánicas en el suelo y poseen estructuras complejas” (Cooper, 1999). Mientras que Bongiovanni y Lobartini en 2009, mencionan que las SH, son una parte de la materia orgánica (MO), y están formadas por moléculas de carácter aromático de. 7.
(8) diferentes pesos moleculares. Schnitzer (1977), menciona que todas las SH son amorfas y son moléculas muy complejas.. Otros autores, como Hayes y Clapp (2001), definen a las SH como los principales componentes de la mezcla de los materiales que forman a la MO del suelo, las cuáles representan la mayor parte del material orgánico en el medio ambiente, y que en conjunto, son complicadas mezclas de restos orgánicos que han sido transformados biológicamente.. Oglesby et al. (1967) suponen que las substancias húmicas tienen su origen en la lignina. Esto se debe a que se ha encontrado que los polifenoles se derivan principalmente de la biodegradación de la lignina, por lo cual, éstos pueden ser considerados los agentes principales en la formación de substancias húmicas; es decir, los polifenoles pueden ser considerados como precursores de los ácidos húmicos. El sistema de substancias húmicas, se crea por la asociación de distintos componentes en el proceso de humificación (como aminoácidos, ligninas, pectinas o hidratos de carbono), (Méndez, et al., 2005). MacCarthy (2001), presenta una definición en donde expone que “El término substancias húmicas se refiere a una categoría de materiales naturales que se encuentran o son extraídos de los suelos, sedimentos y aguas naturales. Son el resultado de la descomposición de los residuos vegetales y animales”.. Dado que las definiciones de dichas substancias no son muy precisas sobre la naturaleza química, Hayes y Clapp (2001), sostienen que las definiciones que se le acuñan a las SH, se establecen en fracciones de la MO del suelo, sedimentos y aguas naturales, y por lo tanto, se basan en los métodos utilizados de su aislamiento y fraccionamiento con el fin de caracterizarlas. Sin embargo, cuando se utilizan procesos químicos para aislar las SH, éstas se alteran, y presentan cambios en su estructura.. El procedimiento de extracción de SH de un suelo, produce tres fracciones principales: ácidos húmicos (AH), ácidos fúlvicos (AF) y huminas (H). (Aiken et al. 1985; Stevenson, 1994; MacCarthy, 2001). Dichas fracciones se definen por su solubilidad en términos acuosos, como una función de pH, o en términos de su capacidad de. 8.
(9) extracción de los suelos como una función de pH del medio de extracción (MacCarthy, 2001). . Ácido húmico: es la fracción de la SH que no es soluble en agua a un pH más bajo que dos, pero si es soluble (o extraíble) en valores de pH más altos (alcalinos).. . Ácido fúlvico: es la fracción de la SH que es soluble en un medio acuoso a todos los valores de pH, contienen más grupos funcionales, particularmente – COOH (Méndez, et al., 2005).. . Humina: es la fracción de la substancia húmica que no es soluble en agua a ningún pH.. Figura 2. Fraccionamiento de las substancias húmicas. Stevenson (1994).. 9.
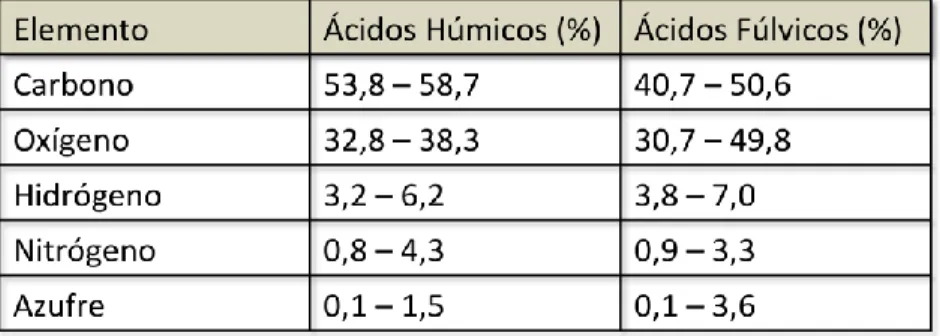
(10) Estructura de las Substancias Húmicas. Dado que las substancias húmicas son materiales muy complejos, se ha buscado formular estructuras moleculares para descubrir las propiedades observadas y su comportamiento. Se han planteado abundantes estructuras de modelos de substancias húmicas (Kononova, 1966; Schnitzer y Khan, 1972; Stevenson, 1982, 1985; Orlov, 1985, Leenheer, 1989; Schulten y Schnitzer, 1993).. Aunque todos los modelos presentados por los diferentes autores, han explicado de cierta forma las propiedades observadas en dichas substancias, también presentan muchas diferencias en cuanto a la distribución de los grupos funcionales, en la naturaleza de la estructura y en la disposición de los restos estructurales.. Como se ha mencionado, la composición elemental de las SH, ), son C, H, O, N y S, (Tan, 2003; Kurková et al. 2004), sin embargo, desde el año 1985, Steelink, realizó un análisis de SH para mostrar el porcentaje de estos elementos (Tabla 1). Tabla 1. Intervalos porcentuales para la composición elemental de las Substancias Húmicas (Steelink, 1985).. Es por eso, que autores mencionan que, la acción de las SH sobre el suelo y las plantas, se encuentra ligada con el tipo y concentración de grupos funcionales presentes en las mismas. Stevenson (1994) y Varanini et al. (1995), mencionan que las SH presentan grupos funcionales en su mayoría de tipo oxigenado: carboxilos, alcoholes, hidroxilos fenólicos y carbonilos (Tabla 2), además de presencia de grupos nitrogenados, aunque también se pueden encontrar éteres, hidroxiquinonas, lactonas.. 10.
(11) Los AF presentan un mayor número de grupos funcionales de carácter ácido que los AH (Stevenson, 1994; Schnitzer, 1990), entre los que se destacan los grupos carboxilos y fenoles. En los AH la mayor parte del oxígeno se encuentra formando parte del núcleo o estructura central, en uniones éter o éster, mientras que para los AF está como COOH, OH o C=O (Stevenson, 1994) (Tabla 3). Se puede mencionar que los AF presentan mayor acidez que los AH, debido a su mayor contenido de grupos carboxilo e hidroxilo (Ramos, 2000). Tabla 2. Grupos funcionales presentes en las Substancias Húmicas.. 11.
(12) Tabla 3. Distribución de grupos funcionales oxigenados es Substancias Húmicas (meq/100g). (Stevenson, 1994).. A pesar de saber que las SH contienen diferentes tipos de grupos funcionales, no se ha llegado a una estructura final. Schnitzer (1990), empleó la resonancia de espín electrónico, espectrometría de masas y recopiló datos en donde menciona que estas complejas estructuras están constituidas por anillos aromáticos.. Mientras tanto, Linehan (1977), menciona que las SH son unas complejas macromoléculas, que pueden llegar a dimensiones variadas, desde unos pocos Da, hasta miles. Un ejemplo de la estructura de AH es creada por Hatcher et al. (1994), (Figura 3).. 12.
(13) Figura 3. Estructura propuesta de un ácido húmico por Hatcher et al. (1994). Para concluir, Hayes (1991), menciona que: “No es necesario averiguar de manera precisa la estructura de las substancias húmicas para tener un aceptable conocimiento de la importante función de las mismas”.. Extracción de Substancias Húmicas. Las substancias húmicas por lo general son extraídas de suelos y sedimentos por medio de un tratamiento al sustrato con una solución básica (Stevenson, 1982; Hayes et al. 2001). Cuando el sustrato es tratado, se identifican dos fracciones, donde los ácidos húmicos y los ácidos fúlvicos se encuentran contenidos en una misma solución, mientras que el residuo (precipitado bajo estas substancias) no extraído contiene la humina no soluble.. Al momento de extraer la solución que contiene los AH y AF, el extracto obtenido es alcalino y se procede a acidificarlo por adición de un ácido fuerte como lo es HCl (ácido clorhídrico), de tal manera que precipita una fracción, y que resulta como los AH, y la otra fracción del material orgánico resultante se definen como los ácidos AF (Stevenson, 1985). En seguida, se lavan los ácidos húmicos para que queden libres de otros materiales, y separar a los AF per se, igualmente de otros materiales, tales como. 13.
(14) cenizas, y convertir absolutamente las fracciones a sus formas de hidrógeno (MacCarthy, 2001).. Cabe mencionar, que el uso de disoluciones alcalinas, generalmente NaOH, aunque también KOH, de 0,1 a 0,5 M, en una relación peso:volumen de 1:2 a 1:5, es la técnica más utilizada para la extracción de las SH de tipo comercial (Ramos, 2000).. Al realizar la extracción y/o aislamiento de las SH, se corre el riesgo inmediato de generar alguna degradación química durante este proceso. Por lo tanto, la base extractante por lo general es una combinación de materiales nativos y alterados. Las SH extraídas se secan con mucha frecuencia, esto debido a la evaporación. Se menciona también, que esto se lleva a cabo por cambios químicos, como por ejemplo, la formación de anhídridos y lactonas y/o por la pérdida de dióxido de carbono, esto sucede cuando las SH se secan, especialmente cuando existen temperaturas elevadas (MacCarthy, 2001).. Existen abundantes procedimientos de extracción, sin embargo, se debe tener en cuenta la naturaleza y concentración del extractante utilizado; la temperatura a la que es realizada la extracción; periodo de contacto con la base y el sustrato del cuál se van a aislar las SH (MacCarthy, 2001).. Características químicas de las substancias húmicas. Hayes (1997), señala que las substancias húmicas poseen muchas funciones importantes, sin embargo, hasta que no se explique la naturaleza de estas substancias, asumiendo que se pueden obtener de diferentes fuentes, no se dará una explicación acertada de dichas funciones. Se sabe que la composición química del material húmico incluye anillos aromáticos que interactúan entre sí y con cadenas alifáticas con respecto al ciclo del Benceno, dando como resultado macromoléculas con diferentes masas. Este mismo autor, menciona que al tener en cuenta la génesis de las SH, se sabe que esto implica muchas combinaciones de distintas vías de reacción y una. 14.
(15) amplia variedad de sistemas de unión química, que deriva en la dificultad de definir claramente un concepto de su composición. La mayoría de los métodos clásicos y originales para entender la naturaleza de las SH se basaron en la composición elemental, pero los resultados obtenidos solo presentan aglomeraciones de moléculas, por lo tanto, es casi imposible derivar fórmulas precisas de esos datos, al igual que el origen de las SH, nunca es el mismo (Hayes et al., 1989).. Por lo tanto, la mayoría de los datos sobre estas substancias, se refieren solo a que sus propiedades promedio dan como resultado un gran conjunto de diversas moléculas, y que dichas propiedades de un extracto húmico dependerán del sustrato elegido y de las condiciones determinadas de la extracción (Schnitzer, 1977; Rice and McCarthy, 1991).. Las substancias húmicas presentan una gran abundancia de grupos funcionales que contienen oxígeno (carboxilos, fenólicos y alcohólicos), su presencia define sus propiedades químicas (MacCarthy, 2001), se describen como moléculas poliméricas (constituyentes moleculares más grandes), sin embargo, no ha sido posible identificar una estructura molecular única o alguna unidad estructural que sea repetitiva en dichas substancias (Hayes et al., 1989). Funciones de las substancias húmicas. Muscolo et al. (2007), proponen que para entender la actividad biológica de las SH en aspectos del crecimiento y metabolismo de las plantas, el efecto está relacionado con la fuente, concentración y fracción húmica del peso molecular de la SH. Es decir, que si una fracción de SH de tamaño molecular bajo (<3500 Da) alcanza fácilmente la membrana celular de las células vegetales y se continua a su absorción, con actividad similar a la que produce el ácido indolacético (AIA); sin embargo, una fracción de tamaño molecular alto (<3500 Da) no se absorbe y solamente puede interactuar con la pared celular.. 15.
(16) Por lo tanto, mismos autores mantienen que las SH de bajo tamaño molecular, son los agentes encargados de realizar efectos a nivel de la membrana plasmática en la absorción de nutrientes, en especial la de nitratos.. Los efectos sobre el metabolismo son menos conocidos, pero las SH pueden influir tanto en la respiración como en la fotosíntesis, ya que dichas substancias muestran una actividad similar a las hormonas; dicha actividad, no se encuentra estrictamente vinculada a la estructura química de las SH o si depende de hormonas de origen microbiano que se encuentran en su naturaleza (Muscolo et al. 2007). Investigaciones realizadas por Piccolo (2001, 2002), menciona que las SH son supramoleculas y su estabilidad y actividad dependen de la fuerza iónica de la solución y del pH del ambiente.. Sin embargo, una combinación de técnicas de genética y biología molecular (Dobbss et al., 2010; Trevisan et al., 2009, 2011) y cromatografía de gases (Jindo et al., 2012), han confirmado la presencia de ácido indolacético en las SH. La manera en la que el AIA se encuentra vinculado a las SH aún no se explica bien (Schulten et al. 1998), sin embargo, se sabe que los grupos carboxílicos de las SH parecen ser receptores para el AIA y así, regular su disponibilidad (Canellas et al., 2002, 2010; Jindo et al., 2012; Muscolo et al., 2007a, b).. Halime et al. (2011), mencionan que las SH son utilizadas como fertilizantes para mejorar la estructura del suelo y promover el aumento y desarrollo de los microorganismos. Se ha detectado que a bajas concentraciones, las substancias húmicas mejoran la elongación celular en raíces (Vaughan y Malcom, 1985; Nardi et al., 1996). Estimulan el desarrollo de las poblaciones de la microflora del suelo y aumentan la tasa de germinación de semillas (Senesi et al. 1991). A concentraciones más altas, inhiben el crecimiento, por lo que su efecto se ha relacionado con el método de acción similar a las hormonas (Bhardwaj et al., 1970; Haan, 1974; Tan y Nopamornbodi, 1979; Vaughan, 1969).. 16.
(17) Varios autores aseguran que se ha demostrado que las SH estimulan el crecimiento de brotes, crecimiento de la raíz y la absorción de nutrientes en cultivos de hortalizas (Tattini et al, 1990; Padem et al., 1997; Akinremi et al, 2000; Cimrin y Yilmaz, 2005). Las aplicaciones foliares de estas substancias, de igual manera promueven el crecimiento, rendimiento y calidad de numerosas especies de plantas (Brownell et al, 1987; Yildirim, 2007).. Tal como lo demuestran Karakurt et al. (2009), en su investigación sobre aplicaciones foliares (pulverización) y al suelo (empapado de la raíz) de SH a pimiento, mediante el crecimiento de las plantas en intervalo de 15 días desde la siembra. Usaron diferentes dosis desde 0 ml, hasta 40 ml de SH. Concluyen que la aplicación de AH a una dosis de 20 ml, aumentó a 63 ton/ha en la cosecha, mientras que la aplicación de AF a una dosis igual, aumentó a 73 ton/ha en la cosecha y que el control (0 ml), tuvo una cosecha de 57 ton/ha-1.. Macroelementos. Potasio. El potasio (K), es un elemento esencial para la nutrición de las plantas, ya que tiene la capacidad para influir en el crecimiento meristemático (Mengel et al., 1987).. Se. encuentra disponible para la absorción de raíces en la solución del suelo como ion K+ (Gil y Pszczólkowski, 2007). Dicho elemento es un nutriente importante para la vid, ya que representa el catión más abundante en la baya (Hradzina et al., 1984). Es altamente móvil en el floema (Mengel y Pflüger, 1969), y el K se acumula principalmente en los tejidos de la piel de la baya durante la maduración como resultado de la removilización de K de hojas maduras (Coombe, 1992). La deficiencia de K, se puede observar en el pardeamiento en las hojas de las porciones medias del brote (Gärtel, 1988).. Magnesio El Magnesio (Mg), se encuentra en la solución del suelo como ion Mg++, de esta forma es absorbido por las raíces (Gil y Pszczólkowski, 2007). El Mg interviene en funciones. 17.
(18) vitales para la planta como lo son la fotofosforilación, fijación fotosintética del dióxido de carbono (CO2), síntesis de proteínas, formación de clorofila (Cakmak, et al. 1994). La deficiencia de Mg se puede notar por el amarillamiento en forma de clorosis intervenal en las hojas viejas.. Microelementos. Boro. El boro (B) es un micronutriente esencial para las plantas, ya que los requerimientos de boro se hacen esenciales de forma pararela a la lignificación y diferenciación xilemática del reino vegetal (Alarzón, 2001). Se encuentra como H3BO3 a pH ácido, forma disponible para la absorción, y como B(OH)4- a pH alto, poco disponible y fijado (Gil y Pszczólkowski, 2007). Las funciones del B en la planta van enfocadas al transporte de azúcares y forma parte importante del citoesqueleto, de igual manera, este elemento es esencial en el desarrollo del tubo polínico (Gil y Pszczólkowski, 2007). Los síntomas de deficiencia de este elemento es la disminución del tamaño y porte de la planta, haciéndola quebradiza y clorosis foliar con pigmentos de color púrpura (Martínez, 2009).. 18.
(19) Hipótesis 1. Dado que los ácidos fúlvicos son catalogados como bioestimulantes, mediante la aplicación vía foliar, mejorarán parámetros de rendimiento en Vitis vinifera cv. Cabernet sauvignon. 2. La aplicación foliar de ácidos fúlvicos en conjunto con elementos minerales como K, Mg y B, mejorarán características químicas de la baya.. Objetivo Evaluar el efecto de la aplicación foliar de substancias fúlvicas en complemento con elementos minerales, en parámetros de rendimiento y características químicas de las bayas, en Vitis vinifera cv. Cabernet sauvignon.. Objetivo Específico -. Evaluar el efecto de los ácidos fúlvicos y su complemento con elementos minerales (K, Mg y B), en parámetros de rendimiento del huerto, como lo son: crecimiento de brote, número de racimos por planta, peso total de racimo por planta y número de bayas por racimo.. -. Evaluar el efecto de los ácidos fúlvicos en conjunto con elementos minerales (K, Mg y B), en características químicas de la baya como lo son: sólidos solubles, acidez total y pH del jugo de uva.. -. Evaluar el efecto de los ácido fúlvicos y su complemento con elementos minerales (K, Mg y B), en la condición nutricional del fruto.. 19.
(20) Materiales y Métodos Localización del experimento. La investigación se llevó a cabo en El Ñilhue, localidad de Catemu, en la V región, durante el ciclo vegetativo del año 2014-2015. Las coordenadas del lugar son 32º 42, 4727 Sur y 70º 54, 9584 Oeste.. El material vegetal utilizado fue Vitis vinifera, variedad Cabernet sauvignon, el viñedo está plantado a una distancia de 2.5 m entre surcos y 2 m entre plantas (2000 plantas por hectárea), con orientación de hileras norte-sur, establecidas en 2010, con sistema de conducción en cordón unilateral, espaldera vertical y sistema de riego por goteo.. Figura 4. Ubicación del viñedo usado en la localidad de El Ñilhue.. 20.
(21) Figura 5. Localización del viñedo.. El diseño experimental consistió en una serie de cinco tratamientos, con la aplicación de ácidos fúlvicos solo o con la adición de los macronutrientes potasio y magnesio y el boro como micronutriente, además de un control (agua). (Tabla 5).. Figura 6. Aplicación de tratamientos foliares a Vitis vinifera cv. Cabernet sauvignon.. 21.
(22) Análisis del producto. Previo a determinar la dosis a usar, mediante análisis de laboratorio, se realizó la caracterización de la concentración de minerales contenidos en los ácidos fúlvicos, (Tabla 4).. Tabla 4. Contenido de minerales en los ácidos fúlvicos. Elemento. Concentración. Valor. K. %. 3,44. Mg. %. 0,75. B. mg/L. 215. Tabla 5. Tratamientos aplicados a las plantas de Cabernet sauvignon. Tratamiento. Concentración. Dosis /planta. Unidad/planta. To. Control (agua). 0. 1500ml. 75ml/planta. T1. Producto (ác.fulvicos. Ác. fúlvicos: 36%. 30ml/1500ml. 75ml/planta. + sulfato de K + sulfato. Sulfato de K 7.67%. de Mg + ác.bórico). Sulfato de Mg 7.61% Ác.bórico 0.12%. T2. Ácidos fúlvicos. 36%. 30ml/1500ml. 75ml/planta. T3. Ác. fúlvicos + sulfato. Sulfato de K, 7.67%. 2.30mg/1500ml. 75ml/planta. Sulfato de Mg, 7.61%. 2.28mg/1500ml. 75ml/planta. Ácido bórico, 0.12%. 0.036mg/1500ml. 75ml/planta. de K. T4. Ác. fúlvicos + sulfato de Mg. T5. Ác. fúlvicos + ac. bórico. 22.
(23) Análisis de suelo. Las evaluaciones se iniciaron primero con un muestreo de suelo por unidad experimental para regularizar condiciones del viñedo, ya que con este análisis se pretende caracterizar el estado nutricional del suelo. Esta evaluación constó de medición de pH mediante el uso de un pH-metro, conductividad eléctrica (CE), para conocer la medida de salinidad. Estas mediciones de un suelo se midieron en el sobrenadante de una solución de suelo y agua destilada en la proporción 1:2,5. Además, se determinó P, K, Mg y B, los elementos K y Mg se determinaron mediante espectrometría de absorción atómica y B a través de colorimetría.. Figura 7. Toma de muestras de suelo en el viñedo, localidad El Ñilhue.. Análisis foliar. Se realizó un muestreo inicial (24 de octubre de 2014), previo a la aplicación de los tratamientos, para diagnosticar y verificar variabilidad inicial del viñedo, durante todo el ciclo se realizó un muestreo más (Tabla 6). Las muestras foliares se tomaron de hojas maduras, igualando tamaño y color, las hojas muestreadas en la cosecha (20 de marzo de 2015), fueron las ubicadas en la posición opuesta al racimo. Estas muestras fueron colocadas en bolsas de papel previamente marcadas con el tratamiento y llevadas al laboratorio de Análisis de suelos de la Pontificia Universidad Católica de Chile.. 23.
(24) Tabla 6. Fechas de muestreos foliares en variedad Cabernet sauvignon. Número de muestreo foliar. Estado fenológico. Fecha. Inicial. Establecimiento del. 24 de octubre de 2014. experimento Final. Cosecha. 20 de marzo de 2015. Se aplicaron los tratamientos en los cinco estados fenológicos (Tabla 7), de acuerdo a la recomendación del producto.. Tabla 7. Aplicación de tratamientos en estados fenológicos de Vitis vinifera cv. Cabernet sauvignon. Número de aplicación. Estado fenológico. Fecha. Primera. Floración, 80% de flores. 13 de noviembre de 2014. abiertas Segunda. Cuaja. 27 de noviembre de 2014. Tercera. Desarrollo de racimo. 17 de diciembre de 2014. Cuarta. Crecimiento de baya. 30 de diciembre de 2014. Quinta. Envero. 2 de febrero de 2015. En laboratorio, la muestra foliar pasó por un proceso de preparación, el cual consiste en lavado, secado y molienda para posteriormente realizar los análisis indicados. Estos análisis midieron el porcentaje de N, por el método de combustión en equipo LECO. El K, Ca, Mg, Cu, Fe, Zn y Mn, se miden por calcinación a 500°C en una mufla, hasta la destrucción total de la parte orgánica, convirtiéndolas en cenizas, las que contienen los elementos que se buscan analizar. Las cenizas que se obtuvieron se disuelven en ácidos diluidos y en ese extracto se determinaron las concentraciones en un equipo de absorción atómica. El P y el B, después de la calcinación y dilución de la muestras, se formó un complejo con molibdato-vanadio, para ser llevado posteriormente a un espectrofotómetro de absorción molecular.. 24.
(25) Figura 8. Toma de muestras foliares en el viñedo en Vitis vinifera cv. Cabernet sauvignon.. Evaluación en campo. La evaluación en campo fue la medición del largo del brote, en donde de las 4 plantas que formaron el tratamiento, se seleccionaron las dos centrales, se eligió un brote al azar y a continuación se marcó con una cinta. Dicho brote se midió en todas las etapas fenológicas del desarrollo para evaluar tasa de crecimiento.. Figura 9. Brotes marcados y medición de brotes en Vitis vinífera cv. Cabernet sauvignon.. 25.
(26) Mediciones de producción de la uva -. Número de racimos por planta: se realizó el día de la cosecha (20 de marzo de 2015), contando el número de racimos presentes en cada planta.. -. Peso total de racimos por planta: se realizó pesando con una báscula los racimos cosechados de cada planta.. -. Número de bayas por racimo: se muestrearon cinco tipos de racimos (escala de tamaños, chico, mediano y grande), se procedió a pesar una bolsa (461,6 g) y a continuación se realizó una proporción del peso de la bolsa con un promedio de 300 bayas por racimo, haciendo una relación entre el peso para obtener el número de bayas.. Mediciones de la calidad de la uva -. Sólidos solubles: se extrajo el jugo de 10 bayas por cada tratamiento y se midieron los °Brix mediante el uso de un refractómetro manual, marca Atago.. -. Acidez Total: se usó el método de alcalimetría. Se tomaron 3 ml de la muestra (jugo de uva) y se le adicionaron 30 ml de agua destilada, enseguida se le midió el pH y a continuación se tituló con hidróxido de sodio (NaOH) 0.1 N, se tituló hasta pH 8.2, midiendo el gasto de NaOH y expresando la acidez total como g/L de H2SO4.. -. pH del jugo de uva: se extrajo el jugo de 10 bayas de cada tratamiento y se procedió a realizar en análisis mediante el uso de un potenciómetro marca Orion Star A211.. Evaluación del fruto -. Porcentaje de materia seca: se colocaron 60 bayas en una caja Petri de cada tratamiento, se continuó a cortar las bayas con un bisturí hasta sacar las semillas y el jugo por completo, a continuación se procedió a dejar las muestras en una estufa por al menos un día completo, cuando la muestra ya se secó se procedió a analizar la concentración de macronutrientes (Nitrógeno, Fósforo, Potasio, Calcio y Magnesio) y de Boro como micronutriente presentes en la uva.. 26.
(27) Diseño Experimental. Se realizó un diseño completamente al azar con 4 repeticiones. La unidad experimental consistió en 6 plantas, en donde se muestrearon las 4 plantas centrales para evitar el efecto borde (Figura 10). Se empleó el paquete para computador Statistical Analysis System (SAS), versión 9.1, para obtener el análisis de varianza (ANOVA) y se efectuó la comparación de medias, mediante la prueba de Tukey (p<0.05).. T0 R4. T2 R4. T1 R4. T5 R4. T3 R4. T4 R4. T3 R3. T0 R3. T5 R3. T4 R3. T1 R3. T2 R3. T5 R2. T1 R2. T4 R2. T0 R2. T3 R2. T2 R2. T5 R1. T1 R1. T4 R1. T3 R1. T0 R1. T2 R1. T:: Tratamiento R:: Repetición Figura 10. Tratamientos establecidos en campo. 27.
(28) Resultados y Discusión Análisis de suelo. El análisis de suelo inicial se realizó con la intención de homogenizar las condiciones del huerto si fuese necesario, pero los resultados reflejaron que no existe una variación entre las unidades experimentales asignadas a los diferentes tratamientos (p=< 0,05) (Tabla 8), por lo cual se procedió a realizar las aplicaciones sin necesidad de adicionar o corregir los elementos presentes en el suelo.. Tabla 8 . Resultados de los análisis de suelo Tratamientos. pH. CE. P. K. Mg. B. Suspensión T0. 7,01. 0,7. 54,7. 356. 4,4. 1,61. T1. 7,61. 0,5. 25,5. 313. 4,0. 1,24. T2. 7,75. 0,5. 22,7. 293. 3,9. 0,97. T3. 7,46. 0,3. 76,2. 319. 3,9. 1,31. T4. 7,57. 0,6. 21,2. 299. 3,7. 1,00. T5. 7,55. 0,5. 44,0. 308. 4,0. 1,18. p. 0,63. 0,78. 0,18. 0,77. 0,44. 0,15. De acuerdo a los valores adecuados de los niveles de elementos en el suelo, no existe diferencia significativa. Sin embargo, basándose en la referencia de Silva et. al (1995), los valores de CE en suspensión se encuentran 0,20 mS/cm más elevados, al igual que el rango del P y K, donde se encuentran valores más altos en el suelo. El Mg se encuentra en un rango alto, mientras que el B se encuentra en el rango adecuado. Por lo cual, podemos mencionar que el pH del suelo para la vid se encuentra óptimo, y el suelo cuenta con un suministro alto de nutrientes.. 28.
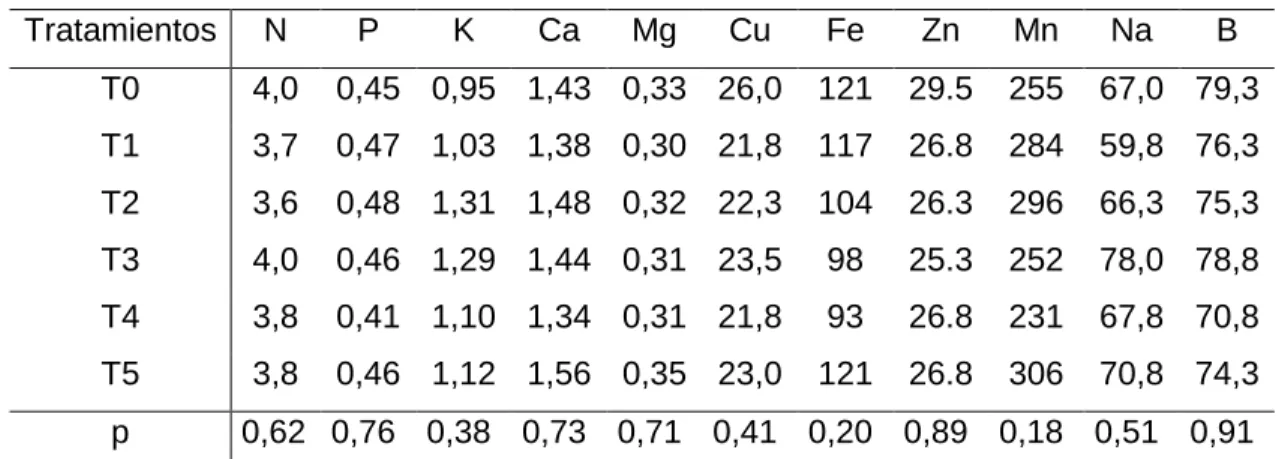
(29) Concentración foliar de elementos. Se realizaron muestreos foliares en dos estados fenológicos (establecimiento del experimento y cosecha), el primer muestreo se realizó el 24 de octubre, para tener un conocimiento previo del estado nutricional de las parras.. En el primer muestreo foliar (Tabla 9), se observó que el estado nutricional de las plantas no presenta diferencia significativa (p>0,05 para todos), por lo cual, se pudo indicar que las parras se encontraban en un estado nutricional similar y óptimo para realizar las aplicaciones foliares y sobre todo, las unidades experimentales presentaron homogeneidad.. Tabla 9. Muestreo foliar inicial, 24 de octubre. Tratamientos. N. T0. 4,0. T1. Fe. Zn. Mn. 0,45 0,95 1,43 0,33 26,0. 121. 29.5. 255. 67,0 79,3. 3,7. 0,47 1,03 1,38 0,30 21,8. 117. 26.8. 284. 59,8 76,3. T2. 3,6. 0,48 1,31 1,48 0,32 22,3. 104. 26.3. 296. 66,3 75,3. T3. 4,0. 0,46 1,29 1,44 0,31 23,5. 98. 25.3. 252. 78,0 78,8. T4. 3,8. 0,41 1,10 1,34 0,31 21,8. 93. 26.8. 231. 67,8 70,8. T5. 3,8. 0,46 1,12 1,56 0,35 23,0. 121. 26.8. 306. 70,8 74,3. p. P. K. Ca. Mg. Cu. Na. B. 0,62 0,76 0,38 0,73 0,71 0,41 0,20 0,89 0,18 0,51 0,91. En el segundo muestreo foliar (Tabla 10), se observó que el estado nutricional de las plantas no presenta diferencia significativa (p>0,05 para todos),sin embargo, podemos mencionar que los niveles de elementos, tales como N, P, y K, disminuyeron, esto relacionado a la absorción que presentan estos nutrientes desde que comienza la temporada hasta la caía de las hojas. En las siguientes tablas (11 a 15), se detalla la concentración foliar de dichos elementos.. 29.
(30) Tabla 10. Muestreo foliar final, 20 de marzo. Tratamientos. N. T0. 1,6. T1. Fe. Zn. Mn. Na. B. 0,12 0,80 2,58 0,54 20,5. 129. 13,7. 266. 125. 42,0. 1,5. 0,15 0,71 2,58 0,53 23,0. 137. 13,7. 266. 191. 45,7. T2. 1,5. 0,19 0,89 2,46 0,56 27,2. 153. 13,7. 276. 170. 61,7. T3. 1,5. 0,16 0,86 2,56 0,55 27,5. 144. 15,7. 283. 162. 62,0. T4. 1,5. 0,13 0,74 2,76 0,56 20,0. 116. 14,0. 276. 165. 53,2. T5. 1,4. 0,14 0,76 2,66 0,57 20,5. 122. 14,2. 325. 162. 39,2. p. P. K. Ca. Mg. Cu. 0,16 0,17 0,48 0,68 0,75 0,21 0,48 0,83 0,47 0,16 0,18. Concentración foliar de Nitrógeno. En la tabla 11, se puede observar la concentración foliar de Nitrógeno en Cabermet sauvignon. Si bien, la concentración de N al inicio del experimento fue de 4%, al terminar el ciclo vegetativo, la concentración fue de 1,6%. Datos que concuerdan con la concentración foliar de N de la variedad Riesling (Waschkies, 1993), en donde menciona que la concentración final de N en la hoja fue de 1,6%. Dichos autores mencionan que la concentración de N en cosecha, se debe a que la parra absorbe al inicio este elemento para el crecimiento vegetativo y a continuación existe traslocación.. Tabla 11. Concentración foliar de N en Cabernet sauvignon, en dos fechas, al inicio del experimento y en cosecha. Tratamientos. N inicial (%). N final (%). T0. 4,0. 1,6. T1. 3,7. 1,5. T2. 3,6. 1,5. T3. 4,0. 1,5. T4. 3,8. 1,5. T5. 3,8. 1,4. p. 0,62. 0,16. 30.
(31) Concentración foliar de Fósforo. En la tabla 12, se puede observar el porcentaje de concentración foliar de P al momento del establecimiento del experimento y el porcentaje final de concentración en la cosecha, en el cuál se observa que el nivel de P al momento de cosecha, disminuyó. En estudios realizados por Gómez et. al (1996), mencionan que el nivel óptimo de fósforo en la parte foliar varía entre 0,2 a 0,3 porciento, rango en el cual, en esta investigación, el fósforo se encuentra, concluyendo que este elemento en la parte foliar se encuentra en un rango normal de concentración de P.. Tabla 12. Concentración foliar de P en Cabernet sauvignon, en dos fechas, al inicio del experimento y en cosecha. Tratamientos. P inicial (%). P final (%). T0. 0,45. 0,12. T1. 0,47. 0,15. T2. 0,48. 0,19. T3. 0,46. 0,16. T4. 0,41. 0,13. T5. 0,46. 0,14. p. 0,76. 0,17. Concentración foliar de Potasio. En la tabla 13, se puede observar la concentración foliar de Potasio en el establecimiento del experimento con un valor de 0,95%, y en cosecha con un valor de 0,8%. Schaller et. al (1992), mencionan que la concentración de K tiende a disminuir en el tiempo por la gran movilización hacia los frutos. Resultado que concuerda con esta investigación, en donde se puede observar una disminución en la concentración de K foliar en cosecha.. 31.
(32) Tabla 13. Concentración foliar de K en Cabernet sauvignon, en dos fechas, al inicio del experimento y en cosecha. Tratamientos. K inicial (%). K final (%). T0. 0,95. 0,80. T1. 1,03. 0,71. T2. 1,31. 0,89. T3. 1,29. 0,86. T4. 1,10. 0,74. T5. 1,12. 0,76. p. 0,38. 0,48. Concentración foliar de Magnesio. En la tabla 14, se puede observar la concentración foliar inicial y final de Mg en los diferentes tratamientos. Si bien, se puede detectar que el nivel final fue mas alto que el inicial, eso debido a lo mencionado por Conradie (1981), donde menciona que el Mg es absorbido mayoritariamente entre brotación y envero, y donde nuevamente empieza a elevar la concentración en cosecha. Comparado con la concentración final, en donde se puede observar una mayor concentración de dicho elemento.. Tabla 14. Concentración foliar de Mg en Cabernet sauvignon, en dos fechas, al inicio del experimento y en cosecha. Tratamientos. Mg inicial (%). Mg final (%). T0. 0,33. 0,54. T1. 0,30. 0,53. T2. 0,32. 0,56. T3. 0,31. 0,55. T4. 0,31. 0,56. T5. 0,35. 0,57. p. 0,71. 0,75. 32.
(33) Concentración foliar de Boro De acuerdo a la tabla 15, en la concentración de boro y con niveles óptimos de boro en el cultivo de la vid (Alarcón, 2001), debe haber una concentración de 30-70 mg/kg. En este trabajo se puede mencionar que el nivel de B foliar se encuentra dentro del rango establecido. Sin embargo, en estudios realizados por Callejas et al., (2014), el nivel de B en cosecha no disminuye y se encuentra en un rango de 80 a 120 mg/kg, por lo cual, se puede observar que hubo un alto contenido de boro. Se puede atribuir esta diferencia a la disponibilidad de dicho elemento, al fruto que funciona como sumidero, y posteriormente al pH (Godoy, 1970; Goldberg, 1997; Hu y Brown, 1997; Bolaños et al., 2004). Tabla 15. Concentración foliar de B en Cabernet sauvignon, en dos fechas, al inicio del experimento y en cosecha. Tratamientos. B inicial (mg/kg). B final (mg/kg). T0. 79,3. 42,0. T1. 76,3. 45,7. T2. 75,3. 61,7. T3. 78,8. 62,0. T4. 70,8. 53,2. T5. 74,3. 39,2. p. 0,91. 0,18. 33.
(34) Concentración de elementos en el fruto. Concentración de Nitrógeno en el fruto. Si bien, en la concentración de N, no existe diferencia significativa (p=0,43), en estudios realizados por Ghisi et. al (1984), al momento de cosecha en la variedad Merlot, el rango de concentración que obtuvieron fue de 100 a 180 mg/100 g, contrastando resultados de esta investigación, donde los niveles de N estuvieron alrededor del rango mostrado por dichos autores, obteniendo 190 mg/100 g en el. Concentración de Nitrógeno en el fruto (mg/100g). tratamiento cuatro. 250 200 150. 100 50 0 T0. T1. T2 T3 Tratamientos p=0,43. T4. T5. Figura 11. Concentración de N en el fruto en la variedad Cabernet sauvignon, al momento de cosecha.. Concentración de Fósforo en el fruto. En la figura 12, de acuerdo a la concentración de P en el fruto, se puede mencionar que no existe diferencia significativa (p=0,54). Rogiers et. al (2006), mencionan que las bayas de Shiraz, obtuvieron un rango de fósforo en el fruto de 32 a 34 mg/100 g, contrastando estos resultados en la variedad Cabernet sauvignon, podemos relacionar que el rango obtenido se encuentra entre 32 a 36 mg/100 g, por lo cuál se puede indicar que la concentración de fósforo en esta investigación, se encuentra dentro del rango normal.. 34.
(35) Concentración de Fósforo en el fruto (mg/100g). 40 35 30 25 20 15 10 5 0 T0. T1. T2 T3 Tratamientos p=0,54. T4. T5. Figura 12. Concentración de P en el fruto en la variedad Cabernet sauvignon, al momento de cosecha.. Concentración de Potasio en el fruto. En la figura 13, se puede observar que no existe diferencia significativa (p=0,49) en la concentración de K en el fruto. Rogiers et. al, (2006), mencionan que el rango de concentración de K en el fruto en variedad shiraz, es de 250 a 280 mg/100 g, siendo el tratamiento tres (ácidos fúlvicos + sulfato de K), el numéricamente de mayor valor y dentro de este rango, al igual que los tratamientos dos, cuatro y cinco. Se puede. Concentración de Potasio en el fruto (mg/100g). concluir, que los tratamientos se encuentran en el rango adecuado de K en el fruto. 300 250 200 150 100 50 0 T0. T1. T2 T3 Tratamientos p=0,49. T4. T5. Figura 13. Concentración de K en el fruto en la variedad Cabernet sauvignon, al momento de cosecha.. 35.
(36) Concentración de Calcio en el fruto. En la figura 14, de acuerdo a la concentración de Ca en el fruto, podemos mencionar que no existe diferencia significativa (p=0,96). Cabanne et. al (2003), mantienen un rango de 30 a 40 mg/100g de concentración de Ca en el fruto, por lo que podemos mencionar que los tratamientos realizados en esta investigación, se encuentran en el rango citado por dichos autores, manteniendo un rango de 37 a 41 mg/100g de Ca en el fruto. Mismos autores afirman que el aumento en el contenido de calcio en la baya, puede ser debido a una acumulación de dicho elemento en las semillas y no la mayor. Concentración de Calcio en el fruto (mg/100g). concentración en la pulpa.. 45 40 35 30 25 20 15 10 5 0 T0. T1. T2 T3 Tratamientos p=0,96. T4. T5. Figura 14. Concentración de Ca en el fruto en la variedad Cabernet sauvignon, al momento de cosecha.. Concentración de Magnesio en el fruto. De acuerdo a la figura 15, en la variable de concentración de Mg, podemos mencionar que no existe diferencia significativa (p=0,88). El magnesio es un factor vital en la absorción de energía de la luz por la clorofila y se transloca principalmente en el floema de las vides (Zatloukalova et.al, 2011). En estudios realizados por Olego et at., (2014), en su tratamiento control, obtuvieron un nivel de Mg en el fruto de 13 a 18 mg/100 g, valores cercanos se obtuvieron en esta investigación, donde el rango de concentración. 36.
(37) de Mg fue de 15 a 16 mg. Datos que concuerdan con Rogiers et. al (2006), en donde muestra un rango de concentración de entre 12 a 15 mg de magnesio. Así la concentración de dicho elemento, se encuentra acorde a los rangos normales de Mg. Concentración de Magnesio en el fruto (mg/100g). en el fruto.. 18 16 14 12 10 8 6 4 2 0 T0. T1. T2 T3 Tratamientos p=0,88. T4. T5. Figura 15. Concentración de Mg en el fruto en la variedad Cabernet sauvignon, al momento de cosecha.. Concentración de Boro en el fruto. En la figura 16, podemos indicar que no existe diferencia significativa (p=0,68) en la acumulación de B en el fruto. Rogiers et. al (2006) menciona que la acumulación de boro en el fruto fue de 0.8 mg/100g, resultado similar al que podemos encontrar en esta investigación, donde el tratamiento control (agua) obtuvo el valor mínimo de acumulación con 0,72 mg/100g, mientras que el tratamiento cuatro (ácidos fúvicos + sulfato de magnesio), obtuvo la acumulación más alta con 0,93 mg/100g.. 37.
(38) Concentración de Boro en el fruto (mg/100g). 1.2 1 0.8 0.6. 0.4 0.2 0 T0. T1. T2 T3 Tratamientos p=0,68. T4. T5. Figura 16. Concentración de B en el fruto en la variedad Cabernet sauvignon, al momento de cosecha.. De acuerdo a la movilidad de los elementos en el floema, el Mg, P, K y S, son de alta movilidad; mientras que Ca y Mn son de baja movilidad y el B, Cu y Zn, presentan una movilidad variable o condicional (Welch, 1986).. Los elementos como el K, P, Mg y B, se acumulan en el crecimiento y maduración de la baya, mientras que el Ca se acumula principalmente en el envero (Rogiers et. al, 2006), por lo cual se puede determinar que el metabolismo de las bayas es un proceso complejo en donde la variedad, el clima y la nutrición juegan un rol importante en el proceso de asimilación de elementos (Famiani et. al, 2000).. Materia Seca. En la siguiente figura (17), se puede observar que no existe diferencia significativa (p=0,32) entre tratamientos para la variante de materia seca en el fruto. Sin embargo, en una investigación realizada por Rogiers et. al, (2006), mencionan que el porcentaje de materia seca en la variedad shiraz se encuentra ligado al contenido de K, y esta concentración es de 40%, mientras que en esta investigación se obtuvo una concentración de 30%. Si bien, podemos mencionar que los resultados de esta. 38.
(39) investigación se encuentran abajo del rango dado por dichos investigadores, Etchebarne et. al (2009), en la variedad Grenache Noir, mencionan que el porcentaje de materia seca es de un 20 a un 30%, por lo cual, podemos concluir, que la. Masa Seca en el fruto (%). concentración de materia seca en esta investigación, se encuentra en un rango normal.. 35 30 25 20 15 10. 5 0 T0. T1. T2 T3 Tratamientos p=0,32. T4. T5. Figura 17. Concentración de materia seca en el fruto en la variedad Cabernet sauvignon, al momento de cosecha.. Crecimiento de brotes. El registro del crecimiento de los brotes seleccionados se inició el 27 de noviembre de 2014. El crecimiento se detuvo el día 20 de enero, y fueron 54 días totales desde la primera hasta la última medición.. En el crecimiento inicial, para el día 27 de noviembre (Figura 18), los brotes no presentaron una diferencia significativa (p=0,24).. 39.
(40) Tratamiento; LS Means Current effect: F(5, 42)=1,3857, p=,24914 Effective hypothesis decomposition Vertical bars denote 0,95 confidence intervals. Crecimiento brotes acumulado (cm) 27 Nov. 95 90 85 80 75 70 65 60 55 50 45 40 T0. T1. T2. T3. T4. T5. Tratamiento. Figura 18. Crecimiento de brotes acumulado (cm), 27 de noviembre.. De igual manera, en la figura 18, en la medición de los brotes de la segunda fecha para el día 17 de diciembre, no se encontraron diferencias estadísticas (p=0,39). Tratamiento; LS Means Current effect: F(5, 42)=1,0621, p=,39487 Effective hypothesis decomposition Vertical bars denote 0,95 confidence intervals. Crecimiento brotes acumulado (cm) 17 Dic. 95 90 85 80 75 70 65 60 55 50 45 T0. T1. T2. T3. T4. T5. Tratamiento. Figura 19. Crecimiento de brotes acumulado (cm), 17 de diciembre.. 40.
(41) El crecimiento de los brotes comenzó a estabilizarse a partir del día 30 de diciembre, cuando éstos alcanzaron una longitud entre 75 a 85 cm (Figura 20), sin embargo, no se encontraron diferencias estadísticas (p=0,28).. Tratamiento; LS Means Current effect: F(5, 42)=1,2942, p=,28467 Effective hypothesis decomposition Vertical bars denote 0,95 confidence intervals 100. Figura. Crecimiento brotes acumulado (cm) 30 Dic. 95 90 85 80 75 70 65 60 55. 20.. 50 45 T0. T1. T2. T3. T4. T5. Tratamiento. Crecimiento de brotes acumulado (cm), 30 de diciembre.. Los brotes finalizaron su crecimiento el 20 de enero (Figura 21), con una longitud de 81,75 cm, para el tratamiento control, mientras que el tratamiento uno (ácidos fúlvicos + sulfato de potasio + sulfato de magnesio + ácido bórico), obtuvo un crecimiento acumulado de 79,25 cm. Sin embargo, para el resto de los tratamientos, solo se obtuvo un promedio de 69,5 cm de longitud. Nuevamente, no se encontraron diferencias significativas (p=0,28).. 41.
(42) Tratamiento; LS Means Current effect: F(5, 42)=1,2877, p=,28735 Effective hypothesis decomposition Vertical bars denote 0,95 confidence intervals 100. Crecimiento brotes acumulado (cm) 20 Enero. 95 90 85 80 75 70 65 60 55 50 45 T0. T1. T2. T3. T4. T5. Tratamiento. Figura 21. Crecimiento de brotes acumulado (cm), 20 de enero. Tasa de crecimiento (cm) / Fechas de medición (período). En la figura 22, se puede observar la tasa de crecimiento (cm) conforme a las fechas de medición, y a partir de la medición del día 17 de diciembre, el crecimiento empezó a. cm de crecimiento. estabilizarse y por consiguiente, el crecimiento se detuvo el día 20 de enero.. 4.50 4.00 3.50 3.00 2.50 2.00 1.50 1.00 0.50 0.00. T0 T1 T2 T3 T4 T5 27 de novimbre. 17 de diciembre. 30 de 20 de enero diciembre. Figura 22. Tasa de crecimiento (cm) en los periodos de medición para la variedad Cabernet sauvignon.. 42.
(43) Crecimiento del periodo (cm). De acuerdo con el crecimiento total del periodo de 54 días de medición (Figura 22), se puede observar que no se encontraron diferencias significativas (p=0,85). Sin embargo, de manera gráfica podemos comentar que, el tratamiento cinco (ácidos fúlvicos + ácido bórico), presenta el mayor crecimiento de cm durante el periodo, al contar con 4,75 cm de crecimiento neto, en comparación con el tratamiento tres, que obtuvo el menor crecimiento neto durante el periodo y obtuvo un valor de 3,25 cm.. Tratamiento; LS Means Current effect: F(5, 42)=,38168, p=,85849 Effective hypothesis decomposition Vertical bars denote 0,95 confidence intervals 8. Crecimiento del período (cm). 7 6 5 4 3 2 1 0 T0. T1. T2. T3. T4. T5. Tratamiento. Figura 23. Crecimiento del periodo (cm), 54 días de medición.. Tasa de crecimiento del periodo (mm/día). En relación a la tasa de crecimiento (mm/día), la mayor tasa de crecimiento se presentó en el tratamiento cinco, con 0,90 mm/día de crecimiento, seguido del tratamiento control con 0,80 mm de crecimiento por día. En los tratamientos restantes, se presenta un rango de crecimiento entre los 0,6 y 0,8 mm/día.. 43.
(44) En esta variable, durante las fechas 27 de noviembre al 17 de diciembre, se presentó la mayor tasa de crecimiento en todos los tratamientos, sin embargo, durante el segundo periodo de medición (30 de diciembre – 20 de enero), se presenta una estabilización del crecimiento, esto de acuerdo a Gil y Pszczólkowski (2007), el crecimiento de los brotes se estabiliza ya que el racimo inicia la fase de maduración y acumulación de azúcares, por lo que la parra se concentra en el desarrollo y acumulación de polifenoles en el racimo y no en seguir expandiendo su área foliar.. Tratamiento; LS Means Current effect: F(5, 42)=,38168, p=,85849 Effective hypothesis decomposition Vertical bars denote 0,95 confidence intervals 1,6. Tasa crecimiento del período (mm/día). 1,4 1,2 1,0 0,8 0,6 0,4 0,2 0,0 T0. T1. T2. T3. T4. T5. Tratamiento. Figura 24. Tasa de crecimiento del periodo (mm/día), en variedad Cabernet sauvignon.. Junquera et. al (2012), en la variedad Cabernet sauvignon, realizaron una evaluación del vigor de los brotes, investigación en la cual no encontraron diferencia significativa en el peso de los brotes, sin embargo, mencionan que el peso de los brotes fue disminuyendo desde envero y caída de hojas.. 44.
(45) Sólidos Solubles. En la figura número 25, se muestra que no existe diferencia significativa (p=0,3), en cuanto a la acumulación de sólidos solubles. El tratamiento dos (ácidos fúlvicos), presentó el mayor nivel de acumulación de azúcares con un resultado de 23,9 ºBrix. Este índice encuentra un parecido con los resultados obtenidos por Ortega et al. (2002), en la misma variedad, al mencionar que los índices de cosecha óptimos para esta variable se encuentran en el rango de 23,6 a 23,9 ºBrix, con fecha de cosecha del 26 de marzo, mientras que la fecha de cosecha para este trabajo, se realizó el 20 de marzo. En una investigación realizada por Knoll et. al. (2010), se realizó un estudio en la variedad tinta Blauer, donde mencionan que el rango adecuado de cosecha es de 20,5 a 21,1 ºBrix. Mientras que estudios realizados por Ramos et. al. (2016), en la variedad Cabernet sauvignon, menciona que el rango de ºBrix para cosecha es de 1820º, que equivale aproximadamente a 11 grados de alcohol probable e indica la migración del azúcar a las bayas. La concentración obtenida de sólidos solubles en esta investigación, tuvo valores más altos de los rangos obtenidos por Knoll y Ramos.. Sólidos Solubres (ºBrix). 30 25 20 15 10 5 0 T0. T1. T2 T3 Tratamientos p=0,35. T4. T5. Figura 25. Acumulación de sólidos solubles en los diferentes tratamientos, en la variedad Cabernet sauvignon, al momento de cosecha (20 de marzo).. 45.
(46) pH. En relación al pH del jugo, en la figura 26 se muestra que el tratamiento dos (ácidos fúlvicos) presentó un valor de pH de 3,48. Si bien, no se muestra diferencia estadística significativa (p=0,7) estadísticamente, Ortega et al. (2002) en la variedad Cabernet sauvignon obtuvieron un pH de 3,28, resultados que se asemejan a datos de Villaseca et al. (1986), en donde se estimó una acumulación de 1500 a 1600 GDA para obtener resultados de pH de cosecha entre 3,2 a 3,4. Muñoz et al. (2002), en la misma variedad, presenta resultados de un pH de 4,0 en donde exponen que un pH mayor a ese valor es indeseable para la vinificación, por lo tanto, podemos atribuir que el pH obtenido en esta investigación se encuentra en un rango aceptable, entre 3,3 a 3,5. Sin embargo, en estudios de la misma variedad, Ramos et al. (2010), mencionan que el rango de cosecha debe encontrarse entre 3,6 a 3,8, los autores atribuyen este rango al tipo de suelo (calcáreo) en el que el viñedo se encuentra establecido.. 4 3.5 3. pH. 2.5 2. 1.5 1 0.5 0 T0. T1. T2 T3 Tratamientos p=0,72. T4. T5. Figura 26. pH de jugo de los diferentes tratamientos en la variedad Cabernet sauvignon.. 46.
(47) Acidez Titulable. La acidez titulable, es la cantidad total de iones hidrógenos disponibles en solución y da una medida de los protones unidos a aniones como también aniones libres (Bordeu et. al, 2000).. En la figura número 27, se puede observar que no existe diferencia significativa (p=0,57) en cuanto a la acidez titulable. El tratamiento cuatro tuvo un valor de 1,09 g/L de H2SO4, mientras que el tratamiento cinco, obtuvo 1,28 g/L de H2SO4. Dichos valores obtenidos, se encuentran considerados bajos para la elaboración de vinos de calidad,. Acidez Titulable (g/L de H2SO4). esto según Flanzy, (2000).. 1.4 1.2 1 0.8 0.6 0.4 0.2 0 T0. T1. T2 T3 Tratamientos p=0,57. T4. T5. Figura 27. Acidez titulable de los diferentes tratamientos en la variedad Cabernet sauvignon.. 47.
(48) Número de racimos por planta. En la figura 28, se puede determinar que, en la variable de racimos por planta no se encontró ninguna diferencia significativa. Cabe mencionar que el tratamiento control, sobrepasó en un 64 por ciento al tratamiento tres (ácidos fúlvicos + sulfato de potasio), el cual obtuvo el menor número de racimos con planta (treinta y uno). De manera general se puede determinar que los tratamientos dos, tres y cuatro, se encuentran en un rango de 32 a 38 racimos por planta, mientras que el tratamiento cinco, es el segundo con mayor valor, obteniendo 45 racimos por planta.. Estos resultados comparados con un estudio realizado por Hidalgo et al., (2008), en donde sus resultados con respecto al número de racimos por planta en la misma variedad, obtuvieron un rango de 33 a 44 racimos en la región del Bío Bío en Chile. Se puede concluir que, en esta investigación, el rango fue de 32 a 50 racimos por planta, donde se puede mencionar que el rendimiento de Cabernet sauvignon en la localidad de Catemu, la variedad produce mayor cantidad de racimos y por consecuencia, un mayor rendimiento.. En investigaciones realizadas por Striegler et. al (1992), mencionan que el rango de racimos por planta es de 35 a 45, mientras que Or et. al (1999), presentan un rango de 30 a 40 racimos por planta. En este estudio, si bien el rango de racimos por planta es de 32 a 45.. En esta investigación, la cantidad de plantas por hectárea es de 2 mil, y en estudios de Striegler et. al (1992), manejan una densidad de población de 1,400 plantas por hectárea. Comparando los número de racimo, haciendo una media de 40 racimos por planta, podemos concluir que, en este estudio se obtienen 80 mil racimos por planta, comparado con los 56 mil racimos por planta del estudio de Striegler et. al. Podemos mencionar que, dependiendo de la densidad de plantación por hectárea, donde se encuentren plantaciones de alta densidad o baja, existe una relación entre las cantidades de producción.. 48.
(49) Tratamiento; LS Means Current effect: F(5, 42)=1,5129, p=,20638 70 65 60. N° Racimos. 55 50 45 40 35 30 25 20 15 T0. T1. T2. T3. T4. T5. Tratamiento. Figura 28. Número de racimos por planta, en la variedad Cabernet sauvignon. Producción de uva por planta (kg). De acuerdo a la variable de producción de uva por planta (kg), no se encontraron diferencias significativas (p=0,59). Gráficamente se puede determinar que, el tratamiento control, presentó un valor de producción con 3,6 kg de uva por planta, mientras que el tratamiento cuatro (ácidos fúlvicos + sulfato de magnesio), presentó solo 2 kg por planta. El segundo con mayor producción de uva por planta lo presenta el tratamiento uno (ácidos fúlvicos + sulfato de potasio + sulfato de magnesio + ácido bórico) con un promedio de 3,1 kg por planta. Se puede mencionar que, los tratamientos dos, tres, cuatro y cinco, se encuentran en un rango de producción de entre 2 a 2,8 kg por planta.. En estudios realizados por Striegler et. al (1992), encontraron un rango de producción de uva por planta de 3,20 a 3,76 kg; rango que podemos comparar con los resultados de esta investigación, donde el rango de producción más alto (tratamiento cero), fue de 3,6 kg por planta. Si bien, el rango que proponen dichos autores es más elevado al encontrado en esta investigación, podemos mencionar que, existen otros factores como el clima, donde tal vez pudieron incidir en el peso por planta, ya que de manera nutrimental (suelo y foliar), se encuentra una reserva eficaz para la producción.. 49.
(50) 4.5. Peso por planta (kg). 4 3.5 3 2.5 2 1.5 1 0.5 0 T0. T1. T2 T3 Tratamientos p=0,59. T4. T5. Figura 29. Producción de uva por planta (kg) en variedad Cabernet sauvignon.. Número de bayas. El tamaño de la baya es considerado un factor importante para la calidad del vino (Melo et. al, 2014). Coombe et. al (2000), mencionan que el fruto crece en una primera etapa que es cuaja-pinta debido a las divisiones celulares y en una segunda etapa que es pinta por la elongación de las células.. La variación del tamaño de las bayas aún no se resuelva, y se menciona que está relacionado con el genotipo de la parra y factores ambientales (Dai et al., 2011). De igual manera Reynier (2002), menciona que el tamaño final de la baya depende de la variedad, efectos del clima como luz y temperatura, así como del nivel hídrico durante el ciclo productivo.. Se obtuvo que el promedio del peso de una baya, fue de 1,5g, resultado similar al de Ramos et al. (2016), que obtuvo 1,3 g de peso de cada baya por racimo. El tratamiento cinco (ácidos fúlvicos + ácido bórico), obtuvo 57 bayas por racimo, siendo el menor valor. Los tratamientos dos, tres y cuatro, obtuvieron 161, 187 y 98 bayas por racimo,. 50.
(51) respectivamente. Sin embargo, el tamaño reducido de la baya puede ser un indicador de calidad, considerando que la dimensión de las bayas expresa la relación superficie/volumen y, por lo tanto, la dilución de los constituyentes de la pulpa y el hollejo; es decir, mientras menos volumen, más concentración de polifenoles (Singleton, 1972; Cordonnier, 1976; Ojeda et al., 2002).. no. Bayas N° de bayas /racimo. 350. y = 0,986 x + 16,7 R² = 0,92. 300 250 200 150. no. Bayas. 100. Lineal (no. Bayas ). 50 0 0. 100 200 300 Peso racimos (g). 400. Figura 30. Número de bayas por racimo en cv. Cabernet sauvignon.. Con respecto a los componentes de rendimiento, se puede observar que las vides con mayor número de racimos por planta y por consiguiente, con mayor producción de uva por planta y número de bayas por racimo, presentan un rendimiento mayor. Esto se puede deber al número de yemas que naturalmente se dejaron en los sarmientos, ya que las yemas no fueron contabilizadas.. 51.
(52) Conclusiones La aplicación de ácidos fúlvicos en la variedad Cabernet sauvignon por separado y en conjunto con los elementos (K, Mg y B), no aumentaron los parámetros de crecimiento y rendimiento como lo son, la longitud del brote, número de racimos por planta y producción de uva por planta.. En los parámetros químicos que se evaluaron (sólidos solubles, pH, acidez titulable), donde se realizaron aplicaciones de ácidos fúlvicos y agregando los elementos K, Mg y B, tampoco mostraron diferencias significativas, así como de igual manera, no cambiaron la concentración de dichas variables.. Si bien, en investigaciones donde se ponen a prueba los ácidos fúlvicos, se han demostrado su eficiencia y su actividad estimulante para las plantas, en este caso, en que el suministro de nutrientes del suelo y en algunos casos sobre el nivel adecuado, no existe la necesidad de la aplicación de nutrientes y de ácidos fúlvicos.. 52.
(53) EFECTO DE LA APLICACIÓN FOLIAR DE ÁCIDOS FÚLVICOS EN CONJUNTO CON POTASIO, MAGNESIO Y BORO EN VARIEDAD CABERNET SAUVIGNON (Vitis vinífera L.). Nora Zulema López Salazar. Resumen El principal objetivo de este trabajo fue evaluar el efecto de la aplicación foliar de ácidos fúlvicos en conjunto con elementos minerales (K, Mg, B). Se realizó en El Ñilhue, localidad de Catemu, Región de Valparaíso, Chile. El material vegetativo utilizado fue Vitis vinifera, variedad Cabernet sauvignon, en el ciclo vegetativo de los años 2014-2015. El diseño experimental utilizado fue completamente al azar con 5 tratamientos y un control, donde los efectos se analizaron por análisis de varianza. Se midieron variables de rendimiento como longitud del brote, número de racimos por plantas y número de bayas por racimo, así como peso total de racimos por planta, y mediciones químicas de la uva como: sólidos solubles (ºBrix), acidez total, pH del jugo, finalizando con evaluación del porcentaje de materia seca del fruto y concentración de elementos.. Se concluye que, la aplicación de ácidos fúlvicos, por separado y en. conjunto con los elementos, no presentaron diferencia estadística significativa y no aumentaron los parámetros de rendimiento, así como los parámetros químicos evaluados en las bayas, debido a que el suministro de nutrientes en el suelo se encontraba en nivel adecuado y en algunos casos, por sobre lo necesario. Palabras clave: ácidos fúlvicos, foliar, vitis vinifera, cabernet sauvignon.. 53.
(54) Referencias. Aiken, G. R., McKnight, D. M., Wershaw R. L., MacCarthy, P. 1985. Humic substances in soil, sediment and water. 1-9 pp. Aiken, G. R., McKnight, D. M., Wershaw R. L., MacCarthy (Eds.) Wiley-lnterscience, NewYork, NY. Alarcón, V.A. 2001. El boro como nutriente esencial, Horticultura 155:35-47. Akinremi, O. O., Janzen, H. H., Lemke, R. L., Larney, F. J. 2000. Response of canola, wheat and green beans to leonardite additions. Canadian J. Soil Sci 80:437-443. Bhardwaj, K. K. R., Gaur, A. C. 1970. The effect of humic and fulvic acids on the growth and efficiency of nitrogen fixation of Azotobacter chroococcum. Folia Microbiologica 15(5):364-367. Bolaños, L., Lukaszewski, K., Bonilla, I., Blevins, D. 2004. Why boron? Plant Physiology and Biochemistry 42:907-912. Bordeu,. E.,. González,. A.. Niveles. de. Nitrógeno. Fácilmente. Aprovechable.. Departamento de Fruticultura y Enología. CEVIUC. 4-7 pp. Bordeu, E., Scarpa, J. 1998. Análisis químico del vino. Ed Universidad Católica de Chile. p 253. Brownell, J. R., Nordstrom, G., Marihart, J., Jorgensen, G. 1987. Crop responses from two new leonardite extracts. Sci. Total Environ 62:491-499. Burdon, J. 2001. Are the traditional concepts of the structures of humic substances realistic? Soil Sci 166:752-769. Cabanne, C., Donèche, B. 2003. Calcium accumulation and redistribution during the development of grape berry. Vitis 42(1):19-21. Cakmak, I., Hengeler, C., Marschner, H. 1994. Partitioning of shoot and root dry matter and carbohydrates in bean plants suffering from phosphorus, potassium and magnesium deficiency. J. Exp. Bot 45:1245–1250.. 54.
(55) Callejas, R., Desmartis, D. 2014. Uso del boro a través de la fertirrigación en parrones de uva de mesa regados por riego por goteo. Universidad de Chile. Facultad de Ciencias Agronómicas.Vol 3. No. 2. Canellas, L.P., Olivares, F. L., Okorokova-Facanha, A. L., Facanha, A. R. 2002. Humic acids isolated from earthworm compost enhance root elongation, lateral root emergence, and plasma membrane H+-ATPase activity in maize roots. Plant Physiology 130:1951-1957. Canellas, L.P., Piccolo, A., Dobbss, L. B., Spaccini, R., Olivares, F. L., Zandonadi, D. B., Façanha, A. R. 2010. Chemical composition and bioactivity properties of sizefractions separated from a vermicompost humic acid. Journal of Agricultural and Food Chemistry 78:457-466. Cimrin, K. M., Yilmaz, I. 2005. Humic acid applications to lettuce do not improve yield but do improve phosphorus availability. Acta Agriculturae Scandinavica, Section B, Soil and Plant Science 55:58-63. Conradie, W.J. 1981. Seasonal uptake of nutrients by Chenin blanc grown in sand culture. II. Phosphorous, potassium, calcium and magnesium. S. Afr. J. Enol. Vitic 2: 713. Coombe, B.G. 1992 Research on development and ripening of the grape berry. Am. J. Enol. Vitic. 43:101–110. Coombe, B.G., McCarthy, M.G. 2000. Dynamics of grape Berry growth and phisiology of ripening. Australian Journal of Grape and Wine Research 6:131-135. Cooper, R. J. 1999. Humic Substances and Their Potential for Improving Turfgrass Growth. Soils. Essays 9. p. Departament of Crop Science, North Carolina State University. Cordonnier, R. 1976. Qualité de la vendage et méthodologie de la sélection viticole. Le Progrès Agricole et Viticole 9 (24):760-762. Dai, Z.W., Ollat, N., Gomes, E., Decroocq, S., Tandonnet, J.P., Bordenave, L., Pieri, P.,. 55.
(56) Hilbert, G., Kappel, C., Van Leeuwen, C., Vivin, P. & Delrot, S., 2011. Ecophysiological, genetic and molecular causes of variation in grape berry weight and composition: A review. Am. J. Enol. Vitic. 62:413-425. Dobbss, L. B., Canellas, L. P., Olivares, F. L., Aguiar, N. O., Pers, L. E. P., Azevedo, M., Spaccini, R., Piccolo, A., Façanha, A. R. 2010. Bioactivity of chemically transformed humic matter from vermicompost on plant root growth. Journal of Agricultural and Food Chemistry 58:3681-3688. Drozd, J., Weber, J. 1996. The role of humic substances in the exosystem and in enviromental protection. Proc. 8 Meeting of the International Humic Substances Society. Wroclaw. Etchebarne, F., Ojeda, H., Deloire, A. 2009. Influence of water status on mineral composition of berries in “Grenache Noir” (Vitis vinifers L.). Vitis 48(2):63-68. Famiani, F., Walker, R.P, Técsi, L., Chen, Z.H., Proietti, P., Leegood, R.C. 2000. An immunohistochemical study of the compartmentation of metabolism during the development of grape (Vitis vinifera L.) berries. J. Exp. Bot. 51:675-683. Flanzy, C. 2000. Enología: Fundamentos Científicos y Tecnológicos. Ed MundiPrensa, Madrid, España. p 783. Gärtel, W. 1988 Part III. Disorders caused by abiotic factors. In Com- pendium of Grape Diseases. Eds. R C Pearson and A C Goheen. pp. 64–66. APS Press, Minnesota, USA. Ghisi, R., Iannini, B., Passera, C. 1984. Changes in the activities of enzymes involved in nitrogen and sulphur assimilation during leaf and Berry development of Vitis vinífera. Vitis 23:257-267. Gil, G., Pszczólkowski, Ph. 2007. Viticultura, Fundamentos para Optimizar Producción y Calidad. Ciencia e investigación agraria, 34(3):243. Godoy, H. J. 1970. Efecto de niveles crecientes de calcio en el contenido foliar de boro en vid de la variedad Sultanina. Tesis Licenciado en Agronomía. Santiago, Chile, Universidad de Chile. Facultad de Agronomía. p 52.. 56.
Figure


Documento similar
Por PEDRO A. EUROPEIZACIÓN DEL DERECHO PRIVADO. Re- laciones entre el Derecho privado y el ordenamiento comunitario. Ca- racterización del Derecho privado comunitario. A) Mecanismos
En cuarto lugar, se establecen unos medios para la actuación de re- fuerzo de la Cohesión (conducción y coordinación de las políticas eco- nómicas nacionales, políticas y acciones
D) El equipamiento constitucional para la recepción de las Comisiones Reguladoras: a) La estructura de la administración nacional, b) La su- prema autoridad administrativa
b) El Tribunal Constitucional se encuadra dentro de una organiza- ción jurídico constitucional que asume la supremacía de los dere- chos fundamentales y que reconoce la separación
Para ello, en base a un modelo econométrico de datos de panel para el periodo 2009-2013, pretende obtener evidencia sobre una asociación entre feminicidio agregado y
"No porque las dos, que vinieron de Valencia, no merecieran ese favor, pues eran entrambas de tan grande espíritu […] La razón porque no vió Coronas para ellas, sería
Cedulario se inicia a mediados del siglo XVIL, por sus propias cédulas puede advertirse que no estaba totalmente conquistada la Nueva Gali- cia, ya que a fines del siglo xvn y en
El nuevo Decreto reforzaba el poder militar al asumir el Comandante General del Reino Tserclaes de Tilly todos los poderes –militar, político, económico y gubernativo–; ampliaba