UNIVERSIDAD REGIONAL AUTÓNOMA DE LOS ANDES
UNIANDES
FACULTAD DE CIENCIAS MÉDICAS
PROGRAMA DE MAESTRÍA EN FARMACIA CLÍNICA Y
HOSPITALARIA
PROYECTO DE INVESTIGACIÓN PREVIO A LA OBTENCIÓN DEL
GRADO ACADÉMICO DE MAGÍSTER EN FARMACIA CLÍNICA Y
HOSPITALARIA
TEMA:
POLITICA DE ANTIBIÓTICOS PARA EL TRATAMIENTO DE LAS
INFECCIONES DEL TRACTO URINARIO EN EL ÁREA DE MEDICINA
INTERNA DEL HOSPITAL VICENTE CORRAL MOSCOSO
AUTORA: BQF. CORONEL GONZALEZ PATRICIA JASSMÍN
TUTORES: LIC. ROMERO VIAMONTE KATHERINE MSc.
LIC. RAMOS SERPA GERARDO PhD.
APROBACIÓN DE LOS TUTORES DEL TRABAJO DE TITULACIÓN
CERTIFICACIÓN:
Quienes suscriben, legalmente CERTIFICAN QUE: El presente Trabajo de Titulación realizado por la Bioquímica Farmacéutica Coronel González Patricia Jassmín, maestrante del Programa de Farmacia Clínica y Hospitalaria, Facultad de Ciencias Médicas, con el tema “POLITICA DE ANTIBIÓTICOS PARA EL TRATAMIENTO DE LAS INFECCIONES DEL TRACTO URINARIO EN EL ÁREA DE MEDICINA
INTERNA DEL HOSPITAL VICENTE CORRAL MOSCOSO, ha sido prolijamente revisado, y cumple con todos los requisitos establecidos en la normativa pertinente de la Universidad Regional Autónoma de los Andes -UNIANDES-, por lo que apruebo su presentación.
Ambato, junio de 2018.
Lic. Romero Viamonte Katherine MSc. Lic. Ramos Serpa Gerardo PhD.
DECLARACIÓN DE AUTENTICIDAD
Yo, Patricia Jassmín Coronel González, maestrante del Programa de Farmacia Clínica y Hospitalaria, Facultad de Ciencias Médica, declaro que todos los resultados obtenidos en el presente trabajo de investigación, previo a la obtención del título de MAGÍSTER EN FARMACIA CLÍNICA Y HOSPITALARIA, son absolutamente
originales, auténticos y personales; a excepción de las citas, por lo que son de mi exclusiva responsabilidad.
Ambato, junio de 2018
B.Q.F. Patricia Jassmín Coronel González C.I. 010475104-5
DERECHOS DE LA AUTORA
Yo, Patricia Jassmín Coronel González, declaro que conozco y acepto la disposición constante en el literal d) del Art. 85 del Estatuto de la Universidad Regional Autónoma de Los Andes, que en su parte pertinente textualmente dice: El Patrimonio de Ia UNIANDES, está constituido por: La propiedad intelectual sobre las Investigaciones, trabajos científicos o técnicos, proyectos profesionales y consultaría que se realicen en la Universidad o por cuenta de ella.
Ambato, junio de 2018.
B.Q.F. Patricia Jassmín Coronel González C.I. 010475104 - 5
DEDICATORIA
A Dios, por su infinito amor y por darme claridad en los momentos de oscuridad, sin él nada sería posible.
A mis padres, por ser mi fortaleza, por el amor y la paciencia brindada durante todo este largo camino, por Uds. soy lo que soy, Uds. han sido mi más grande inspiración.
A ti Isabella, por enseñarme el verdadero amor, porque gracias a ti hija mía aprendí que nada es imposible y que en la vida no hay amor más grande que el amor de una madre.
A mis hermanos, por ser mi apoyo incondicional, por su comprensión y su gran amor hacia mi hija, por estar presentes en casa para ella cuando yo no pude.
AGRADECIMIENTO
Agradezco a Dios por permitirme llegar hasta aquí, por sus bendiciones y por no dejarme sola.
Agradezco a mi padre René y mi madre Olga por enseñarme a luchar y por acompañarme en este largo camino, por sus consejos y por la perseverancia heredada, este trabajo es por ustedes y para ustedes.
A mi hija, a mi motor, a mi gran amor, Isabella, todo lo que hago, lo hago por ti.
A mi hermana y hermano, la vida no me alcanzará para agradecerles por tanto amor.
A mis tutores, por su guía y aporte académico, este trabajo rindió sus frutos gracias a ustedes.
RESUMEN
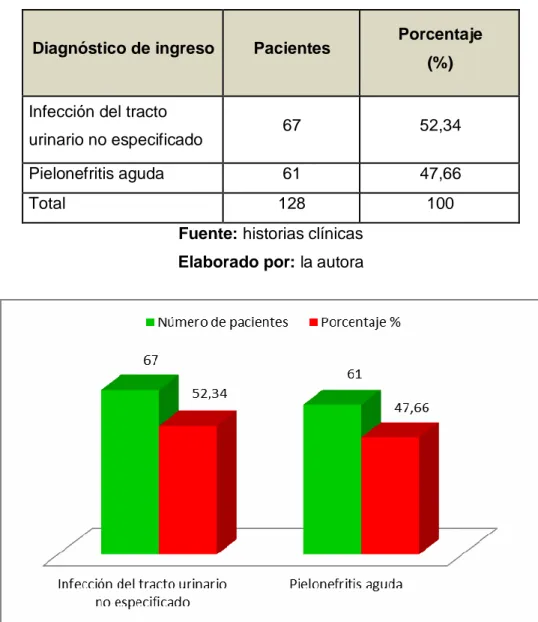
Una de las preocupaciones a nivel mundial es la falta de políticas para el tratamiento de infecciones causadas por bacterias, esto provoca que los prescriptores no tengan criterios unificados de prescripción. Por ello, se vio la necesidad de diseñar una política de antibióticos para el tratamiento de las infecciones del tracto urinario en el servicio de medicina interna mediante la revisión documentada de las historias clínicas. La muestra estuvo constituida por 128 pacientes con infección de vías urinarias hospitalizados en el Hospital Vicente Corral Moscoso que cumplían con los criterios de inclusión durante el año 2017. El 85,16 % de los pacientes fueron del sexo femenino y el 60,94 % de los pacientes fue mayor de 65 años; el 52,34 % fue diagnosticado con ITU no especificado y el 47,60 % con pielonefritis; el antibiótico más utilizado para el tratamiento empírico fue ampicilina+sulbactam en ITU no especificada con el 25 % y en pielonefrtitis el 21,09 %; este antibiótico también presentó el mayor porcentaje de resistencia en el urocultivo, (73,68 %). En cuanto a los errores de prescripción, se detectó el 11 % correspondiente al tratamiento empírico con meropenem para las infecciones del tracto urinario y pielonefrtitis. El tratamiento más costoso en ITU no especificada fue meropenem con 2 241,3 dólares y en pielonefritis fue piperacilina + tazobactam con 1 788 dólares. La aplicación de la política diseñada constituye una herramienta útil que garantice el uso racional de los medicamentos y la disminución de los costos innecesarios.
ABSTRACT
One of the concerns worldwide is the lack of policies for treatment of infections caused by bacteria, this elicits that prescribers do not have a unified criterion to prescribe. Therefore, a need was found to design an antibiotic policy to treat infections in the urinary tract in the internal medicine service through the documented review of medical histories. The sample was taken from 128 patients with urinary tract infections, interned in the Hospital Vicente Corral Moscoso that met the inclusion standard during the year 2017. The 85,14% of patients were females and 60, 94% were patients older than 65 years, 52,34% was diagnosed with ITU nonspecific, and 47,60% with pyelonephritis; the most used antibiotic for the empiric treatment was ampicillin+sulbactamin ITU nonspecific (25 %) and in pyelonephritis (21.09 %); this antibiotic presented the highest percentage of resistance (73,68%). Regarding prescription errors, 11% was for the empiric treatment of ITU nonspecific and pyelonephritis; the most expensive treatment for ITU nonspecific was meropenem with 2 241,3 dollars, and in pyelonephritis was piperacillin+tazobactam with 1.872 dollars.
The application of the designed policy constitutes a useful tool that guarantees the rational use medicaments and degression of unnecessary costs.
ÍNDICE GENERAL
Introducción ... 1
Formulación del problema... 6
Delimitación del problema ... 6
Objeto de la investigación ... 6
Campo de acción ... 6
Identificación de la línea de investigación ... 6
Objetivos ... 7
Objetivo general ... 7
Objetivos específicos ... 7
Idea a defender ... 7
Justificación del tema ... 7
CAPITULO I. MARCO TEÓRICO ... 9
1.1 Infección del Tracto Urinario ... 9
1.1.1 Definición ... 9
1.1.2 Clasificación ... 9
1.1.3 Fisiopatogenia... 10
1.1.4 Síntomas... 12
1.1.6 Diagnóstico de las ITU altas ... 14
1.1.6.1 Diagnóstico de laboratorio... 15
1.1.6.2 Anamnesis y examen clínico ... 18
1.1.7 Diagnóstico de las ITU baja ... 18
1.1.8 Tratamiento ... 19
1.1.8.1 Tratamiento de las ITU de vías altas ... 19
1.1.8.2 Tratamiento de las ITU de vías bajas ... 21
1.1.9 Prevención ... 23
1.2 Resistencia bacteriana ... 24
1.2.1 Definición ... 24
1.2.2 Tipos de resistencia a los antibióticos ... 25
1.2.3 Mecanismos de resistencia ... 28
1.2.4 Causas de la resistencia bacteriana ... 28
1.2.5 Prevención de la resistencia bacteriana ... 31
1.3 Uso racional de medicamentos ... 32
1.3.1 Definición ... 32
1.3.2 Uso racional de antibióticos ... 34
1.3.2.1 Objetivos ... 35
1.3.3 Prescripción de medicamentos ... 37
1.3.4 Calidad de la prescripción ... 38
1.4 Política de antibióticos ... 39
1.4.1 Definición ... 39
1.4.2 Objetivo... 40
1.4.3 Elaboración de la política de antibióticos ... 41
1.4.3.1 Monitorización del consumo de antimicrobianos ... 48
1.4.3.2 Adaptar el tratamiento antibiótico al microorganismo: "desescalar" ... 49
1.5 Comisión de Infecciones ... 50
1.6. Conclusiones parciales del capítulo ... 52
CAPÍTULO II. MARCO METODOLÓGICO Y ANÁLISIS DE LOS RESULTADOS ... 53
2.1 Caracterización del sector ... 53
2.2 Descripción del procedimiento metodológico ... 55
2.2.1 Universo y muestra ... 56
2.2.2. Definición de las variables... 56
2.2.3 Modalidad de la investigación ... 58
2.2.4 Tipo de investigación ... 58
2.2.5 Métodos ... 58
2.2.7 Plan de recolección de datos ... 59
2.3. Análisis y discusión de los resultados ... 61
2.4 Conclusiones parciales del capítulo ... 89
CAPÍTULO III. PLANTEAMIENTO DE LA PROPUESTA ... 90
3.1 Datos informativos ... 90
3.2 Justificación ... 91
3.2.1 Objetivo... 92
3.2.2 Objetivos específicos ... 92
3.3 Desarrollo de la propuesta ... 92
3.4 Validación de la propuesta………...103
3.5 Curriculum vitae del experto………104
3.6 Conclusiones parciales del capítulo ... 107
CONCLUSIONES GENERALES ... 108
RECOMENDACIONES ... 109
REFERENCIAS BIBLIOGRÁFICAS
Introducción
En la década de 1920, el bacteriólogo británico Alexander Fleming, descubrió de manera fortuita la penicilina, la cual presentó una intensa actividad antimicrobiana, principalmente frente a las bacterias no patógenas. Este descubrimiento permitió posteriormente a científicos como Howard Florey y Ernst Chain en 1940 desarrollar nuevos compuestos antibacterianos. Ellos probaron la penicilina por primera vez en humanos la cual permitió demostrar su eficacia en enfermedades como la gonorrea, ciertas meningitis y septicemias. Fue la “era dorada” para estos antibióticos y se creyó que la batalla contra las enfermedades infecciosas ya estaba ganada (1).
Fue así que, durante las décadas siguientes al descubrimiento de la penicilina, el ritmo en el descubrimiento y desarrollo de nuevas familias de antibióticos fue muy rápido, pero este ritmo se ha detenido, y en las últimas décadas muy pocas moléculas con actividades nuevas, o nuevas familias de antibióticos se han incorporado al arsenal terapéutico. Esto supone un importante problema, sobre todo teniendo en cuenta el incremento alarmante en la resistencia a estos fármacos, que dificulta enormemente el tratamiento de muchas infecciones bacterianas (2).
Recientemente se ha señalado que la resistencia podría llegar a constituir una amenaza para la estabilidad mundial y la seguridad de los países. La causa principal de la resistencia es el uso irracional de los antibióticos. Paradójicamente, la presión selectiva surge de la combinación del uso excesivo que se observa en muchas partes del mundo, especialmente en los casos de infecciones sin importancia, del uso incorrecto por falta de acceso a tratamiento apropiado y de la subutilización debido a la falta de recursos financieros para completar los tratamientos. La resistencia bacteriana pone en juego los medios de subsistencia, la vida humana y costo en dinero, por lo tanto, la mejora en el uso de los antibióticos es un punto clave en su lucha (3).
En un estudio de Indicación – Prescripción realizado por María de los Ángeles Flores Montalván acerca de la Utilización y Evaluación económica de los antibióticos prescritos para infecciones de vías urinarias en pacientes adultos en un Hospital de Nicaragua, de 102 casos analizados, el 31,3 % no requirió la administración de antibióticos para el tratamiento de la patología, además se encontró que el 56,8 % fue diagnosticado basándose en criterios clínicos de los profesionales médicos. Este
importante promover los diferentes medios diagnósticos para un mejor manejo y justificación del antibiótico, y así evitar el incremento de la resistencia bacteriana y los costos para el paciente y la unidad de salud (3).
En un estudio realizado por Velasco y colaboradores en un hospital básico de España en el año 2012, se aislaron bacterias betalactamasas de espectro extendido (BLEE) en el 17,9 % de 106 pacientes con bacteriemias de foco urinario. Estos pacientes fueron predominantemente varones, de mayor edad, procedentes de residencia de ancianos, con manipulación urológica más frecuente, con mayor uso de antibiótico, alto porcentaje de infecciones urinarias previas, elevada frecuencia de infección nosocomial e ingreso en el mes previo al estudio (4).
El estudio descriptivo y transversal realizado por Pajarín Fernández y colaboradores acerca de las prescripciones de antibióticos a ancianos con infecciones del tracto urinario en el área de salud del Policlínico Docente "Carlos Juan Finlay" de Santiago de Cuba, desde enero hasta junio del 2010, concluyó que predominaron las prescripciones inadecuadas en un 63,9 % de las cuales 43,3 % fue por individualización del tratamiento. Pudo determinarse en esta investigación que la prescripción de medicamentos contra las infecciones del tracto urinario en el adulto mayor fue deficiente porque los médicos presentaban insuficientes conocimientos sobre los antimicrobianos que debían prescribir pues se indicaron medicamentos como alternativas y no por resistencia local (5).
En un estudio de prevalencia puntual entre Mayo 2008 y Febrero 2009 realizado por Fiterre Lancis y colaboradores en el Hospital Clínico Quirúrgico "Joaquín Albarrán" acerca de la calidad de la prescripción de los antimicrobianos en pacientes hospitalizados en servicios clínicos, se concluyó que de los 1 175 pacientes evaluados, el 38,80 % de los pacientes utilizó agentes antimicrobianos y en el 14,5 % se evidenció un uso irracional de agentes antimicrobianos. Las causas más frecuentes de prescripción inadecuada en los servicios clínicos fueron el uso de agentes antimicrobianos en ausencia de proceso infeccioso y la duración incorrecta del tratamiento (7).
por azitromicina, eritromicina y linezolid, mientras que la resistencia del 100% fue para claritromicina y sulfametoxazol (7).
En el año 2011, el estudio transversal sobre E. coli realizado en el Instituto Nacional contra el Cáncer de la ciudad de Cuenca con todos los pacientes menores de 15 años, determinó que, de las 55 cepas de E.coli fecal analizadas, el 50,9 % presentaron resistencia a trimetoprim sulfametoxazol, el 30,9 % a amoxicilina–ácido clavulánico, el 16,4 % a ceftazidima, el 16,4 % a cefotaxima, el 14,5 % a ciprofloxacina y el 10,9 % a cepas productoras de betalactamasas de espectro extendido (8).
El descubrimiento e introducción de los antibióticos en la práctica clínica, supuso uno de los mayores avances de la medicina, por la “curación de infecciones”; sin embargo, desde la introducción de los antibióticos se ha comprobado cómo los microorganismos pierden con el tiempo su sensibilidad natural a estos agentes a través de la selección y transmisión de diversos mecanismos de resistencia, por lo tanto una de las estrategias dirigidas a solventar esta vía de defensa bacteriana es la optimización del uso de los antibióticos (3).
A nivel hospitalario, los antibióticos constituyen uno de los medicamentos más utilizados (entre el 25 % y el 41 % de los pacientes hospitalizados son tratados con antibióticos y aproximadamente el 60 % recibe al menos una dosis durante su ingreso). También es importante destacar que, desde el punto de vista económico, en algunos países desarrollados, los antibióticos representan un porcentaje importante del gasto farmacéutico hospitalario y que el uso no óptimo de los mismos se asocia, además, con costes indirectos y la prolongación de la estancia hospitalaria de los pacientes (3).
De acuerdo con los últimos cálculos del Centro para la Prevención y Control de Enfermedades de los Estados Unidos (CDC), los organismos resistentes a los antibióticos causan 2 millones de infecciones y 23 000 muertes solo en los Estados Unidos cada año, con un impacto económico de 35 millones de dólares adicionales de gastos en salud. Es probable que esta información sea igual o mayor en otras regiones del mundo, en particular en países de continuo crecimiento tales como los de América Latina (9).
tratamiento estándar de 13 000 a 30 000 dólares; mientras que en el suministro para el tratamiento de la tuberculosis multi-drogo resistente (TBMDR) el incremento en el costo del tratamiento fue de 180 000 dólares, estimación dada por el CDC. Los costos para el tratamiento de las infecciones por enterobacterias resistentes a la vancomicina fueron de 2 766 dólares por caso, esto debido a una estancia prolongada en la unidad de terapia intensiva que aumentaron los costos por hospitalización (10).
Según la nota de prensa de diario el Telégrafo de Ecuador del martes 11 de junio del año 2013, en volumen, Estados Unidos es el país que más gasta en medicamentos en el mundo, con 317 900 millones de dólares, seguido de Japón con 109 790 millones de dólares y China con 65 850 millones de dólares, mientras que, el gasto promedio por habitante en medicamentos en Ecuador al cierre de 2011 fue uno de los más altos en América Latina con 73,20 dólares anuales por habitante (11).
Pero el uso incorrecto de los antibióticos no solo se refleja en una repercusión económica, sino también, en una inmensurable lucha contra la resistencia bacteriana. El informe de la Organización Mundial de la Salud del mes de abril del 2014, titulado “Resistencia a los antimicrobianos: informe mundial sobre la vigilancia”, señala que la resistencia está afectando a muchos agentes infecciosos distintos, pero se centra en la resistencia a los antibióticos en siete bacterias responsables de infecciones comunes graves, como la septicemia, la diarrea, la neumonía, las infecciones urinarias o la gonorrea (12).
«En ausencia de medidas urgentes y coordinadas por parte de muchos interesados directos, el mundo está abocado a una era post antibióticos en la que infecciones comunes y lesiones menores que han sido tratables durante decenios volverán a ser potencialmente mortales», ha dicho el Dr. Keiji Fukuda, Subdirector General de la Organización Mundial de la Salud para Seguridad Sanitaria (12).
De todas las infecciones del tracto urinario, más del 70 % son producidas por E. coli lo que lo convierte en el agente patógeno universal, sin embargo, teóricamente, cualquier bacteria es capaz de colonizar y de producir infección del tracto urinario, las cuáles provocan cada vez una mayor resistencia a los antibióticos utilizados comúnmente para el tratamiento de las infecciones del tracto urinario (13).
La E. coli incrementó en la última década su tasa de resistencia a diversos antimicrobianos de uso frecuente como la ampicilina, amoxicilina, ciprofloxacina, cefalosporinas y trimetoprim-sufametoxazol. En algunas zonas de Estados Unidos la resistencia de este microorganismo a trimetoprim-sufametoxazol ha aumentado al igual que en países como Alemania, Irlanda, Portugal y España en los cuáles llegó a ser mayor al 45 %. La tasa de resistencia en países en vías de desarrollo fue aún más alta con cifras del 65 % (14).
El panorama en el Ecuador es igualmente crítico. Cuando se diseminó la epidemia del cólera en 1998, se descubrieron cepas multiresistentes a la acción de los antibióticos de uso común. La tónica, sin embargo, es el desconocimiento sobre esta realidad en el interior de la misma comunidad médica ecuatoriana, y a pesar de la importancia extrema de este problema, son pocas las investigaciones existentes sobre este tema tanto a nivel regional como nacional (7).
A pesar de esta realidad, no se realizan programas de vigilancia de infecciones producidas por bacterias resistentes, no hay control en el uso indiscriminado de antibióticos, existe poco conocimiento por parte de los servidores de salud como también, ausencia de comités de infecciones en los hospitales, que regulen y controlen el uso antibiótico (7).
En el país, aun cuando existen guías terapéuticas para varias patologías, las cuales fueron diseñadas para evitar la propagación y la resistencia bacteriana a nivel comunitario y hospitalario; siguen siendo insuficientes para el tratamiento de patologías que también representan un alto índice de morbilidad en el Ecuador.
Según el Instituto Ecuatoriano de Estadísticas y Censos (INEC), los trastornos del sistema urinario son la quinta causa de atención en las unidades de salud, con una taza de 10,72 por cada 10 000 habitantes y con un porcentaje de egresos del 1,44 % en el año 2014 (15).
estudios previos relacionados al perfil de sensibilidad y resistencia bacteriana de esta patología, en consecuencia, no es posible estimar el riesgo de los pacientes para el desarrollo de infecciones graves que ponen en peligro sus vidas, por ello, persiste un criterio terapéutico individual, en ocasiones convencionalista para el tratamiento de la patología, de ello se deriva que la relación costo/beneficio no resulta a veces la más favorable, esto se ve evidenciado en los diferentes esquemas farmacológicos utilizados tratar las infecciones del tracto urinario.
Formulación del problema
El uso inadecuado de los antibióticos para el tratamiento de las infecciones de vías urinarias en el área de medicina interna del Hospital Vicente Corral Moscoso, provoca la aparición de resistencia bacteriana y costos agregados innecesarios a la institución.
Delimitación del problema
La disminución de la resistencia bacteriana y los gastos innecesarios a la institución con el diseño de la política de antibióticos se espera resolver de manera parcial; se debe considerar que los problemas relacionados con el uso irracional de los antibióticos no se pueden erradicar completamente, pero sí se pueden monitorizar mediante el seguimiento farmacoterapeútico, la capacitación continua al personal de salud y con el cumplimiento de la política elaborada conforme se implemente.
Objeto de la investigación
Uso racional de medicamentos y farmacoeconomía.
Campo de acción
Uso de antibióticos en pacientes con ITU hospitalizados en el servicio de medicina interna del Hospital Vicente Corral Moscoso. Gastos asociados.
Identificación de la línea de investigación
Objetivos
Objetivo general
Diseñar la política de antibióticos para el tratamiento de las infecciones de vías urinarias en el servicio de medicina interna del Hospital Vicente Corral Moscoso para disminuir la resistencia bacteriana y los gastos innecesarios.
Objetivos específicos
1. Fundamentar científicamente infección del tracto urinario, resistencia bacteriana, uso racional de medicamentos, políticas de antibióticos.
2. Identificar los problemas relacionados con los antibióticos utilizados para el tratamiento de las infecciones del tracto urinario en el Hospital Vicente Corral Moscoso.
3. Determinar los gastos innecesarios debido al uso inadecuado de los antibióticos para el tratamiento de las infecciones del tracto urinario en el Hospital Vicente Corral Moscoso.
4. Elaborar una política de antibióticos para las ITU comunitarias de los pacientes del área de medicina interna del Hospital Vicente Corral Moscoso.
5. Determinar las referencias necesarias para la implementación de la política en el Hospital Vicente Corral Moscoso.
Idea a defender
Mediante la política de antibióticos para el tratamiento de las infecciones del tracto urinario de los pacientes del servicio de medicina interna del Hospital Vicente Corral Moscoso de Cuenca, se disminuirá la resistencia bacteriana y los gastos institucionales.
Justificación del tema
La mejora en el uso de antibióticos es un punto fundamental en la lucha contra las bacterias. De ahí deriva la importancia de establecer mecanismos de control del uso de estos medicamentos por parte del personal médico como la elaboración de políticas de antibióticos. El manejo adecuado conduce a disminuir la resistencia bacteriana y los gastos a la institución.
ingresados a esta casa de salud. Las infecciones del tracto urinario son la cuarta causa de ingreso a este departamento, y los pacientes tratados por esta enfermedad no tienen un tratamiento definido.
Debido a esto, la presente investigación es importante pues brindará las herramientas necesarias para facilitar al personal médico del servicio de medicina interna del Hospital Vicente Corral Moscoso, el tratamiento y seguimiento de los pacientes hospitalizados ya que contará con estudios actualizados para el manejo de las infecciones del tracto urinario y servirá de precedente para el seguimiento de otras patologías que requieran una política de antibióticos.
Los beneficios de este proyecto están dirigidos a los pacientes y a la institución; por un lado, los pacientes recibirán atención de salud de calidad y dirigida a su patología, y, por otro lado, demostrará a las autoridades de salud que el uso racional de medicamentos aporta con el buen manejo del presupuesto de la salud, el mismo que podrá ser reinvertido en los pacientes que serán los beneficiarios directos de este ahorro.
CAPITULO I. MARCO TEÓRICO
1.1 Infección del Tracto Urinario
1.1.1 Definición
La infección del tracto urinario (ITU) consiste en la colonización y multiplicación microbiana, habitualmente bacteriana, a lo largo del trayecto del tracto urinario. Se denomina pielonefritis si afecta al riñón y la pelvis renal, cistitis si implica a la vejiga, utetritis si afecta a la uretra y prostatitis si la infección sea localiza en la próstata (15). Según el Instituto Ecuatoriano de Estadísticas y Censos (INEC), la tercera causa de morbilidad femenina en el año 2015, fueron las infecciones del tracto urinario, con una tasa de 17,77 por cada 10 000 habitantes y con un porcentaje de egresos del 1,95 % (16).
Son más frecuentes en el sexo femenino, debido a que hasta un 50 % de las mujeres pueden presentar una ITU a lo largo de su vida, lo que se relaciona con la actividad sexual, los embarazos y la edad. En el varón, las ITU tienen dos picos de incidencia, durante el primer año de vida y en mayores de 50 años en relación con la presencia de patología prostática o manipulaciones urológicas (15).
1.1.2 Clasificación
La literatura indica que las ITU pueden ser clasificadas de acuerdo al riesgo de complicaciones y a la ubicación anatómica en: alta o baja, no complicada o complicada, asintomática o sintomática, nueva o recurrente y comunitaria o nosocomial (17).
• ITU alta: consiste en la presencia de signos y síntomas de ITU baja, asociada a colonización bacteriana a nivel ureteral y del parénquima renal, con signos y síntomas sistémicos como, escalofríos, fiebre, dolor lumbar, náuseas y vómitos. En este grupo se encuentran las pielonefritis.
• ITU baja: consiste en la colonización bacteriana a nivel de uretra y vejiga que normalmente se asocia a la presencia de síntomas y signos urinarios, como urgencia, disuria, polaquiuria, turbidez y olor fétido de la orina. Incluye la cistitis y la uretritis.
a las mucosas de la vejiga y la uretra o compromete órganos sólidos, como riñones o próstata. Por este motivo, hablar de ITU complicada o no complicada es de mayor utilidad clínica para el médico (17).
• ITU no complicada: es aquella que ocurre en el tracto inferior (cistitis/uretritis) en pacientes que tienen un tracto urinario normal, sin alteraciones funcionales o anatómicas, sin una historia reciente de instrumentación (sondaje, uretrocistoscopia) y cuyos síntomas están confinados a la uretra y vejiga. Estas infecciones son muy frecuentes en mujeres jóvenes con una vida sexual activa y tienen mínimo riesgo de invasión tisular y con previsión de respuesta al tratamiento estándar corto (tres días).
• ITU complicada: ocurre debido a factores anatómicos, funcionales o farmacológicos que predisponen al paciente a una infección persistente o recurrente o a fracaso del tratamiento. Estos factores incluyen condiciones a menudo encontradas en ancianos –ampliación de la próstata, obstrucciones y otros problemas que requieren la colocación de dispositivos urinarios y a la presencia de bacterias resistentes a antibióticos múltiples. Su espectro comprende desde una cistitis complicada hasta una urosepsis con choque séptico.
• ITU o bacteriuria asintomática: esta patología se caracteriza porque los pacientes pueden tener una bacteriuria significativa (≥ 105 UFC/mL de orina) sin presentar síntomas por lo que, no se aconseja tratamiento.
• ITU recurrente: cuando presenta más de tres episodios de ITU demostrados por cultivo en un período de un año.
• ITU nosocomial: refiere ITU nosocomial a la aparición de infección urinaria a partir de las 48 horas de hospitalización de un paciente sin evidencia de infección, asociada a algún procedimiento invasivo, en especial, colocación de un catéter urinario.
1.1.3 Fisiopatogenia
En los adultos, las ITU predominan en las mujeres. Se presenta de manera frecuente asociada con dos eventos importantes de su vida.
a) En el embarazo.
Ciertas características de la anatomía femenina predisponen a la infección: primero, la vecindad de tres orificios naturales (vagina, uretra y ano; este último generalmente colonizado por microorganismos Gramnegativos) y segundo, la longitud de la uretra. Otros factores incluyen el incremento de orina residual secundaria a problemas de estática pélvica y la actividad sexual, ya que el coito favorece la colonización de vías urinarias por microorganismos vulvo–perineales (18).
Además, durante el embarazo existen algunos factores que incrementan la susceptibilidad al desarrollo de ITU:
• La progesterona induce disminución del tono muscular liso, lo cual disminuye el peristaltismo ureteral y dificulta el vaciado vesical. Además, puede alterar la expresión del factor acelerador de la degradación, que es un regulador del complemento y sirve como receptor a muchos patógenos, entre ellos la E. coli. • Los cambios anatómicos que favorecen la elevación anterosuperior de vejiga,
la compresión de uréteres, más en el lado derecho, y de esta forma, un incremento de la estasis urinaria.
• Un estado hipertónico renal, lo cual inhibe la migración leucocitaria, la fagocitosis y la actividad del complemento, así como una menor actividad de linfocitos T, con lo que se favorecen los procesos infecciosos (18).
Por otra parte, la ITU es la complicación médica más frecuente en la mujer embarazada. El tratamiento es obligatorio, además de ser el único estado en el cual se debe tratar la bacteriuria asintomática por las implicaciones de morbimortalidad perinatal (el parto prematuro, que es responsable del 75 % de las muertes neonatales y del 50 % de las alteraciones neurológicas a largo plazo). Además, el embarazo hace a la mujer especialmente susceptible por los factores ya expuestos, esto complica la infección inicial baja y la convierte en una pielonefritis aguda, cuya incidencia se incrementa en un 7 %.
Existe un grupo creciente de pacientes en el cual la ITU se asocia a la actividad sexual. El espectro de este fenómeno va desde la llamada ''cistitis de la luna de miel'' hasta múltiples recurrencias de infección. En estos casos, se justifica la aplicación de diversas medidas higiénico-dietéticas y el uso de antimicrobianos postcoitales en monodosis (18).
hiperplasia de la próstata, que dificulta la excreción de la orina y provoca que se retenga una cierta cantidad en la vejiga tras orinar. Esta orina residual favorece el crecimiento de gérmenes y puede causar una infección
(19).
En general, la E. coli es el microorganismo implicado con mayor frecuencia y no muestra grandes variaciones entre los distintos grupos de edad ni sexo, sin embargo, existen microorganismos que aparecen más frecuentemente en un determinado grupo de población como por ejemplo Proteus spp en los varones menores de 14 años y mayores de 60 años y S. Saprofiticus en mujeres jóvenes (20).
1.1.4 Síntomas
Los síntomas que acompañan a una infección de orina varían de acuerdo al sitio de la infección:
ITU de vías altas
• Pielonefritis aguda: el típico cuadro clínico incluye fiebre y dolor lumbar, puede haber nausea y vómitos. En el examen físico hay dolor a la palpación o a la puño-percusión lumbar. En el laboratorio, aparte de las alteraciones de la orina, hay leucocitosis y elevación de la proteína C reactiva. Algunas veces, el dolor es abdominal (no lumbar) y el cuadro puede simular otros cuadros sépticos abdominales (21).
• Pielonefritis complicada: los síntomas pueden presentarse luego de un largo tiempo; no aparece fiebre como con otras manifestaciones de la pielonefritis aguda. Sin embargo, esta patología compromete, tras cierto tiempo, la función renal, lo que en casos extremos puede derivar en insuficiencia renal. Las posibles molestias se dan a modo de brotes y son menos características como:
✓ Agotamiento
✓ Sudoración excesiva
✓ Dolor de espalda
✓ Trastornos gastrointestinales como náuseas y vómitos
✓ Pérdida de peso
las sustancias de desecho, tales como los productos derivados del metabolismo (19).
ITU de vías bajas
• Cistitis: la cistitis se caracteriza por la presencia de disuria, polaquiuria, micción urgente (síndrome miccional), acompañados a menudo de dolor suprapúbico y orina maloliente y en ocasiones hematuria. En la mujer y en el anciano es relativamente frecuente la incontinencia urinaria. La presencia de fiebre, dolor lumbar o una puñopercusión positiva indican infección del riñón (pielonefritis). Existe riesgo de afección renal subclínica en todos los varones y en las mujeres con cualquiera de las siguientes situaciones: embarazo, edad menor de 5 años, infección previa en el último mes, clínica de más de una semana de evolución, inmunodepresión, diabetes, insuficiencia renal, anomalía anatómica o funcional de la vía urinaria o infección por Proteus spp (22). Puede haber una relación temporal con la actividad sexual, donde se incluye el inicio de ésta, llamada también “cistitis de la luna de miel” (20).
• Uretritis: los principales síntomas incluyen secreción purulenta por la uretra, ardor al orinar, sangre en el semen, incomodidad en los órganos genitales, dolor durante las relaciones sexuales y sangre en la orina (23).
• Prostatitis: se caracteriza porque la próstata puede estar hinchada y dolorosa en el tacto rectal. El masaje prostático está contraindicado y la próstata suele ser normal a la palpación, también, existe aparición de dolor perineal o lumbar, asociado a disuria y fiebre. Algunos pacientes refieren dolor a la eyaculación. El antígeno prostático específico aumenta transitoriamente en la mayoría de los casos (24).
Bacteriuria asintomática
En este cuadro clínico los pacientes por lo general no presentan síntomas (17).
1.1.5 Etiología
a) ITU adquirida en la comunidad: la E. coli es el germen causal que se encuentra con más frecuencia en especial en las ITU ambulatorias no complicadas (80-90 %). El resto de las ITU son producidas por otras enterobacterias como el Proteus mirabilis y Klebsiella spp. El Streptococus saprophytus es frecuente en mujeres con actividad sexual, en cambio el Proteus mirabilis es habitual en niños varones recién nacidos menores de 2 años. El Enterococo faecalis es frecuente en sujetos ancianos con síndrome prostático.
b) ITU adquirida en el hospital: La E.Coli se aísla en el 50 % de los casos, en el resto puede aparecer Enterobacter, Citrobacter, Pseudomona aeruginosa, Serratia, Providencia, Morganella y gérmenes Grampositivos como Enterococcus, Streptococcus y Staphylococcus epidermidis. La proporción de infecciones causadas por Candida está incrementada, siendo sus factores de riesgo de infección: a) sondaje, b) instrumentación de la vía urinaria, c) diabetes mellitus, d) tratamiento antibiótico, y e) trasplante renal (15).
En las ITU por Staphylococcus aureus y Salmonella hay que sospechar de una bacteriemia de cualquier origen con afectación renal hematógena, aunque las ITU por estafilococo también pueden aparecer en pacientes sondados.
El Corynebacterium urealyticumes de crecimiento lento en los medios de cultivo (2-3 días) lo que dificulta su detección, aparece en pacientes con sondajes o nefrostomías de larga evolución. Es un germen productor de ureasa y se asocia a litiasis infecciosa e incrustaciones a lo largo de toda la vía urinaria dando lugar a pielitis y cistitis incrustante. Por último, las ITU por Gardnerella vaginalis se observan en el embarazo.
Estas diferencias observadas entre ITU en la comunidad e infecciones nosocomiales se explican por el aumento de las resistencias bacterianas, el déficit inmunológico en general, los cambios en la composición de la flora gastrointestinal de los pacientes ingresados, la frecuente instrumentación urológica y las propias alteraciones estructurales u obstructivas del aparato urinario (15).
1.1.6 Diagnóstico de las ITU altas
El diagnóstico de las ITU se basa fundamentalmente en dos pilares básicos:
1.1.6.1 Diagnóstico de laboratorio
Para realizar el diagnóstico de estas patologías, se utilizan diferentes métodos entre los que se encuentran:
Tiras reactivas
Las tiras reactivas deben ser interpretadas de la siguiente manera:
• Si la tira reactiva presenta la lectura de leucocitos positivos y nitritos positivos: se debe enviar la muestra para urocultivo y examen de orina completo con inicio de tratamiento antibiótico.
• Lectura de leucocitos negativos, nitritos positivos: en el caso de una muestra fresca se debe realizar examen de orina completo más urocultivo e iniciar antibiótico.
• Lectura de leucocitos positivos, nitritos negativos: si no existen síntomas específicos de ITU se debe esperar hasta obtener resultados de los exámenes de orina y urocultivo y considerar en este caso infección genital.
• Lectura de leucocitos negativos, nitritos negativos: si el paciente no presenta sintomatología se debe descartar ITU, en cambio, en pacientes sintomáticos se debe tomar una muestra de orina y realizar urocultivo para descartar ITU y buscar otras patologías que puedan ser la causa de la sintomatología.
• La detección de nitritos con las tiras reactivas tiene una alta sensibilidad (> 90 %) pero baja especificidad (50 %). Además, existen bacterias que no producen nitritos al no poseer nitrato reductasa, como Pseudomona, Acinetobacter, y Candidas.
• La presencia de cilindros leucocitarios es diagnóstica de pielonefritis, aunque aparecen con poca frecuencia.
• La presencia de bacteriuria en orina sin centrifugar (40x), recogida en condiciones de esterilidad, tiene una alta sensibilidad y especificidad para el diagnóstico de ITU (15).
Examen elemental de orina
Urocultivo
El urocultivo se recomienda en casos de sospecha de pielonefritis, síntomas persistentes o que recurren dentro de las primeras 2 a 4 semanas de haber concluido el tratamiento y en caso de síntomas atípicos (20).
Con respecto al método de recolección de orina es importante minimizar los riesgos de contaminación en la toma de muestra, por lo tanto, previamente debe realizarse un lavado de genitales con agua y jabón sin antisépticos. La muestra debe ser tomada y sembrada de inmediato (orina fresca), si esto no es posible se mantendrá refrigerada a 4° C por un tiempo máximo de 24 horas.
Es importante destacar que la muestra debe ser tomada por personal médico; existen métodos de recolección no invasivos como bolsa recolectora, recolección de segundo chorro y métodos invasivos como sondeo transuretral y punción vesical. El urocultivo requiere mínimo 18 h de incubación para poder informar si hay crecimiento bacteriano, por lo tanto, es recomendable apoyar el diagnóstico en elementos del examen de orina validados como sugerentes de ITU y posteriormente, confirmar con urocultivo (19).
El diagnóstico diferencial más importante se realiza con las infecciones vulvovaginales, donde es común que la paciente confunda la disuria con el ardor vulvar terminal, que produce irritación por la orina en la vulva inflamada. La vejiga hiperactiva es otro de los diagnósticos diferenciales (19).
Sedimento urinario
Se trata de la primera prueba ante una sospecha de ITU. La leucocituria, o piuria, se define como la presencia de > 5 leucocitos por campo (40x) en orina centrifugada, que equivalen a un recuento de > 20 leucocitos/mm3 en orina sin centrifugar. En pacientes sintomáticos se detecta piuria en el 95 % de las ocasiones, la ausencia de piuria hace poco probable el diagnóstico de ITU. Los falsos negativos suelen deberse a inicio previo de tratamiento antibiótico, orinas poco concentradas o muy alcalinas, o infección en su fase inicial (15).
En pacientes sintomáticos
• Síndrome uretral y uretritis • Tuberculosis genitourinaria • Prostatitis
En pacientes asintomáticos
• Nefropatías intersticiales (agudas y crónicas) • Nefropatía por analgésicos
Tinción de Gram
En ocasiones puntuales, para orientar un tratamiento empírico, se recurre a una tinción de Gram. Lo característico es utilizarla ante un enfermo con ITU nosocomial y sepsis para establecer si se está ante un germen Grampositivo (Enterococcus), o Gramnegativo; también se utilizan tinciones especiales de Ziehl Nielsen para bacilos ácido-alcohol-resistentes (positiva en un 50 % de las tuberculosis urinarias) (15).
Urocultivo en medio aerobio
En pacientes asintomáticos, el número de colonias se debe expresar:
• En mujeres: >105 colonias/mL
• En hombres: > 104 colonias/mL
A esta circunstancia, en ausencia de clínica, se le denomina bacteriuria asintomática, y deben cumplirse los criterios mencionados en dos urocultivos diferentes.
En pacientes sintomáticos: la presencia de más de 103 colonias/mL se considera significativa y debe instaurarse tratamiento antibiótico.
1.1.6.2 Anamnesis y examen clínico
La presencia de dolor en la fosa renal, nauseas, vómito, fiebre (> 38,5 °C) o hipersensibilidad en el ángulo costo vertebral indica pielonefritis aguda, que puede ocurrir en ausencia de síntomas de cistitis (por ejemplo, disuria y poliquiuria) (24).
1.1.7 Diagnóstico de las ITU baja
Cistitis aguda
• Diagnóstico de laboratorio: un análisis de tira reactiva, en contraposición a la microscopia urinaria, es una alternativa razonable al análisis de orina para diagnosticar una cistitis aguda no complicada.
• Anamnesis y examen clínico: el diagnóstico puede establecerse con una probabilidad elevada a partir de unos antecedentes de síntomas irritativos (disuria, poliquiuria y tenesmo vesical) y de la ausencia de secreción o irritación vaginal en mujeres que no presentan otros factores de riesgo de ITU complicada.
Se recomienda practicar urocultivos en los siguientes casos: a) sospecha de pielonefritis aguda, b) síntomas que no se resuelve o que reaparecen en las 2 - 4 semanas siguientes a la finalización del tratamiento y c) mujeres que manifiestan síntomas atípicos (24).
Uretritis
En esta patología, si es recurrente, debe diagnosticarse mediante urocultivo y no se recomienda la práctica sistémica de una urografía excretoria, cistografía o citoscopia para evaluar a las mujeres con ITU recurrentes (24).
Prostatitis
El diagnóstico de esta patología se obtiene mediante la demostración de inflamación prostática y para ello es necesario evaluar la secreción prostática. Se considera que la inflamación es clínicamente significativa cuando la secreción prostática contiene 10 o más leucocitos por campo microscópico de alto aumento (x 40 aumentos), también, es de ayuda la visión de macrófagos cargados de lípidos (cuerpos ovales).
1.1.8 Tratamiento
Los objetivos del tratamiento en la infección de vías urinarias están enfocados a la obtención de una respuesta rápida y efectiva, a la prevención de la recurrencia y evitar la aparición de resistencia a los antibióticos. El tratamiento de la ITU depende de si es complicada o no complicada y siempre se debe tener en cuenta factores de riesgo. Es importante seleccionar en forma empírica el tratamiento hasta que se cuente con el resultado del antibiograma que indique cuál es el antibiótico con la mejor eficacia para tratar el agente sospechado, que tenga muy buena distribución corporal, alta concentración en las vías urinarias y toxicidad baja.
La elección de un antibiótico, en diversas infecciones, depende de los niveles de concentración plasmática que alcanza el antibiótico para lograr una susceptibilidad antimicrobiana alta. Pero, en el caso de las ITU, lo importante es la concentración del antibiótico en el parénquima renal, en la capa más profunda de la pared de la vejiga y de la próstata (21).
Por tanto, la excreción-concentración urinaria y la determinación de la actividad del antibiótico en la orina son importantes para la decisión de si su uso se justifica o no en el tratamiento de la ITU. Cuando se elige un betalactámico, por ejemplo, el éxito terapéutico depende del tiempo en que la concentración del antimicrobiano permanece por encima de la concentración inhibitoria mínima (CIM); por tanto, cuanto mayor es el tiempo que la concentración del antibiótico está por encima del CIM, mejor será el resultado terapéutico.
Entonces, muchas veces el fracaso terapéutico con un betalactámico se debe a que se prescribe a intervalos muy largos o a concentraciones muy bajas.
En el caso de los antimicrobianos con actividad dependiente de los picos de concentración máxima sobre la CIM, como los aminoglucósidos y las quinolonas, el resultado adecuado de la terapia se basa en dosis que garanticen picos máximos de concentración antibiótica en relación al CIM con relativa independencia al tiempo de concentración mantenido bajo la curva (21).
1.1.8.1 Tratamiento de las ITU de vías altas
Pielonefritis aguda
complicada pueden utilizarse como guía para el tratamiento empírico de pielonefritis; sin embargo, S. saprophyticus es menos frecuente en la pielonefritis aguda que en la cistitis aguda.
En los casos leves y moderados de pielonefritis aguda no complicada suele ser suficiente un tratamiento oral de 10-14 días, también, se recomienda una fluoroquinolona durante 7-10 días como tratamiento de primera línea cuando la tasa de resistencias de E. coli sigue siendo < 10 %. Si se aumenta la dosis de la fluoroquinolona, el tratamiento puede reducirse probablemente a 5 días. Sin embargo, en algunas partes del mundo ya se ha identificado un número cada vez mayor de E. coli resistente a fluoroquinolonas en el ámbito comunitario, lo que restringe el uso empírico de estos antibióticos.
Una alternativa podría ser una cefalosporina oral de tercera generación, como cefpodoxima; sin embargo, en los estudios existentes sólo se ha demostrado una eficacia clínica, pero no microbiológica, equivalente en comparación con ciprofloxacino (24).
Como resultado del aumento de las tasas de resistencia de E. coli > 10 %, el cotrimoxazol no resulta adecuado para el tratamiento empírico en la mayor parte de las regiones, aunque puede emplearse después de confirmar la sensibilidad en un antibiograma.
No se recomienda el uso de amoxicilina-ácido clavulánico como fármaco de primera elección para el tratamiento empírico oral de la pielonefritis aguda. Sí se recomienda cuando el antibiograma revela la presencia de un microorganismo Grampositivo sensible.
En los casos graves de pielonefritis aguda en los que las pacientes no pueden tomar medicamentos orales debido a los síntomas sistémicos como náuseas y vómitos tienen que ser tratadas inicialmente con uno de los siguientes antibióticos parenterales:
• Una fluoroquinolona parenteral en las comunidades con tasas de resistencia a fluoroquinolonas de E. coli < 10 %.
• Una cefalosporina de tercera generación en las comunidades con tasas de resistencia de E. coli productor de BLEE < 10 %.
• Una aminopenicilina más un inhibidor de betalactamasas en los casos de patógenos Grampositivos con sensibilidad conocida.
• Un aminoglucósido o carbapenémico en las comunidades con tasas de resistencia a fluoroquinolonas de E. coli productor de BLEE > 10 %.
Tras la mejoría, los pacientes pueden pasar a recibir un régimen oral con uno de los antibióticos mencionados anteriormente (en caso de ser activo contra el microorganismo infeccioso) hasta completar el ciclo de tratamiento de 1-2 semanas (24).
1.1.8.2 Tratamiento de las ITU de vías bajas
Cistitis
Para el tratamiento de esta patología se recomienda de entrada un tratamiento
antibiótico porque el éxito clínico es significativamente más probable en las mujeres tratadas con antibióticos que con placebo.
La elección de un antibiótico como tratamiento empírico ha de estar guiada por: • Espectro y patrones de sensibilidad de los uropatógenos etiológicos. • Eficacia en la indicación concreta en estudios clínicos.
• Tolerabilidad. • Efectos adversos. • Coste.
• Disponibilidad.
• Fluoroquinolonas: ciprofloxacino 250 mg a 500 mg cada 12 horas o norfloxacino 400 mg cada 12 horas o trimetropim-sulfametoxazol 160/800 mg cada 6 horas por 6 a 7 días.
• Nitrofurantoína: 100 mg cada 6 horas por 7 días.
Los tratamientos por más de 7 días provocan más efectos adversos por lo que estos sólo se recomiendan en mujeres con síntomas de más de 7 días, hombres, y pacientes con signos de posible complicación (diabetes mellitus, mayores de 65 años, y personas que presentaron ITU recurrente).
Para ITU recurrente se puede seleccionar uno de los tratamientos antes expuestos, pero estos tendrán una duración de 10 a 14 días (24).
Uretritis
El tratamiento para los pacientes que están con esta patología depende del microorganismo presente, así, en los pacientes infectados con N. gonorrhoeae para asegurar su complimiento terapéutico se recomienda la indicación de esquemas de dosis única de ceftriaxona 1 250 mg IM, u ofloxacino 400 mg vía oral, o ciprofloxacina 500 mg vía oral.
Por otra parte, en algunos pacientes con frecuencia se identifican infecciones concomitantes con C. trachomatis, por lo que se recomienda que los pacientes tratados de una uretritis rutinariamente también, reciban tratamiento contra la infección potencial, azitromicina 1g vía oral dosis única 0 100 mg cada 12 horas por siete días.
Los casos de uretritis resistente a quinolonas continúan en aumento, lo que hace en diversas regiones del mundo no admisible el tratamiento con estos antimicrobianos. La resistencia a ciprofloxacina usualmente indica resistencia a otras quinolonas (26).
Prostatitis
que les avale. Las tetraciclinas y macrólidos únicamente deben considerarse en situaciones etiológicas atípicas (Chlamydia, Mycoplasma) (22).
La duración del tratamiento antibiótico es motivo de controversia, se han recomendado ciclos entre 2 y 12 semanas (habitualmente entre 4 y 6 semanas). Esto es debido a que las bacterias se agrupan en pequeñas microcolonias en la profundidad del tejido prostático, en ocasiones protegidas por microcálculos o biopelícula ("slime") o bien por su localización primitivamente intracelular (22).
1.1.9 Prevención
De acuerdo con la Guía de Práctica Clínica Colombiana para el tratamiento de las ITU, existen diversas maneras de prevenir esta enfermedad, entre ellas están el manejo de las enfermedades concomitantes como vulvovaginitis y vaginosis bacteriana, disminuir el número de compañeros sexuales, la higiene personal convencional del área urogenital y el vaciamiento vesical frecuente, las cuales son de mucha importancia para reducir la adhesión bacteriana a la mucosa del tracto urinario (27).
En México, el Sistema Nacional de Vigilancia Epidemiológica reportó que en 2010 las ITU ocuparon el tercer sitio dentro de las principales causas de morbilidad; por ello, dentro de las medidas de prevención que recomiendan en niñas y mujeres está la ingesta apropiada de líquidos (en especial agua), usar ropa interior de algodón, que no sea ajustada y lavarla con jabón suave, limpiar el área genitourinaria con agua y jabón cuando menos una vez al día, bañarse bajo la regadera en lugar de tina y evitar baños de aceite, talco, rociadores, duchas o lavados vaginales.
En mujeres, se recomienda orinar después del coito y evitar productos que contengan perfume u otros alérgenos cerca del área genitourinaria (18).
En cuanto al uso de extractos liofilizados (fracciones inmuno-activas) de E. coli administrados durante 3 meses de manera diaria en pacientes con infecciones recurrentes de vías urinarias, en 2002 se realizó un metanálisis que incluyó cinco estudios controlados con placebo, aleatorizados, doble ciego, con un diseño de estudio similar. En estos estudios se demostró que los extractos actuaron como inmunoestimulantes, con una aproximación profiláctica efectiva de la infección recurrente de vías urinarias.
En las infecciones del tracto urinario recurrentes, se sugiere el empleo de jugo de arándano ya que contiene fructosa y proantocianidinas que, al parecer, son afines a las fimbrias de E. coli, las cubren y evitan que se unan a los receptores glucosídicos de las células del tejido urinario, esto disminuye la colonización de las vías urinarias a causa de este microorganismo.
Aunque la acidificación de la orina a través de ácido ascórbico ha mostrado algunos resultados alentadores, se requiere realizar nuevas investigaciones controladas con placebo y doble ciego ya que actualmente, resulta poco práctico, difícil e innecesario lograr y mantener la acidificación de la orina, ya que la mayoría de los antibióticos presentan una acción adecuada con los valores de pH usuales de la orina (18).
1.2 Resistencia bacteriana
1.2.1 Definición
La resistencia a los antimicrobianos se produce cuando los microorganismos (bacterias, hongos, virus y parásitos) sufren cambios al verse expuestos a los antimicrobianos (antibióticos, antifúngicos, antivíricos, antipalúdicos o antihelmínticos). Los microorganismos resistentes a la mayoría de los antimicrobianos se conocen como ultrarresistentes, como resultado, los medicamentos se vuelven ineficaces y las infecciones persisten en el organismo, lo que incrementa el riesgo de propagación a otras personas (28).
La resistencia bacteriana no es un fenómeno nuevo. En un principio, se reconoció como una curiosidad científica y luego como una amenaza a la eficacia del tratamiento. Sin embargo, el desarrollo de nuevas familias de antimicrobianos en las décadas de 1950 y 1960 y las modificaciones de esas moléculas en la décadas de los años 70 y 80, crearon una falsa sensación de seguridad y la creencia de que siempre se puede adelantar a los agentes patógenos, sin embargo, al comenzar el nuevo siglo, la generación de nuevos antimicrobianos está estancada y son pocos los incentivos para elaborar otros nuevos que permitan combatir el problema mundial de la resistencia (3).
incrementen los costos médicos, que se prolonguen las estancias hospitalarias y que aumente la mortalidad.
Existe por ejemplo, un creciente número de infecciones, como la neumonía, la tuberculosis, la septicemia, la gonorrea o las enfermedades de transmisión alimentaria que son cada vez más difíciles y a veces imposibles de tratar a medida que los antibióticos pierden eficacia (28).
Existen países donde los antibióticos se pueden adquirir sin receta médica para uso humano o veterinario, es ahí donde la resistencia del fármaco empeora, ya que el personal sanitario y veterinario tiene tendencia a prescribirlos sin ninguna política de control y por ende, la población general a consumirlos en exceso (28).
La resistencia bacteriana se sustenta en varios hechos, los datos de tendencia histórica de variaciones de la concentración mínima inhibitoria (CMI) a lo largo del tiempo indican que, en general, los valores de concentración mínima inhibitoria 90 (que inhiben al 90 % de una especie o grupo bacteriano), son menores en la actualidad que en el momento en que se descubrió el antimicrobiano considerado.
El patrón de uso de los antimicrobianos en un determinado entorno, se relaciona habitualmente con el de la resistencia existente en éste (un buen ejemplo es el medio hospitalario y, en su situación extrema, las unidades de cuidados intensivos). En un sentido más restrictivo, los pacientes de quienes se obtienen cepas resistentes han recibido más antimicrobianos que aquellos de los que se obtienen cepas más sensibles (29).
1.2.2 Tipos de resistencia a los antibióticos
La resistencia de las bacterias a los antibióticos puede ser natural, adquirida, provenir de mutaciones o bien originarse por transferencia de genes.
Resistencia natural
Este tipo de resistencia puede producirse por particularidades de la pared bacteriana que impiden acceder al antibiótico a su blanco, este el caso de las bacterias Gramnegativas que son impermeables a la penicilina G. En otros casos, algunas bacterias como los micoplasmas, carecen de una pared celular típica y son resistentes a las penicilinas. También, el organismo puede alterar el antibiótico pasándolo a una forma inactiva por la producción de enzimas que hidrolizan o modifican la molécula. En el caso de la resistencia natural, todas las bacterias de la misma especie son resistentes a algunas familias de antibióticos y eso les permite tener ventajas competitivas con respecto a otras cepas y pueden sobrevivir en caso que se emplee ese antibiótico (31).
Resistencia adquirida
La resistencia adquirida constituye un problema hospitalario, ya que se detectan en las pruebas de sensibilidad, los fracasos terapéuticos en un paciente infectado con cepas de un microorganismo que en otros tiempos eran sensibles.
La aparición de la resistencia en una bacteria se produce a través de mutaciones (cambios en la secuencia de bases de cromosoma) y por la trasmisión de material genético extracromosómico procedente de otras bacterias. En el primer caso, la resistencia se trasmite de forma vertical de generación en generación. En el segundo, la trasferencia de genes se realiza horizontalmente a través de plásmidos u otro material genético movible como integrones y transposones; esto último no solo permite la trasmisión a otras generaciones, sino también, a otras especies bacterianas. De esta forma una bacteria puede adquirir la resistencia a uno o varios antibióticos sin necesidad de haber estado en contacto con estos (30).
Resistencia por mutación
La resistencia por mutación sólo afecta a un pequeño porcentaje (del 1 % al 2 %) de cepas aisladas. El fenómeno de la mutación aparece espontáneamente con una frecuencia de 106 a 109, según el tipo de bacteria y las características ambientales. La contribución del antibiótico es seleccionar las bacterias mutantes que aparecen en la población bacteriana sensible.
bacterias mutantes resistentes al no dejar ningún superviviente, sin embargo, algunas mutaciones cromosómicas pueden conferir resistencia simultánea a varios antibióticos pertenecientes a familias diferentes, lo que hace inútil la aplicación de una terapia antibiótica múltiple (31).
En efecto, en el medio hospitalario se aíslan regularmente gérmenes multirresistentes a los betalactámicos, cloramfenicol, trimetropim-sulfametoxazol y tetraciclinas. La causa de esta multirresistencia es la mutación que modifica unas moléculas llamadas porinas que permiten el paso de estos antibióticos a través de la pared bacteriana y provocan la impermeabilidad de la célula bacteriana. Este tipo de resistencia se da con particular frecuencia en algunas enterobacterias como Klebsiella, Enterobacter y Serratia (31).
Resistencia por transferencia de genes
El mecanismo de transferencia de genes entre bacterias permite una difusión rápida y extensa de la información genética. Se producen estas transferencias tanto en bacterias Grampositivas como Gramnegativas y se califican como horizontales, ya que se dan con independencia de todo mecanismo de reproducción. Cuando el fenómeno se presenta durante la reproducción bacteriana se habla de transferencia génica vertical. Los mecanismos diferentes que permiten esta transferencia horizontal son: transducción, transformación y la conjugación.
• Transducción: en este mecanismo, un bacteriófago es capaz de transferir un fragmento de ADN de una bacteria a otra. Algunas de estas proteínas incluyen ADN fragmentado bacteriano que al infectar a una nueva bacteria puede introducir algunos nuevos genes, entre ellos los causantes de la resistencia bacteriana a los antibióticos
• Transformación: permite la adquisición y la incorporación de ADN exógeno desnudo. En este caso un fragmento de ADN presente en el medio externo es captado por la bacteria. Cuando las bacterias mueren y su membrana ha sido más o menos destruida liberan fragmentos de ADN que pueden ser captados por otras bacterias, por lo tanto, la información transmitida por el mecanismo de transformación es de carácter universal y permite la creación de genes quimeras muy resistentes a los antibióticos.
receptora, sintetizan de nuevo la hebra complementaria, de modo que al final de la conjugación cada uno de los microorganismos posee una doble hebra de ADN, lo que amplia notablemente la resistencia (31).
1.2.3 Mecanismos de resistencia
Un antibiótico necesita alcanzar su diana de acción, en una concentración suficiente y durante el tiempo adecuado, para poder inhibir el crecimiento o causar la muerte bacteriana. Las bacterias pueden utilizar diferentes mecanismos generales para hacerse resistentes a la acción de los antibióticos, entre los cuales se encuentran (2):
• Evitar que el antibiótico entre en la bacteria. En este sentido, las bacterias pueden modificar su pared celular o su membrana haciéndola impermeable a la entrada del antibiótico.
• Producir enzimas que modifican o inactivan al antibiótico. Este es el caso por ejemplo, de las betalactamasas, enzimas de gran importancia implicadas en la inactivación de los antibióticos betalactámicos.
• Modificar la diana de acción del antibiótico, de tal manera que este compuesto no pueda ejercer su acción inhibitoria.
• Expulsar el antibiótico al exterior de la bacteria, a través de la actuación de unas bombas de flujo, que eliminen el antibiótico fuera de la célula.
• Proteger la diana o el antibiótico para evitar la interacción entre ambos.
1.2.4 Causas de la resistencia bacteriana
Causas genéticas
Cuando existe una mutación en el proceso de replicación del ADN, el proceso ya no es seguro. Por término medio, se produce una mutación en un gen concreto en aproximadamente 1 de cada 108 bacterias de una población. Si el gen mutado proporciona una ventaja competitiva en términos de supervivencia cuando exista un antimicrobiano, la población natural (con el gen salvaje sensible) morirá o se inhibirá, pero la población mutante sobrevivirá y podrá reemplazar a la población original. Éste es el principio básico que explica la capacidad de los antibióticos para seleccionar bacterias resistentes.
Causas bioquímicas
Los genes de resistencia codificarán primero a nivel bioquímico los mecanismos responsables de resistencia bacteriana de manera directa o indirecta. Entre los principales se encuentran:
1. Disminución de la permeabilidad
La penetración de antimicrobianos a través de la membrana externa de las bacterias Gramnegativas puede tener lugar a través de lipopolisacáridos o a través de las porinas (canales hidrófilos). La pérdida de una o más porinas o su modificación estructural, hace a las bacterias más estrechas (física o funcionalmente) por lo que disminuye la penetración delos antimicrobianos.
También, se han descrito modificaciones del lipopolisacárido como causa de la disminución de la permeabilidad de la membrana externa de bacterias Gramnegativas. La disminución aislada de la permeabilidad causa un bajo nivel de resistencia (incremento de 2 a 8 veces, por lo general), pero asociada en el mismo microorganismo a otros mecanismos contribuye a un notable aumento del nivel de resistencia.
2. Modificación del antimicrobiano
Las betalactamasas son enzimas que hidrolizan el anillo β-lactámico y causan resistencia a los compuestos afectados. Se conocen cientos de variantes de este tipo de enzimas, ya que pueden tener codificación cromosómica o plasmídica, y producirse de forma constitutiva o inducible.
Muchos microorganismos (en especial los Gramnegativos) poseen genes intrínsecos que codifican enzimas de este tipo. La cantidad y la naturaleza de la enzima producida influyen en el fenotipo de resistencia observado. Algunas enzimas tienen un corto espectro de actividad, mientras que otras, como las betalactamasas de espectro extendido, carbapenemasas, etc, hidrolizan muchos o la totalidad de los β-lactámicos actualmente disponibles.
Algunas betalactamasas se inhiben por compuestos específicos (como el ácido clavulánico, el tazobactam, etc.), por lo que las combinaciones de ciertos β-lactámicos con dichos inhibidores permiten una acción antibacteriana clínicamente útil. Por desgracia, muchas bacterias tienen resistencia natural a dichas combinaciones, mientras que otras se han hecho resistentes a éstas.
3. Eliminación activa
Los microorganismos poseen bombas (proteínas) de expulsión que, mediante consumo de energía, eliminan al medio externo los antimicrobianos que han penetrado en su interior. Estas proteínas se sitúan en la membrana citoplásmica y, en ocasiones, forman parte de un complejo funcional del que participan otras 2 proteínas, una de las cuales, actúa como canal por donde se expulsa el antimicrobiano y otra, como proteína acopladora. Otras, denominadas genéricamente bombas de expulsión multidroga (quizá las más relevantes), pueden expulsar diversos tipos de compuestos.
4. Alteración, protección o hiperproducción de la diana