Universidad Andrés Bello Facultad de Ciencias Biológicas Escuela de Ingeniería en Biotecnología
Optimización de una formulación farmacológica para tratar
infecciones recurrentes causadas por
C. difficile
.
“Tesis presentada como parte de los requisitos para optar al grado de Magister en Biotecnología”.
Profesor patrocinante: Dr. Daniel Paredes-Sabja
Microbiota Host Interactions and Clostridia Research Group Facultad de Ciencias Biológicas
Universidad Nacional Andrés Bello
Juan Andrés Muñoz Miralles Santiago, Chile.
Universidad Andrés Bello Facultad de Ciencias Biológicas Escuela de Ingeniería en Biotecnología
Optimización de una formulación farmacológica para tratar
infecciones recurrentes causadas por
C. difficile
.
Juan Andrés Muñoz Miralles
Esta Tesis fue realizada bajo la supervisión del Dr. Daniel Paredes-Sabja en las instalaciones del laboratorio Microbiota Host Interactions and Clostridia Research Group, Facultad de Ciencias Biológicas, Universidad Nacional Andrés Bello, aprobado por los miembros de la Comisión de Evaluación
_____________________ _____________________ Dr. Daniel Paredes-Sabja Dr. Fernando Gil Michell Director de Tesis Comisión de Tesis
_____________________ Dr. Iván Calderón Lizana Comisión de Tesis
Financiamiento
A mis padres
Agradecimientos
Agradecer al, director de Tesis el Dr. Daniel Paredes-Sabja, por guiarme en este trabajo y darme la oportunidad de desarrollar mi tesis en su laboratorio y de crecer profesionalmente.
A los miembros de la comisión, el Dr. Iván Calderón y el Dr. Fernando Gil por el apoyo y la disposición a ayudarme en la realización de este trabajo.
A los amigos del laboratorio Microbiota Host Interactions and Clostridia Research Group, Angelú, la distante pero presente Cata, Enzo, Fran, Marjo, Nano, Pablo, Pao, Pauli, Rodrigo, Scarlett y Vale quienes aún están y también a los que ya partieron; Juan Pablo, Seba, Edgar, Glenda y Valeria.
A Maca, por acompañarme en este tiempo, por ser un apoyo y un alivio cunado las cosas no salían bien y por ayudarme a disfrutar de este viaje.
A los amigos de la Universidad, Jaime, Brito, Feña, Don Mauro y Alonso y tantos otros por estar en este periodo y ser parte importante de todo esto.
A mis amigos de siempre Carlos, Cristopher, Felipe y Seba quienes se interesaban en algo que no entendían y escuchaban atentos, por entender los tiempos y apoyar en cuanto podían.
A mis abuelos por preocuparse de mí. A mis tíos y primos, por estar ahí para ayudar en lo que fuese necesario.
1 Índice General
1. Índice de Tablas ... 4
2. Índice de Figuras ... 5
3. Lista de Abreviaturas... 6
4. Resumen ... 8
5. Summary ... 9
6. Introducción ... 10
6.1. Clostridium difficile y su importancia clínica... 10
6.2. Patogénesis y factores de virulencia de C. difficile ... 11
6.3. Recurrencia en la infección por C. difficile ... 12
6.4. Ingreso de esporas de C. difficile como mecanismo de persistencia. ... 13
6.5. Indometacina como inhibidor de la formación de caveolas. ... 14
6.6. Nistatina como inhibidor de la formación de caveolas... 16
6.7. Taurocolato como germinante de la espora de C. difficile. ... 17
6.8. Modelos animales para el estudio de la Infección por C. difficile. ... 18
7. Hipótesis ... 22
8. Objetivo general ... 22
9. Objetivos específicos ... 22
10. Materiales y Métodos ... 23
10.1. Evaluación del impacto de distintos agentes antibióticos en el modelo murino de recurrencia de la infección causada por C. difficile. ... 23
10.1.1. Obtención de esporas de C. difficile R20291 ... 23
2
10.1.3. Ensayo de recurrencia en modelo murino. ... 23
10.1.4. Ensayo de persistencia en deposiciones ... 27
10.1.5. Necropsia y toma de muestras biológicas ... 27
10.2. Evaluar el efecto de indometacina en la prevención de la recurrencia de la infección causada por esporas de C. difficile ... 28
10.2.1. Ensayo de recurrencia en modelo murino ... 28
10.2.2. Ensayo de persistencia en deposiciones ... 29
10.2.3. Necropsia y toma de muestras biológicas ... 29
10.3. Evaluar el efecto de la formulación vancomicina/ nistatina+/- germinante+/- en la recurrencia de la infección causada por esporas de C. difficile. ... 30
10.3.1. Ensayo de recurrencia en modelo murino ... 30
10.3.2. Persistencia en deposiciones ... 31
10.3.3. Necropsia y toma de muestras biológicas ... 31
11. Resultados ... 32
11.1. Evaluar el impacto de diferentes agentes antibióticos en el modelo murino de recurrencia de la infección causada por C. difficile ... 32
11.2. La administración oral de indometacina incrementa la severidad del cuadro de infección causado por C. difficile en modelo murino ... 36
11.3. Efecto de la incorporación del germinante taurocolato en la formulación farmacológica compuesta por vancomicina-nistatina+/- en la reducción de la recurrencia de la infección causada por C. difficile.... 41
12. Discusión ... 45
13. Conclusiones y proyecciones ... 49
14. Bibliografía ... 510
4 1. Índice de Tablas
5 2. Índice de Figuras
Figura 1.
Entrada de esporasen células T84 es inhibida por indometacina……… 14 Figura 2.
Diseño experimental de infección para producir ICDR en modelo murino……… 24 Figura 3.
Diseño experimental del tratamiento con indometacina en la ICD en modelo murino … 28 Figura 4.
Diseño experimental del tratamiento con una formulación farmacológica en la ICD en
modelo murino ………. 30
Figura 5.
Evaluación del modelo murino de recurrencia ………...………. 34 Figura 6.
Indometacina incrementa la severidad de la infección causada por C. difficile………… 37 Figura 7.
El tratamiento con indometacina incrementa la severidad de las manifestaciones clínicas asociadas a la ICD ………... 39 Figura 8.
La presencia de taurocolato en la formulación reduce la tasa de recurrencia a la infección causada por esporas de C. difficile. ………... 42 Figura Anexo 1
6 3. Lista de Abreviaturas
AINE: Anti inflamatorio no esteroideo CEI: Células epiteliales intestinales.
cm2: Centímetro cuadrado. COX (1-2): ciclooxigenasa 1 y 2
DPBS: Tampón fosfato salino de Dubelcco (del inglés Dubelcco´s phosphate-buffered saline).
GI: Gastrointestinal
ICD: Infección por Clostridium difficile.
ICDR: Infección por Clostridium difficile recurrente. Indo: Indometacina.
MEC: Matriz extra celular Nista: Nistatina
P: P-value
PBS: Tampón fosfato salino (del inglés phosphate-buffered saline). PFA: Paraformaldehido.
SEM: Error estándar de la muestra (del inglés standard error mean) SFB: Suero fetal bovino.
TA: Temperatura ambiente. Tauro: Taurocolato de sodio
7 TcdA: Toxina A de C. difficile.
8 4. Resumen
9 5. Summary
10 6. Introducción
6.1. Clostridium difficile y su importancia clínica
11 6.2. Patogénesis y factores de virulencia de C. difficile
C. difficile produce dos grandes toxinas, TcdA (308 KDa) y TcdB (270 KDa), las cuales son responsables de las manifestaciones clínicas asociadas con la infección (Govind y Dupuy, 2012). Estas toxinas son glucosiltransferasas que actúan sobre las proteínas Rho-GTPasas en las células epiteliales intestinales del hospedero, provocando alteraciones en el citoesqueleto, activación de la apoptosis y disrupción de las uniones estrechas, resultando en la disminución funcional de la barrera intestinal provocando acumulación de líquido, inflamación y daño intestinal grave debido a la liberación de variadas citoquinas pro-inflamatorias con la consecuente acumulación de neutrófilos en la zona afectada (Shen, 2012; Voth y Ballard, 2005).
Una característica fundamental en la patogénesis de C. difficile, es la capacidad que éste posee de producir esporas, permitiendo su diseminación en ambientes aeróbicos. Las esporas son estructuras tipo células metabólicamente dormantes y por tanto resistentes a la acción de antibióticos. Es por esto que la espora de C. difficile es considerada como el morfotipo de transmisión, infección y persistencia del patógeno (Paredes-Sabja et al, 2014). Durante el desarrollo de una ICD, C. difficile inicia la vía de esporulación culminando en la formación de una espora dormante, permitiendo de esta forma la transmisión hacia un nuevo hospedero y/o hacia el ambiente (Deakin et al, 2012; Paredes-Sabja y Sarker, 2012; Sethi et al, 2009).
El ciclo infectivo de C. difficile se inicia por la ingesta de las esporas mediante el contacto de superficies o por la ingesta de alimentos contaminados (Barra-Carrasco et al, 2014; Cohen et al, 2009). Las esporas, producidas en gran cantidad durante el desarrollo de una ICD, atraviesan el tracto digestivo hasta llegar al colon, donde son capaces de sobrevivir a los ataques del sistema inmune innato del hospedero encontrando las condiciones adecuadas para germinar y volver a su estado vegetativo (Paredes-Sabja et al, 2012).
12 colágeno (I, II y IV) (Cerquetti et al, 2002). Por lo tanto, la ingesta de antibióticos es considerado el factor de riesgo más importante en la ocurrencia de una ICD (Sun et al, 2011). Además, distintos grupos de investigadores sugieren que la adherencia de las esporas al epitelio intestinal es una etapa crítica en el desarrollo de una ICD, jugando un rol fundamental en la persistencia de la espora en individuos sanos, así como en episodios de recurrencia (20% de los casos en un primer episodio) (Paredes-Sabja y Sarker, 2012; Pepin et al, 2005).
6.3. Recurrencia en la infección por C. difficile
Los pacientes que desarrollan una ICD requieren de una terapia antibiótica específica para eliminar C. difficile del colon, sin embargo, el tratamiento que se utiliza en primera instancia y frente a primeros casos consiste en detener toda la terapia antimicrobiana la cual es responsable en la mayoría de los casos del inicio de la diarrea. Posteriormente se realiza la búsqueda de C. difficile o sus toxinas en las heces, para finalmente iniciar el tratamiento con antibióticos específicos si los síntomas y signos de la ICD persisten o empeoran. Los pacientes que presentan complicaciones leves a moderadas por lo general reciben un tratamiento inicial de metronidazol y vancomicina de forma oral, siendo esta última reservada en la mayoría de los casos solo para episodios más graves de la infección (Bauer et al, 2009; Kelly, 2012).
Estos antibióticos mencionados anteriormente son considerados eficaces para el tratamiento de un primer evento de ICD, aun cuando se han reportado diversos casos de fracaso con el uso de Metronidazol (Martinez et al, 2012). Antes del año 2000 la tasa de fracaso en el tratamiento con metronidazol fue menor al 10%, sin embargo desde esta fecha en adelante las tasas de fracasos alcanzan cerca del 20% de los casos, lo cual da cuenta de la aparición de cepas resistentes (Kelly, 2012; Martinez et al, 2012; Aslam, 2005).
13 subconjunto de pacientes tendrá múltiples recurrencias aumentando considerablemente el riesgo de muerte (O’Horo et al, 2014; Sun et al, 2011).
Una ICDR no siempre se debe a la infección con la misma cepa. Diversos estudios reportan que una cepa diferente a la del cuadro inicial se encontró entre 33% y un 56% de los episodios recurrentes (Borriello, 1998; Tang-Feldman et al, 2003; Yusuke et al, 2013) presentando una respuesta inflamatoria mucho más elevada que los pacientes re-infectados con la misma cepa (Chen et al, 2013). Entre los factores más importantes para el desarrollo de ICDR se encuentran la alteración constante de la microbiota intestinal, la continuación de la terapia antimicrobiana, una respuesta de anticuerpos antitoxina inadecuada, estancias intrahospitalarias largas y la edad avanzada de los pacientes (Martinez et al, 2012; McFarland et al, 2010).
A pesar de la existencia de una variedad de tratamientos probados en pacientes con ICD, los tratamientos actuales no logran una recuperación permanente y tienden a presentar múltiples episodios de recurrencia de la infección. Por lo tanto es necesario el desarrollo de nuevos tratamientos que permitan la eliminación de forma permanente de C. difficile y de sus esporas presentes en el hospedero permitiendo una recuperación de forma eficaz contra la ICDR.
6.4. Ingreso de esporas de C. difficile como mecanismo de persistencia.
Resultados previos obtenidos en nuestro laboratorio, sugieren que el ingreso de esporas de C. difficile en células epiteliales del hospedero favorecen la aparición de ICDR, y se ha visto que el uso de inhibidores que reducen la endocitosis mediada por caveolina-1 reducen la endocitosis en células epiteliales intestinales.
14 superficie celular, proceso que depende estrechamente de la polimerización de filamentos de actina (Kaksonen et al, 2006; Smart et al, 1995).
El ciclo de las caveolas se ve afectado principalmente por tres condiciones: células cultivadas en ausencia de una fuente de colesterol reducen considerablemente el número de caveolas y la internalización del receptor de folato; segundo, el tratamiento de células con ésteres de forbol previene la invaginación de las caveolas y tercero, la elevación del ácido araquidónico celular con indometacina, bloquea la formación de vesículas en la membrana plasmática y el retorno de vesículas ya existentes a la superficie celular (Smart et al, 1995).
6.5. Indometacina como inhibidor de la formación de caveolas.
Indometacina es un anti-inflamatorio no esteroideo (AINE) que reduce la fiebre, dolor e inflamación. Actúa inhibiendo de forma no selectiva la ciclooxigenasa 1 y 2 (COX-1 y -2) encontrándose esta última colocalizada con Caveolina-1 en las caveolas (Sharma et al, 2012). Por otra parte, indometacina inhibe las prostaglandinas en la zona de la inflamación por lo cual es ampliamente usado en condiciones de artritis reumatoide, espondilitis anquilosante, osteoartritis y gota (Allison et al, 1992).
Smart et al, descubrió que indometacina bloquea la absorción de caveolas y además sugiere que su acumulación podría actuar como un potencial inhibidor de éstas impidiendo su retorno a la membrana plasmática (Smart et al, 1995).
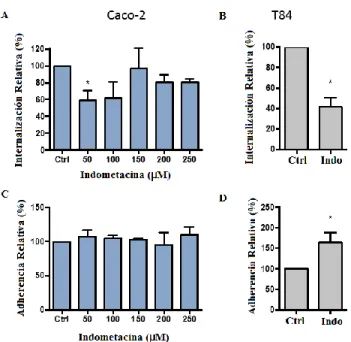
15 60% al ser tratadas con indometacina, y la adherencia de las esporas aumenta en aproximadamente un 60% respecto del control sin tratamiento (Figura 1). Como se puede esperar en células Caco-2 la entrada y adherencia de esporas de C. difficile no se ve afectada por la presencia del inhibidor ya que esta línea celular no expresa caveolina-1.
Figura 1. Entrada de esporas en células T84 es inhibida por indometacina. Células Caco-2 y T84 tratadas con indometacina por 1 hora como inhibidor de endocitosis mediada por caveolina. A) y C) células Caco-2 fueron tratadas con concentraciones crecientes del inhibidor. B) y D) células T84 tratadas con indometacina (250 µM). La entrada relativa de esporas se ve reducida en un 60% respecto de las células no tratadas con el inhibidor mientras que la adherencia aumenta un 60% respecto de las células no tratadas. Los datos fueron analizados mediante t test. *: P<0,05
16 6.6. Nistatina como inhibidor de la formación de caveolas
Nistatina es un polieno anti fúngico, el cual impide la síntesis de ergoesterol en la membrana de los hongos alterando la permeabilidad celular causando la pérdida de componentes esenciales y eventualmente la muerte de la célula (Lim et al, 2016; Wang et al, 2014). Debido a que la endocitosis mediada por caveolina-1 forma vesículas ricas en colesterol y esfingolipidos, el uso de agentes depletores de colesterol como la nistatina, impiden el retorno de las caveolas al citoplasma celular interrumpiendo e imposibilitando de esta forma la endocitosis mediada por caveolina (Nabi y Le, 2003). Trabajos anteriores de nuestro laboratorio indican que la administración de nistatina en un modelo murino de ICDR reduce eficazmente los casos de recurrencia al ser administrados de forma intraperitoneal u oral, pero no reduce el daño provocado en el epitelio intestinal de los animales. Por otra parte se demostró que el tratamiento con nistatina reduce la carga de esporas encontradas en el tejido colónico, a pesar de que la ICD mantiene su curso a nivel del lumen intestinal; es decir, hay crecimiento de células vegetativas, producción de toxinas y generación de esporas. Sin embargo, la adherencia de estas últimas a células del hospedero se reduce, disminuyendo de igual forma la entrada de esporas a las células del epitelio colónico y por tanto la cantidad de esporas intracelulares las que serían las principales responsables de la ICDR (datos no publicados).
Sin embargo, la administración de antibióticos en el sistema de conductos radiculares presenta un alto riesgo debido a distintos efectos sistémicos adversos, la alta toxicidad, reacciones alérgicas y el desarrollo de cepas microbianas resistentes (Lim et al, 2016).
17 6.7. Taurocolato como germinante de la espora de C. difficile.
Dado que las toxinas de C. difficile son producidas por las células vegetativas y no por las esporas, la germinación y la proliferación son prerrequisitos fundamentales para la patogénesis. La germinación de esporas es un proceso desencadenado por la interacción de pequeñas moléculas, denominadas germinantes, con receptores dentro de la membrana interna de la espora. Estos germinantes varían según las especies bacterianas y pueden incluir iones, aminoácidos, azúcares, nucleótidos, surfactantes o combinaciones de los mismos (Setlow, 2003). El reconocimiento de los germinantes desencadena un proceso irreversible, que conduce a la liberación de ácido dipicolínico quelado con Ca+2, lo cual conduce a la hidratación de la espora seguido de una serie de pasos que conducen a la proliferación de la bacteria vegetativa, la cual puede proliferar e iniciar un nuevo ciclo infectivo (Setlow, 2003).
El hígado sintetiza los dos principales ácidos biliares primarios, el colato y el quenodeoxicolato los cuales se modifican por conjugación con taurina (para dar taurocolato o quenodeoxi-taurocolato) o glicina (para producir glicolato o glicoquenodeoxicolato). Tras la secreción de estas moléculas conjugadas en el tracto digestivo, gran parte de la bilis secretada se absorbe activamente y se recicla al hígado para su reutilización. Sin embargo, la recirculación entero hepática no es completa permitiendo a la bilis entrar en el ciego a una concentración de aproximadamente 2 mM (Setlow, 2003; Sorg y Sonenshein, 2010).
En el ciego, la bilis es modificada por la microbiota endógena. En primer lugar, las hidrolasas de sales biliares eliminan el aminoácido conjugado, produciéndose los ácidos biliares primarios desconjugados colato y quenodeoxicolato los cuales actúan como inhibidores de la germinación de las esporas (Ridlon et al, 2006).
18 Estudios anteriores han demostrado que la unión de taurocolato con los receptores de la espora es un requisito previo para la unión de la glicina, sin embargo a concentraciones fisiológicamente relevantes, el quenodeoxicolato inhibe la germinación mediada por taurocolato y también inhibe el crecimiento vegetativo de C. difficile, al igual que el desoxicolato (Sorg y Sonenshein, 2010). De hecho, como el quenodeoxicolato es absorbido por el epitelio del colon y metabolizado en litocolato por la flora colónica, el uso de quenodeoxicolato como terapia contra la enfermedad de C. difficile puede verse obstaculizada por su absorción y conversión en litocolato (Sorg y Sonenshein, 2010). No obstante la utilización de un germinante como taurocolato en presencia de un antibiótico, podría desencadenar la germinación temprana de la espora incluso en regiones aeróbicas del intestino y la posterior muerte de la célula vegetativa por acción del antibiótico.
6.8. Modelos animales para el estudio de la Infección por C. difficile.
En la actualidad se han desarrollado diversos tipos de modelos animales para estudiar varios aspectos de una ICD, tales como la colonización, intoxicación, transmisión y recurrencia. Dentro de los animales utilizados para estos fines encontramos ratones, ratas, hámsters, conejos, liebres, cobayos y hasta codornices (Hutton et al, 2014). De todos los modelos existentes, el más utilizado es el ratón debido a la mejora de los métodos para inducir la susceptibilidad a C. difficile y a la existencia de una mayor disponibilidad de reactivos específicos para ratón permitiendo entre otros, realizar análisis histológicos detallados de sus tejidos.
19 y el tercero utiliza un único antibiótico para inducir la susceptibilidad a la ICD (Theriot et al, 2011). pudiendo ser reproducida variando la dosis de esporas infecciosas o utilizando diferentes cepas bacterianas. Este modelo ha sido desarrollado aún más, permitiendo inducir la recaída o recurrencia de la enfermedad, lo cual imita un aspecto común de la enfermedad en humanos (Chen et al, 2008). Éste modelo también se ha utilizado con éxito para establecer una posible dinámica del microbioma intestinal durante la ICD, ya que se demostró que con ratones que desarrollaron enfermedad clínica severa existe una composición microbiana diferente en el intestino en comparación con los ratones que no presentan la enfermedad (Reeves et al, 2011). Además, ha sido ampliamente utilizado para investigar el potencial terapéutico de nuevas vacunas y tratamientos para ICD, así como para mejorar la comprensión de los tratamientos actuales.
El uso de ratones libres de gérmenes presenta la ventaja de no requerir el pre-tratamiento de antibióticos para interrumpir la microbiota intestinal, sin embargo, aunque estos modelos de infección parecen dar lugar a respuestas inmunitarias innatas clínicamente relevantes y síntomas de enfermedad, los animales que son deficientes en la microbiota residente no desarrollan todas las respuestas inmunes y mucosas normales (Macpherson y Harris, 2004). Aun cuando se han observado similitudes en la patología de la enfermedad entre los modelos libres de gérmenes y el modelo de cóctel antibiótico, la ausencia total de microbiota en la primera no refleja la situación normal en los seres humanos y animales (Hutton et al, 2014) razón por la cual los modelos que implican la susceptibilidad inducida por antibióticos a la enfermedad de C. difficile son más utilizados para estudiar CDI.
20 el uso de un solo antibiótico para alterar la microbiota intestinal, por ejemplo clindamicina (Lawley et al, 2009; Buffie et al, 2012) o la cefalosporina de tercera generación, cefoperazona (Theriot et al, 2011). El pretratamiento de los ratones con uno de estos antibióticos, provoca susceptibilidad a una ICD lo cual genera como resultado una enfermedad caracterizada por diarrea, pérdida de peso, mortalidad y el consecuente daño asociado en el colon o ciego del animal (Theriot et al, 2011; Buffie et al, 2012).
Al comparar los ratones tratados con el cóctel de antibióticos con los ratones tratados con cefoperazona, se observó que los últimos presentaron una mayor susceptibilidad a C. difficile, probablemente debido al efecto más severo de la cefoperazona sobre la composición de la microbiota intestinal (Reeves et al, 2011). Por otra parte, se determinó que la interrupción de la microbiota intestinal causada por la cefoperazona fue de una duración mayor que la causada por el cóctel antibiótico (Reeves et al, 2011), en consecuencia es posible que un mayor tiempo de recuperación de la microbiota normal conduzca a una mayor susceptibilidad a la recaída de estos ratones. De forma similar, otro estudio mostró que una sola dosis de clindamicina dio lugar a una pérdida rápida en la diversidad de la microbiota residente y que los ratones permanecieron susceptibles a la ICD durante al menos 10 días después de la administración del antibiótico, lo que sugiere que los microorganismos sensibles a la clindamicina pueden ser responsables de la resistencia del animal frente a una ICD (Buffie et al, 2012). Sin embargo y a pesar de las variadas ventajas que presentan estos modelos, una limitación importante de este modelo murino y de todos los modelos utilizados, es que los resultados son difícilmente o no reproducibles en ratones de diferentes cepas o de distintas procedencias debido a la diferencia en la microbiota intestinal existente entre distintas cepas murinas (Winston et al, 2016).
21 al, 2011). Es por ello, que la pérdida de resistencia a la colonización por una ICD resulta en un ambiente que permite la germinación de C. difficile.
La forma en que la microbiota intestinal media la resistencia a la colonización contra C. difficile aún no está clara, no obstante trabajos previos han demostrado múltiples mecanismos que contribuyen en la resistencia a la colonización, sin embargo se sabe que debido a la alteración de la estructura de la microbiota intestinal que producen, los antibióticos alteran esta comunidad (Britton y Young, 2012; Theriot et al, 2016).
En consecuencia, la elección de un modelo apropiado para el estudio de las ICD es un paso crítico para probar nuevos fármacos en el desarrollo de nuevas terapias para la prevención y el tratamiento de la ICD particularmente a medida que se conoce más acerca de la compleja relación que existe entre C. difficile y la microbiota intestinal del hospedero.
En resumen:
Para poder evaluar algún aspecto de la ICD necesitamos un modelo murino que se ajuste a las condiciones de nuestros animales y la cepa bacteriana utilizada.
De acuerdo resultados previos de nuestro laboratorio se sabe que uno de los mecanismos de ingreso de esporas de C. difficile a células epiteliales intestinales es mediante endocitosis dependiente de caveolina. Proceso que se ve reducido en presencia de inhibidores de la formación de caveolas como nistatina e indometacina.
Taurocolato es un ácido biliar primario que ha sido utilizado como agente germinante de la espora de C. difficile.
22 7. Hipótesis
La composición farmacológica compuesta de vancomicina con nistatina o indometacina y taurocolato reduce la recurrencia de la infección causada por Clostridium difficile en modelo murino.
8. Objetivo general
Evaluar el efecto de una composición farmacológica de vancomicina con nistatina o indometacina y taurocolato sobre la recurrencia de la infección causada por C. difficile en modelo murino.
9. Objetivos específicos
Objetivo específico 1: Evaluar el impacto de diferentes antibióticos en el modelo murino de recurrencia de la infección causada por C. difficile.
Objetivo específico 2: Evaluar el efecto de indometacina en la prevención de la recurrencia de la infección causada por C. difficile.
23 10. Materiales y Métodos
10.1. Evaluación del impacto de distintos agentes antibióticos en el modelo murino de recurrencia de la infección causada por C. difficile.
10.1.1. Obtención de esporas de C. difficile R20291
Las esporas utilizadas durante la realización de todos los experimentos se obtuvieron de acuerdo al protocolo utilizado en nuestro laboratorio (Barra-Carrasco et al, 2013), en donde se crece C. difficile R20291 bajo condiciones anaeróbicas en cámara de anaerobiosis Bactron III-2 (Shel Lab) en placas 3,7% brain heart infusion broth suplementado con 0,5% de extracto de levadura (BHIS). Para obtener esporas se sembraron 100 µL de una solución de cultivo O/N en placas 3% Tripticasa de Soya con 0,5% de extracto de levadura, las cuales se incubaron por 5 días a 37 °C bajo condiciones de anaerobiosis. Las esporas fueron recolectadas utilizando agua miliQ estéril y se purificaron pasándolas por un gradiente de densidad en Nicodenz 50%, luego se contaron utilizando una cámara de Neubauer para almacenarlas a -80 °C en alícuotas de concentración 5x109 esporas/mL.
10.1.2. Modelo animal
Todos los ensayos con animales realizados en esta Tesis fueron llevados a cabo con ratones silvestres de la cepa C57BL/6de entre 6 y 10 semanas, reproducidos y mantenidos hasta su uso en bioterios pertenecientes al laboratorio Microbiota-Host Interactions and Clostridia Research Group. Todos los procedimientos fueron aprobados por el comité de bioética de la Universidad Nacional Andres Bello.
10.1.3. Ensayo de recurrencia en modelo murino.
24 Ratones silvestres C57BL/6 (machos y hembras) de entre 6 a 10 semanas fueron mantenidos de forma individual en jaulas previamente esterilizadas, con agua miliQ y comida ad libitum con ciclos de luz/oscuridad de 12 horas respectivamente a una temperatura de 24 °C durante todo el desarrollo del ensayo.
Para generar la disrupción en la microbiota intestinal del animal y la consecuente susceptibilidad a la infección, se probaron 4 tratamientos distintos. Todos los grupos de animales fueron tratados durante 3 días con un cóctel de antibióticos mediante vía orogástrica (gavage) consistente en kanamicina (Sigma, EE.UU.) 0,4 mg/mL (equivalente a 40 mg/Kg), colistina (Sigma, EE.UU.) 850 U/mL (equivalente a 4,2 mg/Kg), gentamicina (Sigma, EE.UU.) 0,035mg/mL (equivalente a 3,5mg/Kg), metronidazol (Sigma, EE.UU.) 0,215 mg/mL (equivalente a 21,5 mg/Kg) y vancomicina (Laboratorios Chile, Chile) 0,045 mg/mL (equivalente a 4,5 mg/Kg) en 120 µL de suero (NaCl 0,9%) (Chen et al, 2008). Finalizado el tercer día de tratamiento con el cóctel de antibióticos, se dejó descansar a los animales por dos días.
25 Figura 2. Diseño experimental de infección para producir ICDR en modelo murino. Ratones silvestre C57BL/6 fueron tratados con un cóctel de antibióticos por 3 días. El día -1 se dio una dosis de -10 mg/Kg y 30 mg/Kg de clindamicina. El día 0 los animales fueron desafiados con esporas de C. difficile R20291 (1x107 esporas/mL) mediante gavage. Al tercer día posterior al desafío se dio inicio al tratamiento con vancomicina (50 mg/Kg) por un periodo de 4 y 7 días.
Durante el transcurso del ensayo se evaluaron de forma diaria los parámetros clínicos de la infección, para esto se tomó un registro del peso presentado diariamente y se evaluó el estado de salud de los ratones mediante la observación de distintos aspectos físicos de los animales. También se valoró el estado, consistencia y aspecto de las deposiciones tomadas durante los días de duración del ensayo. Para estandarizar la medición se utilizó una escala de puntuación de la sintomatología presentada por los roedores permitiendo categorizar la gravedad de la infección. Los aspectos considerados y la escala utilizada se muestran en la Tabla N° 1.
26 Tabla N° 1. Puntaje para cada parámetro clínico evaluado
Pérdida de peso
Normal, los animalesmantienen su peso desde el comienzo del experimento. 0
Perdida de un 10% respecto del peso inicial. 1
Perdida inferior al 20% respecto del peso inicial. 2
Perdida Mayor o igual al 20% respecto del peso inicial (animal deshidratado ha dejado de consumir agua y alimento) 3
Aspecto
Pelo en buen estado (limpio, ordenado y con brillo normal) 0
Pelo en mal estado (opaco, desordenado, falta de acicalamiento) 1
Pelo en mal estado, secreciones oculares o nasales. 2
Postura anormal (encorvado), pelo en mal estado, piloerección. 3
Puntaje de
diarrea
Normal (deposiciones secas u oscuras) 0
Ablandamiento de deposiciones - cambio de color (aclaramiento) 1
Presencia de mucosidad (cola mojada) 2
Deposiciones líquidas 3
Comportamiento
espontáneo
Normal 0
Cambios menores (aumento o disminución discreta de actividad o inactividad). 1
Disminución de la movilidad y del estado de alerta, animal aislado. 2
Automutilación, vocalización anormal, animalmuy inquieto o inmóvil. 3
Comportamiento
en respuesta a la
manipulación
Normal, con fuerza y resistencia. 0
Pequeños cambios (leve pérdida de fuerza y resistencia a la manipulación). 1
Moderada pérdida de fuerza y resistencia a la manipulación. 2
Animal agresivo o muy débil, sin resistencia, con signos de dolor y pre comatoso.
No responde a estímulos externos 3
Aspecto de la
herida*
Cicatrización adecuada (ausencia de infección, hemostasia perfecta, afrontamiento correcto de los bordes) 0 Inflamación, desprendimiento de sutura, leve sangramiento que cesa con la
atención adecuada) 1
Inflamación, enrojecimiento, déficit en la hemostasia, sangramiento 2
Herida infectada (color amarillento), inflamada, edema. 3
27 10.1.4. Ensayo de persistencia en deposiciones
Las deposiciones recolectadas durante los días del ensayo se hidrataron con 500µL de agua miliQ estéril toda la noche a 4° C. Al día siguiente, las muestras fueron homogenizadas y se les adicionó 500µL de etanol absoluto (Merk, Alemania) dejándolas en reposo por 20 minutos. Luego se realizó una serie de diluciones (1:10 y 1:100) que posteriormente fueron sembradas en placas proteasa peptona 4% (Becton, Dickinson and Company, EE.UU.), Fructosa 0,6%, Na2HPO4 0,1% (Merck, Alemania), KH2PO4 0,1%
(Merck, Alemania), NaCl 0,2% (Merck, Alemania), MgSO4 0,02% (Merck, Alemania),
cicloserina 250 µg/mL (Sigma, EE.UU.), cefoxitina 16 mg/mL (Sigma, EE.UU.) suplementado con taurocolato de sodio 0,1% (HIMEDIA, India) (TCCFA TS) el cual es un medio selectivo para C. difficile permitiendo la germinación de la espora en un medio anaerobio para su posterior conteo y determinación de unidades formadoras de colonia (UFC). Las placas sembradas se mantuvieron durante 48 horas en condiciones anaerobias en una cámara de anaerobiosis Bactron III-2 (Shel Lab).
10.1.5. Necropsia y toma de muestras biológicas
28 10.2. Evaluar el efecto de indometacina en la prevención de la recurrencia de la infección
causada por esporas de C. difficile
10.2.1. Ensayo de recurrencia en modelo murino
Para evaluar el efecto de indometacina en la recurrencia de la ICD en modelo murino se realizó un ensayo de persistencia de esporas de C. difficile. Para ello se utilizaron ratones silvestres C57BL/6 (machos y hembras) de entre 6 a 9 semanas, los cuales fueron mantenidos como se describe anteriormente en el punto 10.1.3.
29 Figura 3. Diseño experimental del tratamiento con indometacina en la ICD en modelo murino. Ratones silvestre C57BL/6 fueron tratados con un cóctel de antibióticos por 3 días. Juntamente con la dosis de clindamicina (día -1) se inicia el tratamiento con indometacina (2,0 mg/Kg) por un periodo de 11 días. El día 0 los animales son desafiados con esporas de C. difficile R20291 (1x107 esporas/mL) mediante gavage. Al tercer día posterior al desafío se da inicio al tratamiento con vancomicina (50 mg/Kg) por un periodo de 7 días.
Durante los días de ensayo se evaluaron de forma diaria los parámetros clínicos de la infección de la misma forma como se describe en el punto 10.1.3.
10.2.2. Ensayo de persistencia en deposiciones
Las deposiciones recolectadas durante los días del ensayo fueron tratadas de la misma forma como se describe anteriormente en el punto 10.1.4.
10.2.3. Necropsia y toma de muestras biológicas
30 10.3. Evaluar el efecto de la formulación vancomicina/ nistatina+/- germinante+/- en la
recurrencia de la infección causada por esporas de C. difficile.
10.3.1. Ensayo de recurrencia en modelo murino
Para evaluar el efecto de la incorporación del germinante taurocolato en una formulación farmacológica que disminuya la recurrencia de la ICD en modelo murino se realizó un ensayo de persistencia de esporas de C. difficile similar al descrito previamente para el objetivo específico 1 y 2. Para ello se utilizaron ratones silvestres C57BL/6 de entre 6 y 9 semanas, los cuales fueron mantenidos como se describe anteriormente en el punto 10.1.3.
Para generar la disrupción en la microbiota intestinal del animal y la consecuente susceptibilidad a la infección, se administró cefoperazona (50 mg/Kg) mediante gavage durante 7 días al termino de los cuales se dejó descansar a los ratones durante 2 días (Reeves et al, 2011; Theriot et al, 2016; Theriot et al, 2011). Un día previo a la infección, se administró una dosis única de clindamicina (10 mg/Kg) mediante inyección intraperitoneal. El día de la infección, los ratones fueron desafiados con una dosis de 1x107 esporas/mL de C. difficile R20291 (disueltas en PBS) administrada mediante gavage (Figura 4). La recolección de deposiciones y la evaluación diaria del estado de salud de los animales se realizó según se indica en el punto 10.1.3.
31 Figura 4. Diseño experimental del tratamiento con una formulación farmacológica en la ICD en modelo murino. Ratones silvestre C57BL/6 fueron tratados con cefoperazona mediante gavage por 7 días. En el día previo a la infección se dio una dosis única de clindamicina (10 mg/Kg). El día 0 los animales son desafiados con esporas de C. difficile R20291 (1x107 esporas/mL) mediante gavage. Al tercer día posterior al desafío se da inicio al tratamiento con vancomicina (50 mg/Kg) y vancomicina (50 mg/Kg) - nistatina (2,8 mg/Kg) para el segundo grupo, vancomicina (50 mg/Kg) - taurocolato (20 mg/Kg) para el tercer grupo y vancomicina (50 mg/Kg) - nistatina (2,8 mg/Kg) - taurocolato (20 mg/Kg) para el cuarto grupo por un periodo de 7 días.
10.3.2. Persistencia en deposiciones
Las deposiciones recolectadas durante los días del ensayo fueron tratadas de la misma forma como se describe anteriormente en el punto 10.1.4.
Se consideró un caso de persistencia positivo si en las muestras obtenidas entre los días 10 a 16 se observa un aumento en las UFC/gramo de deposición en comparación a la de los días 4 al 9.
10.3.3. Necropsia y toma de muestras biológicas
32 11. Resultados
11.1. Evaluar el impacto de diferentes agentes antibióticos en el modelo murino de recurrencia de la infección causada por C. difficile
Para poder evaluar el efecto de una composición farmacológica sobre la recurrencia de la infección causada por esporas de C. difficile es necesario establecer un modelo que permita obtener un mayor número de animales que presenten la sintomatología clínica asociada a la recurrencia de la infección. Para realizar esto, se llevó a cabo un ensayo de infección por C. difficile recurrente donde se probó el impacto de distintas concentraciones de clindamicina y tiempos de administración de vancomicina en el modelo de recurrencia. Con este fin, se tomaron 10 animales a los cuales se les administró un cóctel de antibióticos por un periodo de 3 días y posteriormente fueron tratados según se describe en la sección 10.1.3. de materiales y métodos.
33 que todos los grupos presentan una disminución en el peso respecto de los valores alcanzados en los días de tratamiento con el antibiótico. Para el caso del Grupo 3 se observa una caída de peso promedio de un 10 % (112,6% el día 11 a 102,6% el día 12). Sin embargo los valores más bajos alcanzados registrados para este grupo se encuentran sobre el peso medido para los ratones al comienzo de la infección. De forma contraria, el grupo que presenta una pérdida de peso mayor, llegando a 92,9% respecto del peso del día inicial es el Grupo 1 que presenta una baja de 103,6 % el día 12 a 92,9 % el día 13. Los dos grupos tratados por 4 días con vancomicina 50 mg/Kg presentan los porcentajes más bajos de pérdida de peso siendo un 6,8 para el Grupo 2 (desde 100,9% el día 8 a un 94,1% el día 9) y 2,8 % para el Grupo 4 (desde 98,3% el día 8 a un 95,5 el día 9) (Figura 5A).
La abundancia de esporas en las deposiciones incrementa de forma esperada para todos los grupos a los dos días de ser infectados. Al cuarto día de iniciado el tratamiento con vancomicina se observa que todos los grupos presentan una baja en la cantidad de UFC hasta llegar a niveles del límite de detección de la técnica. El grupo 1 y 3 mantienen estos niveles hasta el día 10 (un día después de finalizado el tratamiento con vancomicina) presentando un nuevo incremento en la abundancia de esporas en las deposiciones el día 11 llegando incluso a los mismos niveles alcanzados en el día 2 (Grupo 1). De la misma forma el Grupo 4, una vez terminado el tratamiento con vancomicina presenta casi de forma inmediata niveles incluso más altos de esporas que en el día 2 del ensayo. Interesantemente, el grupo 2 (clinda10-vanco4D) presenta un incremento en los niveles de UFC en deposiciones al tercer día de finalizado el tratamiento (día 9) siendo el grupo que más tarda en evidenciar un aumento de la cantidad de esporas eliminadas en las deposiciones (Figura 5B).
36 las deposiciones recolectadas durante los días del ensayo. Cada deposición fue hidratada, tratada con etanol y sembrada en placas TCCFA según se describe en materiales y métodos. La línea punteada indica el límite de detección de la técnica (clinda10-vanco4D: *P<0,05 vs clinda10-vanco4D en día 11; clinda10-vanco7D: **P<0,01 vs clinda30-vanco7D en día 2, clinda30-vanco4D en día 9; clinda30-vanco7D: **P<0,01 vs clinda10-vanco7D en día 3, clinda10-vanco4D, clinda30-vanco4D en día 9; clinda30-vanco4D: ***P<0,001vs clinda10-vanco7D, clinda10-vanco4D y clinda30-vanco7D en día 8; clinda10-vanco7D: ***P<0,001vs clinda10-vanco4D en día 9). C) Indica el día en que los animales presentan diarrea. Se observa un 66,6% de diarrea para el Grupo 1 luego de 4 días después de haber terminado el tratamiento (día 13) y un 50% para el Grupo 4 luego de 7 días del término de tratamiento con vancomicina (día 13). Los datos en A) y B) fueron analizados con ANOVA de dos vías seguido por el test Tukey.
11.2. La administración oral de indometacina incrementa la severidad del cuadro de infección causado por C. difficile en modelo murino
Debido a que indometacina inhibe la entrada de caveolas al citoplasma y además impide el reciclaje de caveolina-1 a la membrana celular y como se demostró anteriormente reduce la entrada de esporas en células epiteliales intestinales T84 se realizó un ensayo de persistencia de esporas en modelo murino para evaluar el efecto de indometacina en la ICDR como se describe anteriormente en la sección 10.2.1.
Podemos observar que el peso relativo de los animales que recibieron solo el tratamiento con indometacina (n=3) aumenta en los primeros días llegando a valores promedio de 104% respecto del día de la infección. De la misma forma los animales que fueron solo infectados (n=8) presentan una pérdida de peso solo en el quinto día, correspondiente a una pérdida relativa de un 3,2 %. Sin embargo los ratones infectados tratados con indometacina ya presentan una pérdida de peso del 10,3 %en el segundo día (Figura 6A) dándonos el primer indicio de que la infección por C. difficile se ve exacerbada en presencia de indometacina.
37 de forma negativa presentando un 82% de muerte al día 3 y un 100% de muerte al cuarto día de ser infectados (Figura 6B) versus un porcentaje de sobrevivencia del 87,5 y 100% para el grupo que fue infectado con C. difficile (n=8) y el grupo solo tratado con indometacina (n=3) respectivamente, lo cual sugiere que indometacina no puede utilizarse para prevenir la recurrencia de la infección ya que este agrava la condición clínica de los animales.
El día de la muerte de los animales se extrajo el ciego y colon de cada uno de ellos, tomándose una medida del largo y ancho (Figura 6C) donde se observó que el grupo infectado presenta un tamaño superior respecto de los infectados tratados con indometacina, lo cual nos daría indicios de que estos animales presentan un estado de mayor inflamación que los tratados con indometacina.
Al cuantificar la carga de esporas de C. difficile en las deposiciones podemos observar que los animales tratados solo con indometacina no presentan carga de esporas como es de esperarse y se encuentran por tanto en el límite de detección de la técnica (línea discontinua). Por otra parte, los animales infectados tratados con indometacina no presentan una diferencia significativa respecto de los animales que solo fueron infectados (Figura 6D). Sin embargo en el día 2 los animales infectados tratados con indometacina alcanzan un valor máximo de 4,7 unidades logarítmicas, empeorando la condición antes mencionada que presenta este grupo.
38 Figure 6. Indometacina incrementa la severidad de la infección causada por C. difficile. Ratones fueron infectados y tratados con indometacina un día previo al desafío (ver punto 6.2.4.). A) Porcentaje de pérdida de peso relativa al día de la infección. B) Porcentaje de sobrevivencia de animales tratados con Indometacina (Indo), infectados no tratados (CD) e infectados tratados con indometacina (CD+Indo). C) Medida del tamaño promedio de colon y ciego para el grupo de animales tratados con indometacina y los animales infectados tratados con indometacina. Los animales que solo fueron infectados presentan un mayor largo de ciego y la región colónica. D) Carga de esporas encontrada en las deposiciones recolectadas durante el ensayo representado como el Log10 de UFC por
39 infectados tratados con indometacina alcanzan valores máximos de 4,3 y 4,7 unidades logarítmicas respectivamente. No hay diferencia significativa entre CD y CD + Indo. Los datos fueron analizados mediante t test con P= 0,12 La línea punteada indica el límite de detección de la técnica. E) Indica el día en que los animales presentan diarrea a lo largo del transcurso del ensayo. Indo n = 3, CD n = 8 y CD + Indo n =12.
40 Figura 7. El tratamiento con indometacina incrementa la severidad de las manifestaciones clínicas asociadas a la ICD. Ratones infectados tratados con indometacina presentan puntajes clínicos mayores que animales infectados sin tratamiento y que los animales tratados únicamente con indometacina. Durante el día 2 del ensayo se presenta un aumento significativo de la condición clínica en el grupo CD +Indo. Los datos fueron analizados mediante ANOVA de dos vías seguido del test Tukey. Indo n= 3, CD n= 8 y CD + Indo n=12
41 condición como un agente reductor de la recurrencia en modelos animales, por lo tanto se descarta para los siguientes experimentos. Sin embargo, sería interesante estudiar los mecanismos moleculares involucrados en el incremento de la severidad de la ICD
11.3. Efecto de la incorporación del germinante taurocolato en la formulación farmacológica compuesta por vancomicina-nistatina+/- en la reducción de la recurrencia de la infección causada de C. difficile.
Para evaluar el efecto de la incorporación del germinante taurocolato en la formulación farmacológica que reduce la recurrencia de la ICD en modelo murino se realizó un ensayo de persistencia de esporas de C. difficile como se describe anteriormente en el punto 10.3.1.
Al evaluar la pérdida de peso relativa podemos observar que los grupos tratados con las formulaciones que contienen taurocolato logran recuperar el peso perdido posterior al desafío, manteniéndose constante inclusive por un periodo de 5 días después de finalizado el tratamiento. Cabe destacar que los grupos tratados con las formulaciones de vancomicina-taurocolato y vancomicina-nistatina-taurocolato mantienen un peso relativo por sobre el 100% a contar del día 9 en adelante. No obstante, los animales tratados con la formulación de vancomicina-nistatina si bien logran recuperar el peso perdido en el día 2, no logran llegar a un 100% ni durante el tratamiento ni en los 5 días posteriores al término de este (Figura 8A).
Por otra parte, los animales tratados con vancomicina-nistatina presentan un 83% de sobrevivencia al llegar día 9 (término del tratamiento farmacológico), llegando con un 66% de sobrevivencia al final del ensayo, mientras que los grupos animales tratados con el germinante no presentan muertes hasta por un periodo de 6 días después de finalizado el tratamiento farmacológico (Figura 8B) lo que demuestra que la adición del germinante en la formulación farmacológica produce un efecto positivo sobre la disminución de la muerte, pérdida de peso y por lo tanto la recurrencia de la infección.
45 12. Discusión
46 diferencia en la composición de la microbiota intestinal de los ratones juega un papel importante en la capacidad de resistencia a la infección (Reeves et al, 2011).
El uso de vancomicina en la eliminación de células vegetativasdesde el lumen intestinal es ampliamente utilizado en los distintos modelos de infección y recurrencia mencionados (Chen et al, 2008; Theriot et al, 2011; Sun et al, 2011). Debido a esto decidimos probar tratamientos de 4 y 7 días de vancomicina (50mg/Kg). En ambos casos podemos ver que una vez que se remueve la vancomicina (día 6 y 9 respectivamente) existe un descenso del peso promedio entre el tercer y cuarto día en aproximadamente 5% para el grupo tratado por 4 días y 10 % para el grupo tratado por 7 días. Sin embargo la pérdida promedio de peso respecto del día de la infección es mayor en los animales que recibieron 10 mg/Kg de clindamicina (Anexo 1). Cabe mencionar que no existen diferencias significativas entre estos valores.
Indometacina es un anti inflamatorio no esteroideo (AINES) utilizado de forma efectiva como antipirético y analgésico (Lucas, 2016). De acuerdo a los datos presentados en este trabajo, se puede ver que indometacina incrementa el daño asociado a la infección por C. difficile produciendo una exacerbación de la sintomatología asociada a la infección, con la consecuente pérdida de peso de los animales y la muerte anticipada de estos.
47 debido a que indometacina estaría contribuyendo a generar disbiosis. Por lo tanto, debido a que indometacina produce una reducción de la resistencia a la colonización de C. difficile, y por consiguiente la colonización del patógeno generando un aumento en la sintomatología y muerte de los animales, ésta fue descartada para los siguientes ensayos como un posible componente de la formulación farmacológica
Para evaluar la incorporación del germinante taurocolato en las formulaciones farmacológicas se llevó a cabo un ensayo como se describe en la sección 10.3.1 de materiales y métodos. En este modelo se utilizó cefoperazona como agente disruptor de la microbiota de los animales el cual es utilizado por periodos de 5 a 10 días en el agua para beber de los animales (Reeves et al, 2011; Theriot et al, 2011; Winston et al, 2016). La administración de cefalosporinas de tercera generación, como la cefoperazona, está asociada con un mayor riesgo de ICD en humanos, por tanto, el uso de este antibiótico de amplio espectro en estos modelos refleja de forma más precisa lo que ocurre de forma natural en la infección (Winston et al, 2016).
Como se tenía en antecedente por trabajos previos realizados en nuestro laboratorio, la administración de nistatina reduce los casos de ICDR pero no reduce la formación de células vegetativas ni la cantidad de toxinas presentes en el contenido cecal. De acuerdo a los resultados obtenidos podemos ver que la formulación de vancomicina-nistatina es la que presenta valores de pérdida de peso más elevados y la única que presenta muerte de los animales una vez finalizado el tratamiento. Esto puede deberse a que no se reduce el número de células vegetativas y por tanto continúa la producción de toxinas que generan daño a nivel tisular, provocando la pérdida de peso y muerte de los animales.
48 Para generar una infección, la espora de C. difficile debe germinar en el tracto GI del hospedero la cual es iniciada por la exposición de la espora a glicina y ciertos ácidos biliares como taurocolato (Sorg y Sonenshein, 2010). Hasta el día de hoy, los antibióticos más comúnmente usados para tratar una ICD son metronidazol y vancomicina (Paredes-Sabja et al, 2012; Zar et al, 2007) antibióticos que también generan una disrupción de la flora comensal del tracto GI, lo que hace que entre un 20 y 30% de los pacientes que ya no presentan la sintomatología asociada a la primera infección generen en un episodio de recurrencia de la ICD (McFarland, 2008). Por tanto, la administración de taurocolato en conjunto con vancomicina y nistatina disminuye la tasa de esporas remanentes en el intestino y por ende la aparición de un cuadro recurrente, lo cual se corrobora por la disminución de la pérdida de peso asociada a la ICDR y la reducción de la aparición de diarrea en el final del ensayo como se puede observar para los grupos vancomicina-taurocolato y vancomicina-nistatina-vancomicina-taurocolato en la figura 8D.
Por otra parte, podemos observar que los animales de los grupos que fueron tratados con taurocolato en su formulación se mantienen vivos hasta 6 días después del termino del tratamiento (Figura 8B y 8D).
49 13. Conclusiones y proyecciones
En esta Tesis se determinó que
El tratamiento con vancomicina por un periodo de 7 días en un modelo murino de recurrencia, genera una mayor tasa de recurrencia que el uso de este antibiótico por un periodo de 4 días.
El uso de indometacina en episodios de ICD exacerba la condición clínica asociada a la infección, aumentando de forma drástica la tasa de muerte en modelo murino.
La adición de taurocolato en una formulación farmacológica compuesta de vancomicina y vancomicina-nistatina reduce la recurrencia de la ICD.
De las dos formulaciones con taurocolato, la que contiene vancomicina-nistatina-taurocolato reduce a 0 la tasa de diarrea hasta 6 días después de terminado el tratamiento.
Por lo tanto la hipótesis de este trabajo de que una composición farmacológica compuesta de vancomicina, nistatina o indometacina y un germinante, reduce la recurrencia de la ICD en un modelo murino, se cumple de forma parcial solo para la formulación de vancomicina-nistatina-taurocolato. En consecuencia, como la formulación propuesta reduce el cuadro de recurrencia en un modelo murino, esta podría solucionar el problema de ICDR en humanos, sin embargo deben realizarse más estudios para determinar las concentraciones más adecuadas y la posibilidad de entrega de estos fármacos en composiciones mejoradas como lo son las nanopartículas las que permitirían una dosificación más reducida y mejor dirigidaantes de llegar a estudios clínicos que validen su uso en humanos.
51 14. Bibliografía
Allison M. C., Howatson A. G., Torrance C. J., Lee F. D., Russell R. I. (1992). Gastrointestinal damage associated with the use of nonsteroidal antiinflammatory drugs. The New England journal of medicine, 327, 749-754.
Anderson Richard G. W., Jacobson Ken. (2002). A role for lipid shells in targeting proteins to caveolae, rafts, and other lipid domains. Science (New York, N.Y.), 296, 1821-1825.
Barra-Carrasco Jonathan, Cristian Hernández-Rocha, Ibáñez Patricio, Guzmán-Durán Ana M, Álvarez-Lobos Manuel, Paredes-Sabja Daniel. (2014). Clostridium difficile spores and its relevance in the persistence and transmission of the infection. Revista chilena de infectología, 31, 694-703.
Barra-Carrasco Jonathan, Olguín-Araneda Valeria, Plaza-Garrido Angela, Miranda-Cárdenas Camila, Cofré-Araneda Glenda, Pizarro-Guajardo Marjorie, Sarker Mahfuzur R., Paredes-Sabja Daniel. (2013). The Clostridium difficile exosporium cysteine (CdeC)-rich protein is required for exosporium morphogenesis and coat assembly. Journal of bacteriology, 195, 3863-3875.
Bauer M. P., Kuijper E. J., van Dissel J. T., of, Diseases European. (2009). European Society of Clinical Microbiology and Infectious Diseases (ESCMID): treatment guidance document for Clostridium difficile infection (CDI). Clinical Microbiology and Infection, 15, 1067-1079.
52 Britton Robert A., Young Vincent B. (2012). Interaction between the intestinal microbiota and host in Clostridium difficile colonization resistance. Trends in microbiology, 20, 313-319.
Buffie Charlie G., Jarchum Irene, Equinda Michele, Lipuma Lauren, Gobourne Asia, Viale Agnes, Ubeda Carles, Xavier Joao, Pamer Eric G. (2012). Profound Alterations of Intestinal Microbiota following a Single Dose of Clindamycin Results in Sustained Susceptibility to Clostridium difficile-Induced Colitis. Infection and Immunity, 80, 62-73.
Cerquetti M., Serafino A., Sebastianelli A., Mastrantonio P. (2002). Binding of Clostridium difficile to Caco-2 epithelial cell line and to extracelular matrix proteins. Immunology Medical Microbioly, 32, 211-218.
Cohen S, Tang Y , Rahmani D, Silva J. (2009). Persistence of an endemic isolate of C. difficile in the environment of a general medicine ward. Clinicla Infection Diseases, 30, 952-954.
Chen Kangni, d’Arc Stephanie, Setty Naveen, Bamford Kathy, Fairweather Neil, Tyrrell-Price Jonathan. (2013). In Recurrent C. difficile, the CRP Response to the Primary C. difficile Infection Predicts Whether the Same Strain or a Different Strain will Cause a Second Infection. Digestive Diseases and Sciences, 58, 1683-1688.
53 Deakin Laura J. , Clare Simon, Fagan Robert P., Dawson Lisa F. , Pickard Derek, J. , West Michael R. , Wren Brendan W. , Fairweather Neil F. , Dougan Gordon, Lawley Trevor D. (2012). The Clostridium difficile spo0A Gene Is a Persistence and Transmission Factor. Infection and Immunity, 80, 2704-2711.
Gerding Dale N. (2004). Clindamycin, cephalosporins, fluoroquinolones, and Clostridium difficile-associated diarrhea: this is an antimicrobial resistance problem. Clinical infectious diseases : an official publication of the Infectious Diseases Society of
America, 38, 646-648.
Govind R, Dupuy B. (2012). Secretion of C. difficile Toxins A and B Requires the Holin-like Protein TcdE. Plos One, 8, 1-14.
Hutton Melanie L., Mackin Kate E., Chakravorty Anjana, Lyras Dena. (2014). Small animal models for the study of Clostridium difficile disease pathogenesis. FEMS Microbiology Letters, 352, 140-149.
Johnson Stuart. (2009). Recurrent Clostridium difficile infection: A review of risk factors, treatments, and outcomes. Journal of Infection, 58, 403410.
Johnson Stuart, Samore Matthew H., Farrow Kylie A., Killgore George E., Tenover Fred C., Lyras Dena, Rood Julian I., DeGirolami Paola, Baltch Aldona L., Rafferty Mary, Pear Suzanne M., Gerding Dale N. (1999). Epidemics of Diarrhea Caused by a Clindamycin-Resistant Strain of Clostridium difficile in Four Hospitals. New England Journal of Medicine, 341, 1645-1651.
54 Karas J. A., Enoch D. A. , Aliyu S. H. . (2010). A review of mortality due to Clostridium
difficile infection. Journal of Infection, 61, 18.
Kelly C. P. (2012). Can we identify patients at high risk of recurrent Clostridium difficile infection? Clinical microbiology and infection : the official publication of the European Society of Clinical Microbiology and Infectious Diseases, 18 Suppl 6, 21-27.
Kim Kyung-Nam, Kang Ju-Hee, Yim Sung-Vin, Park Chang-Shin. (2008). Role of Caveolin-1 in Indomethacin-induced Death of Human Hepatoadenocarcinoma SK-Hep1 Cells. The Korean journal of physiology & pharmacology : Official journal of the Korean Physiological Society and the Korean Society of Pharmacology, 12, 143-148.
Kumar Rakesh, Nagarwal Ramesh C., Dhanawat Meenakshi, Pandit Jayanta. (2011). In-Vitro and In-Vivo Study of Indomethacin Loaded Gelatin Nanoparticles. Journal of Biomedical Nanotechnology, 7, 325.
Lawley Trevor D., Clare Simon, Walker Alan W., Goulding David, Stabler Richard A., Croucher Nicholas, Mastroeni Piero, Scott Paul, Raisen Claire, Mottram Lynda, Fairweather Neil F., Wren Brendan W., Parkhill Julian, Dougan Gordon. (2009). Antibiotic Treatment of Clostridium difficile Carrier Mice Triggers a Supershedder State, Spore-Mediated Transmission, and Severe Disease in Immunocompromised Hosts. Infection and Immunity, 77, 3661-3669.
55 Lim Sang-Min, Ahn Ki-Bum, Kim Christine, Kum Jong-Won, Perinpanayagam Hiran, Gu Yu, Yoo Yeon-Jee, Chang Seok, Han Seung, Shon Won-Jun, Lee Woocheol, Baek Seung-Ho, Zhu Qiang, Kum Kee-Yeon. (2016). Antifungal effects of synthetic human β-defensin 3-C15 peptide. Restorative Dentistry & Endodontics, 41, 91-97.
Lucas Sylvia. (2016). The Pharmacology of Indomethacin. Headache: The Journal of Head and Face Pain, 56, 436-446.
Macpherson Andrew J., Harris Nicola L. (2004). Interactions between commensal intestinal bacteria and the immune system. Nature reviews. Immunology, 4, 478-485.
Martinez Fernando J., Leffler Daniel A., Kelly Ciaran P. (2012). Clostridium difficile outbreaks: prevention and treatment strategies. Risk Management and Healthcare Policy, Volume 5, 55-64.
McFarland Lynne V. (2008). Update on the changing epidemiology of Clostridium difficile-associated disease. Nature Clinical Practice Gastroenterology & Hepatology, 5, 40-48.
McFarland Lynne V., Surawicz Christina M., Rubin Moshe, Fekety Robert, Elmer Gary W., Greenberg Richard N. (2010). Recurrent Clostridium difficile Disease: Epidemiology and Clinical Characteristics. Infection Control and Hospital Epidemiology, 20, 43-50.
McGlone S. M., Bailey R. R. , Zimmer S. M., Popovich M. J. , Tian Y., Ufberg P., Muder R. R., Lee B. Y. (2012). The economic burden of Clostridium difficile. Clinical Microbiology and Infection.
56 O’Horo J. C., Jindai K., Kunzer B., Safdar N. (2014). Treatment of recurrent Clostridium
difficile infection: a systematic review. Infection, 42, 43-59.
Paredes-Sabja Daniel, Cofre-Araneda Glenda, Brito-Silva Christian, Pizarro-Guajardo Marjorie, Sarker Mahfuzur R. (2012). Clostridium difficile Spore-Macrophage Interactions: Spore Survival. Plos ONE, 7.
Paredes-Sabja Daniel, Sarker Mahfuzur R. (2012). Adherence of Clostridium difficile spores to Caco-2 cells in culture. Journal of medical microbiology, 61, 1208-1218.
Paredes-Sabja Daniel, Shen Aimee, Sorg Joseph A. (2014). Clostridium difficile spore biology: sporulation, germination, and spore structural proteins. Trends in Microbiology, 22.
Parton Robert G., Simons Kai. (2007). The multiple faces of caveolae. Nature reviews. Molecular cell biology, 8, 185-194.
Pawlowski S. W., Calabrese G., Kolling G. L., Freire R., AlcantaraWarren C., Liu B., Sartor R. B., Guerrant R. L. (2010). Murine Model of Clostridium difficile Infection with Aged Gnotobiotic C57BL/6 Mice and a BI/NAP1 Strain. The Journal of Infectious Diseases, 202, 1708-1712.
Pelkmans L., Kartenbeck J., Helenius A. (2001). Caveolar endocytosis of simian virus 40 reveals a new two-step vesicular-transport pathway to the ER. Nature cell biology.
57 Reeves Angela E., Koenigsknecht Mark J., Bergin Ingrid L., Young Vincent B. (2012). Suppression of Clostridium difficile in the Gastrointestinal Tracts of Germfree Mice Inoculated with a Murine Isolate from the Family Lachnospiraceae. Infection and Immunity, 80, 3786-3794.
Reeves Angela E., Theriot Casey M., Bergin Ingrid L., Huffnagle Gary B., Schloss Patrick D., Young Vincent B. (2011). The interplay between microbiome dynamics and pathogen dynamics in a murine model of Clostridium difficile Infection. Gut Microbes, 2, 145-158.
Réty Stéphane, Salamitou Sylvie, Garcia-Verdugo Ignacio, Hulmes David J. S. , Hégarat Françoise Le, Chaby Richard, Lewit-Bentley Anita. (2005). The Crystal Structure of the Bacillus anthracis Spore Surface Protein BclA Shows Remarkable Similarity to Mammalian Proteins. Journal of Biological Chemistry, 280, 43073-43078.
Ridlon Jason M., Kang Dae-Joong, Hylemon Phillip B. (2006). Bile salt biotransformations by human intestinal bacteria. Journal of Lipid Research, 47, 241-259.
Robert André, Asano Tomoaki. (1977). Resistance of germfree rats to indomethacin-induced intestinal lesions. Prostaglandins, 14, 333-341.
Rupnik Maja, Wilcox Mark H. , Gerding Dale N. . (2009). Clostridium difficile infection: new developments in epidemiology and pathogenesis. Nature Reviews Microbiology, 7, 526-536.