Optimización de la extracción de Au y Ag a partir de minerales refractarios con contenidos de Sb con una Lixiviación Sulfuro Alcalina
Texto completo
(2) AGRADECIMIENTO. A mis docentes de la Escuela Profesional de Ingeniería. Metalúrgica. de. la. Universidad. Nacional de San Agustín, por haber contribuido con su conocimiento y constancia en mi desarrollo académico..
(3) DEDICATORIA. A Dios por ser la luz que guía mi camino.. A mis padres por ser mi fuente de inspiración para lograr este objetivo, y a mi familia por darme su apoyo incondicional..
(4) ÍNDICE GENERAL CONTENIDO RESUMEN …………………………………………………………….…….. ABSTRACT……………………………………………………………...…… INTRODUCCIÓN …………………...………………………………………. CAPITULO I: ASPECTOS GENERALES ……………...………………… 1.1. PLANTEAMIENTO DEL ROBLEMA ….……………………….…….. 1.2 JUSTIFICACIÓN …………………………………………..…………… 1.3 OBJETIVOS ……………………………………………………….……. 1.3.1 OBJETIVO GENERAL: ………………………………………… 1.3.2 OBJETIVOS ESPECÍFICOS: ………………………………...… 1.4 HIPOTESIS ………………………………………………………….….. 1.5. FUNDAMENTOS BASICOS DE LA CIANURACION …………..….. 1.5.1. TERMODINÁMICA DE LA CIANURACIÓN …………………. 1.5.2. CINÉTICA DE LA CIANURACIÓN ……………………….…… 1.5.3. EFECTOS ACELERADORES Y RETARDADORES ……… 1.5.4. DESCOMPOSICIÓN DE SOLUCIONES DE CIANURO …… 1.5.5. EFECTO DE LA CONCENTRACIÓN DE CIANURO SOBRE LA VELOCIDAD DE DISOLUCIÓN …………..……………… 1.5.6. EFECTO DEL TAMAÑO DE PARTÍCULA SOBRE LA VELOCIDAD DE DISOLUCIÓN …………………………… 1.5.7. EFECTO DEL OXIGENO SOBRE LA DISOLUCIÓN DEL ORO ……………………………………………………………... 1.5.8. EFECTO DE LA ALCALINIDAD SOBRE LA DISOLUCIÓN DEL ORO ……………………………………………..………… 1.5.9. EFECTO DE LA TEMPERATURA SOBRE LA CIANURACIÓN ………………………………………………. 1.6 TEORIAS DE LOS PRES TRATAMIENTOS DE MINERALES REFRACTARIOS DE ORO …………………………………………… 1.6.1. PROCESOS DE TOSTACIÓN. Pg.. 14 14 15 15 15 15 16 16 18 19 19 20. 21 22. 23 25 27. 27 29.
(5) ………………………………… 1.6.2. PROCESOS DE ALTA PRESIÓN …………………………… 1.6.3. PROCESO ARSENO ……………………………….………… 1.6.4. PROCESO NITROX …………………………………………… 1.6.5. OXIDACIÓN BIOLÓGICA ……………………………….……. 1.6.6. LIXIVIACIÓN CON TIOUREA ……..…………….………….… 1.6.7.TRATAMIENTO DE MINERALES REFRACTARIOS DE ORO CONTENIENDO MINERALES CARBONACEOS …… 1.6.8. RECUPERACIÓN DE ORO DE MINERALES REFRACTARIOS, MEDIANTE CIANURACIÓN A BAJA PRESIÓN ………………………………………………………. 1.6.9. PROCESO ALBIÓN……….………………….….…………….. CAPITULO II: FUNDAMENTO TEÓRICO ……………………………….. 2.1. TEORÍAS DE VARIOS AUTORES …………………………………… 2.2. TEORIA DE LA LIXIVIACIÓN ………………………………………… 2.2.1. LIXIVIACIÓN DEL ANTIMONIO …………………….………… 2.2.2. LIXIVIACIÓN DEL ORO CON POLISULFURO ……………… CAPITULO III: DESARROLLO EXPERIMENTAL ……………………… 3. 1. INTRODUCCIÓN ……………………………………………………… 3.2. PROCEDIMIENTO EXPERIMENTAL ……………………………….. 3.2.1. COMPOSICIÓN QUÍMICA …………………………..………… 3.2.2. CARACTERIZACIÓN MINERALÓGICA ……..….…………… 3.2.3. PRUEBAS DE LIXIVIACIÓN …………………..……………… 3.3. RESULTADOS …………………………………………………………. 3.3.1. CIANURACIÓN SIN PRE TRATAMIENTO …..……………… 3.3.2. PRE TRATAMIENTO MEDIANTE LIXIVIACIÓN SULFURO – ALCALINA ……………………………………………….…… 3.3.3. CIANURACIÓN LUEGO DEL PRE TRATAMIENTO …..…… CAPITULO IV : DISEÑO EXPERIMENTAL – METODO TAGUCHI. 31 33 34 35 36 37. 39 41 42 42 44 44 46 50 50 52 53 53 57 59 59 60 60 70.
(6) …... 4.1. ARREGLOS ORTOGONALES PARA EXPERIMENTOS A DOS NIVELES ……………………………………………………………...… 4.2. DESARROLLO ………………………………………………………… 4.2.1. NOCIONES PRELIMINARES ………………………………… CONCLUSIONES ……………………...…………………………………… SUGERENCIAS ……..……………………………………………………... BIBLIOGRAFÍA ……………………………………………………………... 71 73 73 82 83 84.
(7) ÍNDICE DE TABLAS. TABLA N° Tabla N° 1 Tabla N° 2 Tabla N° 3 Tabla N° 4 Tabla N° 5 Tabla N° 6 Tabla N° 7 Tabla N° 8. Tabla N° 9 Tabla N° 10 Tabla N° 11. Tabla N° 12 Tabla N° 13 Tabla N° 14 Tabla N° 15 Tabla N° 16 Tabla N° 17 Tabla N° 18 Tabla N° 19 Tabla N° 20 Tabla N° 21 Tabla N° 22 Tabla N° 23. CONTENIDO Contenido de HCN en función al pH…………….…… Concentración de oxígeno disuelto en agua a diferentes temperaturas y altitudes………………….. Concentración de oxígeno para la disolución del oro Composición química del mineral……………....…… Análisis de fases de microprobeta……………....…… Condiciones experimentales de lixiviación sulfuroalcalina y de cianuración…………………...…….…… Cinética de extracción de oro y de plata de mineral sin pretratamiento…………………………..………… Efecto de la concentración de NaOH sobre la eliminación del antimonio al variar las concentraciones de Na2S………………………...…… Efecto de la concentración de Na2S sobre la eliminación de antimonio……………………………… Efecto de la temperatura sobre la eliminación del antimonio……………………………...……………...… Efecto de la concentración de NaOH sobre la extracción de oro y plata ..………………………..…… Efecto de la concentración de Na2S sobre la extracción de oro y plata……………………………… Efecto de la temperatura de Na 2S sobre la extracción de oro y plata……………………………… Arreglo Ortogonal Para Tres Variables a dos Niveles……………………………………………….….. Arreglos Ortogonales a Dos niveles……...………..… Extracción de oro con las variables NaOH y Na 2S… Niveles de las variables…….…………………….…… Matriz de diseño experimental por variables .........… Matriz de diseño experimental……………...………… Determinar las interacciones………………….……… Totales de los niveles de cada variable ……..……… Promedios en cada nivel…………………...………… Análisis de Varianza (ANAVA)…………….…………. PG. 21 24 25 53 56 58 59. 61 62 63. 64 66 69 72 72 73 74 74 76 77 77 78 79.
(8)
(9) ÍNDICE DE FIGURAS. FIGURA N° Figura N° 1 Figura N° 2. Figura N° 3 Figura N° 4 Figura N° 5 Figura N° 6 Figura N° 7 Figura N° 8 Figura N° 9. Figura N° 10. Figura N° 11. Figura N° 12. Figura N° 13. CONTENIDO Diagrama Eh-pH del sistema de Au-CN-H2O..…. Curva típica mostrando el efecto de la presión de oxígeno y su concentración en solución, versus la concentración de cianuro………………..………… Disociación entre el HCN y CN- libre en función de pH…………………….…..……………………… Curva de velocidad de disolución del oro en función de la temperatura………………….……… Diagrama E-pH para el sistema Sb-S-O-H a 70°C, [Sb] = 1.27 x10-4………………….………… Especies en equilibrio en el diagrama E-pH para el azufre y el sulfuro alcalino de oro…………… Diagrama E-pH para el sistema Au-CN-S-2 a 70°C….................................................................. Presencia y asociación de oro y de plata de un mineral bajo el microscopio………..……………… Extracción de oro y de plata de mineral tal como se recibe, sin ningún pretratamiento, mediante cianuración. Condiciones: tiempo de lixiviación 24 h, [NaCN] = 1.5 g/L, tamaño de partícula P80 = 15 µm……………………………………………… Efecto de [NaOH] sobre la eliminación del antimonio. Condiciones: Temperatura 70°C, tiempo de lixiviación 2.5 h, tamaño de partícula P80 = 15 µm……………………………….………… Efecto de [Na2S] sobre la eliminación del antimonio. Condiciones: Temperatura 70°C, tiempo de lixiviación 2.5 h, tamaño de partícula P80 = 15 µm…………………………………………. Efecto de la temperatura sobre la eliminación del antimonio en un pretratamiento de sulfuro alcalino. Condiciones: tamaño de partícula P80 =. PG. 17. 22 23 27 46 48 49 55. 60. 61. 62. 15 µm, [Na2S] = 320 g/L, [NaOH] = 72 g/L…………………………………………………… 63 Cianuración de ripios pre tratados mostrando la 64.
(10) Figura N° 14. Figura N° 15. Figura N° 16. Figura N° 17 Figura N° 18. extracción de oro y plata………………..………… Cianuración de ripios pre tratados (concentraciones fijas de NaOH 100 g/L y 150 g/L) para la extracción de oro y plata…….……… 67 Correlación entre la extracción de oro y de plata y la eliminación de antimonio a diferentes temperaturas. Condiciones: tamaño de partícula P80 = 15 µm, [Na2S] = 320 g/L, [NaOH] = 60 g/L…………………………………………………… Extracción de oro en función de la concentración de NaOH, presentando la ecuación empírica…………………………………………..… Extracción de oro en función de la concentración de Na2S, presentando la ecuación empírica …… Representación gráfica de los efectos de las variables y de la interacción entre ellas….………. 69. 75 75 78.
(11) RESUMEN. El. presente. trabajo. de. investigación. “OPTIMIZACIÓN. DE. LA. EXTRACCIÓN DE ORO Y PLATA A PARTIR DE MINERALES REFRACTARIOS CON CONTENIDOS DE Sb CON UNA LIXIVIACIÓN SULFURO - ALCALINA”, tiene como objetivo optimizar la extracción de oro y plata aplicando un pre tratamiento a un mineral refractario con contenidos de antimonio para luego aplicar la cianuración convencional; se utilizó la aplicación del método Taguchi en el diseño experimental ya que se demuestra ser una herramienta muy eficaz en la determinación de los factores o variables e interacciones durante la extracción de antimonio, para luego permitir aplicar una cianuración convencional. Los resultados que se dieron para la optimización de la extracción de oro y plata aplicando un pretratamiento al mineral refractario con contenidos de antimonio, para luego aplicar la cianuración convencional nos dio como resultado que la temperatura y las concentraciones relativas de Na 2S y de NaOH en el medio lixiviante se han identificado como los factores más importantes que afectan la extracción de antimonio y en la posterior cianuración para la extracción de oro y de plata; las más altas extracciones de oro (81.51%) y de plata (87.20%) corresponden a un incremento de 29% para el oro y 74% para la plata, cuando se compara con el mineral sin pretratamiento.. Palabras clave: Lixiviación sulfuro – alcalina, cianuración, optimización de recuperación del oro y plata..
(12) ABSTRACT The. present. EXTRACTION. work. of. investigation. OF. GOLD. AND. "OPTIMIZATION. SILVER. FROM. OF. THE. REFRACTORY. MINERALS WITH CONTENTS OF Sb WITH A LEACHING SULFUR ALKALINE", has like objective to optimize the extraction of gold and silver applying a pretreatment to a refractory mineral with antimony content to then apply conventional cyanidation; the application of the Taguchi method was used in the experimental design since it is shown to be a very effective tool in the determination of the factors or variables and interactions during the extraction of antimony, in order to later allow applying a conventional cyanidation. The results that were given for the optimization of the extraction of gold and silver by applying a pretreatment to the refractory ore with antimony contents, to then apply the conventional cyanidation, gave us as a result that the temperature and the relative concentrations of Na2S and NaOH in the leaching medium have been identified as the most important factors affecting the extraction of antimony and in the subsequent cyanidation for the extraction of gold and silver; the highest extractions of gold (81.51%) and silver (87.20%) correspond to an increase of 29% for gold and 74% for silver, when compared to ore without pretreatment.. Keywords: Sulfur - alkaline leaching, cyanidation, optimization of gold and silver recovery..
(13) INTRODUCCIÓN. Algunas veces se obtienen pobres resultados en la cianuración cuando minerales sulfurosos están presentes en los minerales de oro.. Los procesamientos hidrometalúrgicos convencionales como opciones tecnológicas de tratamiento, tal como la lixiviación alcalina con cianuro, resultan generalmente ineficientes ante cierto tipo de menas o concentrados. Estas menas por no responder positivamente a los procesos de concentración tradicional se les ha tipificado como Menas refractarias. En forma simplificada las causas básicas de refractariedad es como sigue: Encapsulamiento físico en pirita y arsenopirita. Carbón orgánico actuando como absolvedor de oro (preg robbing). Reacciones secundarias que consumen cianuro y oxígeno. Capa de revestimiento sobre la superficie de las partículas de oro. Compuesto de oro insolubles en cianuro (teleruros, etc). Elementos perjudiciales como Cu, As, Sb, etc. Baja extracción de oro menor al 80%. Niveles altos de consumo de reactivos. Tiempo de retención prolongada. Actualmente existen una serie de procedimientos no convencionales, casi todos aplicados en la industria, pero para que su aplicación sea exitosa para un yacimiento en particular como es el nuestro se tiene que idear una metodología adecuada de investigación que implica una serie de técnicas que permiten seleccionar el proceso tecnológico más adecuado, del más bajo costo y en el menor tiempo posible..
(14) Se puede recomendar para el procesamiento de cada tipo de ocurrencia del oro lo siguiente: Oro libre: Concentración, gravimetría, cianuración. Sulfuros: molienda, flotación, seguida por cualquiera de los procesos de oxidación a presión, oxidación bacteriana o tostación. Materia carbonaceos: Tostación con flotación o tostación previa. Cuarzo – silicatos: Molienda fina y cianuración. Para liberar los metales preciosos contenidos en minerales refractarios, es necesario realizar un tratamiento previo de oxidación de la matriz sulfurosa que permita el contacto directo de los metales con el reactivo de lixiviación. Una mejora importante al proceso de cianuración convencional, es la oxidación de la matriz refractaria que permita condiciones adecuadas para la interacción de los valores metálicos con el agente acomplejante. De acuerdo a esto, hay varias propuestas: . El uso del ozono.. . Cianuración oxidante a presión.. . Procedimiento del cloruro-oxígeno.. . El uso de mezclas de sulfuro de sodio + hidróxido de sodio.. . Procedimiento NITROX.. . Procedimiento ARSENO.. . Oxidación biológica.. . Procedimiento de tostación.. . Procedimiento ALBIÓN.. Los minerales sulfuros antimoniales y arsenicales como la pirargirita (Ag3SbS3), la proustita (Ag3AsS3), la tenantita (Cu12As4S13) y la tetrahedrita (Cu12Sb4S13), enargita Cu3AsS4, estanita Cu2SnFeS4,.
(15) andorita AgPbSb3S6, jamesonita Pb4FeSb6S14, boulangerita Pb5Sb4S11, franckeita Pb5Sn3Sb2S14, cilindrita Pb3Sn4Sb2S14, entre otros. Todos estos sulfuros de Sb/As son caracterizados por su respuesta pobre a la lixiviación con cianuro para la extracción de Au/Ag. Celep y otros informaron que los métodos de pre tratamiento no lograron el nivel deseado de extracciones de oro y plata de un mineral refractario antimonial. Es por lo cual, a pesar de su contenido de metales valiosos, no son explotados debido a la dificultad de comercializar sus productos, o a los bajos precios que se pagan debido a los castigos que se imponen. El uso de sulfuro de sodio o mezclas de sulfuro de sodio + hidróxido de sodio para la recuperación de sulfuros simples y sulfosales ha sido estudiado por numerosos investigadores. De manera general, se reporta que la velocidad de disolución de Sb, As y Sb de estos minerales tiene una cinética bastante lenta, se requieren soluciones de sulfuro de sodio concentrado y caliente y un mineral en grano fino para solubilizar estos metales. Es por eso al tener nosotros un mineral con contenido de Au y Ag y siendo este mineral refractario, pero teniendo antimonio, se le va hacer un pre tratamiento lixiviante con Na2S y NaOH y mediante esta investigación vamos a mejorar la extracción de oro y plata para luego aplicar el proceso de cianuración convencional.. El presente trabajo de investigación se ha ordenado en cuatro capítulos, el primero en relación a los aspectos generales, el segundo a fundamento teórico, el tercero al desarrollo experimental y el cuarto al desarrollo del diseño experimental – método Taguchi..
(16) Finalmente se dan las conclusiones de los objetivos de la investigación realizada, terminando con las recomendaciones y bibliografía consultada..
(17) CAPITULO I ASPECTOS GENERALES 1.1 PLANTEAMIENTO DEL PROBLEMA En numerosos yacimientos mineralógicos del Perú, se tienen importantes depósitos de minerales del tipo sulfosales, que contienen en su estructura cristalina una variedad de elementos metálicos unidos al azufre, por su composición química los cuales se les considera como minerales complejos, para los cuales no existe un tratamiento metalúrgico estándar para la recuperación de sus valores metálicos de importancia económica.. Estos yacimientos a pesar de su contenido de metales valiosos, no son explotados debido a la dificultad de comercializar sus productos,. 17.
(18) o a los bajos precios que se pagan debido a los castigos que se imponen. Es decir, tenemos una gran cantidad de este tipo de mineral principalmente en las zonas de Ancash, Lima, Cajamarca y Cerro de Pasco, es decir se tiene una gran cantidad de mineral que en algunos casos no se los trata o si se los trata su recuperación de metales preciosos es baja, menor al 80 %. Pero como se mencionó en la parte de la introducción existen diferentes procesos de tratamiento, con esto quiero decir que aplicare uno de ellos para mejorar su recuperación aplicando esta nueva tecnología, pero siempre cuidándonos de hacer el menor impacto ambiental. 1.2. JUSTIFICACIÓN Es necesario buscar alternativas no convencionales para el tratamiento de minerales refractarios con contenidos de antimonio y casos también donde hay arsénico, que son elementos sulfurados muy comunes en nuestro país cuando hay contenidos de oro y plata. También tenemos que ver que no solo nosotros los metalurgistas debemos trabajar aplicando costo – beneficio, sino también ver la parte medioambientalista que en nuestro caso es muy beneficioso. 1.3. OBJETIVOS 1.3.1. OBJETIVO GENERAL . Optimizar la extracción de oro y plata aplicando un pre tratamiento a un mineral refractario con contenidos de antimonio para luego aplicar la cianuración convencional.. 1.3.2. OBJETIVOS ESPECÍFICOS. 18.
(19) . Seleccionar un proceso de pre tratamiento para este mineral refractario.. . Hacer pruebas comparativas del método propuesto con el método tradicional de cianuración.. . Determinar los parámetros operativos al proponer un nuevo proceso de tratamiento.. 1.4. HIPOTESIS Si aplicando un pre tratamiento a un mineral refractario de oro y plata con contenido de antimonio, para luego aplicar una cianuración convencional, este aumentara la recuperación. Para lo cual se hará pruebas comparativas de cianuración con tratamiento y cianuración sin tratamiento. 1.5. FUNDAMENTOS BASICOS DE LA CIANURACIÓN La cianuración es el método más común para recuperar el oro de los minerales. El oro se oxida y se disuelve en una solución alcalina de cianuro en presencia de Oxígeno como oxidante, formando Au (I) complejo de cianuro, Au- (CN)2 .. La reacción general de la lixiviación del oro puede ser expresada por la siguiente Reacción: 4Au + 8CN- + O2 + 2H2O. 4 Au (CN)2 - + 4OH -. Con el fin de representar la química en el equilibrio de la reacción de cianuración, a menudo es conveniente utilizar el diagrama Eh-pH (diagrama de Pourbaix). En donde se indican los equilibrios:. Para la reducción de agua en hidrógeno (línea inferior): 2H+ + 2OH -. 2H2O. Para la reducción de oxígeno en el agua (línea superior): 19.
(20) O2 + 4H+ + 4e. 2H2O. Entre las dos líneas está el área en que el agua es estable. La región indica el área de estabilidad del complejo de oro como Au (CN)2 - en soluciones acuosas de cianuro que se produce en un amplio rango de valores de pH, como se ilustra en la Figura N° 1, el oro puede ser oxidado por el oxígeno en un potencial más o menos de - 0.52 V, y ser soluble en soluciones alcalinas de cianuro a pH alto (>10). A efectos prácticos, la estequiometria de la reacción de disolución de oro es según la siguiente reacción: Au (CN)2 - +e. Au + 2 (CN)-. Mientras que la reacción reductora de oxígeno puede ser presentada por la siguiente reacción: 02 + 2H2O + 4e-. 20. 4OH-.
(21) Figura N° 1: Diagrama Eh-pH del sistema de Au-CN-H2O, a 25 °C (Zhang S. 2004). 1.5.1. TERMODINÁMICA DE LA CIANURACIÓN: Evaluar los diagramas de Pourbaix que relacionan el potencial de óxido-reducción (Eh) del metal con el pH del Medio (ver Fig. N°1), muestran que compuestos como: -2. Au (OH)3; AuO; (HAuO3) y también el ion (Au). +3.. Requieren elevados potenciales Redox (superiores al de la descomposición del oxígeno) para formarse. La lixiviación del oro metálico es, por lo tanto, muy difícil a causa de la gran estabilidad de este último.. 21.
(22) En el diagrama Au-H2 O-CN, no obstante, la reacción: Au + 2 CN-, se lleva a cabo dentro de los. Au (CN)2 - + 1e. límites de estabilidad del agua. El campo de estabilidad del complejo aurocianuro está limitado por una recta que inicialmente muestra una pendiente pronunciada (efecto dela hidrólisis del cianuro a pH menor a 9) tornándose luego casi horizontal debido a la acción oxidante del oxígeno en medio básico, hecho que a su vez permite que se haga efectiva la reacción de lixiviación por formación de aurocianuros. En la misma figura se puede observar que los compuestos Au (OH)3, +3. Au y (HAuO3). –2. son reducidos por la introducción del cianuro.. La disolución del oro está regida por los principios electroquímicos de la Corrosión, la explicación esquemática de este fenómeno se facilita (mediante la reacción 2), la reducción del oxígeno sobre la superficie metálica en la zona catódica va acompañada por la oxidación del oro en la zona anódica de acuerdo a las siguientes reacciones: O2 + 2H2O + 2e2Au. H2O2 + 2OH- (1). 2Au+ + 2e-. Au+ + 2CN-. Au (CN)2 -. (2) (3). Ecuación fundamental de la Cianuración: 4Au + 8NaCN + O2 + 2H2O. 4Na Au (CN)2 + 4 NaOH (4). 1.5.2. CINÉTICA DE LA CIANURACIÓN: Como el tiempo en el cual se lleva la reacción es el de la etapa de menor velocidad (llamada entonces etapa controlante) es importante identificar a ésta para incrementar su rapidez. Una reacción fisicoquímica en el cual se hallan involucradas una fase sólida y otra líquida se consuma en las cinco etapas siguientes:. 22.
(23) a) Difusión de los reactantes desde la solución hasta la interface sólido-líquida. b) Adsorción de los reactantes en la superficie del sólido. c) Reacción en la superficie. d) Desorción de los productos de la reacción de la superficie del sólido. e) Difusión de estos productos de la interface sólido-líquido a la solución. 1.5.3. EFECTOS ACELERADORES Y EFECTOS RETARDADORES a.- EFECTOS ACELERADORES: La presencia de pequeñas cantidades de plomo, mercurio, bismuto y sales de talio, aceleran la disolución del oro. A partir de la determinación de potenciales de electrodo en soluciones cianuradas se ha encontrado que el oro realmente puede desplazar los iones de estos cuatro metales. De ahí que la disolución rápida del oro en presencia de estos iones puede deberse a la alteración en la superficie del oro al mezclarse con estos metales desplazados.. b.- EFECTOS RETARDADORES: Se tiene principalmente: a) Consumidores de cianuro, tales como minerales sulfurados de hierro, como pirita, marcasita, pirrotita, minerales de cobre en general todos a excepción de la calcopirita, como la calcosita, malaquita, covelita, minerales de arsénico, la antimonita. b) Consumidores de oxígeno, como la pirrotita, minerales de arsénico.. 23.
(24) c) Consumidores de cianuro y oxígeno, como los tiosulfatos, tiocianatos, los sulfuros de cobre solubles en cianuro, los cationes metálicos, el ion calcio. 1.5.4. DESCOMPOSICIÓN DE SOLUCIONES DE CIANURO: Las sales de cianuro se descomponen en ácido cianhídrico (HCN) y en ion -. cianuro (CN ). El grado de descomposición en estos dos compuestos, depende del pH. Una solución acuosa de cianuro alcalino se hidroliza de acuerdo a las reacciones siguientes: CN- + H2O. HCN + OH-. NaCN + H2O HCN. (1). HCN + NaOH. (2). H+ + CN-. (3). La razón por la cual se da esta hidrólisis depende de la cantidad de álcali libre. Si la cantidad de álcali es grande la descomposición de cianuro puede ser despreciable, pero en ausencia de este la hidrólisis puede ser retardada por la adición de cal. La proporción de ácido cianhídrico y ion cianuro presentes en la solución de cianuración, depende del pH, de la forma siguiente:. Tabla N° 1: Muestra el contenido de HCN en función al pH pH. HCN (%). CN(%). 8.4. 90. 10. 9.3. 50. 50. 10.2. 10. 90. Fuente: Misari M. Metalurgia del oro.. 24.
(25) 1.5.5. EFECTO DE LA CONCENTRACIÓN DE CIANURO SOBRE LA VELOCIDAD DE DISOLUCIÓN: La concentración de cianuro óptima de la solución depende de las características de la MENA y deberá ser determinada experimentalmente. Las concentraciones de cianuro libre presente en las soluciones comúnmente usadas están entre valores de 0,1 – 3,5 g/l de NaCN, con un consumo de 0,5 – 5 kg NaCN por tonelada de mineral tratado. Solamente son termodinámicamente posibles las reacciones que tienen presencia de cianuro y oxígeno en la solución. A concentraciones bajas de cianuro, una mayor presión de oxígeno no tiene efecto sobre la velocidad de disolución, sea del oro o de la plata, mientras que, a concentración de cianuro mayor, la disolución pasa a ser dependiente de la presión parcial de oxígeno.. Figura N° 2: Curva típica mostrando el efecto de la presión de oxígeno y su concentración en solución, versus la concentración de cianuro.. 25.
(26) El consumo de cianuro es siempre muy elevado comparado con el consumo estequiométrico de la reacción de disolución de oro debido a pérdidas mecánicas y principalmente a la reacción con compuestos cianicidas. 1.5.6.. EFECTO. DEL. TAMAÑO. DE. PARTÍCULA. SOBRE. LA. VELOCIDAD DE DISOLUCIÓN: La velocidad de disolución del oro es proporcional a la superficie expuesta del oro, la misma que depende del tamaño de la partícula mineral y el grado de liberación del metal precioso. En general, la velocidad de disolución aumenta con el menor tamaño de partícula (mayor liberación del oro). Sin embargo, al decrecer el tamaño de la partícula se incrementan también las reacciones de competencia de otros elementos, por tanto, se debe de encontrar un compromiso entre el tamaño de la partícula, el porcentaje de extracción de oro y el consumo de cianuro. La mena algunas veces tiene que ser molida muy fina para liberar a la partícula de oro y hacerlas adecuada para la lixiviación debido a que Barrsky informo que, bajo condiciones óptimas de aeración y agitación, se ha determinado que la velocidad máxima de disolución de oro es de 3,25 mg/cm2/h, esto es equivalente a una penetración de 1,68 um/h en cada lado de una partícula en forma plana lo que significa una reducción total en espesor de 3,36 um/h. Así una partícula de oro de 45 um de grosor (m 350) se disuelve por cianuración en aproximadamente 13 h, una partícula de 150 um de grosor se disuelve en 44 h.. 26.
(27) Las partículas gruesas se recuperan por gravimetría puesto que no podrán ser disueltas completamente en un tiempo de cianuración económicamente aceptable. 1.5.7. EFECTO DEL OXIGENO SOBRE LA DISOLUCIÓN DEL ORO: El agente oxidante para la reacción de cianuración es el oxígeno disuelto. Lograr que la concentración de oxígeno en solución sea alta, normalmente es más difícil que el control de la concentración de cianuro. La concentración de oxígeno aumenta la velocidad de disolución y la recuperación de oro; se puede aumentar hasta cierto punto, debido a que la máxima concentración de oxígeno disuelto está limitada por la máxima solubilidad del oxígeno en una solución acuosa y dependerá de la presión y temperatura del sistema; en condición de una 1 atm. y 25 °C estarán presente 8,2 mg O2/lts.. Tabla N° 2: Concentración de oxígeno disuelto en agua a diferentes temperaturas y altitudes. Temperature. Sea Level. 914 m Altitude. 1.828 m Altitude. (°C). (780mm Hg). (690mm Hg). (780mm Hg). 0. 14.6. 13.1. 11.7. 5. 12.8. 11.4. 10.3. 10. 11.3. 10.1. 9.1. 15. 10.1. 9.0. 8.1. 20. 9.1. 8.2. 7.3. 25. 8.3. 7.3. 6.6. 27.
(28) 30. 7.5. 6.7. 6.1. 35. 7.0. 6.2. 5.6. 40. 6.5. 5.7. 5.2. 45. 6.0. 5.3. 4.8. 50. 5.6. 4.9. 4.5. 60. 4.8. 4.2. 3.8. 70. 3.9. 3.4. 3.0. 80. 2.9. 2.4. 2.0. 90. 1.7. 1.1. 1.7. 100. 0. 0. 0. En la Tabla N° 2. Se puede observar el efecto de la concentración de oxígeno disuelto en agua a diferentes temperaturas y altitudes. Existen dos métodos para incrementar la concentración de oxígeno disuelto: a) Inyección de aire en el proceso de lixiviación a baja presión. b) Inyección de oxígeno puro, aire enriquecido con O2, H2O2 u otra fuente de oxígeno. Ambos métodos son caros que se justifica su uso para minerales con alta ley de oro y minerales constituidos por elementos cianicidas. Tabla N° 3: Concentración de oxígeno para la disolución del oro. % de OXIGENO 0. DISOLUCIÓN DE ORO mg/cm2/hora 0.04. 9.6. 1.03. 28.
(29) 20.9. 2.36. 60.1. 7.62. 99.5. 12.62. Fuente: Vargas Gallardo, Juan. Metalurgia del Oro y Plata. Segunda edición. Lima, Perú 1995. 1.5.8. EFECTO DE LA ALCALINIDAD SOBRE LA DISOLUCIÓN DEL ORO: En soluciones ácidas se promueve la producción del ácido cianhídrico, que no disuelve el oro ni la plata, y es ambientalmente peligroso por ser un gas venenoso muy activo. La norma de seguridad para trabajar industrialmente con cianuro indica que en todo momento debe operarse sobre pH 9.24. En la práctica se trabaja siempre sobre pH 10 que es denominado pH de alcalinidad protectora.. Figura N° 3: Disociación entre el HCN y CN- libre en función del pH Para mantener pH alcalino en las soluciones del sistema, en general se emplea soda cáustica para preparar solución de cianuro de sodio,. 29.
(30) y comúnmente cal en la etapa de lixiviación de minerales, los cuales neutralizan la acidez. Un exceso de cal protege al cianuro sódico de la hidrólisis, pero, si es demasiada concentración, puede retrasar la disolución del oro. Es decir: Evita pérdidas de cianuro por hidrólisis. Evita pérdida de cianuro por acción del dióxido de carbono del aire. Descompone los bicarbonatos en el agua antes de ser usados en cianuración. Neutraliza los compuestos ácidos contenidos en el mineral. Neutraliza los contenidos en el agua, sales ferrosas y férricas etc. Ayuda en la sedimentación de partículas finas. Mejora la extracción cuando se trata minerales conteniendo por ejemplo telururos. 1.5.9. EFECTO DE LA TEMPERATURA SOBRE LA CIANURACIÓN: La temperatura tiene un efecto favorable en la velocidad de disolución del oro, pero muy negativa en la solubilidad del oxígeno en las soluciones, a temperatura cercanas a 85°C se observa punto de inflexión en la velocidad de disolución del oro debido a la disminución de oxígeno en la solución.. 30.
(31) Figura N° 4: Curva de velocidad de disolución del oro en función de la temperatura. 1.6. TEORIAS DE LOS PRES TRATAMIENTOS DE MINERALES REFRACTARIOS DE ORO La evaluación y selección del proceso más económico es un desafío al que está haciendo frente un número cada vez mayor de compañías mineras. Para la adecuada elección de tecnología, el método de explotación empleado, la distribución de la recuperación metalúrgica dentro del yacimiento y la naturaleza refractaria de la minería. Está muy claro que no sería realista evaluar por separado el yacimiento o el proceso, pero, como regla general, la selección del proceso debe basarse en el método de tratamiento que ofrece la máxima rentabilidad económica. La elección definitiva de un esquema de tratamiento adecuado dependerá de muchos factores, pero los más importantes son los siguientes: Recuperación de oro. Costo de explotación. Costo de capital. Aceptación ambiental. En lo que se refiere a las características del mineral dentro del yacimiento, deben considerarse los siguientes aspectos: Mineralogía y causas del comportamiento refractario. Efecto de la mineralogía sobre la fase final del tratamiento y sobre las características del efluente. Posibilidades de concentración previa (generalmente flotación). Grado necesario de oxidación del azufre. Contenido de azufre en el mineral (o en el concentrado).. 31.
(32) Dimensiones, ley y accesibilidad del yacimiento. Efecto de la situación del yacimiento sobre los costos de adquisición de los principales reactivos. Disponibilidad y costes de energía eléctrica y combustibles. Las características del proceso que deben tenerse en cuenta en la evaluación son las siguientes: Eficacia en la consecución del grado necesario de oxidación del azufre. Eficacia de la oxidación, o de otro procedimiento para hacer inactivos los constituyentes carbonáceos que pueden dar lugar a retención por adsorción. Cantidades y coste de los reactivos necesarios. Energía necesaria (energía eléctrica y combustible). Costos de capital. Flexibilidad en el tratamiento de todos los tipos de mineral identificados o que es posible que se encuentren en el curso de la vida de la explotación. Características de los efluentes y efecto sobre los costes de tratamiento y evacuación. Para el tratamiento de menas refractarias hay muchos procesos posibles, tales como los que se describen a continuación entre otros, pero unos tienen un campo de aplicación muy limitado en el tratamiento de menas refractarias complejas o todavía no han llegado a aplicarse a escala industrial.. 32.
(33) 1.6.1. PROCESOS DE TOSTACIÓN: La tostación es una operación pirometalurgica por vía seca en la que mediante el calentamiento de los minerales metálicos a una determinada temperatura y con atmosfera adecuada consigue modificar químicamente su estructura sin llegar a fundirla, es decir la conversión de sulfuros en sulfatos solubles La tostación permita: Liberar el oro submicroscopico contenido en los sulfuros. Eliminare el arsénico y en menos grado el antimonio que interfieren en la cianuración. Oxidar ciertos sulfuros como la pirrotina que es soluble en soluciones cianuradas. Destruir los reactivos orgánicos de la flotación previa. Destruir las materias carboníferas que fijan el oro cianurado. Para este caso se tiene: a.- TOSTACIÓN SIMPLE: Es la descomposición final en sus elementos y el producto final queda al estado sólido, puesto que no existe fusión ni volatilización. La descomposición que origina esta tostación simple es siempre endotérmica. Descomposición de los carbonatos metálicos MCO3 + calor. MO + CO2. Descomposición de sulfatos metálicos MSO4 + calor. MO + SO2 gas. Descomposición de los óxidos MO2 + calor. M3O4 + O2 gas. 33.
(34) Descomposición de sulfuros dobles 2M S2 + calor. 2MS + S2 gas. Al efectuar el calentamiento de la mena sometida a una tostación simple se observa lo siguiente: Al subir la temperatura se da la perdida de la humedad de la carga por la débil tensión de vapor del agua contenida en un material poroso. La eliminación del agua termina cuando comienza la disociación de los hidróxidos es decir a los 550 °C. La disociación de los carbonatos y sulfatos tienen lugar desde los 200 a los 700 °C. b.- Tostación Oxidante: La tostación oxidante requiere de un oxidante para que se realice el calentamiento de la carga en este caso se pueden usar: El oxígeno del aire. Óxidos metálicos. Sales que al descomponerse dan el oxígeno necesario. Para que la oxidación se realice uniformemente es preciso la existencia de una gran cantidad de aire, en contacto con la materia a oxidar. La necesidad de esto se debe a que el poder oxidante del aire disminuye cunado se mezcla con los productos gaseosos de la oxidación. La tostación oxidante siempre da como resultado los óxidos metálicos con mayores contenidos en oxígeno, así el Hierro y el Manganeso dan, Fe3O4, Mn3O4, pero nunca el FeO y el MnO. 34.
(35) 1.6.2. PROCESOS DE ALTA PRESIÓN: La oxidación a presión se ha convertido en la mejor alternativa para la oxidación de los minerales refractarios, con muchas ventajas con relación al proceso de tostación. Tanto las menas como los concentrados pueden procesarse por oxidación a presión sin causar contaminación del medio ambiente debido a las emisiones de gases, como SO2 y arsénico. La oxidación a presión se lleva a cabo a temperaturas entre 170 y 225 °C, presiones totales de 1.100-3.200 kPa y presión parcial de oxígeno de 350-700 kPa, alcanzando la oxidación completa de los sulfuros y la liberación del oro y la plata en 1-3 h. Comparado con el de tostación, el procedimiento de oxidación a presión tiene, como pre tratamiento a la cianuración, las siguientes ventajas: Elevados porcentajes de extracción de oro en los concentrados oxidados. Altas recuperaciones de oro en los minerales o concentrados; es selectivo con respecto a impurezas tales como antimonio, arsénico, plomo y mercurio. Ofrece una gran facilidad de manejo y de tratamiento de las impurezas y, por tanto, menor impacto ambiental. Este procedimiento se puede llevar a cabo tanto en medio alcalino como en medio ácido; sin embargo, este último ha sido el más desarrollado para aplicaciones comerciales. En el proceso alcalino, los contenidos de azufre y arsénico se solubilizan completamente como sales de sulfatos de sodio y arseniatos, mientras el hierro se obtiene como un residuo de Fe203.. 35.
(36) Las ventajas de esta ruta son el empleo de menores temperaturas de oxidación y la aparición de menos problemas de corrosión en las autoclaves. Al parecer, el procedimiento no ha sido atractivo debido a los altos costos del reactivo empleado, el NaOH, y los problemas para. disponer. del. Na3AsO4,. un. subproducto. altamente. contaminante. La oxidación a presión en medio ácido es la ruta más empleada en el. tratamiento. de. minerales. refractarios.. Mediante. este. procedimiento se consigue la oxidación completa de FeS2 y FeAsS a sulfatos y arseniatos, con una mínima formación de Azufre elemental (4, 9 y 10). Este último elemento es indeseable, ya que incrementa el consumo de reactivos en la siguiente etapa de cianuración. Las principales reacciones que ocurren en la oxidación a presión en medio ácido son:. 2FeS2 + 7O2 + 2H2O. 2FeS04 + 2H2SO4. 4FeAsS + 1IO2 + 2H2O MS + 202. 4HASO2 + 4FeS04 MS04. Donde M = Pb, Fe, Zn, Ni, Co, etc. Para evitar la formación de azufre, se precisan temperaturas elevadas (180-190 °C). A continuación, se oxidan el ion ferroso y el ion arsénico trivalente. El consumo de ácido y las condiciones de trabajo promueven la hidrólisis y la precipitación del hierro y del arsénico como arseniatos y sulfatos férricos, hematites y jarosita.. 36.
(37) Para facilitar las operaciones siguientes, (neutralización de la pulpa, recuperación del oro y manejo de las colas o residuos) se prefieren los dos últimos compuestos citados. Sin embargo, la recuperación de plata por el procedimiento de oxidación a presión en medio ácido es muy baja. Con este método, la plata se libera inicialmente, aunque en las condiciones de trabajo imperantes, se asocia con la jarosita, formada por hidrólisis y precipitación del ion férrico. Por lo tanto, es necesario un tratamiento posterior (con cal) para liberar la plata de la jarosita. 1.6.3. PROCESO ARSENO: El proceso, ARSENO, es una variante del proceso NITROX, ya que se lleva a cabo a 5 atm de presión de O 2, a 80 °C durante 15 min. Con este método se genera predominantemente ácido nitroso: 2NO2(g) + H2O 3HNO2. HNO2 + HNO3. HNO3 + 2NO(g) + H2O. El breve tiempo de lixiviación de este procedimiento no permite la precipitación significativa de hierro, azufre, sulfatos y arsénico presentes, que permanecen en la solución, pudiéndose recuperar la plata, ya que la jarosita no precipita. Una variante del método ARSENO consiste en trabajar con altas temperaturas (> 180 °C) para resolver el problema de la formación de azufre, producido durante el proceso junto con la generación de arsenitas, cuya eliminación constituye un problema. En este proceso, ARSENO, se añade cal para eliminar todos los sulfatos y favorecer la precipitación de arseniatos férricos (6).. 37.
(38) 1.6.4. PROCESO NITROX: En el caso de los minerales refractarios de sulfuros (piritas y arsenopiritas) existe el procedimiento de, NITROX, emplea HNO3 para descomponer la pirita y la arsenopirita en sulfatos: FeS2 + 5HNO3. 1/2Fe(S04)3 + 1/2H2SO4 + 5NO(g) + 2H2O. El NO producido escapa en la fase gaseosa, reacciona con el oxígeno y produce NO2, soluble en agua, regenerándose el ácido nítrico. El proceso NITROX trabaja a 90 °C, a presión atmosférica, con tiempos de retención de 1 a 2 h, y recuperaciones superiores al 90 %. Además de la ventaja de trabajar en condiciones de presión atmosférica, durante la lixiviación con HNO3 el arsénico precipita como arseniato férrico y se consiguen recuperaciones de plata elevadas. Sin embargo, es preciso tratar los sulfuros del residuo oxidado y la reducción de nitratos de los efluentes, lo que añade cierto grado de complejidad y costos al proceso. 1.6.5. OXIDACIÓN BIOLÓGICA: Existe creciente interés en la aplicación de la biolixiviación al tratamiento de menas refractarias, ya que este procedimiento ofrece un cierto grado de selectividad en la oxidación de minerales arsenopiríticos - piríticos. Una característica de este método sobre otras tecnologías de pre tratamiento es que presenta diferentes velocidades de oxidación, entre las diferentes especies mineralógicas, o diferentes aspectos cristalográficos del mineral o minerales, lo que conduce a una. 38.
(39) liberación del metal de la matriz mineral sin que se requiera la Oxidación completa de la misma. La oxidación de los minerales sulfurosos se lleva a cabo mediante la acción de bacterias tales como la Thiobacillus ferrooxidans y la Thiobacillus thiooxidans, por combinación de dos mecanismos: 1) Un ataque directo microbiológico a la estructura atómica: 2FeS2 + 2H2O + 7O2 2FeSO2 + 1/2O2 + H2SO4. FeSO4 + 2H2SO4 Fe2 (SO4) 3 + H2O. 2) Un ataque indirecto por regeneración de Fe(II) a Fe(III). FeS2 + Fe2 (SO4) 3 2FeSO2 + 1/2O2 + H2SO4 2S + 3O2 + 2H2O. 3FeSO4 + 2S Fe2 (SO4) 3 + 1/2H2O 2H2SO4. Las bacterias precisan oxígeno y CO2 para su crecimiento y para poder oxidar los minerales. Se adaptan a valores de pH acusadamente ácidos (1 a 3) y su actividad es más eficiente a temperaturas comprendidas entre 30 y 40 °C. La lixiviación biológica es aplicable tanto a menas (biolixiviación en montones) como a concentrados (en tanques agitados). Sin embargo, este método tiene varias limitaciones: Requiere tiempos de retención muy prolongados (2-6 días), lo que lleva a altos consumos de energía para la agitación en tanques.. 39.
(40) La necesidad de eliminar el calor producido durante la oxidación (por las reacciones exotérmicas). 1.6.6. LIXIVIACIÓN CON TIOUREA: El uso de la tiourea CS(NH2) 2 como reactivo de extracción para el oro y la plata ha sido prometedor para ser utilizado en el procesamiento de minerales auríferos los resultados de laboratorio han demostrado que tiene varias ventajas sobre los procesos de cianuración, como, por ejemplo: No está restringida por la toxicidad asociada al cianuro. La cinética de disolución es dos veces más rápida que la cianuración. Los cianiciadas afectan parcialmente la acción lixiviante de la tiourea. Este reactivo ha sido probado en diferentes minerales con buenos resultados, por ejemplo, un mineral refractario ha sido sometido a un tratamiento en una autoclave, el producto de este proceso con 5,3 g/t de oro fue lixiviado con tiourea y las extracciones fueron tan altas como el 80 % en los primeros 15 minutos. La extracción de oro de concentrado de sulfuros con 115 g/t de oro ha dado una extracción de cerca de 65 % en 6 horas, probablemente la mayor desventaja del uso de la tiourea es su alto costo debido al elevado consumo y a la generación de un ambiente ácido. El consumo excesivo es generado por la degradación del ion férrico. Otros aspectos que favorecen la degradación del reactivo son la temperatura y la formación de complejos de otros metales. La tiourea en un ambiente acido forma especies catiónicas con el oro según: Au + 2CS(NH2) 2. Au(CS(NH2) 2) 2 + e. 40.
(41) La reacción es reversible en la presencia de un agente oxidante tal como el peróxido de hidrogeno con iones férricos, la tiourea se oxida en etapas sucesivas en un gran número de productos. La operación en la new England Antimony Mines (NEAM) en Australia utilizo el proceso de lixiviación con tiourea en campañas para tratar concentrados de oro con contenidos altos de antimonio. El concentrado de antimonio usualmente reporto en promedio un contenido de oro de 30 a 40 g/t y fue difícil de comercializar, pero en este caso los parámetros críticos fueron: El pH Potencial redox Concentración de tiourea 1.6.7. TRATAMIENTO DE MINERALES REFRACTARIOS DE ORO CONTENIENDO MINERALES CARBONACEOS: Estos minerales de oro a veces requieren pre tratamiento oxidantes previos a la lixiviación con cianuro. En los procesos de lixiviación de oro en pilas, cuya recuperación normal es del 80% al 90%, cuando se presenta el fenómeno Preg Robbing esta puede bajar entre 10% y 20%. El Preg Robbing del oro, ocurre cuando el metal lixiviado es adsorbido por el carbón orgánico presente en la roca. “Es importante realizar pruebas metalúrgicas de muestras auríferas carbonosas, vía test de cianuración, para cuantificar el impacto del Preg Robbing que puede ir de 1.2 a 6.8 kilogramos de oro por tonelada de carbón. Mejorar la comprensión de este fenómeno es esencial para el incremento de la recuperación del oro”, el comportamiento metalúrgico de los minerales carbonaceos que presentan el efecto. 41.
(42) Preg Robbing se determina al medir la capacidad de carga del oro, junto con la tasa de adsorción del carbón. Entre las tecnologías actuales para contrastar este fenómeno, se tiene: La tostación, que garantiza que el carbón se convierta en CO2. La oxidación a presión vía autoclaves, que es un trabajo a alta presión y temperaturas. La oxidación biológica, que es un procedimiento que demanda meses o años. También que el kerosene y el tiosulfato de amonio se presentan como una alternativa novedosa para minimizar el efecto Preg Robbing de los minerales carbonáceos. Por otro lado, se puede contar con una alternativa más de que las operaciones unitarias de tamizado a una abertura de malla definida y lavado con agua para retirar los finos de carbón, son también una opción más de pretratamiento. Los materiales carbonacios constan generalmente de los siguientes componentes: Hidrocarburo Acidos humicos Carbon activado elemental Sin embargo la naturaleza exacta de los componentes no esta bien establecidad y las variaciones en la actividad del carbon son grandes, como se puede esperar de un fenomeno de la superficie, en lugar del fenomeno de la solución. Las reducidas extracciones de oro también han sido atribuidas a la pirofilita, que absorbe oro y lutita, aunque la absorción en estos casos parece ser facilmente reversibles.. 42.
(43) Una evaluación técnica, económica y específica para cada tipo de mineral asociado al carbón podría determinar su uso a escala industrial en el futuro. 1.6.8. RECUPERACIÓN DE ORO DE MINERALES REFRACTARIOS, MEDIANTE CIANURACIÓN A BAJA PRESIÓN: El oxígeno disuelto en una solución, bajo condiciones normales, es capaz de oxidar algunos minerales sulfurosos. Esta oxidación se puede aplicar a un bajo costo, como por ejemplo en la pre aireación de minerales sulfurosos antes de la lixiviación por cianuración, oxidando y/o pasivando las superficies, evitando un consumo no productivo de reactivo. Naturalmente que este tipo de oxidación es, a menudo, capaz de oxidar solamente la superficie del mineral. La pirita, arsenopirita y calcopirita son relativamente estables en soluciones oxigenadas en un amplio rango de pH; la pirrotita y marcasita son menos estables y se oxidan a Fe(III) como hidróxidos encima de pH 2, aproximadamente:. 4Fe7S8 + 69 O2 + 74H2O. 28Fe (OH) 3 + 64H+ + 32 SO4 2- (1) 4Fe (OH) 3 + 16H+ + 8SO4 2- (2). 4FeS2 + 15 O2 + 14H2O. El ácido generado reacciona con la sal del metal alcalino disponible en la mena para precipitar yeso u otra especie de sulfato. Normalmente, la oxidación se realiza en el rango de pH 8-11, aunque el pH no parece ser crítico.. 43.
(44) La cinética del grado de oxidación depende de la transferencia de masa de oxígeno a la superficie del mineral, el cual es función, principalmente, de la concentración de oxígeno disuelto, grado de mezcla y temperatura. La concentración. de. oxígeno. disuelto se. puede. aumentar,. aumentando la presión parcial del oxígeno en el gas usado; por ejemplo, el uso de oxígeno puro aumenta la presión parcial del oxígeno por un factor de 5, aproximadamente. La temperatura creciente disminuye la solubilidad de oxígeno, pero aumenta la solubilidad del mineral sulfuroso; por ello, normalmente, no se justifican económicamente las temperaturas elevadas para la pre-aireación, salvo procesos de desinfección con cloro para acelerar la cinética. El grado de agitación también puede ser importante, mejorando el transporte de la masa de oxígeno a través de la interfaz gaslíquido. Entre las ventajas de la oxidación a baja presión, o "pre aireación", se puede indicar que: es un proceso económico y ambientalmente compatible; aunque las desventajas hacen que su aplicación sea bastante limitada ya que solo puede oxidar la superficie del mineral y se puede aplicar solo con minerales semi refractarios.. 44.
(45) 1.6.9. PROCESO ALBIÓN: El Proceso Albión es una combinación de molienda fina y lixiviación oxidativa a presión atmosférica. La alimentación del Proceso Albión es un concentrado que contiene metales base o metales preciosos. El Proceso Albión se utiliza para oxidar los minerales sulfurados en el concentrado y así liberar estos. metales. para. recuperarlos. a. través. de. medios. convencionales. La tecnología del Proceso Albión fue desarrollada en 1994 por Glencore PLC y está patentada a nivel mundial.. Actualmente existen tres plantas de Proceso Albión en operación. Dos plantas tratan un concentrado de sulfuro de zinc y están ubicadas en España y en Alemania. Una tercera planta de Proceso Albión está operando en República Dominicana y trata un concentrado refractario de oro/plata.. XT está actualmente completando el diseño y suministro de una planta de Proceso Albión para el proyecto de oro GPM en Armenia. Este proyecto ha comenzado la etapa de adquisiciones, con avanzadas obras civiles en el terreno.. 45.
(46) CAPITULO II FUNDAMENTO TEORICO. 2.1. TEORIAS DE VARIOS AUTORES Muchos minerales auríferos son problemáticos puesto que contienen sulfuros metálicos, tales como pirita, arsenopirita y chalcopirita. Con frecuencia estos minerales son refractarios, puesto que el oro esta encapsulado en la matriz de sulfuro. Con el fin de recuperar el oro, la matriz que lo contiene debe ser destruida. En los pasados 100 años, la tostación y la fusión han sido los métodos dominantes para oxidar los minerales sulfurados y/o concentrados que contiene oro. Sin embargo, con el costo asociado al tratamiento del gas SO2 y el incremento relacionado con las emisiones, muchos centros. mineros. auríferos. han. considerado. otras. opciones. tecnológicas, tales como la lixiviación bacteriana y la oxidación a 46.
(47) presión para el tratamiento de minerales que contienen sulfuros. Durante la oxidación a presión de los sulfuros metálicos, el componente sulfuro puede ser parcialmente oxidado, formando azufre como producto, o completamente oxidado, formando sulfato como producto. La oxidación parcial de los sulfuros metálicos tiene la ventaja de realizarse a bajas temperaturas y presiones, lo que conduce a menores costos de capital (Anderson y Nordwick, 1996; Anderson, 2001). El más grande problema con la oxidación parcial de los sulfuros metálicos es que el azufre que queda en el residuo no puede ser tratado rápidamente empleando la cianuración, lo que hace difícil la extracción de oro. Recientemente se ha demostrado que cuando se disuelve el azufre elemental en soluciones alcalinas, la solución formada es capaz de lixiviar el oro. El álcali empleado en estos estudios es tanto el hidróxido de calcio (así denominada solución sintética azufre-LSSS) o el hidróxido de sodio (Zhang y col., 1992ª; Zhang y col., 1992b; Anderson y Nordwick, 1996; Chen y col., 1996; Fang y Han, 2002). Un beneficio de este proceso es que durante la oxidación parcial de los sulfuros metalicos, el oro tiende a acumularse en el azufre elemental (Fair y Van Weert, 1989; Barth y col., 1998). Puesto que el azufre puede ser fácilmente separado de la ganga, esto proporciona una forma simple de tener una muestra de concentrado de oro antes de la lixiviación. También se ha encontrado que el oro puede ser selectivamente extraído a partir de soluciones complejas sulfuro alcalino, conteniendo una mezcla de metales tales como el arsénico, estaño, mercurio y antimonio. Estos estudios muestran que casi el 100% del oro puede ser selectivamente extraído empleando materiales solidos baratos para la absorción del oro (Anderson y Nordwick, 1996). Finalmente, las soluciones sulfuro alcalinas que son pobres en oro, pueden se recicladas para las posteriores lixiviaciones del oro o posteriormente procesadas con una oxidación a baja. 47.
(48) temperatura para formar a baja temperatura sulfato de sodio, Na2SO4. Esto se ha realizado en la industria. El resultante sulfato de sodio es posteriormente tratado por purificación y cristalización para producir sulfato de sodio de alta ley comerciable. El sulfato de sodio es entonces vendido y utilizado en las industrias tales como la de pulpa y papel, vidrio, cerámicos, detergentes, suplementos alimenticios minerales, tintes textiles y lejías.. 2.2. TEORIA DE LA LIXIVIACIÓN 2.2.1. LIXIVIACIÓN DEL ANTIMONIO: A pesar de existir poca investigación fundamental sobre la lixiviación de oro en un sistema sulfuro alcalina, hay cierto conocimiento de la química involucrada en un sistema similar que puede ser usado para extraer metales tales como antimonio, arsénico, mercurio y estaño. En la práctica industrial, los métodos hidrometalúrgicos sulfuro alcalinos son en la actualidad empleados para la producción de antimonio. La extracción de antimonio normalmente comprende un proceso en dos etapas, lixiviación seguida por una electrodeposición. Esencialmente, el lixiviante es una mezcla de sulfuro de sodio y de hidróxido de sodio y cuando se aplica a la estibnita, se forma una solución de tioantimonito. Este se puede representar por: Sb2S3 + S-2. 2 SbS2-. (1). SbS2- + S-2. SbS3-3. (2). La disolución de azufre elemental en NaOH también se puede emplear como agente lixiviante en la lixiviación sulfuro alcalina del antimonio (Anderson y Krys, 1993). La combinación de NaOH y S elemental. da. como. resultado. 48. la. formación. de. especies.
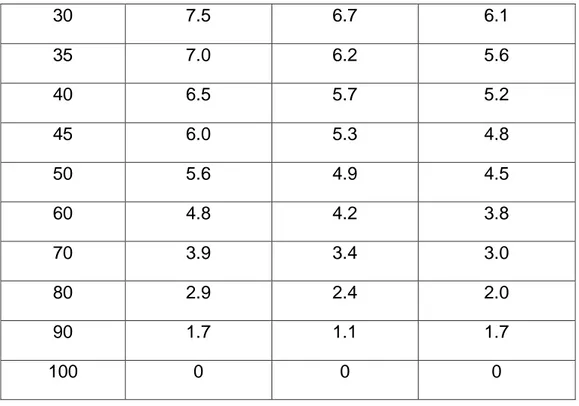
(49) metaestables diferentes al ion S-2. Tanto el polisulfuro (SX-2) como el tiosulfato (S2O3-2), se forman conjuntamente con el sulfuro. Esto se puede ilustrar de forma sencilla de acuerdo a: 2 S-2 + S2O3-2 + 3 H2O. 4 S + 6 OH(x -1)S + S-2. (3). SX-2 (x = 2 a 5). (4). Debido a la capacidad oxidante del ion polisulfuro, la mayor especie en solución normalmente es el tioantimonito de sodio (Na3SbS4). Esto se puede representar de la manera siguiente: SX-2 + (x – 1)SbS3-3. (x – 1) SbS4-3 + S-2. (5). Por lo general se adiciona el NaOH para impedir la hidrolisis del ion sulfuro:. El. OH-. S-2 + H2O. HS- + OH. (6). HS- + H2O. H2S + OH-. (7). también. puede. disolver. la. Sb2S3,. produciendo. oxotioantimonitos y tioantimonitos alcalinos: Sb2S3 + 2 OH-. SbOS- + SbS2- + H2O. (8). El efecto beneficioso del pretratamiento con NaOH es atribuido a la descomposición de las fases antimoniales, tales como la andorita, estibnita y zinkenita presentes en el mineral. Tomando como base el diagrama E-pH (Fig. N°5) para el antimonio, la descomposición de estas fases por el hidróxido desprenderá antimonio en forma de las especies tales como SbO2- , Sb(OH)4-, Sb(OH)6-, SbOS-, SbS2(Baláž, 2000; Anon, 2005). Smincáková (2009) que la estibnita se disuelve se disuelve como las especies SbOS− y SbS2− durante la lixiviación con NaOH, de acuerdo con la ecuación:. 49.
(50) Sb2S3 + 6 OHSb(OH)3 + OHSb2S3 + 6 OH-. 2 Sb(OH)3 + 3 S-2 Sb(OH)4Sb2O5 + 3H2S + ½ O2. (9) (10) (11). Fig. N° 5: Diagrama E-pH para el sistema Sb-S-O-H a 70°C, [Sb] = 1.27 x10-4 2.2.2. LIXIVIACIÓN DEL ORO CON POLISULFUROS: En la lixiviación del oro con soluciones sulfuro alcalinos, se requiere tanto de un agente lixiviante acomplejante, el ion S-2, como oxidantes efectivos, los polisulfuros SX-2. Es bien conocido que el azufre se descompone en soluciones causticas, formando aniones sulfuros, polisulfuros y oxisulfuros tales como el tiosulfato. Una estequiometria simple para estas reacciones se presenta en las Ecs. (3) y (4) (Anderson, 2001). Este método se ha empleado para disolver el oro que está asociado con. 50.
(51) el azufre elemental después de una oxidación parcial de los minerales sulfurados. Tato el ion S-2 como el ion S2O3-2 forma complejos fuertes con el oro, tal como se muestra en las Ecs. (12) y (13), en las cuales también se presentan las constantes de estabilidad (Hiskey y Atluri, 1986). Au+ + S-2. AuS-. Au+ + 2 S2O3-2. β = 2 x 1036 Au(S2O3)2-. (12). β = 1026. (13). Como se puede observar en la Fig. N° 2 siguiente, el oro es soluble en un sistema sulfuro alcalino. La lixiviación de oro es el resultado de la lixiviación por polisulfuros y sulfuros como se presenta en la Ec. (14): 2 Au + S2-2. 2 AuS-. (14). La Fig. N° 6 siguiente muestra el diagrama E-pH para el caso de la lixiviación sulfuro alcalino de oro. Se puede observar en el diagrama que se forman dos especies de sulfuro de oro, Au(HS)2y AuS-. También se presenta el estado de oxidación (+1) para el Au, producto de la acción oxidante de los polisulfuros SX-2.. El oro lixiviado en un sistema sulfuro alcalino es rápidamente recuperable. por. muchos. métodos,. los. que. incluyen. electrodeposición, precipitación gaseosa, precipitación química, cementación, extracción por solventes e intercambio iónico. Los métodos convencionales de recuperación de oro, tales como la cementación con zinc y con aluminio, no son aplicables a este tipo de solución debido a los peligros asociados con la generación de gas estibina. Asimismo, el método convencional de colección de oro mediante el carbón activado no se aplica para estas soluciones, como si se hace para las soluciones de cianuro.. 51.
(52) Fig 6: Especies en equilibrio en el diagrama E-pH para el azufre y el sulfuro alcalino de oro Estando el oro disuelto como los complejos Au(HS)2- y AuS-, al aplicar el ion CN- durante la cianuración, se tiene la reacción: Au(HS)2- + 2 CNΔG°. Au(CN)2 - + 2 HS-. -2.655 KJ/mol. (15). Este valor de energía libre de Gibbs indica que esta reacción se produce espontáneamente, lo que indica que el complejo Au(CN)2se produce al romper el complejo Au(HS)2- mediante el ion CN-. Esto se puede apreciar en la Fig. N° 7, que presenta el diagrama EpH del sistema Au-CN-S-2 a 70°C; se aprecia el campo de estabilidad del complejo Au(HS)2- y la del complejo Au(CN)2-. Como se puede deducir a partir de este diagrama el complejo 52.
(53) Au(HS)2-, solo es estable en el rango de pH 7.5 a 8.5; cuando el pH se incrementa a 10.5 el complejo estable es el Au(CN)2-.. Fig 7: Diagrama E-pH para el sistema Au-CN-S-2 a 70°C. 53.
(54) CAPITULO III DESARROLLO EXPERIMENTAL. 3. 1. INTRODUCCIÓN Los minerales auríferos en, primera instancia, se pueden clasificar en minerales dóciles y minerales refractarios, tomando como referencia su respuesta metalúrgica a la lixiviación con cianuro. Mientras que se obtienen altas recuperaciones de oro, mayores al 09%, con minerales dóciles, con frecuencia los minerales refractarios dan extracciones más bajas, menores al 80%, con el proceso de cianuración convencional. En primer lugar, la refractariedad de los minerales auríferos puede ser el resultado de las características mineralógicas propias del mineral; tales como oro encapsulado en pirita/arsenopirita, oro en teluros o antimoniuros o en mineralogía de ganga reactiva como en los constituyentes carbonaceos preg-robbing. Por consiguiente, se requiere el pretratamiento de minerales/ concentrados refractarios antes de la cianuración, con el fin de poder. 54.
Figure



Documento similar
E Clamades andaua sienpre sobre el caua- 11o de madera, y en poco tienpo fue tan lexos, que el no sabia en donde estaña; pero el tomo muy gran esfuergo en si, y pensó yendo assi
Habiendo organizado un movimiento revolucionario en Valencia a principios de 1929 y persistido en las reuniones conspirativo-constitucionalistas desde entonces —cierto que a aquellas
Por lo tanto, en base a su perfil de eficacia y seguridad, ofatumumab debe considerarse una alternativa de tratamiento para pacientes con EMRR o EMSP con enfermedad activa
o Si dispone en su establecimiento de alguna silla de ruedas Jazz S50 o 708D cuyo nº de serie figura en el anexo 1 de esta nota informativa, consulte la nota de aviso de la
Proporcione esta nota de seguridad y las copias de la versión para pacientes junto con el documento Preguntas frecuentes sobre contraindicaciones y
[r]
El concepto de soberanía, teóricamente independizado de los problemas de fundamen- tación política, sirvió en la teoría jurídica como instrumento adecuado para explicar el derecho
Las manifestaciones musicales y su organización institucional a lo largo de los siglos XVI al XVIII son aspectos poco conocidos de la cultura alicantina. Analizar el alcance y

![Fig. N° 5: Diagrama E-pH para el sistema Sb-S-O-H a 70°C, [Sb] = 1.27 x10 -4](https://thumb-us.123doks.com/thumbv2/123dok_es/7433152.474980/50.893.157.795.225.761/fig-n-diagrama-e-para-sistema-sb-sb.webp)