Implementación de una base de datos de licitaciones para mejorar los tiempos de acceso a la información
Texto completo
(2) Dedicatoria. Dedicado a mis padres, que lo han dado todo por mí y por nuestra familia. Dedicado a ellos porque son lo más importante en mi vida y sin su apoyo, guía y consejos, no sería quien soy ahora. Por estar presentes en los momentos difíciles y no permitir que me rindiera jamás y por creer en mi en momentos donde ni siquiera yo lo hacía. Espero hacerlos sentir orgullosos, tanto como yo estoy de ustedes; les agradezco infinitamente todo lo que han hecho por mí, por las noches de desvelo, por las tristezas y las alegrías que juntos hemos vivido. De hoy y en adelante, el cielo es el límite. Los amo con todo mi corazón..
(3) Agradecimientos. Me gustaría agradecer a todas aquellas personas que me han acompañado a lo largo de mi vida y en todo este proceso, para llegar al día de hoy. Quiero comenzar agradeciendo a mis padres, ya que han sido el pilar fundamental en todo este proceso, tolerando y comprendiendo todos mis momentos de estrés y cansancio que muchas veces provocaron perderme más de algún compromiso familiar. Gracias por jamás dejarme caer y por creer en mí en momentos en los que ni yo misma lo hacía. A mi Maxito, mi primer perrito, que, aunque sé que jamás leerá esto, es una parte muy importante en mi vida, por su compañía, por sus “gracias” para alegrarme cada vez que sentía que algo andaba mal, por dejarme sus innumerables marcas (pedazos menos) en cuadernos y guías mientras me acompañaba a estudiar, por simplemente ser él y estar conmigo en todo momento. Gracias al resto de mi familia, que siempre estaba presente, con su apoyo y palabras de aliento cuando las cosas se ponían difíciles. Gracias a mi entrenadora y lindos compañeros de la Selección de Gimnasia Aeróbica de la UC, que con todos los entrenamientos, disciplina y dedicación lograban distraerme de cualquier momento difícil que pudiera estar pasando, por enseñarme a trabajar en equipo y creer en misma, superándome día a día. A mis amigos de la universidad por compartir tantos momentos de risas, estrés y sobre todo de estudio, por apoyarnos y complementarnos siempre para lograr finalizar de la mejor manera. A las lindas amigas que formé durante la realización de esta profundización, Mis Monis Ori y Marce, que se han convertido en personitas muy importantes en mi vida y que las quiero con el alma..
(4) También quiero agradecer a Seven Pharma S.p.A, y mi director Roberto Contreras, por confiar en mí y permitirme realizar mi profundización con ellos. Por todos los conocimientos entregados y por la oportunidad de desarrollarme en un área hasta entonces desconocida. Gracias a mi profesor y codirector Esteban Castillo por su apoyo incondicional brindado en todo el proceso, por la paciencia y consejos brindados para poder llevar a cabo este trabajo y finalizar con esta gran y desafiante etapa..
(5) Abreviaturas. ISP. : Instituto de Salud Pública.. CENABAST. : Central de Abastecimiento del Sistema Nacional de Servicios de Salud.. MINSAL. : Ministerio de Salud.. S.N.S. : Servicio Nacional de Salud.. S.N.S.S. : Sistema Nacional de Servicios de Salud.. ANMAT. : Administración Nacional de Madicamentos, Alimentos y Tecnología Médica (Argentina).. CECMED. : Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos (Cuba).. COFEPRIS. : Comisión Federal para la Protección contra Riesgos Sanitarios (México).. EMA. : Agencia Europea de Medicamentos (European Medicines Agency).. FDA. : Administración de Alimentos y Medicamentos de Estados Unidos (Food and Drug Administration).. INVIMA. : Instituto Nacional de Vigilancia de Medicamentos y Alimentos.. OMS. : Organización Mundial de la Salud.. BPM/GMP. : Buenas Prácticas de Manufactura (Good Manufacturing Practice).. CPP. : Certificado de Producto Farmacéutico (Certificate of Pharmaceutical Product).. VIH. : Virus de la Inmunodeficiencia Humana.. POE/SOP. : Procedimiento Operativo Estándar (Standard Operating Procedure)..
(6) Índice General. Resumen ........................................................................................................v Abstract ......................................................................................................... vii Capítulo I Estado del arte y Definición del problema ...................................... 1 Dirección de compras y Contratación pública (ChileCompra) ..................... 4 Central de Abastecimiento del Sistema Nacional de Servicios de Salud (CENABAST) ............................................................................................... 8 Bases administrativas ............................................................................ 13 Bases técnicas ....................................................................................... 13 Bases económicas ................................................................................. 15 Seven Pharma Chile S.p.A ........................................................................ 15 Capítulo II Objetivos General y Específico ................................................... 20 Objetivo General ........................................................................................ 21 Objetivos Específicos ................................................................................ 21 Capítulo III Plan de trabajo, resultados y análisis crítico .............................. 22 Objetivo Específico N°1: Analizar el estado actual de Seven Pharma Chile S.p.A .......................................................................................................... 23 Objetivo Específico N°2: Revisar y tabular los requisitos técnicosregulatorios exigidos por las bases de licitación de CENABAST y de Establecimientos de salud de la Región Metropolitana ............................ 30 Objetivo Específico N°3: Verificar cumplimiento Técnico-Regulatorio de lo establecido en las bases de licitación para los productos de Seven Pharma Chile S.p.A ................................................................................................. 36 Objetivo Específico N°4: Crear un sistema de base de datos con los antecedentes técnico-regulatorios, que darán soporte al área de licitaciones para la presentación de ofertas .............................................. 41 Objetivo Específico N°5: Comparar los tiempos en acceso a la información antes de la base de datos y después de la implementación de ésta ......... 61. i.
(7) Capítulo IV Análisis Crítico Global ............................................................... 68 Capítulo V Contextualización de los resultados en el marco de los objetivos de la empresa .............................................................................................. 72 Capítulo VI Conclusiones y sugerencias ...................................................... 74 Capítulo VII Bibliografía ............................................................................... 77 Capítulo VIII Anexos .................................................................................... 81 Anexo 1 Total de productos registrados por Seven Pharma S.p.A a la fecha de búsqueda, obtenidos desde el ISP ....................................................... 82 Anexo 2 Documentos requeridos en las licitaciones por distintas entidades públicas ..................................................................................................... 85 Anexo 3 Clasificación del total de productos registrados por Seven Pharma S.p.A según línea terapéutica .................................................................... 89 Anexo 4 Contenido de cada fila para Línea VIH ........................................ 92 Anexo 5 Contenido de cada columna para Línea VIH .............................. 92 Anexo 6 Contenido de cada fila para Línea Oncológica ........................... 95 Anexo 7 Contenido de cada columna para Línea Oncológica .................. 96 Anexo 8 Contenido de cada fila para Otras Líneas ................................... 99 Anexo 9 Contenido de cada columna para Otras Líneas ........................ 100 Anexo 10 Diferencia de tiempo empleado con y sin el uso de la base de datos ....................................................................................................... 103. ii.
(8) Índice de Tablas. Tabla N°1 Antecedentes necesarios para sometimiento de registro simplificado ................................................................................................... 23 Tabla N°2 Ejemplo de los productos registrados por Seven Pharma S.p.A a la fecha de búsqueda, obtenidos desde el ISP ................................................ 28 Tabla N°3 Porcentaje de frecuencia con que un documento es solicitado respecto del total y si se adjunta o no documentación base a ser completada ...................................................................................................................... 31 Tabla N°4 Puntajes obtenidos en las actas de evaluación de licitaciones en las que Seven Pharma S.p.A había participado ........................................... 37 Tabla N°5 Documentos a incorporar en la base de datos según naturaleza del documento (Administrativo, Técnico, Económico) .................................. 42 Tabla N°6 Documentación de respaldo a los anexos de licitación según la naturaleza del documento ............................................................................ 43 Tabla N°7 Clasificación de productos registrados por Seven Pharma S.p.A según línea terapéutica ................................................................................ 45 Tabla N°8 Tiempo empleado en una postulación sin el uso de base de datos ...................................................................................................................... 62 Tabla N°9 Tiempo empleado en una postulación con el uso de base de datos ...................................................................................................................... 65. iii.
(9) Índice Figuras. Figura 1: Volumen de operaciones de CENABAST en los últimos 4 años . 10 Figura 2: Monto y porcentaje de compra de CENABAST en Mercado Público ...................................................................................................................... 11 Figura 3: Monto y porcentaje de compra de CENABAST en mercado público, dentro del Sector de Salud ........................................................................... 11 Figura 4 Participación de CENABAST en Mercado Público de medicamentos los últimos 4 años ......................................................................................... 12 Figura 5: Proceso por etapas, para la obtención de la aprobación de un registro sanitario ........................................................................................... 25 Figura 6: Sistema de consulta de productos registrados ............................. 27 Figura 7: Porcentaje de frecuencia con que un documento es solicitado respecto del total y porcentaje en que se adjunta o no documentación base a ser completada ............................................................................................. 32 Figura 8 Cantidad y porcentaje de productos por cada línea de clasificación de productos ................................................................................................. 46 Figura 9 Cantidad de documentación y su distribución en porcentaje según tipo de documentación para la Línea VIH ..................................................... 54 Figura 10 Cantidad de documentación y su distribución en porcentaje según tipo de documentación para la Línea Oncológica ......................................... 55 Figura 11 Cantidad de documentación y su distribución en porcentaje según tipo de documentación para Otras Líneas .................................................... 56 Figura 12: Porcentaje y tiempo de diferencia en las simulaciones respecto del uso de base de datos ............................................................................. 66. iv.
(10) Resumen. La industria farmacéutica es un sector empresarial de rápidos cambios y un importante elemento dentro de los sistemas de asistencia sanitaria de todo el mundo.[1] En Chile, el Instituto de Salud Pública es la autoridad sanitaria encargada del control sanitario de los productos farmacéuticos [2]. Debido a los cambios en el sector de salud en Chile y al incremento continuo en la demanda de los medicamentos, se hace necesario un sistema eficiente de contratación pública para asegurar un acceso adecuado a ellos; es por esa razón, que las instituciones acuden a las licitaciones públicas. Gracias a la creación de la Ley 19.886 se norman los procesos de compra con el fin de mejorar la transparencia y eficiencia, conservando la igualdad de competencia y produciendo un ahorro significativo para el Estado. Seven Pharma Chile S.p.A., es una droguería de productos farmacéuticos dedicada a la importación y distribución de productos farmacéuticos en nuestro país, mediante el ingreso de registros similares de productos. Sus ventas se realizan principalmente a través de licitaciones públicas de establecimientos de salud, con foco en licitaciones de la Central de Abastecimiento del Sistema Nacional de Servicios de Salud (CENABAST), todas regidas según la ley 19.886. La principal problemática para ellos se basa en la dificultad de acceso óptimo y eficiente a la información técnico-regulatoria teniendo que emplear mucho tiempo en la postulación a licitaciones públicas. En una primera instancia, se realiza un análisis de la documentación regulatoria necesaria para la obtención de registros sanitarios y una búsqueda en la página del ISP para obtener un listado de los registros sanitarios de Seven Pharma S.p.A., consiguiendo 50 registros activos. Posterior a ello, se efectúa un análisis de las bases de licitación de CENABAST y otros. v.
(11) establecimientos de salud con el fin de determinar la documentación solicitada en ellas, dividiéndolas por área administrativa, técnica y económica. Se evalúa también, a través de una búsqueda en el portal de Mercado Público el desempeño que ha tenido Seven Pharma S.p.A., en relación con la documentación regulatoria adjunta en las postulaciones, a través de una búsqueda de las evaluaciones y reparos realizados a la compañía en las licitaciones en las que había participado obteniendo un puntaje disminuido en el área técnica lo que corrobora el impacto que ha tenido la falta de acceso a la información. Una vez efectuado todo lo anterior, se realiza la creación de una base de datos que entregue la documentación adecuada para la postulación a licitaciones públicas, incorporando en ella un total de 2.780 documentos. El impacto que produjo la base de datos de evaluó mediante la comparación del tiempo empleado en la postulación a licitaciones, a través de simulaciones de postulación, con y sin el uso de la base de datos obteniendo como resultado una reducción promedio del 78% del tiempo empleado en ellas.. vi.
(12) Abstract. The pharmaceutical industry is a fast-growing business sector and an important element in healthcare systems around the world. [1] In Chile, the Public Health Institute is the health authority responsible for the sanitary control of pharmaceutical products [2]. Due to changes in the health sector in Chile and the continual growth in the demand for drugs, an efficient public procurement system is necessary to ensure adequate access to them; It is for that reason that the companies participate in public tenders. By creating of Law N°19,886, the purchasing processes are regulated in order to improve transparency and efficiency, ensuring equal competition and producing significant savings for the State. Seven Pharma Chile S.p.A., is a drugstore dedicated to the importation and distribution of pharmaceutical products in our country, through the application of health registration of similar products. Its sales are mainly made through public tenders of health establishments, focusing on CENABAST tenders, all governed by law N° 19,886. The main problem for the company is based on the difficulty of optimal and efficient access to technical-regulatory information, spending a lot of time in the application for public tenders. In the first instance, an analysis of regulatory documentation required for obtaining health registrations and a search on the ISP webpage is performed to get a list of the licenses of Seven Pharma S.p.A., obtaining 50 active licenses. Subsequently, an analysis of tender regulations of CENABAST and other health establishments is carried out in order to determine the requested documentation, classifying it by administrative, technical and economic documentation area. The performance of Seven Pharma S.p.A., in relation to the regulatory documentation enclosed in the applications is evaluated through a search on Public Market webpage, by searching of the evaluation terms and objections made to the company in the tenders in which the company had vii.
(13) participated, obtaining a decreased score in the technical documentation area, that corroborates the impact that the lack of access to information has had. Once all the above has been done, a database that provides the appropriate documentation for the application for public tenders is created, incorporating a total of 2,780 documents. The impact produced by the database was evaluated by comparing the time spent in the applications to tender, through simulations to tender applications, with and without the use of the database, resulting in an average reduction of 78% of the time employed in it.. viii.
(14) Capítulo I.. Estado del Arte y Definición del problema. 1.
(15) La industria farmacéutica es un sector empresarial y un importante elemento dentro de los sistemas de asistencia sanitaria de todo el mundo. Está constituida por numerosas organizaciones públicas y privadas dedicadas al descubrimiento, desarrollo, fabricación y comercialización de medicamentos para la salud humana y animal, para el tratamiento y prevención de diversas enfermedades y alteraciones. [1] En Chile, el Instituto de Salud Pública (ISP) es la autoridad sanitaria encargada en todo el territorio nacional del control sanitario de los productos farmacéuticos y de velar por el cumplimiento de las disposiciones que se contienen en el reglamento, en el Código Sanitario, en su reglamentación complementaria y en las demás normas legales sobre la materia. Le corresponde ejercer las acciones de control de la calidad de los productos farmacéuticos a través de acciones inspectivas (en establecimientos fabricantes, importadores, acondicionadores, distribuidores y asistenciales), autorización de instalación y funcionamiento de laboratorios farmacéuticos, evaluando el registro de productos farmacéuticos, entre otras acciones sujetas a estas modalidades de control. [2]. Debido a los cambios en el sector de salud en Chile y al constante incremento en la demanda de medicamentos, se hace necesario un sistema eficiente y competitivo de contratación pública que involucre recursos administrativos, técnicos y financieros.. Debido a lo anterior, el día 29 de agosto de 2003 entró en vigencia la Ley de Bases sobre Contratos Administrativos de Suministro y Prestación de Servicios (Ley N° 19.886), más conocida como Ley de Compras Públicas, con el objetivo de uniformar los procedimientos administrativos de contratación de suministro de bienes y servicios, necesarios para el funcionamiento de la Administración Pública. [3]. 2.
(16) El reglamento se redactó con la participación de todos los actores involucrados en los procesos de contratación del Estado y se encuentra en vigencia a partir del 24 de octubre de 2004. Esta ley vela por la transparencia y la eficiencia de las compras, preservar la igualdad de la competencia y considerar el debido proceso contemplando la creación de nuevas instituciones tales como: [3] •. Dirección de Compras y Contratación Pública. •. Tribunal de Contratación Pública. •. Sistema. Electrónico. de. Compras. y. Contratación. Pública,. www.chilecompra.cl Todo lo anterior con el fin de conseguir una máxima transparencia y eficiencia en el mercado de las compras públicas, produciendo un ahorro significativo para el Estado al aumentar la eficiencia, productividad y rapidez de los procesos de compra de los servicios públicos por medio de la digitalización de los procesos de compras de los organismos públicos con su correspondiente impacto en el comercio electrónico y posicionamiento internacional del país, mejorando las oportunidades de negocios para las empresas y personas naturales. [4]. 3.
(17) Dirección de Compras y Contratación Pública (ChileCompra). Es una institución que administra el sistema de compras públicas de Chile, que funciona con un marco regulatorio único, que se basa en la transparencia, la eficiencia, la universalidad, la accesibilidad y la no discriminación. Es un servicio público descentralizado, que depende del Ministerio de Hacienda, y está sometido a la supervigilancia del presidente de la República. Administra y desarrolla las siguientes plataformas: [5] •. www.mercadopublico.cl:. Plataforma. de. licitaciones,. donde. los. organismos realizan sus compras y los proveedores ofrecer sus productos y servicios al estado. [5] •. www.chileproveedores.cl: Donde se realiza el registro oficial de proveedores en Chilecompras, así las empresas pueden mantener su información acreditada y digitalizada. [5]. •. www.analiza.cl: Plataforma de inteligencia de negocios de Chilecompra, donde la ciudadanía y las empresas pueden estudiar el mercado y las oportunidades de negocio con el Estado. [5]. •. www.comprassustentables.cl: sitio que informa sobre la política de compras públicas sustentables del estado, como se puede ser un proveedor sustentable y como se incorporan estos criterios en las adquisiciones del estado. [5]. A través del mercado público se transan más de 13.000 millones de dólares anuales, lo que lo lleva a ser una importante plataforma de comercio electrónico de nuestro país. [6] Para continuar profundizando en el tema, es importante definir los siguientes conceptos: [7] Entidad Licitante: Cualquier organismo regido por la Ley de compras, que llama a un proceso de compras.. 4.
(18) Proveedor: Persona natural o jurídica, que puede proporcionar bienes y/o servicios a las Entidades Licitantes. Oferente: Proveedor que participa en un proceso de compras, presentando una oferta. Formulario/Anexos: Documentos que deberán ser completados por las entidades interesadas en efectuar un proceso de compras, a través del sistema de información y de otros medios para la contratación. Bases de licitación: Documentos aprobados que contienen el conjunto de requisitos, condiciones y especificaciones, establecidos por la Entidad Licitante que describen el bien/servicio a contratar y todos sus costos asociados, presentes y futuros; regulan el Proceso de Compras y el contrato definitivo. Incluye las Bases Administrativas y Bases Técnicas. Bases administrativas: Documentos aprobados por la autoridad competente que contienen, las etapas, plazos, mecanismos de adjudicación, modalidades de evaluación, cláusulas del contrato definitivo, y demás aspectos administrativos del proceso de compras. Bases Técnicas: Documentos aprobados por la autoridad competente que contienen. las. especificaciones,. descripciones,. requisitos. y. demás. características del producto licitado. Adjudicación: Acto administrativo por medio del cual la autoridad competente selecciona a uno o más oferentes para la suscripción de un contrato de suministro o Servicios. Adjudicatario: Oferente al cual le ha sido aceptada una oferta en un proceso de compras, para la suscripción del contrato definitivo.. Una Licitación o Propuesta Pública es un procedimiento administrativo de carácter concursal mediante el cual la administración realiza un llamado público, convocando a los interesados, para que, según las bases fijadas, formulen propuestas, de las cuales se seleccionará y aceptará la más conveniente. Luego de un periodo de tiempo establecido se puede generar o. 5.
(19) no la adjudicación del bien/servicio requerido, dependiendo del análisis llevado a cabo a los proveedores y sus ofertas por parte de la entidad licitante, siguiendo los criterios de evaluación y ponderaciones establecidas en las bases, permitiendo de esta forma, la comparación de las distintas ofertas. [8] De no encontrar un proveedor adecuado para los requerimientos establecidos en las bases, la licitación se declara desierta, esto significa que los proveedores que postularon no cumplen con los requisitos necesarios. Bajo estas circunstancias la adquisición del bien/servicio se puede llevar a cabo bajo otros tipos de contratación. Los contenidos mínimos que deben poseer las bases son: [9,29] 1. Requisitos y condiciones que deben cumplir los oferentes para que sus ofertas sean aceptadas. 2. Especificaciones de los bienes/servicios que se requiere contratar. 3. Etapas y plazos de la licitación. 4. Condición, plazo y modo en que se compromete el/los pagos. 5. Plazo de entrega del bien/servicio adjudicado. 6. Monto de las garantías que estime la entidad licitante, así como la forma y oportunidad en que se restituirán a los oferentes. 7. Criterios de evaluación observables y medibles. 8. Suscripción de Contrato/Orden de Compra. 9. Los medios para acreditar si el proveedor adjudicado registra saldos insolutos de remuneraciones o cotizaciones de seguridad social. 10. La forma de designación de as comisiones evaluadoras (sobre 1000 UTM y licitaciones complejas). 11. Medidas a aplicar en casos de incumplimiento del proveedor. Además de lo anterior, pueden contener elementos optativos tales como: 1. La prohibición de subcontratar impuesta al proponente adjudicado y las circunstancias y alcances de tal prohibición.. 6.
(20) 2. Puntajes y ponderaciones derivados del cumplimiento de normas amigables al medioambiente, contratación de discapacitados y demás materias de alto impacto social. 3. Cualquier otra materia que no contradiga las disposiciones de la Ley de Compras. Sin embargo, pueden existir causas por las cuales no llevar a cabo una licitación pública, estas son: [9] -. Si en la Licitación Pública no se presentaron interesados, procede la propuesta privada y en caso de no encontrar nuevamente interesados, será procedente el trato o contratación directa.. -. Realización de un contrato terminado anticipadamente por falta de cumplimiento del contratante u otras causales; y en que el remanente sea menos de 1.000 UTM. Requiere 3 cotizaciones previas.. -. Emergencia, Urgencia o Imprevisto, calificados por resolución fundada por el Jefe Superior de la entidad.. -. Si solo existe un proveedor del bien o servicio.. -. Convenio de prestación de servicios con Personas jurídicas extranjeras, a ejecutar servicios en el exterior. Requiere 3 cotizaciones previas.. -. Servicios de naturaleza confidencial cuya difusión afecte la seguridad o interés nacional.. -. Cuando por la naturaleza de la negociación, es indispensable acudir al trato directo.. -. Contrataciones iguales o inferiores a 100 UTM.. -. Contratación de servicios especializados inferiores a 1.000 UTM.. -. Si no se reciben ofertas o resultan inadmisibles en caso de que la contratación sea indispensable.. -. En el caso que no sea procedente se sanciona al Jefe de Servicio con multa.. 7.
(21) La finalidad principal de las licitaciones públicas es servir de mecanismo transparente y competitivo para la adquisición de bienes y servicios por parte de la Administración, con el fin de asegurar que la decisión tomada sea la más eficaz y eficiente. [10] En el ámbito farmacéutico, basta considerar los importantes volúmenes y valores comprometidos para entender la importancia que toma un sistema de transparencia en el proceso de compra. Dichas licitaciones pueden ser gestionadas a través de la Central de Abastecimiento del Sistema Nacional de Servicios de Salud (CENABAST), institución pública dependiente del Ministerio de Salud (MINSAL); o bien, las licitaciones. pueden. ser. elaboradas. y. adjudicadas. por. los. propios. establecimientos de salud.. Central de Abastecimiento del sistema Nacional de Servicios de Salud (CENABAST). En el año 1924 nace el Ministerio de salud, éste a su vez en 1932 da origen a una Central de Compras que cubría las necesidades de todo tipo de productos, para posteriormente, en 1952 junto con la creación del Servicio Nacional de Salud (S.N.S), convertirse en la Central de Abastecimiento. En el año 1979 se produce un cambio en el sistema estatal, se crea el Sistema Nacional de Servicios de Salud (S.N.S.S) y se da origen a la Central de Abastecimiento del S.N.S.S que tiene como rol abastecer los fármacos e insumos clínicos al sector de salud. [11] En 1994 se realizaron diagnósticos y estudios para conocer las características del mercado y determinar la eficiencia de la institución y del sistema de abastecimiento. Tras esto, se dio paso a CENABAST; organismo intermediador para el sector público de salud en Chile. [11] La Central de Abastecimiento del sistema Nacional de Servicios de Salud (CENABAST), es una institución pública, dependiente del Ministerio de Salud, 8.
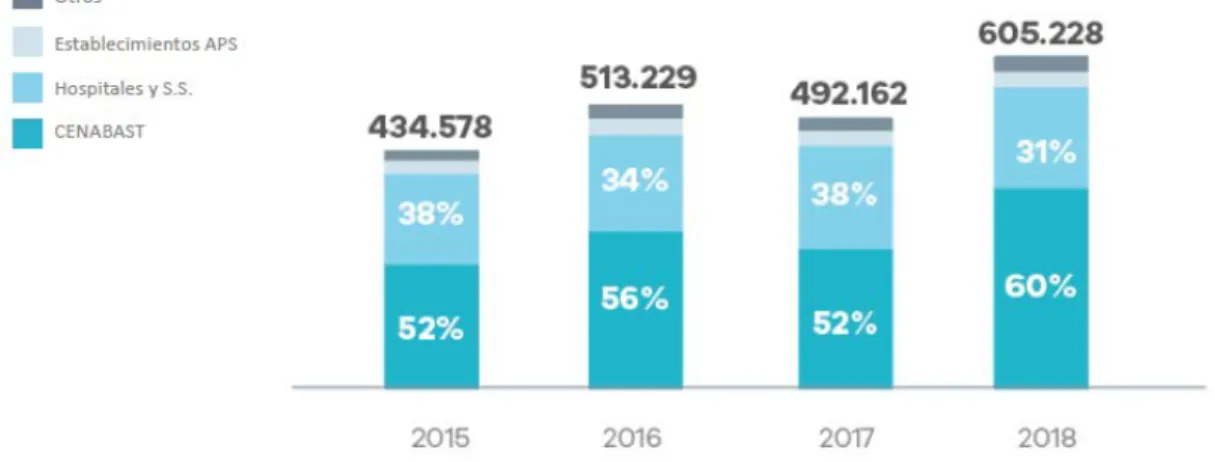
(22) que comienza a operar en 1995 a través del sistema de licitación electrónica, cuya misión es contribuir al bienestar de la población asegurando la disponibilidad de medicamentos, alimentos, insumos y equipamiento de uso médico, para asegurar la continuidad, oportunidad y calidad de éstos, al menor costo posible. [12] El proceso de intermediación que realiza CENABAST comienza con la programación de la demanda de los establecimientos de salud a lo largo del país para, posteriormente, recibir el mandato de compra por parte de la Dirección del establecimiento y dar paso al proceso de compra. [13] La intermediación permite el acceso de los establecimientos de salud para programar sus requerimientos, confirmar la recepción de sus productos, y, por otro lado, disponer de una plataforma que les permite a los proveedores certificar los productos, levantar órdenes de compra, informar las entregas de los productos y los pagos realizados por partes de los establecimientos de salud. [14] Durante los últimos 4 años el volumen de operaciones realizadas a través de CENABAST ha incrementado considerablemente en más de 200.000 millones de pesos, lo que se traduce en más de 1000 millones de unidades transadas y con un incremento del 4% en 2018 respecto del año anterior. La Figura 1 muestra el volumen de operaciones de CENABAST, en monto bruto en millones de pesos, en los últimos 4 años, lo que demuestra su importancia. como. intermediador. en. el. sistema. de. compra. para. establecimientos de salud. [15]. 9.
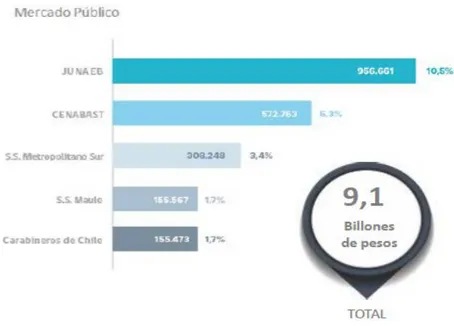
(23) Figura 1: Volumen de operaciones de CENABAST en los últimos 4 años. [15]. Con respecto a la presencia de CENABAST en mercado público, se puede decir que es un servicio que tiene un gran poder de compras al consolidar demandas de las instituciones de salud, lo que se ve reflejado en su participación como uno de los mayores compradores a través de Mercado Público. La Figura 2 muestra el monto y el porcentaje de compra (en montos brutos en millones de pesos) que posee CENABAST en Mercado Público, mientras que la Figura 3 muestra el monto y porcentaje de compra de CENABAST dentro del Sector de Salud como organismo comprador dentro de Mercado Público.. 10.
(24) Figura 2: Monto y Porcentaje de compra de CENABAST en Mercado Público. [15]. Figura 3: Monto y Porcentaje de compra de CENABAST en Mercado Público, dentro del Sector de Salud. [15]. 11.
(25) De lo anterior se desprende que $572.763 millones de pesos corresponden a la compra de fármacos por parte de CENABAST en Mercado Público, alcanzando el último año, un 60% de participación dentro del Sector de Salud (ver Figura 4), lo que corrobora su importante intervención en la adquisición de medicamentos para la salud pública de Chile. [15]. Figura 4: Participación de CENABAST en Mercado público de medicamentos los últimos 4 años. [15]. Para postular a toda licitación se debe llevar a cabo el cumplimiento de las bases del proceso. Las bases son documentos aprobados por la autoridad que contienen el conjunto de requisitos, condiciones y especificaciones, que describen al producto y que regulan el proceso y al contrato definitivo. Estas bases incluyen tres partes: Una parte administrativa, una parte técnica, y una parte económica, además de documentos anexos, los que están disponibles en formato digital en el portal www.mercadopúblico.cl [7] Las instituciones de salud en general, a diferencia de CENABAST, no cuentan con bases de licitaciones preestablecidas o definidas, sin embargo, cumplen con lo señalado anteriormente. A continuación, se describe en que consta cada tipo de base, y los documentos solicitados por CENABAST, establecidos en sus bases de licitación [7].. 12.
(26) Bases administrativas. Son documentos aprobados por la autoridad que contienen, de manera general y/o particular, las etapas, plazos, mecanismos de consulta y/o aclaraciones,. criterios. de. evaluación,. mecanismos. de. adjudicación,. modalidades de evaluación, características del contrato, y demás aspectos del proceso de compra. [16] Además de lo anterior, dan cuenta de la existencia legal y situación económica y financiera de los oferentes y aquellas que los habilitan para desarrollar actividades económicas reguladas. Dentro de los documentos anexos en las bases de CENABAST, se encuentran: •. Identificación del Oferente, Anexo N°1 de las Bases de Licitación de CENABAST.. •. Declaración Jurada Simple del representante de la empresa o persona natural, que acredite no incurrir en prácticas antisindicales o infracción a los derechos de sus trabajadores, Anexo N°3 de las Bases de Licitación de CENABAST.. •. Proveedores no inscritos en www.chileproveedores.cl deben presentar, además: Fotocopia del RUT del oferente y cédula de identidad del representante legal, copia de la escritura pública donde conste la constitución y el representante legal con certificado de vigencia vigente.. Bases Técnicas. Corresponden a documentos aprobados que contienen las especificaciones, descripciones, requisitos y demás características que determinarán la admisibilidad técnica y evaluación del producto a licitar. Dentro de los documentos anexos en las bases de CENABAST, para productos farmacéuticos, se encuentran: •. Ficha Técnica, Anexo N°2a de las Bases de Licitación de CENABAST.. 13.
(27) •. Documentos vigentes emitidos por autoridades sanitarias competentes que respalden la información contenida en la Ficha mencionada anteriormente.. •. Certificado de Buenas Prácticas de Manufactura (BPM ) para la planta de fabricación del producto ofertado emitido por la autoridad sanitaria local, vigente a la fecha de cierre de recepción de ofertas o Certificado de Buenas Prácticas de Manufactura o Certificado de producto farmacéutico, emitidos por: ANMAT (Argentina), ANVISA (Brasil), CECMED. (Cuba),. COFEPRIS. (México),. EMA. (o. entidades. pertenecientes a la Comunidad Europea), FDA (EE.UU), INVIMA (Colombia), OMS, (agencias de alta vigilancia sanitaria) debidamente legalizados o apostillados a partir del 30 de Agosto de 2016. •. Certificado de producto con Equivalencia Terapéutica o Certificado de Producto de Referencia.. Dentro de los documentos anexos en las bases de CENABAST, para productos farmacéuticos, VIH, se encuentran: •. Ficha Técnica, Anexo N°2c de las Bases de licitación de CENABAST.. •. Documentos vigentes emitidos por autoridades sanitarias competentes que respalden la información contenida en la Ficha mencionada anteriormente.. •. Certificado de Buenas Prácticas de Manufactura (BPM ) para la planta de fabricación del producto ofertado emitido por la autoridad sanitaria local, vigente a la fecha de cierre de recepción de ofertas o Certificado de Buenas Prácticas de Manufactura o Certificado de producto farmacéutico, emitidos por: ANMAT (Argentina), ANVISA (Brasil), CECMED. (Cuba),. COFEPRIS. (México),. EMA. (o. entidades. pertenecientes a la Comunidad Europea), FDA (EE.UU), INVIMA (Colombia), Organización Mundial de la Salud (OMS), (agencias de alta. 14.
(28) vigilancia sanitaria) debidamente legalizados o apostillados a partir del 30 de Agosto de 2016. •. Certificado que avale la condición de equivalente terapéutico o la bioequivalencia del producto ofertado emitido por algunas de las siguientes entidades: OMS (listado de productos precalificados), EMA (o entidades pertenecientes a la Comunidad Europea), FDA (EE.UU), Instituto de Salud Pública de Chile (ISP) (agencias de alta vigilancia sanitaria).. •. Certificado que avale producto de referencia o comparadores mediante un certificado emitido por el ISP.. •. Documentos que acrediten experiencia de uso del producto ofertado.. Bases Económicas. •. El precio ofertado se debe expresar en pesos chilenos y valores netos.. •. El anexo N°8 de las Bases de Licitación de CENABAST es referencial y es completado por CENABAST, e indica la distribución mensual del producto licitado en caso de ser adjudicado.. Seven Pharma Chile S.p.A.. En Chile, Seven Pharma S.p.A., inicia sus actividades en el año 2015, con el fin de incorporar productos de excelencia y calidad a nuestro país. Para ello cuenta con un equipo de profesionales adecuado para llevar a cabo las actividades requeridas. A raíz de la modificación al Código Sanitario, mediante la Ley N°20.724 que entró en vigencia en febrero del año 2014, Seven Pharma Chile S.p.A., comenzó a tramitar su autorización ante la Autoridad Sanitaria como una nueva Droguería, la cual consigue en marzo del año 2016.. 15.
(29) Droguería. es. todo. establecimiento. destinado. a. la. importación,. fraccionamiento, distribución y venta de drogas a granel, sustancias químicas, reactivos, colorantes permitidos, aparatos de física y química y accesorios médicos y quirúrgicos. [36] Debido a lo anterior, Seven Pharma Chile S.p.A., lleva a cabo sus actividades mediante la importación y distribución, de productos farmacéuticos en nuestro país mediante el ingreso de productos similares a través de nuevos registros de productos farmacéuticos similares, centrando su área de comercialización en: Línea de productos Oncológicos y Línea de productos para tratamiento de Virus de Inmunodeficiencia Humana (VIH), entre otras. Al momento de ingresar a la compañía para realizar esta profundización profesional, Seven Pharma S.p.A., obtiene sus ingresos a través de la venta al Sistema Público mediante su participación en licitaciones públicas, principalmente de CENABAST a través del portal mercado público de Chile Compra. Al ser una empresa naciente a la fecha de ingreso, Seven Pharma S.p.A., cuenta con cuatro departamentos: -. Gerencia General, encargado de la dirección de la gestión contable, logística, y administrativa de la empresa proporcionando control de las operaciones e información exacta y oportuna para la toma de decisiones de manera de lograr o exceder los resultados de la empresa. Proveer de herramientas necesarias para que la empresa maximice su crecimiento comercial.. -. Operaciones-Ventas, encargado de la dirección de las ventas, de manera de aumentar el volumen de ventas de la empresa, manejo adecuado de las cuentas más importantes y de proporcionar retroalimentación sobre desempeño en ventas y resultados obtenidos.. 16.
(30) -. Asuntos Regulatorios, encargado de desarrollar estrategias regulatorias para el registro de productos farmacéuticos, colaborar con la Autoridad Sanitaria chilena, apoyar actividades de desarrollo, preparar las presentaciones regulatorias y garantizar el cumplimiento de las normas en todo el ciclo de vida de un producto, entre otras responsabilidades trascendentales.. -. Aseguramiento de calidad, encargado de garantizar que los procesos se lleven a cabo de acuerdo con las exigencias de calidad establecidas por la empresa y la Autoridad Sanitaria chilena, estableciendo un sistema de Gestión de Calidad junto con asegurar el desarrollo y cumplimiento de la normativa sobre las Buenas Prácticas de Almacenamiento y Distribución.. Es el área de Gerencia de Operaciones-Ventas la encargada de la revisión, análisis y selección de las licitaciones en las que la compañía participará y el área de Asuntos Regulatorios es la encargada de proporcionar toda la información técnica - regulatoria, para la presentación óptima del producto seleccionado a la licitación. Luego de reuniones con las áreas de Gerencia General y de OperacionesVentas, se llegó a la determinación que dentro del proceso de licitaciones los parámetros críticos que se observan son el acceso y obtención de la información técnico-regulatoria de los productos, lo que implica destinar gran parte del tiempo a evaluarla y conseguirla, dentro del proceso de postulación a licitaciones, conduciendo, algunas veces, a adjuntar información regulatoria errónea o recibir solicitudes de aclaración de información técnica fuera de los plazos establecidos, viéndose afectada la evaluación de la oferta presentada. De lo anterior, se desprende la necesidad de crear un repositorio de información desde el Área de Asuntos Regulatorios, de acceso común con el Área de Ventas-Operaciones, que contenga la información técnico-regulatoria involucrada en el proceso de licitaciones, en su versión actualizada, para cada. 17.
(31) producto registrado por la compañía, buscando mejorar el acceso a información correcta y disminuyendo los tiempos involucrados en su obtención, selección y análisis. Para conseguir la propuesta anteriormente mencionada, se trabajó en conjunto con las áreas mencionadas anteriormente para la implementación de una base de datos que contenga la información necesaria y requerida del Área de Asuntos Regulatorios respecto a los productos registrados para así, facilitar y agilizar el proceso (disminuyendo el tiempo empleado en el análisis de la información regulatoria) de postulación a licitaciones públicas y la elaboración de un Procedimiento Operativo Estándar (POE) que norme los pasos a seguir en el proceso y las responsabilidades de los colaboradores involucrados, para llevar a cabo la presentación exitosa de una oferta por parte de la empresa, para contribuir de manera más tangible al crecimiento y desarrollo de ella. La creación de una base de datos que sirva de soporte a la Gerencia de Ventas-Operaciones para proporcionar la correcta información, tiene una alta relevancia, ya que incrementa la eficiencia de la comunicación entre departamentos, en este caso entre Área de Asuntos Regulatorios y Gerencia de Ventas, lo que permite de esta manera, agilizar el proceso de evaluación y postulación a los llamados realizados por las distintas entidades, y así presentar de mejor forma las propuestas, con el objeto de lograr la venta de los productos registrados en Chile y conformar relaciones de mayor confianza con el Sector de Salud Pública. Para normar el proceso de licitaciones, hace necesaria la elaboración de un Procedimiento Operativo Estándar (instrumento administrativo que tiene el objetivo de asegurar la estandarización y trazabilidad de los procesos o subprocesos. realizados. en. una. empresa,. detallando. funciones. y. responsabilidades) y de un instructivo para el uso y actualización de la base de datos creada para la empresa Seven Pharma Chile S.p.A. [17]. 18.
(32) La aplicación de todo lo anterior contribuye a garantizar el mantenimiento de los niveles de calidad y servicio, con mayor control del proceso y minimización de errores. [18]. Al existir una mejora en la gestión de la información, se consigue una disminución en el tiempo empleado en la recopilación de información del Área Regulatoria, pudiendo ser destinado a ejecutar otras acciones de relevancia al proceso de venta, generando de esta forma un aumento en los índices numéricos de la empresa al favorecer la venta rápida y oportuna de los productos.. 19.
(33) Capítulo II.. Objetivos General y Específicos. 20.
(34) Objetivo General. Implementar una base de datos con el fin de mejorar el proceso de licitaciones desde el área de Asuntos Regulatorios, reduciendo los tiempos de acceso a la información.. Objetivos Específicos. 1. Analizar el estado actual de los registros sanitarios de Seven Pharma Chile S.p.A. 2. Revisar y tabular los requisitos técnicos-regulatorios exigidos por las bases de licitación de la Central Nacional de Abastecimiento y de otros establecimientos de salud en Chile. 3. Verificar el cumplimiento técnico-regulatorio según lo establecido en las bases de licitación para los productos de Seven Pharma Chile S.p,A, en las licitaciones en las que la compañía había participado. 4. Crear un sistema de base de datos con los antecedentes técnicosregulatorios que darán sustento al área de licitaciones para la presentación de ofertas 5. Comparar los tiempos en acceso a la información antes de la base de datos, y después de la implementación de ésta.. 21.
(35) Capítulo III.. Plan de trabajo, resultados y análisis crítico.. 22.
(36) Objetivo Específico N°1: Analizar el estado actual de los registros sanitarios de Seven Pharma Chile S.p.A.. En una primera etapa, se realiza una revisión bibliográfica para tomar conocimiento de las políticas regulatorias que involucran al sistema nacional de control de productos farmacéuticos, dispuestos por la autoridad sanitaria de nuestro país, para luego, conocer los antecedentes que se deben presentar para la obtención de un registro simplificado de un producto farmacéutico. Durante la revisión bibliográfica se estudian los siguientes documentos: -. Decreto Supremo 3. [22]. -. Instructivo informativo del Procedimiento de Registro Sanitario de Productos Farmacéuticos. [24,25]. -. Instructivo para completar la Solicitud de Registro Simplificado de Producto Farmacéutico. [24,25]. Luego de la revisión bibliográfica, se adquieren los antecedentes que aplican someter para la obtención de un registro simplificado de productos farmacéuticos para la compañía Seven Pharma S.p.A. Estos antecedentes se observan en la Tabla N°1 y se clasifican dependiendo de su naturaleza, en antecedentes técnicos y legales.. Tabla N°1: Antecedentes necesarios para sometimiento de registro simplificado. Tipo de Anexo Técnico Técnico Técnico Técnico Técnico Técnico Técnico Técnico. Nombre de Anexo Monografía(s) de los Excipientes Monografía(s) de Principio(s) Activo(s) Especificación de Producto Terminado Especificaciones de Principio(s) Activo(s) Especificaciones de los Excipientes Metodología Analítica completa original y su traducción respecto a las EPT Estudio de Estabilidad Proyecto de Rotulado Gráfico. 23.
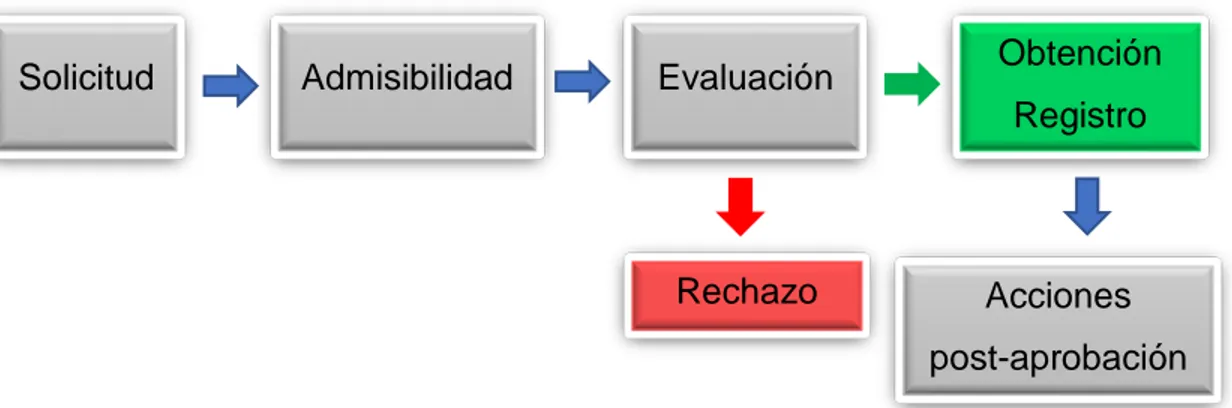
(37) Tipo de Anexo Técnico Técnico Técnico Técnico Técnico Técnico Técnico Legal Legal Legal Legal Legal Legal Legal. Nombre de Anexo Folleto de Información al Paciente Folleto de Información al Profesional Monografía Clínica-Farmacológica Informe de validación de los métodos analíticos de evaluación Registro grafico de la cuantificación del Principio Activo Validación del proceso productivo Descripción clave de fabricación CLV o certificado de fabricante extranjero Convenio de distribución autorizado ante notario. Convenio con laboratorio externo de control de calidad. Certificado de producto farmacéutico (CPP) Convenio de Reacondicionamiento Local, si aplica. Resolución sanitaria que autoriza al establecimiento. Certificado de Buenas Prácticas de Manufactura.. Para complementar lo anterior, se participa de un entrenamiento dictado por el área de Asuntos Regulatorios acerca del proceso de registro con el objetivo de generar un acercamiento tangible a los documentos legales y técnicos involucrados en el registro de los productos farmacéuticos similares, y al sistema informático Gicona (Sistema Informático de tramitación en línea) para ejecutar diversos trámites relacionados a productos farmacéuticos.. Con el objeto de comprender las actividades llevadas a cabo por el Área de Asuntos Regulatorios, se forma parte del proceso de registro de productos farmacéuticos. Al recibir el Dossier (conjunto de documentos que contiene toda la información acerca de un producto) de un nuevo producto, se examina y evalúa si cumple con los requerimientos e información necesarios según la legislación chilena vigente, de estar en cumplimiento, se prepara la información para luego ser sometida ante el ISP; si la información está incompleta, se solicita a casa matriz la información necesaria para completarla. Las diferentes fases para la obtención de un Registro Sanitario son: etapa de admisibilidad y etapa de registro de productos farmacéuticos, ambas se gestionan a través de GICONA. 24.
(38) para optar a la evaluación y posterior aprobación del Registro Sanitario del producto sometido. Las etapas que se deben cumplir para la obtención de la aprobación de un producto sanitario en Chile se muestran en la Figura 5:. Solicitud. Admisibilidad. Obtención. Evaluación. Registro. Rechazo. Acciones post-aprobación. Figura 5: Proceso por etapas, para la obtención de la aprobación de un registro sanitario. Las acciones involucradas en cada etapa son las siguientes:. Solicitud: La solicitud de registro se realiza ingresando los antecedentes en la plataforma electrónica GICONA. Cada tipo de solicitud posee un código, un arancel, un instructivo y un formulario.. Admisibilidad: Esta etapa comienza al presentar la solicitud cancelando el arancel de admisibilidad y consiste en la revisión por parte del ISP, mediante una pauta de evaluación de completitud de antecedentes de solicitud de registro sanitario. Si todos los antecedentes necesarios fueron presentados correctamente, se emite una resolución de admisibilidad. De lo contrario, la solicitud se declara inadmisible otorgando un plazo de 5 días hábiles para completar los antecedentes indicados en la correspondiente resolución, posterior a eso, si los antecedentes enviados durante la inadmisibilidad dieron. 25.
(39) sustento a lo solicitado, se otorga una Resolución Exenta de Aprobación o una Resolución de No Ha Lugar finalizando la etapa de Admisibilidad.. Evaluación: Los antecedentes son evaluados separadamente por lo que, para la aprobación, se requiere de informes de antecedentes de calidad, seguridad y eficacia, legales y administrativos. De acuerdo con el resultado de la evaluación, el producto farmacéutico queda registrado bajo un número único de identificación o se rechaza la solicitud de inscripción.. Acciones post-aprobación: Entre las acciones post-aprobación se encuentran las modificaciones (de tipo legal, técnico o analítico), renovación (vigencia otorgada de cinco años, pudiendo ser renovado por periodos iguales y sucesivos), suspensión y cancelación.. Después de todo lo anterior, se comienza a trabajar junto al Director Técnico, recibiendo información documental acerca de los registros sanitarios aprobados de los productos de Seven Pharma S.p.A., de esta forma se realiza un entrenamiento acerca del formato y contenido de un documento físico de Resolución Inscríbase de registro sanitario otorgado por el ISP, la cual consta de las siguientes secciones: -. Visto estos antecedentes: Menciona la información presentada en la solicitud de Registro y a la cadena logística que estará involucrada en el proceso de importación de los productos.. -. Considerando: Hace mención de las acciones llevadas a cabo por parte del solicitante, durante la fase de evaluación del registro.. -. Teniendo presente: Hace mención de la normativa involucrada en la toma de decisiones y la reglamentación mediante la cual fue evaluada la solicitud.. -. Inscríbase: Describe y detalla la aprobación de la solicitud de registro, indicando nombre del titular y cadena logística involucrada, régimen de. 26.
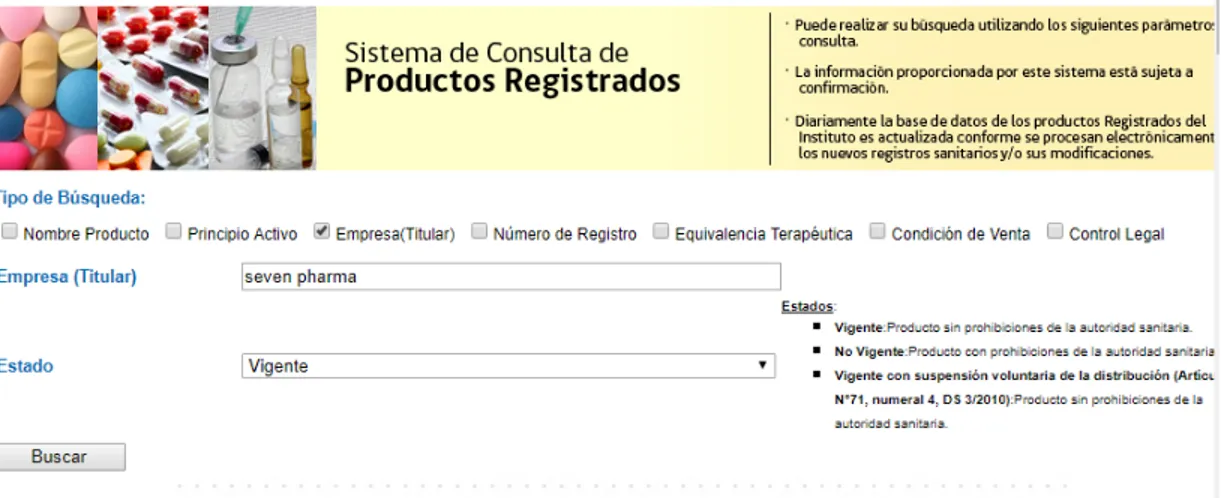
(40) importación y las compañías involucradas en el proceso, principio activo y su fabricante, periodo de eficacia otorgado, presentaciones (y su contenido) aprobadas para el producto, condición de venta, grupo terapéutico, manejo de los rótulos de los envases y de los folletos, indicación. aprobada,. especificaciones. de. producto. terminado,. metodología analítica, responsables encargados del control de calidad local, y demás acciones a cumplir por parte del Titular de Registro. -. Formula cualitativa y cuantitativa.. -. Links: Sección que detalla los enlaces web para la obtención del rotulado gráfico, folleto paciente, folleto profesional y especificaciones de producto terminado, aprobados por el ISP para el registro sanitario.. De manera paralela, y para complementar a lo anterior, se realiza una búsqueda a través del sitio web del Departamento Agencia Nacional de Medicamentos, ingresando al buscador de productos registrados, utilizando el filtro de empresa (Titular de registro) para obtener una visión general de todos los productos con registro sanitario vigente (Figura 6), aprobados para Seven Pharma Chile. [20]. Figura 6: Sistema de Consulta de Productos Registrados.. 27.
(41) Una vez obtenido el listado total desde el sitio web del ISP, se exporta a través de formato Excel para trabajar con la información recopilada. Los productos se ordenan en columnas según el siguiente orden: -. Principio activo.. -. Forma farmacéutica.. -. Dosis.. -. Número de Registro Sanitario.. En la Tabla N°2 se muestra un ejemplo de cómo son obtenidos los registros sanitarios desde la plataforma del ISP. EL total de los productos registrados por Seven Pharma S.p.A., a la fecha de búsqueda, obtenidos en base al análisis realizado, se pueden observar en el Anexo 1.. Tabla N°2: Ejemplo de los productos registrados por Seven Pharma S.p.A., a la fecha de búsqueda, obtenidos desde el ISP. PRINCIPIO ACTIVO. FORMA FARMACÉUTICA. DOSIS. REGISTRO. 1. Aciclovir. comprimidos. 400 mg. F-22710/16. 2. Aciclovir. comprimidos. 800 mg. F-22712/16. 3. Amlodipino. comprimidos. 10 mg. F-22800/16. No.. En base al análisis anterior, se observa que Seven Pharma S.p.A., cuenta con 50 productos aprobados siendo de vital importancia mantener actualizados todos los requisitos técnicos y documentales necesarios que aseguran y demuestran la calidad, seguridad y eficacia de los productos registrados, desde su fabricación hasta su comercialización, para ofrecer un tratamiento eficaz y seguro a los pacientes chilenos.. 28.
(42) De lo anterior se desprende que Seven Pharma S.p.A., posee un variado portafolio de productos que responden a variados tipos de patologías, siendo el principal foco de la compañía los productos para tratamiento de VIH y la línea oncológica. Por otra parte, este análisis y acercamiento permite seleccionar y evaluar la documentación necesaria de incorporar en la base de datos para licitaciones, considerando la importancia de mantener de forma confidencial los datos sensibles contenidos en los documentos regulatorios y legales aprobados por parte del ISP y la relevancia que esta información tiene al momento de generar un impacto en el respaldo documental necesario para elaborar una presentación de Oferta Técnica robusta y completa en el proceso de postulación a licitaciones con productos disponibles de Seven Pharma S.p.A.. 29.
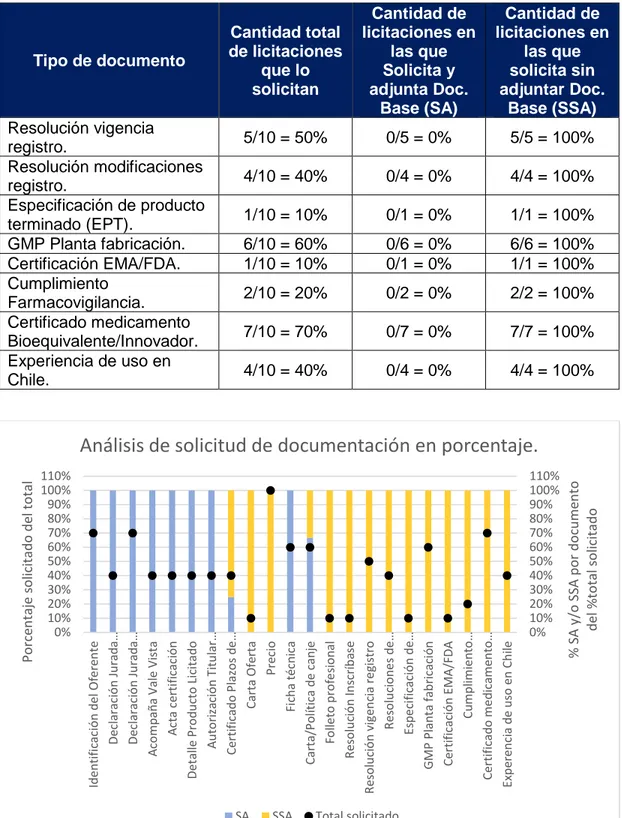
(43) Objetivo Específico N°2: Revisar y tabular los requisitos técnicos-regulatorios exigidos por las bases de licitación de la Central Nacional de Abastecimiento y de otros establecimientos de salud en Chile.. Para llevar a cabo este objetivo, se realiza una revisión de distintas licitaciones en las que la entidad licitante corresponde a CENABAST o un establecimiento de salud. Para ello se realizan los siguientes pasos: -. Ingreso a la plataforma www.mercadopublico.cl,. -. Acceso a sección de registro de licitaciones históricas, búsqueda avanzada.. -. Filtrar por fechas a buscar.. En el Anexo 2 se tabulan los documentos requeridos por las distintas entidades de las licitaciones encontradas, y se clasifica la documentación según tipo de área documental a la que pertenecen: -. Administrativa (A),. -. Técnico-Regulatorio (T-R),. -. Económica (E).. La tabla anteriormente mencionada también indica si respecto a un antecedente, la institución adjunta o no, un documento base sobre el cual completar la información requerida. Los documentos requeridos por las distintas licitaciones evaluadas son: Administrativos: Identificación del oferente, D. Jurada Prácticas antisindicales, D. Jurada persona jurídica, acompaña vale vista, acta certificación, detalle producto licitado, autorización titular registro, certificado plazos de entrega. Económicos: Carta oferta, precio. Técnico-Regulatorio: Ficha técnica, carta/política de canje, folleto profesional, resolución. inscríbase,. resolución. vigencia. registro,. resoluciones. de. 30.
(44) modificaciones al registro, especificación de producto terminado (EPT), GMP planta fabricación, certificación EMA/FDA, cumplimiento farmacovigilancia, certificado medicamento bioequivalente/innovador, experiencia de uso en Chile.. Una vez finalizada la recopilación anterior, se busca cuantificar con qué frecuencia estos documentos son requeridos, expresando lo anterior a través de porcentaje, diferenciando cuando la institución incorpora o no, un documento base para ser completado para entregar la información solicitada en la licitación. La tabla N°3 y figura 7 muestran los porcentajes en los cuales son solicitados los documentos anteriores de acuerdo con las características indicadas.. Tabla N°3: Porcentaje de frecuencia con que un documento es solicitado respecto del total y si se adjunta o no documentación base a ser completada.. Tipo de documento. Identificación del oferente. D. Jurada prácticas antisindicales. D. Jurada persona jurídica. Acompaña Vale Vista. Acta certificación. Detalle producto licitado. Autorización titular de registro. Certificado plazos de entrega. Carta oferta. Precio. Ficha técnica. Carta/política de canje. Folleto profesional. Resolución inscríbase.. 7/10 = 70%. Cantidad de licitaciones en las que Solicita y adjunta Doc. Base (SA) 7/7 = 100%. Cantidad de licitaciones en las que solicita sin adjuntar Doc. Base (SSA) 0/7 = 0%. 4/10 = 40%. 4/4 = 100%. 0/4 = 0%. 7/10 = 70% 4/10 = 40% 4/10 = 40% 4/10 = 40%. 7/7 = 100% 4/4 = 100% 4/4 = 100% 4/4 = 100%. 0/7 = 0% 0/4 = 0% 0/4 = 0% 0/4 = 0%. 4/10 = 40%. 4/4 = 100%. 0/4 = 0%. 4/10 = 40%. 1/4 = 25%. 3/4 = 75%. 1/10 = 10% 10/10 = 100% 6/10 = 60% 6/10 = 60% 1/10 = 10% 1/10 = 10%. 0/1 = 0% 0/10 = 0% 6/6 = 100% 4/6 = 67% 0/1 = 0% 0/1 = 0%. 1/1 = 100% 10/10 = 100% 0/6 = 0% 2/6 = 33% 1/1 = 100% 1/1 = 100%. Cantidad total de licitaciones que lo solicitan. 31.
(45) Tipo de documento. Resolución vigencia registro. Resolución modificaciones registro. Especificación de producto terminado (EPT). GMP Planta fabricación. Certificación EMA/FDA. Cumplimiento Farmacovigilancia. Certificado medicamento Bioequivalente/Innovador. Experiencia de uso en Chile.. Cantidad total de licitaciones que lo solicitan. Cantidad de licitaciones en las que Solicita y adjunta Doc. Base (SA). Cantidad de licitaciones en las que solicita sin adjuntar Doc. Base (SSA). 5/10 = 50%. 0/5 = 0%. 5/5 = 100%. 4/10 = 40%. 0/4 = 0%. 4/4 = 100%. 1/10 = 10%. 0/1 = 0%. 1/1 = 100%. 6/10 = 60% 1/10 = 10%. 0/6 = 0% 0/1 = 0%. 6/6 = 100% 1/1 = 100%. 2/10 = 20%. 0/2 = 0%. 2/2 = 100%. 7/10 = 70%. 0/7 = 0%. 7/7 = 100%. 4/10 = 40%. 0/4 = 0%. 4/4 = 100%. SA. SSA. 110% 100% 90% 80% 70% 60% 50% 40% 30% 20% 10% 0%. % SA y/o SSA por documento del %total solicitado. 110% 100% 90% 80% 70% 60% 50% 40% 30% 20% 10% 0%. Identificación del Oferente Declaración Jurada… Declaración Jurada… Acompaña Vale Vista Acta certificación Detalle Producto Licitado Autorización Titular… Certificado Plazos de… Carta Oferta Precio Ficha técnica Carta/Política de canje Folleto profesional Resolución Inscríbase Resolución vigencia registro Resoluciones de… Especificación de… GMP Planta fabricación Certificación EMA/FDA Cumplimiento… Certificado medicamento… Experencia de uso en Chile. Porcentaje solicitado del total. Análisis de solicitud de documentación en porcentaje.. Total solicitado. Figura 7: Porcentaje de frecuencia con que un documento es solicitado respecto del total y porcentaje en que se adjunta o no documentación base a ser completada.. 32.
(46) En relación con la información anterior, la documentación se detalla según lo siguiente: Precio: Solicitado en un 100% de las licitaciones y sin documentación adjuntada a través de la plataforma para completar la información, éste se completa directamente en el portal de postulación. Identificación del Oferente y Declaración Jurada de Persona Jurídica fueron solicitados en un 70% de las licitaciones analizadas y se adjunta documentación base para completar la información en la totalidad de las solicitudes. Certificado de medicamento bioequivalente/innovador fue solicitado en un 70% de las licitaciones analizadas sin adjuntar documentación base ya que corresponde a un documento específico para cada producto, que el Titular de Registro Sanitario, debe solicitar al Instituto de Salud Pública. Ficha Técnica fue solicitada en un 60% de las licitaciones analizadas adjuntando documentación base para completar la información requerida en la totalidad de las solicitudes Carta/Política de canje fue solicitada en un 60% de las licitaciones analizadas, el 67% de estas solicitudes corresponde a solicitudes en las que se adjunta documentación base para completar la información requerida, mientras que en un 33% de estas solicitudes no se adjunta documentación base, siendo responsabilidad del Titular de Registro adjuntar un documento de formato y contenido propio para dar cumplimiento a lo requerido. GMP Planta de fabricación fue solicitado en un 60% de las licitaciones analizadas sin adjuntar documentación base ya que corresponde a un documento específico para cada producto, que el Titular de Registro Sanitario debe adjuntar, de acuerdo con lo indicado en la Resolución Inscríbase para el producto involucrado. Resolución Vigencia de registro, fue solicitado en un 50% de las licitaciones analizadas no adjuntando documentación base ya que el Titular de Registro Sanitario deberá adjuntar la documentación necesaria de acuerdo a lo. 33.
(47) aprobado bajo resolución del Instituto de Salud Pública para el producto involucrado. Acompaña Vale Vista, Acta certificación, Detalle producto licitado, Autorización Titular Registro y Declaración Jurada de Prácticas Antisindicales fueron solicitados. en. un. 40%. de. las. licitaciones. analizadas. adjuntando. documentación base para completar la información requerida en la totalidad de las solicitudes. Certificado Plazos de entrega fue solicitado en un 40% de las licitaciones analizadas, el 25% de estas solicitudes adjunta documentación base para completar la información requerida, mientras que un 75% de estas solicitudes no se adjunta documentación base, siendo responsabilidad del Titular de Registro adjuntar un documento de formato y contenido propio para dar cumplimiento a lo requerido. Resoluciones de modificaciones al registro sanitario y Experiencia de uso en Chile, fueron solicitados en un 40% de las licitaciones analizadas no adjuntando documentación base, ya que en el caso del primer documento, el Titular de Registro Sanitario deberá adjuntar la documentación necesaria de acuerdo a lo aprobado bajo resolución del Instituto de Salud Pública para el producto involucrado; en el caso del segundo documento no se adjunta ya que es responsabilidad del Titular de Registro adjuntar un documento de formato y contenido propio para dar cumplimiento a lo requerido. Cumplimiento de Farmacovigilancia, fue solicitado en un 20% de las licitaciones analizadas no adjuntando documentación base ya que el Titular de Registro Sanitario deberá adjuntar la documentación necesaria de acuerdo con lo aprobado por el Instituto de Salud Pública para el producto involucrado. Carta Oferta, Folleto de información al profesional, Especificación de producto terminado (EPT), Certificación EMA/FDA, fueron solicitados en un 10% de las licitaciones analizadas, sin adjuntar documentación base ya que el Titular de Registro Sanitario deberá adjuntar la documentación necesaria de acuerdo con lo aprobado bajo resolución del Instituto de Salud Pública para el producto. 34.
(48) involucrado o adjuntar un documento de formato y contenido propio para dar cumplimiento a lo requerido. Lo anterior demuestra que el universo y diversidad de documentación dentro de los tres ejes (Administrativa, Técnica y Económica) que puede ser requerida no está definida de manera concreta para los establecimientos de salud, siendo de criterio de cada institución la documentación a solicitar como requisito para permitir la participación y posterior evaluación de la oferta enviada por parte del oferente, lo cual genera un inconveniente a la hora de determinar la cual es la documentación específica e idónea de incorporar en la base de datos regulatoria para licitaciones. En una primera instancia, el análisis anteriormente realizado sería utilizado para clasificar la información que sería incorporada a la Base de datos de acuerdo al porcentaje de frecuencia en que la documentación era solicitada, los documentos que eran solicitados en un mayor porcentaje serían los clasificados para ser incorporados en la elaboración de la Base de Datos, sin embargo, esa clasificación implicaría dejar fuera documentación técnica que pudiese ser útil y de relevancia en el proceso de participación a licitaciones de los diferentes establecimientos de Salud. Debido a lo anterior y a que las Bases de Licitaciones de los Establecimientos de Salud no se rigen por un formato único preestablecido, se decide en conjunto con Gerencia de Ventas, establecer como modelo de requerimiento a las bases de licitaciones establecidas por CENABAST, debido a que las licitaciones de CENABAST son el foco compañía y además, la información solicitada en ellas engloba lo requerido anteriormente, por lo que para obtener una visión más completa, no sólo se incluirán los documentos técnico-regulatorios, sino también los documentos administrativos y económicos que pueden ser requeridos en el proceso.. 35.
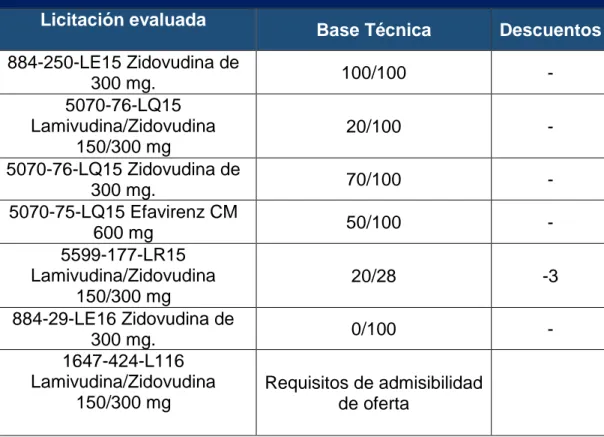
(49) Objetivo Específico N°3: Verificar cumplimiento Técnico-Regulatorio según lo establecido en las bases de licitación para los productos de Seven Pharma Chile S.p.A., en las licitaciones en las que la compañía había participado.. Para llevar a cabo este objetivo, se realiza una búsqueda en el portal de mercado público, se filtra la búsqueda por licitaciones históricas y luego por proveedor, ingresando Seven Pharma S.p.A., en la casilla indicada. Una vez obtenidas las licitaciones en las que la empresa había participado, se ingresa a cada una de ellas para analizar las actas de evaluación, y observar el desempeño que la compañía ha presentado en el ámbito Técnico-Regulatorio al postular a las licitaciones. Las licitaciones analizadas son: 1. 884-250-LE15 correspondiente a Servicio de Salud Metropolitano Sur Oriente. 2. 5070-76-LQ15 correspondiente a Hospital Dr. Lautaro Navarro Avaria. 3. 5070-75-LQ15 correspondiente a Hospital Dr. Lautaro Navarro Avaria. 4. 599-177-LR15 correspondiente a Central de Abastecimiento S.N.S.S. – CENABAST 5. 884-29-LE16 correspondiente a Servicio de Salud Metropolitano Sur Oriente. 6. 1647-424-L116 correspondiente a Servicio de Salud Iquique. Una vez que se ingresa al Acta de adjudicación, se descarga el acta de evaluación donde se detalla el desempeño anteriormente mencionado en el ámbito técnico, los resultados obtenidos por la compañía se observan en la tabla N°4.. 36.
(50) Tabla N°4: Puntajes obtenidos en las actas de evaluación de licitaciones en las que Seven Pharma S.p.A., había participado. PUNTAJES DE EVALUACIÓN DE LAS LICITACIONES POSTULADAS. Licitación evaluada 884-250-LE15 Zidovudina de 300 mg. 5070-76-LQ15 Lamivudina/Zidovudina 150/300 mg 5070-76-LQ15 Zidovudina de 300 mg. 5070-75-LQ15 Efavirenz CM 600 mg 5599-177-LR15 Lamivudina/Zidovudina 150/300 mg 884-29-LE16 Zidovudina de 300 mg. 1647-424-L116 Lamivudina/Zidovudina 150/300 mg. Base Técnica. Descuentos. 100/100. -. 20/100. -. 70/100. -. 50/100. -. 20/28. -3. 0/100. -. Requisitos de admisibilidad de oferta. En base a lo anterior, se observa que en la mayoría de las licitaciones se realizaron descuentos en la sección de Bases Técnicas, esto puede deberse a distintas razones, que se analizan a continuación: -. Licitación 884-250-LE15 - Zidovudina:. Si bien el puntaje obtenido corresponde al total en cada sección, se debe considerar que el aspecto técnico solicitado involucraba ofertar un producto bioequivalente o innovador [30], información que generalmente debe ser respaldada. En este caso no se pidió el respaldo de la información, sin embargo, en caso de haberlo requerido, no se contaba con un documento de respaldo emitido por la Autoridad Sanitaria que acreditara dicha condición, por lo que se hace necesario solicitar el certificado a la Autoridad o contar con la. 37.
Figure
![Figura 1: Volumen de operaciones de CENABAST en los últimos 4 años. [15]](https://thumb-us.123doks.com/thumbv2/123dok_es/7321752.452240/23.918.176.779.141.431/figura-volumen-operaciones-cenabast-últimos-años.webp)
Documento similar
Tejidos de origen humano o sus derivados que sean inviables o hayan sido transformados en inviables con una función accesoria.. Células de origen humano o sus derivados que
En la contrastación de las hipótesis de investigación se usaron pruebas paramétricas y no paramétrica previo análisis de la normalidad de los datos pretest y postest,
Proporcione esta nota de seguridad y las copias de la versión para pacientes junto con el documento Preguntas frecuentes sobre contraindicaciones y
d) que haya «identidad de órgano» (con identidad de Sala y Sección); e) que haya alteridad, es decir, que las sentencias aportadas sean de persona distinta a la recurrente, e) que
Ciaurriz quien, durante su primer arlo de estancia en Loyola 40 , catalogó sus fondos siguiendo la división previa a la que nos hemos referido; y si esta labor fue de
Las manifestaciones musicales y su organización institucional a lo largo de los siglos XVI al XVIII son aspectos poco conocidos de la cultura alicantina. Analizar el alcance y
En este sentido, puede defenderse que, si la Administración está habilitada normativamente para actuar en una determinada materia mediante actuaciones formales, ejerciendo
En la parte central de la línea, entre los planes de gobierno o dirección política, en el extremo izquierdo, y los planes reguladores del uso del suelo (urbanísticos y