Variabilidad ambiental, sistema reproductivo y respuestas fisiológicas a estrés hídrico : las herbáceas de la Cordillera de los Andes
Texto completo
(2) 2. A mi familia.
(3) 3. Agradecimientos La realización de esta tesis doctoral no hubiese sido posible sin la invaluable ayuda y apoyo de muchas personas durante todos estos años. Es difícil recapitular a cuantas personas les estoy profundamente agradecida por sus diversas contribuciones a esta tesis y a mi, a través de los años, pero lo intentaré. En primer lugar, debo agradecer a mis dos tutores Francisco Bozinovic y María Fernanda Pérez, por sus valiosos consejos, su paciencia y por la guía que durante tantos años me dieron y que me ayudó a forjarme como la científica que soy hoy. Pancho, gracias por tu buen humor, por tus consejos en todos los aspectos y por compartir tu invaluable experiencia de la manera mas generosa conmigo, me siento feliz de haber podido ser tu estudiante. Fefa, muchas gracias por tantas conversaciones, tu paciencia en ayudarme a corregir, una y otra vez, por ir mostrándome el camino cada vez que me desviaba hacia terrenos pantanosos. A ambos, muchas gracias por seguir ahí incluso en los momentos en los que me encontré más perdida. Durante mi doctorado, tuve la fortuna de formar parte no de uno, si no de tres laboratorios donde conocí gente maravillosa que me ayudó de muchas maneras diferentes. En el lab de “pancho” Bozinovic es donde encontré un hogar académico y me gustaría agradecer tanto por las herramientas y espacios otorgados para mi desarrollo, como también y más especialmente a todos mis compañeros, por tantos momentos compartidos, por que muchos fueron más que compañeros de trabajo, fueron un hombro donde llorar y también un espacio donde discutir ideas y la fuente de excelentes consejos, risas y calidad humana. Muchas gracias a las chicas “más grandes”, Fran, Sabri y Grisel por siempre darme los consejos mas asertivos, por mostrar empatía y comprensión en todo momento y por ser un ejemplo a seguir como mujeres en ciencias. También por supuesto al Cote por tantas conversaciones profundas compartiendo su experiencia y grandes consejos que ayudaron enormemente al desarrollo de esta tesis, Seba y Cotín, por su invaluable ayuda en distintos terrenos por una parte y por la linda amistad que siempre me han entregado, todos y todas las que conocí en con el paso de los años. También quisiera agradecer a todos los que conocí en el lab de la “Fefa”, Carmencha, Javi, mis queridas amigas “las potis” Dani e Isa, todos siempre me acogieron como en casa. Y como si eso no fuera suficiente, debo agradecer al lugar y personas con quienes pasé cinco meses en Madrid: el laboratorio de Fernando Valladares. A todos los amigos que hice allí, muchas gracias por acogerme con brazos abiertos y hacerme parte de un laboratorio genial, lleno de gente linda y unida y de excelentes científicos con los que tuve la suerte de conversar y aprender, me siento realmente afortunada de haber llegado a un lugar donde conocí personas como ustedes. Entre ellas, mi compañera de experimentos Cristina Crespo, con quien hicimos juntas nuestras tesis, nos apoyamos, acompañamos y formamos una hermosa amistad, así como también a Ali, Xandra, Jorge, Anita, Dulce, Borja, David, Alberto, por su acogida, su ayuda con el experimento, su.
(4) 4. compañerismo, y por todos los aportes y la experiencia que pude compartir y recibir de ustedes. Por supuesto debo agradecer también a Fernando Valladares de quien tuve el honor de aprender muchísimo y espero poder seguir haciéndolo en un futuro, Fernando, gracias por siempre tener las palabras adecuadas y por compartir toda tu experiencia y métodos que fueron claves en mi desarrollo doctoral. También quisiera agradecer a Pablo Marquet, Aurora Gaxiola, y Lohengrin Cavieres, miembros de mi comisión, por sus valiosos aportes y comentarios al desarrollo de esta tesis doctoral. Por otra parte, quiero agradecer a mis compañeras de doctorado, Vanessa y Nuria, por tanto, porque compartimos juntas este viaje, sufrimos juntas y nos alegramos juntas, crecimos como científicas y como personas y en este viaje no pude tener dos mejores compañeras, gracias por toda la ayuda, en todo sentido. Es para mi tremendamente importante agradecer a todos aquellos que durante estos años jamás dejaron de creer en mí, a mis amigos Fendy, Katty, Pili, Guti, Susan, Clau, Thais, Paul, Edmundo, Felipe, Seba, y a especialmente a mi pololo, Jorge. Es verdad que un doctorante necesita formación y consejo de pares, pero, es igual de importante el apoyo y la fe, de aquellos que siempre estuvieron a tu lado, creyendo en ti cuando ni siquiera tú lo hacías, a ellos gracias por verme muchas veces de maneras en las que yo no podía y por darme esa fuerza enorme que viene del apoyo y del inmenso cariño genuinos y verdaderos. Y por último quisiera agradecer de todo corazón a mi familia, a mi hermana Chio, a Max, a mi lela, a mis tíos de chile y también los de España, Jesús y Flor, a mis primos, y especialmente a mis padres, sin ellos nada de esto hubiese sido posible. Claudia y José Antonio, ustedes son mi roca, mi pilar, mi todo, sin su amor y apoyo incondicional desde que era una pequeña niñita llena de sueños, jamás podría haber llegado aquí, los amo con todo mi corazón, muchas gracias. Este trabajo fue financiado por el programa de becas de doctorado nacional de CONICYT, beca Nº. 21110426, el experimento de invernadero de esta tesis fue también financiado por el laboratorio del Dr. Fernando Valladares, Agradezco al Center of Applied Ecology and Sustainability (CAPES) la oportunidad de realizar esta investigación y a CONICYT PIA/BASAL FB0002 por el financiamiento también a IEB (Instituto de Ecología y Biodiversidad). Esta tesis doctoral fue realizada también gracias al apoyo del Departamento de Ecología de la Pontificia Universidad Católica de Chile. A todos, gracias de todo corazón..
(5) 5. INDICE DE MATERIAS TESIS DOCTORAL.......................................................................................................................... 1 VARIABILIDAD AMBIENTAL, SISTEMA REPRODUCTIVO Y RESPUESTAS FISIOLÓGICAS A ESTRÉS HÍDRICO: LAS HERBÁCEAS DE LA CORDILLERA DE LOS ANDES............................................................................................................................................... 1 AGRADECIMIENTOS..................................................................................................................... 3 INDICE DE FIGURAS ..................................................................................................................... 7 INDICE DE TABLAS ....................................................................................................................... 8 LISTA DE ABREVIATURAS .......................................................................................................... 9 RESUMEN ...................................................................................................................................... 10 ABSTRACT..................................................................................................................................... 11 INTRODUCCION GENERAL ....................................................................................................... 12 REFERENCIAS .............................................................................................................................. 22 CAPITULO I ................................................................................................................................... 30 SELFING AND DROUGHT TOLERANCE IN A WARMING WORLD: BALANCE AND FUTURE CHANGES FOR TWO HERBACEOUS SPECIES IN THE SOUTH AMERICAN ANDES............................................................................................................................................. 30 ABSTRACT .................................................................................................................................................................................. 32 Premise of the study............................................................................................................................................................................. 32 Methods ................................................................................................................................................................................................... 32 Key results .............................................................................................................................................................................................. 32 Conclusions............................................................................................................................................................................................ 32. INTRODUCTION ......................................................................................................................................................................... 33 MATERIALS AND METHODS ................................................................................................................................................... 36 Study Species ......................................................................................................................................................................................... 36 Common garden experimental design ........................................................................................................................................... 38 Physiological and morphological measurements ....................................................................................................................... 40 Statistical analysis ................................................................................................................................................................................ 41. RESULTS ...................................................................................................................................................................................... 42 Performance traits ............................................................................................................................................................................... 42 Physiological and water economy traits ........................................................................................................................................ 43 Morphological leaf traits.................................................................................................................................................................... 44. DISCUSSION ................................................................................................................................................................................ 44 LITERATURE CITED ................................................................................................................................................................. 50 APPENDICES ............................................................................................................................................................................... 59 Appendix 1.............................................................................................................................................................................................. 59 Appendix 2.............................................................................................................................................................................................. 60. CAPITULO II ................................................................................................................................. 65 ENVIRONMENTAL VARIABILITY, PHENOTYPIC PLASTICITY AND SELFING IN TWO ANDEAN HERBACEOUS SPECIES............................................................................................. 65 ABSTRACT .................................................................................................................................................................................. 67 INTRODUCTION ......................................................................................................................................................................... 68 MATERIALS AND METHODS .................................................................................................................................................. 71 Study Species ......................................................................................................................................................................................... 71.
(6) 6. Seed collection....................................................................................................................................................................................... 72 Common garden experimental design ........................................................................................................................................... 73 Physiological and morphological measurements ....................................................................................................................... 74 Data Analysis......................................................................................................................................................................................... 75. RESULTS ...................................................................................................................................................................................... 78 Quantitative genetic variation estimation and relationship with selfing rate.................................................................... 78 Estimation of plasticity and its relationship with selfing ......................................................................................................... 79 Variable vs. chronic drought treatments....................................................................................................................................... 79 Selfing and genetic variation............................................................................................................................................................ 81 Responses to treatments: Phenotypic plasticity and differences between chronic and variable drought treatments. .................................................................................................................................................................................................................... 82. CONCLUSIONS ........................................................................................................................................................................... 87 LITERATURE CITED ................................................................................................................................................................. 89. CONCLUSIONES GENERALES ................................................................................................ 106.
(7) 7. INDICE DE FIGURAS INTRODUCCIÓN GENERAL FIGURA A…………………………………………………………………………………………………………...21. CAPITULO I FIGURE 1......................................................................................................................................................... 62 FIGURE 2......................................................................................................................................................... 63 FIGURE 3......................................................................................................................................................... 64. CAPITULO II FIGURE 1. ...................................................................................................................................................... 102 FIGURE 2. ...................................................................................................................................................... 103 FIGURE 3. ...................................................................................................................................................... 103 FIGURE 4. ...................................................................................................................................................... 105.
(8) 8. INDICE DE TABLAS. CAPITULO I TABLE I................................................................................................................................ 54 TABLE II. ............................................................................................................................. 55 TABLE III. ............................................................................................................................ 56 TABLE IV ............................................................................................................................. 57 TABLE V .............................................................................................................................. 58 TABLE S1: ............................................................................................................................ 59 TABLE S2: ............................................................................................................................ 60 CAPITULO II TABLE I ................................................................................................................................ 97 TABLE II .............................................................................................................................. 98 TABLE III ............................................................................................................................. 99.
(9) 9. LISTA DE ABREVIATURAS. PAR: Photosynthetic active radiation RGR: Relative Growth Rate SLA: Specific Leaf Area SWC: Soil Water Content iWUE: Instantaneous Water Use efficiency.
(10) 10. RESUMEN. Las angiospermas presentan una alta diversidad en sus sistemas reproductivos, los cuales incluyen sistemas de predominante auto-fertilización (autogamia), de fertilización cruzada exclusiva y sistemas de reproducción mixtos. Si bien la auto-fertilización puede tener consecuencias negativas en las poblaciones, se ha propuesto que las plantas que poseen autogamia tienen, además, asociados ciertos rasgos fenotípicos y de historia de vida relacionados con una estrategia de escape a la sequía. Además, existe debate acerca de cual es la relación entre variabilidad genética y plasticidad. En un contexto de cambio climático, donde las tasas de sequía, se espera, aumenten en conjunto con un aumento en la variabilidad climática y la presencia de eventos extremos, cabe preguntarse cual es la relación entre las tasas de autogamia y, tanto la expresión, como la plasticidad fenotípica de rasgos de tolerancia o evasión al estrés hídrico. Por lo tanto, los principales objetivos de esta tesis fueron: Evaluar la posible relación entre tasa de auto fertilización y tolerancia o evasión a la sequía. Evaluar de manera general la relación entre auto fertilización y varianza genética aditiva de las poblaciones. Evaluar la relación entre tasa de auto fertilización y plasticidad fenotípica para rasgos relacionados con tolerancia o evasión a la sequía. Y evaluar el efecto de un tratamiento de sequía variable versus crónico en los rasgos de tolerancia o evasión a la sequía. Para esta tesis, además, se consideraron dos especies con estrategias evolutivas diferentes de autogamia de manera de poder evaluar posibles diferencias entre ellas. Se examinaron rasgos relacionados con escape y/o tolerancia a la sequía en dos especies nativas alto andinas del género Schizanthus: S. hookeri, especie auto compatible, hercógama, dependiente de polinizadores; y S. grahamii, especie autocompatible con autogamia tardía e independiente de polinizadores. A través de un experimento de jardín común, estimamos rasgos de desempeño, fisiología y morfología en siete poblaciones de ambas especies con distintos niveles de autogamia, expuestas a dos tratamientos hídricos contrastantes por un lado y luego a un tercero donde hubo diferencias en la variabilidad hídrica. Nuestros resultados muestran que la sobrevivencia en el tratamiento de sequía disminuye con la tasa de auto-fertilización, indicando una menor tolerancia en estas poblaciones. Por otro lado, nuestros resultados también sugieren una relación entre plasticidad y tasas de autogamia. Este estudio cobra una mayor importancia dadas las proyecciones de los modelos de cambio climático, los cuales predicen un aumento en la sequía en la zona alto andina central, donde se distribuyen las especies estudiadas. Esto podría combinarse de forma sinérgica con otros factores que favorezcan el aumento de las tasas de auto-fertilización en estas poblaciones, como, por ejemplo, una disminución en los polinizadores disponibles o en los tamaños poblacionales..
(11) 11. ABSTRACT Angiosperms present a high diversity of reproductive systems, including predominant selffertilization (selfing), exclusive outcrossing and mixed mating systems. Even though selfing can have negative consequences on natural populations, it has been proposed that plants having a predominantly selfing strategy are also associated with certain phenotypic and life history traits related to a drought escape strategy. Also, there is debate about the relationship between genetic variability and plasticity. In a climate change context, where drought rates are expected to increase along with an increase in climatic variability and the presence of extreme events, we should ask about the relationship between selfing rates and both the expression of phenotypic plasticity and drought tolerance or avoidance traits. Therefore, the main goals of this thesis were: To assess the possible relationship between selfing rate and drought tolerance or avoidance. To assess in general terms, the relationship between selfing and additive genetic variance on natural populations. To assess the relationship between selfing rate and phenotypic plasticity for traits related to drought tolerance or avoidance. And to assess the effect of a variable drought treatment versus a chronic drought treatment on traits related to drought tolerance or avoidance. Two species with distinct evolutionary strategies for selfing were considered, in order to evaluate possible differences among them. Traits related with drought avoidance and/or tolerance were examined in two species native of the high Andes belonging to the Schizanthus genus: S. hookeri, self-compatible, presenting hercogamy and dichogamy and dependent of pollinators; and S. grahamii, self-compatible with delayed selfing and independent of pollinators. Using a common garden experiment, traits related to performance, physiology and morphology on six and seven populations of both species with different levels of selfing were assessed. They were exposed to two constant watering treatments (low and high) on one hand, and on the other, to a third with differences on hydric variability. Results showed that survival on the drought treatment is lower with higher selfing rates, indicating low drought tolerance in these populations. On the other hand, our results also suggest a relationship between plasticity and selfing rates. This study gets importance considering the existing projections of climate change models, which predict an increase in drought conditions on the high Andes of central Chile, where the study species have their distribution. This could combine in a synergistic way with other factors that favor an increase in selfing rates in these populations, for example, a decrease on pollinator availability or on population size..
(12) 12. INTRODUCCION GENERAL. Dentro de los sistemas reproductivos en plantas, particularmente en las angiospermas, la transición desde un sistema de fertilización cruzada a un sistema de autofertilización o autogamia ha sido la más común en la evolución de este grupo (Goodwillie et al., 2005, Stebbins 1974). Un 20% de las angiospermas poseen autogamia frecuente y un 41% de ellas un sistema mixto donde la autogamia es posible (Dudley, 2012; Goodwillie, 2005; Jordan & Otto, 2012). De este 60% potencialmente autógamo, existe autogamia independiente de polinizadores, donde es posible encontrar, por ejemplo, sistemas de fertilización tardía, donde las anteras tocan el estigma al final de la temporada, asegurando así la reproducción cuando la polinización no fue posible. Por otra parte, en la dependiente de polinizadores, las especies autocompatibles, no son mecánicamente capaces de autopolinizarse sin la intervención de un polinizador que puede visitar mas de una vez la misma flor, o más de una flor en la misma planta (e.g. Pérez et al. 2009). En términos generales, una amplia variedad de estudios ha descrito las ventajas y desventajas asociadas a la autogamia. Por un lado las ventajas principales de éste sistema reproductivo radican en la seguridad reproductiva, lo cual les permite ser independientes de la presencia de otros individuos en el ambiente y de la polinización (Baker 1955; Stebbins 1957; Lloyd, 1992; Fausto & Eckhart, 2001; Kalisz et al. 2004; Moeller and Geber, 2005; Snell & Aarssen, 2005; Eckert et al., 2010 e Ivey & Carr, 2011; Dudley et al., 2012; Pérez et al., 2013) y la selección automática, mecanismo mediante el cual los genes autógamos tienen una mayor posibilidad de ser seleccionados en la siguiente generación (Fisher, 1941; Schoen & Morgan, 1996; Harder & Wilson, 1998; Aarssen, 2000). Es por ello que la autogamia se ha observado predominantemente.
(13) 13. en especies que colonizan nuevos ambientes como malezas, herbáceas, y plantas anuales (Lloyd, 1980; Barret et al, 1997; Aarsen, 2000). Por otro lado, los biólogos evolutivos se han preguntado si este sistema reproductivo es un callejón sin salida evolutivo (Stebbins, 1957, 1974; Grant, 1958, Wyatt, 1988; Takebashi, 2001; Igic & Busch, 2013), ya que genera una serie de desventajas genéticas, como son:la depresión por endogamia y la disminución de la variación genética poblacional. Esto podría disminuir el potencial adaptativo y a la vez aumentar la vulnerabilidad a extinciones (Stebbins, 1957; Herlihy & Eckert, 2002; Leimu, 2006; Wright et al. 2007; Thiele, 2010; Dudley et al. 2012). En efecto, se ha descrito que la habilidad de responder a nuevos desafíos selectivos se relaciona con la mantención de variabilidad genética (Falconer, 1989, p.128). Uno de los nuevos desafíos selectivos es el cambio global pues impone una serie de amenazas antropogénicas que además interactúan entre sí de manera no aditiva y que tradicionalmente han sido estudiadas de manera separada (Vitousek, 1997; Matesanz et al., 2009; Reed et al., 2012). Entre estas amenazas, existen dos importantes que afectan particularmente a las plantas polinizadas por animales y que podrían afectar tanto su sobrevivencia, como la evolución de sus sistemas reproductivos. Ellas son el cambio climático y la pérdida de diversidad biológica. El cambio climático está y continuará causando cambios en los patrones climáticos de manera global, tales como disminuciones en las precipitaciones o aumento de la desertificación en ciertas zonas del planeta. Estos cambios se proyectan tanto para zonas de valles como para la alta montaña y se espera consecuentemente, un aumento en la sequía en estos ambientes (IPCC, 2012). Aproximaciones teóricas y empíricas indican que el cambio climático impacta tanto las medias de ambientes locales como también la magnitud de la variación anual y estacional (Easterling et al., 2000; Vázquez et al. 2017). Se ha propuesto que este aumento esperado de la.
(14) 14. frecuencia de condiciones ambientales extremas tendrá un impacto incluso mayor en la biodiversidad que los cambios en las condiciones medias (Coumou and Rahmstorf, 2012). Muchos de los modelos que actualmente intentan predecir las respuestas de la biodiversidad a estos cambios rápidos, no poseen una incorporación explícita de variabilidad en ellos, tanto en las condiciones climáticas afectando a los organismos (Vázquez et al. 2017), como también en la posible respuesta variable de los mismos a los cambios ambientales (Nicotra et al. 2010; Chevin et al. 2010). En resumen, se ha prestado muy poca atención a los impactos potenciales que los cambios en variabilidad y extremos climáticos podrían tener en las poblaciones naturales (Vazquez et al. 2017). Por otro lado, se ha descrito que diversos cambios antropogénicos tales como las invasiones biológicas, la fragmentación y la pérdida de hábitat, causarán una disminución en las poblaciones de polinizadores, así como también un desajuste entre los rangos de distribución y fenología de estos y plantas, todo lo cual disminuye su disponibilidad para las poblaciones vegetales (Arroyo et al., 2006; Leimu et al., 2010; Eckert et al., 2010). La combinación de estas dos amenazas implica que, en muchas especies auto compatibles, la frecuencia de autogamia aumentará (Hauser & Loeschcke, 1996; Aguilar et al. 2008; Reed et al., 2012), y las consecuencias de este cambio podrían alterar el balance entre las ventajas y desventajas de ésta. En este contexto, evaluar la interacción entre el aumento de autogamia y el cambio climático en las poblaciones vegetales, podría permitir una mejor comprensión de cómo las plantas polinizadas por animales con sistemas reproductivos mixtos responderán a cambios ambientales futuros. En consecuencia, la pregunta central de este trabajo es: ¿Cómo afectarán los cambios en variabilidad ambiental a las plantas con tasas de autogamia creciente?.
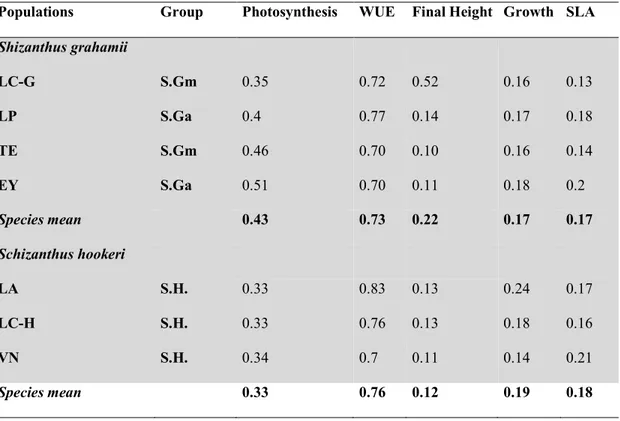
(15) 15. Estudiando el estrés hídrico como variable de cambio climático a evaluar, esta pregunta será abordada a partir de dos principales enfoques: 1) el primer enfoque, aborda las estrategias fisiológicas para enfrentar el estrés hídrico y 2) el segundo evalúa como se verá afectada la variabilidad genética de las poblaciones y también el rol que pudiera jugar la plasticidad fenotípica en estos procesos en un ambiente con una creciente variabilidad climática. Con respecto al primer enfoque, históricamente, se han dividido las adaptaciones que confieren resistencia a la sequía en plantas en tres estrategias alternativas: escape a la sequía, evasión a la deshidratación y tolerancia a la sequía (Ludlow, 1989; Kooyers, 2015). En el extremo de escape a sequía, esta estrategia consiste en una evasión temporal, donde las plantas se desarrollan rápidamente y se reproducen antes de que la sequía sea extrema, de tal forma que a la llegada del máximo momento de estrés hídrico, la planta ya haya realizado todo su ciclo (Dudley et al. 2015; Kooyers, 2015; Emms et al. 2018). En el otro extremo, la tolerancia a la sequía se basa en la presencia de mecanismos fisiológicos y de ajuste osmótico, que permiten a la planta sobrevivir en los momentos donde la sequía es máxima. Es por ello que una estrategia de escape se asocia a fenotipos de crecimiento rápido, florecimiento temprano, capacidad fotosíntetica alta y tasas de intercambio gaseoso también altas, pero una menor eficiencia en el uso del agua. Las estrategias de evasión de la deshidratación y tolerancia a la sequía logran mantener sus tasas fotosintéticas bajo estrés hídrico aumentando su eficiencia en el uso del agua, disminuyendo su conductancia estomática y desarrollando mecanismos de ajuste osmótico (Kooyers, 2015, Fig 1). Se ha propuesto que autogamia y fisiología de escape a la sequía (dada por un ciclo de vida más rápido), podrían haber evolucionado en conjunto (Dudley et al, 2015; Ivey et al, 2016; Emms et al. 2018). Esto implicaría que taxa mas autógamos tendrían asociados rasgos de fisiología de.
(16) 16. escape como los antes mencionados (Mazer et al. 2010). Esta relación ha sido descrita como una tercera hipótesis que ha permitido la evolución de la autogamia, particularmente en plantas anuales: la hipótesis de la limitación temporal, y propone que el mecanismo mediante el cual la autogamia esté conectada evolutivamente a una estrategia fisiológica de escape a la sequía es que ambas tienen asociada una limitación temporal, es decir en ambas el ciclo de vida es más corto (Elle et al 2010). Esta correlacion entre rasgos de escape y tasas de autogamia, se ha observado en algunos géneros de plantas anuales (Dudley et al 2015, Ivey et al. 2016; Emms et al. 2018), (Fig A). Por otro lado, en un escenario futuro donde la sequía podría adelantarse en la temporada, es posible que una estrategia de escape no permita a las plantas evadir completamente el momento de mayor sequía, y se vean igualmente expuestas a un déficit hídrico antes de completar su ciclo de vida. Entonces, cabe preguntarse si, plantas con una alta tasa de autogamia, que se postula podría estar relacionada con fisiología de escape a la sequía, tendrán mayor o menor capacidad de evadir deshidratación o tolerar sequía, ya que se ha propuesto que estas estrategias evolucionan de manera alternativa dados los compromisos fisiológicos que implica tener una u otra (Grime, 1977; Ackerly et al. 2000; Kooyers, 2015), (Fig A). Dentro de la perspectiva de las estrategias fisiológicas entonces, la principal pregunta que se aborda en esta tesis es la siguiente: ¿Existe una asociación entre el sistema reproductivo y rasgos fisiológicos y de historia de vida asociados a escape a la sequía? Y si esto es así ¿Serán los taxa autógamos más vulnerables a una sequía mas temprana y prolongada? Con respecto a ello, planteamos la siguiente predicción: Si existe una asociación entre sistema reproductivo y una fisiología de escape a la sequía, entonces plantas con mayores tasas de autogamia expresarán mayores tasas de intercambio gaseoso en condiciones sin estrés hídrico y una disminución.
(17) 17. mayor en fotosíntesis en condiciones de estrés hídrico, que aquellas que tengan tasas menores de autogamia. A su vez, la eficiencia en el uso del agua en condiciones de estrés hídrico será menor a mayores tasas de autogamia. Todo ello reflejando una menor capacidad de evadir deshidratación por parte de las poblaciones con mayor autogamia. Con respecto al segundo enfoque abordado en esta tesis, la pregunta es ¿Qué ocurre en ambientes variables como los impuestos por el cambio global, donde poblaciones con una baja variabilidad genética podrían tener un potencial adaptativo reducido? (Fig A). La plasticidad fenotípica, definida como la habilidad de un genotipo de expresar diferentes fenotipos de acuerdo al ambiente (Pigliucci et al., 1996), podría ser beneficiosa para poblaciones que poseen una variabilidad genética reducida, ya que ha sido descrita como un importante mecanismo por el cual estas poblaciones podrían expresar nuevos fenotipos que maximizarán su adecuación biológica (Hermanutz & Weaver, 1995; DeWitt et al.1998; Sultan, 2000; Alpert & Simms, 2002; Nicotra et al. 2010). Frente a cambios rápidos en su ambiente, se ha propuesto que las especies pueden responder a través de dos mecanismos principales de manera de evitar extinciones locales: Plasticidad fenotípica y/o adaptación local rápida (Nicotra et al. 2010, Chevin & Hoffman, 2017). Por lo tanto, el estudio de estos dos mecanismos es central para comprender la evolución de las especies en ambientes heterogéneos (Pigliucci et al., 1997; Alpert & Simms, 2002; Gianoli & González-Teuber, 2005, Valladares et al. 2007, Chevin & Hoffmann 2017) y es también crucial para predecir su vulnerabilidad al cambio climático (Nicotra et al., 2010). Al respecto, se ha propuesto que plasticidad fenotípica y adaptación local son antagonistas (Bradshasw 1965; Sultan, 2000) y de acuerdo a ello, diversos estudios han encontrado que especies o poblaciones que poseen una variabilidad genética menor, muestran mayor plasticidad fenotípica (Jain, 1979; Grant, 1975; Hermanutz & Weaver, 1995; Williams.
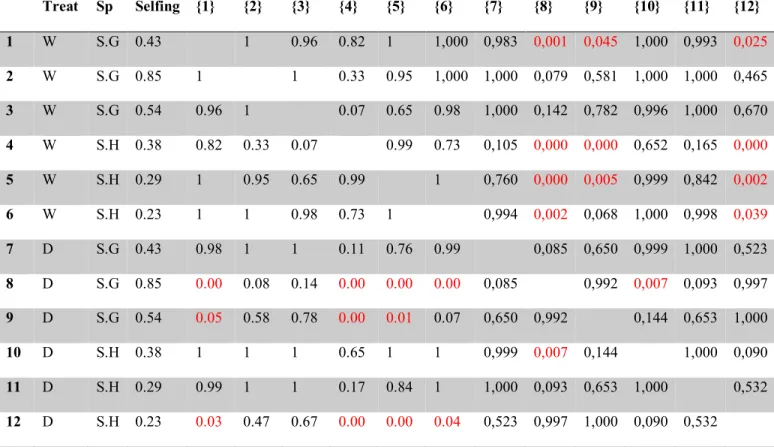
(18) 18. et al., 1995; Sultan 2000; pero ver Scheiner and Goodnight, 1983). Este podría ser el caso de plantas con altas tasas de autogamia, que podrían responder a estrés a través de plasticidad fenotípica, dado que poseen una menor varianza genética. Por otro lado, se ha descrito que una gran heterogeneidad espaciotemporal evita que las plantas puedan seguir señales ambientales y desarrollar mecanismos de protección frente a la sequía, lo cual las podría hacer más vulnerables en ambientes variables que en otros más predecibles (Valladares et al. 2007; C. Bastias et al., 2018). En esta situación, la plasticidad fenotípica podría ser importante ya que permitiría enfrentar la creciente impredictibilidad de las anomalías climáticas (Vázquez et al. 2017). Sin embargo, también se ha propuesto que una heterogeneidad espacio temporal demasiado grande podría exceder el umbral sobre el cual una respuesta plástica puede no ser beneficiosa para las plantas y puede no compensar sus costos (Alpert & Simms, 2002). Dentro de este marco (Fig A), la pregunta entonces fue: ¿Existe una relación entre autogamia, varianza genética y plasticidad de rasgos asociados a respuestas a sequía? Frente a esta pregunta se predicie que (1) La proporción de varianza genética para las poblaciones con altas tasas de autogamia será menor debido a la pérdida de variabilidad causada por la endogamia, (2) Alternativamente, poblaciones con mayores tasas de autogamia mostrarán mayor plasticidad, ya que se ha propuesto que ésta puede ser una alternativa para la mantención de poblaciones con baja variabilidad genética. Finalmente, se aborda si existe una relación entre autogamia y diferencias en la respuesta a estrés hídrico variable versus crónico. Frente a ello la predicción fue que, dado que una alta heterogeneidad ambiental puede superar los límites en la respuesta fenotípica dada por la.
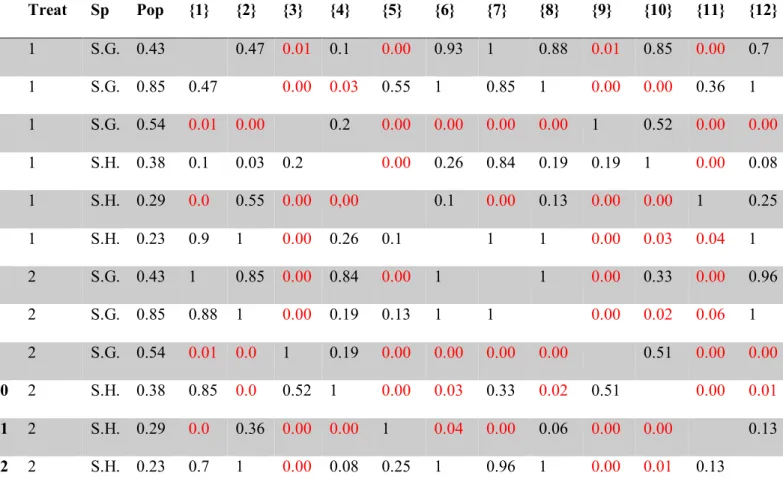
(19) 19. plasticidad, se espera que en poblaciones con mayor autogamia, la magnitud de la respuesta a la sequía variable sea menor que a la crónica. Para responder estas preguntas, se usaron poblaciones de dos especies herbáceas anuales y bianuales del género Schizanthus: Schizanthus hookeri y Schizanthus grahamii que crecen en la cordillera de los Andes en Chile central. Ambas especies de Schizanthus son autocompatibles, pero solo S. grahamii tiene la capacidad de una autogamia autónoma, es decir, sin la intervención de polinizadores (Pérez et al., 2009). La autogamia en S. grahamii ocurre después de que ha pasado la oportunidad de ser polinizada, una estrategia conocida como autogamia tardía, y varía fuertemente con la disponibilidad de polinizadores. S. hookeri también es auto-compatible, pero muestra hercogamia y dicogamia y, por lo tanto, requiere polinizadores para la formación de semillas. Las tasas de autogamia varían fuertemente entre las poblaciones de estas dos especies de Schizanthus, con valores que van desde 0.23 a 0.93. Es muy posible que estas tasas de autogamia pudieran incrementar al reducirse el tamaño poblacional y la disponibilidad de polinizadores (Pérez et al., 2013). Todo ello hace de estas poblaciones un buen modelo de estudio para evaluar la interacción entre autogamia y rasgos fisiológicos relacionados con sequía y responder las preguntas planteadas en esta tesis. De acuerdo a lo anteriormente descrito y en resumen, los principales objetivos de esta tesis fueron los siguientes: (1) Evaluar si la tasa de autogamia se encuentra relacionada a una estrategia específica de resistencia a sequía (escape, evasión a la deshidratación o tolerancia) (2) Evaluar si la tasa de autogamia se encuentra relacionada a una disminución en la variación genética de rasgos relacionados con sequía.
(20) 20. (3) Evaluar si la tasa de autogamia se encuentra relacionada a una mayor plasticidad de estos rasgos (4) Evaluar la relación entre tasa de autogamia y respuesta a sequías crónica y variable.
(21) 21. Figura A. Cambio climático. Favorece. CAPITULO 2. Habitat extremos, efímeros o variables Favorece. Selección indirecta. Favorece. Ciclos de vida cortos Hipotesis de la limitación temporal. Estrategia de escape a la sequía. Compromisos. Estrategias de tolerancia a sequía o evasión de la deshidratación. Correlato por limitacion temporal. Favorece. Evolución de sistemas reproductivos autógamos. CAPITULO 2 Afecta. Variabilidad genética Plasticidad fenotípica Afectan. CAPITULO 1. Vulnerabilidad a cambios ambientales bruscos.
(22) 22. REFERENCIAS Aarssen LW. 2000. Why are most selfers annuals? A new hypothesis for the fitness benefit of selfing. Oikos 89: 606–612. Ackerly, D. D., Dudley, S. A., Sultan, S. E., Schmitt, J., Coleman, J. S., Linder, C. R., ... & Lechowicz, M. J. (2000). The Evolution of Plant Ecophysiological Traits: Recent Advances and Future Directions: New research addresses natural selection, genetic constraints, and the adaptive evolution of plant ecophysiological traits. Aibs Bulletin, 50(11), 979-995. Aguilar, R., Quesada, M., Ashworth, L., Herrerias-Diego, Y. V. O. N. N. E., & Lobo, J. (2008). Genetic consequences of habitat fragmentation in plant populations: susceptible signals in plant traits and methodological approaches. Molecular ecology, 17(24), 5177-5188. Alpert, P., & Simms, E. L. (2002). The relative advantages of plasticity and fixity in different environments: when is it good for a plant to adjust? Evolutionary Ecology, 16(3), 285-297. Arroyo, M. T., Muñoz, M. S., Henríquez, C., Till-Bottraud, I., & Pérez, F. (2006). Erratic pollination, high selfing levels and their correlates and consequences in an altitudinally widespread above-tree-line species in the high Andes of Chile. Acta Oecologica, 30(2), 248257. Baker, H. G. (1955). Self-compatibility and establishment after ‘“long-distance” dispersal. Evolution, 9(3), 347-349. Bradshaw, A. D. (1965). Evolutionary significance of phenotypic plasticity in plants. In Advances in genetics (Vol. 13, pp. 115-155). Academic Press Charlesworth and.
(23) 23. Charlesworth, D., & Charlesworth, B. (1987). Inbreeding depression and its evolutionary consequences. Annual review of ecology and systematics, 18(1), 237-268. Chevin, L. M., & Hoffmann, A. A. (2017). Evolution of phenotypic plasticity in extreme environments. Philosophical Transactions of the Royal Society of London B: Biological Sciences, 372(1723), 20160138. Chevin, L. M., Lande, R., & Mace, G. M. (2010). Adaptation, plasticity, and extinction in a changing environment: towards a predictive theory. PLoS biology, 8(4), e1000357. Coumou, D., & Rahmstorf, S. (2012). A decade of weather extremes. Nature climate change, 2(7), 491. DeWitt, T. J., Sih, A., & Wilson, D. S. (1998). Costs and limits of phenotypic plasticity. Trends in ecology & evolution, 13(2), 77-81. Dierks A, Baumann B, Fischer K. 2012. Response to selection on cold tolerance is constrained by inbreeding. Evolution 66: 2384-2398. Dudley LS, Hove AA, Emms SK, Verhoeven AS, Mazer SJ. 2015. Seasonal changes in physiological performance in wild Clarkia xantiana populations: Implications for the evolution of a compressed life cycle and self-fertilization. American Journal of Botany 102: 962-972. Dudley L, Hove A, Mazer S. 2012. Physiological performance and mating system in Clarkia (Onagraceae): Does phenotypic selection predict divergence between sister species? American Journal of Botany 99: 488–507. Easterling, D. R., Meehl, G. A., Parmesan, C., Changnon, S. A., Karl, T. R., & Mearns, L. O. (2000). Climate extremes: observations, modeling, and impacts. Science, 289(5487), 20682074..
(24) 24. Eckert, C. G., Kalisz, S., Geber, M. A., Sargent, R., Elle, E., Cheptou, P. O., ... & Porcher, E. (2010). Plant mating systems in a changing world. Trends in Ecology & Evolution, 25(1), 35-43. Elle, E., Gillespie, S., Guindre-Parker, S., & Parachnowitsch, A. L. (2010). Variation in the timing of autonomous selfing among populations that differ in flower size, time to reproductive maturity, and climate. American Journal of Botany, 97(11), 1894-1902. Emms, S. K., Hove, A. A., Dudley, L. S., Mazer, S. J., & Verhoeven, A. S. (2018). Could seasonally deteriorating environments favour the evolution of autogamous selfing and a drought escape physiology through indirect selection? A test of the time limitation hypothesis using artificial selection in Clarkia. Annals of botany, 121(4), 753-766. Fausto JA, Eckhart VM. 2001. Reproductive assurance and the evolutionary ecology of selfpollination in Clarkia xantiana (Onagraceae). American Journal of Botany 88: 1794-1800 Fisher RA. 1941. Average excess and average effect of a gene substitution. Annals of Eugenics 11: 53-63. Fuenzalida, H., Falvey, M., Rojas, M., Aceituno, P., & Garreaud, R. (2006). Estudio de la variabilidad climática en Chile para el siglo XXI. Informe para CONAMA. Gianoli, E., & González-Teuber, M. (2005). Environmental heterogeneity and population differentiation in plasticity to drought in Convolvulus chilensis (Convolvulaceae). Evolutionary Ecology, 19(6), 603-613. Goodwillie C, Kalisz S, Eckert CG. 2005. The evolutionary enigma of mixed mating systems in plants: occurrence, theoretical explanations, and empirical evidence. Annual Review of Ecology, Evolution and Systematics, 47–79..
(25) 25. Grant, V. (1958, January). The regulation of recombination in plants. In Cold Spring Harbor Symposia on Quantitative Biology (Vol. 23, pp. 337-363). Cold Spring Harbor Laboratory Press. Grant, M. C. (1975). Genetic properties of ecologically marginal populations of Anthoxanthum odoratum. (Doctoral dissertation, Duke University). Grime, J. P. (1977). Evidence for the existence of three primary strategies in plants and its relevance to ecological and evolutionary theory. The American Naturalist, 111(982), 11691194. Harder LD, Wilson WG. 1998. A clarification of pollen discounting and its joint effects with inbreeding depression on mating system evolution. The American Naturalist 152: 684-695. Hauser TP, Loeschcke V. 1996. Drought stress and inbreeding depression in Lychnis floscuculi (Caryophyllaceae). Evolution: 1119–1126. Herlihy C, Eckert C. 2002. Genetic cost of reproductive assurance in a self-fertilizing plant. Nature 416: 320-323. Hermanutz, L. A., & Weaver, S. E. (1996). Agroecotypes or phenotypic plasticity? Comparison. of. agrestal. and. ruderal. populations. of. the. weed. Solanum. ptycanthum. Oecologia, 105(2), 271-280. Heschel MS, Riginos C. 2005. Mechanisms of selection for drought stress tolerance and avoidance in Impatiens capensis (Balsaminaceae). American Journal of Botany 92: 37-44 Heschel MS, Sultan SE, Glover S, Sloan D. 2004. Population differentiation and plastic responses to drought stress in the generalist annual Polygonum persicaria. International Journal of Plant Sciences. 165: 817-824.
(26) 26. Igic, B., & Busch, J. W. (2013). Is self-fertilization an evolutionary dead end? New Phytologist, 198(2), 386-397. Ivey, C. T., & Carr, D. E. (2011). Tests for the joint evolution of mating system and drought escape in Mimulus. Annals of Botany, 109(3), 583-598. Jain, S. (1979). Adaptive strategies: polymorphism, plasticity, and homeostasis. In Topics in plant population biology (pp. 160-187). Palgrave, London. Jordan, C. Y., & Otto, S. P. (2012). Functional pleiotropy and mating system evolution in plants: frequency-independent mating. Evolution: International Journal of Organic Evolution, 66(4), 957-972. Kalisz, S., Vogler, D. W., & Hanley, K. M. (2004). Context-dependent autonomous selffertilization yields reproductive assurance and mixed mating. Nature, 430(7002), 884. Kooyers, N. J. (2015). The evolution of drought escape and avoidance in natural herbaceous populations. Plant Science, 234, 155-162. Leimu, R., Mutikainen, P. I. A., Koricheva, J., & Fischer, M. (2006). How general are positive relationships between plant population size, fitness and genetic variation? Journal of Ecology, 94(5), 942-952. Leimu, R., Vergeer, P., Angeloni, F., & Ouborg, N. (2010). Habitat fragmentation, climate change, and inbreeding in plants. Annals of the New York Academy of Sciences, 1195(1), 8498. Lloyd DG. 1992. Self-and cross-fertilization in plants. II. The selection of self-fertilization. International Journal of Plant Sciences 370-380..
(27) 27. Ludlow, M. M. (1989). Strategies of response to water stress, in: K.H. Kreeb, H. Richter, T.M. Hinckley (Eds.), Structural and Functional Responses to Environmental Stresses, SPB Academic, The Hague, 1989, pp. 269-281 Matesanz, S., Rubio Teso, M. L., García-Fernández, A., & Escudero, A. (2017). Habitat fragmentation differentially affects genetic variation, phenotypic plasticity and survival in populations of a gypsum endemic. Frontiers in plant science, 8, 843. Mazer S, Dudley L, Hove A, Emms S, Verhoeven A. 2010. Physiological Performance in Clarkia Sister Taxa with Contrasting Mating Systems: Do Early-Flowering Autogamous Taxa Avoid Water Stress Relative to Their Pollinator-Dependent Counterparts? International Journal of Plant Sciences 171: 1029-1047. Moeller DA, GEBRE MA. 2005. Ecological context of the evolution of self-pollination in Clarkia Xantiana: Population size, plant communities and reproductive assurance. Evolution 59(4): 786-799. Nicotra, A. B., & Davidson, A. (2010). Adaptive phenotypic plasticity and plant water use. Functional Plant Biology, 37(2), 117-127. Pérez F, Arroyo MT, Armesto JJ. 2009. Evolution of autonomous selfing accompanies increased specialization in the pollination system of Schizanthus (Solanaceae). American journal of botany 96: 1168–76. Pérez F, León C, Muñoz T. 2013. How variable is delayed selfing in a fluctuating pollinator environment? A comparison between a delayed selfing and a pollinator-dependent Schizanthus species of the high Andes. Evolutionary Ecology 27(5): 911–922 . Pigllucci, M. (1996). How organisms respond to environmental changes: from phenotypes to molecules (and vice versa). Trends in Ecology & Evolution, 11(4), 168-173..
(28) 28. Pigliucci, M., Diiorio, P., & Schlichting, C. D. (1997). Phenotypic plasticity of growth trajectories in two species of Lobelia in response to nutrient availability. Journal of Ecology, 265-276. Reed DH, Fox CW, Enders LS. 2012. Inbreeding–stress interactions: evolutionary and conservation consequences. Annals of the New York Academy of Sciences 1256(1): 33-48. Scheiner, S. M., & Goodnight, C. J. (1984). The comparison of phenotypic plasticity and genetic variation in populations of the grass Danthonia spicata. Evolution, 38(4), 845-855. Schoen DJ, Morgan MT. 1996. How does self-pollination evolve? Inferences from floral ecology and molecular genetic variation. Philosophical Transactions of the Royal Society of London B: Biological Sciences. 351(1345): 1281-1290 Snell R, Aarssen L. 2005. Life history traits in selfing versus outcrossing annuals: exploring the ‘time-limitation’ hypothesis for the fitness benefit of self-pollination. BMC Ecology 5(1): 1. Stebbins, G. L. (1957). Self-fertilization and population variability in the higher plants. The American Naturalist, 91(861), 337-354. Stebbins, G. L. (1974). Flowering plants: evolution above the species level. London: Arnold xviii, 399p. Illustrations. General (KR, 197500089). Suárez, L. H., & Gianoli, E. (2005). Does drought affect inbreeding depression in the autogamous species Convolvulus chilensis (Convolvulaceae)? New Zealand Journal of Botany, 43:4, 825-829 Sultan, S. E. (2000). Phenotypic plasticity for plant development, function and life history. Trends in plant science, 5(12), 537-542..
(29) 29. Takebayashi, N., & Morrell, P. L. (2001). Is self-fertilization an evolutionary dead end? Revisiting an old hypothesis with genetic theories and a macroevolutionary approach. American Journal of Botany, 88(7), 1143-1150. Thiele, J., Hansen, T., Siegismund, H. R., & Hauser, T. P. (2010). Genetic variation of inbreeding depression among floral and fitness traits in Silene nutans. Heredity, 104(1), 52. Valladares F, Sanchez-Gomez D, Zavala M. 2006. Quantitative estimation of phenotypic plasticity: bridging the gap between the evolutionary concept and its ecological applications. Journal of Ecology 94(6): 1103-1116. Vázquez, D. P., Gianoli, E., Morris, W. F. & Bozinovic, F. (2017) Ecological and evolutionary impacts of changing climatic variability. Biol. Rev. 92, 22–42 Vitousek, P.M., Mooney, H.A., Lubchenco, J., & Melillo, J. M. 1997. Human Domination of Earth’s Ecosystems. Science 277 (5325): 494-499. Williams, D. G., Mack, R. N., & Black, R. A. (1995). Ecophysiology of introduced Pennisetum setaceum on Hawaii: the role of phenotypic plasticity. Ecology, 76(5), 1569-1580. Wright, L. I., Tregenza, T., & Hosken, D. J. (2008). Inbreeding, inbreeding depression and extinction. Conservation Genetics, 9(4), 833. Wu C, Lowry D, Nutter L, Willis J. 2009. Natural variation for drought-response traits in the Mimulus guttatus species complex. Oecologia 162 (1): 23-33 Wyatt, R. (1988). Phylogenetic aspects of the evolution of self-pollination. In Plant evolutionary biology (pp. 109-131). Springer, Dordrecht..
(30) 30. CAPITULO I SELFING AND DROUGHT TOLERANCE IN A WARMING WORLD: BALANCE AND FUTURE CHANGES FOR TWO HERBACEOUS SPECIES IN THE SOUTH AMERICAN ANDES.
(31) 31. Selfing and drought tolerance in a warming world: balance and future changes for two herbaceous species in the South American Andes1. Natalia Ricote M2,5,6, Cristina C. Bastias3, Fernando Valladares3,4, Fernanda Pérez T2 & Francisco Bozinovic 2,5. 1. Manuscript received________; revision accepted_______.. 2. Departamento de Ecología, Facultad de Ciencias Biológicas, Pontificia Universidad Católica. de Chile. Santiago, Chile. 3. Departamento de Biogeografía y Cambio Global. Museo Nacional de Ciencias Naturales,. MNCN-CSIC, Madrid, Spain. 4. Área de Biodiversidad y Conservación, Universidad Rey Juan Carlos, Móstoles, Madrid,. Spain. 5. Center of Applied Ecology & Sustainability (CAPES), Pontificia Universidad Católica de. Chile, Santiago 6513677, Chile. 6. Author of correspondence:. Natalia Ricote M. Tel: +56998186496 Email: nricote@bio.puc.cl.
(32) 32. Abstract Premise of the study. The high diversity in mating systems of angiosperms results from the interaction of multiple positive and negative forces. While the benefits of selfing include reproductive assurance and automatic selection, it may also increase the extinction risk of species. This trade-off may be affected by the challenges imposed by global change, such as a decrease on pollinator’s availability that may increase selfing and this effect might interact with new climatic conditions. In this work, our aim was to investigate whether selfing is correlated with drought tolerance, in order to assess how the balance between forces related to it could be affected in a changing scenario. We hypothesize that populations with high selfing rates will show drought-escape related traits compared with populations with lower selfing rates; however, they will have lower survival rates than their more outcrossing counterparts, when exposed to chronic drought throughout their entire life cycle. Methods To evaluate these hypotheses, we characterized different physiological and morphological traits in response to two contrasting glasshouse habitat treatments (moist and dry) in a total of 6 populations of two herbaceous species (Schizanthus hookeri and Schizanthus grahamii) representing a gradient in selfing rates. Key results We did not find a clear relationship between selfing and drought tolerance, however, our results show a general pattern suggesting that selfing is detrimental for populations in general. Conclusions.
(33) 33. Overall, our results suggest that mixed mating could be “the best of both worlds” in future scenarios for herbaceous short-lived species. Keywords: drought tolerance, global change, inbreeding, outcrossing, plant physiological traits, Schizanthus, selfing. Introduction Flowering plants are characterized by a high diversity of mating systems that range from complete self-fertilization (i.e. complete selfing) to complete outcrossing, with 40% of species engaging in mixed mating (Goodwillie et al., 2005; Dudley et al., 2012). This diversity results from the interaction of multiple forces acting against or favoring selfing. On the one hand, selffertilization can lead to higher extinction risk and lower adaptive potential, increase the probability of inbreeding depression (Herlihy & Eckert, 2002) and lower genetic variability in natural populations, reducing their evolutionary potential and increasing extinction risks (Herlihy & Eckert, 2002; Moeller & Gebre, 2005; Dierks et al., 2012; Dudley et al., 2012). On the other hand, selfing has the advantage of reproductive assurance; (Lloyd, 1992; Fausto & Eckhart, 2001; Snell & Aarssen, 2005; Dudley et al., 2012; Pérez et al., 2013), and maintenance by automatic selection (Fisher, 1941; Schoen & Morgan, 1996; Harder & Wilson, 1998; Aarssen, 2000). In natural populations, a balance between these forces is in play. However, this balance might be affected by the new challenges imposed by global change, altering this tradeoff in several ways. One of the greatest challenges in the study of the effect of global change on plant populations is the non-additive interaction between several human-driven threats that have traditionally been studied separately (Vitousek, 1997; Matesanz et al., 2009; Reed et al., 2012). Among these threats, there are two important problems that affect animal-pollinated plant.
(34) 34. populations. First, climate change is causing and will continue to cause changes in rainfall patterns across the world such as a global decrease of precipitations and desertification. These changes are predicted for both mountain and valley areas and a consequent increase of seasonal droughts in these environments is expected (IPCC, 2012). On the other hand, several humandriven changes, such as biological invasions, fragmentation and habitat loss will cause a decrease in pollinator populations as well as a decoupling of distribution ranges and phenology between pollinators and plants, all of which causes a decrease in pollinator availability on plant habitats (Leimu et al., 2010; Eckert et al., 2010). The combination of these two threats implies that, in many self-compatible species, selfing frequency will increase (Hauser & Loeschcke, 1996; Reed et al., 2012), and the consequences of this change may alter the balance between positive and negative effect of inbreeding in the face of new climatic extremes such as increasing aridity. In this context, to assess the interplay between these two different threats imposed by global change in plant populations might allow better understanding how animal pollinated plants will respond to future environmental changes. Although little is known about the relationship between mating systems and physiological tolerances, previous works have shown that selfing can be part of a drought escape strategy (Mazer et al., 2010; Dudley et al., 2012, 2015). Historically, adaptations that confer different levels of drought resistance have been divided into three alternative strategies: Drought tolerance, dehydration avoidance and drought escape. The latter is based on the ability of plants to complete their life cycles before the onset of severe drought condition, whereas the two other strategies are based on developing physiological mechanisms that allow them to face drought and continue to perform their vital functions (Ludlow, 1989; Kooyers, 2015). Accordingly, comparative studies in various herbaceous genera (Aarssen, 2000; Snell & Aarssen, 2005;.
(35) 35. Dudley et al., 2012) have documented that selfing species tend to have faster growth rates, higher photosynthetic rates, higher stomatal conductance and lower water use efficiency than their outcrossing congeners (Heschel & Riginos, 2005; Wu et al., 2009; Mazer et al., 2010), this traits respond to the allocation of resources to complete a short life cycle, therefore, there is a tradeoff between escaping drought and avoiding dehydration or tolerate drought. However, these studies have focused on predominantly selfing or obligate outcrossing species, and no information has been provided regarding species with mixed mating systems. Selfing levels can vary in these species in accordance with pollinator availability and population size and the resulting continuous gradient of selfing rates can be used to test the relationship between selfing and drought tolerance. Schizanthus hookeri and Schizanthus grahamii (Solanaceae) are two annual and biannual herbs that grow in Andes of Central Chile. Climate change scenarios for this region predict an increase of 4 to 5º C in temperatures and a >40% of decrease in rainfall during growing season (Fuenzalida et al., 2006). Also, an increment in precipitation variability, and thus in the occurrence of extreme seasonal droughts is expected (Fuenzalida et al., 2006; IPPC 2012). Annual plants, such as Schizanthus species, are thought to be particularly vulnerable to these events since they have to complete their life cycle within a single season, and population persistence is highly dependent on the reproductive output of a season (Heschel et al., 2004). Both Schizanthus species are self-compatible, but only S. grahamii has the ability for autonomous selfing, i.e., without vector intervention (Pérez et al., 2009). Selfing in S. grahamii occurs after the opportunity for outcrossing has passed, a strategy known as delayed selfing, and the rate varies strongly with pollinator availability (Hauser & Loeschcke, 1996; Aguilar et al. 2008; Reed et al., 2012). S. hookeri is also self-compatible, but shows herkogamy and.
(36) 36. dichogamy and, thus, requires pollinators for seed set. Selfing in this species can occur only when pollinators transfer pollen among flowers of the same plant. Selfing rates vary strongly among populations of these Schizanthus species with values ranging from 0.23 to 0.95. These rates are likely to increase with a reduction in population sizes and mate availability (Pérez et al., 2013). In this study, our aim was to investigate whether selfing rate is correlated with a drought escape strategy, making them unable to tolerate drought or avoid dehydration. In this way we intent to assess if, and how, the balance between negative and positive forces related to selfing could be affected in a globally changing scenario of increased drought and reduced pollinator availability. We selected six populations of S. hookeri and S. grahamii with contrasting selfing rates and conducted a greenhouse experiment to assess how these populations respond to drought conditions. To assess this response, we measured morphological traits related with drought escape. We hypothesize that populations with high selfing rates will show droughtescape related traits such as faster growth, higher photosynthetic rate and lower instantaneous water use efficiency (iWUE), than populations with lower selfing rates; however, they will have lower survival rates than their more outcrossing counterparts, when exposed to chronic drought throughout their entire life cycle, since their strategy is drought avoidance and not tolerance. Materials and methods Study Species Schizanthus hookeri Gillies ex Graham. and Schizanthus grahamii Gillies ex Hook. are two annual –and occasionally biennial- herbaceous sister species of the Schizanthus genus. These two species are endemic to Chile and Argentina (Grau & Gronbach, 1984) and currently they share a similar distribution range across the Chilean Andes: S. grahamii grows at high elevations.
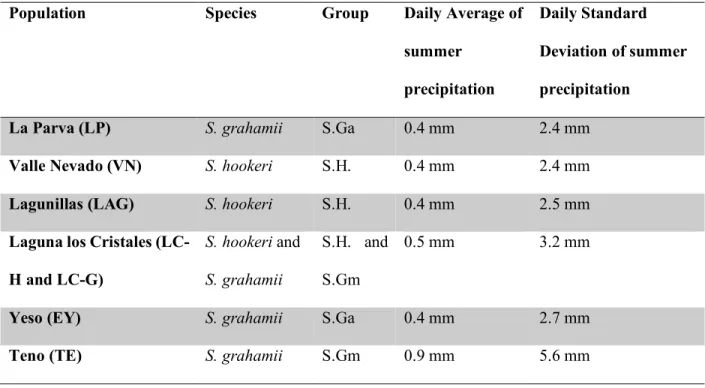
(37) 37. between 33ºS and 39ºS and S. hookeri grows at mid and high elevations between 29ºS and 38ºS (Grau & Gronbach, 1984). The life cycle of these two herbaceous species lasts approximately three months during the austral summer, corresponding to the hot and dry season of the year in this ecosystem. Each species represents a reproductive system that can generate selfing in different ways: S. grahamii is mainly pollinated by hummingbirds and exhibits delayed selfing. This means its style elongates throughout flower development, and once the opportunity for outcrossing has passed, the stigma contacts the anthers, allowing selfing to occur and making it possible for selfing to happen with and without the presence of pollinators. On the other hand, S. hookeri is also self-compatible, but presents strong herkogamy and dichogamy and therefore requires pollinators for seed set and selfing. Its main pollinators are bees, dipterans and also hummingbirds (Pérez et al., 2013). Seeds are produced in both species inside several capsules per plant containing from 20 to 100 rough-surfaced small seeds each one. Once the capsules are dried, seeds usually fall down on the ground near mother plant without apparent signs of dispersion by wind or animals (Pérez et al., 2013). Seed collection We collected a sample of fifty seeds from fifty random individuals belonging to three populations of S. grahamii and three populations of S. hookeri. Populations are located between 33ºS and 34ºS in the high Andes of Central Chile at elevations ranging between 2000 and 2500 m and within a maximum linear distance of 200 km (Table I). Climatic conditions of these sites are similar with mean annual precipitation of 900mm, falling predominantly as snow between May and September, and a mean growing season temperature ranging between 9ºC and 15ºC (Cavieres et al., 2000, Centro de Clima y Resiliencia, see Table II). These sites included one.
(38) 38. location where populations of the two species occur sympatrically (Laguna los Cristales). Selfing rates for these populations were previously estimated by Pérez et al. (2009), using microsatellite markers and a multilocus approach based on heterozygosity disequilibrium values (Table I). Methods based on the degree of heterozigocity provide a long-term measure of the degree of selfing, reflecting an historical average as opposed to progeny-array methods, which base the estimation of selfing rates on the genetic analysis of progeny for which one or more parents are known, therefore focusing on short-term measures (Milligan & Strand, 1996, Ritland 2002). According to this, each population is designated a specific selfing rate, therefore, “population” and “selfing rate” will be considered as the same factor throughout the study. Common garden experimental design Seed sowing In April 2014, 45 seeds from twenty random mothers per population were stratified for 24 hours in water and then germinated in sterilized Petri dishes containing filter paper soaked with a solution of Gibberellin at a concentration of 100 ppm in order to stimulate growth. Petri dishes were sealed with Parafilm to prevent evaporation of water and thus avoiding the changes in concentration of the solution. Seeds were incubated in growth chambers at 7ºC for the first four days and at 20ºC from the fourth day onwards. After 7 days, the seeds started to germinate (seeds were considered to be germinated with the emergence of the radical). Finally, 11 germinated seeds from the healthiest 15 mothers (the ones that showed better germination rates) per population were sown into plastic pots within trays of 15 pots each. Pots were filled with a 2:1:1 mixture of sterilized peat moss (Turba white 6F, Projar, Spain), vermiculite (type 3, Projar, Spain) and washed coarse sand (Leroy Merlin, Spain) and placed in a greenhouse under.
(39) 39. controlled conditions. The final sample was 990 plants (6 populations x 15 mothers/population x 2 treatments x 11 replicates/ mother). Life cycle of these species is approximately three to four months, therefore, to minimize confounding maternal effects, all seedlings were grown in the greenhouse under standard conditions of high water and nutrient availability for 1 month before starting the treatment (Lázaro-Nogal et al. 2015). Treatments Drought treatments were applied from May to August 2014. Five replicate seedlings per mother were assigned to the control treatment and six replicate seedlings per mother were assigned to the drought treatment. Each replicate was assigned randomly to one of the six greenhouse benches to minimize micro environmental biases. Treatments simulated two contrasting regimes of water availability: moisture (control treatment) and drought, aimed to assess a range of conditions to which plants could be exposed in the future. In the moist treatment, plats were kept at field capacity, which for our specific soil mixture was equivalent to 27-29% of soil water content (SWC). SWC was calculated as (W-D) x D-1, where W is the weight of the original sample and D is the weight of the dried sample. In the drought treatment plants were kept at 30% of field capacity, which is equivalent to 8,8% of SWC. Simulations of climate change scenarios in other studies of semi-arid ecosystems have reported reductions of SWC around 15% (Valladares et al., 2006). SWC was determined for a random subsample of 19 trays 16 times during the two months of experiment when the majority of measurements were made (June and July). Across the duration of the experiment, all conditions in the greenhouse where monitored every 10 minutes with a HOBO H08-006-04 data logger (Onset, Pocasset, MA, USA) and plants were provided with all the nutrients needed. Mean temperature and maximum and minimum.
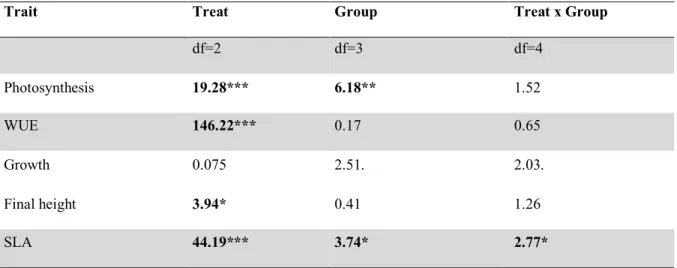
(40) 40. daily range for this period were: 21.2, 12-15 and 27-30ºC, respectively. PAR was between 8001000 µmol m-2 s-1 Physiological and morphological measurements Performance traits Traits considered as estimates of plant performance in this experiment were survival and relative growth rate (RGR). A survival curve was drawn for each population for both treatments, based on four mortality censuses made during the experiment. Plant height and RGR were measured once a month, during the 3 months of treatment making a total of three censuses. RGR was calculated as RGR = (LnHf-LnHi)/2, where Hf is plant height at the last census and Hi at the first one, 2 is the number of months from the first to the last measurement (Lázaro-Nogal et al., 2015). Plant height was measured as the elongation from the ground to the most recent node observable. Physiological and water economy traits Photosynthetic rate (µmol CO2 m-2 s-1) and iWUE (ratio between photosynthetic rate and stomatal conductance; µmol CO2 mol-1 H2O-1) are gas exchange traits affecting drought tolerance and plant overall development rates (Chaves et al 2003), therefore, they were measured two times throughout the experiment: two and four weeks after treatment application. Measurements were conducted on one fully expanded leaf of a primary branch per plant, using a Licor 6400 infrared gas analyzer (LI-COR, Lincoln, NE, USA); when the leaf was too small to fill the entire sensor, a correction was made to match the real occupied area. Leaves were exposed to a CO2 concentration of 400µmol mol-1 and saturating light of 1500 µmol m-2 s-1 and measurements were made at temperatures between 24-26ºC and relative humidity of around 3050%. Each measurement was made on a subsample consisting of 4 individuals per treatment.
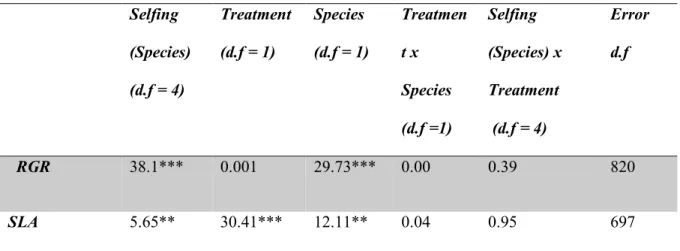
(41) 41. belonging to 5 mothers per population. Measurements were made in the same plant the first and second time (henceforth called “early” and “late” measurement, respectively). Morphological leaf traits At the end of the experiment, three fully expanded and mature leaves from a primary branch on each plant were collected and kept at 4ºC, completely hydrated for 24h. Then, they were weighed and scanned using a LI-3000C portable area meter (LI-COR). Finally leaves were oven dried (At 50ºC for 48 hrs) and weighed to determine Specific Leaf Area (SLA), which is the ratio between leaf area and leaf dry biomass. A decrease in SLA may occur in response to drought in herbaceous leaves as a result of an increased investment in structural tissues allowing increased resistance to unfavorable environmental conditions (Maroco et al 2000, Chaves et al. 2003) Statistical analysis To assess the differences in survival between populations and treatments we applied a logrank test (also known as Mantel-Cox test). We used the survival curve as response variable, calculated from the survival rate in the Y-axis and the days since the beginning of treatment in the X-axis. The factors we considered were population (associated with a specific selfing rate) and treatment. Curves were analyzed and drawn with the program “GraphPad Prism version 5 for Windows, GraphPad Software, La Jolla California USA, www.graphpad.com”. Regarding RGR and SLA, the differences between populations and treatments were assessed performing a nested ANOVA analysis considering Population (also called “selfing” on the tables) and Treatment as fixed factors, and nesting Population within Species. This analysis was followed by a post hoc test, performed to assess differences among populations and between treatments. Photosynthetic rate and water use efficiency (iWUE) were analyzed.
Figure
Outline
Documento similar
The overriding objectives of this study are (i) to deter- mine the possible differences in the response of vegetation activity to drought over Spain, as a function of the different
response of the main forest species present in Moncayo Natural Park to climate to 18.. assess their current relationship and to model these responses over the potential
It is generally believed the recitation of the seven or the ten reciters of the first, second and third century of Islam are valid and the Muslims are allowed to adopt either of
Our results here also indicate that the orders of integration are higher than 1 but smaller than 2 and thus, the standard approach of taking first differences does not lead to
Gene pathway analyses of differentially expressed genes (DEG) revealed a specific FOS-mediated reduction in transcript levels of genes that participate in several canonical
In the preparation of this report, the Venice Commission has relied on the comments of its rapporteurs; its recently adopted Report on Respect for Democracy, Human Rights and the Rule
“ CLIL describes a pedagogic approach in which language and subject area content are learnt in combination, where the language is used as a tool to develop new learning from a
Our goal was to study immune responses against viral infections in order to obtain potentially useful information for the design of new vaccination strategies, focusing on