UNIVERSIDAD DE GUAYAQUIL
FACULTAD DE CIENCIAS MÉDICAS
ESCUELA DE GRADUADOS
PROYECTO DE INVESTIGACIÓN PRESENTADO COMO
REQUISITO PREVIO PARA LA OBTENCIÓN DEL TITULO DE
ESPECIALISTA EN MEDICINA INTERNA
TEMA
“ANEMIA COMO FACTOR PRONÓSTICO DE MORTALIDAD EN
INSUFICIENCIA CARDIACA CRÓNICA DESCOMPENSADA”
AUTOR
DR. ANTONIO JAVIER POZO GARCÍA
TUTOR
DR. FREDDY POW CHON LONG
AÑO
2016
i
DEDICATORIA
Dedico esta tesis a mi madre Lcda. Alicia García Mackliff, gracias a su apoyo incondicional, sus consejos, el estar junto a mí en los momentos duros y vicisitudes a lo largo de mi formación profesional, es lo que me ha permitido lograr alcanzar este objetivo tan anhelado.
ii
AGRADECIMIENTO
Le agradezco a Dios por estar siempre ahí para mí en todo momento, brindándome la fuerza de voluntad y la tenacidad de alcanzar mis objetivos. Gracias Jehová, ya que sin ti no soy nada.
A mi amada novia Nadia Chalacán mis infinitas gracias por ser mi compañera, fiel, comprensiva y brindarme tu apoyo siempre en todo momento durante mis años de formación de la especialidad.
iii
RESUMEN
El objetivo de este trabajo es determinar si la anemia es un predictor de mortalidad en la Insuficiencia Cardiaca Crónica Descompensada, identificar la etiología más prevalente de anemia encontrada, además demostrar si la anemia es debidamente identificada y tratada en los pacientes con Insuficiencia Cardiaca (IC) y se protocolizar opciones de tratamiento para la anemia en insuficiencia cardiaca crónica descompensada. Mediante un estudio observacional de tipo retrospectivo, se estudió a todos los pacientes que fueron ingresados en unidades críticas (UCI, Reanimación y U. Coronaria) del Hospital Luis Vernaza durante el periodo de Enero 2014 a Diciembre 2015, con el diagnostico principal de IC. Se recolectó información de las historias clínicas incluyendo variables como edad, género, clase funcional NYHA, hemoglobina, estancia hospitalaria y datos ecocardiográficos como fracción de eyección, los cuales fueron tabulados metodológicamente. Se seleccionaron a los pacientes que reunieron criterios de inclusión para el estudio. El total de pacientes que se incluyeron en el estudio fue 99. Del total de pacientes incluidos 48 fueron varones (48%) y 51 mujeres (52%). La edad media fue de 70.1± --- años. El promedio de hemoglobina de los pacientes que presentaron y no presentaron anemia fue de 9.19± --- y 13.7± ---g/dl, respectivamente. Del total de pacientes que presentaron anemia el 72% presentaban FE <40%; el 69% presentó creatinina mayor de 1.5mg/dl; el 77% tenía clase funcional Grado III NYHA; el promedio de días de estancia hospitalaria fue de 17.3± --- días y el 25% presentaron eventos mortales. La anemia de trastornos crónicos se encontró en un 70%, seguida de la anemia ferropénica con un 25% y finalmente la anemia megaloblástica con el 5%. El 48% de la población anémica tenia estudios de perfil de hierro y el 17% recibieron tratamiento para la anemia.
PALABRAS CLAVES:
iv
SUMMARY
The aim of this study is to determine whether anemia is a predictor of mortality in Chronic Heart Failure decompensated identify the most prevalent etiology of anemia found also show whether the anemia is properly identified and treated in patients with heart failure and notarize treatment options for anemia in chronic decompensated heart failure. An observational retrospective study, all patients who were admitted in critical (ICU Resuscitation and U. Campion) units Luis Vernaza Hospital during the period January 2014 to December 2015, with the primary diagnosis of IC was studied. Information from medical records including variables such as age, gender, NYHA functional class, hemoglobin, hospital stay and echocardiographic data as ejection fraction, which was collected were tabulated methodologically. Patients who met inclusion criteria for the study were selected. The total number of patients included in the study was 99. Of the 48 patients included were male (48%) and 51 women (52%). The mean age was 70.1 years ± ---. The average hemoglobin of patients who had and did not have anemia was ± 9.19 and 13.7 ± --- --- g / dl, respectively. Of the total number of patients experiencing anemia 72% they had EF <40%; 69% had higher creatinine of 1.5mg / dl; 77% had NYHA functional class III Grade; the average hospital stay was 17.3 ± --- days and 25% had fatal events. Anemia of chronic disorders was found in 70%, followed by iron deficiency anemia with 25% and finally megaloblastic anemia with 5%. 48% of the anemic population profile studies had iron and 17% were treated for anemia.
KEYWORDS:
v
INDICE DE CAPÍTULOS
Resumen
1. Introducción 1
1.1. Planteamiento del problema 3
1.1.1. Determinación del problema 3
1.1.2. Preguntas de la investigación 4
1.1.3. Justificación 4
1.1.4. Viabilidad 5
1.2. Objetivos 1.2.1. Objetivos Generales 5
1.2.2. Objetivos Específicos 5
1.3. Hipótesis 5
1.4. Operacionalización de las Variables 6
2. Marco Teórico 7
2.1. Generalidades: 7
Concepto, clasificación y epidemiología de la anemia en Insuficiencia cardiaca crónica. 2.2. Efectos Patogénicos de la anemia en insuficiencia cardiaca. 8
2.3. Potenciales causas de anemia en Insuficiencia Cardiaca 9
y su fisiopatología 2.3.1. Enfermedad renal crónica 9
2.3.2. Estado inflamatorio 10
2.3.3. Deficiencia de hierro 11
2.3.4. Producción de eritropoyetina y resistencia 13
2.3.5. Hemodilución 14
2.3.6. Fármacos. 15
2.3.6.1. IECA, ARA II y Beta Bloqueantes. 15
vi
2.4.
Tratamiento. 16
2.4.1. Terapia con Hierro 17
2.4.2. Agentes Estimulantes de la Eritropoyesis 25
2.4.3. Hemoderivados 30
3. Materiales y Métodos 33
3.1. Materiales 33
3.1.1. Lugar de Investigación 33
3.1.2. Periodo de la Investigación 33
3.1.3. Recursos Utilizados 33
3.1.3.1. Recursos Humanos 33
3.1.3.2. Recursos Físicos 33
3.1.4. Universo y Muestra 34
3.2. Métodos 34
3.2.1. Tipo de Investigación 34
3.2.2. Diseño de la Investigación 34
3.2.3. Criterios de Inclusión 34
3.2.4. Criterios de Exclusión 35
3.2.5. Técnica de Análisis de Datos 35
4. Resultados y Discusión 36
5. Conclusiones y Recomendaciones 45
6. Anexos 47
1
CAPITULO I
1. INTRODUCCIÓN
El propósito de esta investigación es demostrar que la anemia está asociada a un peor perfil clínico basal y es un marcador práctico, predictor de mortalidad en los pacientes con insuficiencia cardiaca crónica descompensada.
En los últimos años, ha ido aumentando el interés sobre la importancia de un correcto manejo de las comorbilidades asociadas a la insuficiencia cardiaca. La anemia ha demostrado ser la comorbilidad más prevalente encontrada en insuficiencia cardiaca crónica descompensada, observándose en estadios avanzados de la enfermedad, asociada a un peor pronóstico y calidad de vida, especialmente en la población anciana, polimedicada y con múltiples comorbilidades (AMORÓS, J, 2011) (RAVISH, S, 2013). La presencia de anemia constituye
un problema de salud pública frecuentemente subestimado en la práctica médica, incrementa los costos del tratamiento de la enfermedad cardiaca, generando mayores gastos por reingresos y estancia hospitalaria prolongada.
En E.E.U.U., la prevalencia de anemia en sujetos con insuficiencia cardiaca se encuentra en alrededor del 25 al 40% y esta cifra puede variar dependiendo de lo avanzada que este la enfermedad cardiaca. Un meta-análisis con > 150.000 pacientes, demostró que la disminución de 1g/dl en la hemoglobina, aumenta la mortalidad en 15,8%, pese al control de otras comorbilidades como, la insuficiencia renal crónica y la diabetes (YANCY, C, 2013) (CARDOSO, J, 2010).
Los estudios CONFIRM-HF y STAMINA-HeFT, demostraron que la anemia contribuía con un mayor deterioro clínico de la enfermedad cardiaca, favoreciendo a la hipertrofia ventricular izquierda, empeorando la clase funcional según NYHA (New York Heart Association), deteriorando la capacidad cognitiva y aumentando el riesgo de mortalidad (PALAZZUOLI, A, 2014)
2
En España, los hospitales, Municipal de Badalona, Bellvitge L´Hospitalet de Llobregat, y Universitári Germans Trias i Pujol, ubicados en la ciudad de Barcelona, la incidencia anual de anemia en insuficiencia cardiaca fue del 10 –
20% (AMORÓS, J, 2011).
En nuestro país son escasos los trabajos realizados en relación a la prevalencia de la anemia en sujetos con insuficiencia cardiaca crónica descompensada. Salinas et al, realizaron un estudio que incluyó 119 pacientes hospitalizados en el área de Unidad Coronaria del Hospital Luis Vernaza de la Ciudad de Guayaquil de Enero a Agosto del 2008, el estudio reportó una prevalencia de anemia del 23% en sujetos con diagnóstico de insuficiencia cardiaca (SALINAS,A, 2010).
3
1.1 PLANTEAMIENTO DE PROBLEMA.
1.1.1 DETERMINACIÓN DEL PROBLEMA.La anemia en insuficiencia cardiaca es una comorbilidad con alta prevalencia la cual se encuentra en aumento, se estima que el 70% y 50% de los médicos cardiólogos e internistas respectivamente, subvaloran esta comorbilidad, no siendo siempre investigada y tratada. La anemia sin tratamiento en insuficiencia cardiaca crónica, ha demostrado que empeora la enfermedad en menor tiempo en relación con los pacientes no anémicos, este efecto se evidenció al observar en el grupo de pacientes anémicos, una menor tolerancia física, incremento de los re-ingresos hospitalarios, compromiso de las funciones mentales superiores y evolución a síndrome cardio-renal.
Existen factores que predisponen el desarrollo de la anemia en pacientes con insuficiencia cardiaca crónica como edad mayor, sexo femenino, presencia de compromiso renal, déficit de hierro y la polifarmacia. De estos, el déficit de hierro y la polifarmacia son factores que pueden ser modificados, sin embargo no son reconocidos ni valorados por el personal médico en la consulta ambulatoria y al ingreso hospitalario, persistiendo de este modo, la anemia y sus complicaciones. Mundialmente contamos con estadísticas acerca de la prevalencia de anemia en insuficiencia cardiaca, pero ¿contamos actualmente con dichos valores en nuestra población?, ¿Será la anemia una comorbilidad predictora de mortalidad en insuficiencia cardiaca? ¿Es relevante estadísticamente la relación entre la anemia y otras variables como mayor estancia hospitalaria y peor clase funcional NYHA? ¿Es debidamente investigada y tratada la etiología de la anemia de los pacientes con insuficiencia cardiaca? Son tantas las interrogantes que se plantean en relación a esta frecuente comorbilidad, la cual es subestimada y representa un gran impacto en la evolución de la enfermedad cardiaca crónica, lo que motiva el presente estudio, con la finalidad de mejorar el pronóstico y la calidad de vida en esta población.
4
1.1.2 PREGUNTAS DE INVESTIGACIÓN.
¿Es la anemia un predictor de mortalidad en Insuficiencia cardiaca crónica descompensada?
¿Cuál es la etiología más prevalente de anemia encontrada en insuficiencia cardiaca crónica descompensada?
¿En nuestro medio, la anemia de la insuficiencia cardiaca es debidamente identificada y tratada?
¿Existen protocolos terapéuticos mundialmente aceptados para el tratamiento de la anemia en insuficiencia cardiaca?
1.1.3 JUSTIFICACION.
5
1.1.4 VIABILIDAD.
La investigación fue factible ejecutarla en el Hospital Luis Vernaza, hospital de tercer nivel de referencia local, regional e incluso nacional con gran afluencia de pacientes y donde tengo todo el apoyo del personal médico y administrativo de la institución.
1.2 OBJETIVOS.
1.2.1 OBJETIVOS GENERALES.
Determinar si la anemia es un predictor de mortalidad en sujetos
con diagnóstico de insuficiencia cardiaca crónica descompensada, ingresados en áreas críticas del Hospital Luis Vernaza durante el periodo de Enero 2014 a Diciembre 2015, mediante la recolección de historias clínicas, con la finalidad de mejorar el pronóstico y calidad de vida.
1.2.2 OBJETIVOS ESPECIFICOS.
Correlacionar la presencia de anemia y sus efectos, con la
mortalidad en los sujetos con insuficiencia cardiaca crónica descompensada.
Identificar la etiología más prevalente de anemia encontrada en la
Insuficiencia Cardiaca Crónica.
Demostrar si la anemia es debidamente identificada y tratada en los
pacientes con Insuficiencia Cardiaca Crónica.
Protocolizar opciones terapéuticas de la anemia en Insuficiencia
Cardiaca Crónica descompensada.
1.3 HIPOTESIS.
6
1.4 OPERACIONALIZACIÓN DE LAS VARIABLES
.
Variable Independiente: Anemia.
Variable Dependiente: Mortalidad en Insuficiencia Cardiaca Crónica Descompensada.
VARIABLE TIPO DEFINICIÓN DIMENSIÓN INDICADOR NIVEL DE
7
CAPITULO II
2. MARCO TEÓRICO
2.1.
GENERALIDADES: CONCEPTO, CLASIFICACIÓN Y EPIDEMIOLOGÍADE LA ANEMIA EN INSUFICIENCIA CARDIACA CRÓNICA.
La Organización Mundial de la Salud (OMS) define anemia en los hombres para valores de hemoglobina < 13g/dl y en las mujeres < 12g/dl. La Anemia se clasifica en 4 grandes grupos: según su morfología, función, severidad y etiología: 1) Clasificación Morfológica: Anemia Microcítica si su volumen corpuscular medio (VCM) <80fl., Normocítica si VCM entre 80-100fl. y Macrocítica si VCM > 80-100fl.; 2) Clasificación Funcional: Anemias Regenerativa y Arregenerativa; 3) Clasificación según la Severidad: Anemia leve Hb > 10g/dl, Moderada Hb 8 -10g/dl y Severa Hb < 8g/dl; y 4) Clasificación Etiológica: por pérdida sanguínea, producción deficiente de hematíes, destrucción excesiva de hematíes, y producción disminuida con destrucción aumentada de hematíes (GRIFFIN, P, 2014) (CIELSA, B, 2014) (PALMER,S, 2015).
El estudio GESAIC (Grupo para el estudio del significado de la anemia en
la IC) analizó cual era el perfil etiológico más prevalente de anemia en pacientes con IC, basándose en el VCM. Los resultados demostraron a la anemia ferropénica como la más prevalente (36,8%), seguida de la anemia de enfermedad crónica (30,3%) y la anemia megaloblástica (4,4%)
(GRAU-AMOROS, J, 2009). La prevalencia de anemia en insuficiencia cardiaca (IC) se
encuentra en rangos entre el 14% al 61%, valor que guarda relación con lo avanzada que este la enfermedad cardiaca (CARDOSO, J, 2010) (CLYDE, W, 2013).
Constituye una de las comorbilidades más prevalentes especialmente en la población de edad avanzada con IC, encontrándose en un 17 a 63% de los pacientes hospitalizados y en un 14 a 56% de los pacientes ambulatorios
(ALEXANDRAKIS, M, 2012) (MADRAZO-GONZALEZ, Z, 2011). Predomina en hombres que en
mujeres, encontrándose en alrededor del 11% y 10% respectivamente
8
2.2.
EFECTOS PATOGÉNICOS DE LA ANEMIA EN INSUFICIENCIACARDIACA
Los efectos negativos de la anemia en los pacientes con insuficiencia cardiaca, se asocian con una peor hemodinámica, menor consumo máximo de O2 (VO2 máx.), empeoramiento de la función renal, disminución del índice de masa corporal (caquexia cardiaca) y peor clase funcional (BICHARA, V, 2009) (GRAU-AMORÓS, J, 2011).
La anemia produce un estado hiperdinámico acompañado de hipertrofia ventricular izquierda (HVI) para compensar la disminución del aporte de oxígeno a los tejidos. Esto fue demostrado en el estudio RENAISSANCE (The Randomized Etanercept North American Strategy to Study Antagonism of Cytokines), en el cual se comprobó después de 6 meses de seguimiento a 66 pacientes con IC, que la masa ventricular izquierda medida por resonancia magnética era mayor en los pacientes con niveles bajos de hemoglobina, en relación con los que tenían niveles normales (O´MEARA, E, 2014) (ANAND, I, 2008) (SANDHU, A, 2010).
La anemia asociada o no a HVI, incrementa el riesgo de cardiopatía isquémica, infarto de miocardio y muerte súbita. El consumo de oxígeno en los tejidos periféricos, se encuentra alterado por la disminución de la disponibilidad de sustratos de oxígeno, representando otro efecto adverso producido por la anemia. En los pacientes con anemia e IC, un gasto cardíaco reducido no puede compensar los requerimientos de O2 con niveles de Hb bajos, esto podría explicar síntomas más severos en los pacientes anémicos, con un deterioro más grave en la capacidad de ejercicio, un mayor riesgo de re-hospitalización y de mortalidad (SANDHU, A,
2010) (ANAND, I, 2008).
9
2.3. POTENCIALES CAUSAS DE ANEMIA EN INSUFICIENCIA
CARDIACA Y SU FISIOPATOLOGIA:
En la historia natural de la enfermedad cardiaca, la aparición de enfermedad renal crónica, el estado inflamatorio crónico persistente, la actividad neurohumoral incrementada y la polifarmacia, son algunas de las posibles causas responsables del desarrollo de anemia en estos pacientes. El déficit de hierro y la alteración en la producción y la resistencia a la eritropoyetina (EPO) son otros factores asociados al incremento de la anemia (PALAZZUOLI, A, 2014). A continuación revisaremos
las principales causas implicadas en el mecanismo de desarrollo de la anemia en IC y su fisiopatología.
2.3.1. ENFERMEDAD RENAL CRONICA
La enfermedad renal crónica suele manifestarse en la Insuficiencia Cardiaca en estadíos avanzados y se asocia con la disminución en la producción de EPO y anemia. El suministro de oxígeno en el riñón está dado por el flujo sanguíneo renal, el gasto cardiaco (GC), la masa eritrocitaria y por la curva de disociación oxígeno hemoglobina (efecto Bohr) (PALAZZUOLI, A, 2014).
La fracción renal corresponde al 21% del GC que fluye en el riñón en 1 minuto. La afectación renal se debe principalmente a dos alteraciones fisiopatológicas que son: hemodinámicas y del parénquima (PALAZZUOLI, A,
2014). La alteración hemodinámica consiste, en una hipoperfusion renal
producida por un flujo sanguíneo deficiente que a su vez es consecuencia de un bajo GC. Este cambio en el flujo sanguíneo renal, produce hipoxia renal tisular, la cual al cabo de algún tiempo produce daños irreversibles a nivel glomerular (PALAZZUOLI, A, 2014).
10
Cuando el filtrado glomerular (FG) cae por debajo de 60ml/min como consecuencia a las alteraciones hemodinámicas y del parénquima anteriormente descritas, la síntesis endógena de EPO se ve alterada, disminuyendo sus niveles en el plasma y reduciendo su efecto sobre las células madre hematopoyéticas, produciendo resistencia en los tejidos y generando anemia (SANDHU, A, 2010).
El concepto de Síndrome Cardio-Renal (SCR) se utiliza para describir una disminución aguda de la función renal en pacientes con insuficiencia cardíaca descompensada. Smith et al., encontró que el 63% de los pacientes con IC tenían algún grado de insuficiencia renal concomitante y el 29% tenían enfermedad renal crónica grave. El Síndrome Cardio-Renal se encuentra en aproximadamente el 30% de los pacientes con IC descompensada y su progresión a insuficiencia renal crónica conlleva al desarrollo de anemia (SANDHU, A, 2010).
2.3.2. ESTADO INFLAMATORIO
En los sujetos con Insuficiencia Cardiaca se ha encontrado un estado inflamatorio crónico productor de citocinas (TNF-α, interleucinas 1, 6, 10)
que contribuyen con la patogenia de la anemia (COLUCCI, W, 2015) (O´MEARA, E, 2014).
Los altos niveles de interleucina 6, 1, 10 y el TNF-α, inhiben la
producción renal de eritropoyetina mediante la activación de la proteína de unión, GATA 2 y el Factor Nuclear kB, los cuales además, inhiben la proliferación de células progenitoras eritroides a nivel de la médula ósea y generan resistencia a la EPO a nivel de los tejidos periféricos, lo que en conjunto genera anemia (CARAMELO, C, 2008) (MACIN, S, 2008) (RAVISH, S, 2013).
Éste estado inflamatorio crónico es mediado por un péptido específico sintetizado en el hígado llamado hepcidina (PALAZZUOLI, A, 2014) (RAVISH, S, 2013) (CARAMELO, C, 2008).
11
excretado por la orina, y tiene un papel clave en el metabolismo del hierro, la inflamación y la inmunidad innata (CARAMELO, C, 2008).
Su transcripción se induce marcadamente en los procesos inflamatorios especialmente mediados por IL-6 (RAVISH, S, 2013) (CARAMELO, C,
2008) (O´MEARA, E, 2014). De las tres isoformas que existen de hepcidina, la
hepcidina-25 juega un papel clave en la homeostasis del hierro y se la considera crucial para la regulación del mismo a nivel intestinal y hepático (RAVISH, S, 2013) (DIVAKARAN, V, 2012).
Como mecanismo principal, la hepcidina inhibe el flujo celular del hierro al bloquear la acción de la ferroportina-1 proteína transportadora, causando reducción en la absorción de hierro gastrointestinal y disminuyendo su liberación de los sitios de almacenamiento (macrófagos, hepatocitos y enterocitos). Al no liberarse el hierro a la circulación sanguínea, disminuye su oferta a los precursores eritroides en la medula ósea, de este modo se produce anemia por deficiencia de hierro (PALAZZUOLI, A, 2014) (CARAMELO, C, 2008).
La anemia de carácter inflamatorio, es probablemente la principal causa de anemia en la Insuficiencia Cardiaca y en conjunto a las altas concentraciones de hepcidina, condicionan el patrón típico de anemia de proceso crónico aplicable a un 40% de los casos de IC con anemia presente (CARAMELO, C, 2008) (GRAU-AMORÓS, J, 2011). La anemia en la población
anciana con IC, puede incrementarse aún más por otros factores, como por ejemplo, la producción reducida de células madre y la baja producción del factor de crecimiento hematopoyético propias del envejecimiento normal (RAVISH, S, 2013).
2.3.3. DEFICIENCIA DE HIERRO
El hierro es un cofactor esencial que participa en el transporte de oxígeno, genera energía celular en el músculo esquelético y miocardiocitos, y toma parte en la síntesis y degradación de los lípidos
12
Las reservas totales de hierro corporal varían desde un 30 a 40mg/kg contenido en los eritrocitos y un adicional de 0,5 a 1.5g almacenado en las células del parénquima hepático y el sistema reticuloendotelial (QURAT-UL-AIN, J, 2010) (MCDONAGH, T, 2015).
La pérdida diaria normal de hierro proviene del desprendimiento de las células de la mucosa gastrointestinal y es de aproximadamente 1 a 2 mg/día (QURAT-UL-AIN, J, 2010). En los pacientes con IC, se ha demostrado que
el miocardio tiene un contenido de hierro reducido y es posible que el agotamiento de hierro miocárdico juegue un papel en el deterioro de la función sistólica (MCDONAGH, T, 2015).
Nanas et al., encontraron depósitos de hierro pobres en la médula ósea de 73% pacientes con IC, a pesar de presentar hierro sérico, ferritina y EPO normales (PALAZZUOLI, A, 2014) (COLUCCI, W, 2015) (RAVISH, S, 2013). Lo
que indica que la ferritina puede no correlacionarse con las bajas reservas de hierro sérico y por lo tanto no es un marcador fiable de deficiencia de hierro en esta población. La inflamación o el estrés oxidativo pueden aumentar artificialmente las concentraciones de ferritina, independiente de su estado real (COLUCCI, W, 2015) (MCDONAGH, T, 2015).
En condiciones normales, el hierro es absorbido por los enterocitos de la mucosa gastrointestinal de los alimentos ingeridos y en su mayor parte del reciclaje de los glóbulos rojos, y es trasladado posteriormente a sitios de almacenamiento en el hígado. A partir de este punto, el hierro es transportado desde el interior de las células hepáticas hacia el exterior por la proteína transportadora, ferroportina-1 y luego llevada por la glicoproteína transferrina fijada al hierro hacía el torrente sanguíneo plasmático.
ferroportina-13
1 en la membrana basolateral de los enterocitos. El bloqueo de la ferroportina-1 por la hepcidina en los macrófagos y las células reticuloendoteliales, previene que el hierro sea exportado desde el interior de las células y en consecuencia, conduce a una reducción en la absorción de la transferrina (AMORÓS, J, 2011) (DIVAKARAN, V, 2012).
La deficiencia de hierro se relaciona con la gravedad de la enfermedad cardiaca y es un signo de mal pronóstico, independientemente de otros factores pronósticos tanto en IC aguda como crónica (BRUNNER, H, 2015). La deficiencia de vitamina B12 y folatos no
tienen un papel importante en la patogénesis de la anemia en pacientes con IC (PALAZZUOLI, A, 2014).
2.3.4. PRODUCCION DE ERITROPOYETINA Y RESISTENCIA
La Eritropoyetina es una hormona proeritrocítica altamente glicosilada, con una vida media de alrededor de 5 horas. Se produce en alrededor de un 90% en los fibroblastos peritubulares especializados de la corteza renal, mientras que el 10% restante se produce en el hígado
(RAVISH, S, 2013) (CARAMELO, C, 2008).
La hipoxemia es el principal estímulo para el incremento en la producción de eritropoyetina, lo que resulta en un aumento exponencial en el número de células productoras de EPO (RAVISH, S, 2013).
El gen de la EPO pertenece a un conjunto de genes sensibles a la hipoxia tisular (HIF-1 e HIF-2), que se estimulan cuando hay disminución de la presión parcial de oxigeno (pO2) a nivel celular (CARAMELO, C, 2008).El
14
A nivel de la medula renal, la pO2 se encuentra fija por debajo de 10mmhg, mientras que en la corteza es variable, alcanzando una media cercana a 30mmhg. Estudios proponen que en los pacientes con IC avanzada, clase funcional NYHA III-IV, al reducirse el flujo sanguíneo renal, la tensión de oxigeno peritubular disminuiría, estimulando la producción de EPO (CARAMELO, C, 2008) (SANDHU, A, 2010).
Recientemente se ha demostrado que la EPO es un potente factor trófico y antiapoptótico, con efectos protectores de las células cerebrales, retinianas, del epitelio renal y de las células miocárdicas (19).
Los factores que se han visto implicados en la patogenia de la resistencia a EPO en la IC son el estado de inflamación agudo y/o crónico, ferropenia absoluta y/o relativa, pérdida sanguínea, la enfermedad renal crónica, fármacos (IECA- AINES), la desnutrición y la depresión medular (CARAMELO, C, 2008) (SANDHU, A, 2010).
La producción de eritropoyetina defectuosa se demostró en más del 90% de los pacientes con insuficiencia cardíaca y con evidencia clínica de anemia de enfermedad crónica (SANDHU, A, 2010).
2.3.5. HEMODILUCIÓN
La anemia por hemodilución en la IC es el resultado de una actividad neurohumoral alterada, en las que se ven implicados el sistema simpático, sistema renina-angiotensina-aldosterona y la liberación de hormona antidiurética (LANG, Ch, 2008). Estos mecanismos favorecen la
retención de agua y sodio, expandiendo el volumen plasmático, favoreciendo la hemodilución, en lugar de una anemia verdadera por disminución de la masa eritrocitaria (COLUCCI, W, 2015) (LANG, Ch, 2008).
15
2.3.6. FÁRMACOS:
2.3.6.1. IECA, ARA II Y BETA BLOQUEANTES
Los IECA y ARA II han demostrado que prolongan la supervivencia en pacientes con insuficiencia cardiaca, pero también parecen inducir anemia al interferir en la producción de EPO durante el primer año de iniciado el tratamiento, alcanzado su efecto máximo en los 3 primeros meses y es dependiente de la dosis administrada
(COLUCCI, W, 2015) (CARAMELO, C, 2008) (LESHEM-RUBINOW, E, 2012) (AJMAL, A, 2013).
La angiotensina II es un estimulador de la producción de EPO y de la eritropoyesis, incrementa la proliferación de los progenitores eritroides mediante la activación AT1 en las unidades formadoras de eritroblastos, asociándose a una eritrocitosis secundaria. El uso de ARA II y Beta Bloqueadores suprimen completamente el efecto de la angiotensina II (PALAZZUOLI, A, 2014).
Se evaluó el impacto de los inhibidores de la ECA en un informe del estudio SOLVD (Studies of Left Ventricular Dysfunction) en el que los pacientes con disfunción ventricular izquierda fueron asignados aleatoriamente al enalapril o placebo (SANDHU, A, 2010). Un año después
de la aleatorización, la tasa de nuevas anemias fue significativamente mayor en el grupo de enalapril y tenían una tasa de mortalidad global aumentada (COLUCCI, W, 2015) (CARAMELO, C, 2008).
El efecto de los inhibidores de la ECA en el hematocrito puede estar mediado por el Ac-SDKP (N-acetil-seril-aspartil-lisil-prolina), un tetrapéptido que inhibe la eritropoyesis. El Ac-SDKP es metabolizado por los ECA y se acumulan en la presencia de un inhibidor de la ECA, elevando sus niveles e inhibiendo de este modo la eritropoyesis
16
Esta hipótesis fue confirmada en un estudio de 10 pacientes anémicos con insuficiencia cardiaca estable avanzada que fueron tratados con un inhibidor de la ECA y no tenía otra explicación para la anemia. Las células peritubulares productoras de EPO endógena reciben inervación simpática, el receptor específico de la sub-unidad beta2 comparte características químicas similares con los receptores de la EPO, lo que produciría bloqueo de los receptores de la EPO e inhibición de su actividad cuando se administran beta-bloqueadores generando anemia (PALAZZUOLI, A, 2014). La suspensión de estos
fármacos lleva a la normalización del hematocrito en 3 a 4 meses
(CARAMELO, C, 2008).
2.3.6.2. ANTIAGREGANTES PLAQUETARIOS Y ANTICOAGULANTES ORALES
Se han implicado en favorecer la aparición o agravamiento de la anemia al producir sangrando gastrointestinal oculto con pérdida de hierro (PALAZZUOLI, A, 2014) (SANDHU, A, 2010). Los pacientes tratados con
dosis bajas de AAS tienen un riesgo relativo de complicación gastrointestinal con respecto a pacientes no tratados (RODRIGUEZ-RAMOS, C, 2010).
La doble terapia con AAS y clopidogrel demostró un incremento del riesgo gastrointestinal de 2 a 7 veces más frente al tratamiento con cualquiera de los dos fármacos por separado (RODRIGUEZ-RAMOS, C, 2010).
2.4. TRATAMIENTO:
17
Como opciones terapéuticas para la anemia en IC están disponibles la terapia con hierro, los agentes estimuladores de la eritropoyesis y la transfusión sanguínea. Las Guías del 2016 de la Sociedad Europea de Cardiología para el diagnóstico y tratamiento de la insuficiencia cardiaca aguda y crónica, centraron la atención en la importancia de la deficiencia de hierro y la reconocen como una comorbilidad frecuente en IC
(MCDONAGH, T, 2015) (PONIKOWSHI, P, 2016).
Además recomiendan que al realizarse el cribado de todos los pacientes con sospecha de insuficiencia cardiaca, se incluya, una evaluación del perfil de hierro para detectar la deficiencia de este elemento, usando los niveles de ferritina y saturación de transferrina (TSAT). Lastimosamente ésta es una directriz aun no bien difundida y puesta en práctica (PONIKOWSHI, P, 2016).
2.4.1. TERAPIA CON HIERRO
El hierro es un mineral esencial en múltiples procesos metabólicos homeostáticos importantes en el ser humano. Dentro de las principales funciones del hierro destacan, el transporte de oxígeno, participa en procesos bioenergéticos (producción de ATP), síntesis de ADN y tiene un papel importante en la regulación inmune, siendo un componente necesario para la proliferación y maduración de las células inmunitarias
(QURAT-UL-AIN, J, 2010)
18
Estudio IRON-HF (Iron Supplementation in Heart Failure Patients with Anemia) estudio con el objetivo de comparar la eficacia y seguridad del hierro oral vs intravenoso en sujetos anémicos con IC. Los resultados del estudio demostraron incremento de 3,5ml/kg/min en el consumo máximo de O2 (VO2 máx.) en el grupo con hierro IV, sin observarse este incremento en el grupo de hierro VO. Tanto el uso de hierro oral como IV demostraron mejoría en la clase funcional NYHA, disminución de los valores de pro-BNP, mejor FEVI y tolerancia al esfuerzo físico. Aunque estos parámetros que fueron más evidentes en el grupo tratado con hierro IV, por lo que, los investigadores concluyeron que el hierro IV revelaría ser superior al hierro VO (MCDONAGH, T, 2015) (BECK-DA-SILVA, L, 2013).
Estudio FERRIC-HF (Ferric Iron Sucrose in Heart Failure), evaluó el tratamiento con Hierro Sacarosa IV, demostrando buena tolerancia farmacológica, corrección en los niveles de hemoglobina, incremento de la capacidad al ejercicio medida con el test de marcha de 6 minutos (TM6M), mejor puntaje en el Test de Minnesota, y además incrementó el consumo máximo de O2 (VO2-máx (RAVISH, S, 2013) (COLUCCI, W, 2015) (FILIPPATOS, G, 2013) (ANAND, I, 2008).
Usmanov et al, estudiaron los efectos del Hierro Sacarosa en pacientes anémicos con IC clase NYHA III-IV y ERC concomitante. Los resultados demostraron mejoría en el volumen diastólico final de VI y mejor FEVI en los pacientes con clase funcional NYHA III, no observándose así con los de clase funcional IV (QURAT-UL-AIN, J, 2010).
19
El estudio no recomienda el uso de HCM en los pacientes con deficiencia de hierro que presenten niveles de hemoglobina > 13,5g/dl
(COLUCCI, W, 2015) (RAVISH, S, 2013) (ANKER, S, 2009) (FILIPPATOS, G, 2013).
Estudio CONFIRM-HF (Ferric Carboxymaltose evaluation on performance in patients with Iron deficiency in combination with Chronic Heart Failure), estudio con el uso de HCM demostró, incremento en la distancia recorrida en el TM6M, mejor la clase funcional NYHA, mejor evaluación global del paciente y redujo el riesgo de hospitalizaciones por empeoramiento en grupo de pacientes tratados con hierro carboximaltosa (MCDONAGH, T, 2015).
Las Guías de la ESC 2016 señalan que hierro carboximaltosa puede ser considerado para el tratamiento de los pacientes con anemia en Insuficiencia cardiaca con resultados favorables (MCDONAGH, T, 2015).
¿Hierro Oral o Hierro Intravenoso?
Al elegir tratar la anemia con hierro siempre nos asalta la incógnita de si es mejor la terapia con hierro Oral o Intravenoso. El suplemento de hierro por vía oral es ideal para reponer los depósitos de hierro al usar los mecanismos normales del cuerpo. Es relativamente barato, ampliamente utilizado y eficaz, pero el cumplimiento así como la absorción es errática debida a efectos secundarios gastrointestinales significativos.
El aparato digestivo limita la capacidad de absorción de este elemento, por ejemplo de 50 o 100mg de hierro elemental en la luz intestinal solo se absorbe de 2 a 3mg. Estudios revelan que un déficit de 1g de hierro se compensa luego de la administración de hasta 1 año
(PALAZZUOLI, A, 2014) (MCDONAGH, T, 2015)
20
Este proceso de oxidación causa la liberación de radicales libres, capaces de producir efectos nocivos tales como la peroxidación lipídica con daño tisular a nivel de mucosa intestinal, causando efectos secundarios gastrointestinales hasta en el 60% de los pacientes tratados
(MCDONAGH, T, 2015). Hasta el 70% de los pacientes tratados con hierro oral
tienen mala adherencia debido a los efectos secundarios (PALAZZUOLI, A, 2014).
Por otra parte, estudios en roedores han encontrado que las sales ferrosas aumentan la gravedad de la colitis experimental y afectan a la microflora intestinal, debido a reacciones redox que conducen a la producción de ROS (Especies Reactivas de O2), con evidencia de aumento de la prevalencia de adenomas intestinales (MCDONAGH, T, 2015).
Para evitar los efectos secundarios producto del estrés oxidativo, el uso del Complejo Hierro Polimaltosa III (CHP) podría ser una alternativa
(MCDONAGH, T, 2015).
La estructura del CHP minimiza las interacciones con los alimentos o medicamentos concomitantes evitando alteración en la absorción del hierro como se observa en las sales ferrosas. El CHP se absorbe en el intestino a través de un intercambio competitivo de ligaduras, tanto que este sistema de transporte intestinal se satura en caso de sobredosis evitando efectos indeseables (MCDONAGH, T, 2015).
21
Los mecanismos de absorción intestinal del CHP son diferentes al del sulfato ferroso en relación a su tasa de transferencia a la circulación portal. Así la tasa de transferencia es de 30 minutos para el sulfato ferroso y de 24 horas para el CHP (MCDONAGH, T, 2015).
La menor absorción que posee el CHP en comparación con el sulfato ferroso, es compensada por un mayor grado de tolerancia digestiva y por un amplio margen de seguridad al reducir el daño en caso de una sobredosis de hierro accidental. El metaanálisis concluye reportando mejor relación riesgo-beneficio, tolerabilidad, adherencia y eficacia en la práctica clínica con el uso de CHP que con el sulfato ferroso (MCDONAGH, T,
2015).
Como consecuencia de los eventos adversos asociados con la terapia de hierro por vía oral, se considera inadecuado su uso en pacientes que presenten antecedentes de malabsorción, colitis o evidencia de mala adherencia a la terapéutica. El uso de hierro oral se desaconseja si se requiere de una corrección rápida de la anemia.
Con los Preparados de Hierro por vía intravenosa se evitan las dificultades asociadas con la absorción como se observa con el hierro por vía oral, incluso en presencia de niveles elevados de hepcidina. Los más recientes son el hierro carboximaltosa, isomaltosa 1000 y el ferumoxytol (MCDONAGH, T, 2015) (SCHWENK, MH, 2010).
22
Ciertas características de los pacientes con insuficiencia cardiaca pueden limitar la absorción intestinal de los preparados de hierro por vía oral, por lo que el hierro IV es la opción preferida. En primer lugar, los pacientes con insuficiencia cardiaca están generalmente recibiendo múltiples medicamentos para su patología cardiaca y comorbilidades. Por lo tanto, la adhesión a un régimen de dosificación oral de hierro puede ser un reto. En segundo lugar, varios factores pueden contribuir a una morfología intestinal anormal, como el edema de la mucosa y la alteración del flujo sanguíneo intestinal, inhibiendo la absorción de hierro forma adecuada.
Sandek et al, mostró que el flujo sanguíneo intestinal se reduce en un 30 a 43% en pacientes con insuficiencia cardiaca vs pacientes control
(MCDONAGH, T, 2015).
En cuanto a la biodisponibilidad, la dosis media requerida de hierro para lograr cubrir la depleción de hierro en pacientes con IC es de 1000mg
(MCDONAGH, T, 2015).
Teniendo en cuenta que la dosis habitual de sulfato ferroso es de 100-200mg/día, en el mejor de los casos, un paciente que tolera el tratamiento de 200mg/día puede absorber solamente 20mg de hierro y por lo tanto requeriría 50 días para corregir el déficit de hierro (MCDONAGH, T, 2015).
En el peor de los casos un paciente con IC, que pueda tolerar 100mg/día de sulfato ferroso podrá absorber solo el 5% (5mg), por lo tanto requeriría de 200dias de tratamiento para reponer las reservas de hierro (MCDONAGH, T, 2015). De este modo, la reposición de las reservas de
23
¿Existen riesgos asociados al uso del Hierro intravenoso?
La terapia de hierro no está libre de riesgos y se ha asociado con la probabilidad de desarrollo de bacteriemia, anafilaxia y shock. El hierro en el contexto de la activación inmune puede promover radicales hidroxilos altamente tóxicos que pueden causar daños en los tejidos y disfunción endotelial, aumentando el riesgo de efectos cardiovasculares adversos (ANAND, I, 2008) (PALAZZUOLI, A, 2014).
Varias líneas de investigación sugieren que el aumento de las reservas de hierro moderadamente sin evidencia de su deficiencia y asociado con sobrecarga de hierro grave, puede conferir mayor riesgo cardiovascular (QURAT-UL-AIN, J, 2010).
¿Cuál sería la dosis de hierro oral o intravenoso recomendada?
El aporte diario de hierro varía según el tipo de paciente y el grado de déficit a corregir. En pacientes adultos cuando la anemia es moderada, la dosis de hierro oral oscila entre 100 y 250mg/día de hierro elemental, siendo la dosis habitual de 150-200mg/día (2-3mg/kg/día). Los pacientes con anemia grave, o con hemorragias abundantes, pueden requerir hasta 300-400mg/día (PALMER,S, 2015).
En caso de ferropenia leve y déficit nutricional pueden ser suficientes aportes de 30-60mg/día. El hierro debe administrarse, repartido en 2-4 tomas, preferentemente en ayunas (1h antes o 2h después de las comidas). La ferroterapia debe mantenerse durante 6 meses (PALMER,S, 2015).
24
La falta de respuesta, tras un mes de tratamiento puede deberse a incumplimiento, inadecuada elección del preparado, malabsorción o pérdidas de sangre oculta.
La dosis de hierro intravenoso dependerá del preparado a elegir para el tratamiento, en el caso de hierro sacarosa se administrará 100mg a 200mg diluidos en 100cc de suero fisiológico a una velocidad de 40 gotas/min, de 1 -2 veces por semana. Hierro carboximaltosa se administrará a dosis de 500-1000mg (2 ampollas), hasta 15mg/kg, diluido en 250cc de suero fisiológico, a goteo no menos de 15 minutos por ampolla y 1 vez por semana (PALMER,S, 2015).
En anemias moderadas a severas en general se requiere un total de 500mg de hierro por cada 20Kg de peso del paciente. La respuesta al tratamiento se mide evaluando a los 2 a 4 días el aumento de la hemoglobina corpuscular media (HCM), antes de la semana se observa mejoría de los síntomas, a la semana 6 en jóvenes y semana 8 en ancianos elevación del pico reticulocitario, a las semanas 3 - 4 se observa mejoría de los valores eritrocíticos, entre la semana 3-12 presencia del doble población eritrocitaria confirmada por frotis y a los 4 meses corrección de los valores e índices eritrocitarios (PALMER,S, 2015).
Una vez corregidos valores e índices eritrocitarios continuar tratamiento con hierro a dosis bajas durante aproximadamente 3 meses a fin de llenar los depósitos de hierro. Luego suspender y controlar recaídas (PALMER,S, 2015).
Resumen de las Directrices para el Manejo de la Anemia en IC
25
2) Se ha demostrado que el tratamiento con hierro Oral no repone las reservas de hierro en pacientes con comorbilidades como la ERC, sangrado gastrointestinal, síndromes de mala absorción y enfermedad inflamatoria intestinal, por lo tanto no se recomienda su uso (MCMURRAY, 2012) (QURAT-UL-AIN, J, 2010).
3) Se contraindica el tratamiento con hierro en pacientes con anemia que cursen con infecciones sistémicas complicadas activas por aumento de bacteriemia e inflamación (PALAZZUOLI, A, 2014) (MCDONAGH, T, 2015).
4) En pacientes polimedicados con múltiples comorbilidades y en los que se requiera de una reposición rápida de hierro, se recomienda el uso de hierro intravenoso para obtener mejores resultados y adherencia del paciente al tratamiento.
2.4.2. AGENTES ESTIMULANTES DE LA ERITROPOYESIS
La eritropoyetina humana (EPO) es una hormona glucoproteíca que participa en la regulación de la eritropoyesis, se une de forma específica con el receptor de la EPO presente en las células progenitoras eritroides de la medula ósea, induciendo la producción de eritrocitos.
26
Cuatro tipos de EPO cuentan con estudios clínicos realizados en pacientes con IC y ERC asociada, estas son: Epoetina Alfa (Estudio CHOIR), Epoetina Beta (estudio CREATE), darbepoetina alfa (estudio TREAT, STAMINA-HeFT y RED-HF) (RAVISH, S, 2013). Estudio CHOIR
(Correction of Hemoglobin and Outcome in Renal Insufficiency) conto con 1432 pacientes, todos recibían epoetina alfa y eran aleatorizados a dos grupos de tratamiento: Grupo 1 con cifras de Hb > 13,5g/dl y Grupo 2 con cifras de Hb de 11.3g/dl. El estudio concluye prematuramente reportando tendencia a incremento del riesgo de muerte súbita o infarto de miocardio en el grupo con niveles de hemoglobina superiores (BICHARA,
V, 2009) (TEEHAN, G, 2011).
Estudio CREATE (Cardiovascular Risk Reduction by Early Anemia Treatment with Epoetin Beta) conto con 603 pacientes, todos recibían epoetina beta y se asignaron a dos grupos: Grupo 1 con cifras de Hb entre 13-15g/dl y el Grupo 2 con cifras de Hb entre 10.5-11.5g/dl. Similar al estudio CHOIR los investigadores observaron aumento del riesgo de muerte, de infarto de miocardio y eventos cerebrovasculares en el grupo con valores de hemoglobina más altos (TEEHAN, G, 2011).
27
De los estudios CHOIR y CREATE también se obtuvo información con efectos favorecedores en los grupos de pacientes que presentaban niveles de hemoglobina bajos, observándose reducción de la necesidad de transfusiones, mejor tolerancia al ejercicio, reducción de la hipertrofia ventricular izquierda y mejoría en la capacidad cognitiva (PALAZZUOLI, A, 2014).
Los Estudios TREAT (Trial to Reduce Cardiovascular Events with Aranesp Therapy), STAMINA-HeFT (The Study of Anemia in Heart Failure Trial) y el más reciente, RED-HF (The Reduction of Events by Darbepoetin Alfa in Heart Failure), valoraron a pacientes tratados con darbepoetina alfa. Los investigadores concluyeron, que no redujo la tasa de muerte u hospitalización en los pacientes con insuficiencia cardiaca sistólica y no se observo mejoría significativa en la duración del ejercicio, clase funcional NYHA o la calidad de vida. Además se evidencio significativo riesgo de eventos tromboembólicos con los pacientes que se llevó el objetivo de obtener hemoglobina de 13g/dl (SWEDBERG, K, 2013) (COLUCCI, W, 2015) (RAVISH, S, 2013).
Mancini et al, realizaron un estudio con el uso de Epoetina Alfa SC a dosis de 15.000UI a 30.000UI/semanales asociado a hierro oral 325mg y acido fólico 1mg día. El estudio demostró mejoría en el consumo máximo de O2 (VO2) y en el Cuestionario de Minnesota viviendo con la insuficiencia cardiaca. (MLHFQ) (PALAZZUOLI, A, 2014) (RAVISH, S, 2013).
28
Ponikowski et al, realizaron estudio con el uso de Darbepoetina Alfa SC a dosis de 0.75ug/kg cada 2 semanas asociada a hierro oral 200-300mg día, los investigadores concluyeron que no se observó diferencias respecto al consumo máximo de O2, duración de ejercicio, pro-BNP y la función renal entre los grupos de pacientes tratados
(PALAZZUOLI, A, 2014) (RAVISH, S, 2013) (ANAND, I, 2008).
Otros efectos positivos descubiertos en varios estudios relacionados al uso de Agentes Estimulantes de la Eritropoyesis (ESA) en la Insuficiencia Cardiaca podemos mencionar, la disminución del tamaño del infarto experimental, reducción del daño hipóxico evitando el deterioro funcional del corazón, reduce el estrés oxidativo, la inflamación y la fibrosis, y previenen la apoptosis de los cardiomiocitos (PALAZZUOLI, A, 2014) (RAVISH, S, 2013) (CARAMELO, C, 2008).
Westenbrink et al, observó que la neovascularización inducida por la EPO en la IC después de un infarto de miocardio aparecen 3 semanas después del evento, aumentando la movilización, el anidamiento miocárdico y la incorporación vascular de las células progenitoras endoteliales y factores de crecimiento, ejerciendo los efectos positivos ya descritos (PALAZZUOLI, A, 2014) (CARAMELO, C, 2008).
29
La probabilidad de trombosis es consecuencia de la hiperviscosidad y trombocitosis inducida por los ESA. Esta acción puede estar relacionada con un efecto directo de la EPO que potencia la acción de la trombopoyetina aumentando la activación plaquetaria (PALAZZUOLI, A, 2014).
La corrección de la deficiencia de hierro con hierro IV en pacientes con IC y ERC en diálisis tratados con EPO reduce significativamente el recuento plaquetario, por lo que se aconseja el uso de hierro concomitante a EPO para reducir los riesgos (PALAZZUOLI, A, 2014) (TANG, Y, 2007).
Otros efectos secundarios graves poco frecuentes observados con el tratamiento de EPO incluyen convulsiones y aplasia pura de células rojas (APCR) causada por la formación de anticuerpos neutralizantes anti-eritropoyetina. Esta última puede aparecer 3 meses o años de tratamiento con los ESA.
Ante la sospecha de APCR, se debe suspender el tratamiento con EPO exógena, quedando contraindicado su uso (CABRERA GARCIA, L, 2009) (TANG, Y, 2007).
Medicamentos antiplaquetarios y anticoagulantes recetados comúnmente en pacientes con IC pueden mitigar los efectos protrombóticos de los ESA. A continuación se detalla las dosis de las eritropoyetinas para el tratamiento de la anemia en Insuficiencia cardiaca y ERC asociada.
20UI/kg (SC) 3v/semana o 40UI/kg 3v/semana (IV), dosis máxima es 720UI/kg/semanal.
30
Estos agentes pueden ser administrados por vía intravenosa (IV) o subcutánea (SC) siendo preferible la administración IV en aquellos pacientes en los que el acceso vascular esté habitualmente disponible (pacientes en hemodiálisis), dejando la vía subcutánea al resto de pacientes no dialíticos (CABRERA GARCIA, L, 2009).
Las Recomendaciones del American College of Physicians referente al uso de ESA en pacientes con Insuficiencia Cardiaca y
anemia se resumen de la siguiente manera:
1) Utilizar solo en pacientes con IC y ERC con FG <60ml/min/1.73m2, que estén o no en diálisis.
2) Pacientes con IC y anemia sintomática;
3) Usar solo en pacientes con anemia severa, se contraindica su uso en anemias leve a moderada.
4) Administrar en dosis bajas y no por tiempo prolongado para evitar efectos negativos.
5) Manejarse con cuidado riesgo-beneficio y con estricto control de hemoglobina, en pacientes con antecedentes de infarto de miocardio o cáncer. El exceso de Hb se ha relacionado con un incremento del riesgo tromboembólico en esta población.
6) Se recomienda evitar aumento de la hemoglobina > 2g/dl al mes o cifras de hemoglobina superiores a 12g/dl, y realizar ajustes cada 4 semanas reduciendo el 25-50% de las dosis (CABRERA GARCIA, L, 2009) (PALAZZUOLI, A, 2014) (RAVISH, S, 2013) (TEEHAN, G, 2011).
2.4.3. HEMODERIVADOS
31
La evidencia científica sugiere una estrategia estricta (7-9g/dl Hb) es más efectiva y probablemente superior que la estrategia liberal (10-12g/dl Hb) en pacientes críticos, y que, un valor de Hb entre 7 - 9g/dl es bien tolerado por la mayoría de los pacientes a nivel del mar o hasta 1.500mts de altura (MADRAZO-GONZALEZ, Z, 2011) (HEREDIA, M, 2013). Estudios
sugieren que un valor de Hb entre 9-10g/dl es más apropiado que valores más bajos en pacientes con coronariopatías (HEREDIA, M, 2013).
Se describe a continuación las recomendaciones de TSA en pacientes críticos, según las Guías de Transfusión de Sangre y sus Componentes del MSP de nuestro país.
Una unidad de sangre estándar contiene aproximadamente 250mg de hierro elemental (QURAT-UL-AIN, J, 2010). Cuando se requiere una TSA en
un paciente con IC, se recomienda una cuidadosa atención a la condición del volumen, incluyendo el ajuste de diuréticos suplementario para evitar la sobrecarga de líquidos (COLUCCI, W, 2015).
32
La TSA representa una medida rápida y eficaz para restablecer los valores fisiológicos de hemoglobina e incrementar así la capacidad transportadora de O2, especialmente útil en el contexto de anemia grave y/o hemorragia activa, pero no exenta de importantes complicaciones como por ejemplo, transmisión de enfermedades infecciosas (por imposibilidad de detección viral), riesgo de reacciones de tipo inmune (alergias, fiebre, purpura postransfusional, hemolisis, aloinmunización), reacciones no inmunes (error transfusional, sobrecarga férrica), complicaciones cardiopulmonares y tromboembólicas, prolongación de la estancia y mortalidad hospitalaria, leucoencefalopatía posterior reversible, entre otras (MADRAZO-GONZALEZ, Z, 2011). Por estas razones, la
transfusión se debe considerar solo en caso de anemia grave (PALAZZUOLI, A, 2014).
33
CAPITULO III
3. MATERIALES Y MÉTODOS
3.1.
MATERIALES3.1.1. LUGAR DE INVESTIGACION
El estudio se realizará en las Unidades Críticas del Hospital Luis Vernaza de la ciudad de Guayaquil.
3.1.2. PERIODO DE LA INVESTIGACION
El periodo de investigación se realizó desde Noviembre del 2015 hasta Julio del 2016.
3.1.3. RECURSOS UTILIZADOS
3.1.3.1. RECURSOS HUMANOS Investigador
Tutor
Revisor
3.1.3.2. RECURSOS FISICOS Computador AMD HP
Impresora HP multifunción
Ficha de recolección de datos
Hojas de papel bond
Cartuchos de tinta color y b/n
Bolígrafos
34
3.1.4. UNIVERSO Y MUESTRA
El universo está conformado por todos los sujetos hospitalizados en Unidades Críticas (UCI, Reanimación y U. Coronaria) del Hospital Luis Vernaza durante el periodo de Enero 2014 a Diciembre 2015. La población estará constituida por los sujetos con diagnóstico de Insuficiencia Cardiaca Crónica Descompensada hospitalizados en Unidades Críticas del Hospital Luis Vernaza durante el periodo de Enero 2014 a Diciembre 2015. No se muestreará ya que se empleará a toda la población.
3.2 MÉTODOS.
3.2.1. TIPO DE INVESTIGACIÓN
Se trata de un estudio observacional de tipo retrospectivo, en el que se intentará demostrar la asociación de las bajas cifras de hemoglobina y hematocrito al ingreso, con el aumento de la mortalidad en la Insuficiencia Cardiaca Crónica Descompensada, de sujetos hospitalizados en áreas críticas del Hospital Luis Vernaza de la ciudad de Guayaquil, durante el periodo de Enero 2014 a Diciembre 2015.
3.2.2. DISEÑO DE INVESTIGACIÓN
Este estudio se realizará en cooperación con los Servicios de Cardiología, Medicina Crítica y Emergencia del Hospital Luis Vernaza. Se recolectará información de las historias clínicas incluyendo variables como edad, género, clase funcional NYHA, hemoglobina, estancia hospitalaria y datos ecocardiográficos como fracción de eyección, los cuales serán tabulados metodológicamente. Se seleccionará a los sujetos que reúnan los criterios de inclusión para el estudio.
3.2.3. CRÍTERIOS DE INCLUSIÓN.
Mayores de 18 años.
Pacientes hospitalizados en áreas críticas que reúnan criterios clínicos y
de diagnóstico para Insuficiencia Cardiaca Crónica Descompensada.
Presencia de anemia al ingreso, definida por los criterios de la OMS
como hemoglobina < 13.0g/dl para hombres y < 12.0g/dl para mujeres.
35
3.2.4. CRÍTERIOS DE EXCLUSIÓN.
Causa evidente de sangrado, portadores de enfermedades neoplásicas
e infecciosas activas.
Cirugía, uso previo de suplementos de hierro o que hayan recibido
transfusión sanguínea en los últimos tres meses.
Presencia de insuficiencia renal (Estadio V) y hepática terminal (CHILD
PUGH C).
Para la identificación de la etiología más prevalente de anemia en los sujetos con IC se hará uso de los índices eritrocitarios medidos con el Analizador Automático de hematología del laboratorio central.
Finalmente se intentará determinar, que cuanto menor es el índice de Hemoglobina, peor es el pronóstico; demostrando así, que la anemia es un predictor importante y práctico de mortalidad que debe ser tomado en cuenta y resuelto en sujetos con Insuficiencia Cardiaca Crónica Descompensada.
3.2.5. TÉCNICA DE ANÁLISIS DE DATOS
36
CAPITULO IV
4. RESULTADOS Y DISCUSIÓN
Resultados.-
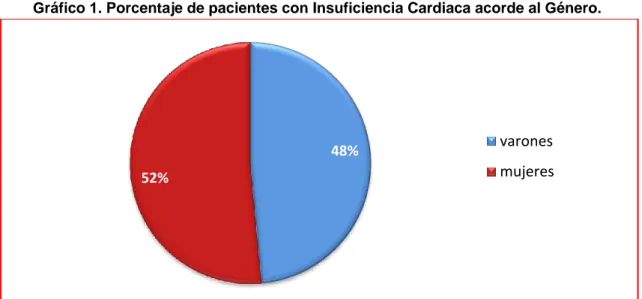
El total de pacientes que se incluyeron en el estudio fue 99. Del total de pacientes, 48 fueron varones (48%) y 51 mujeres (52%) (Ver Gráfico 1).
Gráfico 1. Porcentaje de pacientes con Insuficiencia Cardiaca acorde al Género.
Fuente: Datos recopilados entre Enero 2014 a Diciembre 2015 Unidades Críticas Hospital Luis Vernaza
De los 99 pacientes estudiados, el 66% y 34% de los pacientes anémicos eran mayores y menores de 65 años respectivamente, mientras que los pacientes no anémicos mayores y menores de 65 años se encontraron en un 57% y 43% respectivamente (Ver Gráfico 2).
Gráfico 2. Relación Edad en la población de estudio.
Fuente: Datos recopilados entre Enero 2014 a Diciembre 2015 Unidades Críticas Hospital Luis Vernaza
37
Tabla 1. Características de la población de sujetos con IC anémicos vs No anémicos.
Características Total = 99 Con Anemia
64 (65%)
Hospitalaria 17.0±14.87 17.3±16.27 16.4±12.09 0.766
Óbitos 18(18%) 16(25%) 2(6%) 0.017
Fuente: Datos recopilados entre Enero 2014 a Diciembre 2015 Unidades Críticas Hospital Luis Vernaza
Como se observa en la Tabla 1, 64 pacientes presentaron anemia (65%), mientras que los 35 pacientes restantes no presentaron anemia (35%). El promedio de edad de la población estudiada fue de 70.1±13.7 años. El promedio de hemoglobina de los pacientes que presentaron anemia fue 9.19±1.40 y de los que no presentaron anemia fue de 13.7±1.31 g/d, con una diferencia significativa obteniendo un valor p asociado < 0,050. Los promedios de fracción de eyección (FE) de los pacientes con y sin anemia fue de 34.9±9.36 y 52.3±13.34 % respectivamente, se comprobó una diferencia significativa entre los promedios con un valor p asociado < 0,001.
38
De los 99 pacientes investigados, el 77% de los pacientes con anemia presentaron clase funcional Grado III de la NYHA, mientras que en los pacientes sin anemia el 54% presentaron clase funcional Grado III de la NYHA. El promedio de días de hospitalización de los pacientes con y sin anemia fue de 17.3±16.27 y 16.4±12.09 días respectivamente.
Tabla 2. Relación Eventos Mortales en la población de estudio.
Características Total = 99 Con Anemia
=64
Sin Anemia
=35 Valor p
Vivos 81(82%) 48(75%) 33(94%) ---
Óbitos 18(18%) 16(25%) 2(6%) 0.017
Gráfico 3. Relación Eventos Mortales en la población de estudio.
Fuente: Datos recopilados entre Enero 2014 a Diciembre 2015 Unidades Críticas Hospital Luis Vernaza
39
Tabla 3. Etiología de la anemia en pacientes anémicos con IC en Unidades Críticas.
Pacientes Anémicos
Anemia de Trastorno Crónico
Anemia Ferropénica
Anemia Megaloblástica
64(100%) 45(70%) 16(25%) 3(5%)
Gráfico 4. Etiología de la anemia en pacientes anémicos con IC en Unidades Críticas.
Fuente: Datos recopilados entre Enero 2014 a Diciembre 2015 Unidades Críticas Hospital Luis Vernaza.
En la identificación de la etiología de la anemia, de los 64 pacientes que presentaron anemia, 45 pacientes (70%) presentaron anemia de trastorno crónico, 16 pacientes (25%) anemia ferropénica y 3 pacientes (5%) anemia megaloblástica (Ver Tabla 3 y Gráfico 4).
25%
70%
5%
N° Anemia ferropenica
Anemia trastornos crónicos
40
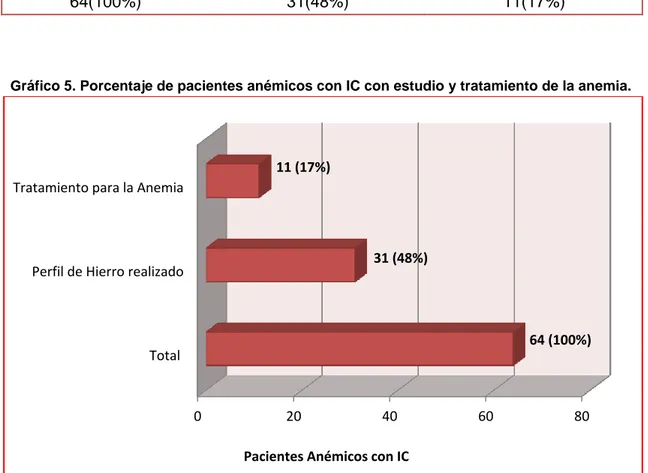
Tabla 4. Porcentaje de pacientes anémicos con IC con estudio y tratamiento de la anemia.
Pacientes Anémicos Estudio Perfil de Hierro Recibieron tratamiento
para la Anemia
64(100%) 31(48%) 11(17%)
Gráfico 5. Porcentaje de pacientes anémicos con IC con estudio y tratamiento de la anemia.
Fuente: Datos recopilados entre Enero 2014 a Diciembre 2015 Unidades Críticas Hospital Luis Vernaza.
En cuanto al estudio de la anemia y su tratamiento, del total de pacientes anémicos se encontró, que 31 pacientes (48%) contaba con estudios de perfil de hierro y solo 11 (17%) recibió tratamiento para la anemia (Ver Tabla 4 y Gráfico 5).
0 20 40 60 80
Total Perfil de Hierro realizado Tratamiento para la Anemia
64 (100%) 31 (48%)
11 (17%)
41
Tabla 5. Relación Fracción de Eyección en la población de estudio.
Características Total = 99 Con Anemia
= 64
Sin Anemia = 35
FE> /= 40% 47(47%) 18(28%) 29(83%)
FE< 40% 52(53%) 46(72%) 6(17%)
Gráfico 6. Relación Fracción de Eyección en la población de estudio.
Fuente: Datos recopilados entre Enero 2014 a Diciembre 2015 Unidades Críticas Hospital Luis Vernaza
De los 99 pacientes estudiados, el 53% presento una FE < 40% y el 47% tenía una FE >/= 40%. En el grupo de pacientes anémicos el 72% y 28% presentaron una FE < 40% y >/= 40% respectivamente. Mientras que en el grupo de pacientes no anémicos se encontró, una FE < 40% y >/=40% en el 17% y 83% respectivamente (Ver Tabla 5 y Gráfico 6).
0 10 20 30 40 50 60 70 80 90 100
Anémicos No Anémicos Total 28%
83%
47% 72%
17%
53%
FE > = 40%
42
Tabla 6. Relación Clase funcional en la población de estudio.
Características Total = 99 Con Anemia
= 64
Gráfico 7. Relación Clase funcional en la población de estudio.
Fuente: Datos recopilados entre Enero 2014 a Diciembre 2015 Unidades Críticas Hospital Luis Vernaza
43
Tabla 7. Relación Creatinina en la población de estudio
Características Total = 99 Con Anemia
= 64
Sin Anemia = 35
Creatinina < = 1.5 45(45%) 20(31%) 25(72%) Creatinina > 1.5 54(55%) 44(69%) 10(28%)
Gráfico 8. Relación Creatinina en la población de estudio
Fuente: Datos recopilados entre Enero 2014 a Diciembre 2015 Unidades Críticas Hospital Luis Vernaza
Del total de pacientes estudiados, el 45% y el 55% presentaron una creatinina < = 1.5 y > 1.5mg/dl, respectivamente. En el grupo de pacientes anémicos, el 69% presentaron una creatinina > 1.5mg/dl y el 31% presentó una creatinina < = a 1.5mg/dl. Mientras que en el grupo de pacientes no anémicos se encontró una creatinina < = 1.5 y > 1.5mg/dl en el 72% y 28%, respectivamente (Ver Tabla
7 y Gráfico 8).
0 10 20 30 40 50 60 70 80 90 100
Anémicos No Anémicos Total
69%
28%
55%
31%
72%
44
Tabla 8. Características de la Anemia de acuerdo a la Severidad en pacientes con IC.
N=64 Anemia Leve
Hospitalaria 16.5±9.19 16.4±14.35 23.8±31.02 ---
Fuente: Datos recopilados entre Enero 2014 a Diciembre 2015 Unidades Críticas Hospital Luis Vernaza
Gráfico 9. Porcentaje de la anemia en pacientes con IC de acuerdo a la severidad.
Fuente: Datos recopilados entre Enero 2014 a Diciembre 2015 Unidades Críticas Hospital Luis Vernaza
45
Del total de pacientes anémicos el 76% presentaron clase funcional Grado III NYHA. El promedio de creatinina en los pacientes con anemia leve fue de 1.3±0.51, con anemia moderada fue de 1.9±0.79 y con anemia severa 2.8±0.92 mg/dl, el 69% de los pacientes anémicos en general, presentaban una creatinina mayor de 1.5mg/dl.