Determinación de la Temperatura Óptima de Sacarificación y Fermentación Láctica con Lactobacillus Delbrueckii Ssp Bulgaricus para la Obtención de Ácido Láctico a partir de Almidón de Bituca (Colocasia Esculenta)
Texto completo
(2) “DETERMINACIÓN. DE. LA. TEMPERATURA. ÓPTIMA. DE. SACARIFICACIÓN Y FERMENTACIÓN LÁCTICA CON Lactobacillus Delbrueckii ssp bulgaricus PARA LA OBTENCIÓN DE ÁCIDO LÁCTICO A PARTIR DE ALMIDÓN DE BITUCA (Colocasia Esculenta)”. TESIS PARA OPTAR EL TÍTULO PROFESIONAL DE INGENIERO QUÍMICO PRESENTADO POR: Bach. AGUILAR BLANCO LUZ MAGALI Bach. HERRERA VÁSQUEZ MAIRA LUDWIKA. Sustentada y aprobada ante el siguiente jurado:. Ing. M. Sc. Carlos Reinerio Arce Cruzado Presidente. Ing. M. Sc. Sebastian Huangal Scheineder Secretario. Ing. M. Sc. Rodolfo Pastor Tineo Huancas Vocal. Dr. José Luis Venegas Kemper Asesor.
(3) DEDICATORIA. A DIOS, por ser el soporte en mi vida, por ser la luz para mis ojos, la sabiduría para mi mente, la humildad para mis senderos y la fortaleza para nunca rendirme. Por haber puesto en mí camino a grandes personas con el fin de enseñarme que existe bondad en el mundo.. A MIS PADRES, Luis y Laura, quienes con su constante e incansable voluntad me han dirigido hacia el camino que me lleve a cumplir mis metas, por su infinito amor, paciencia y por tener las palabras correctas en cada momento. Por su compromiso con mi vida personal y profesional, su entrega es para mí, signo de mucha admiración.. A MIS HERMANOS, Francisco y Maricarmen, por ser mis compañeros de viaje, porque estando a su lado, la luz de la esperanza se hace más visible. Por cada muestra de cariño y por enseñarme con sus acciones lo hermosa es la vida.. A MIS ABUELOS, Porfirio y Adina, por sus sabios consejos y su silencio para discernir y buscar siempre una solución. Han sido y son autores fundamentales en el desarrollo de mi existencia.. A MI TÍO, Adelmo, por ser mi refuerzo en todo momento, por ser mi primer amigo, hermano y guía. Porque los mejores momentos han sido compartidos con su presencia y por confiar siempre en mí.. A MI COMPAÑERA DE TESIS, Magali Aguilar, por ser como es, una gran persona, por enseñarme que no existen imposibles cuando se tiene una visión clara, porque tiene una voluntad infinita y nunca se rinde. Por ser mi hermana y compañera de muchos momentos de la vida.. A MIS FAMILIARES Y AMIGOS, por cada palabra de ánimo, por la confianza brindada y el apoyo emocional.. MAIRA LUDWIKA HERRERA VÁSQUEZ.
(4) DEDICATORIA. A DIOS, por haberme dado la vida y permitirme el haber llegado hasta este momento tan importante de mi formación profesional.. A MIS PADRES, Alejandro y Susana, por ser los pilares más importantes y por demostrarme su apoyo incondicional y económico en todo momento, por sus consejos, sus valores, por la motivación constante que me ha permitido ser una persona de bien, pero más que nada, por su amor.. A MIS HERMANOS, Rey, Lila Y Rocío; porque de una u otra manera son la razón por la cual me vi en este punto de mi vida. A puertas del título profesional tan anhelado. Por sus palabras de aliento en el momento preciso, por cada muestra de cariño y porque no existe duda que siempre contaré con ellos.. A MIS SOBRINOS, Angel, Cielito, Gimena y Alejandro, por ser mi compañía, mi apoyo y mi fuerza para seguir adelante.. A MI COMPAÑERA DE TESIS, Maira Herrera, por ser mi mejor amiga, mi persona, por haber logrado nuestro objetivo con mucha perseverancia, por su comprensión, apoyo y por estar presente en esta etapa tan importante de mi vida.. LUZ MAGALI AGUILAR BLANCO.
(5) AGRADECIMIENTOS. AGRADECER PRINCIPALMENTE A DIOS, por darnos la sabiduría y el discernimiento alcanzado para culminar este proyecto. Por la fortaleza que nunca nos dejó desfallecer y por habernos puesto en el camino a personas que han sido apoyo incondicional en todo momento.. A NUESTROS PADRES, por su apoyo incondicional en todo momento y por creer en nosotras, por darnos siempre una voz de aliento, gracias por los sacrificios que hicieron para que todo esto se hiciera realidad. Sobre todo por ser un excelente ejemplo de vida a seguir.. A NUESTRO ASESOR, Ing. Luis Venegas Kemper, por su apoyo y dedicación brindada. Por la dirección y el rigor durante el desarrollo de este proyecto.. A TODAS LAS PERSONAS, INGENIEROS Y AMIGOS, por su ayuda brindada directa e indirectamente para lograr nuestros objetivos trazados.. TESISTAS..
(6) Índice RESÚMEN .............................................................................................................................................................1 ABSTRAC ..............................................................................................................................................................2 INTRODUCCIÓN .................................................................................................................................................3 CAPÍTULO I: FUNDAMENTO TEÓRICO.......................................................................................................4 1.1.. BITUCA (Colocasia esculenta)..............................................................................................................5. 1.2.. ÁCIDO LÁCTICO......................................................................................................................................19. 1.3.. Sacarificación para la obtención de ácido láctico ................................................................................28. 1.4.. Fermentación láctica .............................................................................................................................30. 1.5.. Factores que influyen en la fermentación láctica. ...............................................................................31. 1.6.. Aplicaciones del ácido láctico. ..............................................................................................................31. 1.7.. Producción de ácido láctico. ...............................................................................................................33. CAPÍTULO II: MATERIALES Y MÉTODOS ................................................................................................38 2.1.. Localización. .........................................................................................................................................39. 2.2.. Medio de cultivo. ..................................................................................................................................39. 2.3.. Población y muestra.............................................................................................................................39. 2.4.. Materiales, técnicas e instrumentos de recolección de datos............................................................39. 2.5.. Descripción del proceso experimental. ...............................................................................................41. CAPITULO III: RESULTADOS Y DISCUSIÓN ............................................................................................60 3.1.. Obtención de almidón ..........................................................................................................................61. 3.2.. Evaluación de la calidad del almidón obtenido .................................................................................61. 3.3.. Sacarificación del almidón de bituca..................................................................................................62. 3.4.. Producción de ácido láctico .................................................................................................................64. DISCUSIÓN .........................................................................................................................................................66 CAPITULO IV: CONCLUSIONES Y RECOMENDACIONES ....................................................................68 RECOMENDACIONES .....................................................................................................................................70 REFERENCIAS BIBLIOGRÁFICAS ...............................................................................................................72 APÉNDICE...........................................................................................................................................................76 ANEXOS ...............................................................................................................................................................88.
(7) Índice de tablas. Tabla 1: Composición química del almidón de bituca (Colocasia Esculenta) ........................................................8 Tabla 2: Superficie cosechada por producto según año, 2012-2016 (miles hectáreas) ........................................14 Tabla 3: Producción agrícola por producto según año, 2012-2016 (miles toneladas) ..........................................15 Tabla 4: Rendimiento agrícola por producto según año, 2012-2016 (toneladas por hectárea).............................16 Tabla 5: Superficie cosechada de raíces y tubérculos comestibles por región según producto, 2016 (hectáreas)18 Tabla 6: Pituca por región según variables productivas, 2015-2016. ...................................................................19 Tabla 7: Microorganismos productores de ácido láctico. .....................................................................................26 Tabla 8: Evolución de las temperaturas vs pH en el proceso de sacarificación....................................................46 Tabla 9: Características y especificaciones del microorganismo utilizado...........................................................51 Tabla 10: Características del crecimiento del microorganismo Lactobacillus Delbrueckii ssp Bulgaricus. ........53 Tabla 11: Evolución de las temperaturas vs pH de la solución en el proceso de fermentación............................55 Tabla 12: Producción de ácido láctico a diferentes temperaturas. ........................................................................58 Tabla 13: composición química del almidón de bituca (Colocasia Esculenta).....................................................62 Tabla 14: Análisis de sacarificación de almidón de bituca (Colocasia Esculenta) ...............................................78 Tabla 15: Análisis del porcentaje de producción de ácido láctico. .......................................................................80. Índice de gráficos Gráfico 1: Tasa de crecimiento del precio al productor agrícola por producción, 2012-2016. ............................17 Gráfico 2: Superficie cosechada de raíces y tubérculos comestibles por producto, 2016 ....................................18 Gráfico 3: Evolución de la temperatura vs pH de la solución en el proceso de sacarificación. ...........................47 Gráfico 4: Determinación de la T° óptima vs % de azúcares reductores de la solución sacarificada...................49 Gráfico 5: Evolución de las temperaturas vs pH de la solución en el proceso de fermentación. .........................56 Gráfico 6: Representación gráfica de la producción de ácido láctico en función a la temperatura. .....................58 Gráfico 7: relación que existe entre la temperatura y el % de ácidos reductores en la solución de almidón de bituca (Colocasia Esculenta) ..................................................................................................................................63 Gráfico 8: relación de la temperatura vs pH de la solución sacarificada. .............................................................63 Gráfico 9: evolución de la temperatura vs pH de la solución fermentada. ...........................................................64 Gráfico 10: porcentaje de producción de ácido láctico. ........................................................................................65. Índice de cuadros Cuadro 1: Propiedades físico-químicas del ácido láctico. ....................................................................................20 Cuadro 2: Microorganismos utilizados en producción de ácido láctico. ..............................................................25 Cuadro 3: Determinación de azúcares reductores en la solución sacarificada. ....................................................49.
(8) Índice de figuras Figura 1: Extracción de almidón por vía húmeda. .................................................................................................9 Figura 2: Extracción de almidón por vía seca. ....................................................................................................12 Figura 3: Síntesis química de ácido láctico. ........................................................................................................22 Figura 4: Fermentación homoláctica para producción de ácido láctico. .............................................................23 Figura 5: Fermentación heteroláctica para producción de ácido láctico. ............................................................23 Figura 6: Método de producción de ácido láctico. (a) Síntesis química (b) Biotecnologica= Sacarificación y fermentación simultánea. .......................................................................................................................................24 Figura 7: Lactobacillus delbrueckii ssp. Bulgaricus. ...........................................................................................27 Figura 8: Usos de ácido láctico según la aplicación. ...........................................................................................32 Figura 9: Consumidores mundiales de ácido láctico. ..........................................................................................33 Figura 10: Proyección del mercado de ácido láctico para el año 2020................................................................34 Figura 11: Importación mundial de ácido láctico. ...............................................................................................35 Figura 12: Exportación mundial de ácido láctico. ...............................................................................................36 Figura 13: Importación de nivel Latinoamérica de ácido láctico. .......................................................................37 Figura 14: Exportación a nivel Latinoamérica de ácido láctico. .........................................................................37 Figura 15: Crecimiento del microorganismo utilizado en el proyecto de investigación. ....................................51 Figura 16: Procedimiento para la obtención del ácido láctico a partir de almidón de bituca. .............................59 Figura 17: Balance de materia para la obtención del almidón de bituca. ............................................................61.
(9) RESÚMEN. El estudio realizado tuvo como materia prima la bituca producida en la provincia de Leoncio Prado, región de Huánuco, por su desconocimiento en el mercado es poco aprovechada como suplemento alimenticio y como alternativa en la industria para generar nuevos productos y minimizar costos de producción.. El presente trabajo de investigación pretende dar una alternativa de desarrollo para la sociedad como fuente de trabajo y a su vez enfocado a disminuir los costes de producción del ácido láctico; trazando para esto como objetivo general determinar la temperatura óptima de sacarificación y fermentación láctica con lactobacillus delbrueckii para la obtención de ácido láctico a partir de almidón de bituca (colocasia esculenta). El presente estudio se ha desarrollado de la siguiente manera, desde la obtención del almidón de bituca hasta la producción de ácido láctico. Para obtener el almidón de bituca se realizaron dos métodos: Vía húmeda y vía seca. Para realizar el procedimiento por vía seca primeramente se procedió a lavar la materia prima para luego ser cortada en partes pequeñas y llevadas a secar en la estufa a una temperatura de 106 °C por 24 horas. De esa manera eliminar el agua presente en la bituca. Pasado el tiempo se llevó la bituca a un proceso de molienda, realizado en un molino industrial. Por otra parte, se realizó el cultivo de la bacteria Lactobacillus Delbrueckii ssp Bulgaricus obteniéndola a partir de muestras de queso y yogurt. Como siguiente paso se realizó el proceso de sacarificación con la finalidad de obtener toda la cantidad de azúcares llevándola a diferentes temperaturas para posteriormente medir la temperatura óptima. Luego se procedió al proceso de fermentación ésta al igual que en la sacarificación también se realizó con una serie de medidas de la temperatura. Este proceso se desarrolló en un tiempo de 5 días. Logrando como producto final el ácido láctico, teniendo un rendimiento del 19.1% a una temperatura de sacarificación de 76ºC y una temperatura de fermentación óptima de 37°C. 1.
(10) ABSTRAC The study carried out as a raw material the bituca produced in the province of Leoncio Prado, Huánuco region, due to its lack of knowledge in the market, it is little used as a food supplement and as an alternative in the industry to generate new products and minimize production costs.. The present research work seeks an alternative development for the company as a source of work and, in turn, reduces the costs of production of lactic acid; tracing for this as a general objective to determine the optimal temperature of extraction and lactic fermentation with lactobacillus delbrueckii to obtain lactic acid from bituca starch (colocasia esculenta). The present study has been developed in the following manner, from the production of bitumen starch to the production of lactic acid. To obtain the bituca starch, two methods were carried out: Wet and dry route. To carry out the dry process, the raw material was first washed and then cut into small pieces and dried in the oven at a temperature of 106 ° C for 24 hours. In this way eliminate the water present in the bituca. After the time the bituca was taken to a grinding process, carried out in an industrial mill. On the other hand, the cultivation of the bacterium Lactobacillus Delbrueckii ssp Bulgaricus was obtained by obtaining it from samples of cheese and yogurt. As a next step, the saccharification process was carried out in order to obtain the entire amount of sugars, bringing it to different temperatures to subsequently measure the optimum temperature. Then the fermentation process was proceeded as in saccharification was also performed with a series of temperature measurements. This process was developed in a time of 5 days. Achieving the final product lactic acid, having a yield of 19.1% at a saccharification temperature of 76 ° C and an optimum fermentation temperature of 37 ° C.. 2.
(11) INTRODUCCIÓN. En la actualidad como bien se conoce el ácido láctico tiene un amplio rango de aplicaciones en la industria alimenticia, farmacéutica, química, y cosmética, entre otras. La producción biotecnológica del ácido láctico ha adquirido gran importancia debido a los beneficios ambientales y al uso de recursos renovables en lugar de los petroquímicos. Los esfuerzos en la investigación del ácido láctico, están enfocados a disminuir los costes de producción a través de nuevos sustratos, nuevas tecnologías de fermentación y separación y nuevos microorganismos capaces de alcanzar altas concentraciones de ácido láctico, altos rendimientos y altas productividades.. El proyecto está desarrollando una nueva tecnología que puede revolucionar el proceso de obtención de ácido láctico, además ofrece nuevos potenciales para la industria de la agricultura. La materia prima (la cual es renovable) juega un papel muy importante en la obtención de ácido láctico, y con ellos, la agricultura obtiene todo un nuevo mercado de alimentos.. En el presente trabajo de investigación se realiza la determinación de la temperatura óptima de sacarificación y fermentación láctica con lactobacillus delbrueckii para la obtención de ácido láctico a partir de almidón de bituca (colocasia esculenta).Se prosiguió de la siguiente manera; comenzando desde la obtención de almidón de bituca hasta la producción de ácido láctico. Aplicando las operaciones de pesado, secado, sacarificación y fermentación, las cuales nos llevaron a desarrollar y cumplir con los objetivos planteados: Determinar composición y las propiedades físico-químicas del almidón de bituca. Estudiar la temperatura óptima en la sacarificación y fermentación láctica con lactobacillus delbrueckii Evaluar los resultados de la experimentación.. Además el trabajo de investigación está dividido en 4 capítulos: cap. I. Fundamento teórico, cap. II. Materiales y métodos, cap. III. Resultados y discusión, cap. IV. Conclusiones y recomendaciones.. 3.
(12) CAPÍTULO I: FUNDAMENTO TEÓRICO. 4.
(13) 1.1.. BITUCA (Colocasia esculenta) La bituca, cuyo nombre científico es “Colocasia Esculenta”, proviene originariamente de Asia (Korea y Japón), aunque se ha adaptado perfectamente a los diversos climas del continente americano. En nuestro país se le puede encontrar profusamente en zonas de la selva, aunque su consumo a nivel local se observa apenas en las poblaciones amazónicas, sobre todo en las nativas o en aquellas que conocen de su uso altamente digestivo, pero para el resto del país, fundamentalmente los capitalinos, constituye algo desconocido. La bituca es uno de las materias primas poco utilizadas, teniendo una composición del 27% de almidón, posee tamaños de granulo de almidón entre 1 a 6,5 micras, cualidad que le hace un almidón de calidad, pues mientras más pequeño sea el tamaño del granulo de almidón, mayor será su digestibilidad. En el Perú a esta raíz se le conoce como "Pituca o Bituca" variando en algunos departamentos como "Aratrina" en Huánuco. "Taro" en Moyobamba, "Michutsi", en lugares de selva alta, "Witina" en el bajo Amazonas.", mientras en otros países se le conoce por diversos nombres como Toran, que en coreano significa “huevo de tierra”, otoe, kalo (del idioma tahitiano), cará (Brasil), malanga (Puerto Rico, México, Cuba, y República Dominicana), y madumbe, entre otros. (Schott, Heinrich Wilhelm, 2015) 1.1.1. Taxonomía Reino: Plantae División: Magnoliophyta Clase: Liliopsida Orden: Alismatales Familia: Araceae Subfamilia: Aroideae Género: Colocasia Especie: Colocasia esculenta Nombre binomial: Colocasia esculenta (L.) Schott. 5.
(14) Foto N°1: Planta de bituca (Colocasia Esculenta). Fuente: Las autoras. Foto N° 2: Fruto de la bituca (Colocasia Esculenta). Fuente: Las autoras. 6.
(15) 1.1.2. Variedades En nuestro país hay dos subespecies: la blanca que es la que tiene un tamaño superior y la morada que según los pobladores de nuestros trópicos húmedos no es de sabor muy agradable. La diferencia en el color radica en que en los cormos hay unas ramificaciones de color morado, en ambas las hay, pero si se dice que la otra subespecie es morada es porque posee mayor cantidad de ramificaciones.. 1.1.3. Características organolépticas:. FORMA: Ovalada, ovoide SABOR: Característico, harinoso AROMA: Ausente. 7.
(16) 1.1.4. Composición química de la pituca, para 100 gramos de producto, en base seca.. Tabla 1: Composición química del almidón de bituca (Colocasia Esculenta). Composición. Pituca blanca. Calorías (kcal). 359.16. Humedad (%). 11.45. Proteínas base seca (%) 3.5 Grasas (%). 0,6. Carbohidratos (%). 84.85. Fibra (%). 2.25. Cenizas (%). 3.1. Valor nutritivo. 24.65. Calcio (mg). 27. Fósforo (mg). 1,6. Riboflavina (mg). 0,03. Niacina (mg). 5,2. Ácido ascórbico (mg). 18. Fuente: Laboratorio de Microbiología – Microservilab – UNPRG (2018). 1.1.5. Métodos De Extracción de almidón. Extracción de almidón por vía húmeda Extracción de almidón por vía seca. 8.
(17) 1.1.5.1.. Extracción de almidón por vía húmeda. PROCEDIMIENTO EXPERIMENTAL:. Figura 1: Extracción de almidón por vía húmeda.. ADQUISICION DE LA MATERIA PRIMA. Agua potable Temperatura ambiente Presión = 100 kPa. LAVADO DE LA BITUCA. Agua potable Residuos solidos. PELADO DE LA BITUCA. Residuos solidos (Cascara). MOLIDO DE LA BITUCA. LAVADO Y PRENSADO. SEDIMENTACIÓN. SECADO. ALMIDÓN DE BITUCA. Fuente: Las autoras. 9. Agua Destilada Residuos solidos. Agua destilada Residuos solidos.
(18) DESCRIPCION DEL PROCEDIMIENTO EXPERIMENTAL Adquisición de la materia prima: la bituca (Colocasia Esculenta) se compró del mercado de abastecimiento de Tingo María, del departamento de Huánuco.. Lavado de la bituca: en esta etapa se utiliza agua potable a temperatura ambiente, a una presión 100 Kpa para eliminar toda la tierra presente en la cascara, así no contaminar con tierra las posteriores etapas. Según el Documento Básico DB-HS 4, que complementa el Código Técnico de la Edificación (Real Decreto 314/2006), "en los puntos de consumo la presión mínima, medida en kilopascales (kPa), debe ser:. a) 100 kPa (=1'02 Kg/cm2) para grifos comunes. b) 150 kPa (=1'53 Kg/cm2) para fluxores y calentadores. La presión en cualquier punto de consumo no debe superar los 500 kPa (=5'1 Kg/cm2)". Pelado de la bituca: se le realizó con la ayuda de un cuchillo, separando la cascara ya que la cascara no interviene en la obtención de almidón.. Molido de la bituca: primeramente se procedió a trozar en tamaños aproximadamente de 3cm por 3cm, luego con la ayuda de una moledora se molió la bituca teniendo un molido fino pastoso.. Lavado y prensado: al molido fino pastoso, se le lavó cuatro veces con agua destilada a temperatura ambiente, en diferentes recipientes para obtener un mayor porcentaje de almidón y eliminar la presencia de impurezas. Posteriormente se realizó el prensado con una coladera de tela para separar la mayor cantidad de agua posible y evitar la pérdida de muestra.. 10.
(19) Sedimentación: las cuatro muestras lavadas en diferentes bandejas, se las dejo sedimentar por dos días. Pasado este lapso de tiempo se separó la parte liquida de la parte sólida.. Secado: una vez obtenida la parte sólida de la sedimentación, se dejó secar a temperatura ambiente, durante un tiempo de 2 días.. 11.
(20) 1.1.5.2.. EXTRACCIÓN DE ALMIDÓN POR VÍA SECA. PROCEDIMIENTO EXPERIMENTAL: Figura 2: Extracción de almidón por vía seca.. ADQUISICION DE LA MATERIA PRIMA. Agua potable Temperatura ambiente. LAVADO DE LA BITUCA. Agua potable Residuos solidos. PELADO DE LA BITUCA. Residuos solidos (Cascara). Presión = 100 kPa. SECADO DE LA BITUCA. Agua presente en la bituca.. MOLIDO DE LA BITUCA. TAMIZADO DEL ALMIDÓN DE BITUCA. ALMIDÓN DE BITUCA O PITUCA. Fuente: Las autoras. 12. Gránulos mayores a 0,106 mm.
(21) DESCRIPCIÓN DEL PROCEDIMIENTO EXPERIMENTAL: Adquisición de la materia prima: la bituca (Colocasia Esculenta) se compró del mercado de abastecimiento de Tingo María, del departamento de Huánuco.. Lavado de la bituca: en esta etapa se utiliza agua potable a temperatura ambiente, a una presión 100 Kpa para eliminar toda la tierra presente en la cascara, y así no contaminar con tierra las posteriores etapas.. Pelado de la bituca: se realizó con la ayuda de un cuchillo, separando la cascara ya que la cascara no interviene en la obtención de almidón.. Trozado y secado de la bituca: se procedió a cortar la bituca o pituca (colocasia esculenta) en partes pequeñas de 3cm x 3cm y se llevó a una estufa a una temperatura de 106 °C por 24 horas para facilitar la eliminación de agua presente en la bituca.. Molido de la bituca: después de la eliminación total del contenido de agua presente en la bituca, ésta se lleva a un molino con el fin de obtener el almidón de la bituca (colocasia esculenta).. Tamizado del almidón de bituca o pituca: el producto obtenido después de la molienda se llevó a tamizar con un tamiz para Granulometría número 140 (Abertura = 0,106 mm) de esa manera obtener un alto rendimiento y mejor calidad del producto (almidón).. 13.
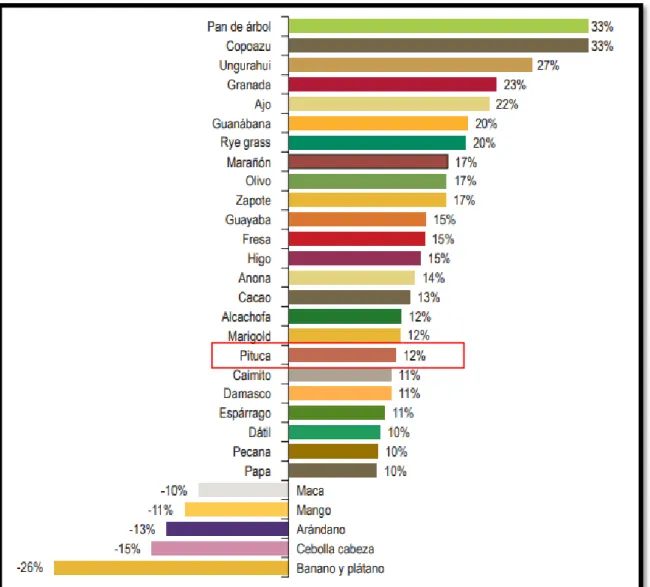
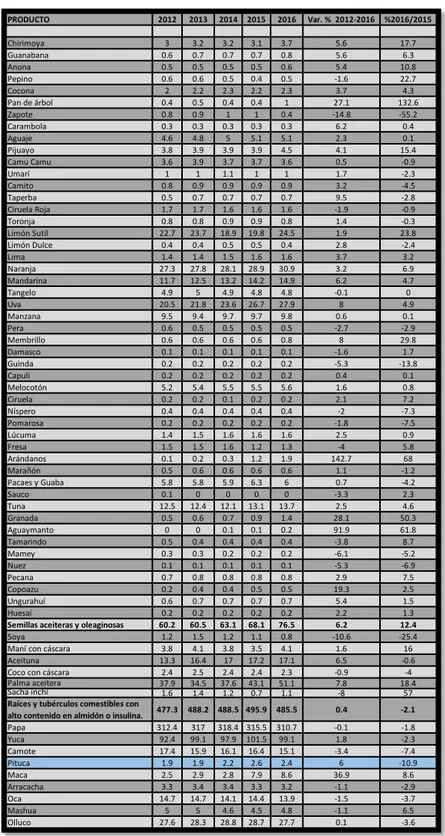
(22) 1.1.6. Producción de bituca entre 2012-2016 según el Ministerio de Agricultura y Riego - FUENTE: SIEA (Sistema Integrado De Estadística Agraria) Tabla 2: Superficie cosechada por producto según año, 2012-2016 (miles hectáreas) PRODUCTO. 2012. 2013. 2014. 2015. 2016. Var. % 2012-2016. %2016/2015. Chirimoya Guanabana Anona Pepino Cocona Pan de árbol Zapote Carambola Aguaje Pijuayo Camu Camu Umarí Camito Taperba Ciruela Roja Toronja Limón Sutil Limón Dulce Lima Naranja Mandarina Tangelo Uva Manzana Pera Membrillo Damasco Guinda Capulí Melocotón Ciruela Níspero Pomarosa Lúcuma Fresa Arándanos Marañón Pacaes y Guaba Sauco Tuna Granada Aguaymanto Tamarindo Mamey Nuez Pecana Copoazu Ungurahuí Huesaí Semillas aceiteras y oleaginosas Soya Maní con cáscara Aceituna Coco con cáscara Palma aceitera Sacha inchi Raíces y tubérculos comestibles con alto contenido en almidón o insulina. Papa Yuca Camote Pituca Maca Arracacha Oca Mashua Olluco. 3 0.6 0.5 0.6 2 0.4 0.8 0.3 4.6 3.8 3.6 1 0.8 0.5 1.7 0.8 22.7 0.4 1.4 27.3 11.7 4.9 20.5 9.5 0.6 0.6 0.1 0.2 0.2 5.2 0.2 0.4 0.2 1.4 1.5 0.1 0.5 5.8 0.1 12.5 0.5 0 0.5 0.3 0.1 0.7 0.2 0.6 0.2 60.2 1.2 3.8 13.3 2.4 37.9 1.6. 3.2 0.7 0.5 0.6 2.2 0.5 0.9 0.3 4.8 3.9 3.9 1 0.9 0.7 1.7 0.8 23.7 0.4 1.4 27.8 12.5 5 21.8 9.4 0.5 0.6 0.1 0.2 0.2 5.4 0.2 0.4 0.2 1.5 1.5 0.2 0.6 5.8 0 12.4 0.6 0 0.4 0.3 0.1 0.8 0.4 0.7 0.2 60.5 1.5 4.1 16.4 2.5 34.5 1.4. 3.2 0.7 0.5 0.5 2.3 0.4 1 0.3 5 3.9 3.7 1.1 0.9 0.7 1.6 0.9 18.9 0.5 1.5 28.1 13.2 4.9 23.6 9.7 0.5 0.6 0.1 0.2 0.2 5.5 0.1 0.4 0.2 1.6 1.6 0.3 0.6 5.9 0 12.1 0.7 0.1 0.4 0.2 0.1 0.8 0.4 0.7 0.2 63.1 1.2 3.8 17 2.4 37.6 1.2. 3.1 0.7 0.5 0.4 2.2 0.4 1 0.3 5.1 3.9 3.7 1 0.9 0.7 1.6 0.9 19.8 0.5 1.6 28.9 14.2 4.8 26.7 9.7 0.5 0.6 0.1 0.2 0.2 5.5 0.2 0.4 0.2 1.6 1.2 1.2 0.6 6.3 0 13.1 0.9 0.1 0.4 0.2 0.1 0.8 0.5 0.7 0.2 68.1 1.1 3.5 17.2 2.4 43.1 0.7. 3.7 0.8 0.6 0.5 2.3 1 0.4 0.3 5.1 4.5 3.6 1 0.9 0.7 1.6 0.8 24.5 0.4 1.6 30.9 14.9 4.8 27.9 9.8 0.5 0.8 0.1 0.2 0.2 5.6 0.2 0.4 0.2 1.6 1.3 1.9 0.6 6 0 13.7 1.4 0.2 0.4 0.2 0.1 0.8 0.5 0.7 0.2 76.5 0.8 4.1 17.1 2.3 51.1 1.1. 5.6 5.6 5.4 -1.6 3.7 27.1 -14.8 6.2 2.3 4.1 0.5 1.7 3.2 9.5 -1.9 1.4 1.9 2.8 3.7 3.2 6.2 -0.1 8 0.6 -2.7 8 -1.6 -5.3 0.4 1.6 2.1 -2 -1.8 2.5 -4 142.7 1.1 0.7 -3.3 2.5 28.1 91.9 -3.8 -6.1 -5.3 2.9 19.3 5.4 2.2 6.2 -10.6 1.6 6.5 -0.9 7.8 -8. 17.7 6.3 10.8 22.7 4.3 132.6 -55.2 0.4 0.1 15.4 -0.9 -2.3 -4.5 -2.8 -0.9 -0.3 23.8 -2.4 3.2 6.9 4.7 0 4.9 0.1 -2.9 29.8 1.7 -13.8 0.1 0.8 7.2 -7.3 -7.5 0.9 5.8 68 -1.2 -4.2 2.3 4.6 50.3 61.8 8.7 -5.2 -6.9 7.5 2.5 1.5 1.3 12.4 -25.4 16 -0.6 -4 18.4 57. 477.3. 488.2. 488.5 495.9. 485.5. 0.4. -2.1. 312.4 92.4 17.4 1.9 2.5 3.3 14.7 5 27.6. 317 99.1 15.9 1.9 2.9 3.4 14.7 5 28.3. 318.4 315.5 97.9 101.5 16.1 16.4 2.2 2.6 2.8 7.9 3.4 3.3 14.1 14.4 4.6 4.5 28.8 28.7. 310.7 99.1 15.1 2.4 8.6 3.2 13.9 4.8 27.7. -0.1 1.8 -3.4 6 36.9 -1.1 -1.5 -1.1 0.1. -1.8 -2.3 -7.4 -10.9 8.6 -2.9 -3.7 6.5 -3.6. Fuente: SIEA (Sistema Integrado De Estadística Agraria). 14.
(23) Tabla 3: Producción agrícola por producto según año, 20122016 (miles toneladas) PRODUCTO. 2012. 2013. 2014. 2015. 2016. Guanabana Anona Pepino Cocona Pan de árbol Zapote Carambola Aguaje Pijuayo Camu Camu Umari Camito Taperba Ciruela Roja Toronja Limón Sutil Limón Dulce Lima Naranja Mandarina Tangelo Uva Manzana Pera Membrillo Damasco Guinda Capulí Melocotón Ciruela Níspero Pomarosa Lúcuma Fresa Arándanos Marañón Pacaes y Guaba Sauco Tuna Granada Aguaymanto Tamarindo Mamey Nuez Pecana Copoazu Ungurahuí Huesaí Semillas aceiteras y oleaginosas Soya Maní con cáscara Aceituna Coco con cáscara Palma aceitera Sacha inchi Raíces y tubérculos comestibles con alto contenido en almidón o insulina.. 5.1 2.2 11.4 9.1 4.3 9.2 3.1 56.4 41.7 10.6 3.7 5.7 5.2 7 5.6 221.6 3.5 11.1 428.8 281.1 80.3 361.9 146.8 4.5 5.2 0.3 1.2 0.7 47.5 0.9 2.6 1 13.8 30.5 0.1 2.7 5 0.3 82 5.2 0.1 2 1.4 0.3 2.4 1 4.4 0.6. 5.5 2.5 13.4 9.9 4.8 9.2 3.5 59.3 43.8 12.6 3.8 6 6.5 8.4 5.2 228.5 4 10.7 441.1 313.8 88.5 439.2 156.4 4.4 5.9 0.3 1.3 0.7 50.2 0.9 2.6 0.9 14.4 30.8 1.7 2.8 7.2 0.3 85.8 6.7 0.1 2.1 1.6 0.4 2.3 1.2 4.8 0.7. 5.6 2.7 12.1 10.8 4.7 9.4 3.5 61.6 41.2 12.3 3.8 5.9 6.1 6.9 6.3 263.8 4 11.2 450.4 339.6 83.4 507.1 159.9 4.7 6.3 0.3 1.3 0.6 52.6 0.8 2.5 0.9 15.6 35 2.5 2.8 8.3 0.2 84.9 9.1 0.3 2.1 0.9 0.3 2.3 1.2 5.2 0.7. 5.5 2.6 10.6 10.4 4.7 9.3 3.4 61.8 38.9 12.6 33.7 6 4.4 7.2 7.8 268 4.4 13.1 456.2 357.9 95.9 597.9 158.5 4.4 7 0.2 1.2 0.7 51.2 0.9 2.5 0.9 14.8 25.3 10.6 2.6 42.4 0.2 94.1 12 0.7 2.1 1.2 0.3 2.5 1.3 5 0.8. 6 3 14 10.7 9 4.9 3.7 63.2 47.7 12.9 3.5 5.8 4.1 8.1 6.7 270.3 4.5 12.6 490.9 403.9 112.7 690 158.1 3.9 7.2 0.2 1.2 0.7 51 0.9 2.1 0.8 15.2 25.7 23 2.7 38.5 0.3 88 23.8 0.9 2.2 1.2 0.3 2.3 1.5 5.3 0.8. 4.2 9.3 5.3 4.2 20.3 -14.6 4.3 2.9 3.4 4.9 -1 0.6 -6.1 3.9 4.8 5.1 6 3.2 3.4 9.5 8.8 17.5 1.9 -3.3 8.6 -6.6 -0.4 1.1 1.8 1.5 -4.7 -3.6 2.5 -4.2 281 -0.4 66.5 -3.8 1.8 45 78.4 2.8 -3.3 -4.1 -0.4 11.3 4.9 4.9. 9.2 14.6 32.8 2.6 91.4 -47.3 8.3 2.3 22.8 2.3 -3.9 -2.9 -7.8 12.3 -13.4 0.9 2.3 -3.4 7.6 12.8 17.5 15.4 -0.9 -10.5 4 -1 0.9 0.7 -0.6 5.6 -14.5 -12.2 2.5 1.7 117.1 4.2 -9.1 7.4 -6.4 98.4 30.6 4.5 1.7 -9.5 -5.9 9.1 4.6 2.3. 2.3 6 92.5 33.6 518.1 3. 2.7 6.5 57.8 34.6 556.6 3.1. 2.1 6.2 151.9 34.9 617.6 2.7. 1.9 6.1 38.4 34.1 684.3 1.8. 1.4 7 56.2 32.4 736.3 1.6. -11.7 3.8 -11.7 -0.9 9.2 -15. -28.2 15.2 46.1 -5.1 7.6 -14.9. 4 514.2 1 181.0 269.7 19 55.5 21.3 92.8. 0.2 1.4 -3 8.7 30.7 -0.9 0. -4.3 -4 -6.4 -5.8 -4.7 -5 -2. Papa Yuca Camote Pituca Maca Arracacha Oca. 4 474.7 1 118.5 334 13.6 19 22.1 92.9. 4 569. 6 4 705.0 4 715.9 1 191.6 1 195.9 1 230.0 292.1 278.3 258.2 13.9 16.1 20.2 22.7 21.3 58.2 23.4 24.1 22.4 94.7 90.9 94.7. Fuente: SEIA (Sistema Integrado De Estadística Agraria). 15. Var. % 2012-2016% 2016/2015.
(24) Tabla 4: Rendimiento agrícola por producto según año, 2012-2016 (toneladas por hectárea) PRODUCTO. 2012. 2013. 2014. 2015. 2016. Anona Pepino Cocona Pan de árbol Zapote Carambola Aguaje Pijuayo Camu Camu Umari Camito Taperba Ciruela Roja Toronja Limón Sutil Limón Dulce Lima Naranja Mandarina Tangelo Uva Manzana Pera Membrillo Damasco Guinda Capulí Melocotón Ciruela Níspero Pomarosa Lúcuma Fresa Arándanos Marañón Pacaes y Guaba Sauco Tuna Granada Aguaymanto Tamarindo Mamey Nuez Pecana Copoazu Ungurahuí Huesaí Semillas aceiteras y oleaginosas Soya Maní con cáscara Aceituna Coco con cáscara Palma aceitera. 4.5 19.5 4.6 11.3 11.1 12.3 12.1 10.9 3 3.8 7.2 11 4.1 7.2 9.7 8.9 7.9 15.7 24 16.6 17.6 15.4 8 8.5 4.9 5.6 3.3 9.1 4.9 6.3 4 9.6 20.2 1.9 5.1 0.9 5.5 6.6 10.3 5.5 4 5.4 4.1 3.2 4.2 7.2 3.1. 4.7 21.9 4.6 10.3 10 12 12.3 11.3 3.3 3.6 6.7 9.3 5.1 6.5 9.6 9.1 7.6 15.8 25 17.8 20.2 16.6 8.1 9.5 4.5 5.8 3.3 9.3 5.2 6.4 3.9 9.4 20.1 9.5 5 1.2 5.8 6.9 11.2 4.6 5.1 6.2 4.3 3 3.3 7 3.4. 5 22.9 4.8 11.1 9.9 11.6 12.2 10.7 3.3 3.6 6.3 8.8 4.4 7.2 13.9 8.9 7.2 16.1 25.7 17.9 21.5 16.5 9.7 10.3 4.3 5.9 3.2 9.5 5.4 6.4 3.9 10 21.7 8.3 4.8 1.4 5.1 7 12.8 5.2 5 4.2 4.3 3 3.4 7.2 3.3. 4.9 23.7 4.8 11 9.5 10.6 12.1 9.9 3.4 3.5 6.4 6.3 4.6 9.1 13.5 9.6 8.3 15.8 25.2 19.8 22.4 16.4 8.5 10.8 4.1 5.9 3.3 9.3 4.8 6.1 3.9 9.4 20.9 9.1 4.5 6.8 5.1 7.2 13.1 4.9 5.5 5.7 4.5 3.2 3 6.9 3.4. 5 25.7 4.7 9.1 11.2 11.5 12.4 10.6 3.6 3.4 6.5 6 5.2 8.2 11 10 7.8 15.9 27.2 23.3 24.7 16.2 7.8 8.6 4 6.9 3.4 9.2 4.7 5.7 3.7 9.6 20.1 11.8 4.8 6.4 5.4 6.4 17.4 3.9 5.3 6.1 4.4 2.8 3.2 7.1 3.5. 2.7 7.1 0.5 -5.4 0.2 -1.8 0.6 -0.7 4.4 -2.6 -2.4 -14.2 5.9 3.4 3.1 3.1 -0.5 0.3 3.1 8.9 8.8 1.2 -0.6 0.5 -5.1 5.2 0.7 0.1 -0.6 -2.7 -1.8 -0.1 -0.1 57 -1.5 65.4 -0.5 -0.7 14 -8 6.9 3 1.3 -3.3 -6.7 -0.5 2.6. 3.4 8.3 -1.7 -17.7 17.8 7.9 2.2 6.4 3.2 -1.6 1.7 -5.1 13.3 -9.4 -18.5 4.8 -6.4 0.7 7.8 17.5 10 -1.1 -7.8 -19.8 -2.6 17.1 0.5 -1.4 -1.5 -7.7 -5.1 1.6 -3.9 29.2 5.5 -5.2 5 -10.6 32 -19.3 -3.8 7.2 -2.8 -12.5 6.4 3 0.9. 1.8 1.6 7 13.8 13.7. 1.8 1.6 3.5 14.1 16.4. 1.8 1.7 8.9 14.3 16.4. 1.8 1.7 2.2 14 15.9. 1.7 1.7 3.3 13.8 14.4. -1.2 2.2 -17.2 0 1.3. -3.8 -0.7 47.1 -1.2 -9.1. 1.9. 2.2. 2.3. 2.5. 1.4. -7.6. -45.8. 14.3 12.1 17.5 7.3 7.5 6.6 6.3 6.2. 14.4 12 18.3 7.3 7.9 6.9 6.4 6.3. 14.8 12.2 17.3 7.3 7.5 7 6.5 6.3. 14.9 12.1 17.6 7.6 7.3 6.8 6.6 6.7. 14.5 11.9 17.8 8.1 6.4 6.7 6.7 6.8. 0.4 -0.4 0.5 2.5 -3.8 0.2 1.5 2.4. -2.5 -1.7 1.1 5.6 -12.3 -2.2 1.8 2.7. Sacha inchi Raíces y tubérculos comestibles con alto contenido en almidón o insulina. Papa Yuca Camote Pituca Maca Arracacha Oca Mashua. Var. % 2012-2016 % 2016/2015. Fuente: SEIA (Sistema Integrado de Estadística Agraria). 16.
(25) Gráfico 1: Tasa de crecimiento del precio al productor agrícola por producción, 20122016.. Fuente: SEIA (Sistema Integrado De Estadística Agraria). 17.
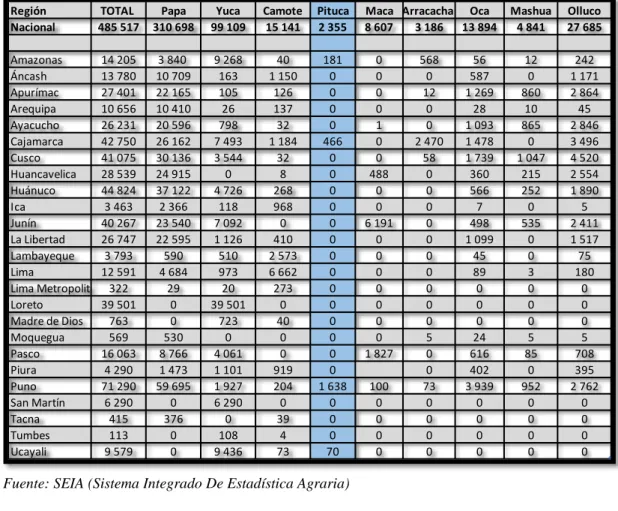
(26) Tabla 5: Superficie cosechada de raíces y tubérculos comestibles por región según producto, 2016 (hectáreas) Región Nacional. TOTAL 485 517. Papa 310 698. Yuca 99 109. Camote 15 141. Pituca 2 355. Maca Arracacha Oca 8 607 3 186 13 894. Amazonas 14 205 Áncash 13 780 Apurímac 27 401 Arequipa 10 656 Ayacucho 26 231 Cajamarca 42 750 Cusco 41 075 Huancavelica 28 539 Huánuco 44 824 Ica 3 463 Junín 40 267 La Libertad 26 747 Lambayeque 3 793 Lima 12 591 Lima Metropolitana 322 Loreto 39 501 Madre de Dios 763 Moquegua 569 Pasco 16 063 Piura 4 290 Puno 71 290 San Martín 6 290 Tacna 415 Tumbes 113 Ucayali 9 579. 3 840 10 709 22 165 10 410 20 596 26 162 30 136 24 915 37 122 2 366 23 540 22 595 590 4 684 29 0 0 530 8 766 1 473 59 695 0 376 0 0. 9 268 163 105 26 798 7 493 3 544 0 4 726 118 7 092 1 126 510 973 20 39 501 723 0 4 061 1 101 1 927 6 290 0 108 9 436. 40 1 150 126 137 32 1 184 32 8 268 968 0 410 2 573 6 662 273 0 40 0 0 919 204 0 39 4 73. 181 0 0 0 0 466 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 638 0 0 0 70. 0 0 0 0 1 0 0 488 0 0 6 191 0 0 0 0 0 0 0 1 827 100 0 0 0 0. 568 0 12 0 0 2 470 58 0 0 0 0 0 0 0 0 0 0 5 0 0 73 0 0 0 0. 56 587 1 269 28 1 093 1 478 1 739 360 566 7 498 1 099 45 89 0 0 0 24 616 402 3 939 0 0 0 0. Mashua 4 841. Olluco 27 685. 12 0 860 10 865 0 1 047 215 252 0 535 0 0 3 0 0 0 5 85 0 952 0 0 0 0. 242 1 171 2 864 45 2 846 3 496 4 520 2 554 1 890 5 2 411 1 517 75 180 0 0 0 5 708 395 2 762 0 0 0 0. Fuente: SEIA (Sistema Integrado De Estadística Agraria). Gráfico 2: Superficie cosechada de raíces y tubérculos comestibles por producto, 2016. Fuente: SIEA (Sistema Integrado De Estadística Agraria). 18.
(27) Tabla 6: Pituca por región según variables productivas, 2015-2016.. Fuente: SIEA (Sistema Integrado De Estadística Agraria). 1.2.. ÁCIDO LÁCTICO. El ácido láctico también conocido por su nomenclatura oficial (ácido 2hidroxipropanoico o ácido α-hidroxi-propanoico), es un compuesto incoloro de fórmula C3H6O3. Es una de las moléculas ópticamente activas más pequeñas de la naturaleza y se encuentra bajo dos formas: la dextrógira D (-) y levógira L (+), frecuentemente denominadas ácido D-láctico y ácido L-láctico. Es producido por animales, plantas y microorganismos en la naturaleza. También puede ser derivado a partir de intermedios con un origen en materiales renovables (por ejemplo acetaldehído, etanol) o a partir de químicos derivados del carbón (acetileno) o aceites (etileno) (Sodergard y Stolt, 2002). A continuación se presentan las propiedades del ácido láctico:. 19.
(28) 1.2.1. Propiedades físico-químicas del ácido láctico.. Cuadro 1: Propiedades físico-químicas del ácido láctico.. Ácido láctico. Nombre IUPAC Ácido 2-hidroxipropanoico General Fórmula molecular. C3H6O3. Propiedades físicas Densidad. 1206 kg/m3; 1.206 g/cm3. Masa molar. 90.08 g/mol. Punto de ebullición. 371 K (98 °C). Propiedades químicas Acidez. 3.86 pKa. Fuente: Wikipedia.. 20.
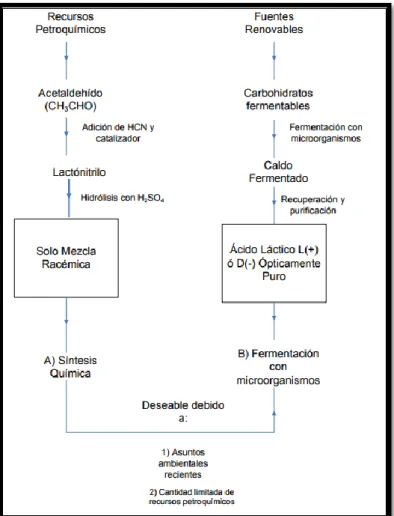
(29) 1.2.2. Producción de ácido láctico.. La producción de ácido láctico puede ser por síntesis química o biotecnológica. Como se sabe el ácido láctico presenta una mezcla racémica. Aproximadamente el 90% del total del ácido láctico es producido a través de vía tecnológica y el resto sintéticamente por la hidrólisis de lactonitrilo (síntesis química) (Gokhale et al., 2006) A continuación se presentan algunas generalidades de ambas rutas.. . Síntesis química La reacción de síntesis del ácido láctico fue descubierta en 1863 por Wislicenus, quien preparo lactonitrilo a partir de acetaldehído y cianuro de hidrógeno y lo hidrolizó a ácido láctico, este procedimiento se conoce en química orgánica como hidrólisis de cianohidrinas y se encuentra representado en las siguientes reacciones. Cabe destacar que la hidrólisis se lleva a cabo de forma ácida, empleando generalmente ácido sulfúrico o clorhídrico. Hoy en día, se emplean las mismas reacciones en el proceso industrial, adicionalmente se incluyen etapas de purificación mediante esterificación con alcohol metílico (metanol) y produciendo lactato de metilo el cual a su vez se purifica por evaporación o destilación. Este último, se hidroliza nuevamente con un catalizador acido fuerte para producir finalmente un ácido láctico, (Narayanan et al. 2004).. 21.
(30) Figura 3: Síntesis química de ácido láctico.. Fuente: (Narayanan et al. 2004).. Cabe destacar que este método se emplea principalmente en estados Unidos y Japón, mientras que el proceso biotecnológico tiene grandes aplicaciones en diferentes partes del mundo.. . Producción biotecnológica. Está basada en procesos de fermentación de sustratos ricos en carbohidratos mediante bacteria u hongos. En general, esta ruta para obtención de ácido láctico incluye tres etapas: fermentación, purificación y concentración. En la primera etapa un sustrato que contiene carbohidratos, tal como glucosa o sacarosa se convierte a ácido láctico por medio de un microorganismo seleccionado. El producto de fermentación se procesa entonces con el fin de obtener ácido láctico. Es necesario establecer la existencia de dos tipos de fermentaciones la homofermentativa (homoláctica – reacción 1) y la heterofermentativa (heteroláctica – reacción 2). La primera consiste en la producción de dos moles de ácido láctico a partir de un mol de glucosa, este tipo de metabolismo es conocido como vía Embden – Meyerhof. La segunda, produce a partir de glucosa, cantidades equimolares de otros productos de fermentación además del ácido láctico como es el ácido acético, etanol y dióxido de carbono, se dice entonces que este tipo de metabolismo se da por el sistema de glucosa -6 fosfato. 22.
(31) deshidrogenasa llevando a la formación de xilusa-5-fosfato (Hofvendahl y Hagerdal 2000). Figura 4: Fermentación homoláctica para producción de ácido láctico. (1). Fuente: Hofvendahl y Hagerdal 2000. Figura 5: Fermentación heteroláctica para producción de ácido láctico. (2) Fuente: Hofvendahl y Hagerdal 2000. A pesar de lo comentado anteriormente, la fermentación homoláctica presenta en casos específicos comportamiento similar al heteroláctico, esto se da en aquellas condiciones de escases de glucosa, es decir, teniendo esta sustancia en condiciones limitadas, lo anterior también ocurre cuando se incrementa el pH, se aumenta la temperatura o se fermentan azúcares diferentes a la glucosa. Como anteriormente se mencionó, la fermentación se puede dar tanto con bacterias como con hongos, en cuanto las bacterias, estas se conocen comúnmente como LAB (bacterias del ácido láctico) y a pesar que se conocen un sinnúmero de ellas, la bacteria Lactobacillus delbrueckii es el microorganismo más utilizado en la producción a gran escala, eso debido a que produce únicamente isómeros L (+). En cuanto a la producción de ácido láctico mediante hongos, cabe resaltar que es poco común. La fermentación fúngica tiene una tasa de producción por debajo de 3g/ (Lh) esta baja velocidad de reacción es probablemente causada por limitaciones en la transferencia de masa ya que el gran tamaño de los micelios provoca un aumento en la viscosidad del medio de fermentación causando un alto incremento en la demanda de oxígeno (Park Y, Okabe M. 1998). 23.
(32) Figura 6: Método de producción de ácido láctico. (a) Síntesis química (b) Biotecnologica= Sacarificación y fermentación simultánea.. Nota. Fuente: (Wee et al., 2006). 1.2.3. Microorganismos productores de ácido láctico. Las bacterias ácido lácticas (LAB) son ampliamente usadas en fermentaciones industriales de alimentos y están recibiendo gran atención por su uso como fábricas celulares para la producción de compuestos industriales y farmacéuticos. La conversión glicolítica de azúcares a ácido láctico es la ruta metabólica más importante en estas bacterias. Las LAB son microorganismos de crecimiento rápido con pequeños genomas, metabolismo simple y relevancia industrial. Estas son un grupo de bacterias Gram24.
(33) positivas relacionadas filogenéticamente, que incluye Lactococcus y Lactobacillus sp. Además, son consideradas fábricas celulares programadas que producen ácido láctico a partir de azúcares y son usadas en varias aplicaciones industriales (Vos y Hugenholtz, 2004).. Las. LAB. consisten. en. los. géneros:. Carnobacterium,. Enterococcus(Ent),. Lactobacillus (Lb), Lactococcus (Lc), Leuconostoc (Leu), Oenococcus, Pediococcus (Ped), Streptococcus(Str), Tetragenococcus, Vagococcus, y Weissella.(Hagerdal y Hofvendahl, 2000).. Cuadro 2: Microorganismos utilizados en producción de ácido láctico. Organismo. g ácido láctico L - Fuente 1. Rhizopus oryzae. 83,0. Zhou et al. 1999. 144,0. Wee et al. 2006. 67,0. Berry et al.,1999. 65,5. Schepers. ATCC 52311 Enterococcus faecalis RKY1 Lactobacillus rhamnosus ATCC 10863 Lactobacillus helveticus. al.. 2002. ATCC 15009 Lactobacillus bulgaricus. et. 38,7. Burgos et al. 2000. NRRL B-548 Lactobacillus delbrueckii. 90 Adsul et al. 2007. Uc-3 Lactobacillus casei. 0,91. NRRL B-441 Fuente: (Tay y Yang 2002)/ autoras. 25. Altiok, 2004.
(34) Las LAB fermentan azúcares a través de diferentes rutas metabólicas resultando en fermentaciones homo, hetero (tabla Nº 7) (Hagerdal y Hofvendahl, 2000).. En la homofermentación se obtiene ácido láctico como el producto final del metabolismo de la glucosa, El grupo de los lactobacilos homofermentativos está. integrado. por Lactobacillus. caucasicus,. Lactobacillus. delbrueckii,. Lactobacillus lactis y Lactobacillus acidophilus (Sánchez y Ramírez, 2004).. Tabla 7: Microorganismos productores de ácido láctico.. Género y Especie. Homofermentativa. Heterofermentativa. L. Delbrueckii. +. -. L. Lactis. +. -. L. Bulgaricus. +. -. L. Casei. +. -. L. Plantarum. +. -. L. Curvatus. +. -. L. Brevis. -. +. L. Fermentum. -. +. +. -. S. Cremoris. +. -. S. Lactis. +. -. -. +. Lactobacillus. Sporolactobacillus S. Inulinus Streptococcus. Leuconostoc L. Mesenteroides. Fuente: Carlos A. Garcia- Mayo 20 de 2010.. 26.
(35) . Lactobacillus:. Son bacilos microaerófilos, Gram positivos y catalasa negativos, estos organismos forman ácido láctico como producto principal de la fermentación de los azúcares. Dentro del género Lactobacillus, existen bacterias homofermentativas obligadas y facultativas, dando lugar a ácido láctico como producto principal de la fermentación. Este grupo está integrado por Lb. caucasicus, Lb. bulgaricus, Lb. Lactis, Lb. helveticus Lb acidophilus y Lb. delbrueckii. La mayoría de las especies pertenecientes a estos géneros tienen alta tolerancia a pH por debajo de 5,0. Esta tolerancia ácida les da la ventaja competitiva sobre otras bacterias; la temperatura óptima de crecimiento varía entre géneros y está en un rango de 20°C a 40°C (Hofvendahl y Hagerdal 2000). Son microorganismos de rápido crecimiento con pequeños genomas, metabolismo simple y relevancia industrial.. Figura 7: Lactobacillus delbrueckii ssp. Bulgaricus.. Fuente: (Hofvendahl y Hagerdal 2000). La temperatura óptima de Lactobacillus delbrueckii ssp. Bulgaricus es de unos 45 ºC, la máxima de 52 ºC y la mínima de 21 – 34 ºC. Estos organismos forman ácido láctico como producto principal de la fermentación de los azúcares, además son microorganismos de crecimiento rápido con pequeños genomas, metabolismo simple y relevancia industrial.. 27.
(36) La bacteria fermenta la lactosa a ácido láctico, el cual hace que se preserve mejor el alimento. En lácteos esta operación hace que las personas con intolerancia a la lactosa sean más tolerantes a estos. (Hagerdal B, Hofvendahl K. 2000).. 1.3.. Sacarificación para la obtención de ácido láctico. En la industria alimentaria, las enzimas se utilizan para recuperar subproductos, para facilitar la fabricación, para mejorar el aroma y para estabilizar la calidad de los alimentos. El número total de enzimas de interés para este tipo de industria es básicamente limitado si se compara con los millares de enzimas que han sido estudiadas. Las enzimas más utilizadas son las carbohidrasas, las proteasas y las lipasas. Se emplean también unas pocas oxidorreductasas y una sola isomerasa. La mayoría de estas enzimas son de origen microbiano, y solo unas pocas proceden de animales o vegetales superiores. Normalmente, las enzimas solubles son desactivadas por el calor, una vez que el tratamiento del alimento se da por el calor, una vez que el tratamiento del alimento se da por concluido. En ocasiones se permite que continúe su actividad para que desarrollen el aroma y la textura deseados, pero nunca se reutilizan. Los recientes avances en tecnología enzimática han conducido a la preparación de enzimas, células microbianas u orgánulos celulares inmovilizados que, en principio, pueden ser recuperados del medio de reacción para volver a ser utilizados. Hidrólisis del almidón La obtención industrial de glucosa se produce fundamentalmente mediante hidrólisis enzimática del almidón. (Reyna L, Robles R. 2004). 1.3.1. Azúcares reductores Los azúcares reductores son biomoléculas que funcionan como agentes reductores; esto es, que pueden donar electrones a otra molécula con la que reaccionan. En otras palabras, un azúcar reductor es un carbohidrato que contiene un grupo carbonilo (C=O) en su estructura. Este grupo carbonilo está formado por un átomo de carbono unido a un átomo de oxígeno a través de un enlace doble. Este grupo se puede encontrar en distintas posiciones en las moléculas de azúcares, dando como resultado otros grupos funcionales como aldehídos y cetonas. 28.
(37) Los aldehídos y cetonas se encuentran en las moléculas de azúcares simples o monosacáridos. Dichos azúcares se clasifican en cetosas si poseen el grupo carbonilo en el interior de la molécula (cetona), o en aldosas si lo contienen en posición terminal (aldehído). Los aldehídos son grupos funcionales que pueden llevar a cabo reacciones de oxidoreducción, las cuales implican el movimiento de electrones entre las moléculas. La oxidación ocurre cuando una molécula pierde uno o más electrones, y la reducción cuando una molécula gana uno o más electrones. De los tipos de carbohidratos que existen, los monosacáridos son todos azúcares reductores. Por ejemplo, la glucosa, la galactosa y la fructosa funcionan como agentes reductores.. Métodos para determinación de azúcares reductores La prueba de Benedict Para determinar la presencia de azúcares reductores en una muestra, esta se disuelve en agua hirviendo. A continuación, se agrega una pequeña cantidad del reactivo de Benedict y se espera a que la solución alcance la temperatura ambiente. En los siguientes 10 minutos la solución debería comenzar a cambiar de color. Si el color cambia a azul, entonces no hay azúcares reductores presentes, particularmente glucosa. Si hay una gran cantidad de glucosa presente en la muestra a analizar, entonces el cambio de color progresará a verde, amarillo, naranja, rojo y finalmente marrón. El reactivo de Benedict es una mezcla de varios compuestos: incluye carbonato de sodio anhidro, citrato de sodio y sulfato de cobre (II) pentahidratado. Una vez agregado a la solución con la muestra, comenzarán las posibles reacciones de oxido-reducción. Si hay azúcares reductores, estos reducirán el sulfato de cobre (color azul) de la solución de Benedict a un sulfuro de cobre (color rojizo), que se ve como el precipitado y es responsable del cambio de color. Los azúcares no reductores no pueden hacer esto. Esta prueba en particular solo proporciona una comprensión cualitativa de la presencia de azúcares reductores; es decir, indica si hay o no azúcares reductores en la muestra. 29.
(38) El reactivo de Fehling De manera similar a la prueba de Benedict, la prueba de Fehling requiere que la muestra esté disuelta por completo en una solución; esto se hace en presencia de calor para garantizar que se disuelva por completo. Luego de esto, se agrega la solución de Fehling agitando constantemente. Si hay azúcares reductores presentes, la solución debería comenzar a cambiar de color a medida que se forma un óxido o un precipitado de color rojo. Si no hay azúcares reductores presentes, la solución permanecerá azul o verde. La solución de Fehling también se prepara a partir de otras dos soluciones (A y B). La solución A contiene sulfato de cobre (II) pentahidratado disuelto en agua, y la solución B contiene tetrahidrato de tartrato de potasio y sodio (sal de Rochelle) e hidróxido de sodio en agua. Las dos soluciones se mezclan en partes iguales para hacer la solución de prueba final. Esta prueba sirve para determinar monosacáridos, específicamente aldosas y cetosas. Estos se detectan cuando el aldehído se oxida a ácido y forma un óxido cuproso. Tras el contacto con un grupo aldehído se reduce a ion cuproso, que forma el precipitado rojo e indica la presencia de azúcares reductores. Si no hubiera azúcares reductores en la muestra la solución permanecería de un color azul, indicando un resultado negativo para esta prueba.. 1.4.. Fermentación láctica. La fermentación láctica es una ruta metabólica anaeróbica que ocurre en la matriz citoplásmica de la célula, en la cual se fermenta la glucosa (se oxida parcialmente) para obtener energía metabólica y un producto de desecho que principalmente es el ácido láctico. (fermentación. homoláctica), además. de otros ácidos. (fermentación. heteroláctica). Se trata de un proceso biológico en el que los azúcares presentes en el medio. (generalmente. azúcares. de. seis. carbonos. como. son. la glucosa, galactosa y fructosa) se transforman en ácido láctico. La presencia de ácido láctico como metabolito en los alimentos provoca la desactivación de los procesos 30.
(39) de descomposición, y por lo tanto la fermentación láctica es tradicionalmente empleada como un método de conserva de alimentos. Las bacterias capaces de promover este proceso biológico se denominan bacterias lácticas.. 1.5.. Factores que influyen en la fermentación láctica.. pH: El pH de la fermentación puede fijarse al comienzo y permitirse disminuir debido a la producción del ácido, o puede ser controlado por titulación, extracción, absorción o electrodiálisis del ácido láctico. Su efecto ha sido estudiado bajo diferentes valores. En todos los casos, la titulación a un pH constante ha resultado en concentraciones iguales o mayores, en comparación con los casos donde no hay control de este (Hagerdal y Hofvendahl, 2000). La remoción del ácido por electrodiálisis y extracción, incluyendo sistemas de dos fases acuosos, ha sido. usado. satisfactoriamente en varios sistemas, mientras en otros la titulación ha dado los mismos o mejores resultados (Ye et al., 1996). El pH óptimo para la producción de ácido láctico varía entre 5.0 y 7.0. Un pH menor a 5.7 ha sido óptimo para las cepas de Lactobacillus, las cuales son conocidas por tolerar menores valores de pH. que las Lactococci (Kashket, 1987).. Temperatura: El efecto de la temperatura en la producción de ácido láctico ha sido estudiado en pocos reportes. La temperatura que da mayores productividades es en algunos casos menor que la temperatura que resulta en el mayor rendimiento y concentración de ácido láctico, mientras que en otros la misma temperatura obtuvo los mismos resultados en todas las categorías. Por ejemplo, para el Lactobacillus casei y Lactobacillus paracasei la temperatura óptima fue reportada entre 37 y 44ºC (Linko y Javanainen, 1996).. 1.6.. Aplicaciones del ácido láctico.. El ácido láctico se ha convertido en un producto químico con muchas aplicaciones potenciales, lo cual lo ha convertido en un producto químico plataforma. Hay cuatro 31.
(40) categorías principales de los usos actuales y aplicaciones del ácido láctico: alimentos, cosméticos, farmacéuticos y aplicaciones químicas. Las aplicaciones potenciales de ácido láctico se ilustran en la siguiente figura. El ácido láctico está clasificado como GRAS ( Generalmente Reconocido como Seguro) para uso como aditivo alimentario por los EE.UU. FDA (Datta & Tsai, 1995), que se utiliza ampliamente en casi todos los segmentos de la industria alimentaria, donde sirve en una amplia gama de funciones, tales como aromatizantes, la regulación del pH, mejorar la calidad microbiana, y el enriquecimiento de minerales. Recientemente el ácido láctico se ha convertido en una de las principales materias primas en la producción de PLA, que sirve como un plástico de la materia biodegradable. El ácido láctico ópticamente puro se puede polimerizar en un PLA de alta masa molecular a través de las reacciones en serie de policondensación, polimerización, y la polimerización por apertura de anillo (Södergård & M. Stolt, 2002) En la figura 8 se muestra una visión general de sus posibles usos Figura 8: Usos de ácido láctico según la aplicación.. Nota. Fuente: (Wee et al., 2006.). 32.
(41) 1.7.. Producción de ácido láctico.. Consumidores mundiales de ácido láctico.. En la actualidad y como se presenta en la figura 9 el consumo de ácido láctico está liderado por Estados Unidos debido a su fuerte inversión en el desarrollo de materiales poliméricos biodegradables como el PLA usado en su mayoría para el empaquetamiento de alimento. Europa de occidente es el segundo consumidor más grande, su uso se extiende a la parte de comidas y bebidas, aunque también han incursionado en el desarrollo tecnológico del PLA, ésta es limitada y deben importar la materia prima para satisfacer la demanda según IHS Markit. En China (el tercer mayor consumidor de ácido láctico) el uso del componente tiene mayor incidencia en los sectores de alimentos y bebidas siendo un componente funcional utilizado como acidulante y persevante respectivamente. A su vez, China es uno de los más grandes exportadores de PLA del mundo. Se prevé que el consumo de ácido láctico incremente significativamente, con una tasa de más del 6% anual desde el 2015 al 2020. (IHS Markit, 2015) Figura 9: Consumidores mundiales de ácido láctico.. Fuente: (IHS Markit, 2015). 33.
(42) Proyección del mercado de ácido láctico para el año 2020.. La proyección de mercado para el consumo ácido láctico en el mundo se muestra en la Figura 10. Tal como lo expresa la publicación realizada por Markets and markets, en el año de 2015 el mercado del ácido láctico registra movimientos de USD 1.628 Billones, liderado por Norte América y seguido por Europa. Sin embargo, para el año 2020 se proyecta a alcanzar un rubro de USD 3.82 billones con una gran demanda por parte de la región Asia-Pacífico. (Markets and markets, 2015). La tendencia de producción de ácido poliláctico está en crecimiento teniendo en cuenta que empresas como Corbion anuncian la intención de ascender su capacidad de producción mediante la construcción de una planta con capacidad de 75.000 toneladas por año en Tailandia. Se prevé que la producción de PLA para el año 2025 sea de 600.000 toneladas por año lo que abre el mercado para el ácido láctico. (Corbion, 2016). Figura 10: Proyección del mercado de ácido láctico para el año 2020.. Fuente: (Markets and markets, 2015). 34.
(43) . Importación y exportación mundial. Evidencia de la creciente demanda de ácido láctico para el desarrollo de aplicaciones en las diferentes industrias ya mencionadas es el registro de importaciones y exportaciones que muestra el comportamiento de los países líderes en la producción de ácido láctico.. En la Figura 11 se muestra un panorama mundial de importación (Figura 11) y exportación (Figura 12.) de ácido láctico con China como país líder en exportación, cuya balanza comercial refleja un superávit al reflejar registros de exportación para el año 2014 de 43’200.285 kg de sustancia al mundo, lo que significó un recaudo total de US$ 145’121.164 comparado con la importación de 6’200.840 kg. De otra parte, Holanda es uno de los países que más importa ácido láctico en el ámbito mundial con un reporte de 103’613.626 kg equivalente a US$ 145’121.164 por encima de otros países como Estados Unidos, Japón y Brasil. Siendo este último el país sudamericano con mayor fluctuación de importaciones y exportaciones. (United Nation Statistics Division, 2016). Figura 11: Importación mundial de ácido láctico.. Fuente: (United Nation Statistics Division, 2016). 35.
(44) Figura 12: Exportación mundial de ácido láctico.. Fuente: (United Nation Statistics Division, 2016). Importación y exportación a nivel Latinoamérica.. A partir de la observación de las Figuras 11 y 12 se puede concluir que Brasil es uno de los pequeños exportadores e importadores en una vista mundial. Sin embargo, en Latinoamérica sobresale como uno de los mayores importadores mientras que en materia de exportación ni siquiera es incluida en las figuras (Figura 13 y 14.), ya que la cantidad exportada haría insignificante los datos de los demás países con un registro de 7’863.380 kg equivalente a una suma de US$ 23’930.020 en el año 2014.. 36.
(45) Figura 13: Importación de nivel Latinoamérica de ácido láctico.. Fuente: United Nation Statistics Division, 2016). Figura 14: Exportación a nivel Latinoamérica de ácido láctico.. Fuente: (United Nation Statistics Division, 2016). 37.
(46) CAPÍTULO II: MATERIALES Y MÉTODOS. 38.
(47) 2.1. Localización.. Los análisis y pruebas correspondientes a este trabajo, se realizaron en los Laboratorios de la Escuela Profesional de Ingeniería Química y el Laboratorio de Microbiología Humana de la facultad de ciencias Biológicas, pertenecientes a la Universidad Nacional “Pedro Ruiz Gallo” - Lambayeque.. 2.2. Medio de cultivo.. El medio de cultivo usado fue el MRS, este medio fue creado por DeMan, Rogosa y Sharpe (1960) para el enriquecimiento, cultivo y aislamiento del lactobacillus. Se utilizó el microorganismo, Lactobacillus Delbrueckii ssp Bulgaricus. obtenido en el. Laboratorio de Microbiología Humana de la Facultad de Ciencias Biológicas de la Universidad Nacional “Pedro Ruiz Gallo” - Lambayeque.. 2.3. Población y muestra.. 2.3.1. Población.. Bituca producida en la Provincia de Leoncio Prado, Región de Huánuco.. 2.3.2. Muestra.. 5 kg de bituca, de la cual se obtuvo 2,1 kg de almidón de bituca mediante proceso de extracción, realizado en la Universidad nacional Pedro Ruiz Gallo – Lambayeque. 2.4. Materiales, técnicas e instrumentos de recolección de datos. 2.4.1. Materia prima y reactivos . Almidón de bituca (Colocasia esculenta). . Agua destilada. . Sulfato de cobre. 39.
(48) . Agua potable. . NaOH (10%). . Microorganismo Lactobacillus Delbrueckii ssp. Bulgáricus. 2.4.2. Materiales y equipos . Agitador magnético. . Autoclave. . Cortadores. . Centrifuga. . Cronómetro. . Bandejas. . Balanza de precisión. . Balanza analítica. . Matraz Erlenmeyer. . Papel filtro. . pH-metro. . Pipeta graduada. . Placa Petri. . Probeta graduada. . Termómetro. 2.4.3. Técnicas de recolección de datos de observación. . Memoria USB 16 GB. . Cuaderno de apuntes. . Cuaderno de recolección de datos. 40.
(49) 2.5.. Descripción del proceso experimental.. -. Primera etapa: obtención del almidón de bituca.. Para obtener el almidón se realizó una extracción de forma manual, pesando 5 kg de Bituca fresca sin procesar, posteriormente se lavó, se secó y se peló, luego se procedió a cortar en dimensiones de 3 cm x 3 cm para de esa manera facilitar la operación de secado en la estufa, manteniendo ésta a una temperatura de 106°C por 24 horas.. Luego se procedió a realizar la operación de molienda, con el fin de obtener el almidón de bituca. Una vez terminada esta etapa, el producto molido se llevó se llevó a tamizar con un tamiz para Granulometría número 140 (Abertura = 0,106 mm) de esa manera obtener un alto rendimiento y mejor calidad del producto (almidón).. Foto 3: Materia prima para extracción de almidón de bituca.. Fuente: Las autoras.. 41.
(50) Foto 4: Acondicionamiento de la materia prima, Bituca.. Fuente: Las autoras.. Foto 5: Molido de la materia prima para obtención de almidón de bituca.. Fuente: Las autoras. 42.
(51) Foto 6: Tamizado del almidón de bituca.. Fuente: Las autoras.. -. Segunda etapa: sacarificación del almidón.. La finalidad de ésta etapa es convertir el almidón en azúcares fermentables. En ésta etapa se realizan los siguientes análisis: Medición de la solución con la prueba del Iodo, medición del pH de la solución y análisis de azúcares reductores, mediante estas pruebas se analiza si la solución de almidón ha llegado a su punto de sacarificación. Se trabajó a diferentes temperaturas y en cada temperatura se realizó los análisis antes mencionados.. Evolución de las temperaturas:. T1: 62°C Como primer paso se llevó la solución a una temperatura de 62°C por 15 min, para luego realizar la prueba con Iodo y medición del pH de la solución de almidón, con la finalidad de observar el cambio de color de azul a marrón lo que nos indica que la solución ya ha llegado a sacrificarse.. 43.
(52) Foto 7: Tinción con Iodo para probar la sacarificación. Fuente: Las autoras. Al realizar la prueba se comprobó que aún no ha llegado al punto de conversión. Es por ello que se continuó llevando la solución a una temperatura mayor que ésta.. T2: 66°C Como la solución anterior no llegó al punto de conversión deseable, ésta solución llevamos a la temperatura de 66°C por un tiempo de 15 min. Pasado el tiempo se realizó la prueba de Iodo y medición del pH de la solución de almidón, tal como se muestra en la imagen siguiente.. Foto 8: Tinción con Iodo para la prueba de la sacarificación. Fuente: Las autoras.. 44.
(53) Como se observa en la imagen aún se mantiene la coloración azul, lo que indica que aún hay presencia de almidón. Entonces se continúa llevando a una temperatura mayor.. T3: 70°C Como se indicó anteriormente, la solución se procedió a llevar a una temperatura de 70°C por 15 min. Finalizado el tiempo, se procedió a realizar la prueba de Iodo y medición del pH de la solución, se continúa llevando a la solución a una temperatura mayor hasta que al realizar la prueba de Iodo ésta cambie de color de azul a marrón.. T4:72°C Se continúa llevando la solución a una temperatura de 72°C por 15 min, así hasta llegar al punto de conversión. Al realizar la prueba del Iodo se verificó que la coloración aún continúa, entonces se lleva a una temperatura mayor, así hasta llegar al punto de sacarificación.. T5:74°C. T6: 76°C Se continuó midiendo el cambio de color de azul a marrón con la prueba del Iodo para de ese modo reconocer si la solución ha llegado a su punto de sacarificación, entonces al analizar la solución a ésta temperatura de 76°C se observó el cambio de color de azul a marrón lo que nos indica que la solución ha llegado a su punto de sacarificación. Para constatar que la solución ha sacarificado llevamos ésta a dos temperaturas superiores (78 ºC y 80 ºC) la cual se observa que se mantiene el cambio de color.. 45.
Figure



Documento similar
The 'On-boarding of users to Substance, Product, Organisation and Referentials (SPOR) data services' document must be considered the reference guidance, as this document includes the
In medicinal products containing more than one manufactured item (e.g., contraceptive having different strengths and fixed dose combination as part of the same medicinal
Products Management Services (PMS) - Implementation of International Organization for Standardization (ISO) standards for the identification of medicinal products (IDMP) in
This section provides guidance with examples on encoding medicinal product packaging information, together with the relationship between Pack Size, Package Item (container)
que hasta que llegue el tiempo en que su regia planta ; | pise el hispano suelo... que hasta que el
dente: algunas decían que doña Leonor, "con muy grand rescelo e miedo que avía del rey don Pedro que nueva- mente regnaba, e de la reyna doña María, su madre del dicho rey,
Entre nosotros anda un escritor de cosas de filología, paisano de Costa, que no deja de tener ingenio y garbo; pero cuyas obras tienen de todo menos de ciencia, y aun
E Clamades andaua sienpre sobre el caua- 11o de madera, y en poco tienpo fue tan lexos, que el no sabia en donde estaña; pero el tomo muy gran esfuergo en si, y pensó yendo assi