Lic. Arturo Azuara Flores:
Director de Asesoría Legal del Sistema
Por medio de la presente hago constar que soy autor y titular de la obra titulada"
", en los sucesivo LA OBRA, en virtud de lo cual autorizo a el Instituto Tecnológico y de Estudios Superiores de Monterrey (EL INSTITUTO) para que efectúe la divulgación, publicación, comunicación pública, distribución y reproducción, así como la digitalización de la misma, con fines académicos o propios al objeto de EL INSTITUTO.
El Instituto se compromete a respetar en todo momento mi autoría y a otorgarme el crédito correspondiente en todas las actividades mencionadas anteriormente de la obra.
De la misma manera, desligo de toda responsabilidad a EL INSTITUTO por cualquier violación a los derechos de autor y propiedad intelectual que cometa el suscrito frente a terceros.
Nombre y Firma AUTOR (A)
Análisis de la Concentración de Metales y Compuestos
Orgánicos Persistentes en Peces en una Sección de la Cuenca del
Río Lacantún en el Estado de Chiapas-Edición Única
Title
Análisis de la Concentración de Metales y Compuestos
Orgánicos Persistentes en Peces en una Sección de la
Cuenca del Río Lacantún en el Estado de Chiapas-Edición
Única
Authors
Vanessa Atenea Marines Garza
Affiliation
ITESM-Campus Monterrey
Issue Date
2005-05-01
Item type
Tesis
Rights
Open Access
Downloaded
19-Jan-2017 11:07:29
CAMPUS MONTERREY
DIVISIÓN DE INGENIERÍA Y ARQUITECTURA
PROGRAMA DE GRADUADOS EN INGENIERÍA
ANÁLISIS DE LA CONCENTRACIÓN DE METALES Y
COMPUESTOS ORGÁNICOS PERSISTENTES EN PECES EN UNA
SECCIÓN DE LA CUENCA DEL RÍO LACANTÚN EN EL ESTADO
DE CHIAPAS.
TESIS
PRESENTADA COMO REQUISITO PARCIAL PARA OBTENER EL
GRADO ACADÉMICO DE:
MAESTRA EN CIENCIAS
ESPECIALIDAD EN SISTEMAS AMBIENTALES
POR:
VANESSA ATENEA MARINES GARZA
Este trabajo de Tesis está dedicado a mis Papás y Hermano.
Por el gran apoyo brindado para que este sueño se hiciera realidad,
así como por las enseñanzas que me han permitido trazarme metas y alcanzarlas.
Sin ustedes no sería lo que soy.
AGRADECIMIENTOS
A Dios por todas las bendiciones que he recibido y por la fuerza que me ha permitido llegar hasta donde estoy ahora.
Agradezco también…
A mis padres, José Luis Marines Pantoja y Aracely Garza Castañón, por su amor, apoyo, esfuerzo y comprensión que me permitieron cumplir esta meta.
A mi hermano Luis Angel por el amor y apoyo moral brindado.
Al Dr. Raúl Antonio Garza Cuevas por haberme dado por la oportunidad de ingresar a este proyecto, así como el apoyo brindado durante todo el trabajo de Tesis.
Al Dr. Porfirio Caballero M. y al Dr. Armando Contreras por aceptar ser mis sinodales durante esta Tesis y por sus comentarios y recomendaciones que sirvieron para el mejoramiento de este trabajo.
Al Q.B.P. José Rodríguez Rodríguez, Q.C.B. Benito Martínez, Q.B.P. Juan José Cortés, así como a Edgar y Jacob del Laboratorio del CCA por su gran ayuda con el análisis de las muestras, por sus consejos y facilidades para el uso de los equipos.
Al Centro de Estudios Interdisciplinarios para la Biodiversidad y Ambiente, A.C. (CEIBA) por el permiso para usar la información recabada en el proyecto “Evaluación de la actividad pesquera en el río Lacantún, estación biológica Chapul, Chiapas”.
A la Dra. María de Lourdes Lozano Vilano, Dr. Armando Contreras Balderas, Dra. María Elena García Ramírez, M.C. Carlos Ramírez y a los estudiantes Jesús María Leza Hernández y Diana L. Romero Melchor por el trabajo de campo y de identificación de las muestras de peces sin las cuales no hubiera sido posible este trabajo.
Al Ing. Antonio Elizondo por las facilidades brindadas para el uso del equipo para la realización de esta Tesis.
A Rodrigo García, Pablo Mendoza y Fernando Ruelas, por el apoyo y los buenos momentos que compartimos durante la realización de esta Tesis.
A mis mejores amigos por el gran apoyo moral brindado a lo largo de mi maestría y por compartir conmigo los buenos y los malos momentos: Ana Yael Vanoye, Irma Rodríguez, Wendy Sánchez, Patsy Vanoye, Alejandra Guitrón, Hilda Pérez, Laura Armendáriz y Marco Antonio León.
A todos mis amigos del CEA, por su compañerismo, con los cuales compartí momentos inolvidables: Carlos Caballero, Erika Zarina Pérez, Francisco Javier Maytorena, Gabriela Limón, Julio Haro, Jorge Donato Franco y José Rodríguez Cisneros.
A todos mis compañeros de la maestría por los grandes momentos compartidos.
ÍNDICE GENERAL
CAPÍTULO I
INTRODUCCIÓN ……… ……… 1
CAPÍTULO II OBJETIVOS E HIPÓTESIS ………... 5
II.1 Objetivo General ………. …….. 5
II.2 Objetivos Específicos ………... 5
II.3 Hipótesis ……….……. 5
CAPÍTULO III ANTECEDENTES ………... 6
III.1 Estado de Chiapas ………... 6
III.1.1 Recursos hidráulicos………... 8
III.1.2 Subregión Lacantún – Chixoy……… 10
III.2 El recurso agua ……… …... 12
III.2.1 Contaminación del agua por metales pesados y compuestos orgánicos persistentes………. 12
III.3 Indicadores biológicos.………. ……. 16
III.3.1 Peces .……….... 18
III.4 Metales ……….……… ……. 19
III.5 Pesticidas ……….. 29
CAPÍTULO IV MATERIAL Y MÉTODOS………. 36
IV.1 Descripción del área de estudio.……….. ….... 36
IV.1.1 Ubicación geográfica………. 36
IV.1.2 Hidrología superficial……… 37
IV.1.3 Uso de suelo. ……… 38
IV.2 Métodos y diseño experimental del trabajo.……… …. .. 39
IV.2.1 Trabajo de laboratorio y selección de los compuestos organoclorados y metales. ……… 39
IV.2.2 Plan de muestreo y ubicación geográfica de las estaciones de muestreo. ………. 40
IV.2.3 Temporalidad de los muestreos………. 41
IV.2.4 Especies de peces muestreadas………. 41
IV.2.5 Manejo de las muestras……….. 41
IV.3 Procedimiento metodológico. ………... 41
IV.3.1 Pasos previos al análisis químico de las muestras……. 41
IV.4 Técnicas analíticas y medición de las sustancias químicas……... 44
IV.5 Análisis de Insecticidas Organoclorados………... 44
IV.5.1 Cromatografía de gases……….. 44
IV.5.2 Análisis cromatográfico………. 47
IV.6. Análisis de Metales……….. 48
IV.6.1 Espectroscopia de Emisión……… 48
IV.7 Análisis estadístico de datos……….. 52
IV.7.2 Métodos convencionales………... 52
IV.7.3 Métodos no paramétricos……….. 53
IV.7.4 Análisis por cauce ……….. 53
IV.7.5 Análisis por temporada………. 54
CAPÍTULO V RESULTADOS Y DISCUSIÓN……… 55
V.1 Metales ………. 55
V.1.1 Concentraciones por metal y por temporada………….. 59
V.1.2 Análisis estadístico de los metales……….. 62
V.2 Pesticidas ……….. 63
V.2.1 Concentraciones por compuesto organoclorado y por temporada ……… 66
V.2.2 Análisis estadístico de los organoclorados……….. 68
CAPÍTULO VI CONCLUSIONES Y RECOMENDACIONES………. 69
LITERATURA CONSULTADA……… 72
ÍNDICE FIGURAS
CAPÍTULO III
ANTECEDENTES
Figura III.1 a. ……… 6 Localización geográfica del estado de Chiapas y del área de estudio
Figura III.1 b. ……… 7 Áreas naturales protegidas
Figura III.1.1 a. ……… 8 Ubicación geográfica de las principales cuencas de México. Figura III.1.1 b. ……… 9 Regiones y subregiones hidrológicas de Chiapas
Figura III.1.2 a. ……… 11 Subregión de planeación Lacantún-Chixoy
Figura III.1.2 b. ……… 11 Subregión de planeación Lacantún-Chixoy
CAPÍTULO IV
MATERIAL Y MÉTODOS
Figura IV.1.1 a. ………. 36 Ubicación general del estado de Chiapas y del área de estudio Figura IV.1.1 b. ………. 37 Delimitación de la Reserva de la Biosfera Montes Azules
y localización del área de estudio
Figura IV.1.1 c. ……….. 38 Ubicación de la cuenca hidrológica del Sistema Grijalva-
Usumacinta y localización del área de estudio (río Lacantún) en la zona sureste de la misma
Figura IV.3.1 a. ………. 42 Equipo de Liofilización utilizado
Figura IV.3.1 b. ……… 43 Muestras trituradas
Figura IV.3.1 c. ……….. 43 Desecador en el que se almacenaron las muestras trituradas
Figura IV.5.1 b. ……… 47 Equipo de rota-evaporador
Figura IV.6.1 a. ……… 51 Horno de microondas
Figura IV.6.1 b. ……… 51 Espectrómetro de Emisión por Plasma
CAPÍTULO V
RESULTADOS Y DISCUSIÓN
Figura V.1. ………... 58 Predominio de los metales analizados en los peces por porcentaje
de aparición
Figura V.1.1 a. ……… 59 Concentración de Bario por temporada y por estación
de muestreo
Figura V.1.1 b. ………. 60 Concentración de Cobre por temporada y por estación
de muestreo
Figura V.1.1 c. ……… 60 Concentración de Manganeso por temporada y por
estación de muestreo.
Figura V.1.1 d. ……….. 61 Concentración de Níquel por temporada y por estación
de muestreo.
Figura V.1.1 e. ……….. 62 Concentración de Zinc por temporada y por estación
de muestreo.
Figura V.2 ……….. 65 Predominio de los insecticidas organoclorados analizados en los peces por porcentaje de aparición.
Figura V.2.1 a. ………. 66 Concentración de DDT y sus metabolitos (DDD y DDE)
en la segunda y tercera temporada.
Figura V.2.1 b. ……….. 67 Concentración de Endrín y Endrín aldehído en la segunda
ÍNDICE TABLAS
CAPÍTULO III
ANTECEDENTES
Tabla III.1.1. ……… .. 10 Balance de aguas superficiales por subregión de planeación
Tabla III.1.1b. ……….. 11 Problemática principal de la subregión Lacantún-Chixoy
Tabla III.2.1. ……….. 13 Clasificación por grupo (tomada de Jiménez, 2001).
Tabla III.3. ……….... 17 Principales ventajas y desventajas de los organismos empleados
como indicadores (Tomado de Lanza, 2000).
Tabla III.4. ………... 20 Límites establecidos para metales contaminantes
(tomada de Jiménez, 2001).
Tabla III.5. ………..… 32 Plaguicidas prohibidos y de uso restringido en México
(Jiménez, 2001) CAPÍTULO IV
MATERIAL Y MÉTODOS
Tabla IV.2.1. ………. 40 Criterios de calidad del agua para la protección de la vida acuática
y la salud humana en aguas superficiales (EPA, 2006).
Tabla IV.2.2. ………. 40
Ubicación geográfica de las estaciones de muestreo.
Tabla IV.5.1. ………. 48 Insecticidas organoclorados analizados
Tabla IV.6.1 a. ………. 49 Dosis Letales Medias para algunos metales en animales de
laboratorio (IPCS,1994).
Tabla IV.6.1 b. ………. 49 Lista de metales analizados
CAPÍTULO V
RESULTADOS Y DISCUSIÓN
Tabla V.1 ………. 55
(septiembre 2005) y sus localidades.
Tabla V.2 ………. 55
Detección de los metales analizados en el segundo muestreo (diciembre 2005) y sus localidades.
Tabla V.3 ………. 56
Detección de los metales analizados en el tercer muestreo (marzo 2006) y sus localidades.
Tabla V.4 ………. 58
Concentración promedio y desviación estándar de las detecciones de los metales analizados en peces por temporada de muestreo.
Tabla V.5 ………. 65
CAPÍTULO I.
INTRODUCCIÓN
Es indudable la importancia que tiene el agua en el mantenimiento de la vida y, además de ello, cumple con diferentes funciones en el ambiente natural actuando como disolvente de innumerables sustancias, sin mencionar las muchas reacciones químicas en las que interviene. En términos físicos y químicos es un líquido incoloro, inodoro e insípido (Novaro, 1998).
El desarrollo per-se del ser humano, incrementa cada vez más los problemas de contaminación del recurso hídrico, ya que la disponibilidad del mismo no sólo depende de la cantidad existente, sino también de su calidad. En las actividades de desarrollo, el uso determina la cantidad y calidad, dependiendo si es destinada al área industrial, riego agrícola, urbano o recreación, entre otros.
La Comisión Nacional del Agua (CNA, 2006) establece un alto valor para el recurso agua como insumo básico para el bienestar social y el desarrollo económico y de las diferentes actividades productivas. No obstante, aún no es totalmente reconocido el valor ecológico que representa para el mantenimiento de los ecosistemas, sobre todo de los acuáticos y del impacto que causa la alteración en la cantidad y la calidad en la sobrevivencia de las comunidades biológicas.
Debido a lo anterior el agua puede fácilmente ser alterada por factores diversos. Una forma de alteración del agua, con consecuencias negativas para el medio receptor y por ende a los seres vivos es la contaminación mediante substancias químicas (Jiménez, 2001). Como la contaminación no conoce las fronteras nacionales, es de suma importancia la acción mundial en el manejo de los químicos y los desechos tóxicos para alcanzar la meta de un desarrollo ambientalmente sostenible, según se menciona en la Cumbre de la Tierra (1997).
Los compuestos ajenos al agua son fácilmente detectables debido a que poseen una composición precisa (Tridgill, 1999). De acuerdo al grupo al que pertenecen se hace la clasificación de contaminantes; entre ellos podemos mencionar los bifenilos policlorados, hidrocarburos, metales, no metales y plaguicidas, entre otros (Jiménez, 2001).
inevitable; y es por eso que su efecto en los ecosistemas, así como en el ser humano puede surgir en cualquier momento.
La utilización de productos agroquímicos constituye un riesgo para la calidad del agua, debido a la toxicidad potencial de estos compuestos. La Agencia de Protección Ambiental de Estados Unidos (U.S. EPA), define a los pesticidas (insecticidas, herbicidas y otros) como sustancias químicas usadas para prevenir, destruir, repeler o ejercer cualquier otro tipo de control sobre algunas plagas; éstas pueden ser insectos, roedores u otros animales indeseables, además de hierbas no deseadas, hongos o algunos microorganismos (bacterias o virus). Son sustancias químicamente complejas que una vez aplicadas al medio ambiente están sujetas a una serie de transformaciones físicas, químicas y biológicas; estas transformaciones pueden conducir a la generación de metabolitos o a la degradación total de los compuestos (Garrido, 1998).
Según menciona Tridgill (1999), estos compuestos son un importante componente de la agricultura moderna, ya que son requeridos para proteger a las plantas de enfermedades y plagas. Sin embargo son también productos letales que pueden tener efectos nocivos; e inevitablemente algunos pueden causar daño a los ecosistemas. Es por esto que la EPA ha suspendido drásticamente la
disponibilidad de un buen número de insecticidas organoclorados. Éstos se absorben en varios grados en el intestino, pulmón y piel, aunque la acción tóxica principal de éstos se dirige al sistema nervioso.
De la misma manera, los metales pesados han sido identificados como uno de los contaminantes más peligrosos no sólo en agua, sino en el ambiente en general. Se sabe que muchos de ellos son esenciales para el crecimiento; sin embargo, los metales resultan tóxicos cuando exceden las concentraciones normales, ya que tienen la capacidad de alterar las células de los organismos (Novaro, 1998). Los metales se encuentran en pequeñas cantidades en cuerpos de agua, en animales, plantas y hasta en humanos. Desafortunadamente, se encuentran también en los residuos de algunas actividades industriales y una mala disposición de éstos hace que se descarguen directamente al ambiente, provocando alteraciones en el mismo, contribuyendo a la contaminación del suelo, de las aguas superficiales y de las aguas subterráneas.
no sólo el agua se ve afectada por la contaminación, además, especies de flora y fauna son afectadas por este fenómeno antropogénico. El agua es un medio para numerosas especies biológicas; los organismos acuáticos que en ella habitan son un reflejo de la calidad del agua.
Entre las sustancias tóxicas producidas por el ser humano se pueden citar el cloro, los metales pesados o compuestos químicos del tipo de pesticidas, detergentes y derivados del petróleo, que en conjunto ejercen un efecto nocivo en las cadenas tróficas (bioacumulación) lo cual se refleja en la conservación y sobrevivencia de las especies (Lanza, 2000). La Comunidad Europea así como la Agencia de Protección Ambiental han incluido en la lista de tóxicos a los plaguicidas y los metales, entre más de 1500 sustancias que son susceptibles de incluirse (Jiménez, 2001).
Los metales son especies químicas no degradables, ni biológica ni químicamente en la naturaleza; es por eso que una vez que se encuentran en el ambiente, sólo pueden distribuirse en aire, agua, suelo o incorporarse a los seres vivos (Novaro, 1998). Dentro de la cadena alimenticia, los organismos fotosintéticos son las principales vías de acceso de los metales pesados hacia los animales y el ser humano (Cervantes y Moreno, 1999).
La CNA menciona que la descarga o adición directa de contaminantes es la más dañina, como la que emiten embarcaciones motorizadas en los embalses de las presas y lagunas, ya que afecta a la biota acuática. En estudios de sustancias tóxicas realizados por la CNA en conjunto con la Comisión Internación de Límites y Agua (CILA) en el Río Bravo y sus afluentes principales se reporta la presencia de algunos metales pesados en tejidos de peces.
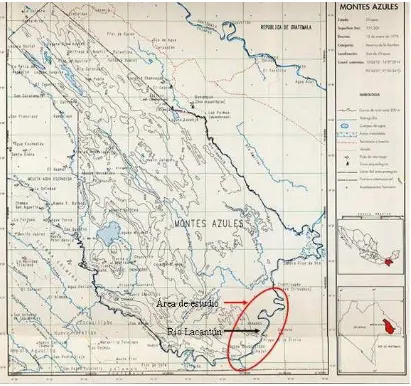
estado de Chiapas. Ya en territorio mexicano se le unen los tributarios del Jataté, Chacaljá, Tzendales y el Negro. Desde la localidad de San Quintín, cerca de la Laguna Miramar, el río Jataté se convierte en el límite suroeste de la Reserva de la Biosfera de Montes Azules. El río Jataté continúa siendo el límite de la reserva conforme avanza hacia el sur y al este hasta la confluencia con el río Lacantún, siendo este punto el límite más sureño de la misma. Posteriormente el río Lacantún se convierte en el límite sureste de la reserva hasta su confluencia con el río Lacanjá. Para propósitos de conservación y protección, el cauce principal del Lacantún se considera dentro de la reserva de la Biosfera de Montes Azules y no fuera de la misma, aún y cuando marca los límites.
Es indudable la importancia que tiene el conocimiento de los distintos grados de contaminación que ocurre en los ecosistemas acuáticos, especialmente en las áreas naturales protegidas como la Reserva de la Biosfera Montes Azules y el Río Lacantún; sin embargo, la información derivada del monitoreo de contaminantes en diferentes matrices físicas y biológicas debe trascender más allá de la sola protección y/o conservación de los ecosistemas sino, que debe funcionar como un mecanismo de alerta para la protección de la salud pública. Una justificación importante estriba en el uso que los pobladores locales de las áreas naturales hacen de los recursos naturales, en particular del agua. Por estas razones los administradores de los recursos deben proveerse con información actual y continua del comportamiento de los principales factores de alteración de los recursos, en este caso de los contaminantes del agua y su dinámica a través de las matrices biológicas.
CAPÍTULO II.
OBJETIVOS E HIPÓTESIS
II.1 Objetivo General
Determinar la concentración de metales pesados y compuestos orgánicos persistentes (COP) en los peces de una sección del río Lacantún y tributarios, localizada en el límite sureste de la Reserva de la Biosfera Montes Azules.
II.2 Objetivos Específicos
1) Determinar las concentraciones de metales pesados y compuestos orgánicos persistentes en las diferentes especies de peces de la cadena alimenticia.
2) Establecer criterios de correlación entre las concentraciones de los metales pesados y los COP, con base en las concentraciones umbrales.
3) Determinar las diferencias entre los sitios muestreados.
II.3 Hipótesis
Fundamentada en la documentación del estado actual del agua y sedimentos basada en la contaminación presente por metales pesados y compuestos orgánicos persistentes en el Río Lacantún en el estado de Chiapas, se analizan las siguientes hipótesis:
Ho: No existe diferencia entre las concentraciones de metales pesados y compuestos orgánicos persistentes presentes en los peces de la sección analizada del cauce principal del río Lacantún con respecto a sus tributarios y entre las muestras temporales.
CAPÍTULO III.
ANTECEDENTES
III.1 Estado de Chiapas
Chiapas se encuentra en el extremo sur de México; comparte 658.5 Km. de frontera con Guatemala (lo que representa 58% de la frontera sur del país). Por su territorio fluye el 30% de las aguas superficiales del país y en la vertiente del río Grijalva se localizan cuatro de las principales presas que generan el 26 % del suministro hidroeléctrico nacional (CNA, 2005).
[image:17.595.114.479.417.701.2]Limita al norte con Tabasco; al sur con el Océano Pacífico; al este con Guatemala y al oeste con Oaxaca y Veracruz. Tiene una superficie, de acuerdo con la Agenda Estadística Chiapas 2002, de 75,634.4 Km.² (3.8 % del territorio nacional) por lo que es el 8° estado más grande del país. Se divide en 118 municipios agrupados en 9 regiones económicas. La capital del estado es Tuxtla Gutiérrez. La localización del estado de Chiapas se muestra en la Figura III.1.
La riqueza del estado depende principalmente de sus recursos naturales, en especial de uno: el agua; la contradicción es que a pesar de los grandes almacenamientos en ríos, lagos y lagunas, hay zonas de este estado que sufren por la falta de este líquido.
En Chiapas se tiene el mayor potencial hidrológico del país, según la CNA, pero presentan el problema de la distribución desigual de la precipitación (2.5 veces mayor a la media nacional) siendo esto un reto para el aprovechamiento sostenible de este recurso por parte del usuario.
[image:18.595.211.384.398.563.2]La pluralidad de climas que se presentan en el estado da lugar a una repartición irregular de flora y fauna; cuenta con una gran biodiversidad de especies, considerado en el segundo lugar en este ámbito y posee varias reservas naturales (ver Figura III.1. b), entre ellas la Selva Lacandona. Las reservas de la Biosfera: Montes Azules, El Triunfo, El Ocote, La Sepultura y La Encrucijada. Hoy en día el número de especies ha disminuido debido a los problemas de deforestación y contaminación del agua; este último problema ha afectado la disponibilidad (en cantidad y calidad) del agua y por ende la sobre vivencia de algunas especies de flora y fauna, así como la existencia de cuerpos de agua y el desarrollo de algunas actividades económico-productivas.
Figura III.1 b. Áreas naturales protegidas
Las principales actividades llevadas a cabo por la población económicamente activa de Chiapas son la agricultura, la silvicultura y la pesca, siendo de carácter prioritario para la economía del estado.
Ante esta disyuntiva se han hecho esfuerzos por parte de las entidades de gobierno teniendo como política principal el aprovechamiento equilibrado y sustentable de los recursos hidráulicos para que contribuyan al desarrollo económico y social del estado. Con este objetivo se implementó el Programa Hidráulico del Estado de Chiapas, así como el Programa Hidráulico Regional 2002-2006 de la Región XI Frontera Sur.
III.1.1 Recursos Hidráulicos
En el estado de Chiapas hay dos regiones hidrológicas. La RH23 Costa de Chiapas y la RH30 Grijalva-Usumacinta (la cual abarca parte de Tabasco y Campeche); en el estado hay 127 cuencas, repartidas en 23 y 104, respectivamente. Algunas de las cuencas son compartidas con estados vecinos y con Guatemala. La ubicación geográfica de las principales cuencas de México puede observarse en la Figura III.1.1 a. Mientras que en la Figura III.1.1 b. se detallan las Regiones y subregiones hidrológicas de Chiapas.
Figura III.1.1 b. Regiones y subregiones hidrológicas de Chiapas
Su gran riqueza hidrológica lo convierte en el eje principal de política de electrificación del país; se distinguen dos vertientes, la del Golfo de México por la que fluyen dos de los ríos más importantes de la República Mexicana: el río Grijalva y el río Usumacinta. El Grijalva tiene 700 Km. de longitud, es el segundo río más caudaloso de México y la extensión de su cuenca es de 50,000 kilómetros cuadrados repartidos en Chiapas, Tabasco, Campeche, Oaxaca y Veracruz.
El Usumacinta por su parte posee 500 Km. navegables y en parte sirve como frontera entre nuestro país y Guatemala. Su caudal es acrecentado con la afluencia del río Lacantún, el cual recibe las aguas del río Jataté. Aquí se localizan las presas Belisario Domínguez (La Angostura); Nezahualcóyotl (Malpaso); Peñitas y Chicoasén.
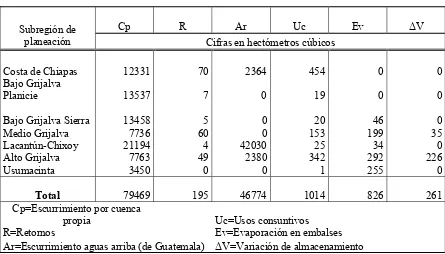
Según reporta la CNA, el escurrimiento por cuenca propia es de 79,469 hm3, por lo cual en Chiapas circula el 30% del escurrimiento nacional concentrado básicamente en seis meses del año.
La disponibilidad total de agua se estima que asciende a 130,029 Hm.³ repartidos en 124,337 Hm.³ como aguas superficiales y 5,692 Hm.³ en los acuíferos. La extracción de este recurso (un volumen aproximado de 1,261 Hm.³/año) se distribuye de la siguiente manera: 75.6% para riego agrícola; 20.3% para consumo público-urbano; 2.8% para la industria y el restante 1.3% para los usos pecuario, servicios, doméstico y acuacultura, entre otros
Tabla III.1.1. Balance de aguas superficiales por subregión de planeación
Cp R Ar Uc Ev ∆V
Subregión de
planeación Cifras en hectómetros cúbicos
Costa de Chiapas 12331 70 2364 454 0 0
Bajo Grijalva
Planicie 13537 7 0 19 0 0
Bajo Grijalva Sierra 13458 5 0 20 46 0
Medio Grijalva 7736 60 0 153 199 35
Lacantún-Chixoy 21194 4 42030 25 34 0
Alto Grijalva 7763 49 2380 342 292 226
Usumacinta 3450 0 0 1 255 0
Total 79469 195 46774 1014 826 261
Cp=Escurrimiento por cuenca
propia Uc=Usos consuntivos
R=Retornos Ev=Evaporación en embalses
Ar=Escurrimiento aguas arriba (de Guatemala) ∆V=Variación de almacenamiento
III.1.2 Subregión Lacantún – Chixoy
La subregión Lacantún-Chixoy está formada por la cuenca del río Lacantún (el cual es un afluente del río Usumacinta) que se desarrolla totalmente dentro del estado de Chiapas.
La parte sur y oeste de esta subregión colinda con Guatemala, aportando cerca de 43 km3 a través de los afluentes de los ríos Chapul, Ixcán y Chixoy. La existencia de extensas zonas acuíferas son propiciadas por la alta precipitación y por sus características geológicas reflejándose en importantes volúmenes de aguas subterráneas; los 16 acuíferos con los que cuenta el estado reciben una recarga anual de 13,069 Hm.3. El mayor escurrimiento virgen se tiene en la subregión Lacantún-Chixoy, resaltando la relevancia fronteriza que tiene también por ser el mayor escurrimiento de Guatemala.
Figura III.1.2 a. Subregión de planeación Lacantún-Chixoy
Figura III.1.2 b. Subregión de planeación Lacantún-Chixoy
En la tabla III.1.1.b se resume la principal problemática que existe en la subregión de estudio.
Tabla III.1.1 b. Problemática principal de la subregión Lacantún-Chixoy
Sector Problema
Agua Potable En esta subregión los asentamientos son preponderantemente rurales, es la subregión con mayor índice de marginalidad, y con una amplia diversidad étnica.
Agrícola Uso y manejo deficiente del agua en Unidades de Riego, limitaciones de tipo topográfico, escasa tecnificación, muy baja disponibilidad de recursos.
Manejo de cuenca (erosión-sedimentación)
III.2 El recurso agua.
El agua es un recurso natural indispensable para mantener la vida en el planeta (CNA, 2003). Es un elemento esencial para la vida, no sólo por ser un disolvente para innumerables sustancias, sino también por muchas reacciones químicas en las que interviene. Es un líquido incoloro, inodoro e insípido (Novaro, 1998). En los últimos años, los problemas de contaminación han afectado en gran medida al recurso hídrico, ya que la disponibilidad del mismo no sólo depende de la cantidad existente, sino de la calidad en la que se encuentra disponible. Dependiendo el uso que se le quiera dar, el hombre la requiere en cantidad y calidad específicas para uso personal, industrial, riego agrícola, etcétera.
III.2.1 Contaminación del agua por metales pesados y compuestos orgánicos persistentes.
El agua puede ser fácilmente alterada por factores diversos. Una forma de alteración del agua, con consecuencias negativas para el medio receptor, es la contaminación (Jiménez, 2001). A la presencia en el ambiente de uno o más contaminantes o de la combinación de ellos que cause desequilibrio ecológico, efectos negativos a la salud, fauna o flora e impacto negativo a la calidad del aire, agua o suelo se le conoce como contaminación (Novaro, 1998).
Tabla III.2.1. Clasificación por grupo (tomada de Jiménez, 2001).
Clasificación de acuerdo al grupo
Biológicos Bifenilos policlorados
Compuestos orgánicos biodegradables Orgánicos refractarios
Detergentes Éteres Fenoles Hidrocarburos
Metales No metales Nutrientes (N y P) Orgánicos refractarios
Plaguicidas Radiactivos Radicales (CN-)
La Comunidad Europea así como la Agencia de Protección Ambiental (EPA por sus siglas en inglés) han incluido en la lista de tóxicos a los plaguicidas y a los metales, entre más de 1500 sustancias que son susceptibles de incluirse y de 126 que se seleccionaron (Jiménez, 2001):
• Plaguicidas (DDD, DDE, DDT, Aldrin, Clordano, Dieldrin, Endrin, Heptacloro).
• Bifenilos policlorados
• Hidrocarburos alifáticos halogenados
• Éteres halogenados
• Esteres del ácido ftálico
• Hidrocarburos aromáticos monocíclicos
• Fenoles
• Hidrocarburos aromáticos policíclicos
• Metales (Antimonio, Arsénico, Asbesto, Berilio, Cadmio, Cianuro, Cobre, Cromo, Mercurio, Níquel, Plata, Plomo, Selenio, Talio y Zinc)
En la Cumbre de la Tierra llevada a cabo en 1997 se concluyó que los químicos son esenciales para el desarrollo económico y social. Sin embargo, el uso de sustancias como el DDT, el clordano, PCBs, dioxina, ácido sulfúrico, mercurio, plomo y arsénico puede representar riesgos importantes para la salud humana y para el medio ambiente. La exposición a estas sustancias es inevitable; es por eso que la contaminación del medio ambiente así como del ser humano puede surgir en cualquier momento.
La utilización de productos plaguicidas constituye un riesgo para la calidad del agua, debido a la toxicidad potencial de estos compuestos. Son de vital importancia para este estudio los insecticidas organoclorados y sus metabolitos principales debido a la aplicación de dosis elevadas de éstos en la zona de estudio.
En México, se han realizado estudios de la contaminación del agua en diferentes cuencas, un ejemplo es la cuenca del Río Bravo, donde la CNA junto con la Comisión Internacional de Límites y Agua (CILA), realizan análisis frecuentes de sustancias tóxicas, básicamente de metales pesados, reportando la presencia de elementos tales como el arsénico en agua, así como cadmio, cobre y zinc en tejidos de peces. Así mismo, en el río Sabinas, afluente del Bravo, el ICA (Índice de Calidad del Agua) presentó un promedio general de 55, quedando en una categoría de contaminada.
La distribución y concentración de compuestos orgánicos sintéticos tales como pesticidas, según reporta el NAWQA (1995), en sistemas de agua superficial, presentan el efecto de bioacumulación. En un estudio realizado en el Río Grande (Bravo) encontró que los compuestos organoclorados así como los PCBs estaban bioconcentrados en organismos acuáticos. El análisis llevado a cabo reporta la presencia de sustancias tales como DDE, dieldrin, lindano, clordano, DDT, DDD, PCBs y endrin.
Según el reporte “Estudio Binacional sobre la presencia de Sustancias Tóxicas en el Río Bravo/Río Grande y sus Afluentes, en su Porción Fronteriza entre México y Estados Unidos” (2000), se detectaron algunos pesticidas y plaguicidas en el Río Bravo, tales como paratión metílico, piretroides, aldrin, carbaril y DDT, entre otros. De la misma manera se concluye que las comunidades biológicas fueron afectadas por sustancias tóxicas en algunos de los sitios estudiados.
p,p´-DDD y p,p´-DDT. El resultado del estudio arrojó que las concentraciones encontradas en los peces no rebasaron los límites permisibles por la FDA, pero se viola la normatividad mexicana que establece la ausencia de COP como Aldrín, Eldrín, Dieldrín y Heptacloro (Aranguré Zúñiga et al, 2005)
Con el fin de sentar las bases de comparación entre la contaminación y una línea de referencia, se realizaron estudios en Nueva Zelanda sobre 8 especies de peces comerciales analizando los metales pesados de Cadmio, Cromo, Cobre, Fierro, Plomo, Manganeso, Níquel y Zinc contenido en distintos órganos de los peces. Los análisis arrojaron que las concentraciones de los elementos no alcanzaban los valores necesarios para convertirse en un problema de salud pública. Las concentraciones de los elementos fueron: Cadmio de 0.002 a 0.02 ppm, Cromo de 0.01 a 0.04 ppm, Cobre de 0.04 a 0.95 ppm, Fierro de 0.9 a 13.5, Plomo de 0.14 a 0.95, Manganeso de 0.04 a 2.0, Níquel de 0.01 a 0.08 y Zinc de 2.0 a 36.0 ppm. Solamente en el hígado se encontraron concentraciones relativamente altas como el Cadmio por arriba de 54 ppm. (Brooks y Rumsey, 1973).
En un estudio realizado en 5 especies de la familia mugilidae (Liza saliens, Liza aurata, Liza ramada, Mugil cephalus y Chelon labrosus) en la bahía de Cádiz, España, Blasco J. et al (1998), encontraron que las concentraciones de los metales Fe, Mn, Cu y Zn fueron, en general, similares para todas las especies y que la concentración era superior en el hígado que en el músculo. La correlación entre la concentración de metal y el tamaño del pez fue variable y dependió de la especie y del tejido analizado; en todos los casos la concentración descendió cuando el tamaño del pez aumentó. Una correlación significativa entre metales (p<0.05), sólo se encontró entre el Cu y el Zn en el hígado de tres especies. Los autores concluyeron que la concentración de metales en estos peces no es de gran valor para determinar los niveles de contaminación.
También se han realizado estudios sobre la posible relación entre el fenómeno de acumulación de sustancias en organismos acuáticos y los efectos que causa a la salud humana. Ling et al. (2004) llevaron a cabo un modelo de exposición de arsénico evaluado en la especie de pez conocida como Tilapia (Oreochromis mossambicus); en él se evalúa el riesgo a la salud humana generado a partir del consumo de este alimento en el suroeste de Taiwán, en donde se presenta la enfermedad del pie negro (BFD, por sus siglas en inglés). Aunque la bioacumulación del arsénico parece poco probable de dar lugar a la toxicidad de la tilapia cultivada y a los seres humanos que lo consumen, los riesgos teóricos para la salud humana en el área por BFD resultaron alarmantes.
III.3 Indicadores biológicos
Se define como un indicador biológico de contaminación a aquel ser vivo que refleja los cambios en la calidad de su ambiente o entorno, siendo un factor integrador de dichos cambios (Guerrero, 2000). Un indicador es un organismo selecto por el grado de sensibilidad o tolerancia a diversos tipos de contaminación o sus efectos (Lanza, 2000). Los indicadores biológicos o bioindicadores ayudan a controlar y vigilar los cuerpos de agua nacionales, mediante el monitoreo de la calidad del agua así como de la contaminación presente en la misma (Lanza, 2000).
Existen grupos taxonómicos que, de acuerdo a sus características tanto biológicas como ecológicas intrínsecas, actúan como indicadores biológicos reflejando la calidad del cuerpo de agua que habitan (Jiménez, 2001). Debido a que las condiciones físicas y químicas en las que viven estos organismos acuáticos son predecibles, es fácil la identificación de compuestos o sustancias químicas que alteran el medio a causa de factores antropogénicos.
Entre los principales grupos de plantas y animales acuáticos que son frecuentemente utilizados como indicadores de la calidad del agua se encuentran el fitoplancton, algas, peces, crustáceos, moluscos e insectos (Lanza, 2000). A continuación, en la Tabla III.3, se presenta un resumen de los grupos de organismos que pueden ser utilizados como indicadores de la calidad del agua, así como las principales ventajas y desventajas para cada uno.
Tabla III.3. Principales ventajas y desventajas de los organismos empleados como indicadores (Tomado de Lanza, 2000).
Bacterias
Metodología rutinaria bien desarrollada; respuesta rápida a
cambios incluyendo contaminación. Indicadores de
contaminación fecal. Fácil muestreo.
Células que no han sido originadas en el punto de muestreo. Poblaciones recuperadas rápidamente de una contaminación intermitente. Se requiere de un equipo especial.
Protozoarios
Valores sapróbicos bien conocidos. Rápida respuesta a cambios. Fácil muestreo.
Buena habilidad y conocimiento para identificar taxones. Células que no han sido originadas en el punto de muestreo. Especies que también tienden a presentarse en medios naturales.
Algas (fitoplancton)
Tolerantes a la contaminación bien documentada. Indicadores usados para la eutrofización e incremento de turbiedad.
Experiencia en taxonomía. No muy usado para contaminación severa orgánica o fecal. Problemas de muestreo con ciertos grupos.
Macroinvertebrados (Insectos, moluscos, anélidos, poliquetos, crustáceos, nemátodos)
Diversidad de formas y hábitats. Muchas especies sedimentarias que pueden indicar efectos en el sitio de muestreo. Todas las comunidades responden al cambio. Especies de larga vida, pueden indicar efectos de contaminación en el tiempo.
Dificultades cuantitativas de muestreo. Sustrato importante durante las muestras. Algunas especies transportadas en aguas en movimiento. Conocimiento necesario de su ciclo de vida será necesario para la interpretación. Algunos grupos tienen dificultades para su identificación.
Macrofitas
Especies fijas a un sustrato, usualmente con facilidad de verse e identificarse. Buenos indicadores de material suspendido y enriquecimiento de nutrientes.
Respuesta a la contaminación no bien documentada. Frecuentemente a contaminación intermitente. Presencia principalmente estacional.
Peces
Métodos bien desarrollados. Efecto fisiológico inmediato obvio. Pueden indicar el efecto en la cadena alimentaria. Fácil identificación.
Las especies pueden migrar para evitar la contaminación.
El método biológico juega un papel importante en la interpretación y manejo del recurso hídrico por ciertas ventajas, dentro de las cuales está su nivel integrador y su bajo costo (Lanza, 2000). Para determinar el nivel de calidad del agua es difícil reproducir ciertas condiciones en animales de laboratorio. En cambio, menciona Lanza (2000), un indicador biológico es característico de un medio ambiente, que cuando mide, cuantifica el estrés, las características del hábitat y el grado de exposición del estresor o el grado de respuesta ecológica a la exposición.
2. Puede expresarme numéricamente la información.
3. Existen conceptos biológicos que proveen información para cierto tipo de contaminación.
Sin embargo, la principal desventaja del uso de estos indicadores es el tiempo que requiere llevar a cabo el muestreo. Para De Zwart (1995), los métodos de biomonitoreo tienen ventajas sobre el monitoreo químico; la principal, es que integran los efectos en un gran número de individuos, lo que reduce el número de medidas en espacio y tiempo.
III.3.1 Peces
Los peces son usados como organismos indicadores en programas de monitoreo biológico por las siguientes características (Lanza, 2000):
1. La información de los ciclos de vida es muy completa para algunas especies, lo que permite planear las actividades de colecta sin perjudicar las poblaciones ícticas.
2. Las comunidades de peces generalmente incluyen una gran variedad de especies, las cuales representan una variedad amplia de niveles tróficos; además, su posición en la cima de la cadena trófica acuática ayuda a proveer una visión integradora de la salud del ambiente. 3. Los peces son relativamente fáciles de identificar en el campo, por la forma, el tamaño y la
coloración; no se necesita tecnología avanzada para su identificación.
4. El tiempo de manipulación y procesamiento es menor que otros grupos taxonómicos. 5. Los peces están presentes aún en ríos pequeños o en aguas muy contaminadas. 6. Los peces son afectados por factores macro ambientales fáciles de ubicar.
7. Son relativamente de vida larga e incorporan varios periodos de evaluación de las condiciones ambientales.
8. Es fácil determinar la anatomía de un pez aún cuando ha estado sometido a algún tipo de influencia anómala.
9. Pueden relacionarse en el establecimiento de políticas de pesca y manejo de los ambientes acuáticos.
Entre las sustancias tóxicas producidas por el hombre se pueden citar el cloro, los metales pesados o químicos del tipo de pesticidas, detergentes y derivados del petróleo, que en conjunto ejercen un nivel nocivo en las cadenas tróficas (bioacumulación) lo cual se refleja en la conservación y sobrevivencia de las especies (Lanza, 2000).
III.4 Metales
Los metales pesados han sido identificados como los contaminantes más peligrosos no sólo en agua, sino en el ambiente en general. Se sabe que muchos de ellos son esenciales para el crecimiento; sin embargo, los metales resultan tóxicos cuando exceden las concentraciones normales, ya que tienen la capacidad de alterar las células de los organismos (Novaro, 1998). Un metal es un elemento que es un buen conductor de la electricidad, es flexible y posee brillo (Cervantes y Moreno, 1999). Algunos metales son necesarios para los seres vivos, pero pueden llegar a ser tóxicos si rebasan ciertas concentraciones. Éstos pueden ser: cadmio, cromo, cobre, mercurio, níquel, plomo, arsénico y zinc, principalmente (Jiménez, 2001).
Como resultado de actividades antropogénicas, se han incrementado los valores de los metales pesados en la biosfera, originando la contaminación de la atmósfera, en especial el agua (Cervantes y Moreno, 1999). Los metales se encuentran en pequeñas cantidades en cuerpos de agua, en
animales, plantas y hasta en humanos. Las descargas industriales presentan altas concentraciones de metales en las aguas residuales (CNA, 2003). Desafortunadamente, una mala disposición de los residuos de algunas actividades industriales hace que se descarguen directamente al ambiente, provocando alteraciones en el mismo. En la Tabla III.4 se muestran los límites establecidos de los metales, tanto para exposición aguda como crónica, para agua dulce, agua salada y salud humana.
Tabla III.4. Límites establecidos para metales contaminantes (tomada de Jiménez, 2001).
Vida acuática
Agua Dulce Salud Humana Metal
Toxicidad Aguda µg/L Toxicidad Crónica µg/L
Aguda µg/L
Antimonio 9000 1600 a 6000 146 7 Arsénico
trivalente 440 0.02
Berilio 5.3 130 0.037
Cadmio e(1.05 ln[dureza]-8.53) e(1.5 ln[dureza]3.73) 10 Cobre e(0.94 ln[dureza]-1.23) 5.6 en 24 h 1
Cromo 21 0.29 en 24 h 50
Mercurio
metílico 8 0.016 en 24 h 0.2
Níquel e(0.76 ln[dureza]+1.6) e(1.75 ln[dureza]+1.42) 13.4
Plata e(1.72 ln[dureza]-6.52) 50
Plomo e(1.22 ln[dureza]-9.48) e(1.22 ln[dureza]-0.49) 50
Selenio 260 35 en 24 h 10
Talio 1400 40 13
Zinc 47 5000
No sólo el agua se ve afectada por la contaminación, además, especies de flora y fauna se ven afectadas por causas antropogénicas. Dentro de la cadena alimenticia, los organismos fotosintéticos son las principales vías de acceso de los metales pesados hacia los animales y el ser humano (Cervantes y Moreno, 1999). Según Cervantes y Moreno (1999), en animales acuáticos, el proceso de captación de metales pesados se efectúa mediante tres procesos principales:
1) a través de superficies respiratorias como las branquias 2) adsorción del agua a las superficies corporales
3) a través del aparato digestivo.
La toxicidad de los metales pesados así como la captación de los mismos por parte de los organismos acuáticos se ven influidas por el tiempo de exposición y de la concentración del metal. Cada especie acuática responde de diferente manera ante la exposición a las diferentes concentraciones de los metales contaminantes, y por lo tanto los acumula en diferente medida.
Los metales que se analizaron durante el estudio son: Arsénico, Bario, Cadmio, Cobre, Cromo, Manganeso, Níquel, Plomo y Zinc; el criterio para la elección de estos metales se detalla en el siguiente capítulo.
El arsénico es un elemento natural ampliamente distribuido en la corteza terrestre. En el ambiente, el arsénico se combina con oxígeno, cloro y azufre para formar compuestos inorgánicos de arsénico. El arsénico en animales y en plantas se combina con carbono e hidrógeno para formar compuestos orgánicos de arsénico. Los compuestos inorgánicos de arsénico se usan principalmente para preservar madera. El cobre cromato arsenado (CCA) se usa para producir madera "presurizada." El uso residencial del CCA se descontinuó en los Estados Unidos, pero aun tiene usos industriales. Los compuestos orgánicos de arsénico se usan como plaguicidas, principalmente en cosechas de
algodón. Los peces y mariscos pueden acumular arsénico; la mayor parte de este arsénico está en una forma orgánica llamada arsenobetaína, que es mucho menos peligrosa.
Bario
El bario es un metal blanco-plateado que toma un color plateado-amarillento cuando se expone al aire. Se encuentra en la naturaleza en muchas formas diferentes llamadas compuestos de bario. Estos compuestos son sólidos que existen en forma de polvos o cristales, y que no se incendian fácilmente. Hay dos formas del bario, el sulfato de bario y el carbonato de bario, que se encuentran a menudo en la naturaleza en forma de depósitos minerales subterráneos. A veces el bario se encuentra naturalmente en el agua potable y en alimentos. Debido a que algunos compuestos de bario (sulfato de bario y carbonato de bario) no se mezclan muy bien con agua, la cantidad de bario que se encuentra generalmente en el agua potable es baja. Los compuestos de bario como el acetato de bario, cloruro de bario, hidróxido de bario, nitrato de bario y sulfuro de bario se disuelven en agua más fácilmente que el sulfato de bario y el carbonato de bario, pero como no se encuentran comúnmente en la naturaleza, generalmente no terminan en el agua potable, a menos que el agua esté contaminada con compuestos de bario liberados desde sitios de desechos. Los niveles naturales de bario en el ambiente son muy bajos, aunque algunos alimentos, por ejemplo la nuez de Brasil, algunas algas, peces y ciertas plantas, pueden contener altas cantidades de bario. La cantidad de bario que se encuentra en los alimentos y el agua generalmente no es suficientemente alta como para ser materia de preocupación para la salud. Sin embargo, aun se están conduciendo estudios para averiguar si la exposición prolongada a niveles bajos de bario afecta la salud.
Cadmio
azufre (sulfato de cadmio, sulfuro de cadmio). Todo tipo de terrenos y rocas, incluso minerales de carbón y abonos minerales, contienen algo de cadmio. La mayor parte del cadmio que se usa en los EE.UU. es extraído durante la producción de otros metales como zinc, plomo y cobre. El cadmio no se oxida fácilmente, y tiene muchos usos incluyendo baterías, pigmentos, revestimientos para metales, y plásticos. Las plantas, peces y otros animales incorporan cadmio del medio ambiente. El cadmio permanece en el organismo por largo tiempo y puede acumularse después de años de exposición a bajos niveles.
Los peces pueden acumular cadmio hasta concentraciones 10-100 veces la del agua (Eisler, 1974). Los efectos letales aparecen a partir de 1 ppm de Cd en todo el organismo (Pascoe y Mattey, 1977). La incorporación del Cd disuelto en agua se realiza principalmente por absorción a través de las branquias, mientras que el cadmio particulado presente en el alimento se absorbe en las paredes del tubo digestivo. El Cd incorporado de forma disuelta se acumula preferentemente en las branquias y el hígado, mientras que el absorbido del alimento se acumula en el hígado, intestino y riñones. El Cd se acumula preferentemente en las branquias, hígado, riñones y tracto digestivo (McFarlane y Franzin, 1980; Ney y Van Hassel, 1983; Bendell-Young et al, 1986). La branquia es el tejido que más Cd acumula en exposiciones cortas, mientras que la mayoría del Cd acumulado en exposiciones largas se sitúa en el hígado o riñones, y la importancia de uno u otro órgano depende de la especie estudiada y de la vía de entrada del Cd. El Cd ingerido y absorbido en el intestino se acumula sobre todo en el hígado, y menos en los riñones. En cambio, cuando el Cd se incorpora disuelto del agua, las cantidades acumuladas en los riñones son mayores (Woodworth y Pascoe, 1983). El tipo de alimentación y la situación en la escala trófica son factores que influyen notablemente en la acumulación del Cd. En un trabajo realizado con 11 especies de peces con diferentes hábitos alimenticios, se observó que las especies carnívoras como Pomoxis nigromaculatus y Micropterus salmoides acumularon cantidades menores de Cd que especies omnívoras como Chaenobryttus gulosus y Lepomis macrochirus (Murphy et al, 1978). Las mayores acumulaciones de Cd se suelen dar en especies que se alimentan de animales bentónicos, como Lepomis microlophus. En otras especies, sin embargo, parece tener más importancia la incorporación de Cd del agua, no encontrándose, por ejemplo, correlación alguna entre el contenido de Cd del hígado y el del intestino en Esox lucius y Catostomus commersoni expuestos a sedimentos poco contaminados (McFarlane y Franzin, 1980). Salmo gairdneri y Coregonus clupeaformis acumulan Cd tanto del agua como del alimento (Harrison y Klaverkamp, 1989).
1979), mientras que en Gasterosteus aculeatus se sitúan entre 6.5 y 19.6 (Woodworth y Pascoe, 1983). Los factores de concentración pueden variar con el nivel de exposición, y es común encontrar una relación inversa entre BCF y exposición, lo que indica existencia de saturación (Eisler, 1974; Pascoe y Mattey, 1977). También influye en tiempo de exposición, y por lo general el aumento de éste provoca un aumento de BCF, debido a que un mayor tiempo de exposición ayuda a que se establezca la situación de equilibrio, que muchas veces no ocurre en exposiciones a corto plazo. Lo valores de BCF varían también con la proporción de Cd+2 libre, pues la membrana plasmática es más permeable al ión divalente libre que al Cd ligado (Merlini y Pozzi, 1977a, b; Ramamoorthy y Blumhagen, 1984). Por lo tanto, los ambientes que desplazan el equilibrio del Cd hacia la forma libre Cd+2, como el pH ácido, favorecen su acumulación en peces (Iniesta y Blanco, 2005).
Los peces eliminan el Cd de forma relativamente rápida, aunque no de todos los tejidos. El hígado y los riñones son los tejidos que eliminan el Cd de forma más lenta, por lo que conforme avanza el proceso de depuración, su importancia relativa frente a los demás tejidos va en aumento. En general, en el proceso de depuración, la concentración de Cd disminuye rápidamente en la mayoría de los tejidos (T1/2 entre 3.4 y 37 días; Brucka-Jastrzêbska y Protasowicki, 2004), se mantiene o disminuye muy poco en el hígado, y aumenta ligeramente en los riñones, como resultado del transporte interno del Cd (Eisler, 1974; Reichert et al, 1979). La eliminación del Cd en peces se realiza fundamentalmente a través del mucus o en la bilis y secreciones hepáticas. En el salmón Oncorhynchus kisutch, el Cd se excreta sobre todo en el mucus (Varanasi y Markey, 1978), y las escamas actúan como almacén de Cd, acumulando grandes cantidades durante su depuración. En cambio, en Fundulus heteroclitus, el mecanismo principal de detoxicación es la excreción vía bilis del Cd previamente acumulado en el hígado y secuestrado por metalotioneínas y otras proteínas hepáticas (Eisler, 1974; Hamilton y Mehrle, 1986).
Cobre
más comúnmente es el sulfato de cobre. Muchos compuestos de cobre pueden ser reconocidos por su color azul-verdoso.
El cobre es minado y procesado extensamente en los Estados Unidos y es usado principalmente por sí solo o en aleaciones en la manufactura de alambre, láminas de metal, cañerías y otros productos de metal. Los compuestos de cobre se usan comúnmente en agricultura para tratar enfermedades de las plantas, por ejemplo hongos, o para el tratamiento de aguas y como preservativo para madera, cuero y telas. El cobre puede entrar al medio ambiente a través de liberaciones desde minas de cobre y otros metales, y desde fábricas que manufacturan o usan cobre metálico o compuestos de cobre. El cobre también puede entrar al medio ambiente desde basurales, del agua residual doméstica, de la combustión de desperdicios y combustibles fósiles, de la producción de madera, de la producción de abonos de fosfato y de fuentes naturales (por ejemplo, polvo en el aire, desde el suelo, volcanes, vegetación en descomposición, incendios forestales y de la espuma del mar). Por lo tanto, el cobre está ampliamente distribuido en el medio ambiente. Cuando el cobre se libera al suelo, puede adherirse fuertemente a la materia orgánica y a otros componentes (por ejemplo, arcilla, arena, etc.) en las capas superficiales del suelo y puede que no se movilice muy lejos cuando es liberado. Cuando el cobre y los compuestos de cobre se liberan al agua, el cobre que se disuelve puede ser transportado en el agua de superficie ya sea en la forma de compuestos de cobre o cobre libre o, con más probabilidad, como cobre unido a partículas suspendidas en el agua. Aun cuando el cobre se adhiere fuertemente a partículas en suspensión o a sedimentos, hay evidencia que sugiere que algunos de los compuestos de cobre solubles entran al agua subterránea. El cobre que entra al agua se deposita eventualmente en los sedimentos de los ríos, lagos y estuarios. El cobre es transportado en partículas que emiten las fundiciones y plantas que procesan minerales, y vuelve a la tierra debido a la gravedad o en la lluvia o la nieve. El cobre también es transportado por el viento al aire en polvos de metales. El cobre elemental no se degrada en el ambiente.
cobre disuelto en el agua. Una vez en el agua, la mayor parte de este cobre rápidamente se adhiere a partículas o se convierte a otras formas que pueden depositarse en sedimentos. Esto puede limitar la exposición al cobre a menos que los sedimentos se agiten, como por ejemplo, cuando personas que nadan en aguas de recreación vuelven a suspender los sedimentos y luego los tragan.
La acumulación de Cu es muy variable entre especies. Se han observado diferencias de 103 en el contenido de Cu en el hígado de especies afines. Morone americana, por ejemplo, puede acumular 2795 ppm de Cu en el hígado, frente a los 3 ppm de Morone saxatilis (Frazier, 1984). El hígado es el principal encargado de mantener la homeostasis del Cu. En teleósteos, procesa y acumula grandes cantidades de Cu, cosa que no hacen los riñones. Salvo contadas excepciones, los niveles de Cu en el hígado siempre superan a los del riñón tras exposiciones a Cu disuelto en agua, por lo que se cree que el papel del riñón en la detoxificación del Cu es poco importante, (Buckley et al, 1982). Los niveles de Cu encontrados en otros tejidos como la sangre, cerebro, bazo, gónada o músculo, son siempre menores que los del hígado (McKim y Benoit, 1974; Buckley et al, 1982).
Los peces expuestos anteriormente a Cu tienen una mayor tolerancia a este metal, y lo acumulan en mayores cantidades (Dixon y Sprague, 1981). Probablemente esto se debe a que el Cu induce la formación de metalotioneínas (Lauren y McDonald, 1987). Estas moléculas se encargan de secuestrar el Cu en su interior, disminuyendo así su toxicidad. Es el principal mecanismo de detoxificación del Cu realizado en el hígado. Otro mecanismo que protege a los peces frente a concentraciones elevadas de Cu es la secreción de mucus en las branquias y cualquier superficie corporal en contacto con Cu disuelto, dado que el mucus es un agente quelante de Cu (Miller y Mackay, 1982) (Iniesta y Blanco, 2005).
Cromo
colorantes y pigmentos, curtido de cuero y preservación de madera. El cromo entra al aire, al agua y al suelo principalmente en las formas de cromo (III) y cromo (VI) como resultado de procesos naturales o de actividades humanas. Los desagües de galvanoplastía pueden descargar cromo (VI). El curtido de cueros y la industria textil, como también la manufactura de colorantes y pigmentos, pueden descargar cromo (III) y cromo (VI) a los cuerpos de agua. En el aire, los compuestos de cromo se encuentran principalmente en forma de pequeñas partículas de polvo. Eventualmente, este polvo se deposita sobre la tierra y el agua. La lluvia y la nieve ayudan a remover el cromo del aire. Los compuestos de cromo generalmente permanecen en el aire menos de 10 días. Aunque la mayor parte del cromo en el agua se adhiere a partículas de tierra y a otros materiales y se deposita en el fondo, una pequeña cantidad puede disolverse en el agua. Los peces no acumulan mucho cromo del agua en el cuerpo. Aunque la mayor parte del cromo en el suelo no se disuelve fácilmente en el agua y se adhiere fuertemente al suelo, una pequeña cantidad de cromo se disuelve y puede alcanzar el agua subterránea. La movilización del cromo en el suelo depende del tipo y de la condición del suelo y de otros factores ambientales.
Manganeso
El manganeso es un metal que ocurre naturalmente y que se encuentra en muchos tipos de rocas. El manganeso puro es de color plateado, pero no ocurre naturalmente en esta forma. Se combina con otras sustancias tales como oxígeno, azufre o cloro. El manganeso también puede combinarse con carbono para producir compuestos orgánicos de manganeso. Algunos compuestos orgánicos de manganeso comunes incluyen pesticidas, tales como maneb o mancozeb, y metilciclopentadienil manganeso tricarbonil (MMT), un aditivo en ciertas gasolinas. El manganeso es un elemento esencial poco abundante y es necesario para mantener buena salud. Se puede encontrar manganeso en varios artículos alimenticios, incluyendo granos y cereales, y se encuentra en grandes cantidades en otros productos, como té. Puede entrar al agua y al suelo desde depósitos naturales, a través de la disposición de residuos o por deposición desde el aire. El manganeso existe naturalmente en ríos, lagos y en agua subterránea. Las plantas acuáticas pueden incorporar un poco de manganeso del agua y así concentrarlo.
Níquel
intercambiadores de calor. La mayor parte del níquel se usa para fabricar acero inoxidable. El níquel también se combina con muchos otros elementos tales como el cloro, azufre y oxígeno para formar compuestos de níquel. Muchos de los compuestos de níquel son solubles en agua (se disuelven fácilmente en agua) y tienen un color verde característico. El níquel y sus compuestos no tienen ni olor ni sabor característico.
Los compuestos de níquel se usan para niquelado, colorear cerámicas, fabricar baterías, y como sustancias conocidas como catalizadores, que aceleran la velocidad de reacciones químicas. El níquel ocurre en forma natural en la corteza terrestre combinado con otros elementos. Se encuentra en todos los suelos y es liberado por volcanes. El níquel ocupa el lugar número 24 en la lista de elementos más abundantes. En el ambiente se encuentra principalmente combinado con oxígeno o azufre en forma de óxidos o sulfuros. El níquel también se encuentra en meteoritos y en el fondo del océano formando masas de minerales llamadas nódulos del fondo del mar. El níquel es liberado a la atmósfera cuando se mina y por industrias que fabrican o usan níquel, aleaciones de níquel o compuestos de níquel. Estas industrias también pueden desechar níquel en aguas residuales. El níquel también es liberado a la atmósfera por plantas de energía que queman petróleo o carbón y por incineradores de basura. El níquel puede ser liberado en aguas residuales de industrias. Una gran cantidad de níquel liberada al ambiente termina en el suelo o en sedimento en donde se adhiere fuertemente a partículas que contienen hierro o manganeso. Las condiciones acídicas favorecen la movilización del níquel en el suelo y facilitan su filtración hacia el agua subterránea. El níquel no parece concentrarse en peces. Hay estudios que demuestran que algunas plantas pueden incorporar y acumular níquel. Sin embargo, se ha demostrado que el níquel no se acumula en pequeños organismos que habitan terrenos tratados con lodo que contiene níquel.
Plomo
El plomo es un metal gris-azulado que ocurre naturalmente en pequeñas cantidades en la corteza terrestre. El plomo se encuentra ampliamente distribuido en el ambiente. La mayor parte proviene de actividades como la minería, manufactura industrial y de quemar combustibles fósiles. El plomo tiene muchos usos diferentes. Se usa en la fabricación de baterías, municiones, productos de metal (soldaduras y cañerías) y en láminas de protección contra los rayos X. Debido a inquietudes sobre salud pública, la cantidad de plomo en la gasolina, pinturas y cerámicas y en materiales para calafatear y soldar se ha reducido considerablemente en los últimos años. El plomo no se degrada, pero los compuestos de plomo son transformados por la luz solar, el aire y el agua. Cuando se libera plomo al aire, puede movilizarse largas distancias antes de depositarse en el suelo. Una vez que cae al suelo, generalmente se adhiere a partículas del suelo. La movilización del plomo desde el suelo al agua subterránea dependerá del tipo de compuesto de plomo y de las características del suelo.
El plomo se absorbe principalmente por las branquias (Varanasi y Gmur, 1978) o el intestino (Somero et al, 1977). Como en el caso del Cd, los órganos que acumulan más Pb son el hígado, riñones y branquia (Varanasi y Gmur, 1978; Reichert et al, 1979). Por lo general, las especies marinas acumulan menos plomo que las de agua dulce. Las concentraciones de Pb en estos tejidos oscilan entre 0.07-0.40 ppm (Holcombe et al, 1976) y 12-100 ppm (Somero et al, 1977), aunque los valores más habituales suelen ir de 2.7-4.1 ppm (Merlini y Pozzi, 1977a,b; Reichert et al, 1979). Los factores de concentración varían entre 2.7 y 21.0 en Lepomis gibbosus y Oncorhynchus kisutch. (Reichert et al, 1979), y 33-230 para Lepomis macrochirus (Wiener y Giesy, 1979).
III.5 Pesticidas
Jiménez (2001) menciona que los plaguicidas son productos muy diversos y, la mayor parte de las veces, artificiales; por ejemplo: los organoclorados, los organofosforados, los carbamatos y los organometálicos que son muy difíciles de biodegradar. La Agencia de Protección Ambiental de Estados Unidos (U.S. EPA) define a los pesticidas como sustancias químicas usadas para prevenir, destruir, repeler o ejercer cualquier otro tipo de control sobre algunas pestes; éstas pueden ser insectos, roedores u otros animales indeseables, además de hierbas no deseadas, hongos o algunos microorganismos (bacterias o virus). Son sustancias químicamente complejas que una vez aplicadas al medio están sujetas a una serie de transformaciones a nivel físico, químico y biológico; estas transformaciones pueden conducir a la generación de metabolitos o a la degradación total de los compuestos (Garrido, 1998). Según menciona Tridgill (1999), estos compuestos son un importante componente de la agricultura moderna, ya que son requeridos para proteger a las plantas de
enfermedades y plagas. Sin embargo son también productos letales que pueden tener efectos nocivos; inevitablemente una pequeña porción puede causar daño a los ecosistemas. Los pesticidas son catalogados frecuentemente de acuerdo al tipo de peste que controlan. Otra manera de pensar en los pesticidas es considerar aquellos que sean pesticidas químicos o que se deriven de una fuente común o de un método de producción. Otras categorías incluyen biopesticidas, antimicrobianos, y los dispositivos de control de pestes.
Pesticidas químicos.
Algunos ejemplos de pesticidas químicamente relacionados se mencionan a continuación.
• Pesticidas Organofosforados. Estos pesticidas afectan el sistema nervioso interrumpiendo la enzima que regula la acetilcolina, un neurotransmisor. La mayoría de los organofosforados son insecticidas. Fueron desarrollados a principios del siglo XIX, pero sus efectos sobre los insectos, que son similares a los efectos que tienen sobre los humanos, fueron descubiertos en 1932. Algunos son muy venenosos (fueron usados durante la Segunda Guerra Mundial como agentes neurosistémicos). Sin embargo, no son generalmente muy persistentes en el ambiente.
• Pesticidas Organoclorados. Fueron utilizados comúnmente en el pasado, pero muchos se han quitado del mercado debido a sus efectos en la salud y el ambiente y por su persistencia (por ejemplo DDT y clordano).
• Pesticidas Piretroides. Fueron desarrollados como versión sintética del pesticida de ocurrencia natural llamado Piretrín, que se encuentra en los crisantemos. Se han modificado para aumentar su estabilidad en el ambiente. Algunos piretroides sintéticos son tóxicos al sistema nervioso.
Biopesticidas.
Son ciertos tipos de pesticidas derivados de materiales naturales tales como animales, plantas, bacterias y ciertos minerales. Por ejemplo, el aceite de canola y el bicarbonato de sodio tienen ciertas aplicaciones como pesticidas, por lo que se consideran biopesticidas. A finales del 2001, había aproximadamente 195 ingredientes activos registrados como biopesticidas y 780 productos. Los biopesticidas son clasificados en tres clases importantes:
1. Los pesticidas microbianos consisten en un microorganismo (por ejemplo una bacteria, un hongo, virus o protozoario) como ingrediente activo. Pueden controlar diversas clases de parásitos, aunque cada ingrediente activo por separado es relativamente específico para su(s) peste(s) objetivo. Por ejemplo, hay hongos que controlan ciertas hierbas malas, y otros hongos que matan a insectos específicos.
2. Protectores de Plantas Incorporados (PIPs por sus siglas en inglés) son sustancias pesticidas que las plantas producen a partir del material genético que se ha adicionado a la planta. La proteína y el material genético son regulados por la EPA, no la planta misma.
Dispositivos de Control de Plagas.
Un “dispositivo” es cualquier instrumento o invención (diferente a un arma de fuego) creado para atrapar, destruir, repeler o atenuar cualquier peste. Una ratonera es un ejemplo de un dispositivo. A diferencia de los pesticidas, la EPA no requiere que los dispositivos sean registrados en la agencia. Sin embargo, están sujetos a ciertos requisitos de etiquetado, empaque y requisitos de importación/exportación. Según el Programa Ambiental Regional para Centroamérica, los insecticidas organoclorados son compuestos químicos de una de las primeras generaciones de insecticidas. Se caracterizan por una alta persistencia (vida media) en el ambiente y con capaces de ser trasladados en el viento hacia lugares muy lejanos. Son solubles en grasa y por su resistencia a la degradación en el ambiente, se acumulan en tejidos humanos, tejidos de animales silvestres y especies de vertebrados e invertebrados (bioacumulación). Los plaguicidas organoclorados son compuestos orgánicos de origen sintético los cuales se caracterizan por una estructura química con uno o varios átomos de cloro; son muy persistentes, de difícil descomposición y acumulables en el tejido graso tras una exposición crónica.
En este grupo se consideran el DDT, Aldrín, Dieldrín, Endrín y Lindano. Debido a que dichos productos son compuestos que, cuando se encuentran en el ambiente, no se desnaturalizan fácilmente en el aspecto químico y biológico; están por discontinuarse en casi todos los países (López, 2001). Además de causar daño al ecosistema, los pesticidas tienen cierto riesgo sobre la salud humana, es por eso que su uso está estrictamente regulado.
La Agencia para la Protección del Medio Ambiente de los Estados Unidos (EPA) ha suspendido drásticamente la disponibilidad de un buen número de insecticidas organoclorados ya que éstos se absorben en varios grados en el intestino, pulmón y piel y tras una exposición a este tipo de sustancias, una parte importante de la dosis absorbida se almacena en el tejido graso; la acción tóxica principal de los pesticidas organoclorados se dirige al sistema nervioso. Para México, existen algunos plaguicidas prohibidos así como otros de uso restringido, según se indica en la Tabla III.5.
PLAGUICIDAS PROHIBIDOS PLAGUICIDAS DE USO RESTRINGIDO Acetato o proplonato de fenil
mercurio 1,3-dicloropropeno
Ácido 2,4,5-T Alaclor
Aldrín Aldicarb
BHC Bromuro de metilo
Cianofos Clordano Cloranil Cloropicrina DBCP Dicofol Dialiafor Forato
Dieldrín Fosfuro de aluminio
Dinoseb Isotiocianato de metilo
Endrín Lindano
EPN Metam sodio
Erbon Metoxicloro Formotión Mevintos Fluoracetato de sodio (1080) Paraquat
Fumisel Pentaclorofenol Kepone/Clorcedone Quintozeno
Mirex
DDT por su alto riesgo para la salud humana, su
Monuron elevada persistencia y sus propiedades de Nitrofen
bioacumulación, sólo podrá ser utilizado por las
Paratión etílico *
dependencias del Ejecutivo en campañas fitosanitarias.
Schradan Sulfato de talio *
Toxafeno *
Triamifos
* Plaguicidas de los que sólo se prohíbe su comercialización y uso; del resto se prohíbe la importación, fabricación, formulación, comercialización y uso.