SEGUIMIENTO DE LA PRESENCIA DE ROTAVIRUS A EN UN PROCESO DE
COMPOSTAJE REALIZADO A PARTIR DE RESIDUOS ORGÁNICOS
DOMICILIARIOS Y CONTENIDO RUMINAL.
MARÍA DEL PILAR BONILLA ARBELAEZ
MARIELA MOSQUERA RENTERIA
TRABAJO DE GRADO
Presentado como requisito parcial
para optar el título de:
MICROBIOLÓGAS INDUSTRIALES Y MICROBIOLÓGAS AGRÍCOLAS Y
VETERINARIAS
MARÍA MERCEDES MARTÍNEZ. Directora
MARÍA FERNANDA GUTIERREZ. Codirectora
PONTIFICIA UNIVERSIDAD JAVERIANA
FACULTAD DE CIENCIAS
CARRERAS DE MICROBIOLOGÍA INDUSTRIAL Y MICROBIOLOGÍA AGRÍCOLA
Y VETERINARIA
Artículo 23 de la Resolución No 13 de Julio de 1946
SEGUIMIENTO DE LA PRESENCIA DE ROTAVIRUS A EN UN PROCESO DE
COMPOSTAJE REALIZADO A PARTIR DE RESIDUOS ORGÁNICOS
DOMICILIARIOS Y CONTENIDO RUMINAL.
MARÍA DEL PILAR BONILLA ARBELAEZ
MARIELA MOSQUERA RENTERÍA
APROBADO
__________________________
___________________________
MARIA MERCEDES MARTINEZ MARÍA FERNANDA GUTIERREZ
MICROBIÓLOGA MSc.
BACTERIÓLOGA PhD.
Directora Codirectora
SEGUIMIENTO DE LA PRESENCIA DE ROTAVIRUS A EN UN PROCESO DE
COMPOSTAJE REALIZADO A PARTIR DE RESIDUOS ORGÁNICOS
DOMICILIARIOS Y CONTENIDO RUMINAL.
MARIA DEL PILAR BONILLA ARBELAEZ
MARIELA MOSQUERA RENTERIA
APROBADO
______________________
______________________
ANGELA UMAÑA MUÑOZ
JANETH ARIAS PALACIOS
BIOLOGA M. Phil
BACTERIÓLOGA MSc.
AGRADECIMIENTOS
•
A la Empresa Bioagrícola del Llano por la oportunidad de realizar este proyecto.
•
A la Dra. María Mercedes Martínez por su dirección, paciencia, apoyo y
oportunidades que nos brindó para complementar los conocimientos en la
realización de este trabajo.
•
A la Dra. Carolina Galindo por su apoyo y colaboración en la realización de este
trabajo.
•
A la Dra. María Fernanda Gutiérrez por su oportuna colaboración.
•
A Orlando Torres por su valiosa asesoría.
!!!!
TABLA DE CONTENIDO
1 INTRODUCCIÓN 1
2. MARCO TEÓRICO 3
2.1 Rotavirus 3
2.1.1 Morfología y Estructura 3
2.1.2 Taxonomia y clasificación 6
2.1.3 Replicación Viral 6
2.1.4 Epidemiología 7
2.1.5 Morbilidad y Mortalidad 8
2.1.6 Dinámica Viral en el Medio Ambiente 9
2.1.7 Métodos para la detección en lodos y compost 12
2.1.8 Métodos de detección 15
2.2 Efecto de las Condiciones Medioambientales Sobre la Partícula Viral 18
2.2.1 Adsorción Viral a Partículas Sólidas 19
2.2.2 Virus en el suelo 19
2.2.3 Temperatura 21
2.2.4 pH 22
2.2.5 Radiación Solar 22
2.2.6 Compuestos químicos 23
2.3 COMPOSTAJE 24
2.3.1 Etapas del proceso de compostaje según la temperatura 25 2.3.2 Factores que condicionan el proceso de compostaje 27
2.3.3 Calidad de Materias Primas 32
2.3.4 Patógenos en Compost 34
2.3.5 Control de calidad del producto final 35
3. Formulación del problema y justificación 40
4. Objetivos 41
4.1 Objetivo General 41
4.2 Objetivos específicos 41
5. MATERIALES Y MÉTODOS 42
5.1. Preparación de inóculo acelerador 42
5.2 Seguimiento de las Pilas y Muestreo 43
5.4 Estandarización del proceso de extracción y concentración de virus a partir de muestras de compostaje
45
5.5 Montaje del control positivo y negativo del comñpost 46 5.6 Detección de rotavirus por Inmunocromatografía (ICT) 46
5.7 Detección de rotavirus por ELISA. 47
5.8 Modelo estadístico 48
6. RESULTADOS Y DISCUSIÓN 50
6.1. Preparación de inóculo acelerador 50
6.2 Seguimiento de las Pilas y Muestreo 51
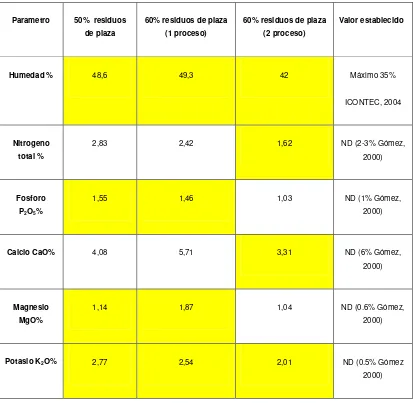
6.3 Análisis Fisicoquímico del compost 54
6.4 Estandarización del proceso de extracción y concentración 59 6.5 Montaje del control positivo y negativo del comñpost 59 6.6 Detección de rotavirus por Inmunocromatografía (ICT) y ELISA 62
7. CONCLUSIONES 70
8. RECOMENDACIONES 71
9. REFERENCIAS BIBLIOGRÁFICAS 72
LISTA DE TABLAS
TABLA TITULO
PAG.
1
Propiedades de las proteínas constituyentes del rotavirus
5
2
Número de casos de la enfermedad causada por rotavirus en
niños menores de 5 años a nivel mundial
9
3
Virus en lodos y residuos sólidos urbanos
12
4
Comparación de dos métodos de recuperación de virus en lodos
14
5
Tiempo de supervivencia de virus en el suelo
20
6
Dosis requeridas de luz UV para la inactivación de virus
23
7
Principales características de algunos materiales orgánicos
28
8
Microorganismos patógenos asociados a compost
34
9
Patógenos que se pueden encontrar en el contenido ruminal
34
10
Indicadores microbiológicos de calidad de compost.
36
11
Clasificación de biosólidos según la EPA
37
12
Parámetros microbiológicos en la legislación europea
38
13
Composición de las pilas evaluadas.
43
14
Concentración microbiana inicial del inóculo acelerador
50
15
Actividad enzimática del inóculo mixto
51
16
Parámetros físico químicos de las pilas de compostaje
54
17
Proporción de muestras positivas en el primer proceso de
compostaje por los dos metodos de detección (ELISA e ICT), pH y
temperatura promedio
61
LISTA DE FIGURAS
FIGURA TITULO
PAG.
1
Estructura del rotavirus
4
2
Método de inmunocromatografía
17
3
Determinación de temperatura
44
4
Determinación de pH
44
5
Componentes de inmunocromatografía
46
6
Control positivo de la prueba.
47
7
Comportamiento de temperatura durante el proceso de
compostaje.
52
8
Comportamiento de pH durante el proceso de compostaje
52
9
Porcentaje de humedad, nitrógeno orgánico, potasio, magnesio
y calcio total de las pilas de compostaje del primer proceso y
segundo proceso
56
RESUMEN
Con el fin de realizar el seguimiento de la presencia de rotavirus en muestras de compost, se realizó el diseño una técnica de extracción y concentración viral a partir de la matiz acompañada de una detección de rotavirus mediante ELISA e Inmunocromatografía (ICT). Para ello, se realizaron dos procesos de compostaje a partir de residuos sólidos urbanos (RSU) del relleno sanitario Don Juanito, de la ciudad de Villavicencio con diferentes porcentajes de podas, contenido ruminal, residuos de plaza y cascarilla de arroz.
En el montaje de las pilas se aplicó un inoculo mixto termofílico con una actividad amilolítica y proteolítica cuantificada a nivel de laboratorio arrojando resultados de 276UA y 246UP respectivamente y una concentración microbiana inicial de 1023UFC/ml. Durante los procesos de compostaje que se obtuvo en 56 días se logró una temperatura máxima de 68.9 ºC y pH 8.86 y características fisicoquímicas adecuadas según la NTC 5167.
En cuanto al seguimiento de la presencia de rotavirus en el proceso de compostaje se modificó la técnica cualitativa usada por Ahmed y Sorensen, 1995 y Lewis y Metcalf, 1988 para la extracción y concentración de partículas virales. Consecutivamente se llevó a cabo la detección de rotavirus donde se encontraron muestras positivas para la primera, segunda, quinta y octava semana del primer proceso de compostaje mediante ELISA y para la primera, segunda y quinta semana mediante Inmunocromatografía (ICT). La muestra de contenido ruminal del primer proceso de compostaje resulto positiva para rotavirus mediante los dos test de detección a diferencia de las otras materias primas. En el segundo proceso de compostaje las materias primas y las muestras del proceso fueron negativas para rotavirus.
ABSTRACT
In order to monitoring Rotavirus presence in compost samples, it was designed an extraction technique and viral concentration starting from the matrix accompanied by a rotavirus detection by means of ELISA and Inmunocromatography (ICT). For it, was carried out two compostaje processes starting from urban solid residuals (RSU) of the sanitary filler Don Juanito, of the city of Villavicencio with different percentages of prunings, ruminal content, square residuals and husk of rice. In the assembly of the piles it was applied an mixed termofilic inoculant with an amilolityc and proteolityc activity quantified at laboratory throwing results of 276UA and 246UP respectively and population's recounts to an initial concentration of 1023UFC/ml. During the composting processes that were obtained in 56 days with maxim temperature of 68.6 Cº, pH value of 8.86.and physiochemical characteristics according with NTC 5167.
As qualitative detection technique of the rotavirus presence in the composting process was used Ahmed and Sorensen, 1995 test and Lewis and Metcalf, 1988 method, for the extraction and concentration of viral particles was modified. Consecutively it was carried out the rotavirus detection where they were positive samples for the first one, second, fifth and eighth week of the first composting process by means of ELISA and for the first one, second and fifth week by means of Inmunocromatography (ICT). The ruminal content sample of the first composting process was positive for rotavirus by means of the two detection test contrary to the other raw material. In the second composting process the raw material and the samples of the process were negative for rotavirus.
In conclusion, is evident the direct temperature and pH effect and on rotavirus particles. However, despite this agent is found in raw materials used to produce compost and occasionally in the final product; factors such as heterogeneity of the analyzed material, detection limit of existing diagnostic methods and especially the characteristics of rotavirus, not allowed to consider it as an efficiency indicator in a stabilization process of organic matter such as composting.
1. INTRODUCCIÓN
Bioagrícola del Llano SA EPSP, es una empresa dedicada a la investigación para el aprovechamiento integral de la fracción orgánica de los residuos sólidos mediante alternativas como el compostaje. Este mecanismo facilita el control sobre el proceso de biodegradación de materia orgánica obteniendo abono orgánico conocido como compost de buena calidad fisicoquímica y microbiológica que se reincorpora al medio ambiente.
La calidad biológica de este producto está determinada por la ausencia de microorganismos fitopatógenos como Fusarium sp, Phytophtora sp, Sclerotinia sp, Salmonella sp, enterobacterias, fagos somáticos y huevos de helminto los cuales permiten verificar su inocuidad al momento de ser utilizado, evidenciando así la total eliminación de los patógenos presentes.
Sin embargo, pese a cumplir la normatividad nacional con relación a la búsqueda de microorganismos patógenos establecida por el ICONTEC, 2004, se consideró necesario ampliar el rango de estos organismos y evaluar otros grupos microbianos para garantizar la inocuidad del producto, en especial cuando se aplique en cultivos de consumo directo.
mencionadas, usualmente la detección de estos organismos está sujeta a la búsqueda de indicadores virales de contaminación fecal los cuales incluyen colifagos somáticos, fagos F-específicos y los bacteriófagos que infectan Bacteroides fragilis en lugar de la búsqueda de patógenos. Estos presentan tamaño, estructura y supervivencia similar a la de los virus entéricos pero las técnicas para su identificación son más rápidas, sencillas y económicas. A nivel mundial el Rotavirus ha sido el causante de 608.400 muertes en menores de 5 años y de un 39% de las hospitalizaciones por diarreas, en el caso particular de América se han producido 15.000 muertes en menores de 5 años y 75.000 hospitalizaciones por enfermedad diarreica aguda (EDA) (De Oliveira, 2006).
Los procesos de manejo de residuos sólidos que involucran altas temperaturas favorecen la eliminación de patógenos ya que en estos la generación de compuestos químicos como el amonio y ácidos orgánicos causan la variación del pH logrando la desestabilización de agentes virales. Sin embargo luego de la ampliación de estos procesos es posible detectar la presencia de genomas virales siendo esta una evidencia de la resistencia viral en virus como el Rotavirus y el Virus de Hepatitis A.
Dentro de los métodos tradicionalmente utilizados para demostrar la presencia de Rotavirus en muestras ambientales se encuentran kits comerciales basados en reacciones antígeno anticuerpo como los métodos de ELISA e inmunocromatografía, con un límite de detección aproximado de 4.105 partículas/mL. Sin embargo las mayores desventajas de estas técnicas son el no reconocimiento de partículas virales infectivas como también las variaciones observadas en sensibilidad y especificidad relacionadas con factores inherentes al procesamiento de las muestras.
2. MARCO TEORICO
2.1 ROTAVIRUS
2.1.1 Morfología y estructura
El Rotavirus presenta simetría icosaédrica, con un diámetro medio de 75 nm y no poseen envoltura lipídica. Su genoma está formado por once segmentos de RNA de doble cadena rodeado por tres capas proteicas concéntricas que se denominan cápside interna o core, cápside intermedia y cápside externa (Figura 1) (Chanock y Kapikian, 2001).
El core o cápside interna esta constituida por sesenta dímeros de proteínas VP2 (102 kda) VP1 y VP3 unidas al RNA viral de doble cadena (Chanock y Kapikian, 2001). La capa intermedia esta constituida por 260 unidades de la proteína trimérica VP6 mientras que la capa externa contiene dos proteínas VP7 y VP4 (Desselberg y Gray, 2000).
Figura 1. Estructura del Rotavirus
Fuente: Estes, 2001
El genoma del Rotavirus contiene once segmentos de dsRNA de cadena doble con un peso molecular que oscila en un rango de 2 x 105 y 20.2 x 104 Daltons con un tamaño de 0.6 a 3.3 Kilopares de bases. Los segmentos de RNA viral están numerados según la velocidad de migración que presentan en gel de poliacrilamida (Chanock y Kapikian, 2001).
El genoma evoluciona ya sea por mutación puntual o por reorganización de los segmentos entre diferentes cepas. Este último mecanismo consiste en el intercambio de segmentos genómicos entre dos cepas al infectar una misma célula; los virus resultantes podrán entonces contener segmentos derivados de ambas cepas parentales (Jaimes et al.,2000)
Tabla 1. Propiedades de las proteínas constituyentes del Rotavirus
Segmento del Genoma
Proteína Localización en partículas
virales
No. De moléculas
por virión
Características y función
1 VP1 Core interna 12 RNA polimerasa, unión al ssRNA, unión a VP3
2 VP2 Core interna 120 Unión al dsRNA, requerida para la actividad replicasa de VP1
3 VP3 Core interna 12 Guanililtransferasa, metiltransferasa, unión a ssRNA, unión con VP1
4 VP4 Cápside externa 120 Hemaglutinina, antígeno neutralizante, potenciación infectividad por proteasa, virulencia, putativa región de fusión, adherencia a la célula, induce protección
5 NSP1 No estructural Básica, anillo de zinc, unión al ssRNA 6 VP6 Cápside interna 780 Hidrofóbica, trimérica, antígeno de
subgrupo
7 NSP3 No estructural Ácida, dimérica, unión extremo 3, del mRNA viral, inhibe traducción del huésped
8 NSP2 No estructural Básica, oligomérica, unión al ssRNA, NTPasa
9 VP7 Cápside externa 780 Glicoproteína integrada en la membrana del RER, trmérica, antígeno neutralizante, 2 regiones hidrofóbicas NH2 terminales, induce protección
10 NSP4 No estructural Glicoproteína transmembranal RER, participa en morfogénesis, induce protección
11 NSP5 No estructural Básica, fosfoproteína, unión al ssRNA, proteína quinasa, interacción con NSP2
2.1.2 Taxonomía y clasificación
El género Rotavirus hace parte de la familia viral Reoviridae, la cual se divide en seis géneros Orthoreovirus, Colitivirus, Orbivirus, Fijivirus, Cypovirus y Rotavirus. El nombre de Rotavirus proviene de la raíz latina rota que significa rueda, debido a la apariencia redonda de las partículas virales al ser visualizadas por tinción negativa en un microscopio electrónico. Este género está dividido en siete grupos serológicos (A a la G). Los grupos A, B y C infectan a los humanos y los grupos restantes infectan especies animales (Ramig, 2004). Hasta ahora, se han clasificado en 14 serotipos-G con base a la glicoproteína VP7 y en 11 serotipos-P con base a la proteína VP4 (Chanock y Kapikian, 2001).
2.1.3 Replicación viral
El Rotavirus inicia su ciclo de infección uniéndose a un receptor localizado en la superficie celular. Luego de la unión al receptor, el virus penetra al interior de la célula y pierde la capa externa, con lo cual se activa la transcripción. La replicación se lleva a cabo en el citoplasma de la célula hospedera. La partícula completa, que contiene las tres capas proteicas, es también llamada TLP; esta es la partícula infecciosa ya que la presencia de la capa externa formada por las proteínas VP4 y VP7 le permite unirse y penetrar a su célula huésped; la partícula que contiene dos capas proteicas o DLP no es infecciosa, pero es transcripcionalmente activa. Luego de la unión a un receptor celular ocurren los siguientes pasos en un transcurso de tiempo de 14 horas aproximadamente
1. Adsorción de las proteínas externas del virión VP4 y VP7 a un receptor celular. 2. Penetración directa o por endocitosis.
3. La capa externa es removida como parte del proceso de entrada y permite activar la transcripción.
4. Producción de mRNA en el citoplasma por DLPs
5. Una vez el mRNA emerge de las DLPs, el RNA de polaridad positiva es sintetizado por la RNA polimerasa viral.
6. Simultáneamente el mRNA es usado como molde para la traducción de 6 proteínas virales estructurales y 5 proteínas no estructurales.
a. Glicosilación de VP7 en el retículo endoplasmático rugoso (RER), NSP4 actúa como un receptor intracelular para DLPs.
b. Envoltura transitoria de las partículas en el RER que contienen VP4 y VP7 c. Remoción de la envoltura
9. Liberación de partículas infecciosas por lisis celular (Desselberg y Gray, 2000)
In vivo, el Rotavirus presenta un tropismo celular específico; la infección viral sólo se lleva a cabo en los enterocitos diferenciados de las vellosidades del intestino delgado. In vitro, la infección por Rotavirus está restringida a líneas celulares epiteliales de origen renal como las MA104 de riñón de mono, e intestinal como las células de cáncer de colon, CaCo-2 (Estes et al., 2001).
2.1.4 Epidemiología
Dentro de la etiología viral, el Rotavirusconstituye la causa más frecuente de diarrea, siendo su frecuencia entre el 70-80% de los casos de EDA enfermedad diarreica aguda en niños de países desarrollados. Su distribución geográfica es universal y pueden ser más frecuentes en las regiones socioeconómicas más pobres (Cáceres et al., 2006).
Tanto en los países desarrollados como en los países en vía de desarrollo casi todos los niños han sido infectados por Rotavirus en los primeros años de vida. Las primeras infecciones después de los tres meses de edad son generalmente sintomáticas y la incidencia de la diarrea disminuye hacia los 2 o 3 años de edad. La incidencia de Rotavirus en niños en países en vía de desarrollo ha sido definida por estudios prospectivos de cohortes y varía entre 0,07 y 0,8 episodios por niño por año (Bresee et al., 1999)
En los países desarrollados, los Rotavirus constituyen el agente único más frecuente de diarrea en los niños menores de 2 años que necesitan asistencia médica, concentrándose el mayor número de casos entre los 3-12 meses de edad, con un claro predominio en los meses invernales.
años afectados. Se estima que aproximadamente 600.000 casos de EDA existen en el mundo cada año (Ciarlet et al., 2002).
En países desarrollados la diarrea por Rotavirus es principalmente una enfermedad que se presenta en el invierno con muy pocos cuadros fuera de este pico estacionario; mientras que en los países en vía de desarrollo la enfermedad ocurre durante todo el año sin variaciones según las estaciones, aunque puede presentarse picos en los meses fríos o secos o en el invierno (Bresee, et al., 1999). En Colombia, según Cáceres, et al., 2006 el Rotavirus se presenta con una variación biestacional, con un primer pico en los meses entre Febrero y Mayo y un segundo pico entre Septiembre y Noviembre manteniéndose estable los meses restantes, principalmente en las ciudades de Facatativa, Bogotá, Medellín, Manizales, Cartagena y Quibdó donde se han hecho estudios de prevalencia para enfermedad diarreica aguda (EDA).
La principal fuente de este agente viral son las heces de personas y animales infectados, la liberación de Rotavirus del tracto intestinal de un individuo infectado se produce antes de manifestar la diarrea e incluso cuando la diarrea ha cesado, de hecho se ha documentado la excreción de virus sin presentar diarrea. Las heces fecales suelen contener 108-1010 partículas virales por mililitro, y la dosis infecciosa es de 10-100 partículas virales (Rzezutka y Cook, 2004; OPS, 2007). El virus puede ser transmitido por vía fecal oral, por agua, alimentos contaminados, persona a persona y probablemente por secreciones respiratorias aunque este último hallazgo es circunstancial.
Con los conocimientos actuales y con las técnicas presentes se dispone de un mejor diagnóstico de los agentes etiológicos de las diarreas infantiles. En la actualidad, el agente viral más frecuentemente encontrado en niños menores de cinco años con gastroenteritis aguda son los Rotavirus grupo A, causantes del 25 al 65% de gastroenteritis graves infantiles. El segundo agente encontrado son Calicivirus (7-22%), y el tercer lugar se lo disputan Astrovirus y Adenovirus, con un 2-9% y 2-6% respectivamente (Simpson et al., 2003)
2.1.5 Morbilidad y Mortalidad
y entre 352.000 y 592.000 defunciones en niños menores de 5 años (Tabla 2). Así, casi cada niño menor de 5 años tendrá un episodio de gastroenteritis causada por Rotavirus, 1 de cada 5 necesitará visita médica, 1 de cada 65 será hospitalizado y, aproximadamente, 1 de cada 293 morirá (Parashar et al., 2003).
La incidencia de la enfermedad causada por Rotavirus es similar en países industrializados y en países en vías de desarrollo. Sin embargo, los niños de los países en vías de desarrollo mueren con más frecuencia, posiblemente por un cúmulo de factores cómo un peor acceso a la terapia de rehidratación y una mayor prevalencia de desnutrición. Se ha calculado que 1.205 niños mueren cada día debido a una gastroenteritis causada por Rotavirus y que el 82% de estas muertes ocurren en los países más pobres (Wilhelmi et al., 2003)
Tabla 2. Número de casos de la enfermedad causada por Rotavirus en niños menores de 5
años a nivel mundial
Países en vías de desarrollo
Países industrializados
Total
Atención en casa 104.280.000 7.122.000 111.402.000
Atención clínica 23.233.000 1.781.000 25.017.000
Atención hospitalaria
1.920.000 223.000 2.143.000
Fuente: Parashar et al., 2003
2.1.6 Dinámica viral en el medio ambiente
Las vías de transmisión de los virus en el medio son muy diversas, por esta razón ha provocado una creciente alarma al comprobarse que la población está expuesta a una gran variedad de posibilidades para adquirir una infección. Las distintas vías de transmisión incluyen (Kittigul et al., 2001):
• Ingestión de agua contaminada
• La infección directa por virus de los agricultores y de sus contactos
• Ingestión de vegetales que se han regado con aguas insuficientemente tratadas o que se han cultivado en terrenos abonados con lodos de depuradora que contenían virus infecciosos
• Contaminación por virus de las fuentes de agua potable como resultado de la escorrentía de la fracción de agua que corre por la superficie o de la infiltración a las aguas profundas
• Contacto con aguas de baño que han recibido aporte de aguas contaminadas
• Contacto con aerosoles generados a partir de aguas contaminadas
Los virus entéricos humanos, ingresan a los ambientes acuáticos a través de las descargas de aguas contaminadas con heces, se han detectado concentraciones significativas de virus en las aguas vertidas al ambiente y en los biosólidos generados en plantas de tratamiento de agua residual (Graffo et al.,1993; Hurst,1997) y, a pesar de que se considera que hay una reducción importante de la concentración de virus, se ha estimado, a partir de los 100.000 enterovirus por litro frecuentemente detectados en el agua residual, que en una población de 300.000 habitantes pueden liberarse al medio ambiente cantidades de 109 partículas víricas en 24 horas en aguas residuales tratadas (Schwatzbrod, 1995, OMS, 1979)
Los virus entéricos en agua pueden permanecer estables durante meses o incluso más tiempo si están asociados a sólidos y pueden acumularse en sedimentos donde persistirán durante más tiempo y desde donde pueden resuspenderse en la columna de agua por diversos procesos naturales como lluvias fuertes, o por procesos artificiales, facilitando la diseminación viral (Rzezutka y Cock, 2004). De igual forma estos microorganismos han demostrado ser más estables en el ambiente que los indicadores bacterianos comúnmente utilizados para evaluar la contaminación fecal (Bosch et al., 2006). La asociación de bacteriófagos y virus animales con sólidos, tiene un efecto protector resultando en la resistencia a la inactivación por cloro en tratamientos de agua y un aumento de la sobrevivencia del virus en esta. Esto se debe a que los sedimentos no actúan solo como depósitos de virus entéricos sino que estos pueden desprenderse de los sólidos y llegar a la columna de agua por degradación de los sedimentos o lluvias (Chalapati, et al,. 1984).
En los sistemas de producción agrícola los virus se encuentran asociados a los alimentos de consumo directo irrigados con aguas contaminadas y también aquellos cultivos donde se realiza fertilización orgánica con compost, lodos de plantas de tratamiento de aguas y biosólidos. Los virus pueden ser transferidos a las superficies de vegetales y permanecer allí por varios días luego de la aplicación de abono o del efluente contaminado con partículas virales principalmente en las hojas de cultivos de tomate, pimentón y col de brucelas (Raezuka y Cock, 2004). Se considera que en los vegetales con superficies húmedas como la lechuga y el apio la supervivencia viral se incrementa convirtiendo a estos alimentos en una fuente de transmisión viral; la lechuga es el mejor vehiculo para la trasmisión de Rotavirus SA -11 de igual forma este virus puede sobrevivir a temperatura de refrigeración luego de la inoculación directa sobre el alimento (Bosch et al., 2006, Seymour y Appleton, 2001).
La supervivencia de virus en vegetales de consumo directo está influenciada por parámetros como temperatura, exposición a la radiación, humedad tipo de virus y tipo de vegetal. De igual forma la conservación de los vegetales a 4°C impide la inactivación viral e incrementa el tiempo de supervivencia de partículas virales (Schwartzbrod, 1995).
Los residuos orgánicos que se producen a partir de la actividad agrícola, industrial y doméstica generalmente son sometidos a procesos de estabilización con el fin de mejorar sus condiciones fisicoquímicas y biológicas como también para permitir el aprovechamiento y reincorporación de estos al ecosistema como ocurre con la producción de abonos orgánicos.
Las partículas virales presentes en materiales como excrementos, aguas residuales, desechos domiciliarios, etc., no son completamente destruidos luego de tratamientos como digestión anaerobia, digestión aerobia y compostaje; y su supervivencia en lodos, compost, biosólidos dependerá de las características propias de cada material y condiciones externas como pH, temperatura, humedad, presencia de iones y sólidos.
Una vez los lodos y biosólidos han sido aplicados al suelo se crean aerosoles que favorecen la dispersión de agentes bacterianos y virales. Según, Gerba et al., 2004 debido a la baja concentración de enterovirus (1-2 UFP/g) los aerosoles virales no constituyen un problema significativo, sin embargo se han encontrado la presencia de poliovirus, reovirus, echovirus y coxsackievirus B cien metros después del punto de aplicación del biosólido siendo los reovirus los indicadores potenciales de presencia de aerosoles de virus entéricos (Carducci et al., 2000).
Se espera que en el producto final del proceso de compostaje a partir de biosólidos no se encuentren partículas virales viables ya que el principal factor que contribuye a la eliminación de este tipo de patógenos es la temperatura y su interacción con las sustancias que se producen durante el desarrollo del proceso. Normalmente los virus entéricos pueden ser encontrados en la primera fase del proceso pero el rango de temperatura entre (55 – 70°C) permite la reducción de 3 unidades logarítmicas en la concentración viral por ruptura de la cápside y liberación del ácido nucleico. La supervivencia de virus puede presentarse por un manejo inadecuado de temperatura, contaminación del área y utensilios utilizados durante el proceso y también por la distribución heterogénea de los materiales (Guardabassi et al, 2003; Monphoeho et al., 2004).
2.1.7 Métodos Para la Detección de Virus en Lodos y Compost
En ocasiones los virus se encuentran en el suelo y en sistemas de tratamiento de residuos sólidos en rangos variables según la clase de virus, causando diferentes patologías al hombre (Tabla 3) y con un patrón de distribución heterogéneo debido a la distribución irregular de la materia orgánica y de los componentes coloidales del suelo.
Tabla 3. Virus en lodos y residuos sólidos urbanos
Virus Enfermedad causada
Poliovirus Poliomielitis
Coxsackivirus Meningistis, neumonía y hepatitis Echovirus Meningitis, encefalitis y paralisis
Hepatitis A Hepatitis infecciosa
Calicivirus humano Gastroenteritis
Hepatitis E Hepatitis
Astrovirus Gastroenteritis
Adenovirus Infecciones del tracto respiratorio y gastroenteritis
Fuente: (Gerba y Smith, 2005; Van Soelen,2007)
En relación a los virus, el lodo crudo puede contener más de 100 especies diferentes de virus patógenos para humanos. Varios autores han examinado el lodo crudo en países desarrollados en diferentes áreas geográficas, demostrando que el número de virus entéricos puede variar desde 1000 hasta más de 50000 unidades formadoras de placa por litro (UFP/L). Los virus de la Hepatitis A y los Calicivirus son los de mayor preocupación, pero no se han desarrollado métodos estandarizados para su aislamiento y detección. Estos parásitos intracelulares son más resistentes a los procesos de desinfección que los organismos coliformes. Por lo tanto, los indicadores tradicionales de contaminación bacteriana no evalúan de manera eficiente la presencia o ausencia de virus (Guzmán y Campos, 2002)
Lo anterior hace necesario el desarrollo de métodos de concentración y constituye uno de los problemas principales de la virología ambiental. Safferman, 1989, describió un procedimiento para la presencia de virus asociados a sólidos (lodos, suelos, sedimentos y otros). Su diseño implica la elusión del virus directamente del sólido. Estas muestras son evaluadas en cultivo celular por virus formadores de placa. El método que describe la EPA/625/R-92/013 (1999), detecta virus cultivables totales los cuales incluyen principalmente el grupo de los enterovirus (Poliovirus, Coxsackievirus, Echovirus) y el grupo de los Reovirus.
coloración vital que colorea solo células vivas. El número de placas circulares no coloreadas (UFP) es proporcional a la cantidad de partículas infecciosas inoculadas.
[image:26.595.105.520.314.608.2]Los métodos recomendados para la extracción de virus en lodos son el método de vaso (Glass method) el cual consiste en la adición de extracto de carne pH 9, seguido de una sonicación, centrifugación, precipitación viral usando Na2HPO4 y cultivo celular para la enumeración de los virus y el método de la EPA con AlCl3. Según Lichtenberg, 1988 ambos métodos poseen problemas inherentes como se muestra en la tabla 4, pero ambos son recomendados como métodos estándar para la recuperación de virus entéricos en lodos.
Tabla 4. Comparación de dos métodos de recuperación de virus en lodos
Factor Método de vaso EPA /625/R-92/013
Volumen final de muestra para el ensayo de
detección
Pequeño (aprox. 10ml) 50 a 100ml
Equipo especial o inusual de laboratorio requerido
Sonicador Ninguno inusual
Contaminación bacteriana o fúngica de la muestra a
analizar
No usual Frecuente
Facilidad para procesar un alto número de muestras
simultáneamente
Difícil Fácil
Volumen de muestra 800ml 300ml
Problemas operacionales Formación de espuma en el extracto de carne
Dificultad en el proceso de filtración, especialmente en el caso de lodos primarios.
Fuente: (Lichtenberg, 1988)
causan lisis en cultivos celulares (Hurst y Goyke, 1983). Además estos compuestos pueden formar complejos con los ácidos nucleícos e inhibir las enzimas de amplificación, disminuyendo la efectividad de la PCR (Graff, et al., 1993)
La mayor parte de los métodos de recuperación de virus aprovechan las propiedades de los virus como macromoléculas proteicas. Los virus se comportan en el medio como un coloide hidrófilo en el que la carga eléctrica neta varía en función del pH y de la fuerza iónica del medio. Tienen, además, la capacidad de adsorberse sobre partículas en suspensión o soportes de cualquier tipo.
Un buen método de concentración debe ser simple, rápido y económico. Debe proporcionar altas tasas de recuperación y ser aplicable a la recuperación de diferentes virus. El concentrado viral obtenido debe estar libre de posibles sustancias tóxicas o inhibidoras presentes en las muestras para que pueda ser utilizado en los procesos de detección subsiguientes. La metodología debe escogerse en función de factores geográficos y climáticos, tipo de residuo, ya que las variaciones en sus características físico-químicas y en la cantidad de materia orgánica afectan a la capacidad de agregación de los virus, así como a la eficiencia de algunos métodos; y tipo de virus, ya que ciertos métodos podrían provocar su inactivación (Mignotte et al., 1999).
Como se ha visto anteriormente la mayoría de literatura existente se refiere a la recuperación de agentes virales a partir de lodos y suelo más no a compost, sin embargo estos métodos pueden ser utilizados para la extracción viral en este tipo de matriz.
2.1.8 Métodos de detección
El diagnóstico de laboratorio de Rotavirus está basado fundamentalmente en su detección en las heces, se emplean variadas técnicas tales como son la microscopia electrónica (ME), la electroforesis en gel de poliacrilamida (PAGE), la aglutinación por látex, el ELISA, la hibridación de ácidos nucleícos, PCR (reacción en cadena de la polimerasa) entre otras (Ribas et al., 1996)
involucrados y la identificación de los virus mediante la visualización del ojo humano requiere profesionales altamente capacitados y con gran experiencia, motivo por el cual éste es un método limitado como herramienta diagnóstica (Riverón et al., 1989)
Las partículas virales de Rotavirus son detectadas por microscopía electrónica (ME) siempre y cuando se encuentran en elevadas concentraciones en las heces, lo que con frecuencia ocurre en las personas infectadas que presentan sintomatología, aunque se estima que se requiere del orden de 106 partículas víricas por gramo de muestra para poder ser observadas. La inmunomicroscopía electrónica, utilizando antisueros o anticuerpos monoclonales, incrementa la sensibilidad de la ME, y además sirve para demostrar la agregación de partículas víricas por los anticuerpos específicos, una de las observaciones consideradas como demostrativas del papel patógeno de los distintos virus. Estas técnicas continúan siendo de gran utilidad en el diagnóstico de las gastroenteritis víricas, siempre, por supuesto, que se pueda disponer de un microscopio electrónico y de personal entrenado. La gran ventaja de la microscopía electrónica respecto a otras técnicas diagnósticas es que permite encontrar cualquier virus, sin que el procedimiento limite la identidad del agente detectado, como sucede con las técnicas inmunológicas o moleculares. La mayoría de los virus son reconocibles por su morfología, y algunos virus se diagnostican principalmente por este procedimiento (Torovirus, Coronavirus). Por microscopía electrónica se detectan, además, virus que en muchos laboratorios no se investigan por otras técnicas (Rotavirus de grupos B y C, Calicivirus, etc.) (Buesa et al., 2007)
La electroforesis en gel de poliacrilamida (PAGE) se fundamenta en la separación electroforética de los segmentos del RNA del virión. Por otro lado, el inmunoensayo enzimático es el método más utilizado para confirmar la presencia de Rotavirus porque es altamente sensible y no requiere equipos especializados. Los ensayos de ELISA para Rotavirus utilizan anticuerpos (policlonales o monoclonales) en un inmunoensayo tipo sándwich de fase sólida para detectar el antígeno específico de grupo (Kapikian y Chanock, 1996).
anticuerpos de captura, presencia en la muestra de enzimas que degradan proteínas o ácidos nucleícos (Rivera, 1995).
Estudios realizados con anterioridad, demuestran la gran sensibilidad del Kit de ELISA frente a las técnicas de aglutinación en látex y la electroforesis de ARN. Sin embargo estas técnicas son más específicas que ELISA (Rivera, 1995)
La inmunocromatografía es un inmunoensayo que en la actualidad es ampliamente utilizado en la detección rápida de diversos antígenos; de igual forma se convierte en una de las técnicas de inmunodiagnóstico más modernas cuyas principales ventajas son la sencillez y rapidez. En el diagnóstico de enfermedades virales se ha trabajado en pruebas de cassette inmunocromatográficas para el Virus de la influenza A y B, Virus respiratorio Sincitial, Adenovirus, Norovirus y Rotavirus y otros patógenos como Corynebacterium diphtheriae, Mycobacterium tuberculosis, Triticum aestivum, Tenia solium entre otros (Crespo, 2000; Skerritty Heywood, 2000, De frutos et al., 2004)
Esta técnica permite visualizar la reacción antígeno-anticuerpo por la acumulación de oro coloidal u otra sustancia indicadora del conjugado en zonas específicas del papel de nitrocelulosa donde se fijan previamente anticuerpos de captura (Skerritty Heywood, 2000).
En primer lugar la muestra se pone en contacto con la zona del conjugado formado por un anticuerpo específico contra uno de los epítopes del antígeno a detectar y un reactivo de detección. Si la muestra contiene el antígeno a detectar, éste se unirá al conjugado formando un complejo y migrará a través de la membrana de nitrocelulosa, en caso contrario migrarán el conjugado y la muestra sin unirse.
La zona de captura está formada por un segundo anticuerpo específico contra otro epítope del antígeno. Al llegar la muestra a esta zona, los complejos formados por la unión del antígeno y conjugado quedarán retenidos y la línea se coloreará (muestra positiva). Si la muestra no contenía el antígeno no hay captura y la línea quedara transparente en el caso de una muestra negativa (De Frutos et al., 2004).
Figura 2. Método de inmunocromatografía.
Fuente: Martín, 2004
Los métodos inmunológicos detectan solamente Rotavirus del grupo A, ya que por el momento no existen métodos comercializados para detectar Rotavirus de grupos B y C. En este caso particular el diagnóstico de las infecciones por Rotavirus se realiza habitualmente detectando la existencia de antígeno vírico en muestras de heces, con frecuencia la proteína VP6 (James et al., 1998).
El desarrollo de las técnicas moleculares ha permitido la detección e identificación de bajas concentraciones de virus en muestras de diversos orígenes, proporcionando sensibilidad y especificidad. Estas técnicas detectan la presencia de RNA vírico, bien poniendo de manifiesto segmentos de RNA bicatenario mediante la electroforesis en gel de poliacrilamida (PAGE), o bien amplificando por reacción en cadena de la polimerasa (PCR) (Monpoeho et al., 2004; Coll, 1993).
El desarrollo de la tecnología molecular ha provisto sensibilidad, especificidad y rápida detección viral. El PCR se utiliza para detectar niveles de acido nucleico que están presentes en un número bajo de copias en las muestras ambientales (Soule et al., 2000). El PCR no determina el estado infeccioso de un organismo solo puede determinar la presencia o ausencia de secuencias de RNA o DNA especificas del patógeno. Una gran desventaja es la sensibilidad de la polimerasa a la presencia de inhibidores los cuales pueden ser concentrados con el virus (Gratacap-Cavallier et al., 2000)
Las expectativas están enfocadas al desarrollo de técnicas sensibles, específicas y de alta reproducibilidad para la detección temprana de agentes virales que involucren un riesgo para la comunidad, el trabajador y el medio ambiente.
2.2 EFECTO DE LAS CONDICIONES MEDIOAMBIENTALES SOBRE LA PARTÍCULA VIRAL
La reutilización de lodos y compost para la agricultura implica un riesgo potencial para la salud pública debido a los virus y otros organismos patógenos provenientes de industrias, hospitales e individuos afectados, que puedan estar presentes en los biosólidos y ser potenciales contaminantes del ambiente, del hombre y de los animales.
La única característica que hace a un virus infectivo es la capacidad de producir una progenie. Por consiguiente el efecto de las condiciones medioambientales sobre la partícula viral implica la variedad de factores físicos y químicos que afectan su infectividad entre otras características propias de estos agentes.
La tasa de sobrevivencia de virus es una consideración importante en el tratamiento de residuos sólidos municipales, domésticos y animales la cual no ha sido evaluada adecuadamente. Numerosos estudios de campo y a nivel de laboratorio han establecido que la retención y la sobrevivencia de los virus están influenciadas por factores como el tipo de material, pH, presencia de materia orgánica disuelta, concentración total de sólidos disueltos, cationes polivalentes y orgánicos y características de la partícula viral como su punto isoeléctrico e hidrofobicidad (Williamson et al., 2005; Schwatzbrod, 1995, OMS, 1979).
2.2.1 Adsorción viral a partículas sólidas
Los virus entéricos tienen una mayor estabilidad cuando están adheridos a partículas sólidas, por lo tanto se espera que se concentren en lodos, residuos orgánicos, sedimentos y suelos donde su permanencia en el tiempo será mayor, aunque presentan diferencias con respecto a la eficacia de adhesión, los sólidos a los cuales se adsorben y las condiciones que favorecen el proceso (Lucena et al., 2005).
hidrofóbico. Estas interacciones son las responsables de la adsorción de partículas virales a superficies sólidas y en la interfase aire – agua. Las superficies virales pueden tener dominios hidrófilos e hidrófobos. La parte hidrófoba de una partícula viral depende de cómo estén sus dominios equilibrados y orientados en la superficie (Thompson et al., 1998).
El riesgo de contaminación de aguas subterráneas a partir de biosólidos puede estar asociado principalmente con el virus, debido a su tamaño relativamente pequeño y a la adsorción variable a las partículas del suelo (Chauret et al., 1999).
2.2.2 Virus en el suelo
La supervivencia y destino de los virus entéricos en el suelo es una consideración importante debido a los riesgos potenciales para el humano y los animales. Esta supervivencia se encuentra influenciada por factores como el tipo de suelo, las características químicas del agua de riego, el pH, y las concentraciones de sólidos totales disueltos, cationes polivalentes y orgánicos (Sobsey, et al., 1980).
La textura del suelo determina la retención y transporte de las partículas virales en el ecosistema suelo. Los suelos arcillosos pueden retener mayor cantidad de agua que los suelos arenosos, no obstante el fenómeno de evaporación de agua ocurre a mayor velocidad en las arcillas debido al alto contenido mineral. Lo mismo ocurre con la concentración de partículas virales ante la reducción del contenido de agua disponible en el suelo para la actividad biológica (Straub et al., 1992). El fenómeno de adsorción viral a las fracciones de materia orgánica y arcilla también determina la viabilidad de los virus en el suelo protegiendo a los viriones de la acción de enzimas líticas como nucleasas y de otros factores antagónicos propios de este ecosistema (Sylvia et al., 2005).
Los virus presentes en aguas contaminadas, lodos y compost pueden pasar a través del suelo, alcanzar y contaminar aguas subterráneas. El fenómeno de migración viral se hace más intenso en temporada de lluvia o por irrigación excesiva de los cultivos de suelo, de igual forma debido a que la supervivencia de los virus en el suelo está determinada por diversos factores su tiempo de permanencia en este ecosistema varia de 11 a 180 días (Tabla 5).
Tabla 5. Tiempo de supervivencia de virus en el suelo
Agente viral Tipo de suelo y tiempo de supervivencia
Poliovirus 91 días en suelos arenosos y condiciones húmedas; 180 días en suelos arenosos saturados y compost
Hepatitis A 91 días en suelos arenosos y condiciones húmedas Coxsackievirus
A
180 días en suelos arenosos saturados y compostaje
Coxsackievirus B
180 días en suelos arenosos saturados y compostaje
Echovirus 3-33 semanas dependiendo de las condiciones del suelo
Fuente: (Schwartzbrod, 1995)
Keswick y Gerba (1980) evaluaron los factores que controlan la supervivencia de los virus y pudieron comprobar que la desactivación era mucho más rápida cerca de la superficie del perfil del suelo Esto se debería a los efectos dañinos los microorganismos aeróbicos del suelo, a la evaporacíón y a las elevadas temperaruras en las zonas próximas a la superficie. Así, la supervivencia de los virus aumentaría según el grado de penetración de los suelos.
2.2.3 Temperatura
las proteínas del virus, mientras en temperaturas bajas cercanas a la congelaciónlos virus persisten por periodos más largos. Yeager y 0'Brien (1979) constataron que el período de supervivencia del virus de polio dependía de la temperatura: en suelos saturados y a una temperatura de 37°C, los virus sobrevivían cerca de 12 días; al reducirse la temperatura a 22°C el lapso de supervivencia alcanzaba 92 días, l legando hasta 180 días cuando la temperatura era de 4°C.
Las temperaturas más bajas generalmente refuerzan la supervivencia del virus y la mayoría de estos pueden permanecer en temperaturas de congelación manteniendo su infectividad por periodos largos de tiempo (Sobsey y Meschke, 2003).
La temperatura está implicada en la destrucción de Rotavirus fuera de la célula hospedera, la inactivación a altas temperaturas produce daños principalmente en la porción proteica del virión (Ashley y Ward, 1978). Un ejemplo de esto es el compostaje, el cual es un proceso de estabilización dependiente del calor, y las temperaturas alcanzadas durante el tratamiento (55 – 70°C) parecen ser suficientemente altas para eliminar los microorganismos entéricos siendo capaces de disminuir la cantidad viral entre 3 y 4 unidades logarítmicas.
Se ha demostrado que el Rotavirus es capaz de ser infectivo, después de ser mantenido 7-9 meses a temperatura ambiente (18-20°C), en heces (R amos et al., 1998). La deshidratación también juega un rol importante en la inactivación viral por ruptura de la cápside del virus y la remoción del ácido nucleico (Monpoeho et al., 2004)
Con la temperatura interactúan otros factores como el contenido de humedad del material a compostar y la presencia de sustancias químicas. Los virus son menos sensibles a la inactivación por calor en ambientes con humedad reducida. La disminución en el contenido de humedad de lodos por evaporación reduce significativamente las tasas de inactivación por calor de Enterovirus y Reovirus (Ashley y Ward, 1978).
2.2.4 pH
El pH del suelo, además de seleccionar los organismos adaptados a vivir en un pH concreto, determina la carga neta de sustancias anfóteras y condiciona la adsorción de los organismos al complejo adsorbente del suelo. A valores de pH menores a cinco los virus se adsorben como cationes a las partículas coloidales cargadas en el suelo, cuando el pH supera este valor la carga eléctrica viral se hace menos positiva y la adsorción se reduce. Generalmente el proceso de adherencia se incrementa cuando el pH decrece y aumenta la salinidad de la solución de suelo (Sobsey y Meschke, 2003).
Las partículas de Rotavirus son estables en un rango de pH de 5 a 9, en general no son sensibles al ácido y por lo tanto pueden sobrevivir con valores de pH entre 3 y 5. En contraste la exposición a valores elevados de pH puede resultar en la inactivación viral por pérdida de proteínas (Ciartlet et al., 2002).
2.2.5 Radiación solar
El principal factor inactivador en sistemas a cielo abierto es la radiación solar. Según Campos, 2003 la radiación solar es un factor inactivador relevante, sin dejar de lado que la inactivación natural se produce como la suma de varios factores (predación por protozoos, estrés osmótico, adsorción a partículas y deficiencias de nutrientes).
Tabla 6. Dosis requeridas de luz UV para la inactivación de virus
Virus 90% 99% 99.9% 99.99%
Echovirus 8 16.5 25 33
Coxsackievirus 9.5 18 27 36
Poliovirus 8 15.5 23 31
Adenovirus 40 78 119 160
Fuente: (Gerba, et al., 2002)
La inactivación se presenta como un fenómeno integrado, debido a fenómenos de foto-oxidación generados por la radiación solar, materia orgánica y catalizada por el oxígeno. Además esta influenciada por el color tal como ocurre en los residuos urbanos y en el caso de aguas por su turbidez que permite la absorción de la radiación solar (Knight, 1975). Este fenómeno unido a fluctuaciones del pH, induce cambios conformacionales de la cápside de las partículas virales alterando su infectividad.
La luz ultravioleta causa la inactivación viral sin ocasionar la ruptura de las cadenas de polinucleótidos sino por modificaciones en las mismas tales como formación de enlaces covalentes en los residuos de timina en el DNA viral o en los residuos de uracilo en el caso del RNA formando dímeros de nucleótidos en ambas cadenas, formación de derivados de 5 – hidroxi, 6 – hidroxi en las moléculas de pirimidinas, lo cual es de suma importancia en la inactivación de virus (Knight, 1975).
2.2.6 Compuestos químicos
Los principales agentes químicos que inactivan virus incluyen enzimas como fosfolipasas y proteasas, proteínas denaturantes, agentes oxidantes, ácidos y bases y agentes que afectan los grupos amino primarios como el formaldehido y el ácido nitroso (Sobsey, 1986).
La concentración y el tipo de sales presentes en el ambiente también influyen sobre el transporte y sobrevivencia de virus entéricos. Los cationes, en especial aquellos que son multivalentes como el calcio (Ca2+) y el magnesio (Mg2+) tienen la capacidad de formar
puentes entre las superficies sólidas y los virus mejorando significativamente la adsorción. De igual forma determinan el número de sitios disponibles para el enlace como también el número de puentes que pueden ser formados entre estas dos superficies (Bitton y Harvey, 1992; Simoni et al., 2000).
La materia orgánica disuelta disminuye la adsorción viral ya que compite por los sitios de unión sobre el material particulado debido a la similitud de las cargas eléctricas entre este material y los virus (Williamson et al., 2005).
2.3 COMPOSTAJE
El compostaje es una técnica utilizada desde hace mucho tiempo en la agricultura, consistente en el apilamiento de diferentes tipos de residuos tales como residuos urbanos, restos de cosecha, excrementos animales entre otros, con el fin de obtener un producto aprovechable para el suelo.
Uno de los principales objetivos del proceso es estabilizar la materia orgánica presente en los residuos orgánicos que comprenden una amplia gama de diferentes materiales, desde los mas sencillos como las proteínas, grasas y azucares, hasta los mas complejos y recalcitrantes como celulosa, hemicelulosa y lignina (Avendaño, 2003).
Inicialmente, la materia orgánica seleccionada es atacada por microorganismos descomponedores cuyo crecimiento exotérmico eleva la temperatura de la masa hasta los 75°C. En esta fase se seleccionan microorganismos t ermófilos y aerobios debido a los sucesivos volteos de la masa en la zona de fermentación. Durante esta primera fase termófila con una duración aproximada de 15 días (varía de acuerdo con los residuos) se espera que los patógenos, larvas de insectos y semillas de malezas sean eliminados, garantizando de esta forma sanitariamente el producto final obtenido (Sylvia et al., 2005). La eliminación total de los patógenos concluye con la acción antibiótica generada por numerosos hongos y actinomycetes aerobios (Avendaño, 2003). Finalmente, el producto comienza la fase de maduración hasta que se obtiene un producto estable de color oscuro.
garantiza la eliminación total de los patógenos presentes tales como huevos de helminto y Salmonella sp y estructuras reproductivas de hongos. Adicionalmente luego de una desinfección del compost existe el riesgo de reaparición o multiplicación de patógenos; este riesgo es drásticamente reducido si el material a compostar es tratado aeróbica o anaeróbicamente antes de ser incorporado al proceso (Bjorklund et al., 2003).
Los residuos orgánicos ocupan en el mundo un lugar prioritario ya que constituyen entre el 30 y el 65 % de los residuos domiciliarios y más del 85% de los residuos considerados agrícolas (Sztern y Pravia, 1999). Es por esta razón que la tendencia actual es la reducción sustancial del volumen de los residuos cuya fracción orgánica será la materia prima de los procesos de compostaje.
Actualmente, el uso de inoculantes termofílicos es una alternativa viable en el tratamiento de residuos vegetales y residuos sólidos orgánicos. La gran estabilidad que presentan las enzimas de estos microorganismos frente a temperaturas extremas, garantiza una capacidad de degradación mayor que la obtenida por géneros microbianos mesófilos. La utilización de inoculantes biológicos a partir de microorganismos mesófilos y termófilos ha traído grandes beneficios en compostación de residuos agrícolas, domésticos, industriales y hospitalarios. Así lo demuestran experiencias realizadas en varias zonas del país, obteniendo un rendimiento óptimo en la tasa de degradación de cada tipo de residuos a tratar, sin alterar de modo alguno la calidad del producto final; por el contrario, se logra la producción de un compost con alto contenido en elementos como nitrógeno, fósforo y potasio, que ayudan a incrementar la viabilidad de los suelos (Moreno, 2001).
2.3.1 Etapas del proceso de compostaje según la temperatura
La temperatura es un factor importante en el proceso de compostaje, refleja la actividad biológica de los microorganismos, siendo una de las condiciones ambientales determinante de la rapidez con la cual los materiales son metabolizados. Es fundamental en la maduración del compost, ya que el aumento de la temperatura durante el proceso refleja una actividad microbiana óptima y un equilibrio entre la aireación, humedad y composición de la mezcla (Labrador, 1996).
Carbono/Nitrógeno de sus constituyentes, los de menor relación Carbono/Nitrógeno alcanzan mayores temperaturas (Mathur, 1991).
Durante el proceso se pueden encontrar cuatro fases de gran importancia dependiendo de la actividad metabólica de los microorganismos; la primera es la mesofílica, la segunda la termofílica, la de enfriamiento y finalmente la de maduración (Trautmann y Olynciw, 1999; Coyne, 2000)
Inicialmente los residuos se encuentran a temperatura ambiente (fase de latencia), pero una vez superado el tiempo de adaptación de los microorganismos al medio, estos crecen y la temperatura sube considerablemente alcanzando a los pocos días los 40°C, esta primera fase se denomina mesofílica, actúan especialmente bacterias mesófilas, las cuales degradan el material de fácil descomposición produciendo ácidos orgánicos que hacen bajar el pH (Kent, 1991, Páez et al., 2000, Alfaro et al., 2001, España y Barreto, 2002).
La temperatura sigue subiendo hasta alcanzar valores comprendidos entre 60-70°C (fase termofílica), aquí la microflora mesófila es sustituida por la termófila y el material más difícil de descomponer comienza a ser degradado. Si existen condiciones óptimas de humedad y ventilación se producen visibles emanaciones de vapor de agua. Estos microorganismos transforman el nitrógeno en amoniaco y el pH del medio se hace alcalino, a los 60°C los hongos termófilos cesan su actividad y aparecen bacterias esporógenas y actinomicetos (Avendaño, 2003, Beffa et al., 1996, Arnedo et al., 2002, Nakamura et al., 2004). Además se produce una disminución del carbono presente en el material, provocando el descenso de la relación C/N ya que se degradan sustancias como celulosa y lignina (Forgarty y Tuovinen, 1991) también en esta fase la mayoría de los microorganismos patógenos, parásitos, fitotoxinas y semillas de malas hierbas son destruidos (Avendaño, 2003, Arnedo et al., 2002, Dávila et al., 2002).
degradación se desnaturalizan y se convierten en no funcionales, provocando que los microorganismos no puedan nutrirse de manera adecuada (Graves, 2000)
El CO2 se produce en volúmenes importantes que difunden desde el centro a la superficie de la pila. Este gas, juega un papel fundamental en el control de larvas de insectos, dado que concentraciones altas de CO2 resultan letales para las larvas (Graves, 2000).
La etapa de maduración o de estabilización, se encuentra marcada por una baja tasa de actividad microbiana, al agotarse los sustratos se produce una caída gradual de la temperatura, la cual es igual a la del medio ambiente, lo que indica el término de la elaboración del compost. (Avendaño, 2003, Arnedo et al., 2002).
Durante esta etapa los productos resultantes de la etapa termofílica del compostaje se estabilizan, lo que involucra una descomposición más avanzada de ácidos orgánicos, una disminución de los compuestos resistentes y la formación de compuestos húmicos. Se debe continuar con un manejo apropiado de la humedad y oxígeno para mantener la actividad microbiana (Graves, 2000).
2.3.2 Factores que condicionan el proceso de compostaje
• Relación Carbono / Nitrógeno (C/N)
La relación C/N, expresa las unidades de Carbono por unidades de Nitrógeno que contiene un material. El Carbono es una fuente de energía para los microorganismos y el Nitrógeno es un elemento necesario para la síntesis proteica. Una relación adecuada entre estos dos nutrientes, favorecerá un buen crecimiento y reproducción.
El compost final debe tener una relación de C:N 15 a 20:1 (EPA, 1995). Mientras la compostación ocurre, la concentración (C/N) decrece gradualmente de 30:1 a 10:1-15:1 para la terminación de los productos del compostaje. Esto se debe a que en cada tiempo en que la materia orgánica es consumida por los microorganismos, dos terceras partes del carbono son desprendidas como dióxido de carbono y la tercera parte restante es incorporada junto con el nitrógeno en las células microbianas lo que refleja la descomposición de la materia orgánica y su estabilización (Trautmann y Olynciw, 1999; Jürgen et al., 1992).
Los residuos de origen vegetal presentan por lo general una relación C/N elevada. Las plantas y montes contienen más nitrógeno cuando son jóvenes y menos en su madurez. A diferencia de los residuos de origen animal que comúnmente presentan una baja relación C/N (Tabla 7).
Tabla 7. Principales características de algunos materiales orgánicos
Material %N C:N Humedad %
Estiércol Vacuno 1.5 – 4.2 11 – 30 67 – 87 Residuos de origen animal
Contenido ruminal 9.6 85.8
Plaza 1.9 – 2.9 14 – 16 69
Residuos Municipales
Cascarilla de arroz 1.9 – 6.2 Cortes de pasto 2.0 – 6.0 9 – 25 -
Hojas 0.5 – 1.3 40 – 80 -
Residuos vegetales
Cortes de poda 1.5 25 - 30 20 – 30
Fuente: (Avendaño, 2003, Ministerio de Minas y Energía, 1990, Falla – Cabrera, 1995)
• Oxígeno
El compostaje es considerado un proceso aeróbico, por lo cual requiere oxigeno. Las condiciones anaerobias con deficiencias de oxígeno pueden producir olores. La descomposición puede ocurrir bajo ambas condiciones aerobia y anaerobia, sin embargo la descomposición aeróbica ocurre mucho más rápido.
oxígeno suficiente y permitir al máximo la evacuación del dióxido de carbono producido. (Avendaño, 2003)
La concentración de oxígeno depende de la textura, humedad del material a compostar, frecuencia de volteo y tasas de utilización, y suministro si se controlan estos factores se favorecerá la proliferación de bacterias, hongos y actinomycetes disminuyendo así la presencia de microorganismos anaerobios (Páez et al., 2000). Entre el 10 y el 15 % en concentración de oxígeno es considerado adecuado, aunque una concentración del 5% puede ser suficiente. Si la concentración de oxigeno es más alta, puede afectar negativamente el proceso de compostaje causando problemas como la remoción del calor y el enfriamiento de la pila, también puede promover el exceso de evaporación, lo cual hace más lento el proceso (EPA, 1995).
La pila de compost debe tener suficientes espacios vacíos para permitir el libre movimiento del aire, el ingreso del oxígeno que viene de la atmósfera y la liberación del dióxido de carbono y otros gases. En algunas operaciones de compost, el aire puede ser inyectado mecánicamente o empujado hacia las pilas para mantener los niveles adecuados de oxígeno. En otras situaciones la pila es volteada frecuentemente para exponer los microorganismos a la atmósfera y también para crear más espacios vacíos en la pila.
La aireación es la forma más rápida y económica de garantizar el flujo de oxigeno, de la misma manera, la forma de la pila es importante para una lograr una buena aireación porque de ella depende el flujo de oxigeno hacia el interior de la masa. El volteo además intenta que todas las zonas de la pila tengan una temperatura uniforme favoreciendo la descomposición y elimina malos olores (Martínez-Almela et al., 2001; EPA, 1995; Dávila et al., 2002)
• Humedad
Debido al carácter aeróbico del proceso de compostaje, exige una relación entre la estructura de los materiales que van a transformarse y la humedad, ya que un exceso de agua puede desplazar el aire necesario para la actividad microbiana, dando paso a una descomposición anaeróbica (EPA, 1995).
humedad y ello se alcanza con la humedad propia de la mezcla o añadiendo agua. En los procesos donde se hacen volteos para reactivar el proceso, se acostumbra rehumedecer y entonces la temperatura se eleva de nuevo. Para aprovechar el agua de descomposición del proceso se propone el compostaje solarizado que consiste en tapar la pila con un plástico que permita aireación y de paso evita el lavado de nutrientes en pilas colocadas a la intemperie (Gómez, 2002).
Porcentajes de humedad superiores a los valores indicados producirían un desplazamiento del aire entre las partículas de la materia orgánica, con lo que el medio se vería anaerobio, favoreciendo los metabolismos fermentativos y las respiraciones anaeróbicas. Si la humedad se sitúa en valores inferiores al 10%, desciende la actividad biológica general y el proceso se vuelve extremadamente lento (Galindo et al., 2005).
El contenido en humedad de los desechos orgánicos crudos es muy variable, tal es el caso de la excretas y estiércoles, donde el contenido en humedad está relacionado con la dieta. Si la humedad inicial de los residuos crudos es superior a un 50%, se debe buscar la forma de que el material pierda humedad, antes de conformar las pilas
El contenido de humedad en el caso de los residuos vegetales (tallos, fibras, cutículas, cáscaras, bagazos, rastrojos, restos de podas, frutas) es relativo dependiendo de varios factores como: características de las especies cultivadas, ciclo del cultivo, tiempo de exposición a los factores climáticos y manejo (Sztern y Pravia, 1999).
• pH
El compostaje puede desarrollarse dentro de un amplio rango de pH (3–11), se consideran óptimos los valores de pH comprendidos entre 5 y 8. Las bacterias prefieren un medio casi neutro, mientras que los hongos se desarrollan mejor en medios ligeramente ácidos (Graves, 2000).