Comparación de la abundancia y diversidad de actinomicetos en sistemas agroforestales con Arazá y Cocona bajo dos condiciones ecosistémicas en el departamento del Guaviare.
María Del Carmen Ramírez Millán
TRABAJO DE GRADO
Presentado como requisito para optar al título de
Microbióloga industrial
CARRERA DE MICROBIOLOGIA INDUSTRIAL DEPARTAMENTO DE MICROBIOLOGIA
FACULTAD DE CIENCIAS BIOLOGICAS PONTIFICIA UNIVERSIDAD JAVERIANA
Comparación de la abundancia y diversidad de actinomicetos en sistemas agroforestales con Arazá y Cocona bajo dos condiciones ecosistémicas en el departamento del Guaviare.
María Del Carmen Ramírez Millán
Firma Decano académico Firma Director de carrera
CARRERA DE MICROBIOLOGIA INDUSTRIAL DEPARTAMENTO DE MICROBIOLOGIA
FACULTAD DE CIENCIAS BIOLOGICAS PONTIFICIA UNIVERSIDAD JAVERIANA
Comparación de la abundancia y diversidad de actinomicetos en sistemas agroforestales con Arazá y Cocona bajo dos condiciones ecosistémicas en el departamento del Guaviare.
María Del Carmen Ramírez Millán
Firma directora trabajo de grado Firma Co-directora trabajo de grado Gladys Cardona Vanegas Marcela Franco Correa
Firma evaluador José Salvador Montaña
CARRERA DE MICROBIOLOGIA INDUSTRIAL DEPARTAMENTO DE MICROBIOLOGIA
FACULTAD DE CIENCIAS BIOLOGICAS PONTIFICIA UNIVERSIDAD JAVERIANA
NOTA DE ADVERTENCIA
Artículo 23 de la Resolución N° 13 de Julio de 1946
RESUMEN
Las prácticas de monocultivo utilizadas en la mayoría de zonas agrícolas ocasionan serios daños en el suelo donde principalmente se disminuye la diversidad de la microbiota; además el uso de fertilizantes químicos no solo contamina el suelo sino también disminuye la actividad metabólica de los microorganismos nativos. En la amazonia la intervención ha ocasionado este tipo de efectos negativos, por eso se ha comenzado a implementar sistemas agroforestales los cuales promueven la siembra de policultivos y la utilización de abonos orgánicos que contribuyen a la recuperación de suelos y su conservación. La microbiota del suelo cumple un papel muy importante en el mantenimiento de la fertilidad y productividad del mismo, los microorganismos son los encargados de la disponibilidad y retención de nutrientes al igual que de los procesos de descomposición de materia orgánica. Conjuntamente, los microorganismos hacen parte de los atributos biológicos del suelo, los cuales son altamente sensibles a los cambios en las condiciones que se presenten, ayudando también a determinar el efecto del manejo de su sostenibilidad; por ello al evaluar una comunidad microbiana como los actinomicetos se puede monitorear el estado de un suelo determinado. El objetivo de este trabajo fue evaluar la ocurrencia de la comunidad de actinomicetos en los suelos bajo sistemas agroforestales con cultivos de Arazá y Cocona establecidos en el departamento del Guaviare bajo dos condiciones ecosistémicas (Vega del río y Tierra firme). Se realizaron recuentos en placa y se encontró que la abundancia de actinomicetos cultivables estaba en el orden de 105UFC/g de suelo, además se recuperaron alrededor de 49 morfologías diferentes, sin embargo no hubo diferencias significativas (p>0.05) en los índices de diversidad obtenidos a partir de estos resultados. La abundancia de las poblaciones de actinomicetos encontrados en Tierra firme, permitió establecer que estos están adaptados a condiciones de acidofilía y tienen la capacidad de tolerar saturaciones de aluminio (S.Al), pues en estos suelos se reportaron pH extremadamente ácidos y S.Al toxicas por encima del 60%. La diversidad en Vega del río fue explicada, debido a que en estas zonas se presentan inundaciones periódicas al año, lo que provoca cambios en el suelo por lo que se dan fluctuaciones en la rizosfera que contribuyen a que se dé una rotación de los nutrientes y al mismo tiempo de microorganismos, además el sistema agroforestal en esta condición ecosistémica tiene mayor número de especies de cultivos diferentes, lo cual contribuye de una manera importante a la diversificación microbiana del suelo.
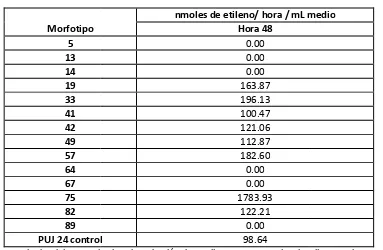
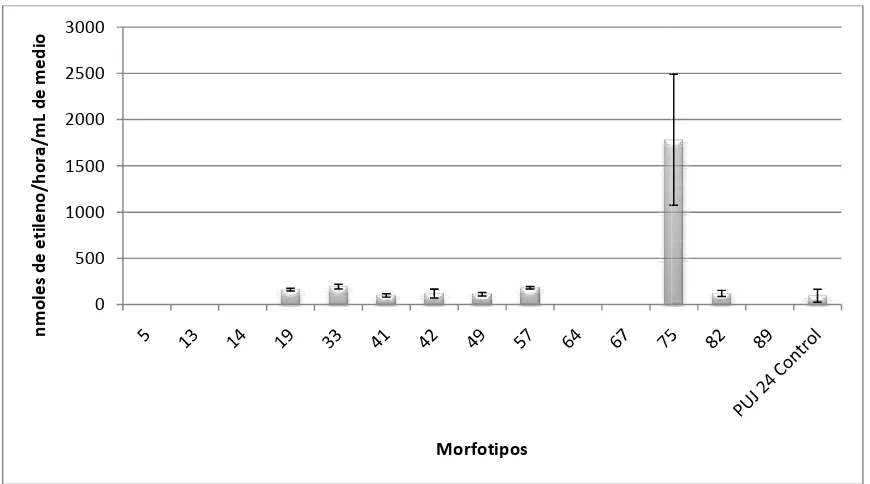
Igualmente se evaluó la actividad metabólica de algunos de los actinomicetos aislados, específicamente la fijación de nitrógeno, para ello se realizo el análisis de reducción de acetileno (ARA) donde 8 de las 14 cepas evaluadas reportaron valores desde 100.47 hasta 1783.93 nmoles de etileno/hora/mL a las 48 horas de exposición. Estos valores son altos comparados con otros estudios realizados y con el control positivo utilizado; lo cual sugiere que es posible la utilización de estos actinomicetos como biofertilizantes.
relativa de cada especie bacteriana encontrada la intensidad de su respectiva banda en el gel, de esta manera se determino la diversidad de bacterias con base en el índice de diversidad de Shannon, índice de equitatividad de Hill, índice de riqueza de Margalef e índice de dominancia de Simpson (Corredor, 2000). Para estos resultados se realizo un prueba de ANOVA donde se encontró que existían diferencias significativas (p<0.05) en cuanto a la diversidad de actinomicetos presentes en cada una de las condiciones ecosistémicas evaluadas. Además se pudo determinar que las muestras más diversas eran las asociadas a los suelos de Cocona en Vega del río, lo que concuerda de cierta manera con los resultados obtenidos en la fase cultivo dependiente.
En general la comunidad de actinomicetos dentro de los suelos evaluados reporta valores altos de diversidad tanto de la fracción cultivable de la comunidad como la no cultivable teniendo en cuenta los resultados de cultivo en placa y los del análisis de DGGE respectivamente, por lo cual es posible decir que los sistemas agroforestales mantienen la abundancia y diversidad de las poblaciones microbianas entre las cuales están los actinomicetos, independientemente del tipo de asociación (Arazá o Cocona) y del tipo de condición ecosistémica, por lo que son sistemas aptos para regiones tan frágiles como la amazonia donde su vocación es más forestal que agrícola, pero que necesita de cultivos adaptados a la región para que suplan las necesidades de autoconsumo de los pobladores locales.
Además se comprobó que una pequeña parte de la población de actinomicetos ya adaptados a las condiciones de estos suelos, se encuentra metabólicamente activa lo cual también es positivo debido a que esto brinda la opción de emplear estos actinomicetos nativos como biofertilizantes y/o promotores de crecimiento vegetal en los mismo cultivos de Arazá y Cocona, ayudando a cumplir la meta de impulsar estos como productos agrícolas de la región.
INTRODUCCIÓN Y MARCO TEORICO
El Amazonas es la región más rica en flora y fauna en el mundo, 6.8% de esta se encuentra en nuestro país con un área de 477.274 km2, conformada geopolíticamente por 10 departamentos. La temperatura promedio de la región es de 25.3˚C, sus lluvias son de tipo unimodal y la precipitación media multianual es de 3.307 mm. Se caracteriza por tener suelos con una delgada capa orgánica compuesta por hojarasca y otros residuos vegetales en estado de descomposición que vienen siendo la principal fuente de nutrición para las plantas y la microbiota del suelo, se considera que químicamente es un suelo muy pobre y a la vez físicamente sensible al deterioro, además, se sabe que es un suelo con fertilidad natural baja, alta susceptibilidad a la erosión y con altas concentraciones de aluminio y hierro, que son tóxicos para el uso del suelo con fines agrícolas (SINCHI) (Murcia & Uriel, 2003).
Es una de las regiones que posee la mayor biodiversidad del mundo, en Colombia resguarda más de 600 especies de aves y más de 150 de anfibios, además se reportan más de 6000 especies de plantas, sin embargo muchas de estas especies animales y vegetales se encuentran bajo amenaza y necesitan de planes de conservación para no perderlas, el desconocimiento de esto, es el principal problema por el cual no se explotan todos los beneficios de una región tan rica en diversidad como lo es el Amazonas (SINCHI).
frutales, los más importantes de la región son el arazá, la carambola, la piña nativa, la cocona, canangucha y copoazu entre otros.
El Arazá (Eugenia stipitata Mc vaugh), es cultivada en Colombia, Brasil, Perú, Ecuador, Costa Rica y Bolivia, la planta es de tipo arbuscular y la generación del fruto se demora aproximadamente dos años, el contenido nutricional del fruto se resume en una concentración medianamente alta de proteínas, un aporte significativo de fibra cruda a la dieta básica y una cantidad moderada de ácido ascórbico entre otras vitaminas; lo cual lo hace una buena fuente de alimento para los habitantes de la región; generalmente es comercializado como fruto fresco y producto procesado, pero además tiene varios usos agroindustriales como la elaboración de pulpas, néctares y bocadillos, mermeladas, conservas y deshidratados, que le dan un alto valor agregado como producto agrícola de la región (Hernández et al. 2004).
La Cocona (Solanum sessiliflorum Dunal), es original principalmente del Perú, pero también es común en Colombia y en el Ecuador, es una planta capaz de crecer en suelos ácidos y de baja fertilidad por lo cual se desarrolla sin problema en los suelos del Amazonas, es de crecimiento rápido donde el fruto se genera aproximadamente a los seis meses; este es nutricionalmente una buena fuente de energía debido a que posee una alta concentración de carbohidratos, además de aportar grasa y minerales como calcio y hierro, también posee vitamina C y pectinas. Aparte del uso alimentario de este fruto en forma de néctares y mermeladas, también posee usos a nivel medicinal como antidiabético, antiofídico y escarbicida para la hipertensión y en tratamientos para quemaduras, por todo esto, es también un producto agrícola con alto interés para la región (Hernández et al. 2004).
La agricultura es una de las actividades industriales más importantes en Colombia, ya que genera la mayoría de ingresos de las zonas rurales del país; en el departamento del Amazonas es difícil hablar de agricultura como tal, sin embargo, se encuentran siembras de diferentes productos agrícolas, que vienen siendo unos de los principales ingresos de la región, es por ello que al pasar de los años se ha incrementado el uso agrario de los suelos del Amazonas.
El sistema de producción agrícola que se ha llevado a cabo a través de la historia en el Amazonas consiste en la tumba y quema del bosque, seguida de la siembra de monocultivos de yuca, maíz o plátano, para posterior a la cosecha repetir el proceso y sembrar cultivos transitorios para luego establecer el monocultivo de pasto (Pérez et al., 2005); esto ha ocasionado daños en el suelo afectando no solo sus características fisicoquímicas sino también la microbiota habitante en esté. Por esta razón, se ha buscado implementar nuevas formas de agricultura que buscan recuperar y conservar la sostenibilidad del suelo, dentro de los cuales están los sistemas agroforestales (SA) (Murcia & Uriel, 2003).
Los SA hacen parte de los sistemas productivos sostenibles, consisten en coberturas con siembra en policultivo con varias especies (maderables, frutales y pancoger) y en el uso de abonos de tipo orgánico exclusivamente, el conjunto de todo esto permite la utilización de recursos naturales para la obtención de productos y beneficios agrícolas, forestales, sociales, ambientales y animales (Benavides y Ávila, 2006; Peña y Arias, 2001). Entre los cuales la purificación del agua, aire y la generación y preservación de los suelos son claves para el mantenimiento de la diversidad de macro y microorganismos.
La microbiota del suelo cumple un papel muy importante en el mantenimiento de la fertilidad y productividad del mismo, los microorganismos son los encargados de la disponibilidad y retención de nutrientes al igual que de los procesos de descomposición. Además están altamente relacionados con los ciclos biogeoquímicos, como las transformaciones del carbono, nitrógeno y fósforo, también son importantes por las interacciones microbianas que se pueden dar, ya que así pueden favorecer el crecimiento de las plantas, ayudar a contrarrestar enfermedades de los cultivos o ejercer un papel antagónico contra una plaga. Por lo cual la microbiota y sus interacciones tienen un efecto indirecto sobre la productividad de un agroecosistema. Es por ello que al estudiar las alteraciones que se puedan dar sobre la diversidad y funcionalidad de una comunidad microbiana se puede llegar a establecer la calidad del suelo y el estado del desarrollo de agroecosistemas sostenibles (Thomas & Kevan, 1993; citado en Kennedy, 1999; Stark et al., 2007)
Previos estudios acerca de la microbiota del suelo del Amazonas en Colombia han sido realizados. Cardona et al. 2009, evaluaron la comunidad de actinomicetos bajo tres coberturas vegetales, bosque, pastizal y rastrojo, en ese estudio se encontró que se presentan diferencias en los patrones de abundancia, diversidad morfológica y genética de las poblaciones de actinomicetos, como respuesta a cambios de la cobertura vegetal. Se observó además que la abundancia de actinomicetos se relacionó directamente con características fisicoquímicas asociadas a fertilidad; condiciones presentes en los bosques evaluados donde se reportaron los valores más altos de abundancia de actinomicetos.
Por otro lado en el estudio de Mantilla et al. 2009, donde también se estudiaron tres coberturas vegetales del Amazonas colombiano (Bosque, pastizal y chagras); se encontró que la mayor abundancia de bacterias diazótrofas aerobias y microaerofilas reportadas en la cobertura de pastizal, estaba relacionada con bajos niveles de aluminio, una relación estrecha con especies de gramíneas, homogeneidad de la cobertura y por tanto una mayor disponibilidad de sustrato alimenticio. Por otro lado observaron que las bacterias con potencial para fijar nitrógeno eran más abundantes en los suelos donde este elemento era escaso.
En este sentido, los actinomicetos pueden ser potenciales promotores de crecimiento vegetal, ya que proveen sustancias que las plantas necesitan para su desarrollo como auxinas de tipo indólico como el ácido indol acético (AIA) que ayuda al crecimiento longitudinal de la raíz de las plantas y también se ha reportado que ayuda a la proliferación y elongación de pelos radiculares; además pueden transformar el nitrógeno atmosférico a una forma biológicamente disponible para las plantas como es el amonio por medio de la enzima nitrogenasa (Weyens, et al., 2009).
Este es uno de los vacíos de investigación encontrados; pues poco se ha estudiado acerca de las actividades metabólicas de los actinomicetos nativos del amazonas como la fijación de nitrógeno; este análisis se pretende abarcar en este trabajo ya que contribuye a establecer posibles promotores de crecimiento vegetal para usar en estos mismos cultivos, además de ahondar en el conocimiento de la diversidad funcional microbiana de los suelos en estudio. Al evaluar estas características metabólicas también se tendrá una idea del efecto de los sistemas agroforestales sobre el estado funcional de los actinomicetos y a la vez se podría establecer si en un futuro estos se podrían usar como biofertilizantes para potencializar el desarrollo de los frutos Arazá y Cocona.
El ensayo de reducción de acetileno (ARA), es una técnica ampliamente empleada y conocida que sirve para determinar entre otros, la fijación de nitrógeno por parte de un microorganismo, basado específicamente en la reducción del acetileno al etileno por medio de la enzima nitrogenasa (Posgate, 1971), al utilizar esta prueba se podrá determinar si los actinomicetos en estudio poseen la capacidad de fijar nitrógeno, lo cual los haría candidatos a ser usados como promotores de crecimiento vegetal. Mohapatra et al. 2004 usaron también ARA (Análisis de la reducción de acetileno) para evidenciar la presencia de la enzima nitrogenasa en Frankia sp.
Ahora bien, para establecer la diversidad de un grupo microbiano uno de los métodos utilizados es el recuento en placa, sin embargo esta técnica posee limitaciones ya que solo permite evaluar la población cultivable del suelo, que como se conoce, representa solo del 0.1 al 10% de la microbiota total (Head et al., 1998 citado en Cardona, 2004). Es por ello que los análisis moleculares en conjunto con los recuentos en placa permiten resultados más robustos y cercanos a la realidad para determinar la diversidad total de un grupo microbiano en muestras ambientales ya que incluyen la población cultivable y no cultivable. La electroforesis en gel con gradiente denaturante (DGGE) (Muyzer, 1999) es una de las técnicas moleculares más utilizadas para evaluar diversidad de grupos microbianos que por medio de un gradiente de agentes denaturantes como formamida y urea, permite separar en un gel de poliacrilamida las diferentes bandas de DNA que representan los miembros de un grupo en estudio (Kirk et al., 2004); y así poder establecer la diversidad de bacterias incluyendo aquellas no cultivables en un ambiente determinado.
El objetivo de este trabajo fue evaluar la ocurrencia de la comunidad de actinomicetos bajo sistemas agroforestales con Arazá y Cocona en suelos bajo dos condiciones ecosistémicas en el departamento de Guaviare.
JUSTIFACIÓN Y PLANTEAMIENTO DEL PROBLEMA
Existen dos condiciones ecosistémicas que se dan en el Amazonas, una de forma fluvial en vega del río y otra con forma de planicie amazónica disectada en tierra firme, la primera se caracteriza por suelos de pH ácido, alta saturación de aluminio y con texturas finas francas a arcillosas. Los suelos de Tierra firme se caracterizan por ser de baja fertilidad y por contenidos altos de aluminio de cambio (Murcia, 2003). En general los suelos de la Amazonia colombiana tienden a ser ácidos debido a la pérdida de bases, aumento en la producción de arcilla, formación de arcillas caoliníticas y óxidos amorfos de Fe, Al y Mn (Galeano, 1991).
Debido a que las características fisicoquímicas de estos suelos no permiten el establecimiento de procesos agrícolas a gran escala en la región, es que se han desarrollado sistemas agroforestales que permiten una mayor diversidad de especies. Estos SA que se basan en la implementación de agricultura orgánica; han sido establecidos en el departamento del Guaviare con el fin de recuperar los suelos y ayudar a su sostenibilidad. Específicamente, SA asociados a ecotipos de Arazá y Cocona, frutos nativos de la Amazonía, se han implementado bajo las condiciones ecosistémicas de Vega del río y Tierra firme (Murcia & Uriel, 2003).
Ahora bien, para poder establecer la calidad y fertilidad de los suelos donde se encuentran los sistemas agroforestales, se pretende evaluar la población microbiana nativa que sirva para monitorear cambios en la sostenibilidad de los suelos como respuesta a intervenciones de tipo agrícola. Lo anterior, debido a que los microorganismos mantienen los ciclos biogeoquímicos del suelo y además son los responsables de la transformación de la materia orgánica, factores que determinan la fertilidad de un suelo (Peña et al., 2006). Es por ello que al establecer la calidad y fertilidad de este, se podrá comprobar si los sistemas agroforestales están cumpliendo su objetivo de ayudar a recuperar los suelos, mejorando así la productividad de los cultivos de Arazá y Cocona, para impulsar y mejorar estos como productos agrícolas de la región.
Por lo mencionado anteriormente, se estudiará por un lado la diversidad de los actinomicetos cultivables y no cultivables, ya que su presencia en el suelo promueve de cierta manera al desarrollo vegetal debido a la serie de características que poseen algunos como fijación de nitrógeno, producción de auxinas y demás (Valdéz, 2005; Franco-Correa, 2008; Mazo, 2009). Por medio de este análisis se busca entonces, determinar la ocurrencia de la comunidad cultivable y no cultivable de actinomicetos bajo el establecimiento de arreglos agroforestales con Arazá y Cocona; correlacionándolo con los resultados de algunas características fisicoquímicas del suelo.
De otra parte, se estudiará una de las actividades metabólicas de importancia agrícola que pueden tener algunos actinomicetos; la fijación de nitrógeno, actividad que genera una influencia positiva sobre las plantas, ya que facilitan la conversión del nitrógeno gaseoso en una forma biológicamente disponible, como lo es el amonio. De acuerdo a lo anterior este análisis permitirá establecer la posibilidad de usar los actinomicetos, como futuros promotores de crecimiento vegetal y/o biofertilizantes para impulsar los cultivos de Arazá y Cocona; aumentando al mismo tiempo su uso como productos industriales de la región.
OBJETIVOS OBJETIVO GENERAL
Evaluar la ocurrencia de la comunidad de actinomicetos bajo suelos de sistemas agroforestales con Arazá y Cocona en dos condiciones ecosistémicas en el departamento de Guaviare.
OBJETIVOS ESPECIFICOS
• Evaluar la estructura de actinomicetos cultivables y no cultivables, asociados a las rizosferas de Arazá y Cocona en suelos de tierra firme y vega del río y su relación con algunos parámetros fisicoquímicos del suelo.
• Seleccionar 10 aislamientos de actinomicetos y evaluar la capacidad de fijación de nitrógeno
METODOLOGIA
Muestreo: El área de estudio está ubicada en el departamento del Guaviare y corresponde a la zona de transición entre las sabanas naturales de la altillanura orinocense y el bosque húmedo tropical de la llanura amazónica, con altitudes entre 200 y 300 msnm. Se seleccionaron parcelas establecidas con tres ecotipos de Arazá y tres de Cocona en la Vega de río y en Tierra firme; tomando muestras de suelo rizosférico por triplicado para cada morfotipo, para un total de 36 muestras (Ver tabla anexo 1).
Estudio de la comunidad cultivable de actinomicetos por técnicas cultivo dependientes:
• Recuento en placa: Para evaluar la abundancia de actinomicetos cultivables, se realizaron recuentos en placa en medio Agar Almidón Sales Inorgánicas (AASI) (Shirling & Gottlieb, 1966). Cada una de las muestras de suelo rizosférico (Arazá o Cocona de Vega del río o tierra firme), fueron tratadas según la metodología planteada por Goodfellow et al., 1983 y modificada por Cardona 2004. Se hicieron diluciones y siembra en superficie del agar AASI (Shirling & Gottlieb, 1966) de la dilución 10-3, la cual se estableció por estandarización, ya que contenía el mayor número de morfotipos diferentes que fueran contables. Este procedimiento se realizó igual para cada una de las 9 muestras (MF 1 R. 1, 2 y 3; MF 2 R. 1, 2 y 3; MF 3 R. 1, 2 y 3), obteniendo 18 cajas que fueron incubadas a 30˚C (Cardona, 2004) de 8 a 10 días. Pasado este tiempo se realizó el conteo de las diferentes morfologías de actinomicetos que se encontraron en unidades formadoras de colonia por gramo (UFC/g), y se tuvo en cuenta su frecuencia de aparición. Las morfologías recuperadas se conservaron bajo condiciones de ultracongelación (-70°C) en caldo BHI más glicerol al 30%.
espirales y bucles, formación de esporangios, presencia de esporas terminales, en pares o grupos en el micelio).
• Estudio de la actividad nitrogenasa: Se siguió la metodología reportada por Mantilla (2009), que consiste brevemente en el barrido y ajuste de esporas del actinomiceto a una concentración de 105 esporas/ml utilizando solución salina 0.85% + Tween 80 (0.2% v/v), a partir de esta solución se sembró el medio de cultivo semisólido NFB; donde se hizo el análisis de la reducción de acetileno (ARA). Se llevó a incubar a 30˚C durante 8 días. Posteriormente se extrajeron 25µL de la fase gaseosa para reemplazarlos con una inyección de 25µL de acetileno, se evaluaron los tiempos 0, 5, 24 y 48 horas de incubación, retirando para cada uno 100µL de muestra que se inyectó al cromatógrafo de gases marca Hewlett Packard Agilent 4890D con detector de ionización en llama TID y detector de conductividad térmica TCD, gas de arrastre helio y software de lectura Clarity lite (Mantilla, 2009). Igualmente se realizó un control con un actinomiceto suministrado por el laboratorio UNIDIA de la Pontificia Universidad reportada anteriormente como fijadora de N (Franco-Correa, 2008; Mazo, 2009).
Estudio de la comunidad cultivable y no cultivable de bacterias por DGGE:
• Extracción de ADN comunitario: Se escogieron 6 muestras de cada uno de los sitios de muestreo (Cocona y Arazá Tierra Firme y Cocona y Arazá Vega del río) según los resultados de cultivo dependiente; se eligieron las 2 replicas que reportaron el valor más alto y más bajo de abundancia de actinomicetos dentro de cada morfotipo de Arazá o Cocona; obteniendo así un total de 24 muestras. Para la extracción de ADN total del suelo se utilizó el kit “Power Soil DNA Isolation Kit” de MO BIO Laboratorys, siguiendo las instrucciones del fabricante. Se tomaron 0.5 mg de suelo y se resuspendió el producto final en 50 ul de ADN de buffer TE.
• Amplificación de fragmentos del gen ADNr16S utilizando primers para eubacteria: Para el análisis de los patrones de bandas de las comunidades de bacterias totales presentes en el suelo, se llevo a cabo la amplificación de los fragmentos 16S rDNA, se utilizaron los primers reportados por (Muyzer, 1999) como universales para el dominio filogenético
“bacteria”; el GM5F-GC, (5’ –
CGCCCGCCGCGCCCCGCGCCCGTCCCGCCCCCCGCCCGCCTACGGGAG GCAGCAG-3’) y el 907r
(5’ –CCGTCAATTCCTTTRAGTTT-3’), la PCR se realizó con un volumen final de 50μL que contenía lo siguiente: 1X de buffer PCR, 2.5 mM de MgCl2, 0.3 µg/µl de BSA, 0.2 µM de dNTPs, 0.2 µM de los primers GM5F-GC/907R y 0.03 U de Taq Polimerasa (Invitrogen ®). El protocolo de PCR comenzó con: Denaturación inicial a 94ºC x 5 min; 80ºC x 1 min; 65ºC x 1 min y 72ºC x 3 min seguido por 9 ciclos a 94ºC x 1 min; 64ºC x 1 min; Touch down de 1ºC por cada ciclo y 72ºC x 3min, 15 ciclos de 94ºC x 1 min; 55ºC x 1 min y 72ºC x 3min y un paso de extensión final a 72ºC x 10min. Los productos de PCR fueron electroforéticamente separados y visualizados en un gel de agarosa al 1% en buffer TBE 1X y teñido con bromuro de etidio 0.5 g/mL. El ADN se cuantificó por fluorometría en un fluorómetro Hoefer DyNA 200 a una longitud de onda de 260 nm.
denaturante de 30-70%, donde la solución denaturante del 100% contenía urea 7M y 40% de formamida des ionizada. La electroforesis se corrió utilizando Buffer TAE 1X (20 mM Tris, 10 mM acetato, 0.5 mM Na2EDTA; pH 8.1) las condiciones de corrida fueron 60°C, 200 V por 10 minutos y 16 horas a 80 V; 43 mA y 3.5 W. Se cargó aproximadamente la misma concentración de ADN de todas las muestras (300-370ng/ L). El DGGE se llevó a cabo en el equipo DCode Universal Mutation Detection System (Biorad,USA).El gel fue teñido y luego se visualizo el patrón de bandas obtenido en un transiluminador UVP realizando una tinción con SYBR GOLD por 40 minutos.
Análisis de datos
• Diversidad de la comunidad cultivable de actinomicetos: Segúnla metodología usada por Cardona 2004, se determinó la abundancia de actinomicetos en cada muestra de suelo mediante la fórmula de UFC/g X factor de dilución 104 (103x101(Factor corrección)). Obteniendo la abundancia relativa de cada morfotipo en cada una de las placas de cultivo, con la cual se determinó la diversidad fenotípica de los actinomicetos cultivables teniendo en cuenta los índices de diversidad de Shannon, índice de equitatividad de Hill, índice de riqueza de Margalef e índice de dominancia de Simpson, además se realizo un ANOVA para ver si existían diferencias estadísticamente significativas entre los resultados obtenidos de estos índices de las diferentes muestras.
• Diversidad de bacterias no cultivables: Los geles del DGGE fueron leídos en el programa ECapt donde para el análisis de la diversidad genética, se interpretaron los patrones generados como un conjunto de caracteres binarios, en donde la presencia de la banda (1) es uno de los estados del carácter y la ausencia (0) el otro. Con base en los resultados se construyeron matrices binarias con las que se analizaron patrones de organización entre las réplicas de los tratamientos, calculando el índice de similaridad de DICE (D) (Zuart, 1998) equivalente al de Nei-Li (Nei et al, 1979) y agrupando bajo la estrategia de fusión de UPGMA (Unweighted Pair Group method using Arithmetic) usando la herramienta XLSTAT - Agglomerative hierarchical clustering (AHC) en Excel. De igual manera, por medio de la intensidad de las bandas se estimó la abundancia de cada una de las poblaciones para así determinar los índices de diversidad de Shannon, Simpson, Riqueza de Margalef y Equitatividad de Hill. Se realizó un ANOVA para ver la relación en las muestras evaluadas. Estos dos últimos análisis fueron realizados en el programa estadístico PAST versión 1.18 (Copyright Hammer and Harper 2003).
• Caracterización fisicoquímica del suelo: Este análisis fue realizado por el laboratorio de suelos del Instituto Geográfico Agustín Codazzi (IGAC). Se realizó el análisis químico Q-01. Los parámetros evaluados fueron: Textura, CIC, calcio, magnesio, potasio, fósforo, aluminio de cambio, saturación de bases, carbón orgánico y pH. A partir de los resultados obtenidos se realizo un análisis de componentes principales (Anexo 7b) con el programa estadístico PAST, para determinar cuáles de las variables diferenciaban los suelos analizados.
RESULTADOS
actinomicetos en los diferentes sitios de muestreo presentaron resultados en el orden de 105 UFC/g en las muestras de suelo rizosférico, lo cual concuerda con lo planteado por Goodfellow & Williams (1983) quienes exponen que en normalmente en un suelo se pueden obtener recuentos de actinomicetos en el orden de 105 a 106UFC/g de suelo. Los datos no se distribuyeron normalmente por lo que se les hizo el test de Levene donde se encontró que no había diferencia entre la homogeneidad de las varianzas (p>0.05); por ello se procedió a tratar los datos de manera normal realizando un análisis de varianza donde no se encontraron diferencias significativas (p>0.05) entre las abundancias según los cultivos (Arazá y Cocona) y según las condiciones (Tierra firme y Vega del río). Aunque no se encontraron diferencias significativas, si se observó una mayor abundancia de actinomicetos en suelos asociados a Arazá Vega del río, Cocona Tierra Firme y Arazá Tierra Firme. Según el análisis de comparación de honestidad de Tukey (Ver resultados de análisis estadístico en anexo 7), respecto a los resultados de abundancia, todas las muestras pertenecen a grupos homogéneos. La muestra con menor abundancia fue la de Cocona Vega del río, sin embargo esta también estuvo dentro de los mismos grupos en el análisis de Tukey.
[image:14.595.83.515.320.492.2]Fig. 1. Abundancia de actinomicetos (± Desviación estándar) en suelos de Tierra firme y Vega del río con cultivos de Arazá y Cocona.
Tabla 1: Abundancia de actinomicetos (± Desviación estándar) bajo la condición ecosistémica de Tierra firme y Vega del río con Arazá y Cocona
Morfologías encontradas en los sitios de muestreo evaluados: Se recuperaron un total de 49 morfologías diferentes repartidas entre los 4 sitios de muestreo (Algunas se presentan en el anexo 6) La mayor cantidad de morfologías fue observada en las muestras de suelo rizosférico asociado a Arazá Tierra Firme, Cocona y Arazá Vega del río, lo cual no representó una diferencia significativa (p<0.05) entre estas, sin embargo Cocona Tierra Firme fue el sitio con menos morfologías diferentes.
0.0 0.5 1.0 1.5 2.0 2.5 3.0 3.5 4.0 4.5 5.0
Arazá Vega del río Cocona Tierra Firme Cocona Vega del río Arazá Tierra Firme
UFC/g (x10^5)
Si
ti
o
d
e
m
u
e
st
ro
Muestra Abundancia x 10^5(UFC/g) ± Desviación estándar
Arazá Tierra Firme 3.08 ± 0.30
Cocona Tierra Firme 3.75 ±0.73
Arazá Vega del río 3.97 ± 0.73
[image:14.595.77.517.540.625.2]Caracterización fisicoquímica del suelo: En el anexo 4 se encuentran los resultados del análisis Q-01 realizado al suelo por el IGAC; en esta tabla se señalan los parámetros redundantes y que permiten una discusión sobre la relación con los microorganismos encontrados.
Se realizó un análisis de componentes principales para determinar cuáles parámetros eran los que más influían en la variabilidad de los resultados entre las muestras, se encontró que los dos primeros ejes explicaban la variabilidad del 99.083%, las variables que más contribuyeron a estos dos ejes fueron: el aluminio, la S. Al, el carbono y nitrógeno orgánico, el potasio, el magnesio, la CIC, la arena, la arcilla y las Bases totales; lo que quiere decir que estas son las propiedades que más diferencian a los suelos evaluados (Ver anexo 7).
Identificación y selección de morfotipos de actinomicetos: Según las características macroscópicas, se seleccionaron las 10 morfologías con mayor índice de aparición en los medios de cultivo de todas las muestras de suelo y 4 morfologías por crecimiento en medio NFB, todas fueron también descritas microscópicamente. Las 14 morfologías presentaron diferencias en cuanto a la forma del micelio, tamaño de colonia y texturas, la descripción completa se encuentra en el anexo 5. Según sus características macro y microscópicas y según lo reportado por Goodfellow et al. (1983), se relacionaron las diferentes morfologías con géneros específicos. El 71.42% de estas fueron asociadas al género Streptomyces sp. Y el 28.58% a otros géneros posiblemente pertenecientes a la familia de Nocardioformes. En el anexo 6 se encuentran las diferentes morfologías.
Diversidad fenotípica de actinomicetos en los cuatro de sitios de muestreo: Según Odum & sarmiento (1998), la diversidad biológica se puede distinguir en dos componentes, la riqueza o variedad que se puede definir como la cantidad de tipos y la abundancia o distribución de los individuos entre los tipos. Por esto se podría inferir que las diferentes morfologías encontradas de actinomicetos pueden ser una medida de la riqueza biológica cultivable de este grupo microbiano. De esta manera, se usaron los datos de riqueza y abundancia obtenidos para determinar índices de diversidad como: Índice de Shannon, Dominancia de Simpson, Equitatividad de Hill y Riqueza de Margalef. Medidas que involucran el estudio de la distribución de las abundancias con el fin de establecer la diversidad biológica de una muestra en un sitio específico (Cardona, 2004).
Los resultados obtenidos de los diferentes índices ecológicos se encuentran representados en el anexo 9. Aunque el numero de morfologías encontrado en las muestras de Arazá y Cocona Vega del río y Arazá tierra firme fue el mismo; el mayor valor para el índice de Shannon se obtuvo en la muestra de Arazá tierra firme, la cual también obtuvo el valor de equitatividad más alto, por lo que se podría decir que esta es la muestra con mayor diversidad de actinomicetos cultivables.
Sin embargo según el análisis de varianza (ANOVA) realizado para todos los índices ecológicos se encontró que no existen diferencias significativas (p>0.05) respecto a los cuatro grupos de muestras evaluadas, además el análisis de comparaciones múltiples de Tukey HSD con α=0.05 mostró que todos los grupos evaluados son homogéneos. (Ver anexo 7)
Además de esto, también se evaluaron los tiempos de incubación: 5 minutos, 5 horas y 24 horas, obteniendo resultados positivos a la hora 5, donde solo 3 cepas reportaron etileno en valores entre 1146.15 y 2497.29 nmoles de etileno/hora/mL de medio (Datos no mostrados).
Extracción de ADN de las muestras de suelo: Se logró extraer el ADN comunitario a partir de suelos de 23 de las 24 muestras seleccionadas, el cual fue resuspendido en Buffer TE 1x y conservado a -20°C para posteriores determinaciones.
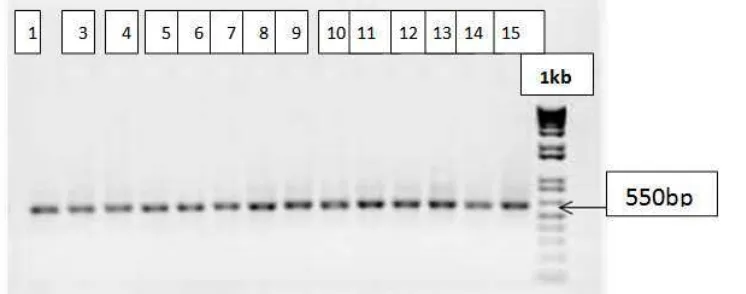
[image:16.595.91.464.270.417.2]PCR para la amplificación de fragmentos de ADNr 16S utilizando primers universales para eubacteria: Se lograron amplificar las 23 muestras obteniendo bandas definidas de aproximadamente 550pb en gel de agarosa al 1% (Ver figura 2), las concentración de ADN variaron desde 5 a 31 ng/ L.
Figura 2: Productos de PCR de algunas de las muestras donde se observa el fragmento de aproximadamente 550 pares de bases obtenido. Electroforesis en gel de agarosa al 1% corrido a 70V por 45 minutos.
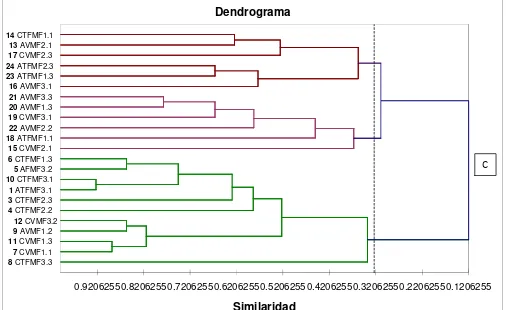
Análisis DGGE: En los DGGE a partir de los fragmentos de ADNr16S de eubacteria se distinguieron 32 bandas de diferentes tamaños (180-548pb según el marcador de peso molecular MassRuler 1kb marca Fermentas). Según el dendograma de similaridad genética obtenido (Ver anexo 8), se observa de forma general que las muestras se agruparon en tres clusters principales donde la similaridad entre las muestras fue baja, pues los puntos de corte de unión entre estos tres clusters estuvieron entre 0.12 y 0.3. Según los clusters internos, no se observó una similitud genética marcada entre los tipos de cultivo (Arazá y Cocona) o entre las condiciones ecosistémicas (Tierra firme y Vega del río).
Los resultados de los índices de diversidad mostraron que las muestras asociadas a suelos de Vega del río, en especial con cultivos de Cocona, se caracterizaron por ser las más diversas. Se realizó un ANOVA para ver la relación de estos, entre las diferentes muestras y se encontró que no hay diferencias significativas (p<0.05) para los índices de diversidad de Shannon, Simpson y Margalef, según los cultivos Arazá y Cocona mientras que entre las condiciones Tierra Firme y Vega del río si se encontraron diferencias significativas (p>0.05).
DISCUSION
mayor cantidad de materia orgánica tanto carbono como nitrógeno y mayor CIC lo que favorece el crecimiento de microorganismos (Sylvia et al., 1999). La CIC debe ser alta para tener una buena fertilidad del suelo, pues de esta manera se logran retener los cationes (nutrientes y/o microorganismos) procedentes de la meteorización y fertilización y así mismo se evita su perdida por lixiviación (Sylvia et al., 1999; Sociedad colombiana de la ciencia del suelo, 1990), la CIC está dada por las bases cambiables (Ca, Mg, K, Na y otras) y la acidez intercambiable por el aluminio (Al), de esta manera la CIC o más directamente el Al siempre va a influir en el pH por el aumento que se puede dar en la acidez bajo una mayor acumulación (Gogo & Pearce, 2009); en los suelos de Tierra Firme se encontró que las concentraciones de aluminio eran muy altas con saturaciones de Al (S.Al) por encima del 60% lo cual según las consideraciones generales para interpretar análisis de suelos (IGAC, 1986) son valores en los que el Al ya es considerado tóxico para la mayoría de los cultivos y/o microbiota; el pH de estos suelos es extremadamente acido (pH<4.5), lo cual también se relaciona con la baja saturación de bases cambiables. Estos resultados sugieren que los actinomicetos encontrados en esta zona, muy probablemente son organismos acidófilos y con capacidad para soportar altas concentraciones de aluminio. Esto ya había sido observado por Cardona (2004), quien estimó la abundancia de actinomicetos en suelos extremadamente ácidos y con altas concentraciones de aluminio también en la región del Amazonas; por lo que infirió que estos actinomicetos podrían hacer parte de poblaciones acidodúricas y acidofílicas con actividad incluso a pH<4.
Respecto a los suelos de Vega del río, que al contrario de los de Tierra firme presentaron una baja concentración de materia orgánica, baja CIC, un pH dentro del rango óptimo para el crecimiento de los actinomicetos, que va de 5.0 a 9.0 (Goodfellow et al., 1983), donde la baja concentración de aluminio explica no solo un pH más alto sino también la mayor disponibilidad de fósforo, pues este elemento tiende a fijarse en los hidróxidos de Al (Useche, 2003). Estos resultados en conjunto explican la abundancia de los actinomicetos bajo esta condición ecosistémica, pues aunque no hayan altas concentraciones de materia orgánica, si hay mayor presencia de otros nutrientes como el fósforo, además el pH dentro del rango optimo es muy importante, pues este parámetro es uno de los que más influye en el desarrollo de los microorganismos (Sylvia et al., 1999). La baja CIC es común encontrarla en este tipo de suelos, debido a que las inundaciones que se presentan, dificultan la capacidad del suelo para retener los cationes. La hojarasca sirve como reservorio de materia orgánica y sustrato para la actividad de la macrofauna, mesofauna y microflora nativa de estos suelos (Landecker ,1996) y su descomposición permanente y continua favorece el movimiento de nutrientes y por lo tanto la proliferación microbiana. Es probable entonces, que la mayor capa de hojarasca presente en los SA ubicados en Vega del río según los formatos de campo (Datos no mostrados), haya contribuido a la proliferación de la comunidad de actinomicetos en estos suelos. Sin embargo, no hay una fuerte evidencia que apoye está teoría.
diversifiquen los microorganismos, debido a que pueden estar contribuyendo con un mayor número de sustratos a descomponer, lo que favorecería la actividad y diversificación en términos de riqueza de géneros de actinomicetos altamente competitivos.
Básicamente esta es la idea principal de los sistemas agroforestales, recuperar la diversidad biológica de los suelos por medio de la implantación de varios tipos de cultivos (Peña y Arias, 2001). En todos los sitios de muestreo predomina el sistema agroforestal, sin embargo en Cocona de Vega del río es el sitio donde más cultivos asociados se observaron.
Según el ANOVA para todos los índices ecológicos, no existen diferencias significativas respecto a las muestras y además son grupos homogéneos según el análisis de comparación múltiple de Tukey HSD (α=0.05). Lo que indica que independientemente del SA con Arazá o Cocona y de la condición ecosistémica, se mantienen las poblaciones microbianas abundantes y diversificadas, gracias a la riqueza de especies, bajo número de individuos, acumulación de hojarasca y utilización de productos orgánicos exclusivamente para aumentar la productividad.
En cuanto a las actividades metabólicas evaluadas, los resultados de ARA mostraron que algunas de las cepas pueden llegar a tener el potencial para fijar nitrógeno, debido a la presencia de la enzima nitrogenasa que tiene la capacidad de romper otros compuestos de triple enlace a parte del N atmosférico, por lo que el microorganismo que la posea puede reducir el acetileno a etileno, siendo esta una manera indirecta para medir la fijación de nitrógeno (Park et al., 2005). Se observó que 8 de las 14 cepas evaluadas, redujeron el acetileno a etileno a las 48 horas de exposición, sin embargo hubo 3 de ellas (42, 64 y 89), que a las 5 horas ya mostraban concentraciones de etileno con valores desde 1142.15 hasta 3397.4 nmoles de etileno/h/mL.
Las 8 cepas que mostraron reducción del acetileno a etileno a las 48 horas de exposición, fueron la 19, 33, 41, 42, 49, 57, 75 y 82, de estas la que más produjo etileno fue la 75 la cual reportó un valor de 1783.93 nmoles de etileno/h/mL, resultado bastante alto comparado con el control y con las otras cepas evaluadas, por esta razón, esta cepa podría ser una de las más adecuadas para usar en un futuro como promotora de crecimiento vegetal cuando se evalué su efectividad bajo condiciones controladas de invernadero y campo. Todas estas cepas a excepción de la 19, son procedentes de suelos asociados a Vega del río, donde se reportó el menor valor de nitrógeno total en el suelo, por lo que era de esperar que estos aislamientos pudieran reportar mayores tasas de fijación, debido a que bajo estrés nutricional la mayoría de las bacterias tienden a expresar actividades metabólicas (Sylvia et al., 1999). Mantilla (2009) también encontró mayor abundancia de bacterias diazótrofas fijadoras de nitrógeno en los suelos donde este elemento se encontraba en menor cantidad, lo que explico debido a que la fijación biológica de nitrógeno presenta su máxima expresión en condiciones de baja disponibilidad de este elemento y en ocasiones muchos de estos microorganismos desaparecen de ambientes donde el nitrógeno es abundante (Martinez – Romero, 2006 en Mantilla, 2009)
la zona andina, se podría explicar esta diferencia metabólica, pues el complejo nitrogenasa puede variar su actividad según las condiciones medioambientales que se presenten (Huss-Danel, 1997).
Mantilla (2008), evaluó la fijación de nitrógeno de bacterias diazótrofas aisladas de suelos de Terraza (Similar a Tierra Firme) y Varzea (Similar a Vega del rio) también en la región del Amazonas, en sus resultados encontró que las tasas de reducción de acetileno a etileno eran mejores a la hora 24 de exposición, lo cual tiene relación con los resultados obtenidos en este estudio, pues aunque los actinomicetos mostraron actividad a la hora 48 y no a la 24, siguen siendo tiempos de exposición prolongados donde la nitrogenasa toma tiempo en activarse en presencia del acetileno.
Respecto a la tasa de producción de etileno por parte de las bacterias evaluadas, se realizó un prueba de ANOVA donde se encontró que si existen diferencias significativas entre las diferentes cepas (p<0.05), además se encontraron dos grupos diferentes según el análisis de comparación múltiple de Tukey donde todas pertenecieron al grupo A, a excepción de la cepa 75 que perteneció al grupo B, lo cual se explica con los resultados ya que como se mencionó anteriormente esta cepa produjo grandes concentraciones de etileno comparada con las otras cepas evaluadas. De las cepas del grupo A algunas no produjeron etileno y las otras produjeron muy poco respecto a la 75, es por ello que seguramente se agrupan juntas dejando a la 75 en un grupo diferente (B) por su alta producción de etileno.
En general, los valores reportados de etileno por la cepas evaluadas en este estudio estuvieron entre 100.47 y 196.13 nmoles de etileno/h/mL sin tener en cuenta a la cepa 75, los cuales superaron los resultados alcanzados por el control positivo. Ahora bien, si se comparan los valores obtenidos con otros estudios como el de Mantilla (2008) son valores bajos, pues la mayoría de las bacterias diazótrofas evaluadas en ese trabajo mostraron tasas desde 2000 a 8000 nmoles de etileno/h/mL. Sin embargo si se comparan con estudios como el de Pedraza et al (2009) quienes evaluaron la fijación de nitrógeno de Azospirillum brasilensis, donde obtuvieron valores de 17.01 a 27.08 nmoles de etileno/hora/cultivo, o como el de Gupta & Roper (2010) quienes evaluaron la fijación de nitrógeno de bacterias de origen de suelos del sur de Australia, donde obtuvieron valores desde 5 a 40 nmoles de etileno/hora; la tasa de producción de etileno de los actinomicetos evaluados en este estudio es bastante alta, lo cual les podría dar la ventaja de ser seleccionados para usarlos como promotores de crecimiento vegetal y/o biofertilizantes; sobre todo por el hecho de ser nativos de suelos ácidos del Amazonas, ya que se encuentran adaptados a esas condiciones limitantes para otros microorganismos foráneos que hacen parte de biofertilizantes comerciales.
Para poder hablar de diversidad como tal, de la población de actinomicetos y de bacterias en general en las muestras evaluadas, es necesario tener en cuenta los análisis moleculares, pues las técnicas de cultivo dependiente recuperan solo una pequeña parte de la comunidad cultivable o capaz de recuperase en placas de cultivo con los procedimientos actuales (Ibekwe et al., 2002), además otros estudios han planteado que muchas bacterias de la misma especie pueden presentar diferentes morfologías de colonia (McCaig et al., 2001) por lo que no es posible determinar diversidad por el conteo de morfologías diferentes en una muestra.
de los perfiles PCR-DGGE (Clegg et al., 2003; McCaig et al., 2001). Otra desventaja que se puede encontrar en un análisis de DGGE, es que hay algunas bacterias de diferentes especies que no se diferencian en la región del 16S por lo que podrían aparecer como una misma banda, además las bandas que se observan representan a las especies más abundantes dentro de la comunidad, pues varios estudiados han comprobado que el DGGE no puede separar todos los fragmentos de ADNr 16S obtenidos de microorganismos del suelo, sino solo las especies dominantes; cuya concentración debe ser mayor al 1% de la población total (Ibekwe et al., 2002; Casamayor et al., 2000). Aun así la técnica es efectiva para comparar diversidad entre las diferentes muestras, pues todas fueron tratadas bajo las mismas condiciones por lo que el potencial de sesgo en la PCR es común a todas las muestras (Clegg et al., 2003).
Los perfiles de DGGE obtenidos en este estudio, permitieron observar 32 bandas diferentes de lo que se puede inferir que pueden existir alrededor de 32 poblaciones bacterianas incluyendo a los actinomicetos, estos resultados son similares a los obtenidos por Marschne et al. (2005) quienes encontraron alrededor de 30 bandas polimórficas, analizando muestras de suelo de tres especies Banksia en suelos australianos; sin embargo por los problemas de la técnica mencionados anteriormente no es posible establecer con seguridad la presencia de 32 poblaciones diferentes, para esto sería ideal hacer una escisión de algunas bandas, clonarlas y correrlas de nuevo en DGGE para ver su comportamiento de corrida, este procedimiento fue realizado por Casamayor et al. (2000) quienes encontraron que alrededor del 10% de las bandas clonadas eran homo o heterodúplex y se separaban completamente en el nuevo DGGE; otra manera de asegurarse de que las bandas encontradas representan a una sola población bacteriana es por medio de la construcción librerías del gen 16S ADNr, donde al secuenciarlas se puede estimar inferencias filogenéticas y estimar también la diversidad (Wang et al. 2007). Según el dendograma de similaridad genética, se observó que las muestras se agrupan en tres clusters principales, donde el porcentaje de similitud fue del 12%, lo que indica que la variabilidad genética es bastante alta. Sin embargo se observó que en uno de los clusters se agrupaban todas las muestras corridas en el primer gel y en los otros dos clusters todas las corridas en el segundo gel, lo que sugiere que la baja similitud encontrada se puede deber a las diferencias entre geles mas no entre las muestras; sin embargo esta agrupación puede tener una mejor explicación debido a que las primeras 12 muestras agrupadas en el cluster 1 poseen una banda monomórfica que las otras no presentan; a diferencia de los otros dos clusters donde se agruparon todas las muestras corridas en el segundo gel, esta tendencia se repitió pues las muestras agrupadas en el cluster 2 (13, 14, 17, 16, 23 y 24) también compartían una banda que no aparecía en las otras muestras agrupadas en el cluster 3. Este misma tendencia fue también encontrada por Ferrari & Hollibaught (1999), quienes estudiaron la distribución de la población microbiana en una zona del océano Ártico por medio de DGGE y observaron que la presencia de una banda común en varias muestras conducía a su agrupamiento dentro del mismo cluster, así hubieran sido corridas en diferentes geles.
Por otro lado no se observó una correlación entre el agrupamiento de los clusters internos y la procedencia de las muestras, por lo que se podría plantear que la semejanza genética en este caso, no está condicionada por el tipo de suelo o de cultivo donde se encuentre.
procedentes de Vega del río fueron unas de las que más morfologías diferentes de actinomicetos presentaron, los cuales están incluidos en el análisis de la comunidad total bacteriana realizadó por el DGGE. Según el ANOVA de los resultados de Shannon, Simpson, Margalef y Equitatividad de todas las muestras, se encontró que si existen diferencias significativas (p<0.05) según la condición ecosistémica (Vega del río o Tierra firme), lo cual concuerda con lo mencionado por Zornoza et al. (2009) quienes discuten que las características medio ambientales y del suelo influyen directamente sobre la diversidad de la comunidad bacteriana, este hecho confirma lo mencionado anteriormente acerca de por qué se observa mayor diversidad en los suelos asociados a Vega del río.
La aparición de bandas únicas en una muestra también es una medida de diversidad (Cardona, 2004); se encontró que la mayoría de bandas únicas observadas estaban en las muestras procedentes de Cocona Vega del río, corroborando que es en este ecosistema donde se reporta la mayor diversidad bacteriana.
El hecho de encontrar una mayor diversidad con diferencias significativas en los suelos de Vega del río con respecto a los de Tierra firme, muestra que los análisis moleculares son más específicos y dan resultados más reales acerca de las poblaciones microbianas, pues en las técnicas de cultivo dependiente no se observaron diferencias significativas en cuanto a diversidad; lo cual se puede deber a la baja capacidad de recuperación de algunas especies de bacterias en medios de cultivo, así mismo es posible que la comunidad de actinomicetos sea más diversa que lo reportado por los resultados en cultivo en placa. Esto se puede explicar también debido a que existen comunidades de actinomicetos que son muy difíciles de aislar en medios de cultivo, haciendo que la recuperación en placa sea más baja (Cardona, 2004).
De acuerdo a los resultados, se podría decir que la comunidad de actinomicetos en los suelos evaluados es altamente diversa, pues este grupo está incluido dentro la población general bacteriana evaluada por DGGE y además de esto los recuentos en placa obtenidos estuvieron en el orden de 105UFC/g de suelo, valor que ha sido establecido anteriormente por otros autores como la abundancia estándar de este grupo en un suelo (Goodfellow & Williams, 1983). Se encontró también que algunos de los actinomicetos presentes en el suelo poseen características metabólicas como fijación de nitrógeno, lo cual permitiría usarlos como biofertilizantes y/o promotores de crecimiento vegetal en los mismos suelos de muestreo, lo cual ayudaría a cumplir con uno de los fines de los sistemas agroforestales, donde se busca el uso exclusivo de fertilizantes orgánicos.
Teniendo en cuenta no solo los resultados de abundancia de la comunidad de actinomicetos cultivables, sino también el análisis de DGGE para toda la comunidad bacteriana, se observa que la diversidad de los suelos evaluados es alta, por lo cual se ratifica que los sistemas agroforestales es un sistema de cultivo que no solo permite recuperar los suelos dañados por actividades antrópicas sino también conservarlos de manera sostenible.
CONCLUSIONES Y RECOMENDACIONES
Actinomicetos aislados de estos suelos, ya adaptados a las condiciones acidas y a una alta concentración de Al, se encuentran activos metabólicamente y poseen características para promover el crecimiento vegetal como la fijación de nitrógeno; lo que posibilita su uso como biofertilizantes, promoviendo una alternativa para cambiar el uso de fertilizantes químicos por fertilizantes orgánicos que son más sanos para el medio ambiente y para la sostenibilidad del suelo.
Los sistemas agroforestales mantienen la abundancia y diversidad de las poblaciones microbianas entre las cuales están los actinomicetos, independientemente del tipo de asociación (Arazá o Cocona) y del tipo de condición ecosistémica, por lo que son sistemas aptos para regiones tan frágiles como la amazonia donde su vocación es más forestal que agrícola, pero que necesita de cultivos adaptados a la región para que suplan las necesidades de autoconsumo de los pobladores locales.
BIBLIOGRAFIA
ALEF, K. & NANNIPIERI, P. 1995. Methods in Applied Soil Microbiology and Biochemistry. Academic Press, Harcourt Brace Co. Publishers, London, New York, Toronto
ARANIBAR, N., ANDERSON, C., RINGROSE, S. & MACKO, A. 2003. Importance of nitrogen fixation in soil crusts of southern African arid ecosystems: acetylene reduction and stable isotope Studies. Journal of Arid Environments 54: 345–358
ARCOS, A.L., BECERRA, M.T., BENITEZ, A.M. & DÍAZ, J.A. 2004. Diagnostico y caracterización de la cadena de valor de frutales amazónicos. Informe Final. Instituto Alexander Von Hulboldt. Ed. Instituto von Humboldt, Bogotá, 120p
BANDICK, A.K. & R.P. DICK. 1999. Field management effects on soil enzyme activities. Soil biology and biochemistry 31: 1471-1479.
BENAVIDES, B. & VARGAS, G. 2006. Conservación de sistemas productivos en la Amazonia norte colombiana. Instituto Amazónico de Investigaciones Científicas, SINCHI. 64 p.
BENDING, G. D., TURNER, M. K., RAYNS, F., ARX, M.-C., & WOOD, M. 2004. Microbial and biochemical soil quality indicators and their potential for differentiating areas under contrasting agricultural management regimes. Soil Biology & Biochemistry. 1785–1792.
CARDONA, G. 2004. Evaluación de la diversidad de actinomicetos en suelos bajo tres coberturas vegetales en el sur del trapecio amazónico colombiano. Tesis maestría. Pontificia Universidad Javeriana.
CARDONA, G., PEÑA-VENEGAS, C. & RUIZ-GARCIA, M. 2009. Comunidades de hongos actinomicetos en tres tipos de vegetación de la Amazonia colombiana: abundancia, morfotipos y el gen 16S ADNr. Revista de Biologia tropical. Vol. 57. 1119-1139.
CASAMAYOR, E., SCHAFER, H., BAÑERAS, L., PEDRO´ S-ALIO, C. & MUYZER, G. 2000. Identification of and Spatio-Temporal Differences between Microbial Assemblages from Two Neighboring Sulfurous Lakes: Comparison by Microscopy and Denaturing Gradient Gel Electrophoresis. APPLIED AND ENVIRONMENTAL MICROBIOLOGY. Vol. 66 No 2: 499–508
CHEN GANG, HONGLONG ZHU & YONG ZHANG. 2003. Soil microbial activities and carbon and nitrogen fixation. Research in Microbiology 154: 393–398
CHIMETTO, L.A., BROCCHI, M., THOMPSON, C., MARTIN, R.C.R, RAMOS, H.R. & THOMPSON, F.L. 2008. Vibrios dominate as culturable nitrogen-fixing bacteria of the Brazilian coral Mussismilia hispida. Systematic and Applied Microbiology 31: 312–319
CLEGG, C., LOVELL, R. & HOBBS, P. 2003. The Impact of grassland management regime on the community structure of selected bacterial groups in soils. FEMS Microbiology Ecology 43: 263-270
EL-TARABIL, K. & SIVASITHAMPARAM, K. 2006. Non-streptomycete actinomycete as biocontrol agents of soil born fungal plant pathogens and as plant growth promoters. Soil Biology & Biochemistry. 38. 1505-1520.
FERRARI, V.C. & HOLLIBAUGH, J.T. (1999). Distribution of microbial assemblages in thecentral Arctic ocean basin studied by PCR/DGGE: analysis of a large data set. Hydrobiologia 401, 55-68.
FRANCO, M. 2008. Evaluación de caracteres PGPR en actinomicetos e interacciones de estas rizobacterias con hongos formadores de micorriza. Tesis doctoral. Universidad de Granada, España.
GALEANO, F. 1991. Capacidad de intercambio catiónico y aniónico. Bases de cambio y saturaciones. Fundamentos para la interpretación de análisis de suelos, plantas y aguas para riego. Sociedad Colombiana de la Ciencia del Suelo.
GAVRISH, E., BOLLMANN, A., EPSTEIN, S. & LEWIS, K. 2008. A trap for in situ cultivation of filamentous actinobacteria. Journal of microbiological methods. 72. 257-262.
GOODFELLOW, M., WILLIAMS, S. T. & MORDARSKI, M. 1983. The biology of the actinomycetes. Academis press INC. London, UK
GOODFELLOW, M & WILLIAMS S.T. 1983. Ecology of Actinomycetes. Ann. Rev. Microbial. 37: 189-216
GOGO, S. & PEARCE, D.M.E. 2009. Carbon, cations and CEC: Interactions and effects on microbial activity in peat. Geoderma 153: 76–86
GUPTA, V.V.S.R & ROGER, M.M. 2010. Protection of free-living nitrogen-fixing bacteria within the soil matrix. Soil & Tillage Research.
HACE, K., DENNER, E., KUFFNER, M., PIÑAR, G., HANDSCHUR, H., LUBITZ, W. & HASLBERGER, A. 2004. DGGE analysis and shot gun cloning 1 detects different actinomycete-communities in soils from fields under conventional and organic management.
HEAD, I.M., J.R. SAUNDERS & R.W. PICKUP. 1998. Microbial evolution, diversity and ecology: a decade of ribosomal RNA analysis of uncultivated microorganisms. Microbial Ecology. 35: 1-21
HERNÁNDEZ M., BARRERA J., PÁEZ, D., OVIEDO, E. & ROMERO, H. 2004. Aspectos biológicos y conservación de frutas promisorias de la amazonia colombiana. Instituto Amazónico de Investigaciones Científicas, SINCHI. Universidad de la Amazonia.150 p.
HEUER, H., KRSEK, M., BAKER, P. & WELLINGTON, K. S. 1997. Analysis of Actinomycete Communities by Specific Amplification of Genes Encoding 16S rRNA and Gel-Electrophoretic Separation in Denaturing Gradients. Applied and environmental microbiology. 3233–3241.
IBEKWE, A.M., KENNEDY, A.C., FROHNE, P.S., PAPIERNIK, S.K., YANG, C.H. & CROWLWY, D.E. 2002 Microbial diversity along a transect of agronomic zones. FEMS Microbiology Ecology 39: 183-191
IGAC. 1986. Consideraciones generales para interpretar análisis de suelos.
JAYASINGHE, D. & PARKINSON, D. 2007. Actinomycetes as antagonist of litter descomposer fungi. Applied soil ecology. 38. 109-118.
KENNEDY, A.C. 1999. Bacterial diversity in agroecosystems. Agriculture, Ecosystems and Environment 74: 65–76
KIRK, J., BEAUDETTE, L.A., HART, M., MOUTOGLIS, P., KLIRONOMOS, J., LEE, H. & TREVORS, J. 2004. Methods of studying soil microbial diversity. Journal of Microbiological Methods. 58. 169-188
LANDECKER, M. E. 1996. Fundamentals of the fungi. 4 edición. New jersey.
MANTILLA, A. 2009. Segundo informe del proyecto: Mantenimiento de la fertilidad de suelos y generación de tecnologías para la recuperación de áreas degradadas en la amazonia colombiana. SINCHI.
MANTILLA, A. 2008. Distribución de bacterias diazotrofas y su capacidad fijadora de nitrógeno asociadas con tres coberturas vegetales en paisajes de terraza y varzea en suelos del sur del trapecio amazónico colombiano. Magíster en ciencias biológicas. Pontificia Universidad Javeriana, Facultad de ciencias. Bogotá D.C. 153 pg
MANTILLA, A., CARDONA, G., PEÑA-VENEGAS, C., MURCIA, U., RODRIGUEZ, M. & ZAMBRANO, M.M. 2009. Distribucion de bacterias potencialmente fijadoras de nitrógeno y su relación con parámetros fisicoquímicos en suelos con tres coberturas vegetales en el sur de la Amazonia colombiana. Revista de Biologia tropical. Vol. 57. 915-927.
MANULIS, S., SHAFIR, H., EPSTEIN, E., LICHTER, A. & BARASH, I. 1994. Biosynthesis of indole-3-acetic acid via the indole-3-acetamide pathway in Streptomyces spp. Microbiology. 140. 1045-1050.
MARSCHNER, P., GRIERSON, P. & RENGEL, Z. 2005. Microbial community composition and functioning in the rhizosphere of three Banksia species in native woodland in Western Australia. Applied Soil Ecology 28: 191–201
MARTINEZ-ROMERO, 2006. Dinitrogen-Fixing Prokaryotes. Prokaryotes. Cap. 1.24: 793 – 817.
MAZO, C. 2009. Detección de la actividad nitrogenasa en actinomicetos aislados en la zona Cundiboyacense. Microbiología Industrial. Pontificia Universidad Javeriana. Facultad de ciencias. Departamento de microbiología. Bogotá D.C. 126 pg
MOHAPATRA, A., LEUL, M., MATTSSON, U. & SELLSTEDT, A. 2004. A hrydogen-envolving enzyme is present in Frankia sp. R 43. FEMS Microbiology letters. 236. 235-240.
MURCIA, G. & URIEL, G. 2003. Análisis de los procesos de deforestación y praderización en las zonas de colonización de la Amazonia colombiana. Estudio de caso departamento del Guaviare, periodo 1987-2001”, tesis de grado M. Sc., Pontificia Universidad Javeriana, Bogotá, 95 p.
MUYZER, G., 1999. DGGE/TGGE a method for identifying genes from natural ecosystems. Current Opinion Microbiology. 2, 317–322.
NEI, M. 1987. Molecular evolutionary genetics. Columbia University Press. New York.
NORTCLIFF, S. O. 2002. Standardisation of soil quality attributes . Agriculture, Ecosystems and Environment. 161–168.
ODUM, E. & F. SARMIENTO. 1998. Ecología, el puente entre ciencia y sociedad. McGraw Hill-Interamericana. México D.F
PARK, M., KIM C., YANG, J., LEE, H., SHIN, W., KIM, S. & SA, T. 2005. Isolation and characterization of diazotrophic growth promoting bacteria from rhizosphere of agricultural crops of Korea. Microbiological Research. 160. 127-133.
PEDRAZA, R., BELLONE, C., CARRIZO DE BELLONE, S., FERNANDES, P. & SANTOS, R. 2009. Azospirillum inoculation and nitrogen fertilization effect on grain yield and on the diversity of endophytic bacteria in the phyllosphere of rice rainfed crop. European journal of soil biology. 45: 36-43.
PEÑA-VENEGAS, C. P., CARDONA, G. I. & MAZORRA, A. 2006. Micorrizas Arbusculares de la Amazonia colombiana. Catálogo Ilustrado. Instituto Amazónico de Investigaciones Científicas Sinchi. Pp 90.
PEÑA-VENEGAS, C. P. & ARIAS-GARCIA J.C. 2001. Recuperación de suelos en el Amazonas a partir de sistemas agroforestales. Instituto amazónico de investigaciones científicas SINCHI. PRONATTA. Bogotá D.C.
PEREZ, H., BUCHELLI, P. & GIRALDO, B. 2005. La agroforestería en la Guainía: Una alternativa sostenible. Instituto amazónico de investigaciones científicas SINCHI. Bogotá, Colombia. 32 p.
POSTGATE, JR. 1971. The acetylene reduction test for nitrogen fixation. Meth Microbiology 6B: 342–356
SOCIEDAD COLOMBIANA DE LA CIENCIA DEL SUELO. 1990. Fundamentos para la interpretación de análisis de suelos, plantas y aguas para riego. Tercera edición. Bogotá D.C.
SHIRLING, EB & D GOTTLIEB. 1966. Methods for characterization of Streptomyces species. Int. J. Syst. Bacteriol. 16:313-340.
SINCHI. 2009. Mantenimiento de la fertilidad del suelo y generación de tecnologías para recuperación de aéreas degradadas. Proyecto de investigación en curso.
STARK, C., CONDRON, L.M., O´CALLAGHAN, M., STEWART, A. & DI H.J. 2007. Differences in soil enzyme activities, microbial community structure and short-term nitrogen mineralization resulting from farm management history and organic matter amendments. Soil biology & Biochemistry. 12 p.
SYLVIA, D., J. FUHRMANN, P. HARTEL & D. ZUBERER. 1998. Principles and Applications of Soil Microbiology. Prentice Hall. New Jersey.
TIEN, T., GASKINS, M. & HUBBELL, D. 1979. Plant growth substances produced by Azospirillum brasilense and their effect on the growth oh pearl millet (Penisetum americanum L.). Applied and environmental microbiology. 1016-1024.
USECHE, Y.M. 2003. Caracterización de bacterias y hongos solubilizadores de fosfato bajo tres usos del suelo en el sur del trapecio amazónico. Biología. Universidad Nacional de Colombia. Facultad de ciencias. Departamento de biología. Bogotá D.C. 179pg.
VALDÉS, M., PEREZ, N., ESTRADA, P., CABALLERO, J., PEÑA, J., NORMAND, P & HIRSCH, A. 2005. Non-Frankia actinomycetes isolates from surface-sterilized roots of Casuarina equisetifolia fix nitrogen. Applied and Environmental microbiology. 71,1: 460-466.
WANG, M, CHEN J.K. & LI, B. 2007. Characterization of Bacterial Community Structure and Diversity in Rhizosphere Soils of Three Plants in Rapidly Changing Salt Marshes Using 16S rDNA. Pedosphere Volume 17, Issue 5, October 2007, Pages 545-556
WEYENS, N., VAN DER LELIR, D., TAGHAVI, S., NEWMAN, L. & VANGROSVELD. 2009. Exploiting plant-microbe partnerships to improve biomass production and remediation. Trends in Biotechnology. Vol. 27. No. 10. 591-598.
ZORNOZA, R., GUERRERO, C., SOLERA, J., SCOW, K. W., ARCENEGUI, V. & MATAIX-BENEYTO, J. 2009. Changes in soil microbial community structure following the abandonment of agricultural terraces in mountainous areas of Eastern Spain. Applied Soil Ecology 42: 315–323
ZUART, J.L. 1998. Caracterización bioquímica y molecular de judía (Phaseolus vulgaris L.). Trabajo de tesis. Escuela Técnica Superior de Ingenieros Agrónomos. Universidad Politécnica de Madrid.
ZVYAGINTSEV, D. G., ZENOVA, G. M., SUDNIZIN, I. I. & DOROSHENKO, E. A. 2005. The Ability of Soil Actinomycetes to Develop at an Extremely Low Humidity. Doklady Biological Sciences, Vol. 405: 461–463. Translated from Doklady Akademii Nauk, Vol. 405, No. 5, 2005:702–704
RECURSOS ELECTRONICOS