EFECTO DEL AUMENTO DE TEMPERATURA SOBRE HONGOS EN SUELOS
DE PASTIZAL Y BOSQUE ALTOANDINO (MUNDO NUEVO, CUNDINAMARCA)
MIGUEL FELIPE CAMARGO GALINDO
TRABAJO DE GRADO
Pre-requisito parcial para optar para el título de
BIÓLOGO
PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS
CARRERA DE BIOLOGÍA BOGOTÁ, D.C.
EFECTO DEL AUMENTO DE TEMPERATURA SOBRE HONGOS EN SUELOS
DE PASTIZAL Y BOSQUE ALTOANDINO (MUNDO NUEVO, CUNDINAMARCA)
MIGUEL FELIPE CAMARGO GALINDO
APROBADO
______________________ _______________________
EFECTO DEL AUMENTO DE TEMPERATURA SOBRE HONGOS EN SUELOS
DE PASTIZAL Y BOSQUE ALTOANDINO (MUNDO NUEVO, CUNDINAMARCA)
MIGUEL FELIPE CAMARGO GALINDO
APROBADO
______________________ _______________________
Amanda Varela, Ph. D. Jairo Pérez Torres, Ph.D. Directora. Jurado.
NOTA DE ADVERTENCIA
Artículo 23 de la Resolución N° 13 de Julio de 1946
“La Universidad no se hace responsable por los conceptos emitidos por sus alumnos
Agradecimientos
Quiero agradecer a Dios quien me da la vida y siempre está conmigo, a mi familia especialmente a mis padres, que aunque lejos siempre están muy cerca y pendientes de mí; gracias por su apoyo incondicional. A mi tía Clarita que fue como mi mamá en estos largos e importantes años de mi vida, en los cuales estuve en la universidad. A Camila la niña más linda y especial que me apoyó y me acompañó en los momentos buenos como en los difíciles, siempre dándome buenos consejos y alentándome a seguir adelante.
Gracias a la Universidad Javeriana, a Amanda Varela por su dirección y asesoría en este trabajo de investigación, a Jairo Pérez por ser mi jurado y haberse tomado el trabajo de leer el escrito y aportar valiosos comentarios, a mis compañeros de laboratorio por su compromiso y arduo trabajo, y a todos los que de una u otra forma contribuyeron en la
realización de este trabajo…. Gracias por todo, los llevo en el corazón.
1. RESUMEN
2. INTRODUCCIÓN
3. PLANTEAMIENTO DEL PROBLEMA 3.1 Justificación
4. MARCO TEÓRICO 4.1Cambio climático 4.2Los hongos del suelo
4.3Características fisicoquímicas del suelo y hongos 4.4Bosque altoandino y pastizal
5. OBJETIVOS 5.1General 5.2Específicos
6. ASPECTOS METODOLÓGICOS 6.1Área de estudio
6.2Experimento
6.3Pruebas Microbiológicas 6.4Pruebas Fisicoquímicas 6.5Análisis estadístico
7. RESULTADOS Y DISCUSIÓN
1. RESUMEN
Se diseñó un experimento en campo con condiciones controladas de temperatura, en donde se establecieron nueve dispositivos para elevar la temperatura del suelo por lo menos 1°C tanto en bosque altoandino como en pastizal para ganadería. Después de 17 meses de instalados los dispositivos se realizaron dos muestreos separados por un periodo de dos meses entre sí, en donde se tomaron muestras de suelo y se registró la temperatura en campo dentro y fuera de los dispositivos. Las muestras se procesaron en el laboratorio para cuantificar la densidad y la riqueza de hongos antagonistas, usando el método de diluciones seriadas y siembra en placa profunda en diferentes medios de cultivo. Adicionalmente se realizaron pruebas fisicoquímicas del suelo para correlacionarlas con la densidad y riqueza de estos hongos. No se encontraron diferencias significativas entre dentro y fuera del dispositivo en la densidad total de hongos, pero la densidad fue mayor en bosque (5.05 Log10 UFC/g de suelo) que en pastizal (4.85 Log10 UFC/g de suelo). Con relación a los
hongos antagonistas esta fue diferente entre dentro y fuera del dispositivo pero no varió en ambos usos de suelo. La riqueza calculada con el índice de diversidad de Fisher fue mayor en pastizal (4,15) que en bosque (2,91). El efecto de la temperatura no se evidenció pues esta no aumentó significativamente. No se encontró relación entre las variables fisicoquímicas del suelo, y la densidad y riqueza de hongos. Se sugiere aumentar la precisión del termómetro para registrar cambios menores en la temperatura del suelo y tomar las muestras en los primeros 5 cm de profundidad.
1. ABSTRACT
density of fungi, but it was higher in the high Andean forest (5.05 Log10 CFU/g of
soil) than in grassland which was (4.85 Log10 CFU/g of soil). Density between inside
and outside the device was also different for the antagonists fungi but unchanged in both land uses. Richness calculated by Fisher diversity index was higher in pasture (4.15) than in forest (2.91). The effect of temperature was not prominent as it did not increase significantly. It was also found that there was no relationship between soil physicochemical variables and the density and richness of fungi. It is suggested to increase the accuracy of the thermometer in order to record minor changes in soil temperature and take samples in the first 5 cm of depth.
2. INTRODUCCIÓN
3. PLANTEAMIENTO DEL PROBLEMA
Son muchas las evidencias de cómo las prácticas actuales de producción agrícola e industrial insostenibles afectan todos los niveles desde lo económico, social, político hasta lo ambiental (Brown 2010). Es un hecho que como consecuencia de estas prácticas el planeta se está calentando, lo que genera cambios en el clima tales como, sequías, lluvias extremas, catástrofes naturales como huracanes e inundaciones (Bunyard 2010). Dentro de 50 años se estima que la temperatura media del planeta se incrementará en 1°C. Este incremento afectará a los ecosistemas tanto terrestres como acuáticos (IPCC 2007), ya que el clima es uno de los factores más importantes que determina la distribución de las especies y la diversidad biológica, la fisiología y las interacciones entre las especies y con su entorno, lo que influye directamente sobre el funcionamiento de los ecosistemas (Odum 2006).
temperatura del suelo sobre estos hongos, permitiría planear estrategias de mitigación. El bosque altoandino y el pastizal ganadero, cobertura de reemplazo de este en zonas de alta montaña como La Calera (Cundinamarca), se constituyen en un escenario propicio para hacer esta evaluación ya que se predice que estas zonas van a ser las más afectadas por el cambio climático (Tobón 2009, INAP 2007).
3.1 Justificación
Se estima que los ecosistemas y las zonas de alta montaña serán las más afectadas por el incremento de temperatura, la cual se predice que para el 2100 estará entre 1,4 y 5,8°C por encima de la actual. Estas zonas son de vital importancia ecológica y agrícola, por los ecosistemas que allí se encuentran como las actividades productivas tales como la ganadería y la agricultura, que son una fuente importante de sustento para la población. El bosque altoandino se ha visto disminuido por la ampliación de la frontera agrícola cambiándose el uso del suelo. Esto posibilita la erosión del suelo al dejarlo expuesto y llevando a la pérdida de captación de agua por parte del bosque, lo que afecta la regulación hídrica, ya que el bosque bombea vapor de agua por el proceso de evapotranspiración y permite la formación de nubes, y por supuesto lleva a la pérdida de biodiversidad y de los bienes y servicios que de esta se derivan.
Además de esto, los pastizales para ganadería lechera han sido uno de los usos de reemplazo importantes en áreas donde previamente existía bosque altoandino, particularmente en la Sabana de Bogotá y sus alrededores. Estos pastizales, en ocasiones por mal manejo, se han visto afectados por una serie de enfermedades que causan la disminución de su calidad y en algunas ocasiones la aparición de enfermedades en los rebaños (INAP 2007, Bernal y Granada 1997).
y además aumentando los factores que producen estrés hídrico (Bunyard 2010, Plaster 2000).
Todos estos factores asociados con el incremento de la temperatura influyen sobre la diversidad y las condiciones físicas, químicas y biológicas del suelo, repercutiendo directamente sobre la riqueza y diversidad de las especies fúngicas que cumplen funciones importantes como la de fertilizar los suelos y la de controlar de plagas y enfermedades, las cuales afectarán el funcionamiento de estos ecosistemas. Sin embargo no se conoce bien cómo responden los microorganismos del suelo al calentamiento global y en particular los hongos (Scindlbacher et al. 2011, Frey et al. 2008). Por esto el estudio de la densidad y distribución de los organismos y la comprensión de las interacciones entre estos y su ambiente implica un abordaje de la información de forma netamente cuantitativa en donde es necesario tomar datos de densidad y riqueza a través del tiempo para poder medir el posible efecto de la temperatura sobre hongos antagonistas en suelos de pastizal y bosque altoandino.
4. MARCO TEÓRICO
4.1Cambio climático. El cambio climático fue definido por el Panel Intergubernamental de Cambio Climático (IPCC) como cualquier modificación que registre el clima del planeta en el tiempo, ya fuera debida a causas naturales o como resultado de la actividad humana. Este fenómeno ha existido durante toda la historia de la vida en la Tierra, como consecuencia de los diferentes periodos geológicos y es responsable también de las radiaciones de vida durante el proceso evolutivo (Bunyard 2010). Sin embargo las concentraciones de gases de efecto invernadero tales como el CO2, CH4 y N2O han
aumentado desde 1750 en 31, 150 y 16%, respectivamente, debido a múltiples actividades humanas, incluidas la agricultura y la industria (Bunyard 2010, Houghton et al. 2001).
aumento de la temperatura en la Tierra, que en los últimos 30 años ha sido casi de 1°C (Bunyard 2010, IPCC 2007).
El incremento de gases de efecto invernadero eleva la temperatura del planeta al atrapar mayor radiación infrarroja, lo cual genera a su vez un aumento en la concentración de vapor de agua como resultado de la evaporación de los océanos. Esto produce mayor cantidad de nubes, que en lugar de reflejar la luz del sol y enfriar la superficie del planeta, fomentan el calentamiento global debido a que el vapor de agua tiene mayor efecto sobre el efecto invernadero que todos los gases combinados (Bunyard 2010).
Actualmente la atmósfera presenta cerca de 390 ppm de CO2, un 36% superior a las
concentraciones de la era preindustrial, hace unos 200 años (Brown 2010, Bunyard 2010). Si el ritmo de emisiones continúa así, se prevé que la temperatura aumentará en promedio cuatro grados o más antes que finalice el siglo actual (Bunyard 2010). Este incremento se ha demostrado que tiene consecuencias directas sobre los ciclos de materia y energía, por ende sobre el funcionamiento de los ecosistemas y los organismos que los componen afectando su distribución, fisiología y fenología (Bunyard 2010, IPCC 2007, Fraser 2004).
Se ha detectado que tan sólo un aumento de 0.6°C ha ocasionado cambios en los rangos de distribución de algunas especies, cambios fisiológicos, fenológicos y comportamentales (Harvell et al. 2002), lo cual puede aumentar el riesgo de la irreversible pérdida de biodiversidad como resultado del calentamiento global (Bunyard 2010, IPCC 2007, Fraser 2004). Se han hecho estudios acerca del efecto de la concentración de dióxido de carbono sobre organismos del suelo y su actividad (Lagomarsino et al. 2006, Briones et al. 2004, Hoekseman et al. 2000). A nivel nacional los trabajos se han centrado en evaluaciones del potencial de secuestro de carbono en suelos y bajo algunas coberturas vegetales (Rondón et al. 2006, Amézquita 2005, Rondón et al. 2004), pero no se registran trabajos sobre organismos edáficos. Adicionalmente no se han realizado experimentos en campo usando alguna variable climática como indicador del cambio climático del planeta.
de los materiales edáficos, que dan soporte físico a las plantas (Smith y Smith 2007, Plaster 2002, Chamorro 2001, Primavesi 1982). Las especies dentro de una comunidad que se entiende como el conjunto de especies que interactúan entre sí y con su ambiente en un espacio y tiempo dados (Atlas y Bartha 2002, Fauth et al. 1996) pueden clasificarse en ensamblajes o en grupos funcionales para facilitar su estudio (Magurran 2004). El ensamblaje es el grupo de organismos relacionados filogenéticamente que interactúan entre sí y con su entorno (Fauth et al. 1996), mientras que los grupos funcionales son grupos de especies emparentadas filogenéticamente que explotan un recurso en común de forma similar o grupo de especies basado en su respuesta común al entorno, características de su ciclo vital o papel dentro de la comunidad (Smith y Smith 2007). Un grupo funcional se define de acuerdo con sus atributos funcionales. Pueden ser considerados grupos funcionales de respuesta, si las especies responden de manera similar a cambios en el ambiente, como cantidad o calidad de recursos necesarios para la supervivencia, por ejemplo la temperatura o la humedad. O pueden ser considerados como grupos funcionales de efecto si realizan algún proceso en particular como la fijación de nitrógeno (Díaz y Cabido 2001, Gitay y Noble 1997). Esto determina también su lugar en el ecosistema la función que cumplen. Estas relaciones e interacciones ecológicas entre antagonistas y fitopatógenos suponen un equilibrio fino y sutil entre sus poblaciones (Cortés 2004, Manners 1994, Agrios 1988, Sarsola 1975, Walker 1973).
Los hongos que infectan plantas se conocen como fitopatógenos, y tienen controladores naturales que se conocen como antagonistas que protegen a las plantas compitiendo por recursos, o inhibiendo su crecimiento mediante la producción de sustancias antibióticas (Brock, 2007, Atlas y Bartha 2002). Estos dos grupos de hongos pueden considerarse como grupos funcionales dentro del suelo. Las relaciones que tienen estos organismos entre ellos y su ambiente son fundamentales para el funcionamiento del ecosistema. Los hongos fitopatógenos pueden entrar en contacto con la planta desde la rizosfera o desde el rizoplano (Brock 2007, Deacon 2006, Atlas y Bartha 2002, Manners 1994, Agrios 1988, Sarasola 1975, Walker 1973,), dado que la mayoría de los hongos fitopatógenos dispersan sus esporas por el aire, a menudo entran en contacto con la planta a través de las hojas o tallos (Atlas y Bartha 2002, Manners 1994, Agrios 1988). Aunque pueden afectar cualquier órgano de la planta, estos retardan el desarrollo de la misma ocasionándole la pérdida de viabilidad o causándole enfermedad o hasta la muerte (Isaac 1992, Zentmyer, 1980). Estos hongos fitopatógenos se encuentran en todos los suelos de los ecosistemas y agroecosistemas del mundo. Algunas especies son de amplia distribución y tienen gran capacidad de adaptación, mientras que otras presentan características de adaptación más limitadas o son más especializadas, lo cual restringe su distribución (Cook y Baker 1983). Por otro lado la importancia de los hongos fitopatógenos que infectan las raíces de las plantas, no sólo radica en el daño que generan a las plantas hospederas, sino a la función que desempeñan dentro de las cadenas tróficas y en las diversas relaciones que establecen con otros microorganismos del suelo (Agrios 1988, Lumsden 1981).
general los antagonistas no tienen un único modo de acción y la multiplicidad de estos es una característica para su selección como agentes de control biológico (Brock 2007, Harman 2004).
4.3Características fisicoquímicas del suelo y hongos. Hay muchas características tanto físicas, químicas, biológicas y ecológicas que determinan que una especie de hongo se encuentre en un lugar u otro (Díaz 2008, Sylvia et al. 2005, Gualdrón et al. 1997). Del mismo modo ciertas especies también determinan las características de su entorno, en este caso del suelo. Esta es una relación recíproca, en las que las condiciones del suelo posibilitan la permanencia de los hongos, y los hongos influyen sobre las características del suelo (Smith y Smith 2007, Odum 2006, Sylvia et al. 2005). Los hongos del suelo son importantes agentes de agregación del suelo, sus hifas se entrelazan entre las partículas del suelo, reuniéndolas para formar agregados sueltos, pero también producen sustancias gomosas que unen a los agregados entre sí (Brock 2007, Sylvia 2005, Plaster 2000). Estas sustancias mejoran la estructura del suelo, haciéndola resistente al riego y a la lluvia (Plaster 2000, Primavesi 1982). También influyen sobre el pH, capacidad de intercambio catiónico, salinidad, y conductividad, pero hay variables físicas que no pueden ser modificadas por los organismos, sino que estas influyen directamente sobre ellos como la temperatura y la humedad (Smith y Smith 2007, Deacon 2006, Odum 2006, Sylvia et al. 2005). Estas dos variables hacen parte de los factores climáticos e influyen casi en cada aspecto del ecosistema, como en la respuesta fisiológica y comportamental de los organismos. Afectan la tasa de crecimiento y reproducción, las habilidades competitivas relativas de la especie, la estructura de la comunidad, la productividad y la circulación de nutrientes (Smith y Smith 2007, Odum 2006, Purves 2004). La densidad de microorganismos en el suelo está determinada por factores intrínsecos a las especies que están presentes, como la tasa de crecimiento y mortalidad, la tasa de reproducción y la producción de estructuras de resistencia (Brock 2007, Sylvia et al. 2005, Atlas y Bartha 2002).
más alta en la que se ha registrado el crecimiento de un hongo es a 60°C y corresponde a la especie Thermomyces lanuginosus (Maheshwari et al. 2000). La humedad (la disponibilidad de agua) es uno de los factores limitantes para la mayoría de los hongos (Abarca et al. 2008, Sylvia et al. 2005). A partir del 60% de humedad relativa proliferan la mayoría de las especies. Sin embargo, existen micromicetos que crecen en ambientes xéricos, como algunas especies de Aspergillus (Herrera y Ulloa, 1990).
Se han hecho estudios acerca de la diversidad e importancia de los hongos, sobre el beneficio de estos para la agricultura (Schalamuk y Cabello 2008), calidad de suelos (Acuña et al. 2006), potencial biológico (Gamboa y García 2008), enzimas (Abarca et al. 2008, García et al. 2008, Valenzuela y Toro 2008), entomopatógenos, biocontroladores (Sepúlveda y Rojas 2008, Wraight et al. 2000, Varela 1997), biodegradadores (Valenzuela y Pinochet 2008), y en general en el campo biotecnológico (Arambarri y Saparrat 2008, Paraszkiewicz et al. 2007, Hanson y Nasir, 1993). Sin embargo la diversidad fúngica y su importancia en el funcionamiento del ecosistema y cómo esta es afectada por el incremento de la temperatura es algo que no se ha estudiado aún en el trópico, pues la mayoría de trabajos provienen principalmente de zonas templadas y no hay un consenso acerca de los patrones encontrados. Adicionalmente se han encontrado aumentos en los rangos de distribución de plagas e insectos que se han desplazado hacia el norte, como es el caso del hongo Cercospora sp. (Rosenzweig et al. 2000), como también mayor número de hongos y bacterias que atacan los cultivos, así como los brotes de enfermedades causadas por hongos, como el oídio y la plaga de la papa (Bunyard 2010).
4.4Bosque altoandino y pastizal. Se predice que el clima cambiará mucho sobre todo en los ecosistemas de alta montaña como es el caso del bosque altoandino, afectando la temperatura y la humedad. Se estima que el incremento de temperatura se será de 2,5- 3°C, con cambios en los patrones espaciales y temporales de las precipitaciones en un 10 al 20%. El bosque altoandino es una prioridad de conservación por la gran biodiversidad que alberga, además de los bienes y servicios ecosistémicos que presta (Rodríguez et al. 2010).
humedad presentan una proporción alta de epífitas (briófitas, líquenes y helechos) que contribuyen a la regulación del flujo hídrico (Osejo, 1995). Los árboles dominantes del dosel generalmente exhiben troncos y ramas retorcidas, presentando hojas más pequeñas y coriáceas, los valores de biodiversidad de árboles, hierbas, arbustos y epifitas son altos y también hay un alto endemismo (Olson y Dinerstein 1998, Hamilton et al. 1995). La descomposición de la hojarasca es el principal aporte de materia orgánica y la vía de llegada de nutrientes al suelo (Staaff y Berg 1982, Aber y Melillo 1980), presenta una productividad y tasa de ciclaje de nutrientes baja (Veneklaas 1991) y los suelos son del orden Inceptisoles (IDEAM 2001).
Este ecosistema se ha visto muy disminuido y se ha ido reemplazando paulatinamente por agroecosistemas como el pastizal y diversos cultivos, lo que genera fragmentación que es uno de los procesos más importantes de disturbio y pérdida de hábitat. Esto afecta la regulación hídrica en cuanto a que se reduce la cobertura vegetal del bosque altoandino y se pierde la capacidad de retener agua; la erosión de los suelos debido a la tala, al cambio de cobertura vegetal y el uso de suelo, y la biodiversidad al reducirse el tamaño del hábitat. El pastizal es un agroecosistema productor de forraje natural, principalmente usado para ganadería. La diversidad vegetal está representada por familias Poaceae (Graminaeae), leguminosas (Fabaceae), y otras especies arvenses (Sierra 2002). La Sabana de Bogotá cuenta con unas 290.000 ha en praderas de diferentes especies, en donde algunas ocasiones debido al mal uso de los suelos se han presentado enfermedades por parte de hongos fitopatógenos de géneros tales como Acremonium, Lecanicillium, Fusarium, Pythium y Rhizoctonia, entre otros, que ocasionan pérdidas y bajo rendimiento de las pasturas y cultivos (INAP 2007).
5. OBJETIVOS
5.1 OBJETIVO GENERAL
Evaluar el efecto del aumento de temperatura sobre la densidad y riqueza de hongos edáficos antagonistas en bosque altoandino y pastizal ganadero.
5.2 OBJETIVOS ESPECÍFICOS
5.2.1 Comparar la densidad de hongos totales en medio Rosa de Bengala presentes en bosque altoandino y pastizal ganadero con aumento y sin aumento de temperatura.
5.2.2 Comparar la densidad y riqueza de hongos edáficos antagonistas presentes en bosque altoandino y pastizal ganadero con aumento y sin aumento de temperatura.
5.2.3 Identificar los géneros de hongos edáficos antagonistas presentes en bosque altoandino y pastizal ganadero, con aumento y sin aumento de temperatura.
5.2.4 Medir algunas características fisicoquímicas del suelo en bosque altoandino y pastizal ganadero con aumento y sin aumento de temperatura.
5.2.5 Establecer la relación entre las variables fisicoquímicas con la densidad y riqueza de hongos antagonistas en bosque y pastizal con aumento y sin aumento de la temperatura.
6. ASPECTOS METODOLÓGICOS
precipitación. La humedad relativa tiene un valor medio multianual de 82.5 % y con valores máximos mensuales que llegan al 95% y mínimos mensuales que llegan al 65% (Betambiental 2005).
El suelo en bosque y pastizal es del orden de los Inceptisoles de la formación Guadalupe, y en cuanto a la estructura del suelo puede reconocerse una condición intermedia entre grano simple y masiva en la cual las partículas del suelo están asociadas en pequeños terrones estables, llamados agregados (Pinzón 2009).
La cuenca del Río Blanco tiene un área total de 40,528 ha, de las cuales 1,384 ha están cubiertas por pastos limpios, 3,567 ha cubiertas por pastos enmalezados, 7,669 ha corresponden a mosaico de pastos y cultivos, 4,279 ha a mosaico de cultivos, pastos y espacios naturales, y 3,217 ha cubiertas por un mosaico de pastos con espacios naturales (INAP 2007). La cuenca sólo se encuentra protegida en un 32,48% y el resto es usada en actividades productivas como en sistemas agrícolas y ganaderos, hecho que ha traído beneficio económico para la zona pero ha impactado negativamente los ecosistemas, con el cambio de uso de suelo, sobre todo con la introducción de ganadería a los bosques (INAP 2007).
6.2 Experimento. Se montó un experimento de 2x2, con dos usos de suelo que corresponden a bosque altoandino y a pastizal ganadero y con dos temperaturas, temperatura ambiental y aproximadamente 1°C por encima de esta. Se establecieron nueve dispositivos de policarbonato para aumentar la temperatura 1°C en bosque y en pastizal como parte del proyecto de investigación de hongos fitopatógenos y antagónicos del suelo asociados a cambio climático desarrollado por la Universidad Javeriana iniciado en julio de 2009, que hace parte del componente B Alta Montaña del programa piloto nacional de adaptación al cambio climático (INAP).
último fue el control) usando un termómetro de suelo en ambos muestreos; las muestras se almacenaron a 4°C hasta su procesamiento. Se realizaron dos muestreos el primero en octubre y el segundo en diciembre, separados por un periodo de dos meses correspondientes a epoca seca. Las muestras se procesaron en el laboratorio para cuantificar la densidad y la riqueza de los hongos antagonistas.
6.3 Pruebas microbiológicas. Se usó el método de diluciones seriadas y siembra en placa profunda en el medio de cultivo Rosa de Bengala con antibiótico, para hongos antagonistas. Se incubaron a 15°C por un periodo de 5-7 días. Se realizaron recuentos de unidades formadoras de colonia por gramo de suelo (UFC/g) para obtener la densidad total y de posibles hongos antagonistas, y se determinó la riqueza con el número de morfotipos seleccionados. Se calculó el Índice de Diversidad Alfa de Fisher con el programa PAST 1, para comparar la riqueza de especies o morfotipos entre los dos usos de suelo, bosque altoandino y pastizal. Los morfotipos seleccionados se identificaron hasta el menor nivel taxonómico posible con la ayuda de claves taxonómicas especializadas (Domsch y Grams, 1980, Pardo 1995, Barnett y Hunter, 1987) y la clave del Manual de Micología (2006). Las cepas seleccionadas se fotografiaron, se aislaron y se sembraron en Agar Extracto de Malta y se almacenaron a 4° C.
6.4 Pruebas fisicoquímicas.
Porcentaje de humedad: se tomaron 10 g de suelo, se depositaron en bolsas de papel y se llevaron al horno de secado a 105°C por 24 horas, se registró el peso seco y se restó el peso final al inicial según la fórmula descrita por Andrades (1996) y Pikul (2003).
Materia orgánica: se calculó pesando 10 g de muestra seca, la cual se calcinó a 550°C en una mufla por 2 horas. Se registró el peso final con el fin de hallar la pérdida de peso por ignición y se calculó el porcentaje de materia orgánica presente en cada muestra con las fórmulas descritas en Abella y Zimmer (2007) y De Vos et al. (2005).
pH: se midió con la ayuda de un potenciómetro, en una suspensión de suelo 1:1 en agua desmineralizada, previamente mezclada en un agitador orbital durante 5 minutos a 150 rpm, y que se dejó reposar por 30 min (Andrades 1996).
Conductividad eléctrica: se midió pesando un equivalente a un volumen de 30 ml de la muestra de suelo, se agregó 30 ml de agua destilada y se agitó a 150 rpm durante 5 min en un agitador orbital, y se midió con la ayuda de un conductivímetro para establecer esta en Ds /m. (Andrades 1996).
Textura: se tomaron 25 g de suelo de cada muestra y se dejaron secar a 22°C por 24 horas. Luego se agregaron 5 ml de solución dispersante compuesta por 18.75 g de tripolifosfato de sodio, 3.75 g de carbonato de sodio y 60 ml de agua destilada durante 24 horas. Usando un hidrómetro se realizó la lectura de la densidad de la suspensión, para calcular el porcentaje de arena, arcilla y limo según las fórmulas descritas por Cooper (1982) y Norambuena et al. (2002).
7. RESULTADOS Y DISCUSIÓN
La densidad de hongos totales para bosque dentro del dispositivo fue de 5,12 Log10 UFC/g
de suelo y fuera de 4,98 Log10 UFC/g de suelo y para pastizal dentro fue de 4,83 Log10
UFC/g de suelo y fuera de 4,88 Log10 UFC/g de suelo, estas no presentaron diferencias
significativas entre dentro y fuera del dispositivo (F=1,46, P=0,23), pero sí presentaron diferencias significativas entre los dos usos de suelo (F=35,10, P<0,001). Presentando mayor densidad de hongos el bosque, esto se explica posiblemente a la alta diversidad de recursos que proporciona este ecosistema.
En cuanto a la densidad de hongos antagonistas entre dentro y fuera del dispositivo mostró diferencias significativas (F=4,37, P=0,04) siendo mayor la densidad de hongos antagonistas fuera del dispositivo en ambos usos de suelo. Se determinó que la densidad de hongos antagonistas para bosque dentro del dispositivo fue de 4,25 Log10 UFC/g de suelo y
para fuera de 4,59 Log10 UFC/g de suelo. Para pastizal dentro del dispositivo fue de 4,39
Log10 UFC/g y fuera de 4,63 Log10 UFC/g de suelo. Para la comparación entre bosque y
pastizal (Figura 1), por el contrario, no se encontraron diferencias en la densidad de hongos antagonistas (F=0,31, P=0,58).
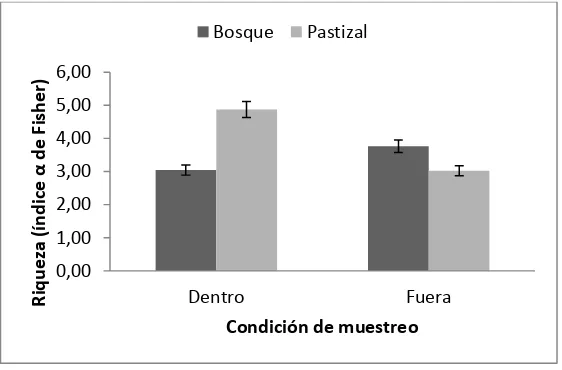
Figura 1. Promedio ± desviación estándar de la densidad de hongos antagonistas del suelo en bosque y pastizal de la vereda San José, Mundo Nuevo.
Se aislaron 19 y 18 morfotipos de hongos posiblemente antagonistas, en el primer y segundo muestreo en pastizal y bosque, respectivamente, los cuales pertenecieron a los géneros Paecilomyces sp., Trichoderma sp., Lecanicillium sp. y posibles fitopatógenos como Aspergillus sp. y Penicillium sp. Estos géneros se encontraron tanto en bosque y pastizal como dentro y fuera del dispositivo.La riqueza determinada con el índice α de Fisher dió como resultado mayor en pastizal que en bosque con una diferencia de 1.24 unidades (F=34,182, P<0,001). Se encontró una riqueza específica de 19 y 18 morfotipos para pastizal y bosque, respectivamente, con un alfa de Fisher de 4,15 en pastizal ganadero y 2,91 para bosque. La riqueza de hongos antagonistas varió considerablemente entre dentro y fuera del dispositivo (F=5,062, P=0,015), para pastizal con el índice α de Fisher dentro del dispositivo fue de 4,87 y fuera 3,02 y en bosque dentro fue de 3,05 y fuera 3,76 esta variación aunque significativa no obedece a un posible efecto de la temperatura pues esta no varió significativamente (Figura 2).
Figura 2. Promedio ± desviación estándar de la riqueza de hongos antagonistas del suelo en bosque y pastizal de la vereda San José, Mundo Nuevo.
Se esperaba tener una mayor riqueza en bosque pero no fue así. Esto se debe a que en los primeros días de crecimiento de los hongos, en donde se seleccionan las colonias de interés, las características de los hongos no son bien diferenciadas. Es a medida que crecen que se diferencian tomando sus formas y patrones de coloración característicos, por lo cual se pudo haber dejado de lado o excluidos algunos morfotipos de potencial interés, teniendo en cuenta que sólo se seleccionaron morfotipos posiblemente antagonistas. Por otro lado esta
0,00 1,00 2,00 3,00 4,00 5,00 6,00 Dentro Fuera R iq u e za (í n d ic e α d e Fi sh e r)
Condición de muestreo
es una forma de estimar las densidades y riqueza, pero hay que tener en cuenta que muchos microorganismos son difícilmente cultivables en el laboratorio. Se estima que sólo el 0,01% al 10% crecen en los medios de cultivo comúnmente utilizados (Varela 2010, Dandurand y Knudsen 2002). Pero aunque se subestime la riqueza, hay que tener en cuenta que es un método que funciona para hacer comparaciones pues opera bajo las mismas condiciones, y permite establecer diferencias.
Aunque no existen reportes de estudios que evalúen hongos antagonistas en altitudes similares al sitio de estudio, se sabe que en Colombia hay registros de entre 23 y 38 morfotipos distintos de hongos en suelos de la cuenca del río La Vieja y del río Otún, en un estudio que incluyó varios usos de suelo (Varela y Sierra, en preparación). La riqueza de hongos del suelo en este trabajo varió entre 5,2 en pastizal para ganadería y 13,1 en bosque subandino (Varela 2010). Esto nos llevaría a pensar que la riqueza encontrada en el presente estudio es baja, pero hay que tener en cuenta que sólo se evaluaron morfotipos antagonistas y en un sólo medio de cultivo.
Se encontraron varios morfotipos tanto en bosque y pastizal, de los identificados la gran mayoría pertenecieron al género Paecilomyces sp. (72%), varios al género Trichoderma sp. (12 %), Lecanicillium sp. (4%), Penicillium sp. (8%), Aspergillus sp. (4%), y algunos quedaron sólo como morfotipos debido a que no se lograron identificar. Muchas especies de estos géneros son de importancia agrícola y ecológica Paecilomyces spp., involucra generalmente especies antagonistas y controladoras biológicas de otros hongos y nematodos, y se encuentran principalmente en suelos ácidos (Vera et al. 2007) como en el caso del bosque y pastizal .
de sustancias fungotóxicas, la inducción de resistencia por medio de fitoalexinas, y el micoparasitismo (Obregón 2010, Atlas y Bartha 2002).
También se encontró Lecanicillium sp. que involucra especies fitopatógenas como antagonistas. Dos de las especies utilizadas para el control biológico y el combate de plagas agrícolas son: Lecanicillium lecanii y Lecanicillium muscarium, que son hongos entomopatógenos, antagonistas y nematofagos (Obregon 2010), estas especies son muy usadas para el control simultaneo de insectos como lo es la mosca blanca, trips; cochinillas y afidos, así como enfermedades del tipo roya y mildius polvosos (Obregón 2010).
En cuanto a Penicillium sp. se sabe que este género incluye muchas especies saprófitas, sus conidios son fácilmente dispersados, son muy comunes en los suelos y algunas especies pueden ser fitopatógenas y otras antagonistas. Aunque son muy pocas las interacciones entre las especies de Penicillium sp. y otros hongos, estas se llevan a cabo a mayores profundidades en el suelo y poco en la rizosfera. Sin embargo se ha reportado que Penicillium chrysogenum puede ser capaz de controlar la verticilosis del tomate producida por Lecanicillium sp. (Phuwiwat y Soytong 2001).
Adicionalmente el género Aspergillus sp. involucra alrededor de 200 especies. Es un hongo que se encuentra comunmente en los suelos, pero poco se conoce sobre su utilidad como controlador biologico. Se conoce que Aspergillus niger es un hongo que produce un moho negro en vegetales, común en la lechuga, el tomate y la acelga. Actualmente se investiga si este hongo puede emplear como fertilizante biologico, debido a su capacidad de solubizar compuestos de hierro, que es un micronutriente importante en el crecimiento vegetal (Deacon 2006, Atlas y Bartha 2002).
Las predicciones al respecto de la aparición de enfermedades infecciosas por parte de hongos fitopatógenos es difícil, pero se sabe que los patógenos que más responden al clima son los hongos y las bacterias en un 44 y 41%, respectivamente (Anderson et al. 2004). Aunque en este trabajo no se consiguió evidenciar un efecto de la temperatura sobre la densidad y riqueza de hongos antagonistas habría que evaluar el efecto que este aumento podría tener sobre las plantas y los recursos vegetales, pues las enfermedades van mucho más allá que simplemente el incremento de poblaciones de patógenos fúngicos (Brock 2007, Atlas y Bartha 2002, Manners 1994, Agrios 1988).
Las especies con estrategias K tienen tasas de crecimiento y reproducción ajustadas a los recursos limitados disponibles, lo que las hace exitosas en situaciones de limitación de nutrientes (Atlas y Bartha 2002). Estas son más persistentes en el tiempo debido a sus tasas de crecimiento lentas, la producción de estructuras de resistencia y la capacidad de metabolizar compuestos complejos. Dentro de estas especies se encuentran muchas de las poblaciones de hongos que se encargan de transformar la materia orgánica (Atlas y Barta 2002, Andrews 1983), las cuales en el presente estudio no variaron entre dentro y fuera del dispositivo. Aunque al nivel de morfotipos y algunas de géneros se encontraron diferencias entre bosque y pastizal en cuanto a la densidad total de hongos, debido a las condiciones ambientales de ambos usos del suelo, presentando una mayor densidad el bosque.
Figura 3. Promedio ± desviacion estandar de temperatura del suelo en bosque y pastizal de la vereda San José, Mundo Nuevo.
La temperatura no mostró diferencias significativas entre dentro y fuera del dispositivo (F=0,378, P=0,541). Aunque la temperatura se encuentra sujeta a variaciones diurnas, semanales y estacionales, ésta no varió probablemente debido a que los muestreos en los meses octubre y diciembre correspondieron a una misma epoca climática en la zona. Sin embargo sí hubo una diferencia entre ambas coberturas, presentándose una mayor temperatura en el pastizal de aproximadamente 4°C (F= 377,452, P<0,001), muy seguramente debido a que se encuentra más expuesto a la radiación solar directa. La sombra y el recubrimiento del suelo afectan la temperatura del mismo, ya que las plantas y los detritos vegetales interceptan la radiación solar, la niebla persistente y la vegetación espesa, condiciones que están presentes en el bosque (Bunyard 2010, Kappell y Brown 2001). Esto hace que la variación de la temperatura sea menor y se mantenga en un rango relativamente estrecho (en promedio 10°C), por lo que su temperatura es menor en comparación con el pastizal (en promedio 14°C). El dispositivo no aumentó la temperatura como se esperaba, sin embargo el material y el diseño usados proporcionan una alta tramitancia solar al suelo, ya que funciona como trampa solar aumentando la temperatura dentro de este (Molau et al. 1996), lo hacen ideal para este tipo de experimentos. Pero en este caso la radiación que es la emisión de energía no fue suficiente para elevar la temperatura 1°C, debido probablemente a las condiciones de nubosidad que interfieren y absorben la radiación solar (Forsythe 2002) y la densa vegetación, en el caso del bosque. La
0 5 10 15 20 Adentro Fuera Tem p e ratu ra d e l su e lo ( °C)
Condición de muestreo
transferencia de calor en el suelo por radiación y convección son generalmente secundarias en importancia, ya que el proceso primario de transporte de calor se debe a la conducción, que es la propagación del calor dentro de un cuerpo por movimiento molecular interno (Pinzón 2009).
La conductividad térmica depende también de la composición mineral y contenido de materia orgánica, así como del contenido de agua y aire del suelo. Al ser estos suelos muy húmedos y con gran cantidad de materia orgánica, la cantidad de energía necesaria para elevar un grado la temperatura debería ser mayor a la proporcionada por los dispositivos. Los cambios de temperatura edáfica durante el día ocurren principalmente en los primeros 30 cm; esto se explica por la radiación solar directa y por los fenómenos de conducción y convección de calor (Pinzón 2009).
A medida que se profundiza en el perfil del suelo las variaciones de temperatura se reducen, favoreciendo el mantenimiento de las densidades microbianas dentro de rangos más estrechos (Varela 2010, Atlas y Bartha 2002, Plaster 2002). Existe un equlibrio térmico que consiste en la liberación de calor desde los horizontes más profundos hacia los superficiales, que ocurre cuando baja la temperatura en las horas de la tarde, como en la madrugada, cuando el aire se hace más frío; el calor se transfiere por conducción de los horizontes más profundos hacia los superficiales manteniendo un equilibrio y una temperatura relativamente estable en el suelo (Pinzón 2009). Posiblemente por estas razones fue que la tramitancia solar proporcionada por el dispositivo no fue suficiente para elevar la temperatura pues el proceso de conducción es mayor que el de radiación en cuanto a la transferencia de energía, por lo cual no se registró una diferencia entre dentro y fuera del dispositivo.
Atlas y Bartha 2002, Plaster 2002). Como la temperatura es baja estos procesos se hacen lentos; esto también podría influir en que el porcentaje de materia orgánica sea mayor en bosque que en pastizal.
En relación con el porcentaje de humedad no hubo variación significativa entre dentro y fuera del dispositivo (F=0,83, P=0,36), pero fue mayor en bosque (F=14,08, P<0,001), con una humedad promedio de 57,39 %. Esta variable se comportó según lo esperado, pues al ser en la misma epoca climática esta no varió entre los muestreos ni entre dentro y fuera, pues tampoco varió la temperatura, aunque los niveles de humedad del suelo están muy relacionados con la temperatura (Campbell 1987). En este estudio no hubo correlación entre estas dos variables pues no variaron entre dentro y fuera del dispositivo.
La humedad no presentó ninguna correlación con la densidad y riqueza de hongos ni en pastizal (r=0,000, P=0,99) ni en bosque (r=-0,003, P=0,98), aunque el muestreo se realizó en los primeros 20 cm de profundidad, pues a medida que se profundiza en el perfil de suelo, las variaciones de humedad y temperatura se reducen. La humedad influye marcadamente sobre las tasas de descomposición (Taylor 1998) principalmente afectando la actividad microbiana, las poblaciones de microorganismos en densidad y tasa de crecimiento (Varela 2004, Valencia 1983, Rai y Srivastava 1982), particularmente los hongos (Cornejo et al. 1993) y la respiración en el suelo (Varela 2004, Rai y Srivastava 1982). Pero para que esto suceda, y específicamente para observar una respuesta en la densidad y riqueza de hongos la humedad debe variar en al menos un 10% (Heredia 2008).
Por otro lado un mayor contenido de humedad del suelo comúnmente está asociado con un pH ácido del mismo, al cual los microorganismos responden favorablemente, en el rango de 5 a 6,6 (Sylvia et al. 2005). Es posible que el suelo del bosque tenga un pH más ácido que el del pastizal, porque el bosque es mas húmedo y retiene mayor contenido de agua debido a sus condiciones ambientales (Bunyard 2010, Osejo 1995).
(F=81,013, P<0,001) siendo mayor en bosque. Esto se puede explicar por la expansión y contracción del suelo al impacto de las gotas de lluvias, que es diferencial en ambas coberturas, pues el bosque tiene una cobertura vegetal más densa que lo protege amortiguando el impacto de la lluvia y el efecto de las raíces de las plantas; además la gran variedad de organismos y microorganismos edáficos contribuyen a la formación de agregados, que mejoran la estructura del suelo. Aunque el pastizal no se encuentra precisamente desprotegido, su cobertura vegetal si es mucho menor y la lluvia es uno de los factores que afecta de manera determinante la agregación del suelo así como la compactación del suelo por parte del ganado en el caso del pastizal.
La variación de humedad del suelo también es uno de los factores que cambia notablemente la agregación, pero en este caso la humedad no presentó diferencias significativas. Los organismos del suelo afectan de una u otra forma la agregación del suelo, como los hongos y actinomicetos que secretan sustancias pegajosas, colaboran en la formación de agregados más estables o simplemente son formadores de estructura como lo hace la lombriz de tierra y en menor proporción los caracoles terrestres (Pinzón 2009, Sylvia et al. 2005, Plaster 2002). Al no haber variación entre la distribución de agregados del suelo dentro y fuera del dispositivo esto tampoco influyó en la densidad de hongos en el presente estudio.
Este suelo tiene una estructura que se denomina agregada y es la más deseable para el crecimiento de las plantas, especialmente en los estados tempranos críticos de germinación y establecimiento de la semilla, permitiendo un adecuado enraizamiento, lo cual hacen de estos, suelos muy fértiles (Pinzón 2009, Plaster 2002, Primavesi 1982).
en procesos tales como la respiración microbiana, que particularmente en el caso de los hongos edáficos es de tipo aerobia estricta (Deacon 2006) y en el caso de la vegetación, la absorción de nutrientes y agua, el intercambio de gases entre las raíces y el suelo, y procesos de reducción pueden afectar la movilidad de algunos elementos (Pinzón2009).
En este caso el suelo se encuentra en buenas condiciones en ambos usos de suelo. Su textura es arenoso – franco. Dado el alto contenido de arena, este tiene como característica una buena aireación, con baja retención de agua y buena permeabilidad lo que favorece la formación de agregados de gran tamaño (Cepeda 1991). También altos porcentajes de humedad y materia orgánica favorecen la formación de macroagregados en el suelo (Hernández et al. 2001, Burbano 1989), tal como sucede en bosque, lo cual repercute sobre la densidad y riqueza de los hongos del suelo.
En cuanto a la materia orgánica esta no presentó diferencias significativas entre dentro y fuera del dispositivo (F=0,194, P=0,661), pero fue diferente entre los dos usos de suelo estudiados. El bosque presentó mayor contenido de materia orgánica (52,10 %) que el pastizal (37,72 %) con una diferencia de 14,38 %. Esta favoreció posiblemente la densidad de hongos totales que tambien fue mayor en bosque. La disponibilidad de elementos y recursos está fuertemente relacionada con la cantidad y calidad de la materia orgánica que llega al suelo proveniente de la vegetación (Varela 2010, Plaster 2000).
En suelos bajo cobertura de bosque hay un aporte continuo de materia orgánica al suelo. Por tal motivo esta no constituye una limitante para el crecimiento de los microorganismos, particularmente de los hongos, como sí puede ocurrir en zonas con escasa cobertura vegetal, como en áreas desérticas o algunas áreas de cultivo (Varela 2010, Campbell 1987).
Por otra parte el pH influye sobre la movilidad de los diferentes elementos y nutrientes del suelo. En unos casos al aumentar la acidez del suelo disminuirá la solubilidad, con lo que las plantas no podrán absorberlos. El suelo de pastizal es ácido y el de bosque es muy ácido, lo cual puede deberse a la quema de bosques durante la conversión y transformación a pastizales, que produce residuos de cenizas que son ricas en bases; también puede estar relacionado con la aplicación de fertilizantes y presencia de materia fecal que tienden aumentar el pH (Reiners et al. 1994). Estos suelos son propios de climas lluviosos y con humus ácido; lo que sugiere niveles bajos de Ca, Mg, Na, y K que hacen que la actividad bacteriana sea escasa y favorezca el crecimiento de hongos (Lillo 2000), que son los más tolerantes a pH ácidos (Deacon 2006, Sylvia et al. 2005).
La conductividad eléctrica no presentó diferencias entre dentro y fuera del dispositivo (F=1,497, P=0,225). Esto puede deberse a que el tipo de suelo es el mismo, es no salino (USDA, 1999), y la composición de sales y minerales es la misma. Aunque el tipo de suelo se haya clasificado como no salino, la conductividad eléctrica fue diferente entre bosque y pastizal (F=151,537, P<0,001), siendo mayor en bosque, pues a mayor acidez mayor conductividad. Los valores para esta variable fueron bajos y esto está relacionado con el tipo de suelo y el pH, ya que la acidez del suelo está asociada con una disminución de sales minerales y un consecuente decrecimiento de la conductividad eléctrica de los suelos, condición favorable para el crecimiento de hongos, pues de todos los microorganismos son los que más toleran pH ácidos (Sylvia et al. 2005, Steubing et al. 2002).
8. CONCLUSIONES Y RECOMENDACIONES
La densidad de hongos totales no fue afectada por el dispositivo, pero sí por el uso de suelo dado que dio una mayor densidad en el bosque.
La riqueza de hongos antagonistas fue afectada tanto por el dispositivo como por el uso de suelo. La respuesta de la riqueza fue diferencial dependiendo del uso de suelo, porque fue mayor dentro del dispositivo en el caso del pastizal, y menor dentro en el bosque.
Los géneros de hongos antagonistas identificados se encontraron tanto en bosque como en pastizal, y no fue diferente su densidad en ambos usos de suelo.
No se evidenció relación entre las variables fisicoquímicas medidas y la densidad y riqueza de hongos antagonistas, en bosque ni en pastizal.
Se sugiere aumentar la precisión de los instrumentos como en el caso del termómetro para detectar cambios menores en la temperatura del suelo y tomar las muestras de suelo en los primeros 5 cm de profundidad, donde es más probable que ocurran y se evidencien los posibles efectos.
Se recomienda realizar el mismo trabajo de investigación evaluando otros medios de cultivo con el fin de aumentar la representatividad de las especies de hongos encontradas.
9. BIBLIOGRAFÍA
Abadín, J. 2008. Agricultura sostenible en áreas de montaña. Importancia de la materia orgánica en la conservación de la fertilidad del suelo. Ed. Universidad de Santiago de Compostela. Galicia, España. 155 p.
Abarca, G. 2008. Tópicos sobre diversidad, ecología y usos de los hongos microscópicos en Iberoamérica. Programa Iberoamericano de Ciencia y Tecnología para el Desarrollo (CYTED) e instituto de Ecología, A.C. Xalapa, México. 386 pp.
Abella, S., Zimmer, B. 2007. Estimating organic carbon from loss-on-ignition in Northern Arizona Forest Soils. Soil Science Society of America Journal 71 (2): 545-550.
Agrios, G. 1988. Plant Pathology. Third Edition. Academic Press. New York, United States of America. 803 p.
Alexopoulos, C.J., Mims, C.W., Blackwell, M. 1996. Introductory mycology. Fourth Edition. John Wiley & Sons, INC. United States of America, New York. 869 p.
Amézquita, M.C. 2005. Carbon sequestration in pasture, agro-pastoral and silvo-pastoral systems in ecosystems of the American Tropics. Carbon sequestration project. The Netherlands cooperation CO 010402.
Andrews, J.H. 1983. Relevance of r- and K-theory to the ecology of plant pathogens. In: Klug, M. J. and C. A. Reddy (eds.). Current perspectives in microbial ecology. American Society of Microbiology. Whashington, D.C., USA. 710 p.
Anónimo, 2009. Pastizales para ganadería en la Sabana de Bogotá. http://www.imcportal.com/contenido.php?option=shownews&newsid=4233&render=page. Consultada el 20 de enero de 2011.
Arambarri, A., Saparrat, M. 2008. Implicaciones funcionales de la enzima lacasa en la biología de los hongos y su potencial biotecnológico. Capítulo 17. En: Tópicos sobre diversidad, ecología y usos de los hongos microscópicos en Iberoamérica. Editora. Gabriela Heredia Abarca. Xalapa, México. 371 p.
Atlas, M., Bartha, R. 2002 Ecología Microbiana y Microbiología Ambiental. Cuarta edición. Addison Wesley. Madrid, España. 696 p.
Barnett, H., Hunter, B. 1987. Illustrated genera of imperfect fungi. Third edition. Minneapolis, United States of America. 241 p.
Briones, M.J.I., Poskitt, J. & Ostle, N. 2004. Influence of warming and enchytraeid activities on soil CO2 and CH4 fluxes. Soil Biology & Biochemistry 36:1851-1859.
Brock, M., Madigan, M., Parket, J. 2007. Biología de los microorganismos. Décima edición. Editorial Pearson Prentice Hall. Madrid, España. 1011 p.
Brown, L. 2010. Plan 4.0 movilizarse para salvar la civilización. Primera edición en español. Editorial Kimpres. Bogotá, Colombia. 216 p.
Bunyard, P. 2010. Caos climático, calentamiento global, efecto invernadero y otros factores que amenazan la vida. Bogotá, Colombia. 216 p.
Burbano Orjuela, H. 1989. El suelo: una visión de sus componentes biorganicos. Serie de investigaciones 1. Universidad de Nariño. Pasto, Colombia. 447 p.
Campbell, M., Madden, L. 1990. Introducction to Plant Disease Epidemiology. John Wiley and Sons. New York, United States. 532 p.
Chet, L., Inbar, J., Hadar, I. 1997. Fungal antagonists and mycoparasites. In: Wicklow, D.T. & Söderström, B. (eds.). The mycota IV. Environmental and microbial relationships. Springer –Verlag. Berlin, Germany. 200 p.
Cooper, T. 1982. Learning center laboratory manual for soil science. University of Minnesota. Minneapolis. United States of America. 10-17 p.
Cook, R., Baker, K. 1983. The Nature and Practice of Biological Control of Plant Pathogens. The American Phytopathological Society. St. Paul. Minnesota, United States of America. 539 p.
Cornejo, F. H., Varela, A., Wright, S.J.1994. Tropical forest litter decomposition under seasonal drought: nutrient release, fungi and bacteria. Oikos 70:183-190.
Cortés, A. 2004 Suelos Colombianos una mirada desde la academia. Fundación de Bogotá Jorge Tadeo Lozano, Facultad de Recursos Naturales. Bogotá, Colombia. 198 p.
M.J., Stetzenbach, L. D. Manual of envioronmental Microbiology. Second Edition. ASM Press. Washington, D.C., USA. 1138 p.
Deacon, J. 2006. Fungal biology. 4th ed. Blackwell Publishing. Malden, United States of America. 371 p.
De Vos, B., Vandecasteele, B., Deckers, J., Muys, B. 2005. Capability of loss-on-ignition as a predictor of total organic carbón in non-calcareous forest soils. Comunications in soils. Comunications in Soil Science and Plant Analysis 36 (19): 2899-2921.
Dickinson, C.H., Lucas, J.A. 1987. Patología vegetal y patógenos de plantas. Universidad de Nottingham. Editorial Limusa. México D.F, México. 312 p.
Fauth, J.E., Bernardo, J., Camara, M., Resetarits, W.J., van Buskirk, J. McCollim, S.A. 1996. Simplifying the jargon of community ecology: a conceptual approach. American Naturalist 147: 282-286.
Forsythe, W. 2002. Parámetros ambientales que afectan la temperatura del suelo en Turrialba, Costa Rica y sus Consecuencias para la Producción de Cultivos. Agronomía costarricense 26 (1): 43-62 p.
Fragoso, C., Reyes, P., Rojas, P. 2001. La importancia de la biota edáfica en México. Acta Zoológica Mexicana 1:1-10 p.
Fraser, J. Climate change impacts on biological systems. Proceedings of Species at Risk 2004. Pathways to Recovery Conference. 2 March 2–6, 2004, Victoria, B.C, Canada. 7 p.
Frey, S.D., Drijber, R., Smith, H., Melillo, J. 2008. Microbial biomass, functional capacity, and community structure after 12 year of soil warming. Journal Soil Biology & Biochemistry. 40: 2904-2907.
Tópicos sobre diversidad, ecología y usos de los hongos microscópicos en Iberoamérica. Editora. Gabriela Heredia Abarca. Xalapa, México. 371 p.
Garret, S. 1981. Soil Fungi and Soil Fertility. An Introduction to Soil Mycology. 2nd edition. Pergamon Press, Oxford. United Kingdom. 150 p.
Gary, A., Lehrsch, D., Kincaid, C. 2006. Sprinker droplet energy effects on soil penetration resistance and aggregate stability and size distribution. Soil Science 171 (6): 35-447.
Gitay, H., Noble, I. R. 1997. What are functional types and how should we seek them?. In: Smith, T.M., Shugart, H. H., Woodard, F.I. Plant functional types. Their relevance to ecosystem properties and global change. Cambridge University Press. Cambridge, United Kingdom. 383 p.
Grupo Interinstitucional de Investigación en Suelos Sulfatados Ácidos Tropicales, GISSAT. 2006. Caracterización biológica de suelos sulfatados ácidos. Documento 5. Proyecto: Caracterización de la problemática de los suelos sulfatados ácidos improductivos y evaluación de manejo para su habilitación agrícola. Distrito de riego del alto Chicamocha (Boyacá). Facultad de Ciencias Agrarias. Universidad Pedagógica y Técnologica de Colombia. 43 p.
Hamilton, L.S., Juvik, J.O., Scatena, F.N. 1995. The Puerto Rico Tropical Cloud Forest Symposium: introduction and workshop synthesis. In : Hamilton, L.S., Juvik, J.O., Scatena, F.N. (eds.). Tropical Montane Cloud Forests. Ecological Studies 10. Springer Verlag. Berlin, Germany. 1-23 p.
Harman, G. 2004. Trichoderma spp., including t. harzianum, T. viride, T. koningii, T.
hamatum and other spp. Deuteromycetes, Moniliales (asexual classification system).
Cornell University, Geneva, New York. [En línea]:
http://www.nysaes.cornell.edu/ent/biocontrol/pathogens/trichoderma.html. [Consulta: Julio 23 de 2009].
Harvell, C.D., Mitchell, C.E., Ward, J.R., Altizer, S., Dobson, A.P., Ostfeld, R.S. & Samuel, M.D. 2002. Climate warming and disease risks for terrestrial and marine biota. Science 296:2158-2162.
Herrera, T., M. Ulloa. 1990. El Reino de los hongos. UNAM. México D.F, México. 544 p.
Hoekseman, J.D., Lussenhop, J., Teeri, J.A. 2000. Soil nematodes indicate food web responses to elevated atmospheric CO2. Pedobiologia 44:725-735.
Houghton, J., Ding, Y., Griggs. D.J., Noguer, M., van der Linder, P.J., Dai, X. & Maskell, K. & Johnson, C.A. 2001. Climate Change 2001: The scientific basis. Published for the Intergovernmental Panel on Climate Change. Cambridge University Press. New York, United States of America. 881p.
Hunt, H.W. y D.H. Wall. 2002. Modelling the effects of loss of soil biodiversity on ecosystem function. Global Change Biology 8: 33-50.
IDEAM, 2001. Ministerio de Ambiente, Vivienda y Desarrollo Territorial de Colombia. Sistema Nacional Ambiental. [En línea]: http://www.ideam.gov.co/atlas/mclima.htm.
IPCC, 2007: Cambio climático 2007: Informe de síntesis. Contribución de los Grupos de trabajo I, II y III al Cuarto Informe de evaluación del Grupo Intergubernamental de Expertos sobre el Cambio Climático [Equipo de redacción principal: Pachauri, R.K. y Reisinger, A. (directores de la publicación)]. IPCC, Ginebra, Suiza. 26 p.
INAP-Componente B “Alta Montaña”. 2007. Programa piloto nacional de adaptación al cambio climático. Diseño e implementación de un programa de adaptación que soporte el mantenimiento de los servicios ambientales en el Parque Nacional Natural de Chingaza-Cuenca Río Blanco.
Isaac, S. 1992. Fungal-plant interactions. University Cambridge, London, United Kingdom. 209-210 p.
Komada, H. 1975. Development of a selective medium for quantitative isolation of Fusarium oxysporum from natural soil. Review on Plant Protection Research 8:114-25.
Lagomarsino, A., Moscatelli, M.C., de Angelis, P., Grego, S. 2006. Labile substrates quality as the main driving force of microbial mineralization activity in a poplar plantation soil under elevated CO2 and nitrogen fertilization. Science of the Total Environment 372:256-265.
Lecarno, L., Velez, P., Sevilla, F., Madrid, O. 2006. Abundancia y biomasa de microorganismos edáficos en la temporada lluviosa en tres usos de la tierra en los Andes Colombianos. Revista UNAL. Vol. 3 No. 1. Valle, Colombia.
Lillo 2000. Acidificación de suelos-Gestión y conservación de suelos y aguas. Universidad Rey Juan Carlos [En línea]: http://www.escet.urjc.es/~jlillo/Acidificacion.pdf. [Consulta: Mayo 24 de 2011].
Logan II, R.M., Siehr, D.J. 1996. Solubilization of acid-swollen cellulose by an enzyme system from a species of Alternaria. Applied Microbiology 14(6):1015-1018.
Magurran, A. 2004. Measuring biological diversity. Blackwell Publishing. Malden, Massachusets, United States of America. 256 p.
Maheshwari, R., G. Baradwaj y M. K. Bhat. 2000. Thermophilic fungi: Their physiology and enzymes. Microbiology and Molecular Biology Reviews 64(3): 461-488.
Manners, J.G. 1994. Introducción a la Fitopatología. Editorial Limusa. Balderas 95, México, D.F, México. 295 p.
Mayea, S., & Padrón, J. 1983. Bacterias y Hongos Fitopatógenos. Editorial Pueblo y Educación. Ciudad de la Habana, Cuba. 187 p.
Millennium Ecosystem Assessment. 2005. Ecosystems and Human Well-being: Synthesis. Island Press. Washington, D.C., United States of America. 155p.
Norambuena, P., Luzio, W., Vera, W. 2002. Comparación entre los métodos de la pipeta y bouyoucos y su relación con la retención de agua en ocho suelos de la zona altiplánica de la provincia de Parinacota, Chile. Agricultura Técnica 62 (1): 150-157.
Obregón, G.M. 2010. Trichoderma a beneficial microorganism used in integrated production systems of Costa Rica. 11th International Workshop on Trichoderma and Gliocladium: Molecular mechanisms and applications of biocontrol in agriculture. Haifa, Israel, October 5-7 2010.
Odum, P., Barret, G. 2006. Fundamentos de ecología. Quinta edición. Editorial International Thomson Editores México D.F., México. 598 p.
Olson, D.M., E. Dinerstein. 1998. The global 2000: a representative approach to conserving
the earth’s most biologically valuable regions. Conservation Biology 12(3): 502-515.
Osejo, L. 1995. Estudios ecológicos del paramo y del bosque altoandino cordillera oriental de Colombia Tomo I. Editorial Helmut Sturm. Bogotá, D.C., Colombia. 348 p.
Paraszkiewicz, K., A Frycie y J. Dlugon´ski. 2007. Enhancement of emulsifier production by Curvularia lunata in cadmium, zinc and lead presence. Biometals 20 (5): 797-805.
Parmesan, C., G. Yohe. 2003. A globally coherent fingerprint of climate change impacts across natural systems. Nature 421:37–42.
Phuwiwat, W., and Soytong, K. 2001. The effect of Penicillium notatum on plant growth. Fungal Diversity. Thailand. 8:143-148.
Pikul, J., Howell, T. 2003. Soil water gravimetric measurement of soil water. Encyclopedia of water Science. 879-881 p.
Pinzón P.A. 1985. Propiedades físicas del suelo transformadas por acción de la mesofauna en suelos de Arauca y Vichada. IGAC, Subdirección Agrológica.
Plaster, E. 2000. La ciencia del suelo y su manejo. Segunda edición. Editorial Paraninfo. Madrid, España. 417 p.
Primavesi, A. 1982. Manejo ecológico del suelo. Quinta edición. Editorial El Ateneo. Sao Paulo, Brazil. 499 p.
Purves, W., Sadava, D., Orians, H., Heller, C. 2004. Vida la Ciencia de la Biología. Sexta edición. Editorial Panamericana. Bogotá, Colombia. 1133 p.
Reiners, A., Bouwman, F., Parsons, W., Keller, M. 1994. Tropical Rain Forest Conversion to Pasture: Changes in Vegetation and Soil .W. A.: Ecological Applications; 4 (2): 363-377.
Rodríguez, J., Beard, D., Bennett, E., Cumming, G., Cork, S., Agara, J., Dobson, A. and Peterson, G. 2006, Trade-off across Space, Time, and Ecosystem Services. Ecology and Society 11(1):11-28.
Rodríguez. N. Pabon. J, Bernal. Martínez. 2010. Cambio climático y su relación con el uso del suelo en los andes colombianos. Primera edición. Alianza Ediprint. Bogotá, Colombia. 85 p.
Rondón, M., Acevedo, D., Hernandez, M., Pubiano, Y., Rivera, M., Amézquita, E., Romero, M., Sarmiento, L., Ayarza, M., Barrios, E. & Rao, I. 2006. Carbon sequestration potencial of neotropical savannas (Llanos) of Colombia and Venezuela. In: Lal, R. Kimbel, J. (eds.). Potential to sequester carbón in soils from Latinoamérica. Harworth Press, Inc. In press.
Rondón, M., Amézquita, E., Díaz, E., Chávez, L.F., Paz, L., Chávez, J. 2004. Efecto de cambios en el uso del suelo sobre los almacenamientos de carbono y flujos de gases de efecto invernadero en áreas del páramo de las Ánimas, Cauca, Colombia. Taller Nacional sobre indicadores de calidad del suelo. Palmira, Colombia. Memorias en CD.
the Global Environment. Harvard Medical School. http: //www.med.harvard.edu/chge/reports/climate_change_us_ag.pdf).
Sarasola, A., Rocca, M. 1975. Fitopatología. Curso Moderno. Editorial Hemisferio Sur, Buenos Aires, Argentina. 4 v. 234 p.
Schalamuk, S., Cabello, M. 2008. Capitulo 10. Efecto de la labranza sobre las poblaciones de Glomeromycota. En: Tópicos sobre diversidad, ecología y usos de los hongos microscópicos en Iberoamerica. Editora. Gabriela Heredia Abarca. Xalapa, México.
Schindlbacher , A., Rodler , A., Kuffner , M., Kitzler, B., Sessitsch, A., Zechmeister-Boltenstern, S. 2011. Experimental warming effects on the microbial community of temperate mountain forest soil. Soil Biology & Biochemistry 43(7):1417-1425.
Sepúlveda, G., Rojas, M. 2008. Hongos entomopatógenos (HEP): evaluación en agricultura de zonas áridas del extremo norte de Chile. Capítulo 14. En: Tópicos sobre diversidad, ecología y usos de los hongos microscópicos en Iberoamérica. Editora. Gabriela Heredia Abarca. Xalapa, México. 317 p.
Sierra, J. 2002. Fundamentos para los establecimientos de cultivos y pasturas y cultivos forrajeros. Universidad de Antioquia. Medellín, Colombia. 91 p.
Smith, R.L., Smith, T. M. 2001. Ecología. Primera Edición. Pearson. Madrid, España. 642 p.
Steubing, L., R. Godoy, M. Alberdi. 2002. Métodos de ecología vegetal. Editorial Universitaria, Santiago, Chile. 115 p.
Sylvia, D.M., Fuhrmann, J.J., Hartel, P.G., Zuberer D.A. 2005. Principles and Applications of Soil Microbiology. Second Edition. Pearson. New Jersey, United States of America. 640 p.
USDA. Guía para la evaluación de la calidad y salud del suelo. Instituto de suelos CRN – CNIA – INTA. Buenos Aires, Argentina 1999; 88 p.
Van Beelen, P., Doelman, P. 1997 Significance and application of microbial toxicity test in assessing ecotoxicological risks of contaminants in soil and sediment. Chemosphere (4): 455-499 p.
Van der Putten, W.H., P.C. de Ruiter, T.M. Bezemer, J.A. Harvey, M. Wassen y V. Wolters. 2004. Trophic interactions in a changing world. Basic and Applied Ecology 6:487-494.
Varela, A. 2004. Efecto de la fragmentación sobre la producción y descomposición de la hojarasca en bosque altoandino nublado: patrones, mecanismos y modelos. Tesis de Ph. D. Facultad de ciencias, Pontificia Universidad Javeriana. Bogotá, D. C., Colombia. 331 p.
Varela, A. 1997. Selección de aislamientos de Beauveria bassiana para el control de la broca del café Hypothenemus hampei. Revista Colombiana de Entomología. Vol. 23 Nos. 1-2, 73-81 p.
Varela, A., Feria, L. 2004. Comparación de la actividad microbiana en hojarasca entre un fragmento y un área continua de bosque andino en el sector suroccidental de la Sabana de Bogotá. Universitas Scientarum 9: 47-58. Edición Especial. Investigaciones en Biología.
Varela, A., Sierra, L. Efecto del uso de suelo sobre la diversidad de grupos funcionales microbianos edáficos en la ecorregión cafetera (En preparación).
Varela, A., Rueda, D. 2010. Capítulo 7. Organismos del suelo En:Ciencia del suelo principios básicos. Burbano, H & Silva, F. (eds.). Primera edición. Editorial Guadalupe. Bogotá D.C, Colombia. 589 p.
Valenzuela, E., Pinochet, D. 2008. Biodegradación de paja de trigo mediante cepas fúngicas. Capitulo 16. En: Tópicos sobre diversidad, ecología y usos de los hongos microscópicos en Iberoamérica. Editora. Gabriela Heredia Abarca. Xalapa, México. 371 p.
Vera D., Peña Venegas C., Cardona Vanegas G. 2007. Paecilomyces sp.Bainier 1907. http://www.siac.net.co/sib/catalogoespecies/especie.do? [Consulta: 20 de Julio de 2011].
Veneklaas, E.J. 1991. Litterfall, nutrient cycling and nutrient limitation in tropical forests. Ecology 65: 285-298.
Walker, J.C. 1973. Patología Vegetal. Ediciones Omega S.A. Barcelona, España. 818 p.
Welker, J.M., J.T. Fahnestock, P.F. Sullivan y R.A. Chimner. 2005. Leaf mineral nutrition of artic plants in response warming and deeper snow in northern Alaska. Oikos 190: 167-177.
Wraight, S.P., Carruthers, R.I., Jaronski, S.T., Bradley, C.A., Garza, C.J., Galaini-Wraight. 2000. Evaluation of the Entomopathogenic Fungi Beauveria bassiana and Paecilomyces fumosoroseus for Microbial Control of the Silverleaf Whitefly, Bermisia argentifolii. Biological Control 17, 203-217.
Zabaleta, E.S., M.R. Shaw, N.R. Chiariello, B.D Thomas, E.E. Cleland, C,B. Field y H.A. Mooney. 2003. Grassland responses to three years of elevated temperature, CO2,
precipitation and N deposition. Ecological Monographs 73: 585-604.